INTRODUCCIÓN
El manejo de camélidos domésticos, así como el ingreso y cultivo de vegetales andinos, son algunas de las prácticas económicas distintivas del período Formativo en Atacama (ca. 3000-1450 A. P.). Durante este período surgen varias aldeas, sitios fúnebres y campamentos de tarea conectados por rutas de paso que hacen recurrente el traspaso de información entre estas poblaciones, ya sea en soportes materiales o inmateriales (Núñez & Dillehay, 1979; Gallardo, 2009; Pimentel et al., 2017). El cementerio Topater 1 del oasis de Calama (río Loa) es uno de los cementerios más tempranos del oasis y con mejor conservación diferencial de cuerpos y ofrendas. Se emplaza sobre la planicie desértica al sur oriente de la ciudad de Calama. Posee un componente estilístico Formativo medio (500 a. C.-100 d. C.) dominante y dos fechas de radiocarbono coherentes en materiales vegetales provenientes de dos distintas unidades de recuperación: Beta - 322289, cal. 360 a 270 a. C. y cal. 260 a 170 a. C. (calibrada 2 sigmas, 95% de probabilidad) y Beta 259693, cal. 410 a 360 a. C. (calibrada 2 sigmas, 95% de probabilidad).
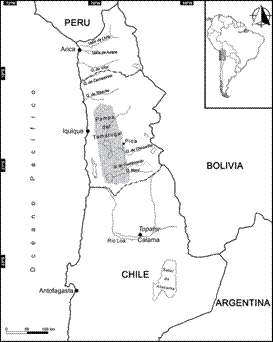
La locación de este cementerio en un oasis de ribera a orillas del río Loa (Fig.1), el único curso de agua exorreico en Atacama, lo inserta dentro de un dinámico corredor ecológico y cultural. Situado a los 2400 m s. m. es la antesala desértica hacia las tierras altas andinas, así como para el descenso por el Loa hacia la costa y hacia la Pampa del Tamarugal. En este cementerio hay diversos tipos de tumbas y son abundantes las ofrendas de diversas materialidades. Se recuperaron artefactos confeccionados con materia prima vegetal, tales como cestería, algodón hilado, maderas trabajadas, instrumentos musicales, así como también restos vegetales de múltiples semillas y frutos cultivados y silvestres. Además, entre las evidencias se cuentan pescado seco y conchas marinas obtenidos en la costa Pacífica, plumas de vivos colores procedentes de la alta puna y el oriente boliviano y cerámicas negras pulidas del noroeste argentino. En gran número aparecen también extremidades de camélidos o llamas utilizadas como animales de carga, indicador que, junto a las otras evidencias, hacen indiscutible que los habitantes de este lugar eran activos participantes del tráfico y el intercambio, tanto al interior de la región como fuera de ella (Thomas et al., 1995a; Gallardo,
2009; Labarca & Gallardo, 2015).
En este trabajo caracterizaremos una sub- muestra representativa de los frutos y semillas recuperados en el cementerio Topater 1. Se presentarán los antecedentes regionales y biogeográficos de estos taxones, evaluando la factibilidad de su cultivo local y las implicancias que tuvieron en el devenir socio-cultural de las poblaciones asentadas en el desierto de Atacama durante el Formativo regional. Se plantea que el arribo de estos vegetales, sus conocimientos e imaginarios asociados, en conjunto con un incremento en la humedad regional; habrían diversificado las posibilidades de habitar y conectar el territorio, y esto queda plasmado en la idiosincrasia observada en los diversos contextos locales (García et al 2014; Pestle et al., 2015; Ballester et al., 2019; Uribe et al., en prensa). El éxito de este nuevo modo de vida se ve reflejado en un aumento demográfico (Santoro et al., 2016; Gayó et al., 2019) y en la emergencia de aldeas o caseríos agro-silvopastoriles, en donde Prosopis spp., jugaría un rol preponderante (Agüero & Uribe 2011; Adán et al., 2013; García et al., 2014; McRostie et al., 2017).
MATERIALES Y MÉTODOS
El sitio arqueológico Topater fue excavado durante los años 80 y nunca fue publicado monográficamente, sólo existen los inventarios parciales del Museo de la Corporación Cultural de Calama, reportes de algunos artefactos y un ensayo interpretativo con vagas referencias contextuales (Thomas et al., 1995a; Cases, 2000; Agüero & Cases, 2004). El sitio presentaba excelentes condiciones de preservación acorde a la hiperaridez y salinidad del desierto de Atacama. No obstante, nuestro actual conocimiento es sumario y parcial debido a las precarias condiciones de conservación y bodegaje posteriores a la excavación. Sabemos que fue intervenido arqueológicamente mediante una grilla de 9 x 25 cuadrículas de 25 m2 cada una, desde la cuales se recuperaron 61 fardos funerarios y restos de entierros secundarios equivalentes a 155 individuos (Thomas et al., 1995a). Con excepción del algodón que aparece como hilado en la mayoría de las unidades de excavación y la cestería, las plantas cultivadas y silvestres consideradas en este estudio por lo general fueron depositadas en pequeñas bolsas de cuero o lana, aunque en ocasiones también aparecen directamente como ofrendas. Se distribuyen en 43 unidades de recuperación, de un total de 90 según el inventario del depósito en Calama.
Hace algunos años se fotografiaron algunos restos vegetales en el depósito de Calama, a la vez que se tomaron especímenes representativos de estos frutos y semillas. Tanto las fotografías como esta sub-muestra fueron entregadas a lo/as investigadores de este artículo para su análisis. El material macroscópico se analizó a ojo desnudo y/o bajo lupa trinocular Leica EZ4E (35x) y cámara digital Leica ICC50 W. Aquellos especímenes más grandes se midieron con pie de metro digital considerando su longitud, latitud y grosor. Para lograr la determinación de las variedades de maíces presentes en la muestra se recurrió a los atributos descritos por Paratori et al. (1990). Se observó la forma y tamaños de las corontas, granos y cúpulas. Se midió el número de hileras de cada coronta y su distribución a lo largo del eje de la mazorca (regular, irregular, o en espiral). También se contabilizó el número de granos por hilera. Adicionalmente, se recurrió a la distribución actual de variedades de maíces presentes en los alrededores de Calama y San Pedro de Atacama descrita en la literatura, para comparar estas variedades con los ejemplares de Topater.
Para ejemplares de granos o semillas más pequeños y abundantes, se calculó el diámetro máximo, mínimo y su promedio con el programa IMAGEJ 1.52a.
Todos los especímenes fueron identificados mediante bibliografía pertinente, sin embargo, un gran problema fue la falta de colección de referencia para taxones exóticos, por lo que algunos ejemplares se identificaron como cf. o “por confirmar” contra dicho taxón. Para aquellos recursos silvestres se utilizó una colección de referencia proveniente de colectas en distintos puntos del curso del río Loa (desembocadura 21°41’, 70°06’; Quillagua 21°40’, 69°31’); en el área del Salar de Atacama (23°05’, 68°05’) y Quebrada Tulan (23°47’, 68°06’). Los análisis fueron realizados en el Laboratorio de Arqueología de la Pontificia Universidad Católica de Chile.
RESULTADOS
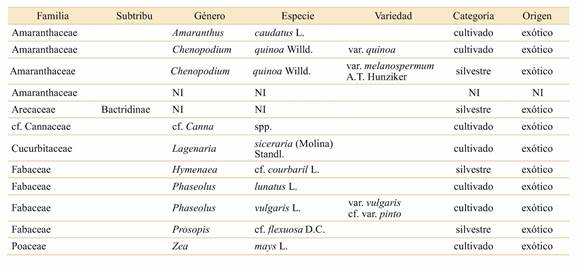
Se identificaron 12 taxones, los que representan seis familias, una subtribu, ocho géneros, ocho especies y cuatro variedades. De estos taxones hay siete que son domésticos, cuatro silvestres y uno no identificado (N. I.). Todos los restos identificados tendrían un origen biogeográfico exótico (Tabla 1), sin perjuicio de que algunos de ellos pudiesen estar siendo cultivados y adaptados localmente como discutiremos más adelante.
A continuación, se describen los restos vegetales recuperados.
1. Amaranthaceae
Las semillas de Amaranthaceae halladas en
Topater 1 se encontraban en hoyos y sacos (Fig. 2
A-B), sin relación con algún entierro en particular
(Thomas et al., 1995a). Fig. 2.

Fig. 2 A-B. Amarantháceas en bolsas textiles. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
1.1. Amaranthus caudatus. Los amarantos encontrados son granos con pericarpio translúcido y brillante, un embrión café claro y curvo alrededor del perisperma de un tono amarillento o dorado. Estos granos son circulares-lenticulares, levemente aplanados. Tienen forma similar a una herradura que permite distinguirlas del género Chenopodium, con los bordes más redondeados (Martin & Barkley, 1961). El diámetro de 30 granos dió una mínima de 1,4 mm y máxima de 1,8 mm, con un promedio de 1,6 mm. Fig. 3.

Fig. 3 Semillas de Amaranthus caudatus. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
1.2. Chenopodium quinoa var. quinoa y C. quinoa var. melanospermum. Las semillas están envueltas por el pericarpio con los alvéolos y la región de la unión visibles. El embrión está formado por los cotiledones y una radícula prominente, que envuelven al perisperma como un anillo (Fig. 4A). También se encontraron especímenes inflados o hinchados tipo “pop corn” (Fig. 4B). Fig. 4.
Se propone que posiblemente habrían dos variedades, correspondientes al “quinoa crop/ weed complex”: Ch. quinoa var. quinoa tiene testa delgada y transparente, la que permite ver el perisperma claro y el embrión perimetral amarillo.

Fig. 4 Semillas de Chenopodium quinoa arqueológicas. A, naturales. B, tipo pop-corn o reventadas. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/ view/824/1151

Fig. 5 Semillas de Ch. quinoa var. quinoa y var. melanospermum, se distingue la distinta coloración de la testa y el perisperma de ambas. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
El diámetro de 30 semillas dio una mínima de 1.5, máxima de 2, y un promedio de 1.8 mm. Por otro lado, Ch. quinoa var. melanospermum tiene testa color castaño oscura brillante, la que no permite ver el perisperma claro, conocida también como quinoa negra (Planchuelo 1975; Bruno & Whitehead 2003, Bruno 2006) (Fig. 5). El diámetro de 30 semillas dio una mínima de 1.3, máxima de 2, y un promedio de 1.7 mm. Ambas son similares en morfología y fenología (Mujica & Jacobesen 2006). Fig. 5
1.3. No Identificada. Este ejemplar se presentó como un aglomerado de granos que se encontraba en un resto de una pequeña bolsa de cuero fino (Fig. 6). Los granos son negros y se asemejan más al género Chenopodium que a Amaranthus por su forma circular (Martin & Barkley, 1961). Se observa un pericarpio negro, brillante y punteado. El perisperma es claro y el embrión café (Fig. 7). El diámetro de 30 granos dio una mínima de 0,9, máxima de 1 mm, y un promedio de 0,9 mm. Se descartó que fuese Cistanthe amaranthoides, planta silvestre local. Por el momento es difícil establecer una taxonomía más acotada.

Fig. 6 Aglomerado de semillas N. I. de Amaranthaceae y su contexto de ofrenda. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151

Fig. 7 Granos no identificados de Amaranthaceae. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
2. Arecaceae
2.1. Subtribu Bactridinae. Se recuperó un endocarpo con semilla y endosperma removido. Tanto la base como ápice de este endocarpo han sido tallados dejando un pequeño y gran orificio respectivamente. Se observa un solo poro lateral (Fig. 8), por lo tanto, los rasgos diagnósticos de esta especie

Fig. 8 A-C. Endocarpo de palma arqueológica. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
se reducen al no poder visualizar más poros basales y/o laterales (Quingley com pers). El fragmento de endocarpo recuperado se midió dando 28,54 × 26.46 mm, con un grosor de 4,16 mm. Por el tamaño, forma y composición del fruto se propone que podría pertenecer a la tribu Cocoseae, subtribu Bactrinidae (Moraes com pers). Dentro de esta tribu hay diversos géneros: Acrocomia, Astrocaryum, Aiphanes, Bactris, Desmoncus (Pintaud et al., 2009).
3. cf. Cannaceae
3.1. cf. Canna sp. Estas semillas han sido trabajadas como cuentas discoidales y se encuentran sueltas o en collares (Fig. 9). Las semillas son de color negro y textura brillante, miden aproximadamente 4,13 × 5,04 mm. En algunas se ve un tono blanquecino en los surcos desgastados, lo cual puede deberse a causas tafonómicas o bien se trataría de la coloración original interna de estas semillas (Fig. 10). Una especie aún no identificada de Canna colectada en Chile central por las autoras posee rasgos, morfología y tamaño similar. Informes en preparación postulan Canna sp. como posible adscripción taxonómica para estos ejemplares (Carrasco y Sinclaire, com pers.).

Fig. 9 Collar de cuentas de cf. Canna sp. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151

Fig. 10 Semillas talladas como cuentas de cf. Canna sp. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
4. Cucurbitaceae
4.1. Lagenaria siceraria. Varios fragmentos de pericarpio de calabaza fueron recuperados, presuntamente como partes de recipientes ofrendados. Algunos fragmentos tienen orificios o perforaciones con restos de lana seguramente para acarrearlos, o bien como testigo de reparaciones durante su vida útil (Tartaglia, 1980). Fig. 11.

Fig. 11 Cáscaras de Lagenaria. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/ view/824/1151

Fig. 12 A-B. Pericarpo arqueológico de Hymenaea. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151

Fig. 13 A-D. Variedad de Phaseolus y sus contextos arqueológicos. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
5. Fabaceae
5.1 Hymenaea cf. courbaril. Pericarpo leñoso, de 11 × 3,5 cm y 0,5 - 1 cm de grosor. Su consistencia es leñosa, con fibras estriadas paralelas a lo largo de la semilla. Fig. 12.
5.2. Phaseolus vulgaris var. vulgaris y Phaseolus lunatus. Estas semillas se encontraron tanto dentro de bolsas como sueltas Fig.13 A-D.
Los especímenes de P. vulgaris son ovales. Sus tonalidades son amarillas, café, granate y morado; además, de porotos bicolores (morado y amarillo). Las mediciones de longitud, latitud (en el sector del hilo seminal) y grosor de 21 especimenes disponibles, entregó un promedio de 12 × 8,5 × 7 mm respectivamente, y una relación longitud/latitud de 1.4 mm. Esas medidas apoyarían que se trata de la variedad vulgaris y no de otra como, por ejemplo, Ph. vulgaris var. aborigineus, que generalmente presenta especímenes pequeños (6,7-8,5 × 4,7-6 × 2,2-3,1 mm) (Babot et al., 2007) (Fig 14). No obstante, podría ser que también hubiesen ejemplares de Ph. vulgaris var. pinto o “kidney beans”, de coloración granate. En la muestra disponible sólo había un ejemplar de esta variedad, cuya longitud es mayor a la media de los anteriores (17,13 × 8,26 × 6,35 mm). Es importante aclarar que, por ahora, no es posible ahondar en esta identificación.

Fig. 14 Phaseolus vulgaris var. vulgaris. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151

Fig. 15 Phaseolus lunatus. Material arqueológico. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/ view/824/1151
P. lunatus tiene semillas aplanadas, arriñonadas de coloración blanca, amarillento, morada y una combinación o variegado entre estos tonos con patrones recurrentes. Las mediciones de longitud, latitud (en el sector del hilo seminal) y grosor de 21 especimenes disponibles, entregó un promedio de 22,5 × 13,5 × 5,1 mm (Fig. 15). Probablemente estos pertenezcan al tipo “inca”, y son sumamente parecidos a aquellos registrados por Cárdenas (1969: 106) para los valles cochabambinos, como ya ha observado Núñez (1982) en el sitio arqueológico Caserones, que pertenece al Formativo de Tarapacá. A su vez, para Guatacondo, Tartaglia ha recuperado 18 especímenes y los describe como “pinto with smooth surface with black specks or spots; solid yellow with smooth surface; tan yellow wrinkled surface; red with smooth surface; dark blue with smooth surface, assorted light yellow with not clearly coloration and texture” (Tartaglia, 1980: 132).
5.3. Prosopis cf. flexuosa DC. Sección Algarobia. Se recuperaron vainas curvas y rectas y algunos endocarpios, en ciertos casos estaban amarradas con cuerdas de fibra animal (Fig. 16). Si bien la morfología de las vainas difieren, es difícil discernir especies a partir de esta característica (Pasiecznik et al., 2001; Trobok, 1985). Siguiendo a este último autor se midieron y caracterizaron morfológicamente aquellos endocarpios disponibles en la muestra. El promedio de ocho endocarpios fue de 7 ×10,19 × 4.5 mm; dimensiones que coinciden con la descripción dada por Trobok para P. flexuosa: “segmentos longitudinales, subcuadrado- rotundos, duros, rugosos y umbonados por ambas caras” (Trobok 1985: 250). Las semillas del género Prosopis son consideradas diagnósticas para identificar especies (Trobok 1985). La extracción de las semillas desde los endocarpios fue muy difícil por la dureza y hermetismo de los segmentos, característica que podría asimilarse a P. flexuosa más que a P. alba (Trobok 1985). En esta extracción las semillas pueden resquebrajarse si aún estaban en el interior del endocarpio. Por este motivo, se tomaron sólo dos semillas, las cuales coinciden más con P. flexuosa que con P. alba. Estas semillas son “ovoides, con sección angostamente elíptica; extremo chalazar anchamente redondeado” (Trobok 1985: 244) (Fig. 17). De Ugarte y Gallardo (2018) identifican las especies de este género en la cercana aldea de San Salvador como Prosopis flexuosa DC. Mediante análisis taxonómicos que consideren más caracteres, además de análisis genéticos, se podrán confrontar estas identificaciones.

Fig. 16 Vainas de Prosopis cf. flexuosa y sus contextos arqueológicos. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151

Fig. 17 Prosopis cf. flexuosa arqueológico. A, endocarpios. B, semillas. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/824/1151
6. Poaceae
6.1. Zea mays. El maíz está representado por corontas con y sin granos sueltos. A partir de los cariopses sueltos se distinguen tipos de dos variedades. La primera variedad que caracterizamos posee corontas de largos por sobre los 10 cm y un diámetro promedio de 2 cm en su parte media. Presenta formas ovalada y ápices apuntados. Tiene un promedio de 11 hileras por corontas dispuestas de manera regular. Las cúpulas de las corontas son redondas y grandes y cada hilera posee más de 20 granos. Los granos de esta variedad se describen como ovalados apuntados, algunos levemente indentados y con pico, del tipo harinoso y su disposición es montada, es decir un grano se sobrepone con el otro. Los tamaños de los granos alcanzan un promedio de 100 mm de largo, por 6 mm de ancho y 5 mm de espesor (Fig. 18). A partir de estos elementos, sugerimos que estos ejemplares de Topater tienen afinidad con las variedades conocida como “Capio Chileno Chico” (sensuParatori et al., 1990) y la variedad “Paro”, que actualmente se cultiva en Perú (Salhuana, 2004). Sin embargo, se debe considerar que la variedad es una categoría taxonómica discutible, pues pueden presentar gran diversidad, producida por procesos de hibridización y el manejo antrópico de los cultivos. Por lo tanto, estas asignaciones deben tomarse con cautela (Vidal, 2017).

Fig. 18 Maíz arqueológico tipo capio chico chileno. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/ view/824/1151

Fig. 19 Maíz arqueológico, granos tipo reventador. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/ view/824/1151
La segunda variedad se reconoce sólo a partir de granos sueltos (Fig. 19), los cuales difieren completamente con la primera variedad descrita. Estos presentan formas redondas, con un diámetro promedio de 5 mm, y dada la dureza de su corteza, pueden corresponder a algún tipo de grano ¨reventador¨ (pop corn) como los descritos para Tarapacá (Vidal et al., 2016) y los Valles Occidentales de Arica (Muñoz, 2004).
ANTECEDENTES DE LOS TAXONES RECUPERADOS EN TOPATER 1
En este apartado se hace una breve referencia a los antecedentes para cada taxón recuperado. En ellos se describe su probable lugar de origen, cronología general de las evidencias arqueobotánicas en América, en especial aquellas más próximas o insertas en el área de estudio; usos etnobotánicos, y la posibilidad de estos taxones para adaptarse y crecer en el ambiente del desierto de Atacama.
Amaranthus caudatus. El género Amaranthus tiene más de 60 especies, y existen tres especies domesticadas en América. A. cruentus y A. hypochondriacus son más comunes en América Central, mientras A. caudatus se presenta en la región Andina de Sud-américa (Stetter et al., 2015).
La abundancia de especies y la semejanza entre ellas, ha llevado a una gran cantidad de sinonimias siendo difícil en algunos casos la adscripción taxonómica. A. caudatus es una especie originaria de los Andes (Pickersgill & Heiser, 1977), posiblemente domesticada a partir de su par silvestre A. hybridus subsp. quitensis y/o A. quitensis (Sauer, 1967; Costea et al., 2001). Se han encontrado semillas y microfósiles con antigüedades que van desde 7000 A. P. hasta el período Inka, lo cual sugiere que tanto sus versiones silvestres como domesticadas han sido aprovechadas por los grupos humanos para fines alimenticios, decorativos y medicinales (Babot, 2011; Arreguez et al., 2013; García et al., 2014; López et al., 2015). En Antofagasta de la Sierra, Noroeste Argentino, microrestos de Amaranthus caudatus han sido registrados hacia el 4500 A. P. (Arreguez et al., 2013). En Atacama hallazgos de Amaranthus sp. han sido reportados en la costa de Arica durante el Arcaico tardío y Caserones y Ramaditas para el Formativo de la Pampa del Tamarugal (Muñoz,1995a; Rivera & Dodd, 2013; García et al., 2014).
El amaranto puede crecer desde el nivel del mar hasta los 3300 m s. m. (Tapia, 2000). Las especies de amaranto se cultivan en una amplia variedad de suelos siendo el más apto para su cultivo los de tipo francos bien drenados, con un pH neutro o básico (arriba de pH 6). Crece mejor con limitantes de agua, una baja humedad y altas temperaturas, por lo que se considera como un cultivo tolerante a sequía (Aguilar, 2012). Algunos reportes mencionan que algunas especies de amaranto son tolerantes a la salinidad y alcalinidad (Kauffman et al., 1984). Por lo tanto, con cierto manejo podría haber sido plantado en el Atacama. Recientes análisis polínicos en los campos de cultivos Guatacondo 1 y 2 del Formativo han arrojado granos de Cheno-am (Segura, 2018). Probablemente, en estas tierras bajas se estuviesen aprovechando las inundaciones estacionales producto del invierno altiplánico, junto con la implementación de nuevo sistemas de irrigación y fertilizantes (Planella et al., 2018). Polen de Chenopodiaceae también se ha reportado en campos del sitio Maní 19 hacia el 2290 ±15 A. P. (González & Maldonado 2013). Rivera & Dodd también reportan campos agrícolas en Ramaditas (2600 A. P.) desde donde se obtuvieron macrorestos preliminarmente identificados como “Amaranthus, posiblemente cruentus o hypochondriacus, o alternativamente, alguna variedad de Chenopodium” (Rivera & Dodd 2013: 47). No obstante, estos restos, en parte, podrían ser especies silvestres que crecen en el área (Atriplex spp.) y que han sido encontrados abundantemente en otras muestras del período (Kautz, 1980).
Chenopodium quinoa var. quinoa y Ch. quinoa var. melanospermum. El género Chenopodium (Amaranthaceae) incluye cerca de 150 especies herbáceas anuales. Estas se encuentran principalmente en zonas templadas y subtropicales (Bazile et al., 2014). Diferentes variedades y especies de pseudocereales están presentes en el rango andino a lo largo de las Américas. La quinoa se cultiva a más de 1800 m s. m., aunque existe la variedad costera del sur de Chile que crece al nivel del mar (Planella & Tagle, 1995). Las quenopodiáceas son plantas herbáceas que colonizan hábitats perturbados, por lo tanto, los expertos regionales creen que la domesticación andina surgió de especies silvestres que se establecieron en espacios antropogénicos. Por el mismo motivo, se ha propuesto que co-evolucionó con la domesticación de camélidos (Kuznar, 1993; Pearsall, 1989; Smith, 1998). Wilson (1988) propone, sobre la base de la variación genética, que el corazón de la domesticación en Sudamérica fue en los Andes centro-sur, en el sur de Perú y Bolivia. Durante el período Formativo en las tierras altas de Bolivia, se manipularon diferentes variedades de quenopodiáceas (Langlie et al., 2011). Semillas de testa delgada provienen de los niveles de 4950 A. P. en las cuevas de Panalauca y Pancan, Perú Junín (Nordstrom, 1990). Los especímenes más tempranos de quinoa identificados se encuentran en las tierras altas de Bolivia, fechadas en Chiripa desde 3450 A. P. (Bruno, 2001; Gott et al., 2006; Bruno & Whitehead, 2003). Langlie et al. (2011) describe un nuevo tipo morfológico arqueológico de Chenopodium sp. en el sitio La Barca, ubicado en el Departamento de Oruro, Bolivia por 3024 ± 35 14C años, A. P. cal. También Eisentraut (1998) obtuvo una fecha AMS de 2740 A. P. en la cueva Quelcatani en Perú. Babot (2004) informa sobre la presencia de microfósiles de quinoa y amaranto en herramientas que datan entre 5350 y 3150 A. P. en la puna del noroeste Argentino. Para la misma área se reportaron macrorrestos: semillas y tallos de quinoa (Rodríguez et al., 2006).
En la costa chilena se encontraron granos de Chenopodium, aparentemente quinoa, como parte de una ofrenda en un contexto Chinchorro hacia 5450 A. P., aunque no están fechados directamente ni se describen con precisión (Uhle, 1917). Según estos hallazgos, una estimación liberal del momento de la domesticación de la quinoa en los Andes será de 5000 A. P. en comparación con una estimación conservadora de 3500 A. P. (Bruno, 2006; Planella et al., 2014). A partir del periodo Formativo Chenopodium quinoa comienza a presentarse en distintos contextos aldeanos y fúnebres del norte chileno. Cercanos a Topater los sitios que presentan afinidad a este cultivo son el cementerio Chorrillos; Guatacondo, Caserones, Tulan 55, 58, Calar y Gatchi entre otros (Núñez, 1974, 1982; Focacci, 1980; Muñoz, 1983, 2004; Holden, 1991; Belmar & Quiroz 2005; McRostie, 2007; Vidal, 2007). Como fue descrito para Amaranthus, la quinoa pudo haber sido parte de los campos agrícolas regionales cultivados hacia el Formativo.
Subtribu Bactrinidae. Estos taxones producen cocos y etnobotánicamente muestran variados usos. Sus semillas son comestibles con alto contenido de aceites, además de ser usadas sus hojas y troncos para artesanía y/o construcción (Albán et al., 2008). Las especies de esta subtribu son de origen neotropical o andino-subandino (Pintaud et al., 2009). Arqueológicamente, distintas palmas, así como partes de palmas, han sido encontrados en sitios a lo largo de Sudamérica y Mesoamérica desde al menos 10.000 A. P. (Morcote-Ríos & Bernal, 2001; Lima et al., 2018). En el desierto de Atacama, endocarpos similares, pero aparentemente del género Syagrus han sido encontrados para el sitio Coyo Oriente en los oasis del Salar de Atacama. Sus características ecológicas y botánicas no harían posible su crecimiento en el desierto de Atacama. El único género presente en Chile de Cocoseae es Jubaea, con dos especies endémicas, una de Chile central J. chilensis y otra especie extinta, oriunda de la Isla de Pascua. cf. Canna spp. Este género presenta muchas especies, algunas de ellas sólo ornamentales. Con respecto a sus especies cultivadas, Canna edulis sin. indica tiene profunda temporalidad en el mundo andino.
Canna edulis tiene diferentes propuestas para áreas de domesticación, desde las montañas del sur del Per ú hasta la selva tropical colombiana (Ugent et al., 1984). En Real Alto, Ecuador, se han encontrado f itolitos y almidones de Canna edulis en un lapso de tiempo de 4750-4350 A. P. (Chandler-Ezell et al., 2006; Perry, 2007). Babot (2004) encontró almidones de Canna edulis adheridos a herramientas de molienda en el noroeste de Argentina (4100-3200 A. P.). Las hojas de Canna edulis se han recuperado en sitios costeros del centro de Per ú y su ubicuidad llevó a Cohen (1978) a proponer que el achira junto con la yuca eran las plantas alimenticias dominantes durante el período pre-cerámico. En el norte chileno esta especie aparece hacia el Arcaico tardío en Morro 1/6 (Muñoz, 1995b) y en la misma zona hacia el Formativo (Erices, 1975; Santoro, 1980; Muñoz, 1985). Su amplia presencia en la costa y Andes Centro sur da cuenta de su adaptación a distintos nichos y probablemente pudo ser cultivada en el Atacama, tal como se ve en jardines de quebradas y oasis actualmente. Con anterioridad estas cuentas se han identif icado erróneamente como Mucuna elliptica en los sitios de Playa Miller 7, Azapa 71 y Quillagua 84 y 89, así como también para las aldeas tempranas de Pampa del Tamar ugal (García et al., 2014).
Lagenaria siceraria. Este cultivo se originó en el Viejo Mundo, pero apareció en el Nuevo Mundo antes de la llegada de Colón (Vavilov, 1992 [1940]). Los especímenes arqueológicos de calabaza de botella son los más comunes, ocurriendo en contextos anteriores a 6950 A. P. dentro de América del Sur (Pearsall, 1992, 2008). Erickson et al. (2005), sobre la base del análisis del grosor de la corteza de la fruta, indican que la calabaza de botella estaba presente en Estados Unidos hacia los 10000 A. P. y que sus antepasados estaban más estrechamente relacionados con variedades asiáticas. Aunque las semillas oleaginosas de Lagenaria sp. probablemente se consumieron, se destaca su papel utilitario como recipiente, especialmente durante el período pre cerámico, lo que pudo haber influido en el hecho de que la s poblaciones portaban este cultivo ya durante las migraciones del Pleistoceno (Erickson et al., 2005).
En la costa norte de Perú, Quebrada Jaguay presentó especímenes fechados en 8400 A.P. y varios si tios confirmaron su presencia temprana (Berman & Pearsall, 2008). En el noroeste de la Argentina también hay restos tempranos (Lema, 2011; Rodríguez, 2013). Se hallaron como microfósiles en tiempos precerámicos en Punta de la Peña 4 (4060-3820 A. P.) (Babot, 2004). En la costa norte de Atacama y la Puna Salada Occidental, aparecen hacia el período Arcaico tardío (Dauelsberg, 1974; Núñez, 1974, Focacci & Chacón, 1989; McRostie, 2007). Durante el período Formativo, aparece en diferentes sitios de la Puna de Atacama Occidental (p. ej. Pollard, 1971; McRostie, 2007; Lema, 2009), y aparece en varios sitios en la costa norte de Chile después de 2450 A. P. (Núñez, 1974; Núñez & Moragas, 1977; Muñoz, 1983; Dauelsberg, 1985). Esta familia es ampliamente cultivada en los trópicos, y requiere una cantidad de agua moderada y abundante sol (Tindall, 1983), motivo por el cual, con algo de irrigación en el desierto de Atacama probablemente también pudo cultivarse. Mostny (1970) da cuenta que para el subárea de Guatacondo se cultivaba maíz y calabaza hacia la época de sus investigaciones; si bien Tartaglia (1980) señala que probablemente durante el Formativo ésta fuese importada desde otros lugares ya que no se adaptaría bien a los fríos extremos del desierto. A su vez, el alto grado de reparación podría estar avalando esta hipótesis (Meighan, 1980).
Hymaneae cf. courbaril. El género Hymaneae presenta más de 14 especies. El género estudiado tiene una amplia dispersión y variedades en la mayor parte de los países tropicales de Sudamérica, hallándose en una altitud de hasta 1200 m s. m. Crece mejor en áreas en donde las precipitaciones promedian entre 1900 y 2150 mm por año (Francis et al., 2000, p. 279). Es un árbol de 12 a 25 m de alto, de madera muy dura, que requiere terrenos bien drenados para su desarrollo. Dentro de su distribución el área más cercana al desierto de Atacama es la Provincia de Abel Iturralde del departamento Boliviano de la Paz, parte de la Amazonía boliviana (Chávez et al., 2011).
Este árbol es genéricamente conocido como “paquio” en Bolivia. El árbol exuda una resina inflamable llamada copal, usada en la preparación de barnices, la cual cristalizada es similar al ámbar, de color amarillento transparente.
También tiene propiedades medicinales, utilizada como antidiarreico. El fruto tipo legumbre, oblongo, grueso y leñoso, es de color pardo rojizo oscuro brillante, aproximadamente de 5 a 12 cm de largo. El pericarpio inmaduro está provisto de pequeñas bolsas de resina y presenta una a seis semillas duras, aplanadas, elipsoides, de 1,5 a 2 cm de largo, café claro brillante, cubiertas de una sustancia harinosa, color crema, seca, dulce y comestible. Los frutos se recogen del suelo y se los golpea para abrirlos. Las poblaciones amazónicas han consumido estos frutos; este hábito se habría transmitido de generación en generación (Cárdenas, 1969; Chávez et al., 2011).
Este fruto sólo se ha recuperado en Atacama, en el contexto analizado de Topater y en la aldea Formativa temprana de Chiu Chiu 200. Su escasez en los contextos, distribución geográfica y requerimientos ambientales sugieren su importación desde allende los Andes.
Phaseolus spp. Estos cultivos tienen dos áreas de domesticación: América Central y del Sur. Ambas especies de frijol crecen silvestres en elevaciones alrededor de 1500-2500 m s. m. desde México hasta el noroeste de Argentina (Smith, 1998). En el sur de América, la extraordinaria variación de ambas especies en la costa y sierra del Perú, así como en valles interandinos de Bolivia y Argentina induce a pensar en un origen andino para ellas (Cárdenas, 1969; Babot, 2007). Gepts (1990) determina que Phaseolus vulgaris o poroto, “purutu”, fue domesticado dos veces: en México y en los Andes del sur. Kaplan
& Lynch (1999) sugieren que Phaseolus lunatus o pallar fue domesticado a partir de poblaciones silvestres en los Andes sudamericanos, creciendo en las pendientes occidentales de la cordillera. La alta variedad de colores y tamaños de pallares da cuenta de una gran profundidad temporal y manipulación humana, tal como muestran los sitios arqueológicos en los Andes Centrales y Centro-sur. Se han reportado microrestos tempranos en el valle de Ñanchoc, al norte de Perú, donde se encontraron granos de almidón de Phaseolus en el cálculo dental hacia 8000 A. P. (Piperno & Dillehay, 2008). Los fechados obtenidos por AMS en frijoles del sitio de Chilca, en la costa sur de Perú, dieron 5616-6920 A. P., lo que sugiere que por 7000 A. P. esta especie ya estaba domesticada en el área (Kaplan & Lynch 1999).
En las tierras altas del Perú, en Guitarrero (2500 m s. m.), P. vulgaris fue datado por 4337 A. P. y P. lunatus alrededor de 3495 A. P. En la costa peruana, Ugent et al. (1986) reportan frijoles en Pampa Rosario y Las Haldas (2760-2400 A. P.,
2990-2845 A. P.). En el noroeste de la Argentina, se han reportado semillas de Phaseolus en Huachichocana, Inca Cueva, Puente del diablo, La Gruta 1 (4450 A. P.), entre otros sitios (Pearsall 2008; Lema 2009). También se han identificado microfósiles en contextos de cazadores recolectores del noroeste de Argentina datados en 6000-3500 A. P. (Hocsman, 2006; Rodríguez et al., 2006). Los porotos aparecen en el desierto de Atacama hacia el Formativo (Reichert, 1913; Romero et al., 2004; Rivera, 1995-96). En varios sitios, en su mayoría funerarios se hallaron Phaseolus vulgaris y lunatus. Sitios cercanos a Topater que presentan estas especies están en el área de la pampa del Tamarugal, tales como Guatacondo y en la desembocaura del río Loa (Núñez, 1982, 1984; García et al., 2014; Carrasco et al., 2017). Phaseolus vulgaris es un cultivo mesotérmico típico de los valles y faldas templadas sudamericanas. Crece comúnmente entre los 0 y 2000 m s. m., aunque en algunas zonas se siembra hasta los 3500 m s. m. (Tapia, 2000). Ninguna otra especie de poroto cultivada alcanza mayor distribución ni variación morfológica (Cárdenas, 1969). Los pallares se adaptan a varios tipos de terreno (Corcuera, 2017). Tartaglia (1980) y Planella et al. (2018) señalan que estos pallares pudieron haber sido cultivados en el desierto chileno, ya que son flexibles en adaptarse a distintos tipos de suelos y regímenes de irrigación. No obstante, aún no sabemos si en esta fase estos recursos eran cultivados localmente (Muñoz, 1980).
No obstante, los porotos o pallares no sólo fueron importantes en la dieta, sino que también tienen un gran valor artístico y simbólico. En Perú son representados en el arte Moche, Nazca y Paracas. En la cultura Moche se hallan semillas talladas que formarían parte de un sistema ideográfico (Larco Hoyle, 1942); también se piensa que fueron utilizadas durante ceremonias funerarias o agrícolas, o bien como oráculos o juegos junto con P. vulgaris (Cárdenas, 1969; Corcuera, 2017).
Incluso los cronistas distinguen entre “purutus” comestibles y “chuwis o chuis” multicolores no comestibles, usados en los juegos tanto de niños como adultos. Los distintos colores y diseños a su vez reciben distintos nombres como por ejemplo “toritos o burritos”. Los pallares además de comerse sirven para juegos, siendo dos “chuis” equivalente a un “palatu” (o pallar) (Cárdenas, 1969:108). Para Guatacondo, Tartaglia da cuenta de que los distintos pallares estaban asociados diferencialmente a ciertas casas y posiblemente a distintos campos agrícolas. Así, todos los “pinto” (16%) se encontraban en la casa nueve, los “yellow smooth surface” en la casa 26 (33%) y los restantes, también estaban distribuidos selectivamente en otras casas (Tartaglia, 1980: 132, traducido por el autor). Podría ser que esta distribución obedeciera a un sistema simbólico propio que involucaría a estas especies, como hemos referido más arriba.
Prosopis spp. La sección Algarobia se presenta en América con más de 30 especies, y su distribución disyunta ha llevado a distintas hipótesis sobre su biogeografía. Los centros de origen más cercanos al desierto de Atacama se consideran la región chaqueña y el sur de Perú (Pasiecznik et al., 2001; Bessega et al., 2006). La mayoría de los autores dan cuenta de especies pertenecientes a la serie Chilenses de la sección Algarobia ( P. alba, P. alba var panta, P. flexuosa) (Barros & Wrann, 1992). Estos árboles, por pertenecer a la familia de las leguminosas, tienen la propiedad de fijar nitrógeno en el suelo y a la vez su hojarasca permite generar materia orgánica para albergar diversos microorganismos, insectos, animales y plantas (Beresford Jones, 2004). Su madera dura es excelente material para combustible, construcciones y artesanías. Sus vainas, al poseer un mesocarpo dulce y nutricio, son un alimento preciado tanto por grupos humanos como por los animales. “Thaccu o Taco”, su nombre en quechua significa “el árbol” (Yacovleff & Herrera, 1934) lo cual refleja su relevancia para estas poblaciones. Con estas especies se pueden preparar múltiples recetas para consumo inmediato o bien para almacenamiento (Galera, 2000; Pasiecznik et al., 2001; Giovannetti et al., 2008). A su vez, tanto su hojarasca como sus vainas son excelente forraje para animales (Galera, 2000).
En asentamientos pre-Colombinos, Shimada y Shimada (1985) han detectado cutículas de Prosopis en coprolitos de camélidos. Hay ciertos autores que han propuesto su uso como forraje en el desierto de Atacama (Núñez, 1982; McRostie, 2014). La presencia de algarrobo en tiempos precolombinos se ha detectado tempranamente en la costa norte y centro de Perú, así como en el noroeste Argentino hacia los 10.000 A. P. (McRostie et al., 2017). Recientes investigaciones proponen que esta especie económica y fundamental en la colonización efectiva del desierto fue introducida hacia alrededor de 3000 años antes del presente. Su origen biogeográfico foráneo junto con un set de dataciones por AMS sobre endocarpios de diversos sitios arqueológicos arcaicos y formativos muestran fechados tardíos de aparición (McRostie et al., 2017), si bien hay que seguir investigando esta biogeografía. De ser así, una combinación entre su carácter invasivo y su resistencia a la aridez, más la apropiación y aceptación cultural de sus beneficios; facilitó su rápida dispersión y naturalización, constituyéndose así en el recurso más utilizado y representado en estos contextos.
Zea mays. El maíz es una planta que presenta una alta plasticidad fenotípica (Bonavia, 2013). Esto le permitió adaptarse a las diversas condiciones ecológicas de los Andes, utilizándose en el pasado, y hasta la actualidad, como una de las principales fuentes alimenticias (Staller, 2010). Existe poca evidencia sobre el origen del maíz para el Norte Grande de Chile. Se postula no obstante, que la variedad Pirincinco Coroico, recuperada desde los contextos de Tiliviche 1B, provendría del Oriente Boliviano (Núñez 1986). Esta asignación se realizó a partir de la similitud fenotípica que presentaban los ejemplares nortinos de Chile con respecto a los de Bolivia. En concordancia, estudios genéticos realizados sobre una mazorca tarapaqueña datada hacia el 1500 ± 50 años AP, indican la presencia del alelo GA TA (gen ADH2), el cual es propio de ejemplares de maíces de la vertiente oriental andina (Freitas et al., 2003). Esto sugiere que un importante flujo génico se produjo en tiempos prehispánicos, con la introducción de variedades desde el oriente, que se adaptaron a las condiciones ecológicas del desierto de Atacama.
Para la zona de San Pedro de Atacama y alrededores, no se poseen estudios similares que den cuenta del origen del maíz. Dada la larga tradición de intercambio entre el norte de Chile y el Noroeste de la Argentina, así como también la presencia de maíces tempranos en esta región (ca. 3000 A. P.) (Lia et al., 2007; Lema, 2014), sugerimos que parte de las variedades prehispánicas de maíces del Norte Grande de Chile, pueden haber sido introducidas desde este lugar de origen (Vidal et al., 2019). Sabemos que el maíz ya está presente en el período Formativo en los contextos de Toconao y Sequitor (Vidal,
2007). Asimismo, se reportan mazorcas en el sitio de Tulor 1 (Llagostera et al., 1984). No obstante, la consolidación de una agricultura de maíz se habría producido durante el Formativo tardío (García et al., 2014). A partir de este momento (ca.2000 A. P.), se ofrendan mazorcas de maíz que acompañan a los difuntos prehispánicos de San Pedro (Le Paige, 1974). Las variedades harinosas son utilizadas para la preparación de harinas, masas, en bebestibles (chicha), en sopas y guisos. Las variedades reventadores se cocinan tostadas permitiendo que reviente el grano y también en preparaciones de guisos y sopas.
DISCUSIÓN
En este trabajo, realizado a partir de una submuestra arqueobotánica, presentamos los restos vegetales del cementerio Formativo Topater 1. El repertorio de taxones vegetales se destaca por ser diverso y tener una buena conservación. Ahora bien, creemos que la cantidad y exacerbación de recursos de distintas materialidades recuperados en el sitio Topater 1 tiene que ver con su caracter fúnebre y simbólico (Binford, 1971; Thomas & Salazar, 1997). Pero también, esta diversidad está asociada a su locación. El sitio Topater, al estar situado en un oasis en el curso medio del río Loa, se transforma en un sector en donde confluyen diversos actores. Agüero y Cases, a partir de los textiles hallados, lo interpretan como un sitio que se relaciona con “otros espacios productivos del curso del Loa, como Quillagua y la desembocadura, y desde estos puntos, con la costa y quebradas tarapaqueñas” (Agüero y Cases 2004: 23).
Por su parte, Thomas, señala que “con una mayor representatividad encontramos la quínoa y después los porotos…es importante destacar que la quínoa se encontraba en hoyos y en sacos hechos exprofeso, sin ninguna relación con algún entierro en particular, aspecto que podría correlacionarse con sitios de Alto Ramírez, Valle de Azapa” (Thomas 1995b:163).
De hecho, los taxones hallados se presentan diferencialmente en los diversos sitios insertos dentro de la red de intercambio de Topater. A pesar de las posibles variables tafonómicas que puedan influenciar estos patrones; estas diferencias contribuyen a examinar el Formativo local, proceso idiosincrático en donde cada grupo fue adoptando estas innovaciones de distintas maneras (Hastorf, 1999). De este modo, recapitulando los antecedentes de estos taxones, se puede decir que en los contextos coetáneos situados al oriente y noroccidente de Topater, habría diferencias en la composición de los repertorios arqueobotánicos. Así, ciertas plantas como Amaranthus caudatus no estaría presente en los sitios del eje prepuna de Atacama (p. ej., Toconao Oriente, Tulan, Chiu Chiu 200, Tulor 1) y curso medio del río Loa (San Salvador, Quillagua), pero sí en contextos de Pampa del Tamarugal (Guatacondo). Otros recursos presentes en Topater serían más o menos comunes al eje del río Loa y Pampa del Tamarugal (cuentas de semillas, Phaseolus, Gossypium), otros aparecen sólo en contextos aguas arriba del río Loa o Salar de Atacama (Bactridinae e Hymenaea), y algunos serían comunes a la macrozona que abarca la Pampa del Tamarugal, el río Loa y la Cuenca del Salar de Atacama (Prosopis spp., C. quinoa, Z. mays, L. siceraria).
Como se revisó en el capítulo precedente, la mayoría de los taxones recuperados en Topater ya estaban circulando desde algunos milenios atrás en Sudámerica, y el ingreso de estos cultivos hacia esta época también da cuenta de la extensión de las redes regionales y la inserción de las poblaciónes del desierto de Atacama dentro de un proceso macro-regional. Ahora bien, desde nuestra experiencia en terreno y la bibliografia disponible, se puede proponer que los recursos vegetales domésticos adaptables al desierto de Atacama aún no predominaban del todo por sobre otros recursos silvestres o semi-domésticos.
De hecho, sus frecuencias son bajas en relación a Schinus molle L. o Prosopis spp. para la pampa del Tamarugal (García et al., 2014; Planella et al., 2018), o Prosopis spp., Cyperaceae, Cactaceae, en el eje del río Loa Medio-Cuenca del Salar de Atacama (Núñez et al., 2009; McRostie 2014; McRostie et al., en prensa). Así, si bien la mayoría de las especies se podrían cultivar en el Atacama durante la ocupacion de Topater, su cultivo aún parece incipiente (García et al., 2014; McRostie, 2014; Planella et al., 2018). A la fecha, se han registrado varios campos de cultivo asociados con aldeas Formativas, no obstante, aún se está trabajando en afinar sus cronologías. Para el Formativo inicial se postula el cultivo de chenoam en Ramaditas, Guatacondo y Maní 19 (Rivera & Dodd 2013; González & Maldonado 2013; Segura 2018) y el maíz más tardíamente (Santana et al., 2014; Pestle et al., 2015; Planella et al., 2018). Por ahora, es díficil precisar la extensión de estas prácticas agrícolas y si acaso algunas de estas plantas domésticas eran todavía parte de un baggage de bienes de intercambio, como lo serían por ejemplo los especímenes de Bactridinae e Hymenaea. Es posible asegurar, según lo muestran diversas evidencias, que el algarrobo habría sido fundamental en el surgimiento de aldeas y el manejo de tropillas de llamas (Le Paige, 1974; Adán et al., 2013; García et al., 2014; McRostie, 2014; Rozas, 2014). La manipulación y expansión de este ecosistema forestal, eventualmente habría ido facilitando el desarrollo de chacras o huertas con cultivos andinos al ser Prosopis spp. una leguminosa fijadora de nitrógeno y especie nodriza en ambientes desérticos (Beresford Jones 2004; Greene, 2013). De esta manera se estarían integrando diversos elementos bajo un sistema agro-silvopastoril.
El desierto de Atacama, teniendo una base de recursos vegetales silvestres limitados, se va reformulando como un nuevo hábitat, adquiriendo, y luego también produciendo, un conjunto de plantas y ecosistemas domésticos (García et al., 2014; McRostie et al, 2017; Gayó et al., 2019). La exoticidad geográfica en algún punto se torna local, los cultivos provenientes de distintos lugares prosperan, y junto con ellos emerge una nueva relación entre los grupos de humanos y de éstos con el paisaje.
La posibilidad de ir develando esta historia ecológica al establecer categorías taxonómicas más detalladas, así como también entender la genética y/o fitogeografía de los recursos nos ayudará a vislumbrar los recorridos, negociaciones y adaptaciones particulares de estas sociedades al desierto.
CONCLUSIONES
A partir de las evidencias arqueobotánicas del cementerio Topater 1 se puede establecer que este cuenta con la mayoría de los recursos vegetales que estaban siendo utilizados en el área hacia el Formativo regional. No obstante, la excepcional abundancia y diversidad de estos taxones en el sitio en comparación a los otros sitios regionales, revela su carácter de ofrenda funeraria, a la vez que su locación nodal en el eje del río Loa, la que permitió un continuo contacto con poblaciones asentadas desde la costa Pacífica hasta allende los Andes. La revisión de la biogeografía de los taxones domésticos andinos permite dar cuenta de la antiguedad (período Arcaico) de éstos en el continente. Sin embargo, su baja abundancia registrada durante el Formativo de las sociedades estudiadas en comparación a otros recursos tales como Prosopis spp. y Cyperaceae; lleva a considerar que durante este período podría haber tenido lugar una agricultura incipiente. Esta agricultura se desarrolla al reparo de los bosques de Prosopis spp. y en conjunto con un extenso intercambio caravanero. Tanto la sinergia producida entre condiciones ambientales favorables como el arribo de recursos diversos, tecnologías e ideas, habría propulsado un nuevo modo de habitar el desierto el cual se intensificaría hacia períodos posteriores.












 uBio
uBio