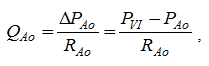Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Iberoamericana de Tecnología en Educación y Educación en Tecnología
Print version ISSN 1851-0086On-line version ISSN 1850-9959
Rev. iberoam. tecnol. educ. educ. tecnol. no.21 La Plata June 2018
ARTÍCULOS ORIGINALES
Simulación del Corazón Izquierdo para Aplicaciones en Docencia e Investigación
C. Nahuel Cervino1, Claudio O. Cervino1
1 Instituto de Fisiología y Neurociencias (IFiNe), Secretaría de Ciencia y Tecnología, Universidad de Morón. Machado 914, 5to Piso. (1708) Morón, Pcia. Buenos Aires, Argentina
nahuel_cervino@yahoo.com.ar, ccervino@unimoron.edu.ar
Recibido: 14/09/2017 | Corregido: 04/01/2018 | Aceptado: 19/02/2018
Cita sugerida: C. N. Cervino, C. O. Cervino, “Simulación del Corazón Izquierdo para Aplicaciones en Docencia e Investigación,” Revista Iberoamericana de Tecnología en Educación y Educación en Tecnología, no. 21, pp. 41-51, 2018. DOI: 10.24215/18509959.21.e05
Resumen
Un modelo es una descripción lógica de cómo un sistema funciona o cómo se comportan sus componentes. Las herramientas de la modelización dinámica facilitan mucho la construcción de los modelos. El objetivo de este artículo es mostrar el desarrollo y los resultados del funcionamiento de un modelo interactivo de la fisiología del sistema cardiocirculatorio para el uso de estudiantes y otros interesados en la fisiología cardiovascular. El sistema de simulación está compuesto por un modelo simple de cuatro componentes, y simula las siguientes variables y parámetros: a) variaciones del volumen aurícula izquierda (AI) y ventrículo izquierdo (VI); b) variaciones presión en AI, VI y aorta (Ao); c) flujo a través de válvula mitral (VM) y válvula aórtica (VAo), y d) reproduce el “efecto Windkessel” en Ao. Se utilizó el entorno de modelización Extend el cual provee una estructura integrada para la construcción de modelos de simulación y el desarrollo de nuevas herramientas de simulación. El corazón derecho y la circulación pulmonar no son considerados. Los resultados de este modelo simulan las características generales del corazón izquierdo y de la circulación arterial, considerando distintas situaciones fisiológicas y patológicas.
Palabras clave: Modelos dinámicos; Simulación; Fisiología cardiocirculatoria; Efecto Windkessel; Extend.
Abstract
Left heart simulation for applications in teaching and scientific research. A model is a logical description of how a system works or how their components behave. The tools of the dynamic modeling facilitate the construction of the models. The aim of this article is to show the development and results of the operation of an interactive model of the cardiocirculatory system physiology for the use of students and others interested in cardiovascular physiology. The model used is a simple model of four components, and simulates the following variables and parameters: a) volume variations of left atrial (LA) and left ventricle (LV); b) pressure variations in LA, LV and aorta (Ao); c) the flow across mitral (MV) and aortic valve (AoV), and d) imitates the "Windkessel effect" in Ao. The modeling environment "Extend" was used, which provides an integrated structure for the simulation models construction and the development of new simulations tools. The right heart and the pulmonary circulation are not considered. The model's results simulate the general characteristics of the left heart and of the arterial circulation, considering different physiological and pathological situations.
Keywords: Dynamic models; Simulation; Cardiocirculatory physiology; Windkessel effect; Extend.
1. Introducción
Los primeros modelos matemáticos en investigación cardiovascular datan del s. XVII, con la ecuación de Bernoulli, y del s. XVIII, con la ecuación de Poiseuille. Mientras que el primer modelo describe el comportamiento de un fluido moviéndose a lo largo de una línea de corriente, el segundo, permite determinar el flujo laminar estacionario de un fluido newtoniano a través de un tubo cilíndrico de sección circular constante. Aunque estos modelos resultan muy útiles para describir cualitativamente muchas de las características de un fluido en movimiento, normalmente resulta inadecuado cuando se compara cuantitativamente con los resultados experimentales.
Hasta la década de 1970, experimentos in vitro e in vivo fueron las principales formas de investigación del sistema cardiocirculatorio (SCC). Mientras las técnicas computacionales para estudiar procesos dentro de la física e ingeniería surgen en la década de 1940, habiendo constituido uno de los primeros usos de la computadora digital, la simulación computarizada de los procesos biomédicos data a partir de los años 1960. En años recientes ha habido logros suficientes, tanto en el campo de la investigación biomédica como en técnicas de computación, junto con los avances en la dinámica de fluidos, como para permitir una revolución en la investigación cardiovascular y en el desarrollo de modelos de simulación útil y confiable del SCC [1] - [4].
Como en cualquier ciencia aplicada, los modelos matemáticos y computacionales están incrementando su importancia en Biomedicina. Las formulaciones matemáticas son extremadamente útiles en la descripción de un sistema ya que son compactas y rigurosas. Así, fruto de mucho tiempo de trabajo, las Matemáticas y la Informática han desarrollado un método universal sustentado en tres grandes pilares: a) la modelización matemática; b) el análisis y la simulación, y c) el control e intervención sobre los sistemas.
Los principios de la fisiología cardiovascular son complejos, y debido a su naturaleza dinámica, no son fácilmente comprensibles mediante el estudio desde los libros de texto estáticos. Por lo tanto, la visualización de los procesos dinámicos por medio de la utilización de herramientas de simulación permite al usuario ajustar las variables fisiológicas, y así, proporciona una herramienta útil para el proceso enseñanza-aprendizaje en los estudiantes de Biología, Ciencias de la Salud y Bioingeniería [5], [6].
1.1. Conceptos de Modelización y Simulación
La modelización es una herramienta poderosa [6]. Con ella se puede analizar, diseñar y operar sistemas complejos. Se utilizan modelos computacionales para evaluar procesos de la vida real demasiado complejos para analizar por medio de hojas de cálculo o diagramas de flujo. Estos modelos abrevian ciclos de diseño, reducen costos y aumentan el conocimiento.
Un modelo es una descripción lógica de cómo un sistema funciona o cómo se comportan sus componentes. En vez de interactuar con el sistema real, se puede crear un modelo que corresponda a dicho sistema en ciertos aspectos.
Se puede definir simulación como la representación dinámica de la interacción de los objetos de un sistema real. La simulación involucra diseñar un modelo de un sistema y llevar a cabo experimentos en él. El propósito de los experimentos “que pasaría si…” es el de determinar cómo el sistema real funciona y predecir el efecto de los cambios en el sistema a medida que el tiempo progresa.
Los modelos computacionales pueden ser estáticos o dinámicos. Mientras que los modelos estáticos describen a un sistema en términos de ecuaciones, donde el potencial efecto de cada alternativa es el resultado de una simple resolución de una ecuación, los modelos dinámicos –las simulaciones– constituyen un programa de ordenador que permite la representación del comportamiento temporal de un sistema.
El incremento de la capacidad computacional y la velocidad de cálculo de los ordenadores actuales, asociado con la necesidad de respuestas más exactas, han puesto a los modelos dinámicos a la cabeza, por sobre los modelos estáticos. Por otro lado, las herramientas de simulación pueden ser clasificadas, de acuerdo al lenguaje, el programa o estado del arte, como continuas, de eventos discretos o combinación de ambas. La principal diferencia entre estos modelos es como están siendo operadas las variables y como es manipulado el tiempo.
La simulación utiliza el marco teórico conceptual de la ciencia computacional: aplicación, algoritmo y arquitectura. Aplicación refiere al problema científico de interés y a los componentes del problema que se desea estudiar. Algoritmo refiere a la representación lógico/matemática del problema, incluyendo cualquier método numérico utilizado para resolver el problema. Por último, arquitectura refiere a la plataforma y las herramientas del software utilizados para calcular el conjunto de soluciones para el/los algoritmo/s desarrollados.
Las herramientas de la modelización dinámica facilitan mucho la construcción de los modelos y la comprensión de su funcionamiento. Una buena herramienta de modelización es lo suficientemente flexible para encajar en un programa de enseñanza, en un proyecto científico o en un desarrollo industrial. Debería proveer puntos de referencia para permitir explorar enfoques predictivos o alternativos, ayudar a determinar cómo utilizar prudencialmente los recursos, u optimizar una secuencia de pasos durante un proceso.
1.2. Simulaciones del Sistema Cardiocirculatorio
Es difícil elaborar un modelo completo del SCC; por un lado, por las muchas variables que intervienen, y por otro, por las complejas relaciones entre sus componentes que llevan a modelos demasiado complejos, difíciles de resolver, y cuyos resultados, muchas veces, son difíciles de interpretar. De las observaciones experimentales del SCC se pueden fijar unas condiciones que simplifican el tratamiento de cada subsistema y facilitan la solución de los modelos [1], [7]. El SCC ha sido modelado completamente por Coleman [8] y por Sud et al. [9]. Otros han elaborado modelos parciales para estudiar un fenómeno particular, como el modelo de Jaron et al. [10], para evaluar el efecto de la aceleración sobre la circulación, o el modelo de Ursino [11], para analizar la regulación cerebrovascular.
En el tipo de simulación biomecánica del SCC, las mismas se apoyan en conceptos físicos, que conllevan la interpretación fisiológica del sistema en estudio. Por lo tanto, para la simulación en ordenador, el comportamiento del SCC se deberá plantear en términos de variables como: presión, volumen, viscosidad, densidad y velocidad sanguínea, resistencia y capacitancia cardiovascular. Los conceptos físicos necesarios para acometer el estudio se concentran en los campos de la mecánica de sólidos, el análisis estructural, la mecánica de fluidos, para el análisis de la circulación. De esta manera, los modelos representarán los fenómenos biomecánicos y hemodinámicos en términos de modelos matemáticos.
Para lograr este propósito, el comportamiento del SCC se puede analizar dividiéndolo en cuatro subsistemas con el fin de considerar su función específica y deducir su participación biomecánica en el conjunto: a) el fluido (la sangre), es el medio de transporte de masa; b) la red de vasos sanguíneos, a través de los cuales se desplaza el fluido; c) las válvulas, dispositivos que marcan la unidireccionalidad del flujo, y d) la unidad de bombeo (el corazón), que provee la energía necesaria para impulsar el fluido y vencer las pérdidas de presión.
El enfoque biomecánico ofrece una visión diferente del SCC [12], [13], aportando los conceptos necesarios para aprovechar los desarrollos tecnológicos, y plantear modelos para realizar simulaciones, que permiten evaluar el comportamiento del sistema bajo diferentes condiciones fisiológicas y patológicas, como alternativa a complejos estudios en el sistema in vivo, sea por dificultad técnica, por el riesgo sobre el paciente o por el alto costo.
1.3. Objetivos
El objetivo de este artículo es presentar el desarrollo y los resultados del funcionamiento de un modelo biomecánico interactivo de la fisiología del corazón izquierdo y de la circulación arterial para el uso de estudiantes y otros interesados en la fisiología cardiovascular. El modelo simula las siguientes variables y parámetros:
-
Variaciones del volumen de la aurícula izquierda (AI) y del ventrículo izquierdo (VI).
-
Variaciones de la presión en la AI, el VI y la aorta (Ao).
-
El flujo a través de la válvula mitral (VM) y de la válvula aórtica (VAo)
-
Simular el “efecto Windkessel” en la Ao [6].
Con el modelo se simulan los eventos más importantes del ciclo cardíaco (Figura 1). Los conceptos principales acerca de la anatomía y fisiología cardiocirculatoria normal y patológica pueden ser revisados en Liotta y del Río [15], del Río et al. [16] y del Río [17].
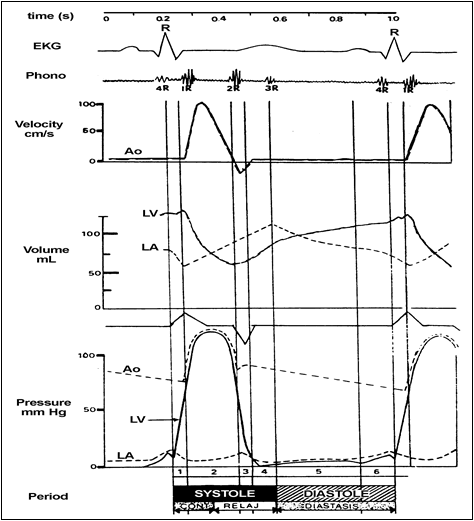
Figura 1. Ciclo cardíaco humano. Relaciones entre sístole y diástole con ECG, fonocardiograma, velocidad de flujo aórtico, cambios volumétricos en aurícula y ventrículo izquierdo, el primer desvío (dP/dt) de la presión del ventrículo izquierdo, y finalmente curvas de presión de aurícula izquierda (LA), ventrículo izquierdo (LV) y aorta (Ao) [14].
2. Diseño y Desarrollo
El entorno de modelización Extend (Imagine That, Inc. San José, CA, USA.) provee una estructura integrada para la construcción de modelos de simulación y el desarrollo de nuevas herramientas de simulación [18], [19]. Este entorno soporta modeladores de simulación en una amplia gama de niveles. Los usuarios pueden utilizar los componentes preconstruidos para rápidamente construir y analizar sistemas sin necesidad de programación.
2.1. Entorno de modelización de Extend
El software Extend permite ejecutar un modelo o construir uno nuevo. Contiene una Biblioteca con varios bloques, los cuales se seleccionan y colocan en la hoja de trabajo. Cada bloque posee conectores de salida que permiten conectarlo al conector de entrada de otro bloque.
Cada bloque describe un cálculo o un paso en un proceso. Los cuadros de diálogo de los bloques son un mecanismo para la entrada de datos del modelo y para reportar los resultados del bloque. La biblioteca representa una agrupación de bloques con características similares como evento discreto, graficación, electrónicas, etc. Los bloques son colocados en la hoja de trabajo del modelo arrastrándolos desde la ventana de la biblioteca hasta la hoja de trabajo. Se establece entonces un flujo entre los bloques. La animación es una potente herramienta de presentación y de depuración que puede incrementar la claridad del modelo. En Extend, los iconos animados movilizándose de bloque en bloque representan la corriente de ítems a través del sistema. Los usuarios pueden elegir entre un número de íconos provistos por Extend o crear sus propios íconos con un paquete de dibujo externo.
2.2. Componentes del modelo corazón izquierdo-circulación arterial
Este modelo simple simula las características generales del corazón izquierdo y de la circulación arterial [14] - [17]. El corazón derecho y la circulación pulmonar no están considerados. Esta construido con 40 bloques organizados en 6 grupos, a saber: (1) aurícula izquierda (AI), (2) ventrículo izquierdo (VI), (3) flujo y volumen del VI, (4) válvula aórtica (VAo), (5) aorta (Ao) y (6) circulación periférica.
Para el desarrollo del modelo se realizaron las siguientes suposiciones:
-
El cambio de la presión del VI (PVI) en el tiempo está solo en función del inotropismo (contractilidad del miocardio ventricular) y del volumen de fin de diástole alcanzada en el ciclo anterior.
-
La presión y el volumen de la aurícula derecha se supone que afecta al VI inmediatamente.
-
En este modelo consideramos una frecuencia cardiaca de 60 lat/min, un ciclo cardíaco con un período de 1.000 ms, y un período sistólico de 333 ms.
2.3. Descripción de los componentes del modelo
Debido a la falta de espacio, no pueden describirse en detalle los seis grupos de bloques. En esta sección solamente se definirá cada grupo y se tabularán las entradas y salidas del grupo (Tabla I). A continuación, y a modo de ejemplo, se desarrolla el Grupo Aorta.
Los seis grupos considerados son:
-
Grupo Aurícula Izquierda (AI): este grupo de bloques simula las variaciones de presión y de volumen de la AI. El flujo entrada al VI (mL/s) contiene los valores de entrada de sangre desde la AI al VI a través de la válvula mitral, según Nolan [20]. El volumen de la AI considera la sangre total que ingresa desde la circulación periférica, de la cual cierta cantidad es removida en cada latido de acuerdo al flujo de entrada al VI. Los valores de estrés de la AI fueron estimados desde del Río y Romero [14] y Schmidt y Thews [21]; para ciertos cálculos, se consideró el espesor de la pared de la aurícula como constante (0,2 cm) durante el ciclo cardíaco.
-
Grupo Presión del Ventrículo Izquierdo (VI): grupo de bloques que simula variaciones de presión del VI a lo largo del ciclo cardíaco. El espesor de la pared (cm) y el radio (cm) del VI fueron estimados desde del Río y Romero [14] y Schmidt y Thews [21].
-
Grupo Flujo y Volumen del Ventrículo Izquierdo: este grupo de bloques simula las variaciones de volumen y de flujo del VI. El volumen de la AI que ingresa al VI proviene del Grupo AI. El porcentaje de eyección desde el VI hacia la aorta a través de la válvula aórtica se calculó desde del Río y Romero [14].
-
Grupo de la Válvula Aórtica (VAo): este grupo de bloques simula la acción de apertura-cierre de la VAo a lo largo del ciclo cardíaco.
-
Grupo Aorta (Ao): este grupo de bloques simula la presión y el flujo a través de la Ao. Además, simula el efecto Windkessel. Luego, se explica con detalle cómo se obtienen los parámetros prefijados del flujo (mL/s), del volumen (mL) y de la presión (mmHg) en la Ao.
-
Grupo Circulación Periférica: este grupo de bloques simula la circulación periférica.
Ciertos parámetros internos de diversos grupos de bloques pueden ser cambiados para simular diferentes condiciones patológicas o para determinar la influencia del parámetro en la producción del modelo, y por lo tanto en la fisiología de la circulación. Estas variables aparecen en negrita en las columnas "parámetros internos" de la Tabla I.
Tabla I. Entradas y salidas de los distintos grupos de bloques que simulan los distintos componentes de la porción del sistema cardiocirculatorio considerado. En negrita aparecen los distintos "parámetros internos" que pueden ser cambiados para simular diferentes condiciones.

El Grupo Aorta (Figura 2) combina relaciones hemodinámicas tales como presión con distensibilidad (compliance) y volumen, y flujo con resistencia y presión. Todos estos parámetros ayudan a determinar la fisiología de la aorta.
Figura 2. Grupo de bloques que simula el comportamiento de la aorta (Ao) durante el ciclo cardíaco.
El modelo conceptual considerado para la aorta pulsátil es el siguiente: el corazón bombea (con cierta presión, PVI) una cantidad de sangre a la aorta con cada latido (QAo). El flujo QAo causa variaciones de presión. La aorta es predominantemente elástica. Esta cantidad de sangre en relación a la variación de la presión, en donde juega un rol importante la elasticidad de la aorta, es la distensibilidad (CAo). Se consideró CAo como parámetro del modelo y a QAo como una variable de estado.
El flujo de sangre a través de un vaso sanguíneo es determinado por dos factores (Ley de Ohm): 1) la DP entre los dos extremos del vaso, llamado “gradiente de presión”, la cual es la fuerza que empuja la sangre a través del vaso, y 2) el impedimento al flujo sanguíneo a través del vaso, llamado resistencia periférica (Rp).
Por otro lado, hay una conexión entre los cambios de presión en la Ao (PAo) y la CAo. Además, hay una conexión entre la PAo, la cantidad de sangre que fluye a través de la aorta (QAo) y la resistencia ofrecida por el cuerpo (Rp):
con PVI < PAo => QAo = 0.
El Bloque 12 de la Figura 2 calcula QAo, donde 1/RAo (Bloque 108) puede variar entre 1 y 80 mL/mmHg.s (0 a 0,0125 mmHg.s/mL). El Bloque 71 decide si hay QAo, según el grupo VAo. De lo contrario, QAo tiene un valor constante durante la diástole (parámetro del modelo). El Bloque 20 realiza la diferencia entre el flujo aórtico (QAo) y el flujo periférico (Qp). El Bloque 19 integra el QAo remanente, y da el volumen (variable de estado) dentro de la aorta:
De C= ΔV/ΔP, y considerando un valor normal de distensibilidad entre 0,70 a 0,80 mL/mmHg, se obtiene la P
3. Experimentación
Los modelos computacionales del SCC captan el interés de muchos investigadores y docentes por las posibilidades que ofrecen [22], [23], ya que representan poderosas herramientas en la enseñanza y la investigación. El modelaje del corazón izquierdo y la circulación arterial que hemos desarrollado es muy útil para el estudio de su funcionamiento normal como el de sus anormalidades.
A continuación, todos los resultados mostrados en las figuras son producto de la simulación, considerando los siguientes valores [14] - [17]: Rp = 1,2 mmHg.s/mL; RAo = 0,03 mmHg.s/mL; CAo = 0,8 mL/mmHg; ciclo cardiaco= 60 min-1.
3.1. Fisiología del Ventrículo Izquierdo
En la Figura 3 se puede observar uno de los tantos gráficos que se pueden obtener desde la simulación. En este caso, la relación entre la presión y el volumen del VI, la presión de la AI y el flujo por la VM, durante tres ciclos cardíacos normales.
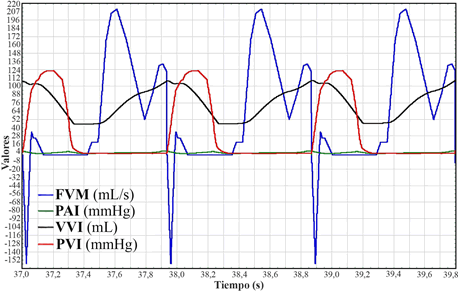
Figura 3. Tres ciclos cardíacos simulados con función normal de ventrículo izquierdo (VI). En azul, flujo en la válvula mitral (FVM, mL/s); en verde, presión de aurícula izquierda (PAI, mmHg); en negro, volumen del VI (VVI, mL), y en rojo, presión del VI (PVI, mmHg).
3.2. Fisiología de la Aorta
En la Figura 4 se pueden observar los cambios de presión del VI y de la AI, junto con el flujo por la VAo y la presión Ao durante tres ciclos cardíacos normales. Se puede observar el “efecto Windkessel” en la variación de la presión aórtica en el tiempo.
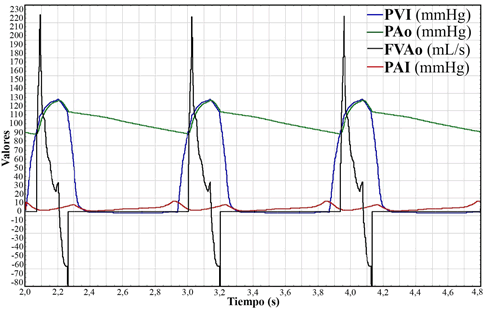
Figura 4. Tres ciclos cardíacos simulados del SCC. En azul, presión del VI (PVI, mmHg); en verde, presión aórtica (PAo, mmHg); en negro, flujo en la válvula aórtica (FVAo, mL/s), y en rojo, la presión de AI (PAI, mmHg).
En los ejemplos mostrados, se comprueba que las simulaciones del SCC pueden mejorar la enseñanza de la fisiología subyacente al proporcionar a los estudiantes (y a los investigadores) la posibilidad de: a) manipular los parámetros del sistema y así descubrir y describir las relaciones funcionales entre los distintos componentes fisiológicos, y b) combinar gráficamente distintas salidas de la simulación para entender relaciones entre presiones, volúmenes, flujos, etc. de los distintos componentes del modelo.
3.3. Condiciones Patológicas
Se han realizado diversas simulaciones considerando distintas situaciones patológicas. Por ejemplo, considerando el estrés parietal del VI un 75% del valor normal (Figura 5), en donde se simula la disminución de la presión del VI y en la aorta bajo esta nueva condición.
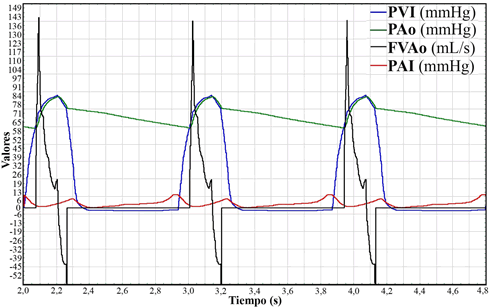
Figura 5. Tres ciclos cardíacos simulados de una condición patológica del SCC. En azul, presión del VI (PVI, mmHg); en verde, presión aórtica (PAo, mmHg); en negro, flujo en la válvula aórtica (FVAo, mL/s), y en rojo, la presión de AI (PAI, mmHg). El estrés parietal del VI fue ajustado al 75 % del valor normal (insuficiencia cardíaca).
De esta forma, se pueden representar y estudiar diferentes patologías cardiovasculares tales como trastornos cardíacos (cambios en la contractilidad ventricular) o arteriales (variaciones en la poscarga), con solo cambiar parámetros del modelo. Por ejemplo, pueden cambiar valores que provoque en el modelo la representación de un aumento de poscarga (observado en la Hipertensión) o como en la Figura 5, comprobar que ocurre cuando el corazón izquierdo pierde capacidad mecánica de bombeo, como en la Insuficiencia Cardíaca, con una caída en la capacidad de generación de presiones en el VI y en la Ao.
4. Discusión
El entendimiento de la función cardiovascular depende del análisis de una variedad de conceptos matemáticos subyacentes. El principal aporte de los modelos es que ayudan a comprender los conceptos matemáticos y de cómo el SCC está organizado y funciona. La modelización permite diseñar y operar sistemas complejos, aunque cada modelo mostrará una limitación acerca del sistema o parte del sistema que quiere simular. El advenimiento de las computadoras y su vertiginoso progreso ha impulsado el desarrollo de modelos matemáticos y de la simulación computacional, logrando excelentes resultados, y además, obtener resultados abreviados en el tiempo. Por esto, el campo del modelaje y la simulación es actualmente una parte inseparable y por demás importante de las Ciencias Biomédicas.
Al momento de hoy, una gran variedad de modelos han sido desarrollados en relación al estudio del SCC: su morfología y fisiología [6] - [9] [13], [23], sus alteraciones y fisiopatología [7], [24], y de los dispositivos de implante (válvulas artificiales, asistencia cardiocirculatoria mecánica, etc.) [7], [25] - [27]. Puede comprobarse el desarrollo y perfeccionamiento de muy buenos modelos, pero que pueden ser utilizados bajo muy pocas situaciones. En otros casos, los modelos son muy complejos para ser de uso corriente, mientras otros son muy simples, pero aún resultan muy útiles.
El usuario debe tener siempre presente que el modelo físico o matemático, a pesar de ser válido, no es exactamente igual al sistema real y no puede suplantarlo. El desarrollo de modelos matemáticos y simulaciones realistas del SCC aún son muy difíciles de obtener, debido a las fuertes interacciones no-lineales entre los diferentes componentes del sistema y a la complejidad geométrica de la morfología cardiovascular.
Para aprender acerca del comportamiento cardiovascular, por medio de simulaciones, se debe utilizar un modelo “fácil de usar” que ayude a entender cómo trabajan los parámetros y las variables cardiocirculatorias.
Mientras hay modelos que se basan en representaciones de los componentes y funcionamiento del SCC a través de circuitos eléctricos (por ej., [28] - [30]) y otros basados en formulaciones matemáticas (por ej., [24], [31]), el modelo que presentamos en este trabajo es muy intuitivo en su comprensión y uso y, por su disposición gráfica, facilita la aprehensión de los procesos que operan en el sistema en simulación. En los modelos que utilizan equivalentes eléctricos o representados por modelos matemáticos es necesario que el usuario tenga conocimientos, incluso avanzados, de electricidad o de cálculo matemático para comprender y poder simular, en este caso, al SCC. El ambiente Extend permite que el usuario pueda cambiar la configuración del modelo o los valores de los parámetros que caracterizan al mismo e ir probando las relaciones que se establecen entre entradas y salidas y, así, poner a prueba distintas hipótesis de trabajo.
En este sentido, se diseñó un modelo para simular el comportamiento aproximado del corazón izquierdo y del sistema arterial. Este modelo cubre los aspectos más importantes de su fisiología y fisiopatología. La regulación nerviosa –simpática y parasimpática– y la humoral están ausentes, por ahora, en este modelo. La falta de inervación nerviosa es compensada por un marcapasos trabajando a una frecuencia fija, aunque se puede variar la resistencia periférica (Rp).
El modelo desarrollado está basado en las relaciones entre parámetros fisiológicos cardiocirculatorios, los cuales surgen desde la literatura [14] - [17], [20] y los principios físicos subyacentes. Como un modelo es también un vehículo importante para explicar predicciones, es importante que el modelo este organizado del tal forma que las relaciones sean lo más intuitivas posibles.
A continuación, se enumera una visión cualitativa del modelo dinámico desarrollado:
1. El modelo incluye sólo el lado izquierdo del corazón y la circulación arterial.
2. El modelo funciona en tiempo real.
3. Para el cálculo, los volúmenes están en mL, los flujos en mL/s y las presiones en mmHg, para una mayor consistencia con los datos clínicos.
4. La presión de la AI está en función del radio auricular.
5. La salida del VI es una función del llenado ventricular. Depende del flujo de la AI a través de la VM.
6. La presión sanguínea es el producto de la resistencia vascular sistémica (RVS) y de la eyección cardíaca (gasto cardíaco).
7. La estimulación simpática, así como el ejercicio y algunas terapias pueden naturalmente modificar RVS. En este modelo el usuario puede modificar la Rp.
8. Se asumió que la PVI depende del inotropismo, y la forma de la curva de PVI se calculó desde la relación entre el estrés parietal, el radio y el espesor del VI (Ley de Laplace).
9. La eyección del VI está en función de la fuerza de contracción del corazón izquierdo.
El modelo simplificado funciona como sigue:
-
En la sístole temprana, la sangre fluye desde el VI hacia la Ao cuando PVI > PAo. La eyección ventricular es compartida entre QAo y Qp, proporcionalmente dependiendo de: a) Qp através de la resistencia periférica (Rp) y b) la distensibilidad aórtica (CAo). La sangre, de densidad ρ, gana impulso, el cual es transmitido a las paredes de la aorta aumentandoPAo. La presión de salida desde el VI se reduce por la eyección ventricular fluyendo a través de la resistencia de la válvula aórtica (VAo).
-
Cuando la PVI comienza a descender luego del pico sistólico, el impulso de la sangre continúa generando presión en la aorta. La presión resultante enlentece la sangre, reduciendo y luego revirtiendo el QAo, y eventualmente, la eyección ventricular. El reflujo inicial menos la salida ventricular hace que la VAo se cierre. La elasticidad de las paredes aórticas genera la onda dicrótica. A partir de este punto, el único flujo es hacia el árbol arterial y es generado por las paredes aórticas (efecto Windkessel). Luego, la PAo se reduce en consecuencia hasta el próximo pulso sistólico.
-
Dentro del corazón, al final de la sístole, la PVI se reduce por debajo de la presión de llenado auricular (PLLA). En este punto, la VM se abre y la sangre fluye dentro del VI, aumentando su volumen hacia un valor teórico dependiente de la PLLA. En teoría, dicha presión de llenado debería producirse por la AI, pero la circulación pulmonar no ha sido incorporada al modelo todavía (la PLLA deriva desde datos de entrada).
El modelo es adecuado para el estudio del ciclo cardíaco básico que cubre los cambios de presión y de volumen ventricular, las relaciones temporales y el mecanismo valvular. Las simulaciones también permiten predecir y examinar efectos primarios tales como el Mecanismo de Frank-Starling o el efecto Windkessel a la presión arterial.
El Mecanismo de Frank-Starling –descrito como "a mayor volumen diastólico del corazón (...) mayor es la fuerza (energía) de su contracción" [32] establece que el corazón posee una capacidad intrínseca de adaptarse a volúmenes crecientes de flujo sanguíneo, es decir, cuanto mayor se llena de sangre un ventrículo durante la diástole (precarga o estrés parietal de fin de diástole), mayor será el volumen de sangre expulsado durante la sístole. Esto significa que la fuerza de contracción aumentara a medida que el corazón se llena con mayor volumen de sangre y ello es consecuencia directa del efecto que tiene el incremento de carga sobre la fibra muscular, aumentando así la fuerza contráctil [33]. A pesar que nuestro modelo considera solamente las cámaras izquierdas del corazón y está conectado a una fuente de sangre virtual ilimitada, proporcionando una presión constante de la carga, el Grupo Presión del VI cuenta con un bloque que representa un factor que multiplica el estrés de la pared del VI y simula, por ejemplo, el decremento del estrés parietal durante la fisiopatología de la Insuficiencia Cardíaca.
Por otro lado, el sistema arterial puede definirse como una red compleja de tubos elásticos ramificados que, tras recibir la sangre procedente de las contracciones rítmicas del corazón consigue, mediante un efecto de amortiguado (efecto Windkessel), obtener un flujo continuo en arteriolas y capilares [34]. Esto es así, y se comprueba durante la simulación, porque el flujo que sale del VI en cada ciclo cardíaco es de tipo “todo o nada”, es decir, alcanza un máximo durante la sístole y cae a cero durante la diástole, aunque su valor medio puede considerarse en ~96 mL/s. En la aorta este flujo todo o nada se transforma en pulsátil. Aumenta tras la apertura de la VAo para alcanzar un máximo después del primer tercio del período de eyección, cayendo progresivamente durante el resto de dicho período. Cuando cesa la sístole y antes de cerrarse la VAo, la retracción elástica de la aorta genera un flujo retrógrado con un valor negativo (Figura 4). Así, este efecto trata de incorporar el efecto de la deformabilidad de las arterias en el modelado del flujo sanguíneo. Tiene en cuenta la distensibilidad (C) arterial aumentando en diámetro durante la sístole como consecuencia de la mayor presión arterial, y reduciéndose, por el contrario, durante la diástole, haciendo el papel de reservorio y bomba adicional al del corazón. La distensibilidad de una arteria es el aumento de volumen por unidad de aumento de presión en su interior (C= dV/dP). El modelo Windkessel de dos compartimientos describe lo que sucede durante la diástole, pues cerrada la VAo, la retracción elástica sigue durante la fase diastólica ventricular hasta alcanzar su posición elástica original, generándose un flujo de salida, que empuja el resto del volumen de sangre almacenado en la distensión hacia adelante. Otto Frank, un importante fisiólogo alemán de finales del s. XIX, desarrolló el concepto y había proporcionado un fundamento matemático [35]. El modelo de Frank, como el utilizado en nuestro modelo, a veces se denomina Windkessel de dos elementos (resistencia periférica-capacitancia arterial) para distinguirla de los más recientes y elaborados modelos Windkessel (por ej., tres o cuatro-elementos Windkessels) [6], que en los modelos eléctricos o matemáticos aportan una mayor exactitud en las simualciones [36]. Consideramos que nuestro modelo simula con bastante fidelidad el efecto Windkessel, concepto clave en fisiología cardiocirculatoria [33], [34].
Los resultados obtenidos a partir de los modelos pueden dar una aproximación del fenómeno real. En todos los casos, y esto es muy importante, la simulación debe ser validada. La validación de un modelo es parte importante del proceso de modelización. Entonces, antes de utilizar el modelo, se debe probar su eficacia de funcionamiento y conocer los límites impuestos por su propio diseño y construcción. La contrastación entre el funcionamiento del modelo y el sistema real que se quiere representar, va estableciendo los límites de reproducibilidad y de exactitud con la cual se está trabajando. Así, cuando el objetivo del proceso de modelización es la predicción de respuestas, la validación de un modelo es un componente básico del procedimiento. En cambio, cuando los objetivos se orientan hacia la enseñanza, la validación no es imprescindible y las contrastaciones sólo intentan mostrar las similitudes con la realidad. En próximos pasos, nuestro modelo del corazón izquierdo y circulación arterial será puesto a prueba al realizar la validación del mismo con la realización de contrastaciones con resultados experimentales conocidos y ya publicados en revistas de la disciplina.
Conclusiones
El entendimiento de la función cardiovascular depende de mediciones basadas en una variedad de conceptos matemáticos subyacentes. La finalidad de este modelo es ayudar a los usuarios en general, y a estudiantes en particular, a comprender los conceptos matemáticos elementales y los términos importantes, que definen el comportamiento del SCC. El propósito de esta simulación interactiva es enseñar a sus usuarios acerca de las complejas interacciones en dicho sistema orgánico.
A diferencia de los modelos matemáticos, la realización de modelos computacionales, como in vitro en laboratorio, permite acceder a procesos en tiempo real para sistemas complejos, con muchos parámetros y variables, y analizar variaciones de las condiciones iniciales, procesos, incluir alteraciones fisiopatológicas, etc. De tal forma, el desarrollo de modelos en docencia e investigación permite acortar los ciclos de comprensión y entendimiento de procesos, ajustar y perfeccionar los diseños, reducir costos, análisis de características de los materiales de construcción, y refuerza el conocimiento.
Para nuestro modelo de simulación los próximos pasos serán: a) incorporar los grupos de bloques correspondientes al corazón derecho y a la circulación pulmonar; b) incluir algunos controles de la función cardiovascular desde el sistema nervioso autónomo y catecolaminas circulantes, y c) realizar las validaciones correspondientes. Quedará así, el camino abierto para realizar la contrastación contra variables fisiológicas reales, e ir ajustando sus componentes para ir evaluando la exactitud del modelo.
A partir de los resultados mostrados sobre el funcionamiento de nuestro modelo dinámico, consideramos que es una herramienta educativa sólida e integral para la enseñanza de la mecánica cardíaca y la hemodinámica circulatoria arterial [37]. El funcionamiento de la simulación es simple, requiere muy poco mantenimiento y es fácil de usar, sin conocimientos informáticos profundos por parte de los estudiantes y otros interesados en utilizar este modelo.
Agradecimientos
El autor COC agradece a la Ing. Perrine Debaene por su desinteresada colaboración y al Dr. Klaus Affeld por su invitación al Laboratorio de Biofluidos (Charité Facultad de Medicina, Universidad Humboldt, Berlín, Alemania).
Parte de los resultados de este trabajo se presentaron en: Cervino, C.N. y C.O. Cervino. 2009. Desarrollo de un Modelo Computacional del Corazón Izquierdo para Aplicaciones en Docencia. XVII Congreso Argentino de Bioingeniería y VI Jornadas de Ingeniería Clínica, organizado por la Sociedad Argentina de Bioingeniería y El Polo Tecnológico de Rosario. 14 a 16 de Octubre de 2009. Rosario, Argentina, y en: Cervino, C.N. y C.O. Cervino. 2016. Simulación del Corazón Izquierdo para Aplicaciones en Docencia e Investigación. XI Congreso de Tecnología en Educación y Educación en Tecnología TE&ET 2016, organizado por Red UNCI y Facultad de Informática, Cs. de la Comunicación y Técnicas Especiales (Univ. de Morón). 9 y 10 de Junio de 2016. Morón, Argentina.
[1] K. Sagawa, “The use of control theory and systems analysis in cardiovascular dynamics,” in Cardiovascular fluid dynamics, vol. 1, London: Academic Press, 1972, pp. 115-171.
[2] K. Perktold, M. Resch and H. Florian, “Pulsatile non-Newtonian flow characteristics in a three-dimensional human carotid bifurcation model,” ASME J. Biomech. Eng., vol. 113, pp. 463-475, 1991.
[3] C. Taylor, T. Hughes and C. Zarins, “Computational investigations in vascular disease”, Comput. Phys., vol. 10, pp. 224-232, 1996.
[4] A. Quarteroni, M. Tuveri and A. Veneziani, “Computational vascular fluid dynamics: Problems, models and methods”, Comput. Visualisation Sci., vol. 2, pp. 163-197, 2000.
[5] R. A. Wildhaber, F. Verrey and R. H. Wenger, “A graphical simulation software for instruction in cardiovascular mechanics physiology”, BioMedical Engineering OnLine, 10 : 8, 2011, https://doi.org/10.1186/1475-925X-10-8
[6] C. O. Cervino, “Modelos y Simulaciones del Sistema Cardiocirculatorio,” en Función Cardiopulmonar y sus Aspectos Clínicos y Terapéuticos. Valoración de los antiguos y nuevos paradigmas, M. del Río, Ed. Buenos Aires: Ed. Inter-Médica, 2009, pp. 27-33.
[7] C. O. Cervino, “Left Ventricular Assist Device (LVAD),” Biofluidmechanics Laboratory, Humboldt University Berlin, Berlin, Germany. Final Rep. Deutscher Akademischer Austauschdienst (DAAD), Jul. 2002.
[8] T. G. Coleman, “Mathematical analysis of cardiovascular function”, IEEE Trans Biomed Eng., vol. 32(4), pp. 289-294, 1985.
[9] V. K. Sud, R. S. Srinivasan, J. B. Charles and M. W. Bungo, “Mathematical modelling of the human cardiovascular system in the presence of stenosis”, Phys Med Biol., vol. 38(3), pp. 369-378, 1993.
[10] D. Jaron, T. W. Moore and J. Bai, “Cardiovascular responses to acceleration stress: A computer simulation”, Proc of IEEE, vol. 6, pp. 700-707, 1988.
[11] M. Ursino, “Computer analysis of the main parameters extrapolated from the human intracranial basal artery blood flow”, Comp and Biom Res., vol.23, pp. 542-559, 1990.
[12] J. Bustamante y J. Valbuan, “Biomecánica cardiocirculatoria: análisis y modelado cardiovascular”, Rev. Col. Cardiol., vol. 10, pp. 229-239, 2003.
[13] T. Kulhánek, M. Tribula, J. Kofránek and M. Mateják, “Simple models of the cardiovascular system for educational and research purposes”, MEFANET Journal, vol. 2(2), pp. 56-63, 2014.
[14] M. del Río y J. Romero, Función cardiovascular. Conceptos de fisiología y fisiopatología. Aplicaciones clínicas y terapéuticas, Buenos Aires: Propulsora Literaria, 1992.
[15] D. Liotta y M. del Río, Eds., Anatomía, Fisiología y Fisiopatología de la Práctica Médica (volumen I: Sistema Cardiovascular, 1ra Parte), Morón: Editorial de la Universidad de Morón, 1999.
[16] M. del Río, D. S. Liotta and C. O. Cervino, “Physiology and Pathophysiology aspects in cardiovascular system,” in A Practical Textbook of Congenital and Acquired Diseases of the Aorta, D. S. Liotta, M. del Río, D. Cooley, C. Cabrol, Eds. Morón: Editorial de la Universidad de Morón, 2003, pp. 50-62.
[17] M. del Río, Ed., Función Cardiopulmonar y sus Aspectos Clínicos y Terapéuticos. Valoración de los antiguos y nuevos paradigmas, Buenos Aires: Ed. Inter-Médica, 2009.
[18] Extend: simulation software for the next millennium (Extend User´s Manual, version 4), Imagine That Inc., San Jose, CA, 1997.
[19] D. Krahl, “Modeling with Extend,” in WSC '01 Proceedings of the 33nd conference on Winter simulation, Arlington, VA, 2001, pp. 217-225.
[20] S. Nolan, “The normal mitral valve: patterns of instantaneous mitral valve flow and the atrial contribution to ventricular filling,” in The mitral valve: a pluridisciplinary approach, Massachusetts: Publishing Sciences Group, Inc., 1976, pp. 137-143.
[21] R. Schmidt. and G. Thews. Physiologie des Menschen (27 Auflage), Berlin: Springer-Verlag, 1997.
[22] A. Brunberg, S. Heinke, J. Spillner, R. Autschbach, D. Abel and S. Leonhardt, “Modeling and simulation of the cardiovascular system: a review of applications, methods, and potentials”, Biomed Tech (Berl), vol. 54, pp. 233–244, 2009.
[23] T. Heldt, R. Mukkamala, G. B. Moody and R. G. Mark, “CVSim: An Open-Source Cardiovascular Simulator for Teaching and Research”, Open Pacing Electrophysiol Ther J. vol. 3, pp. 45–54, 2010.
[24] S. Zenker, J. Rubin and G. Clermont, “From inverse problems in mathematical physiology to quantitative differential diagnoses”, PLoS Comput Biol, vol. 3(11), pp. e204, 2007, doi:10.1371/journal.pcbi.0030204
[25] D. Morley, K. Litwak, P. Ferber, P. Spence, R. Dowling, B. Meyns, B. Griffith and D. Burkhoff, “Hemodynamic effects of partial ventricular support in chronic heart failure: Results of simulation validated with in vivo data”, J Thorac Cardiovasc Surg, vol. 133, pp. 21-28, 2007, doi: 10.1016/j.jtcvs.2006.07.037
[26] J. R. Gohean, M. J. George, T. D. Pate, M. Kurusz, R. G. Longoria and R. W. Smalling, “Verification of a computational cardiovascular system model comparing the hemodynamics of a continuous flow to a synchronous valveless pulsatile flow left ventricular assist device”, ASAIO J, vol. 59(2), pp. 107–116, 2013, doi:10.1097/MAT.0b013e31827db6d4
[27] J. R. Gohean, M. J. George, K-W Chang, E. R. Larson, T. D. Pate, M. Kurusz, R. G. Longoria and R. W. Smalling, “Preservation of native aortic valve flow and full hemodynamic support with the Torvad™ using a computational model of the cardiovascular system”, ASAIO J., vol. 61(3), pp. 259–265, 2015, doi:10.1097/MAT.0000000000000190
[28] K. Hassania, M. Navidbakhshb and M. Rostami, “Simulation of the cardiovascular system using equivalent Electronic system”, Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub., vol. 150(1), pp. 105–112, 2006.
[29] M Mirzaee, O Ghasemalizadeh and B Firoozabadi, “Modeling vessels in human cardiovascular system and calculating pressure wastes using lumped method, The Internet Journal of Bioengineering, vol. 3(2), pp. 1-11, 2008.
[30] I. Kokalari, T. Karaja and M. Guerrisi, “Review on lumped parameter method for modeling the blood flow in systemic arteries”, J. Biomedical Science and Engineering, vol. 6, pp. 92-99, 2013, JBiSE http://dx.doi.org/10.4236/jbise.2013.61012
[31] P. Reymond, F. Merenda, F. Perren, D. Rufenacht, and N. Stergiopulos, “Validation of a one-dimensional model of the systemic arterial tree”, Am J Physiol Heart Circ Physiol, vol.297, pp. H208–H222, 2009; doi:10.1152/ajpheart.00037.2009
[32] H. E. Cingolani, “Mecánica cardíaca. Fenómenos sistólicos y diastólicos,” en Fisiología Humana de Houssay, H. E. Cingolani y A. B. Houssay, Eds. Buenos Aires: Editorial El Ateneo, 2000, pp. 293-330.
[33] A. C. Guyton y J. E. Hall, Tratado de Fisiología Médica (11º edición), Madrid: Interamericana-McGraw-Hill, 2006.
[34] B. Koeppen and B. Stanton. Berny y Levy. Fisiología (6ta edición). Madrid: Elsevier España SA, 2009.
[35] O. Frank, “La forma básica del pulso arterial. Primer tratado: análisis matemático. 1899”, J. Molec. Cellular Cardiology, vol. 22(3), pp. 255–277, 1990, doi: 10.1016/0022-2828 (90) 91460-O.
[36] N. Westerhof, J. W. Lankhaar and B.E. Westerhof, “The arterial Windkessel”, Med Biol Eng Comput., vol. 47, pp. 131-141, 2009, doi: 10.1007/s11517-008-0359-2.
[37] N. S. Peterson and K B. Campbell, “Simulated laboratory for teaching cardiac mechanics”, Physiologist, vol. 27, pp. 165-169, 1984.
Información de contacto de los autores:
C. Nahuel Cervino
Instituto de Fisiología y Neurociencias (IFiNe-SeCyT)
Universidad de Morón
Machado 914, 5º piso, (1708) Morón
Provincia de Buenos Aires, Argentina
nahuel_cervino@yahoo.com.ar
Claudio O. Cervino
Instituto de Fisiología y Neurociencias (IFiNe-SeCyT)
Universidad de Morón
Machado 914, 5º piso, (1708) Morón
Provincia de Buenos Aires, Argentina
ccervino@unimoron.edu.ar
C. Nahuel Cervino
Médico cardiólogo Hospital D. F. Santojanni, Ciudad Autónoma de Buenos Aires, Argentina. Stagiaire en Cardiología, Hôpital Eurepeen Georges Pompidou, Paris, France. Miembro de la Sociedad Argentina de Cardiología.
Claudio O. Cervino
Dr. en Ciencias Biológicas (UBA). Fisiólogo. Director del Instituto de Fisiología y Neurociencias (IFiNe-SeCyT). Profesor de Fisiología e Investigador Universidad de Morón, Buenos Aires, Argentina.