Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.66 n.2 Buenos Aires mar./abr. 2006
Respuesta a la hipoxia. Un mecanismo sistémico basado en el control de la expresión génica
Carlos Caramelo, Juan J. Peña Deudero, Ángeles Castilla, Soledad Justo, Alain J. De Solís, Fernando Neria, Silvia Peñate, Francisco R. González-Pacheco
Laboratorio de Nefrología e Hipertensión, Instituto de Investigaciones Médicas, Fundación Jiménez Díaz, Universidad Autónoma de Madrid
Dirección postal: Dr. Francisco Román González-Pacheco, Laboratorio de Nefrología-Hipertensión, Instituto de Investigaciones Médicas, Fundación Jiménez Díaz, Universidad Autónoma de Madrid, Av. Reyes Católicos 2, 28040, Madrid. España. Fax: +34 91 549 80 75. E-mail: froman@fjd.es
Resumen
La respuesta hipóxica, sobre la que se dispone de nuevos datos críticamente importantes, puede esquematizarse en tres sistemas, vg. de detección o sensor de oxígeno, de regulación, que controla la expresión génica y efector. El elemento principal de organización del sistema regulador es un factor de transcripción específico, el factor inducible por hipoxia 1 (HIF-1). En presencia de oxígeno, la subunidad a del HIF-1 (HIF-1a) se modifica por las hidroxilasas, que constituyen el punto central del mecanismo sensor, induciendo su catabolismo por el proteosoma. Por el contrario, en hipoxia, o en presencia de algunos factores de crecimiento que incrementan su síntesis, el HIF-1a se transloca al núcleo, donde, unido al HIF-1b, actúa como factor transcripcional de genes con elementos de respuesta hipóxica (HRE) en su promotor. Estos regulan la síntesis de una amplia serie de proteínas, que abarcan desde enzimas respiratorias y transportadores hasta hormonas involucradas en la regulación a escala del organismo de la circulación y la eritropoyesis. El papel del HIF-1 no se restringe a la mera inducción de una respuesta adaptativa a la falta de oxígeno, sino que participa significativamente en los mecanismos de reparación celular. Una simple lista de algunas alteraciones de importancia fisiopatológica, tanto estimulatorias como inhibitorias, que involucran al sistema de HIF-1, incluiría: enfermedad pulmonar crónica, adaptación al tabaco/humo, anemia/hemorragia, isquemia/reperfusión, crecimiento, vascularización y resistencia celular de los tumores, preeclampsia y crecimiento intrauterino retardado, hiper o hipovascularización retiniana, sobredosis de fármacos, enfermedad inflamatoria intestinal y curación de heridas. Esta sola enumeración ilustra la importancia de este mecanismo.
Palabras clave: hipoxia, HIF-1, sensor de oxígeno, VEGF, eritropoyetina
Abstract
Response to hypoxia. A systemic mechanism based on the control of gene expression. New, critically important data have been recently generated about the response to hypoxia. This response can be schematized in three main systems or functions, ie, detectional or oxygen sensing, regulatory, which controls gene expression and effector. The principal organizer of the regulatory branch is a specific transcription factor, the hypoxia-inducible factor 1 (HIF-1). In the presence of oxygen, the a subunit of HIF-1 (HIF-1a) is modified by hydroxylases, that represent the central point of the oxygen sensing mechanism. This type of hydroxylation induces HIF-1a catabolism by the proteosome. On the contrary, in hypoxia, or in the presence of certain growth factors that increase HIF-1a synthesis, HIF-1a translocates to the nucleus, where it binds HIF-1b, and thence acts on transcription of genes carrying hypoxia responsive elements (HRE) on their promoters. These genes regulate the synthesis of an ample series of proteins, which span from respiratory enzymes and transporters to hormones regulating circulation and erythropoiesis. The role of HIF-1a is not restricted to the mere induction of adaptation to decreased oxygen: instead, it significantly participates in cell repairing mechanisms. A simple list of some of the stimulatory or inhibitory alterations of pathophysiological importance involving the HIF-1 system, would include: chronic lung disease, smoking adaptation, anemia/hemorrhage, ischemia/reperfusion, growth, vascularization and cell resistance of tumors, preeclampsia and intrauterine growth retardation, retinal hyper o hypovascularization, drug intoxications, bowel inflammatory disease and wound repair. This list illustrates by itself the importance of the mechanism herein reviewed.
Key words: hypoxia, HIF-1, oxygen sensor, VEGF, erythropoietin
La fisiopatología es un territorio de límites imprecisos, que tiene como denominador común la adaptación a la enfermedad de mecanismos que, en su origen, se desarrollaron para responder a situaciones de especial exigencia en individuos sanos. Así, entre otras, el organismo enfermo emplea respuestas sistémicas primarias ante la agresión, como las que se desencadenan ante la pérdida de sangre, la infección, los traumatismos, la deshidratación, el ayuno, o la hipoxia, para hacer frente a situaciones patológicas. Estas últimas, especialmente las crónicas, son sustancialmente diferentes de la condición original a la que se aplica el mecanismo de respuesta. Valgan como ejemplos característicos de esta dualidad los siguientes: uno, la estimulación del eje renina-angiotensina-aldosterona incluye aspectos inflamatorios y promotores de la cicatrización vascular, que son útiles en el caso de la herida de un vaso, pero resultan deletéreos en la arteriosclerosis crónica; otro, el remodelado vascular pulmonar inducido por la hipoxia es necesario y favorable en la adaptación fisiológica a la altitud, pero actúa negativamente en un paciente con enfermedad pulmonar crónica. La hipoxia es un prototipo considerablemente bien estudiado y un paradigma de respuestas que involucran al organismo en su conjunto y pueden tener consecuencias diferentes en la salud y en la enfermedad.
Hipoxia: Una pregunta inmediata a realizarse es qué condiciones fisiopatológicas se asocian con hipoxia. Existe hipoxia transitoria durante el ejercicio, en sepsis o en tejidos traumatizados e hipoxia crónica en la altura o en zonas tisulares menos oxigenadas, como por ejemplo la médula renal. Ya en el terreno de la patología, hay hipoxia en la enfermedad pulmonar, la insuficiencia cardíaca, la isquemia tisular, la anemia y en los tejidos tumorales.
La respuesta a la hipoxia puede esquematizarse en tres sistemas: a) de detección o sensor de oxígeno, b) de regulación, mediante el control de la expresión de una amplia serie de genes, y c) efector múltiple, que incluye no sólo expresión de genes, sino múltiples cambios funcionales, que van desde la estimulación de moléculas vasodilatadoras hasta las variaciones en la afinidad de la hemoglobina por el oxígeno. El sistema regulador está modulado directamente por el sensor y el elemento organizador principal es un factor de transcripción específico, el factor inducible por hipoxia 1 (HIF-1). La presente revisión se centra específicamente en este factor.
Respuesta a la hipoxia: La diferencia entre los tejidos y órganos no proviene de su dotación génica, sino de la manifestación particular de los genes en cada tipo celular. En este contexto, los factores de transcripción actúan para orientar y adaptar, o dicho más gráficamente, reclutar la expresión génica hacia patrones determinados de respuesta, como por ejemplo la supervivencia, la migración, la proliferación o el crecimiento.
La respuesta a la hipoxia requiere un alto nivel de coordinación. Su mecanismo incluye un espectro de cambios que van desde variaciones en la expresión enzimática que adaptan la producción de energía frente a una menor disponibilidad de oxígeno, hasta la puesta en marcha de fenómenos de autoeliminación de la célula ante la imposibilidad de sobrevivir en circunstancias adversas extremas. Todos los organismos, desde las bacterias hasta los humanos, poseen mecanismos para el mantenimiento de la homeostasis del oxígeno, que son esenciales para la producción energética y por lo tanto para la supervivencia. En los mamíferos superiores, la respuesta a la hipoxia es compleja, e incluye, entre otras, adaptaciones de la función respiratoria y hemodinámica, del metabolismo intermedio y de la función renal. Estas adaptaciones se manifiestan en cambios hormonales, de mediadores y de actividad enzimática, e implican variaciones en la expresión de una serie de genes entre los que destacaremos el factor de crecimiento del endotelio vascular (VEGF) y la eritropoyetina (EPO).
El incremento en la expresión de VEGF en condiciones de hipoxia ocurre a través de mecanismos moleculares de aumento de transcripción1 y/o estabilización del ARNm2. La regulación transcripcional del VEGF en condiciones de hipoxia está mediada por la unión de HIF-1 a secuencias específicas localizadas en el promotor del VEGF (HIF-1 binding sites – HBSs o hypoxia responsive elements, HREs), constituida por las bases: -RCGTG-3. La regulación de la expresión de EPO es similar a la referida para VEGF en lo que concierne al papel del HIF-1, pero diferente en cuanto a otros elementos co-reguladores con efectos sobre el promotor.
El factor inducible por hipoxia (HIF-1): HIF-1 es un heterodímero compuesto por dos sub-unidades (HIF-1a y HIF-1b) con pesos moleculares aparentes de 120-130 kD y 91-94 kD4, respectivamente. Ambas sub-unidades comparten cierta homología en sus extremos N-terminales, conteniendo un dominio bHLH (basic helix-loop-helix) y un dominio PAS (Per-Arnt-Sim), que están involucrados en la dimerización y en la unión al ADN5. El extremo COOH-terminal de la sub-unidad a contiene dos dominios de transactivacion (TADs) y un dominio de degradación dependiente de oxígeno (ODD), siendo éstos los responsables de las funciones transactivadora y reguladora de este factor en diferentes condiciones de disponibilidad de oxígeno6. HIF-1b es idéntico al ARNT–translocador nuclear del receptor Ah (aril hydrocarbon)–. Esta proteína dimeriza con receptores Ah activados cuyos ligandos constituyen diferentes contaminantes ambientales, como aminas heterocíclicas, hidrocarburos aromáticos y compuestos aromáticos (dioxinas, dibenzofuranos y bifenilos)7. La identificación de ARNT como sub-unidad de HIF-1 demostró por vez primera que ARNT (HIF-1b) constituye una sub-unidad común de varios heterodímeros que contienen dominios bHLH. La translocación al núcleo de HIF-1a y heterodimerización con HIF-1b son necesarias para la unión de HIF-1 a los HBSs y su consiguiente transactivación.
El descubrimiento de HIF-1 como factor regulador de la homeostasis del O2 surgió como consecuencia del estudio de los mecanismos moleculares que modulaban la transcripción de la EPO en respuesta a la hipoxia3. La caracterización de los niveles de expresión de HIF-1a y HIF-1b, se evaluó inicialmente en células Hep3B y HeLa bajo diferentes condiciones de disponibilidad de O2 –hipoxia, normoxia y re-oxigenación–8. De manera general el ARNm de ambas sub-unidades se expresaba constitutivamente bajo cualquier condición. Sin embargo, la proteína de HIF-1a sólo era detectable en hipoxia.
En presencia de oxígeno, HIF-1a sufre modificaciones post-traduccionales por parte de hidroxilasas (PHD1-3, FIH-1), las cuales hidroxilan residuos de Pro402/564 y de Asn803 que se localizan en los dominios ODD y TADs, respectivamente9, 10. Estas modificaciones permiten la unión de la proteína VHL (von Hippel Lindau) a los sitios hidroxilados de HIF-1a formando parte del complejo E3 ubiquitin-ligasa, provocando asi su ubiquitinación y degradación11. La hidroxilación del residuo Asn803 se ha descrito recientemente y constituye un impedimento estérico en la unión del co-activador CBP/p300 a HIF-1a, necesario para la transactivación de HIF-110. En ausencia de oxígeno, HIF-1a es fosforilado y translocado al núcleo, donde dimeriza con HIF-1b y se acopla a su co-activador CBP/p300, permitiendo la transactivación e inducción de genes (Fig. 1). Es importante también, aunque está menos caracterizada, la unión de HIF-1 a proteínas de estrés (HSPs)12. Esta unión protege a HIF-1 de la degradación. En este sentido, el efecto pro-degradativo de HIF-1 de agentes del tipo de las ansamicinas, bloqueantes de HSP90, abre una posibilidad de interés en el campo terapéutico de la antiangiogénesis13.

Fig. 1.- Ciclo de activación-degradación de HIF-1α. A la izquierda se muestra el funcionamiento en hipoxia y a la derecha en normoxia. Abreviaturas: Asn, asparagina; CBP/p300, complejo coactivador transcripcional CREB-binding protein/p300; FIH, factor inhibidor de HIF; HIF-1α, subunidad α del factor inducible por hipoxia; OH, sitios de hidroxilación; P, sitios de fosforilación; PHDs, prolil hidroxilasas; Pro, prolina.
El sensor de oxígeno: Desde hace décadas, se ha trabajado en la identificación del sensor de oxígeno, en general bajo el supuesto de que se trataría de una proteína con un grupo hemo o similar14. En los últimos años, se han hecho avances notables en el conocimiento del mecanismo de este sensor, basadas en su propiedad de activar la señalización vía HIF-1. Existen varios modelos que involucran a diferentes moléculas como responsables de dicha función; entre ellas es fundamental un tipo especial de hidroxilasas (PHDs) que utilizan 2-ceto-glutarato como sustrato, y que al ser reguladas por oxígeno, cumplen todas las premisas para ser consideradas como el sensor principal de oxígeno. En la estructura de estas proteínas es característico un grupo prostético de tipo hemo, en el cual el Fe2+ puede ser sustituido por otros metales (Co2+, Ni2+) causando un bloqueo en la capacidad hidroxilasa de la enzima y por lo tanto una inhibición de la degradación de HIF-1a15. Un segundo tipo de regulación atribuye a las especies reactivas de oxígeno (ROS), principalmente el superóxido (O2-) y el peróxido de hidrógeno (H2O2), un papel modulador importante. Este papel se ejerce de dos maneras distintas. En un caso, la enzima NADPH oxidasa (O2 ® O2) es la responsable de la producción de ROS, que en condiciones de normoxia inducen la degradación de HIF-1a. Una segunda situación señala que la producción de ROS en la mitocondria (cyt c1 ® O2- ® H2O2) en condiciones de hipoxia induce la estabilización de HIF-1a16. Los mecanismos celulares de ambas formas de regulación están aún pendientes de resolver.
Otras vías de estimulación de HIF-1: La hipoxia no es el único estímulo que incrementa los niveles de HIF-1a. En condiciones de normoxia muchas citoquinas y factores de crecimiento activadores de receptores del tipo tirosina quinasa (RTKs) son también capaces de inducir HIF-1a, repercutiendo sobre un incremento en los niveles de este factor transcripcional. Entre éstos se incluyen: insulina17, factor de crecimiento similar a la insulina 2 (IGF-2)18, interleuquina-1b (IL-1b)19, factor de necrosis tumoral alfa (TNF-a)19, factor de crecimiento epidérmico (EGF)20, trombina21, endotelina 1 (ET-1)22 y heregulina (HER2)23. De manera general, el mecanismo por el cual todos ellos inducen HIF-1a incluye un incremento en la sintesis de la proteína, a diferencia de lo que ocurre en hipoxia, en la que la estabilidad del factor está asociada a una disminución en su tasa de degradación. Las vías principales de señalización descritas hasta el momento que participan en la inducción de HIF-1a a partir de estos factores de crecimiento, incluyen PI3K (fosfatidilinositol 3-quinasa), Akt (PKB), Ras, MAPK (proteína quinasa activada por mitógenos), y MEK (quinasa de MAPK) (Fig. 2). En el corriente año académico, y en el curso de trabajos enfocados al efecto del estrés oxidativo sobre las células endoteliales, hemos obtenido resultados que sugieren la existencia de una vía de retroalimentación del VEGF sobre su propio factor de transcripción principal, el HIF-124, 25. Un aspecto novedoso adicional de esta vía es el papel del anión superóxido como mediador principal de transmisión de la señal activadora. En cuanto al posible significado funcional de esta vía, pueden postularse la sensibilización a la respuesta hipóxica a través de uno de sus productos intermedios y la amplificación de los efectos de factores de crecimiento a través del reclutamiento de genes dependientes de HIF-1. En este último sentido, puede considerarse, por ejemplo, que el efecto inductor de HIF-1 sobre las vías glucolíticas puede ser crítico a la hora de la oferta de energía y metabolitos intermediarios necesarios para la proliferación.
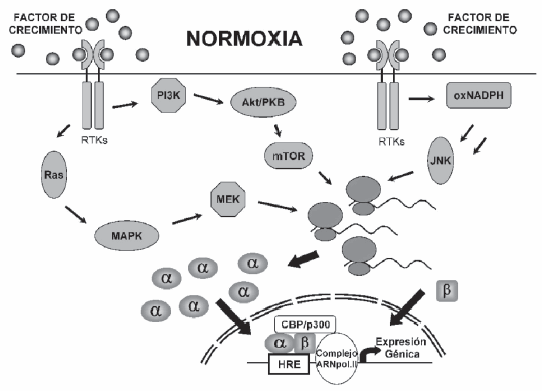
Fig. 2.- Mecanismo común de inducción de HIF-1α por citoquinas y/o factores de crecimiento. Abreviaturas: Akt/PKB, proteína quinasa B; CBP/p300, CREB-binding protein/p300; HRE, hipoxia-responsive element; JNK, c-jun N-terminal kinase; MAPK, mitogen-activated protein kinase; MEK, MAPK kinase; mTOR, mammalian target of rapamycin; oxNADPH, nicotinamide adenine dinucleotide phosphate oxidase; PI3K, phosphatidylinositol 3-OH kinase; Ras, small G protein; α, sub unidad α del factor inducible por hipoxia; β, subunidadβ del factor inducible por hipoxia.
Expresión génica en la hipoxia: Tal como hemos mencionado, la respuesta a la hipoxia es integral, y abarca todos los aspectos necesarios para proveer oxígeno a los tejidos y conseguir su aprovechamiento más eficaz.
En la actualidad, la identificación de genes que se activan por HIF-1 se ha incrementado considerablemente, incluyendo muchos cuyas proteínas participan en múltiples funciones celulares dirigidas a favorecer la oxigenación tisular, entre otras, angiogénesis, metabolismo energético, eritropoyesis, proliferación y viabilidad celular, remodelado vascular y apoptosis. La Figura 3 esquematiza los genes que se ponen en marcha a través de HIF-1. La inducción vía HIF-1 afecta a factores de citoprotección, destinados a amortiguar el daño hipóxico1, 26 y enzimas glucolíticas27, 28 y de transporte de hexosas29, necesarias para la adaptación metabólica inmediata y producción de ATP por vías anaerobias; también, se activan genes de mediadores hemodinámicos22, 30, destinados a mantener la perfusión tisular; a nivel de organismo, se inducen genes de más largo alcance e integradores, enfocados a la angiogénesis1, 31, al trofismo vascular26 y a la producción de transportadores de oxígeno, incluyendo hematíes8, 32. Un dato importante de interpretación es que, si bien el HIF-1 ejerce el papel principal en la inducción de estos genes, necesita elementos co-reguladores, cuyos sitios de unión al promotor se distribuyen en el flanco del HRE donde se une el HIF-1, incrementando su respuesta e incluso haciendo posible la transcripción, que no ocurre en su ausencia. Un ejemplo típico de esta circunstancia es el estímulo por hipoxia de la expresión del gen de ET-1, que necesita de la acción mancomunada de HIF-1, AP-1, GATA-2, y CAAT-binding factor (NF-1)33.
Fig. 3.- Genes transactivados por HIF-1. La distribución concéntrica se ha empleado a los fines de visualizar la participación de genes ligados a adaptaciones celulares esenciales a la hipoxia (centro) y mecanismos con diferente grado de integración sistémica (periferia). Abreviaturas: ADM, adrenomedullin; ALD A y C, aldolase A and C; EG-VEGF, endocrine-gland-derived VEGF; ENG, endoglin; ET1, endothelin 1; ENO1, enolase 1; EPO, erythropoietin; GLUT1, glucose transporter 1; GAPDH, glyceraldehyde-3-p-dehydrogenase; HK 1 y 2, hexokinase 1 and 2; IGF2, insulin-like growth factor 2; IGF-BP 1, 2 y 3, IGF-factor-binding-protein 1, 2 and 3; LDHA, lactate dehydrogenase A; LEP, leptin; LRP1, LDL-receptor-related protein 1; MDR1, multidrug resistance 1; NOS2, nitric oxide synthase 2; PFKL, phosphofructokinase; TGF-a, transforming growth factor-a; TGF-β3, transforming growth factor-β3; TPI, triosephosphate isomerase, VEGF, vascular endothelial growth factor.
HIF-1, hipoxia y citoprotección: Sintetizando estos apartados, la respuesta de HIF-1 es específica de la hipoxia y del estímulo por factores de crecimiento. Esta última vía se relaciona con la necesidad de proveer una mayor oferta de oxígeno en tejidos en expansión celular. En este punto cabe preguntarse si la célula responde a la depleción energética de forma idéntica a la falta de oxígeno. Los datos disponibles, si bien todavía insuficientes, indican que el déficit de ATP, que podría ser interpretado como un equivalente de hipoxia, no parece estimular la activación de HIF-1, aunque sí en cambio la de HSPs34, 35. De interés adicional, en modelos experimentales en células tubulares renales (LLC-PK1), la hipoxia no extrema no causa depleción de ATP, un dato que refleja la eficiente adaptación de la producción energética ante la disminución de oxígeno34. No se han publicado aún estudios similares en modelos con bloqueo de HIF-1, pero su interés es obvio, ya que es probable que HIF-1 sea en gran parte responsable de la citada eficiencia.
Estos datos se relacionan con el apartado final, referido a posibilidades terapéuticas. En breve, las acciones citoprotectoras abarcan a muchos tipos celulares y respuestas sistémicas. En este contexto, HIF-1 es un factor transcripcional clave en una respuesta génica compleja, desarrollada a múltiples niveles. A modo de ejemplos, en experimentos en ratón, se ha observado que episodios breves de hipoxia intermitente bastan para inducir la producción de EPO, que a su vez protege al corazón del daño apoptótico por isquemia-reperfusión; por el contrario, en animales que no expresan HIF-1, esta respuesta no ocurre, no estimulándose la producción de EPO con la hipoxia36. En diferentes tipos tumorales, HIF-1 se encuentra marcadamente activado, y este estado se relaciona con mayor agresividad del tumor. Más aún, otra posible explicación, más indirecta, de los efectos de HIF-1 sobre los tumores proviene de datos recientes, que demuestran una elevación de HIF-1, con efectos protectores, en las células endoteliales de tumores irradiados, lo que aporta un nuevo abordaje de interpretación a los posibles mecanismos de resistencia tumoral a la radioterapia37.
Aspectos clínicos: La expresión de HIF-1 y los genes que regula, se han relacionado con múltiples circunstancias ambientales y fisiológicas (altura, ejercicio, frío, exposición al tabaco), como procesos patológicos. Hemos seleccionado algunas situaciones de interés inmediato.
Enfermedad pulmonar crónica: En un ejemplo de adaptación fisiológica, en la altura se ha observado un aumento de expresión de HIF-1 tanto en nativos aclimatados crónicamente como en viajeros; este aumento se acompaña de incremento de EPO y cambios en el músculo esquelético, y especialmente en el número y actividad de mitocondrias38. Este aumento de HIF-1, que es útil para incrementar la capacidad transportadora de oxígeno, se acompaña de estimulación de mecanismos de remodelado de la vasculatura, que llevan a mayor hipertensión pulmonar. La hipoxia es un potente estímulo para la producción por el endotelio pulmonar de ET-1, un péptido capaz de inducir vasoconstricción y proliferación del músculo liso de los vasos pulmonares y VEGF, un agente proliferativo y remodelante; ambos genes están relacionados con HIF-1. En contrapartida fisiológica, ET-1 aumenta en la altitud de forma inversamente proporcional a la saturación arterial de oxígeno y de manera directamente proporcional con el aumento en la presión sistólica de la arteria pulmonar39. Es de interés el estudio del papel de genes dependientes de HIF-1 en otros mecanismos relacionados con la hipertensión pulmonar, como la inhibición del canal de potasio en los vasos pulmonares, así como en la activación local de angiotensina II39. En la misma línea de evidencia, el síndrome de apnea obstructiva del sueño se acompaña de niveles elevados de VEGF en sangre, en proporción al grado de hipoxia; este dato proporciona una pista en la dirección de un posible incremento de HIF-1 y por consiguiente de otros genes potencialmente relevantes40.
El sistema de HIF-1 participa de la adaptación al ejercicio, y especialmente de los cambios hipóxicos relacionados con el mismo, favoreciendo el paso de la glucólisis aerobia a la anaerobia. En este sentido, en animales a los que se ha eliminado HIF-1, se observa ausencia de acumulación de ácido láctico durante el ejercicio, con disminución de la fatigabilidad y consiguiente uso muscular excesivo y daño similar al encontrado en las distrofias musculares con alteración de la vía glucolítica41. De interés especial, la glucólisis anaerobia mantiene los niveles de ATP a pesar de la ausencia de producción aerobia de energía. Este fenómeno es especialmente importante en la isquemia/reperfusión, y depende de HIF-1 y sus genes relacionados.
Patología tumoral: El crecimiento rápido de los tumores determina que su incremento de tamaño no se acompañe de un desarrollo vascular suficiente, lo que genera zonas de hipoxia en el interior de la masa tumoral. Esta hipoxia activa HIF-1 y éste a su vez pone en marcha toda la familia de genes angiogénicos42, aumentando la densidad y permeabilidad vascular, y por tanto el crecimiento y propagación del tumor y, de gran interés, en algunos casos la resistencia del mismo al tratamiento. Independientemente de la hipoxia, en algunos tumores, como hemangioblastomas y carcinomas renales, la activación de HIF-1 se relaciona con la inactivación funcional del gen supresor VHL, lo que disminuye la degradación y aumenta el HIF-1, aun en normoxia43, 44. Además, el hallazgo reciente de niveles altos de HIF-1 en neoplasias como la leucemia aguda linfática, en la que no existe aparentemente hipoxia, sugiere que la explicación del aumento debe ser más compleja45.
Si bien el incremento de HIF-1 en los tumores es un hecho demostrado, no se han desarrollado aún abordajes terapéuticos basados en su bloqueo específico. Ahondando un poco más, se desconocen las causas de por qué, dentro de todos los genes dependientes de HIF-1, solo se expresan con mayor intensidad algunos, un fenómeno que debe estudiarse y que se relaciona con la presencia de sitios co-reguladores de los efectos de la unión del HIF-1 al HRE. Un aspecto de interés extremo es el posible papel de HIF-1 en la particular adaptación metabólica de los tumores, en los que la glucólisis anaerobia no se inhibe en presencia de formación de ATP por vía aeróbica; esta situación puede relacionarse en forma directa con el efecto protector del HIF-1 sobre las células tumorales.
Shock hemorrágico: En el shock hemorrágico, el HIF-1 se activa a nivel tisular, pero la información disponible es todavía muy fragmentaria. En este tipo de shock existe inducción de óxido nítrico sintasa (NOS), cicloxigenasa 2 (COX-2) y CD14, lo que aumenta la producción de óxido nítrico (NO) y prostaglandinas. HIF-1 regula la inducción de NOS durante la fase isquémica de este shock46, 47.
Anemia y eritropoyetina: HIF-1 es esencial en la inducción fisiológica del gen de EPO. Viendo esta relación desde el punto de vista del mecanismo global desarrollado anteriormente, es notable que HIF-1 actúe sobre al menos tres genes de importancia en cuanto al efecto de la EPO: el de la transferrina, necesario para la oferta de hierro a las células eritroides, el del VEGF, cofactor en la estimulación de estas mismas células y el de la NOS2, necesario para la producción de NO, que permite el mantenimiento de cifras normales de presión arterial durante el efecto de la EPO, hasta el punto en que en ratones transgénicos para EPO humana, la inhibición de NOS provoca la muerte por complicaciones masivas cardiovasculares48.
En patología, individuos con mutaciones estimulatorias de HIF-1 presentan policitemia familiar; del mismo modo, la eritrocitosis paraneoplásica se ha asociado a mutaciones del gen VHL que afectan su interacción con HIF-149. De especial interés, la EPO no solo tiene funciones como regulador de la eritropoyesis, sino que participa en diferentes mecanismos, entre otros la vascularización retiniana y de la glándula mamaria, diferenciación de adipocitos, maduración embrionaria de la cresta neural, citoprotección neuronal, de miocardiocitos y de túbulos renales en situaciones de isquemia/reperfusión50.
El mecanismo exacto por el cual aumenta la EPO en la anemia humana no se ha dilucidado por completo; por ejemplo, en las Unidades de Cuidados Intensivos, los niveles de EPO pueden ser inapropiadamente bajos para el grado de anemia; las razones no se conocen suficientemente, pero la insuficiencia renal es probablemente un elemento significativo. En nuestro conocimiento, se carece de estudios acerca del HIF-1 de pacientes de cuidados intensivos51.
Enfermedad cardíaca: En la insuficiencia cardíaca (IC), en un contexto parecido al que referimos en la enfermedad pulmonar crónica, existe aumento de ET-1, que si bien tiene un efecto inotrópico positivo, en el largo plazo favorece la hipertrofia miocárdica y la mala adaptación. En la isquemia miocárdica, se han detectado aumentos de VEGF, relacionados con estimulación hipóxica52. Los niveles de VEGF en leucocitos expuestos a hipoxia se correlacionan con el grado de formación de colaterales que induce la isquemia coronaria in vivo53, por lo que una disminución de la expresión de HIF-1/VEGF inducidos por isquemia representaría un factor de riesgo no descrito previamente. En este sentido, es de prever que los desarrollos terapéuticos se dirigirán progresivamente a drogas que aumenten la activación de HIF-1 o inhiban su degradación, como por ejemplo el recientemente descrito PR39, péptido derivado de los macrófagos que induce angiogénesis miocárdica54. Un segundo aspecto de interés es el del papel de HIF-1 en el precondicionamiento cardíaco ante la isquemia, en el que tiene un papel relevante la síntesis de nuevas proteínas en las primeras 24 h que siguen a un episodio agudo, con particular referencia a la NOS2 en miocardiocitos y células endoteliales55. El HIF-1 es esencial en esta inducción.
La anemia es un factor patogénico relevante en la IC, cuyo origen está aún incompletamente dilucidado56. La presencia de niveles elevados de EPO en pacientes con IC hace probable que HIF-1 esté estimulado, pero no se dispone aún de datos publicados en este sentido. Actualmente están en curso estudios, como el auspiciado por la Red Cardiovascular del Instituto de Salud Carlos III (Ministerio de Sanidad, España) acerca de la patogenia de la anemia en la IC, que incluye medidas de HIF-1, pero del que no se han comunicado aún resultados.
Ictus: En modelos de oclusión vascular en ratas, se ha visto un incremento de la expresión de ARNm de HIF-1 en la zona de penumbra o tejido viable circundante al infarto57. Esto coincide con la expresión de ARNm de otros genes transactivados por HIF-1, como enzimas glucolíticas y VEGF, que promueven la supervivencia neuronal58.
Tabaco/Humo: Algunos de los mecanismos de carcinogénesis mediada por los hidrocarburos policíclicos aromáticos, encontrados en el humo del tabaco y en la contaminación urbana, así como la de las dioxinas, depende de su unión al receptor aril hidrocarburo (AhR) y su dimerización con ARNT, proteína que también dimeriza con HIF-1a5. Por otra parte, la exposición al humo del tabaco reduce la angiogénesis inducida por hipoxia, disminuyendo la expresión de VEGF y HIF-1a, a través de una desestabilización de HIF-1a por el monóxido de carbono (CO) producido en la combustión del cigarrillo. Esta supresión de genes angiogénicos puede ser determinante en los efectos del tabaco sobre la microcirculación, habiéndose propuesto terapéuticas basadas en la administración de vectores portadores de VEGF59. Sin embargo, en un estudio en curso (Deudero JJP y González-Pacheco FR, datos no publicados) no se han encontrado diferencias en la respuesta de HIF-1a hasta una semana después de haberse interrumpido el uso del tabaco en fumadores de más de 20 cigarrillos diarios.
Preeclampsia y crecimiento intrauterino retardado: En la preeclampsia, existe un fallo primario del trofoblasto para invadir el miometrio e inducir la remodelación de las arterias espirales uterinas durante la placentación. Esto provoca disminución de la perfusión de la unidad uteroplacentaria, condicionando hipoxia que activa HIF-1, promueve la expresión del factor de crecimiento de transformación b3 (TGFb3) y la síntesis del receptor-1 soluble del VEGF (sVEGFR1)60, que bloquea al VEGF y empeora la perfusión de la placenta. En este contexto, son posibilidades terapéuticas la inhibición de HIF-1/TGFb3 con oligonucleótidos antisentido, o la administración de VEGF.
En el crecimiento intrauterino retardado existe disminución de perfusión placentaria e hipoxia. IGFBP-1 (insulin growth factor binding protein-1) constituye un regulador negativo de IGF y éste está inducido por la presencia de sitios HREs en el promotor del gen que le da origen. IGFBP-1 está muy aumentado en sangre de cordón umbilical de neonatos con retraso de crecimiento61.
Sobredosis de fármacos: La hipoxia estimula, a través de HIF-1, la expresión de sub-unidades del citocromo p450, como CYP3A6, influyendo por lo tanto en la capacidad de neutralización y eliminación de drogas y productos tóxicos y de desecho metabólico durante la hipoxia62.
Enfermedad inflamatoria intestinal: La sobreexpresión de HIF-1 protege el epitelio colónico ante la inflamación, mientras que la ausencia de HIF-1 produce el efecto contrario63.
Patología retiniana: En modelos animales, se ha observado que la exposición a hiperoxia en el período neonatal, determina regresión vascular e isquemia, fenómenos similares a los descritos en la retinopatía de la prematuridad y que se relacionan con alteraciones de la expresión génica. Del mismo modo, se considera crucial el papel de péptidos como el VEGF en la neovascularización retiniana de la diabetes mellitus y otras retinopatías proliferativas64-66. Este es uno de los campos en los que el progreso terapéutico puede ser más acelerado, ya sea mediante incremento o inhibición de HIF-1 y genes dependientes.
Heridas: El VEGF aumenta localmente durante la curación de heridas, involucrando un mecanismo mediado por ROS67. En este contexto, la sobreactivación de la vía de HIF-1 puede ser útil para incrementar la vascularización, permeabilidad vascular y cicatrización en heridas donde el VEGF no haya aumentado suficientemente.
La presente no es una revisión exhaustiva de los efectos de HIF-1, pero intenta dar una visión de conjunto de las circunstancias tan diversas en que este factor transcripcional se halla implicado y de las extraordinarias posibilidades terapéuticas que ofrecen su bloqueo o estimulación. En este sentido, HIF-1 representa el eje de un mecanismo central con múltiples conexiones, por lo que la intervención sobre el mismo puede ser un instrumento esencial en el control de múltiples situaciones patológicas.
Agradecimientos: Al Fondo de Investigación Sanitaria (FIS:PI030888), Red Cardiovascular C03/01 (RECAVA, Instituto de Salud Carlos III), Comunidad Autónoma de Madrid (CAM: 08.3/0008.3/2001.3), Instituto Reina Sofía de Investigación Nefrológica (IRSIN), Fundación Conchita Rábago.
Referencias
1. Forsythe JA, Jiang BH, Iyer NV et al. Activation of vascular endothelial growth factor gene transcription by hypoxia-inducible factor 1. Mol Cell Biol 1996; 16: 4604-13. [ Links ]
2. Liu LX, Lu H, Luo Y, et al. Stabilization of vascular endothelial growth factor mRNA by hypoxia-inducible factor 1. Biochem Biophys Res Commun 2002; 291: 908-14. [ Links ]
3. Semenza GL, Nejfelt MK, Chi SM, Antonarakis SE. Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene. Proc Natl Acad Sci USA 1991; 88: 5680-4. [ Links ]
4. Wang GL, Semenza GL. Purification and characterization of hypoxia-inducible factor 1. J Biol Chem 1995; 270: 1230-7. [ Links ]
5. Wang GL, Jiang BH, Rue EA, Semenza GL. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA 1995; 92: 5510-4. [ Links ]
6. Jiang BH, Zheng JZ, Leung SW, et al. Transactivation and inhibitory domains of hypoxia-inducible factor 1alpha. Modulation of transcriptional activity by oxygen tension. J Biol Chem 1997; 272: 19253-60. [ Links ]
7. Hoffman EC, Reyes H, Chu FF, et al. Cloning of a factor required for activity of the Ah (dioxin) receptor. Science 1991; 252: 954-8. [ Links ]
8. Wang GL, Semenza GL. General involvement of hypoxia-inducible factor 1 in transcriptional response to hypoxia. Proc Natl Acad Sci USA 1993; 90: 4304-8. [ Links ]
9. Jaakkola P, Mole DR, Tian YM, et al. Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science 2001; 292: 468-72. [ Links ]
10. Lando D, Peet DJ, Whelan DA, et al. Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch. Science 2002; 295: 858-61. [ Links ]
11. Huang LE, Gu J, Schau M, Bunn HF. Regulation of hypoxia-inducible factor 1alpha is mediated by an O2-dependent degradation domain via the ubiquitin-proteasome pathway. Proc Natl Acad Sci USA 1998; 95: 7987-92. [ Links ]
12. Katschinski DM, Le L, Heinrich D, et al. Heat induction of the unphosphorylated form of hypoxia-inducible factor-1alpha is dependent on heat shock protein-90 activity. J Biol Chem 2002; 277: 9262-7. [ Links ]
13. Isaacs JS, Jung YJ, Mimnaugh EG, et al. Hsp90 regulates a von Hippel Lindau-independent hypoxia-inducible factor-1 alpha-degradative pathway. J Biol Chem 2002; 277: 29936-44. [ Links ]
14. Goldberg MA, Dunning SP, Bunn HF. Regulation of the erythropoietin gene: evidence that the oxygen sensor is a heme protein. Science 1988; 242: 1412-5. [ Links ]
15. Maxwell P, Salnikow K. HIF-1: an oxygen and metal responsive transcription factor. Cancer Biol Ther 2004; 3: 29-35. [ Links ]
16. Michiels C, Minet E, Mottet D, Raes M. Regulation of gene expression by oxygen: NF-kappaB and HIF-1, two extremes. Free Radic Biol Med 2002; 33: 1231-42. [ Links ]
17. Zelzer E, Levy Y, Kahana C, et al. Insulin induces transcription of target genes through the hypoxia-inducible factor HIF-1alpha/ARNT. EMBO J 1998; 17: 5085-94. [ Links ]
18. Feldser D, Agani F, Iyer NV, et al. Reciprocal positive regulation of hypoxia-inducible factor 1alpha and insulin-like growth factor 2. Cancer Res. 1999; 59: 3915-8. [ Links ]
19. Hellwig-Burgel T, Rutkowski K, Metzen E, et al. Interleukin-1beta and tumor necrosis factor-alpha stimulate DNA binding of hypoxia-inducible factor-1. Blood 1999; 94: 1561-7. [ Links ]
20. Zhong H, Chiles K, Feldser D, et al. Modulation of hypoxia-inducible factor 1alpha expression by the epidermal growth factor/phosphatidylinositol 3-kinase/PTEN/AKT/FRAP pathway in human prostate cancer cells: implications for tumor angiogenesis and therapeutics. Cancer Res 2000; 60: 1541-5. [ Links ]
21. Gorlach A, Diebold I, Schini-Kerth VB, et al. Thrombin activates the hypoxia-inducible factor-1 signaling pathway in vascular smooth muscle cells: Role of the p22(phox)-containing NADPH oxidase. Circ Res 2001; 89: 47-54. [ Links ]
22. Spinella F, Rosano L, Di C, et al. Endothelin-1 induces vascular endothelial growth factor by increasing hypoxia-inducible factor-1alpha in ovarian carcinoma cells. J Biol Chem 2002; 277: 27850-5. [ Links ]
23. Laughner E, Taghavi P, Chiles K, et al. HER2 (neu) signaling increases the rate of hypoxia-inducible factor 1alpha (HIF-1alpha) synthesis: novel mechanism for HIF-1-mediated vascular endothelial growth factor expression. Mol Cell Biol 2001; 21: 3995-4004. [ Links ]
24. González-Pacheco FR, Deudero JJP, De Solis AJ, et al. El factor de crecimiento del endotelio vascular (VEGF) incrementa la síntesis de la sub-unidad alfa del factor inducible por hipoxia 1 (HIF-1alfa) en condiciones de normoxia. XXXIV Congreso de la Sociedad Española de Nefrología (SEN). Oct 2-5 2004, Santa Cruz de Tenerife, España. [ Links ]
25. Deudero JJP, González-Pacheco FR, De Solis AJ, et al. VEGF increases HIF-1 levels by a superoxide-mediated mechanism. A joint meeting of the Oxygen Club of California and the University of Turín. Sept 7-10, 2005; Alba, Italy. [ Links ]
26. Palmer LA, Semenza GL, Stoler MH, Johns RA. Hypoxia induces type II NOS gene expression in pulmonary artery endothelial cells via HIF-1. Am J Physiol 1998; 274: L212-9. [ Links ]
27. Graven KK, Yu Q, Pan D, et al. Identification of an oxygen responsive enhancer element in the glyceraldehyde-3-phosphate dehydrogenase gene. Biochim Biophys Acta 1999; 1447: 208-18. [ Links ]
28. Semenza GL, Jiang BH, Leung SW, et al. Hypoxia response elements in the aldolase A, enolase 1, and lactate dehydrogenase A gene promoters contain essential binding sites for hypoxia-inducible factor 1. J Biol Chem 1996; 271: 32529-37. [ Links ]
29. Gleadle JM, Ratcliffe PJ. Induction of hypoxia-inducible factor-1, erythropoietin, vascular endothelial growth factor, and glucose transporter-1 by hypoxia: evidence against a regulatory role for Src kinase. Blood 1997; 89: 503-9. [ Links ]
30. Palmer LA, Semenza GL, Stoler MH, Johns RA. Hypoxia induces type II NOS gene expression in pulmonary artery endothelial cells via HIF-1. Am J Physiol 1998; 274: L212-9. [ Links ]
31. Caniggia I, Mostachfi H, Winter J, et al. Hypoxia-inducible factor-1 mediates the biological effects of oxygen on human trophoblast differentiation through TGFbeta(3). J Clin Invest 2000; 105: 577-87. [ Links ]
32. Rolfs A, Kvietikova I, Gassmann M, Wenger RH. Oxygen-regulated transferrin expression is mediated by hypoxia-inducible factor-1. J Biol Chem 1997; 272: 20055-62. [ Links ]
33. Yamashita K, Discher DJ, Hu J, et al. Molecular regulation of the endothelin-1 gene by hypoxia. Contributions of hypoxia-inducible factor-1, activator protein-1, GATA-2, AND p300/CBP. J Biol Chem 2001; 276: 12645-53. [ Links ]
34. Eickelberg O, Seebach F, Riordan M, et al. Functional activation of heat shock factor and hypoxia-inducible factor in the kidney. J Am Soc Nephrol 2002; 13: 2094-101. [ Links ]
35. Mabjeesh NJ, Post DE, Willard MT, et al. Geldanamycin induces degradation of hypoxia-inducible factor 1alpha protein via the proteosome pathway in prostate cancer cells. Cancer Res 2002; 62: 2478-82. [ Links ]
36. Cai Z, Manalo DJ, Wei G et al. Hearts from rodents exposed to intermittent hypoxia or erythropoietin are protected against ischemia-reperfusion injury. Circulation 2003; 108: 79-85. [ Links ]
37. Semenza GL. Intratumoral hypoxia, radiation resistance, and HIF-1. Cancer Cell 2004; 5: 405-6. [ Links ]
38. Hoppeler H, Vogt M, Weibel ER, Fluck M. Response of skeletal muscle mitochondria to hypoxia. Exp Physiol 2003; 88: 109-19. [ Links ]
39. Semenza GL. Oxygen-regulated transcription factors and their role in pulmonary disease. Respir Res 2000; 1: 159-62. [ Links ]
40. Schulz R, Hummel C, Heinemann S, et al. Serum levels of vascular endothelial growth factor are elevated in patients with obstructive sleep apnea and severe nighttime hypoxia. Am J Respir Crit Care Med 2002; 165: 67-70. [ Links ]
41. Mason SD, Howlett RA, Kim MJ, et al. Loss of skeletal muscle HIF-1alpha results in altered exercise endurance. PLoS Biol 2004; 2: e288. [ Links ]
42. Quintero M, Mackenzie N, Brennan PA. Hypoxia-inducible factor 1 (HIF-1) in cancer. Eur J Surg Oncol 2004; 30: 465-8. [ Links ]
43. Kanno H, Kondo K, Ito S, et al. Somatic mutations of the von Hippel-Lindau tumor suppressor gene in sporadic central nervous system hemangioblastomas. Cancer Res 1994; 54: 4845-7. [ Links ]
44. Gnarra JR, Tory K, Weng Y, et al. Mutations of the VHL tumour suppressor gene in renal carcinoma. Nat Genet 1994; 7: 85-90. [ Links ]
45. Wellmann S, Guschmann M, Griethe W, et al. Activation of the HIF pathway in childhood ALL, prognostic implications of VEGF. Leukemia 2004; 18: 926-33. [ Links ]
46. Hierholzer C, Billiar TR. Molecular mechanisms in the early phase of hemorrhagic shock. Langenbecks Arch Surg 2001; 386: 302-8. [ Links ]
47. Hierholzer C, Harbrecht BG, Billiar TR, Tweardy DJ. Hypoxia-inducible factor-1 activation and cyclo-oxy-genase-2 induction are early reperfusion-independent inflammatory events in hemorrhagic shock. Arch Orthop Trauma Surg 2001; 121: 219-22. [ Links ]
48. Eckardt KU. Anaemia in end-stage renal disease: pathophysiological considerations. Nephrol Dial Transplant 2001; 16 Suppl 7: 2-8. [ Links ]
49. Wiesener MS, Seyfarth M, Warnecke C, et al. Paraneoplastic erythrocytosis associated with an inactivating point mutation of the von Hippel-Lindau gene in a renal cell carcinoma. Blood 2002; 99: 3562-5. [ Links ]
50. Poellinger L, Johnson RS. HIF-1 and hypoxic response: the plot thickens. Curr Opin Genet Dev 2004; 14: 81-5. [ Links ]
51. Fink MP. Pathophysiology of intensive care unit-acquired anemia. Crit Care 2004; 8 (Suppl 2): S9-10. [ Links ]
52. Kakinuma Y, Miyauchi T, Yuki K, et al. Novel molecular mechanism of increased myocardial endothelin-1 expression in the failing heart involving the transcriptional factor hypoxia-inducible factor-1alpha induced for impaired myocardial energy metabolism. Circulation 2001; 103: 2387-94. [ Links ]
53. Schultz A, Lavie L, Hochberg I, et al. Interindividual heterogeneity in the hypoxic regulation of VEGF: significance for the development of the coronary artery collateral circulation. Circulation 1999; 100: 547-52. [ Links ]
54. Li J, Post M, Volk R, et al. PR39, a peptide regulator of angiogenesis. Nat Med 2000; 6: 49-55. [ Links ]
55. Palmer LA, Semenza GL, Stoler MH, Johns RA. Hypoxia induces type II NOS gene expression in pulmonary artery endothelial cells via HIF-1. Am J Physiol 1998; 274: L212-19. [ Links ]
56. Justo S, Gil P, González-Pacheco FR, Caramelo C. Anemia en la insuficiencia cardíaca: mecanismos patogénicos. Rev Esp Cardiol (En prensa, 2006). [ Links ]
57. Bergeron M, Yu AY, Solway KE, et al. Induction of hypoxia-inducible factor-1 (HIF-1) and its target genes following focal ischaemia in rat brain. Eur J Neurosci 1999; 11: 4159-70. [ Links ]
58. Marti HJ, Bernaudin M, Bellail A, et al. Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia. Am J Pathol 2000; 156: 965-76. [ Links ]
59. Michaud SE, Menard C, Guy LG, et al. Inhibition of hypoxia-induced angiogenesis by cigarette smoke exposure: impairment of the HIF-1alpha/VEGF pathway. FASEB J 2003; 17: 1150-2. [ Links ]
60. Vuorela P, Helske S, Hornig C, et al. Amniotic fluid soluble vascular endothelial growth factor receptor-1 in preeclampsia. Obstet Gynecol 2000; 95: 353-7. [ Links ]
61. Tazuke SI, Mazure NM, Sugawara J, et al. Hypoxia stimulates insulin-like growth factor binding protein 1 (IGFBP-1) gene expression in HepG2 cells: a possible model for IGFBP-1 expression in fetal hypoxia. Proc Natl Acad Sci USA 1998; 95: 10188-93. [ Links ]
62. Fradette C, Du SP. Effect of hypoxia on cytochrome P450 activity and expression. Curr Drug Metab 2004; 5: 257-71. [ Links ]
63. Karhausen J, Furuta GT, Tomaszewski JE, et al. Epithelial hypoxia-inducible factor-1 is protective in murine experimental colitis. J Clin Invest 2004; 114: 1098-106. [ Links ]
64. Ferrara N. Molecular and biological properties of vascular endothelial growth factor. J Mol Med 1999; 77: 527-43. [ Links ]
65. Pierce EA, Avery RL, Foley ED, et al. Vascular endothelial growth factor/vascular permeability factor expression in a mouse model of retinal neovascularization. Proc Natl Acad Sci USA 1995; 92: 905-9. [ Links ]
66. Ozaki H, Yu AY, Della N, et al. Hypoxia inducible factor-1alpha is increased in ischemic retina: temporal and spatial correlation with VEGF expression. Invest Ophthalmol Vis Sci 1999; 40: 182-9. [ Links ]
67. Sen CK, Khanna S, Babior BM, et al. Oxidant-induced vascular endothelial growth factor expression in human keratinocytes and cutaneous wound healing. J Biol Chem 2002; 277: 33284-90. [ Links ]
Recibido: 4-04-2005
Aceptado: 20-12-2005














