Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista veterinaria
versión On-line ISSN 1669-6840
Rev. vet. vol.28 no.2 Corrientes jun. 2017
TRABAJOS DE INVESTIGACIÓN
Estudio comparativo entre las técnicas convencionales e inmunohistoquímicas para el diagnóstico de leishmaniosis canina
Cátedra de Patología General y Sistemática, Facultad de Ciencias Veterinarias, Universidad Nacional del Nordeste, Sargento Cabral 2139, Corrientes, Argentina. E-mail: aburna@yahoo.com.ar
Resumen
En la leishmaniosis visceral (LV) los amastigotes pueden ser identificados por tinción con Giemsa en preparaciones o secciones de tejidos obtenidos de lesiones en piel, bazo, hígado y médula ósea, o bien aspirados de nódulos linfáticos. Se considera como resultado positivo, la aparición de una sola célula parasitada. El diagnóstico puede no ser exitoso debido a la baja sensibilidad de las técnicas histológicas tradicionales para detectar el parásito. Los métodos inmunohistoquímicos para detección de Leishmania sp en tejidos son simples, no requieren equipamiento especial y son altamente sensibles y específicos. El objetivo de este estudio fue evaluar las técnicas consideradas más sensibles y específicas para el diagnóstico de LV. Se obtuvieron muestras de caninos del nordeste argentino. Fueron seleccionados 42 pacientes con diagnóstico serológico reactivo a Leishmania sp, a los cuales se les extrajeron muestras mediante punción de médula ósea. También se obtuvieron muestras por biopsia de piel proveniente del pabellón auricular, para coloración HyE e inmunohistoquímica. En la observación microscópica de los extendidos de médula ósea, la coloración Giemsa permitió detectar amastigotes de Leishmania sp en los 42 animales investigados. Con la técnica inmunocitoquímica solo el 70% de las muestras reaccionó marcando los parásitos. En los cortes histológicos se pudieron identificar amastigotes de Leishmania sp con la técnica inmunohistoquímica en el 100% de los casos. Por su parte, la coloración HyE permitió detectar solamente un 65% de las muestras como positivas a la presencia de amastigotes. En el caso de bloques parafinados, la técnica inmunohistoquímica mostró mayor sensibilidad en la detección de amastigotes de Leishmania sp. En cuanto a las muestras citológicas, la coloración Giemsa mostró mayor utilidad, ya que permitió detectar no solo la presencia de amastigotes de Leishmania sp sino también otros microorganismos.
Palabras clave: canino, leishmaniosis, diagnóstico, sensibilidad, especificidad.
Abstract
In canine leishmaniosis, amastigotes can be revealed by Giemsa staining on samples of lesions from skin, spleen, liver, bone marrow and lymph nodes. A positive result must be considered with only one parasitized cell. The diagnosis can be unsuccessful because of the low sensitivity of traditional methods to detect the parasite. Immunohistochemical methods to detect Leishmania sp are simple, they do not need special equipment, and are highly sensitive and specific. The aim of this work was to evaluate techniques that are considered more sensitive and specific to diagnose visceral leishmaniosis. Samples were obtained from dogs from areas of argentine north-east. Forty two canines with positive serum diagnosis to Leishmania sp were selected for the extraction of bone marrow and skin samples in order to perform HE staining and immunohistochemistry. In bone marrow of 42 animals Leishmania amastigotes were observed using Giemsa stain. Immunohistochemistry revealed a 70% of positives to the parasite. In histological samples, Leishmania amastigotes were observed in 100% with immunohistochemistry, while only 65% were positive with HE stain. In paraffin embedded blocks, immunohistochemical technique is more sensitive for the detection of Leishmania amastigotes. Giemsa stain was more useful as it allowed the observation of not only Leishmania sp but also other types of microorganisms.
Key words: dog, leishmaniosis, diagnosis, sensibility, specificity.
Recibido: 14 noviembre 2016
Aceptado: 12 julio 2017
INTRODUCCIÓN
La leishmaniosis visceral (LV) es una enfermedad crónica zoonótica del canino causada por un protozoario del género Leishmania. En el nuevo mundo el agente causal es L. chagasi 4, 23. La enfermedad es endémica en varios países de América Latina, en los cuales el parásito es transmitido al hombre y animales mediante la succión sanguínea de flebótomos del género Lutzomya 16.
Las hembras de los flebótomos se infestan cuando pican para ingerir sangre de hospedadores parasitados. En ellos, los macrófagos circulantes (monocitos) están infestados con las formas amastigotas del parásito en el interior de las vacuolas lisosomales. En el intestino del insecto, las leishmanias desarrollan una compleja serie de transformaciones morfológicas y funcionales. Los perros son los reservorios domésticos de la LV humana y muchos de los signos clínicos observados en tales animales, son similares al patrón de la enfermedad en seres humanos 12.
Gran número de perros padece una infección subclínica denominada leishmaniosis críptica. Algunos autores consideran que únicamente los perros con síntomas son infectivos para los flebótomos, y que la capacidad infestante para el vector por parte de los perros sin sintomatología aparente, es muy reducida 10, 22. Sin embargo, otros investigadores no hallaron variaciones significativas en el porcentaje de flebótomos infectados al ponerlos en contacto con perros de sintomatología muy variada 19.
El período de incubación de la LV canina es muy variable, oscilando entre pocos meses y varios años 8. Estas etapas pueden alcanzar lapsos superiores y reflejar la cronicidad con la cual se presenta esta afección, con prolongados períodos asintomáticos 1.
Los signos clínicos más comunes de la LV canina son lesiones cutáneas (alopecia, dermatitis, úlceras, onicogrifosis), oculares (conjuntivitis, queratoconjuntivitis, blefaritis, uveítis) y viscerales (linfoadenopatía local o generalizada, fiebre, pérdida de peso progresiva, débil o marcada pérdida del apetito, anemia, hepato-esplenomegalia, glomerulonefritis y falla renal crónica) 14, 15.
La enfermedad es extremadamente polimórfica y la observación del parásito en los tejidos es necesaria para confirmar el diagnóstico. Los amastigotes pueden ser identificados por tinción con Wright o Giemsa en preparaciones como frotis o secciones de tejidos obtenidos de lesiones en piel, bazo, hígado y médula ósea, o bien aspirados de nódulos linfáticos. La aparición de una sola célula parasitada debe ser considerada como resultado positivo.
La punción ganglionar es menos útil, ya que el porcentaje de falsos negativos es mayor que en las muestras obtenidas a partir de médula ósea. La mayor desventaja de éste método se debe a que en tejidos ganglionares la cantidad de parásitos puede ser baja, por lo cual una punción negativa no es excluyente. Es aconsejable tomar varias muestras y apoyar el diagnóstico en otras pruebas complementarias 11.
Otras técnicas para el diagnóstico parasitológico incluyen el cultivo in vitro de fragmentos o de material aspirado de tejidos, así como la inoculación de animales de laboratorio. La baja sensibilidad de estos procedimientos hace que los resultados sean frecuentemente inconclusos, además de requerir repetidas tomas de muestras ejecutadas por personal capacitado 25.
Otros métodos incluyen demostración de anticuerpos específicos anti-Leishmania en suero de animales infectados, mediante fluorescencia indirecta de titulación de anticuerpos, tests de fijación de complemento, ELISA, aislamiento del parásito mediante cultivo o mediante inoculación en hámster 28, así como cultivos in vitro de fragmentos o materiales aspirados de tejidos 20 y análisis histopatológicos de órganos infectados como bazo, hígado, nódulos linfoides y médula ósea 12, 26, 27.
Las biopsias de piel son útiles cuando existen lesiones cutáneas, en especial en la leishmaniosis cutánea localizada, ya que en el inicio de la infección (primo-infección) todavía no se ha producido una seroconversión, ni existen variaciones en el proteinograma, ni leishmanias en la médula ósea. Mediante técnicas inmunohistoquí- micas (inmunoperoxidasa) se pueden detectar parásitos en los cortes histológicos con gran sensibilidad y especificidad 5,7.
La característica histopatológica clásica de la LV canina es una reacción inflamatoria crónica con o sin formación de granulomas asociados con hiperplasia e hipertrofia de macrófagos. Estas células (principalmente en bazo, hígado, ganglios linfáticos y médula ósea) pueden contener numerosas formas amastigotas de Leishmania intracelular. Sin embargo, en órganos como riñones, pulmones, sistema nervioso central, glándula adrenal, ojos, testículos y eventualmente en la piel, el parásito no se reconoce fácilmente 6, 9, 26.
La detección directa del parásito sobre la piel (biopsia), puede ser obtenida a través de un procedimiento quirúrgico muy simple y constituye una buena herramienta para el diagnóstico definitivo y para el seguimiento clínico de perros bajo tratamiento médico. Sin embargo, particularmente en la piel, el examen de preparados histopatológicos de rutina coloreados con hematoxilina y eosina, son frecuentemente inconclusos 3, 21, 26.
La detección inmunohistoquímica de amastigotes de Leishmania sp en secciones de tejidos caninos fijados en formol y embebidas en parafina, son rutinariamente utilizados en los laboratorios 3. El diagnóstico de LV puede no ser exitoso debido a la baja sensibilidad de los métodos histológicos tradicionales para detectar el parásito. Los métodos inmunohistoquímicos para su detección en tejidos son simples, no necesitan equipamiento especial y son altamente sensibles y específicos 3,17. Además, el método inmunohistoquímico para la detección de LV en piel aumentó el 50% de certidumbre en comparación con los métodos histológicos de rutina.
En la LV canina la cantidad de parásitos presentes en la piel es crítico por constituir la fuente de infección para el flebótomo y consecuentemente la transmisión al hombre. Las manifestaciones clínicas de la infección no están necesariamente relacionadas a la carga parasitaria. Por lo tanto, perros asintomáticos pueden ostentar parásitos cutáneos en cantidad similar a perros sintomáticos, mientras que perros sintomáticos con una intensa carga parasitaria en distintos órganos, pueden no poseer parásitos detectables en piel 2, 26.
Actualmente la confirmación parasitológica de LV no es posible en todos los casos. El cultivo, aunque es el método más sensible y en ocasiones es capaz de convalidar por sí solo el diagnóstico, puede presentar problemas de contaminación 27. El frotis de la lesión y la coloración con Giemsa, constituyen procedimientos fáciles y rápidos pero son de mayor ayuda cuando hay un número considerables de amastigotes. En caso contrario prevalecerá la alternativa de la biopsia histopatológica, la cual generalmente requiere de una búsqueda prolongada para visualizar el parásito 13, 18.
Muchas veces, mediante un simple frotis se pueden detectar las leishmanias en muestras que resultan negativas para inmunoperoxidasa. Por ello, la combinación de estos dos métodos incrementa la proporción de casos diagnosticados hasta un 72%. Esto indica la importancia de aplicar varios procedimientos para llegar a un diagnóstico definitivo de leishmaniosis y resalta la necesidad de emplear métodos aún más sensibles 24.
El objetivo de este estudio fue evaluar las técnicas consideradas más sensibles y específicas para el diagnóstico de LV, utilizando biopsias de piel teñidas con hematoxilina y eosina, sobre las cuales se aplicaron técnicas de inmunohistoquímica. Además, se obtuvieron muestras citológicas que se colorearon con Giemsa para luego aplicarse técnicas de inmunocitoquímica. Los casos incorporados en el estudio fueron diagnosticados previamente mediante exámenes clínicos y serológicos.
MATERIAL Y MÉTODOS
Se obtuvieron muestras de caninos procedentes principalmente de clínicas privadas de la ciudad de Corrientes, Argentina. Asimismo, según solicitud pertinente, se incluyeron a aquéllos procedentes de campañas realizadas por distintos organismos municipales y/o provinciales. También se tomaron muestras de perros que habitaban o frecuentaban lugares del nordeste argentino donde se constató la presencia de flebótomos infectados.
En total fueron seleccionados 42 pacientes con diagnóstico serológico reactivo a leishmaniosis. A los animales positivos a la prueba serológica realizada con tiras reactivas Rk39 Kala Azar Detect, se les extrajeron muestras para examen parasitológico directo por punción de médula ósea, con posterior ejecución de técnica inmunocitoquímica y tinción Giemsa.
También se obtuvieron muestras por biopsias de piel provenientes del pabellón auricular. Con los bloques parafinados obtenidos mediante el procesamiento de tejidos por la técnica histológica clásica, se realizaron cortes para histopatología con posterior coloración de HyE e inmunohistoquímica. Para esta última, las muestras fueron desparafinadas y rehidratadas. La recuperación de antígenos se realizó sumergiendo las muestras en solución de acido cítrico con pH 6 y luego tratándolas en un horno microondas. La actividad peroxidasa endógena fue bloqueada mediante solución de peróxido de hidrógeno con metanol al 3% durante 20 min. Las interacciones inespecíficas fueron bloqueadas con suero normal equino en dilución 1/20 con PBS estéril (phosphate buffered saline) durante 30 min en cámara húmeda a temperatura ambiente.
Se utilizó anticuerpo primario policlonal anti Leishmania chagasi (elaborado en nuestro laboratorio) en dilución 1/500, con posterior incubación en cámara húmeda a 4ºC toda la noche. Al día siguiente se efectuó la incubación con el anticuerpo secundario biotinilado (AM-B1-UNL) en dilución 1/100 a temperatura ambiente por 30 min y luego exposición de 30 min a extravidina (Sigma) en dilución 1/200 y solución DAB (3,3-diaminobenzidine) durante 1 min. Entre cada paso, las muestras fueron lavadas con PBS
Para la técnica de citoinmunohistoquímica el procedimiento fue el mismo, pero no se realizó recuperación de antígenos. Las imágenes fueron captadas por microscopio óptico Carl Zeiss provisto con cámara fotográfica.
RESULTADOS Y DISCUSIÓN
En los 42 animales, la observación microscópica de los extendidos de médula ósea coloreados con Giemsa, posibilitó la detección de amastigotes de Leishmania sp (Figura 1). En algunos casos también pudieron identificarse otros microorganismos como Erlichia canis y Hepatozoon canis, los cuales presentan similar sintomatología que la LV
Con la técnica inmunocitoquímica (Figura 2), solo el 70% de las muestras reaccionó a esta prueba marcando los parásitos, presentando el inconveniente del “marcado background” y tinción de núcleos celulares. En los cortes histológicos se pudieron identificar amastigotes de Leishmania sp con la técnica inmunohistoquímica en el 100% de los casos (Figura 3), los cuales no se identificaron con la coloración HyE (Figura 4).
Todas las muestras obtenidas presentaron infiltrado inflamatorio linfoplasmocitario con HyE, sin embargo, el 65% de las muestras dieron positivas a la presencia de amastigotes, coincidiendo con los animales que presentaron sintomatología clínica compatible con LV.
En conclusión, se resalta que la técnica más sensible y específica para el diagnóstico de LV varía de acuerdo al tipo de muestra tomada. En el caso de bloques parafinados la técnica inmunohistoquímica mostró mayor sensibilidad en la detección de amastigotes de Leishmania sp, resultando útil incluso cuando los parásitos estuvieron presentes en escasa cantidad. En el caso de las muestras citológicas la mayor utilidad recayó en la coloración con Giemsa, ya que permitió detectar no solo la presencia de amastigotes del parásito, sino también de otros microorganismos cuyos síntomas se podrían confundir con LV.
Figura 1. Punción de médula ósea. Se observan numerosos parásitos dentro y fuera de un macrófago. Giemsa 100x
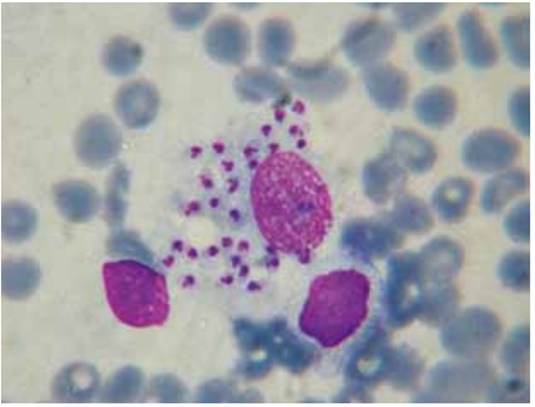
Figura 2. Inmunocitoquímica de médula ósea. Macrófago con numerosos amastigotes de Leishmania teñidos de color marrón. 100x

Figura 3. Inmunohistoquímica de piel. En el intersticio se identifican macrófagos con numerosos amastigotes de Leishmania teñidos de color marrón. 100x

Figura 4. Piel teñida con HyE. En el intersticio se observa infiltrado inflamatorio mononuclear. No se visualizan microorganismos de Leishmania. 100x

1. Abranches P, Silva MC, Conceiçao FM, Santos GM, Janz JG. 1991. Canine leishmaniasis: pathological and ecological factors influencing transmission of infection. J Parasitol 77: 557-561 [ Links ]
2. Abranches P, Campino L, Santos GM. 1998. Leishmaniose canina: novos conceitos de epidemiologia e imunopatologia e seus reflexos no controlo da leishmaniose visceral humana. Acta Méd Port 11: 871-875 [ Links ]
3. Bourdoiseau G, Marchal T, Magnol JP. 1997. Immunohistochemical detection of Leishmania infantum in formalin fixed, paraffin-embedded sections of canine skin and lymphnodes. J Vet Diagn Invest 9: 439-440. [ Links ]
4. Deane LM, Deane MP. 1962. Visceral leishmaniasis in Brazil. Geographical distribution and transmission. Rev Inst Med Trop 4: 198-212 [ Links ]
5. Ferrer L, Rabanal R, Domingo M, Ramos JA, Fondevila D. 1988. Identification of leishmania amastigotes in canine tissues by immunoperoxidase staining. Res Vet Sci 44: 194-196. [ Links ]
6. Ferrer L, Rabanal R, Fondevila D, Ramos JA, Domingo M. 1988. Skin lesions in canine leishmaniosis. J Small Canin Prac 29: 381-388. [ Links ]
7. Ferrer L. 1994. Leishmaniasis. In: Terapeutica Veterinaria (Kirk R, Bonagura J, edit.), Interamericana-McGrawHill, Madrid, p. 296-301. [ Links ]
8. Ferrer L. 2002. The pathology of canine leishmaniasis. Proceed 2nd Internat Canine Leishm Forum, Sevilla, España, p. 21-24. [ Links ]
9. Goncalves R, Tafuri WL, Melo MN, Raso P, Tafuri WL. 2003. Chronic interstitial pneumonitis in dogs naturally infected with Leishmania chagasi: histopathological and morphometrical study. Rev Inst Med Trop Sao Paulo 45: 153-158. [ Links ]
10. Grandoni L, Maroli M, Gramiccia M, Mancianti M. 1987. Leishmania infantum infection rates in Phlebotomus perniciosus fed don natural infected dogs under antimonial treatment. Med Vet Entomol 1: 339-342. [ Links ]
11. Herwaldt B. 1999. Leishmaniasis. Lancet 354: 1191-1199 [ Links ]
12. Keenan CM, Hendricks LD, Lightner L, Johnson AJ. 1984. Visceral leishmaniasis in the German shepherd dog: II. Pathology. Vet Pathol 21: 80-86. [ Links ]
13. Kerdel F, Essenfeld E. 1996. Histopatología de la leishmaniasis americana. Medicina Cutánea 3: 267-276 [ Links ]
14. Koutinas AF, Scott DW, Kantos V, Lekkas S. 1992. Skin lesions in canine leishmaniosis (kala-azar): A clinical and histopathological study on 22 spontaneous cases in Greece. Vet Dermatol 3: 121-130. [ Links ]
15. Koutinas AF, Polizopoulou ZS, Saridomichelakis MN, Argyriadis D, Fytianou A, Plevraki KG. 1999. Clinical considerations on canine visceral leishmaniasis in Greece: a retrospective study of 158 cases (1989-1996). J Am Anim Hosp Assoc 35: 376-383. [ Links ]
10. Grandoni L, Maroli M, Gramiccia M, Mancianti M. 1987. Leishmania infantum infection rates in Phlebotomus perniciosus fed don natural infected dogs under antimonial treatment. Med Vet Entomol 1: 339-342. [ Links ]
11. Herwaldt B. 1999. Leishmaniasis. Lancet 354: 1191-1199
12. Keenan CM, Hendricks LD, Lightner L, Johnson AJ. 1984. Visceral leishmaniasis in the German shepherd dog: II. Pathology. Vet Pathol 21: 80-86.
13. Kerdel F, Essenfeld E. 1996. Histopatología de la leishmaniasis americana. Medicina Cutánea 3: 267-276 [ Links ]
14. Koutinas AF, Scott DW, Kantos V, Lekkas S. 1992. Skin lesions in canine leishmaniosis (kala-azar): A clinical and histopathological study on 22 spontaneous cases in Greece. Vet Dermatol 3: 121-130.
15. Koutinas AF, Polizopoulou ZS, Saridomichelakis MN, Argyriadis D, Fytianou A, Plevraki KG. 1999. Clinical considerations on canine visceral leishmaniasis in Greece: a retrospective study of 158 cases (1989-1996). J Am Anim Hosp Assoc 35: 376-383. [ Links ]
16. Lainson P. 1988. Ecological interactions in the transmission of the leishmaniasis. Philos Trans R Soc Lond B 321: 389-404. [ Links ]
17. Livni N, Abramowitz A, Londner M, Okon E, Morag A. 1983. Immunoperoxidase method of identification of Leishmania in routinely prepared histological sections. Virchows Arch Pathol Anat 401: 147-151. [ Links ]
18. Magalhaes AV, Moraes MA, Raick AN, Llanos AM, Costa J, Cuba C, Marsden PD. 1986. Histopatologia da leishmaniose tegumentar por Leishmania braziliensis braziliensis. Padroes histopatológicos e estudo evolutivo das lesoes. Rev Inst Med Trop Sao Paulo 28: 253-262. [ Links ]
19. Miró G, Fraile C. 1999. Leishmaniosis canina: revisión práctica. Consult Dif Vet 7: 63-74 [ Links ]
20. Moreno J, Alvar J. 2002. Canine leishmaniasis: epidemiological risk and the experimental model. Trends Parasitol 18: 399-405. [ Links ]
21. Palma G, Gutierrez Y. 1991. Laboratory diagnosis of Leishmania. Clin Lab Med 11: 902-922. [ Links ]
22. Restrepo M, Gómez ME. 1983. La reacción de inmunofluorescencia indirecta en el diagnóstico de la leishmaniasis tegumentaria americana. Biomédica 3: 15-21. [ Links ]
23. Rioux JA, Lanotte G, Croset H, Dedet JP. 1972 . Ecologie des leishmaniosis dans le Sud de la France. 5. Pouvoir infestant comparé des diverses formes de leishmaniose canine vis-a vis de Phlebotomus ariasi Tonnoir 1921. Ann Parasitol Hum Comp 47: 413-419. [ Links ]
24. Roze M. 1988. La leishmaniose et l’oeil. Prat Méd Chir Anim Compag 23: 49-55.
25. Slappendel RJ. 1988. Canine leishmaniasis: a review based on 95 cases in the Netherlands. Vet Q 10: 1-16. [ Links ]
26. Sundar S, Rai M. 2002 Laboratory diagnosis of visceral leishmaniasis. Minireview. Clin Diag Lab Immunol 9: 951-958. [ Links ]
27. Travi BL, Tabares CJ, Cadena H, Ferro C, Osorio Y. 2001. Canine visceral leishmaniasis in Colombia: relationship between clinical and parasitological status and infectivity for sandflies. Am J Trop Med Hyg 64: 119-124. [ Links ]
28. Tryphonas L, Zawidzka Z, Bernard MA, Janzen EA. 1977. Visceral leishmaniasis in a dog: clinical, hematological and pathological observations. Can J Comp Med 41: 1-12. [ Links ]














