INTRODUCCIÓN
La enfermedad de Chagas, causada por el protozoario Trypanosoma Cruzi (T. cruzi) es una patología endémica de América Latina que ha trascendido a nivel mundial a causa de la migración de aquellos infectados en las últimas décadas. Afecta a un número aproximado de 6 millones de personas en la región. Según estimaciones recientes de la Organización Panamericana de la Salud (OPS), se registran 30 000 casos nuevos anuales, lo que motiva 12 000 muertes cada año, considerándose un notable problema de salud pública que tiene una fuerte asociación con un déficit en aspectos socio-económico-culturales. 1
Estudios longitudinales revelan que 25 a 35% de los infectados evolucionan hacia la fase crónica de la enfermedad, caracterizada principalmente por la afección gastrointestinal y cardíaca; esta última es la manifestación clínica más frecuente y de mayor impacto en la morbimortalidad. 2 La Miocardiopatía Chagásica (MCh) se caracteriza por la presencia de miocarditis crónica, fibrosis, lesión microvascular y remodelación cardíaca que causan lesiones del sistema de conducción, aparición de eventos embólicos, formación de aneurismas ventriculares apicales o posterobasales, y progresión hacia la forma dilatada en un 10% de los casos 3,4 Años atrás, la MCh era considerada una potencial contraindicación para un trasplante cardíaco (TxC) debido a la alta incidencia de reactivación (Ra) de la enfermedad, asociada al tratamiento inmunosupresor y al tratamiento del rechazo agudo del injerto. En la actualidad,el TxC está establecido como una opción terapéutica eficaz y segura en aquellos pacientes que evolucionan con insuficiencia cardíaca avanzada. 5,6
El diagnóstico de Ra de Chagas se realiza mediante la detección del parásito en sangre o en tejidos. Resulta imprescindible una estrategia de seguimiento con métodos diagnósticos específicos que se anticipen a la aparición de síntomas, ya que si la Ra es tratada de forma precoz y adecuada, raramente evoluciona de manera tórpida. Los episodios de Ra pueden ser asintomáticos o tener gran variabilidad en la presentación clínica: síntomas inespecíficos, afección cutánea, miocarditis, y con menor frecuencia afección del sistema nervioso central. 7,8
El principal objetivo de este trabajo es comparar la supervivencia de pacientes trasplantados cardíacos por MCh frente a aquellos trasplantados por otras causas, así como analizar el impacto en la supervivencia a corto y mediano plazo en aquellos que reactivaron la enfermedad de Chagas en un centro de alta complejidad en América Latina.
MATERIAL Y MÉTODOS
Población y definición de variables
Se evaluaron retrospectivamente pacientes con TxC en el Hospital Universitario Fundación Favaloro entre agosto de 1998 y marzo de 2021. Se analizó la supervivencia de pacientes con TxC por MCh en comparación con aquellos trasplantados por otras causas.
En todos los pacientes se realizó seguimiento clínico y biopsias de vigilancia según el protocolo institucional. El diagnóstico de Ra se realizó mediante PCR-ADNk (minicircle sequences Polymerase Chain Reaction) y PCR SL-ADN (spliced leader )9,10, prueba de Strout en sangre periférica, tejido miocárdico y/o cutáneo. El tratamiento utilizado en casos de Ra fue benznidazol (5 mg/kg/día) durante 60 días. Como terapia alternativa en caso de presentarse intolerancia se planteó el uso de nifurtimox. En el postoperatorio inmediato se inició tratamiento inmunosupresor con esteroides, inhibidores de la calcineurina (tacrolimus o ciclosporina), y antiproliperativos (azatioprina en TxC MCh y micofenolato en TxC no chagásicos).
El diagnóstico de rechazo del injerto se realizó a partir de la sospecha clínica y ecocardiográfica y se confirmó mediante biopsia endomiocárdica (BEM) considerándose positivos aquellos con grado ≥2R (clasificación ISHLT 2004) o ≥3A (clasificación ISHLT 1990) en caso de los rechazos celulares y pAMR ≥1 (Immunopathologic or Histologic pathologic Antibody Mediated Rejection - clasificación ISHLT 2011). 11,12
El tratamiento instaurado fue metilprednisolona en rechazo celular aislado y asociado a plasmaféresis, anticuerpos policlonales e inmunologlobulina en los rechazos mediados por anticuerpos o mixtos. La presencia de enfermedad vascular del injerto (EVI) fue evaluada mediante cinecoronariografía y ecografía intravascular. 13
Análisis estadístico
Las variables continuas fueron expresadas como media ± desviación estándar o mediana y rango intercuartilo (RIC 25%-75%) según fuera su distribución Gaussiana o no, y las categóricas como porcentajes y valores absolutos. Se utilizó test de t o Mann Whitney para la comparación de variables continuas según la distribución normal o no, y test de Fisher para comparación de las variables nominales. Se analizó la supervivencia a 1, 5 y 10 años en un modelo de Mantel-Cox¸ se graficaron las curvas correspondientes mediante KaplanMeier y se compararon con log rank test. Se consideró significativa una p<0,05.
RESULTADOS
Características basales de la población
Se incluyeron 606 pacientes con TxC desde agosto de 1998 a marzo de 2021. Las etiologías más frecuentes fueron la miocardiopatía no isquémica (41%) e isquémica (31%). El programa de TxC para pacientes con enfermedad de Chagas en nuestro centro se inició hace 23 años. Desde entonces se realizaron 39 (6,4%) T×C en pacientes con MCh en estadío avanzado (Figura 1). La mediana de seguimiento de la población fue de 4,4 años (RIC 1,2-8,6).
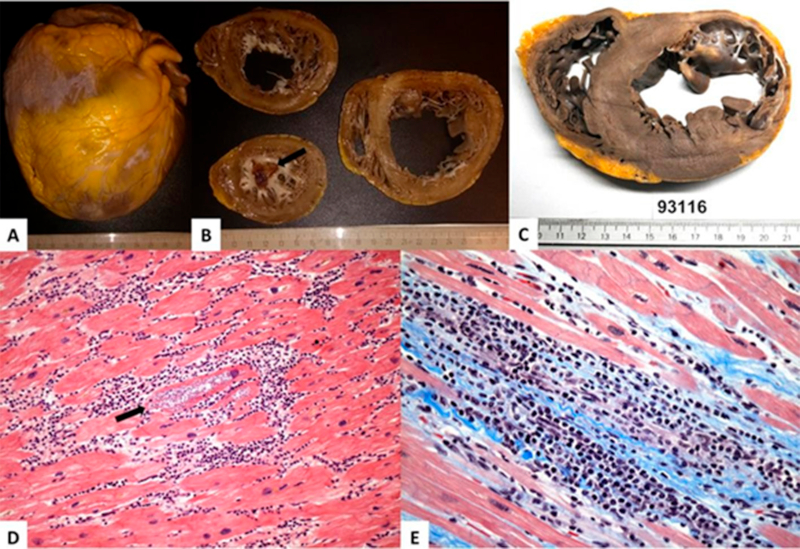
Fig. 1 Explantes con Miocardiopatía Chagásica dilatada crónica. A. Aspecto macroscópico del corazón nativo de un paciente trasplantado por Miocardiopatía dilatada Chagásica crónica. Se observa pericardio con áreas blanquecinas levemente sobreelevadas a nivel de la cara anterior derecha, que siguen las ramas de la arteria coronaria descendente anterior, y en el ápex ventricular. B. Cortes seriados del mismo caso por el eje corto. Cavidades cardíacas de aspecto dilatado, con endocardio engrosado, de coloración blanquecina y con trombo adherido a nivel del ápex ventricular (flecha). C. Aspecto macroscópico del corazón nativo de un paciente trasplantado por Miocardiopatía Chagásica crónica. Se observa aneurisma ventricular a nivel de la pared posterolateral del ventrículo izquierdo. D. Aspecto histológico de un corte del tabique interventricular de un corazón nativo. Se observan cardiomiocitos con nidos de amastigotes (flecha), rodeados por infiltrado inflamatorio intenso a predominio mononuclear. (Hematoxilina-eosina x200). E. Aspecto histológico de un área con miocarditis intensa, con daño de cardiomiocitos y fibrosis de tipo de reemplazo. (Tricrómico de Masson x400).
Las características basales de los pacientes con MCh sometidos a T×C se muestran en la Tabla 1. La mediana de edad fue 51 años (RIC 41-59), hombres 28 pacientes (72%). Se empleó VA ECMO (Venoarterial Extracorporeal Membrane Oxygenation) en 17 pacientes, balón de contrapulsación intraaórtico en 1 paciente, Berlin Excor Univentricular en 1 paciente; se operaron en situación de emergencia 19 pacientes (48,7%), urgencia 14 pacientes (35,9%) y en forma electiva 6 pacientes (15,4%). Se realizó trasplante cardio-renal en un solo paciente. Se realizó inducción con timoglobulina a 6 pacientes (15,4%). La inmunosupresión inicial se basó en esteroides, ciclosporina y azatioprina. En una segunda etapa, se modificó a un esquema de novo con esteroides, tacrolimus y azatioprina. Durante el seguimiento, en los primeros 6 meses pos trasplante, se intentó reducción progresiva de las dosis de esteroides hasta su suspensión. En aquellos pacientes con más de dos episodios de rechazo, se reemplazó la azatioprina por micofenolato. En caso de falla renal o EVI se indicó tratamiento con m-TOR (rapamicina o everolimus). Se evidenciaron ≥2 episodios de rechazo celular >2R en 11 pacientes (28,2%). Dos pacientes presentaron rechazo mediado por anticuerpos (pAMR ≥1). El 15,4% de los pacientes desarrollaron neoplasias: carcinomas cutáneos (2 pacientes), enfermedad linfoproliferativa post trasplante (3 pacientes) y carcinoma renal (1 paciente). El 23,1% de los pacientes desarrolló EVI a los 5 años del trasplante (Tabla 2). Las principales causas de muerte fueron sepsis y rechazo del injerto.
Tabla 1 Características basales de los pacientes con Miocardiopatía Chagásica
| Variable | Población total (n = 39) | |
|---|---|---|
| Características del receptor | ||
| Edad (años), mediana y RIC | 51 (45-60) | |
| Sexo masculino, n (%) | 28 (71,8%) | |
| IMC (kg/m2), mediana y RIC | 23,3 (20-26,2) | |
| Comorbilidades [n (%)] | ||
| Diabetes, n (%) | 3 (7,7%) | |
| Tabaquismo, n (%) | 12 (30,8%) | |
| Situación en lista de espera [n (%)] | ||
| Electiva, n (%) | 6 (15,4%) | |
| Urgencia, n (%) | 14 (35,9%) | |
| Emergencia, n (%) | 19 (48,7%) | |
| Características del donante | ||
| Sexo masculino, n (%) | 33 (84,6%) | |
| Edad (años) | 22 (17,7-27) | |
IMC: índice de masa corporal
RIC: rango intercuartilo
Tabla 2 Seguimiento post trasplante en Miocardiopatía Chagásica
| Variable | Población (n = 39) | |
|---|---|---|
| Complicaciones inmunológicas [n (%)] | ||
| ≥2 Rechazo Celular >2R | 11 (28,2%) | |
| Rechazo mediado por anticuerpos | 2 (5,1%) | |
| EVI | 9 (23,1%) | |
| Neoplasias [n (%)] | 6 (15,4%) | |
| Carcinomas cutáneos | 2 (33,3%) | |
| Enfermedad linfoproliferativa post trasplante | 3 (50%) | |
| Carcinoma renal | 1 (16,7%) | |
| Reactivación [n (%)] | 15 (38,5%) | |
| 90 días post trasplante | 8 (53,3%) | |
| Post tratamiento de rechazo | 11 (73,3%) | |
| Tipo de reactivación [n (%)] | ||
| Parasitemia | 5 (33,3%) | |
| Cutánea | 7 (46,7%) | |
| Miocarditis | 2 (13,3%) | |
| Mixta | 1 (6,7%) | |
EVI: enfermedad vascular del injerto
Reactivación
Se documentó Ra de enfermedad de Chagas en 15 pacientes (38,5%), de los cuales 5 presentaron parasitemia, 7 compromiso cutáneo (Figura 2 A-E), 2 miocarditis y 1 reactivación mixta causada por compromiso cutáneo y miocarditis (Figura 2 F-J). El 53,3% de los que reactivaron presentaron Ra dentro de los 90 días post T×C, y el 73,3% posteriormente al tratamiento de rechazo. Todos los episodios fueron tratados exitosamente con benznidazol.
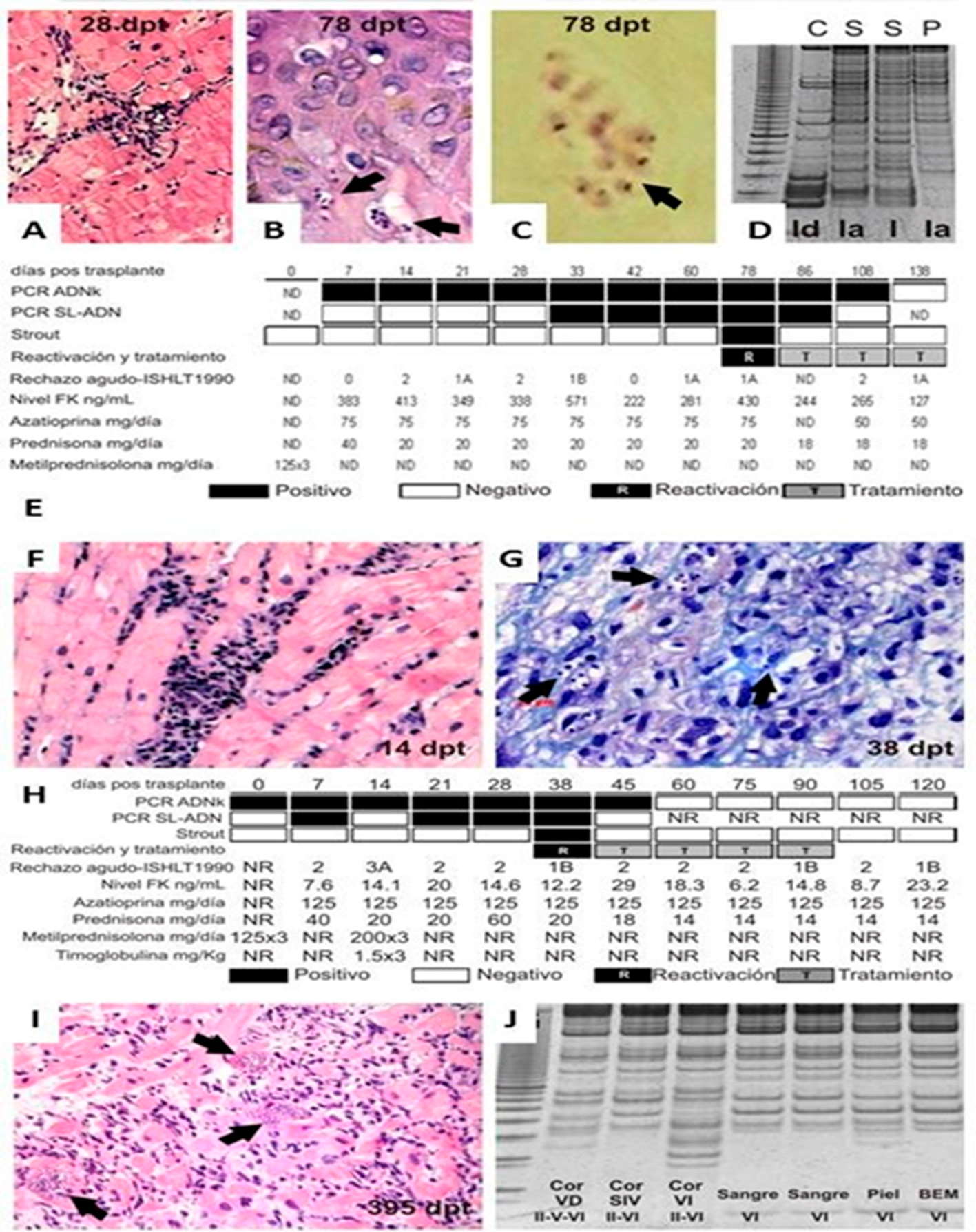
Fig. 2 Reactivación de Chagas pos trasplante. A. Biopsia endomiocárdica de control (día 28 post-trasplante), con infiltrado linfocitario leve y daño focal de cardiomiocitos (rechazo celular leve). B. Biopsia cutánea tomada el día 78 post-trasplante. Se observan nidos de amastigotes en la unión dermo-epidérmicas (flechas). (Hematoxilina-eosina x400). C. Magnificación de un nido de amastigotes. (Tricrómico de Gallego x1000). D. Análisis electroforético de perfiles de fragmentos de restricción obtenidos a partir de amplicones de PCR-ADNk. Las unidades de tipificación discretas (UTDs) obtenidas tanto del corazón nativo (C), sangre periférica (S) y piel (P) (sitio de la reactivación) corresponden a T. cruzi tipo1. E. Seguimiento pos trasplante cardíaco del paciente. PCR ADNk = detección de ADN de la región del kinetoplasto de T. cruzi (límite de detección en sangre = 1 parásito /10mL); PCR SL-ADN = PCR con gen principal empalmado (límite de detección en sangre = 200 parásitos /10 mL). FK = Tacrolimus. NR = No realizado. Se muestra episodio de reactivación y tratamiento mediante benznidazol, incidencia de rechazo, niveles de tacrolimus y dosis de drogas inmunosupresoras. F. Biopsia endomiocárdica del septum interventricular derecho del día 14 pos trasplante de otro paciente. Se observan varios focos con infiltrado mononuclear y daño de cardiomiocitos (Rechazo celular grado 3A - según la clasificación de la ISHLT 1990). (Hematoxilina-eosina x400). G. Biopsia cutánea del día 38 pos trasplante. Tejido subcutáneo con nidos de amastigotes (flechas) e infiltrado inflamatorio intenso de mono y polimorfonucleares. (Giemsa x1000). H. Seguimiento pos trasplante del paciente. I. Biopsia endomiocárdica de control, realizada a los 395 días pos trasplante. Miocarditis chagásica aguda (reactivación). Se observan numerosos nidos de amastigotes en cardiomiocitos, edema e intenso infiltrado inflamatorio constituido por mono y polimorfonucleares. (Hematoxilina - eosina x400). J. Análisis electroforético de perfiles de fragmentos de restricción obtenidos a partir de amplicones de PCR-ADNk (RFLP-PCR) en geles teñidos con Sybr green, en el corazón explantado, en sangre y en los sitios de reactivación durante el seguimiento pos trasplante. Cor = corazón explantado. VD = ventrículo derecho. SIV = septum interventricular. VI = ventrículo izquierdo. BEM = Biopsia endomiocárdica. Al pie figuran las UTDs de T. cruzi demostradas mediante el análisis de sangre y tejidos. En este caso se trató de una cepa monoclonal Tc VI.
Supervivencia
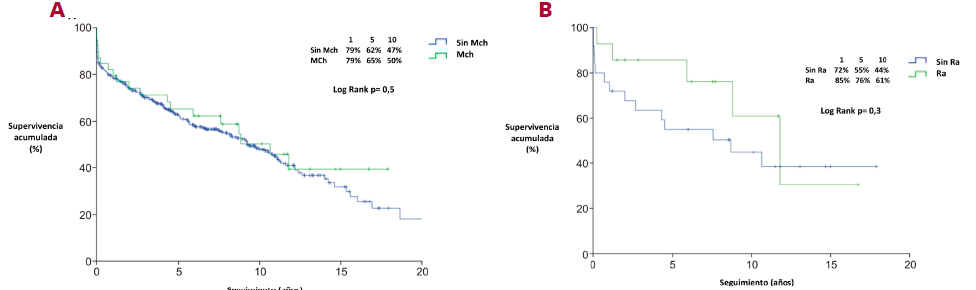
En lo que respecta la supervivencia a 1, 5 y 10 años, no hubo diferencias estadísticamente significativas entre los pacientes con TxC por MCh frente a TxC por otras etiologías (79%, 65% y 50% versus 79%, 62% y 47% respectivamente; p=0,5) (Figura 3A). La supervivencia a 1, 5 y 10 años de TxC por MCh que reactivaron la enfermedad frente a aquellos que no presentaron Ra, fue de 85%, 76% y 61% versus 72%, 55% y 44% (p= 0,3). (Figura 3B).
DISCUSIÓN
En nuestra serie, observamos una incidencia de Ra similar a la reportada en la literatura. La incidencia elevada de Ra de la infección por T. cruzi en los pacientes con T×C varía entre el 23% y el 75%. 7 La misma ha sido vinculada al tratamiento del rechazo agudo del injerto y a la utilización de micofenolato mofetil como droga inmunosupresora.5,14 Si bien se ha descripto que este último fármaco aumenta la incidencia de Ra de la enfermedad de Chagas en comparación con la azatioprina, no existe evidencia lo suficientemente fuerte para definir cuál es el esquema ideal de inmunosupresión para el paciente trasplantado por MCh. 15,16 En la población analizada, el tratamiento inmunosupresor de mantenimiento se basó en un triple esquema: esteroides, inhibidores de la calcineurina (ciclosporina o tacrolimus) y antiproliferativos (azatioprina o micofenolato mofetil). En aquellos pacientes que presentaron más de dos rechazos, se reemplazó la azatioprina por micofenolato, según lo mencionado. Los inhibidores de mTOR fueron de elección frente a los inhibidores de la calcineurina en pacientes con insuficiencia renal progresiva o EVI.
Los pacientes chagásicos requieren un monitoreo cercano para la detección temprana de los episodios de Ra. Son dos las circunstancias en las cuales existe un mayor riesgo de Ra de enfermedad: los primeros meses posteriores al trasplante y luego del tratamiento de un episodio de rechazo, situaciones en donde se intensifica el esquema inmunosupresor.
Los episodios de Ra pueden ser completamente asintomáticos o manifestarse con compromiso subcutáneo (nódulos o paniculitis), miocarditis, y en menor frecuencia, afectar el sistema nervioso central (meningoencefalitis o absceso cerebral). Si bien el diagnóstico clínico de Ra requiere de la presencia de un cuadro clínico compatible, así como evidencia parasitológica, el diagnóstico diferencial entre el rechazo del injerto y la Ra resulta un desafío y en ocasiones puede dificultar el inicio temprano del tratamiento adecuado 15 Esto se atribuye a dos factores principales: los infiltrados inflamatorios presentes en la BEM son similares a aquellos encontrados en el escenario de un rechazo; y los nidos de amastigotes de T. cruzi característicos de la miocarditis son un hallazgo histopatológico poco frecuente. Si bien el gold standard para documentar la Ra es la observación microscópica del parásito en sangre mediante el método de Strout (gota gruesa), éste tiene poca sensibilidad debido a los bajos niveles de parasitemia al inicio de los eventos de Ra. Por otro lado, las pruebas serológicas no son útiles debido a la positividad de las mismas en la fase crónica de la enfermedad. En las últimas décadas, el desarrollo de métodos moleculares cobró relevancia. 9,10,17 La detección de ADN mediante técnicas de PCR han permitido el diagnóstico precoz, anticipándose a la fase sintomática de la reactivación de Chagas y a la presencia microscópica de tripomastigotes; así como el seguimiento y respuesta al tratamiento. 5,16,17
En la actualidad, no existen protocolos universalmente validados de screening y monitoreo en el seguimiento de los pacientes con TxC por MCh por ausencia de evidencia robusta y concluyente sobre el tema. Por tal motivo, la aplicabilidad de los mismos es individualizada de acuerdo a los protocolos de cada institución, y se basará también en la disponibilidad de recursos técnicos, humanos y el contexto socioeconómico de los pacientes. Una forma de consolidar las decisiones en estos escenarios clínicos complejos es mediante el desarrollo de algoritmos acordados y validados internamente por el equipo multidisciplinario tratante formado por especialistas en insuficiencia cardíaca avanzada, infectólogos y anatomopatólogos.
En nuestro trabajo, en forma similar a lo reportado por Bestetti y col en una revisión sistemática en Brasil, se observó una sobrevida similar en receptores de trasplante cardíaco con enfermedad de Chagas frente a aquellos no infectados con T. cruzi.7,15
Entre las limitaciones del trabajo cabe mencionar que se trata de un estudio retrospectivo, unicéntrico, con una subpoblación reducida de pacientes con MCh, la cual podría no ser suficiente para demostrar diferencias estadísticamente significativas. De todas formas, dicha población presentó un período prolongado de seguimiento. Futuros análisis prospectivos y multicéntricos que incluyan un mayor número de pacientes, nos permitirán determinar cuál es el esquema inmunosupresor más apropiado en los mismos y desarrollar protocolos universales que permitan un monitoreo estrecho durante el seguimiento.
CONCLUSIONES
A lo largo de las décadas, nuestra experiencia institucional continúa sosteniendo que el trasplante cardíaco es un tratamiento seguro y eficaz en los pacientes con Miocardiopatía Chagásica ya que se asocia con una supervivencia similar a aquellos trasplantados por otras causas. Si bien la reactivación de la infección por Trypanosoma Cruzi es una complicación frecuente, las terapéuticas disponibles en la actualidad implementadas de manera oportuna, han demostrado una evolución favorable en el seguimiento de estos pacientes, sin impacto en su pronóstico.