Introducción
El éxito de las malezas en los sistemas cultivados depende de los atributos que le confieren capacidad para sobrevivir a los disturbios y de adaptarse a las características ambientales del lugar (Cousens y Mortimer, 1995). En Argentina en los últimos 25 años el manejo del cultivo de soja se modificó produciendo cambios cualitativos y cuantitativos en la comunidad de malezas (de la Fuente et al., 2006, 2010). Estos cambios fueron promovidos al principio por el pasaje de labranza convencional a siembra directa y a partir de 1997 por la introducción de cultivares transgénicos resistentes a glifosato (Tuesca et al., 2001; Tuesca y Puricelli, 2007; Puricelli y Faccini, 2009). En la actualidad, con más del 90% de la tierra cultivada bajo siembra directa (Aapresid, 2018), las gramíneas anuales se han transformado en el principal grupo de malezas (Leguizamón et al., 2006; Cabrera y de la Vega, 2018).
El enfoque más utilizado para solucionar el problema de las malezas en cultivos extensivos consiste en el uso masivo de herbicidas (Scursoni et al., 2019). En los últimos 15 años el uso de herbicidas se incrementó en un 250%, representando el glifosato el 62% del volumen comercializado (CASAFE, 2015). Desafortunadamente, el uso extensivo de esta molécula dentro de una gran variedad de sistemas de cultivos ha provocado la aparición de 43 especies resistentes a nivel mundial (Heap, 2019), entre ellas, Urochloa panicoides P. Beauv.
El uso del glifosato quedó circunscripto a un enfoque de corto plazo que considera sólo la eliminación de la competencia, sin tener en cuenta la verdadera escala espacio-temporal en la que se produce el proceso de enmalezamiento (Guglielmini et al., 2003), en donde, la biología de la especie es un aspecto clave e indispensable para un manejo integrado del problema (Cabrera y de la Vega, 2018). Dentro de los aspectos biológicos de las malezas, el patrón de emergencia, definido como el número de cohortes, nacimientos o flujos de plántulas a partir de semilla, permite identificar el momento oportuno de control (Cabrera y de la Vega, 2018). Un seguimiento adecuado de la presencia de malezas en el cultivo permite evitar, por ejemplo, el escape a herbicidas de especies que emergen tarde en la estación o que poseen un período de emergencia prolongado (Burke et al., 2003; Puricelli y Tuesca, 2005; Scursoni et al., 2007). El patrón de emergencia de una maleza tiene una gran influencia en su habilidad para tomar recursos y producir descendencia (Lindquist et al., 1995; Verdú y Mas, 2006) y puede afectar la efectividad de algunas prácticas de control. Asimismo, el conocimiento de la dinámica de germinación y emergencia, y los factores que regulan dichos procesos permiten comprender, al menos en parte, el éxito poblacional de las malezas en sistemas cultivados y también usar de forma eficiente y racional diferentes estrategias de control.
Dada esta escasez de alternativas en el conjunto de herbicidas y la baja probabilidad de que se descubra una sustancia activa que pertenezca a un modo de acción diferente, se hace imprescindible la combinación del uso de herbicidas con otros métodos de control (Peerzada et al., 2016). Un aspecto que merece atención son las mezclas entre distintas moléculas herbicidas (Moss et al., 2005; Arvalis, 2006; Beckie, 2006). Estas mezclas sumado a la rotación de modos de acción puede influir en un retraso notable en la aparición de resistencias (Powles et al. 1997; Peerzada et al., 2016). En todo caso, debe conseguirse la suficiente eficacia para que el banco de semillas no se enriquezca con nuevos individuos resistentes a los herbicidas. La modelización ha demostrado que el uso de otros herbicidas como sustitutos, además del glifosato puede retrasar la evolución de la resistencia (Diggle et al., 2003; Werth et al., 2008).
La presión de selección para la resistencia al glifosato es una función de la frecuencia de aplicación de glifosato así como la frecuencia y efectividad de otros métodos de eliminación químicos y no químicos como la labranza y la competencia de cultivos (Thornby et al., 2010).
La especie Urochloa panicoides P. Beauv, de ciclo anual y emergencia estival es nativa de África y fue introducida y naturalizada en el noroeste (NOA) y centro de Argentina (Morrone y Zuloaga, 1992). En el NOA es considerada como la tercera maleza gramínea, la cuarta más frecuente en cultivos estivales (Cabrera y de la Vega, 2018) y se reportaron biotipos resistentes a glifosato (REM, 2018; Varela et al., 2018). En Australia, se confirmó la evolución de biotipos resistentes de esta especie a atrazina (Adkins et al., 1997) y a glifosato (Boutsalis y Preston, 2008). Dentro del espectro de herbicidas disponibles citados para el control de U. panicoides se encuentran los pre-emergentes de las familias de sulfonilureas, triazolpirimidinas, imidazolinonas (inhibidores de la aceto lactato sintasa) y cloracetamidas (inhibidores de ácidos grasos de cadena larga) (Pfeiffer, 2013; Umeda, 2017).
En base a lo expuesto, los objetivos de este trabajo fueron: a) caracterizar cuantitativamente la dinámica de emergencia de U. panicoides en relación a las condiciones ambientales y b) evaluar la eficacia de diferentes alternativas de control químico con herbicidas residuales pre-emergentes sobre biotipos resistentes a glifosato.
Materiales y métodos
Sitio experimental
Los estudios se realizaron en la localidad de Tala Pozo, departamento de Burruyacú de la provincia de Tucumán, Argentina (26° 43’ 09,26’’ S; 64° 47’ 00,02’’ O), en un lote de maíz y soja principalmente, infestado con la maleza U. panicoides. Las características del suelo indican que se trata de un suelo franco limoso y el porcentaje de materia orgánica de 1,9.
Dinámica de emergencia
Los estudios de dinámica de emergencia se realizaron durante las campañas 2015-2016 y 2016-2017. Se marcaron, al azar, 6 cuadrados de 1m2 sobre la superficie a evaluar con alta infestación de la especie. Cada 15 días desde inicios del mes de julio de 2015 hasta fines de junio de 2017, se realizaron conteos destructivos de plántulas. Se registró el número total de plántulas emergidas en cada observación. Asimismo, se registraron la temperatura y las precipitaciones en una estación meteorológica cercana al lote en estudio.
Con los datos de temperatura, se realizó el cálculo de los grados días acumulados (GDDA) para el periodo comprendido desde el 1° de Julio hasta el 30 de junio de cada campaña. Para ello se usó la temperatura base calculada por Ustarroz (2011), el cual confirmó para el biotipo de Córdoba que, una vez embebidas las semillas, se necesitaban 250 GDDA para la germinación. Tomando estos datos como referencia para comparar el biotipo tucumano, se registraron GDDA desde la lluvia previa a las emergencias hasta la emergencia propiamente dicha para estandarizar los datos y poder comparar con el biotipo de Córdoba. Para el cálculo de los grados días se empleó la metodología propuesta por Leblanc et al. (2003), utilizando la siguiente fórmula:
Donde de θT grados días acumulados, i es la fecha a partir de la cual comienza la acumulación de grados días (1° de Julio de cada año) n es el número de días para el cual se calcula el tiempo térmico, T max y T min son la temperatura máxima y mínima diaria, respectivamente y Tb es la temperatura base para la emergencia.
Se realizaron regresiones lineales y no lineales de la emergencia acumulada en función de los GDDA (°C) y de las precipitaciones (mm). Se eligieron los modelos que presentaron el menor valor de AIC (Akaike Information Criterion) (Gualdrón, 2009). El paquete estadístico utilizado fue InfoStat (Di Rienzo et al., 2018).
Experimento de herbicidas residuales preemergentes
El efecto de la aplicación de herbicidas residuales sobre U. panicoides se estudió durante dos campañas sucesivas (2015-2016 y 2016-2017), simulando la realización de barbechos cortos, previo a la siembra de cultivos de verano. El diseño experimental fue en bloques completos al azar con 7 tratamientos y 4 repeticiones. El tamaño de la unidad experimental fue de 5 m de ancho por 8 m de largo; en cada parcela se dejó aproximadamente 1 m sin tratar a modo de testigo apareado con la finalidad de facilitar la evaluación (además de la parcela testigo). Los tratamientos evaluados se detallan en Tabla 1.
Tabla 1 Descripción de los tratamientos herbicidas aplicados para evaluación del control de la maleza Urochloa panicoides. Tala Pozo, Tucumán, Argentina.
| Trat. | Producto | I.A. (g o cm3/l)* | Dosis (g o cm3/ha)** | Grupo (HRAC/WSSA) |
| 1 | Clomazone1 | 630 | 1750 | F4/13 |
| 2 | Clomazone1 | 720 | 2000 | F4/13 |
| 3 | Sulfometuron + Clorimuron1,3 | 15 + 20 | 100 | B/2 + B/2 |
| 4 | Imazetapir1,2 | 106 | 1000 | B/2 |
| 5 | S-metolocloro1,2 | 1440 | 1500 | K3/15 |
| 6 | Diclosulam1 | 33,6 | 40 | B/2 |
*I.A. Ingrediente Activo. Concentración del ingrediente activo en el producto comercial formulado
**Dosis de producto comercial
1Soja
2Maiz
3Barbecho
Previo, a la implementación del ensayo, la primera cohorte de U. panicoides fue controlada con un herbicida post-emergente de contacto (paraquat + diuron 2,5 l/ha) de manera que no hubiese malezas emergidas al momento de la aplicación de los residuales. En 2015-2016 la aplicación se realizó el día 12 de diciembre de 2015 a las 19 h, con una temperatura de 29°C, una humedad relativa del 52% y una velocidad del viento de 4 km/h. En 2016-2017 la aplicación se realizó el día 10 de diciembre de 2016 a las 18 h, con una temperatura de 29°C, una humedad relativa del 46% y una velocidad del viento de 2 km/h. Los datos de precipitaciones acumulados por quincena se muestran en las Figuras 1 y 2.
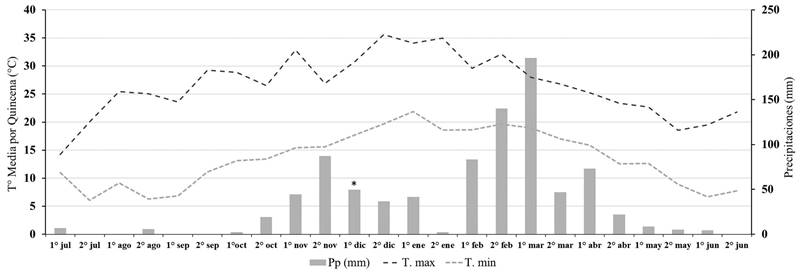
Figura 1 Promedio de temperatura máxima (Tºmax), promedio de temperatura mínima (Tºmin) y precipitaciones (Pp) por quincena durante la campaña 2015-2016 para la localidad de Tala Pozo. Aplicación de los herbicidas indicada con asterisco (*).
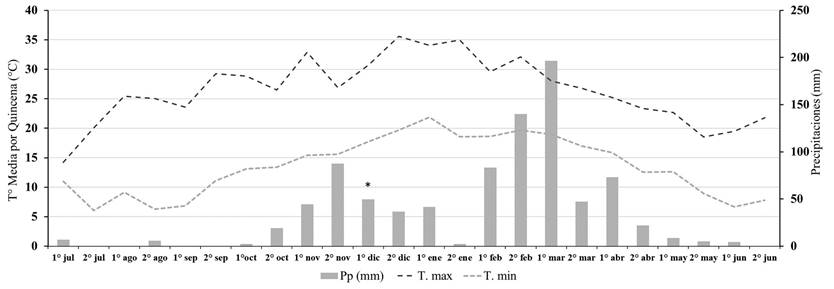
Figura 2 Promedio de temperatura máxima (Tºmax), promedio de temperatura mínima (Tºmin) y precipitaciones (Pp) por quincena durante la campaña 2016-2017 para la localidad de Tala Pozo. Aplicación de los herbicidas indicada con asterisco (*).
Para evaluar la eficacia de los tratamientos se estimó el porcentaje de control usando una escala visual en relación a un testigo sin control, donde 0% indica que no hubo control y 100% que controló en forma total. Los síntomas evaluados en U. panicoides en las parcelas tratadas fueron clorosis, necrosis, retraso en el crecimiento y muerte de plántulas (Sarangi et al., 2014; Ganie et al., 2015). Las evaluaciones se realizaron a los 30, 45 y 60 días después de la aplicación (DDA).
El equipo empleado para la aplicación de los tratamientos fue una mochila de presión constante con fuente de CO2 dotada de una barra de 6 boquillas con pastillas tipo abanico plano 8002 a 52 cm de separación, operando a un volumen de 120 l/ha.
Los datos obtenidos en cada experimento no cumplieron con los supuestos de normalidad y homogeneidad de varianza y fueron sometidos a un análisis no paramétrico de Kruscall Wallis para determinar las diferencias.
Resultados y discusión
Dinámica de emergencia
En ambas campañas la variable independiente de mayor ajuste a la dinámica de emergencia de U. panicoides fueron los GDDA (Campaña 2015-2016 AIC: 164,04; Campaña 2016-2017 AIC: 171,64) (Figuras 3.B y 4.B). La dinámica de emergencia frente a las precipitaciones no superó el ajuste logrado por los GDDA, lo cual sugiere que la temperatura es el factor de mayor influencia para reducir el nivel de dormición. De acuerdo a Leguizamón et al. (2008) esta metodología es precisa si la temperatura mínima es superior a la temperatura base. Tal es el caso de U. panicoides de crecimiento primavero-estival, que se desarrolla bajo condiciones de temperaturas en aumento, conforme avanza la estación.
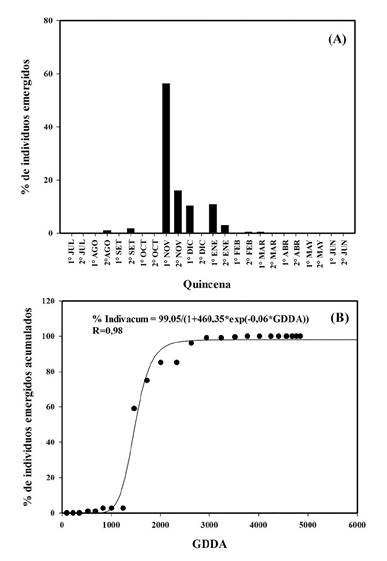
Figura 3 A. Porcentaje de individuos (%) de Urochloa panicoides emergidos por quincena para la campaña 2015-2016. B. Modelo logístico de individuos emergidos acumulados en función de GDDA para la campaña 2015-2016. AIC de 164,04.
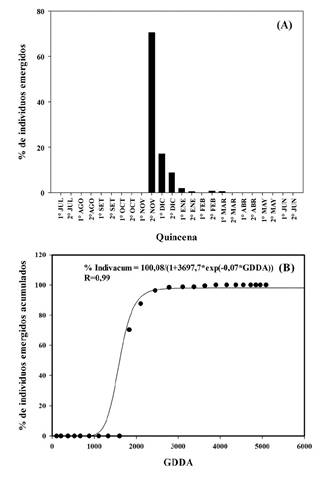
Figura 4 A. Porcentaje de individuos (%) de Urochloa panicoides emergidos por quincena para la campaña 2015-2016. B. Modelo logístico de individuos emergidos acumulados en función de los GDDA para la campaña 2015-2016. AIC de 171,64.
En 2015-2016, se determinaron nueve cohortes. La mayor se registró en la primera quincena de noviembre con un 56,3 % del total de individuos emergidos (Figura 1.A) y representó en promedio 38,7 individuos por m2. Esta cohorte ocurrió con una acumulación de 1465 GDDA (Figura 1.B). Posteriormente se registraron cohortes durante la segunda quincena de noviembre, la primera quincena de diciembre y enero con 10 %, 16 % y 10,9 % del total de individuos, respectivamente (Figura 3.A); las mismas ocurrieron con una acumulación de 1724, 2003 y 2623 GDDA, respectivamente (Figura 1.B). Entre noviembre y diciembre se registró la emergencia del 85 % de la población total de la campaña (Figura 3.A). El resto de las cohortes fueron inferiores al 3 % del total, ocurriendo dos, previo a las cohortes más importantes, en la segunda quincena de agosto (1 %) y la segunda quincena de septiembre (1,7 %) y las otras tres, luego de la ocurrencia de las cuatro cohortes más significativas en la segunda quincena de enero (2,9 %), segunda quincena de febrero (0,5 %) y primera quincena de marzo (0,5 %).
En 2016-2017, se determinaron siete cohortes, siendo la más significativa la primera ocurrida en la segunda quincena de noviembre con una acumulación de 1828 GDDA (Figura 4.B). La misma representó el 70 % del total de emergencias de dicha campaña y correspondió a 481,5 individuos por m2 (Figura 4.A). Posteriormente se registraron emergencias en la primera (17,2 %) y segunda (8,8 %) quincena de diciembre con 2101 GDDA y 2447 GDDA acumulados, respectivamente (Figura 4.B). El resto de las cohortes fueron inferiores al 2 % del total, ocurriendo todas luego de los flujos más significativos, y ocurrieron en la primera (2 %) y segunda quincena de enero (0,4 %), en la segunda quincena de febrero (0,6%) y la primera quincena de marzo (0,5 %).
En este trabajo, en ambas campañas la variable independiente de mayor ajuste a la dinámica de emergencia de semillas de U. panicoides fueron los GDDA, coincidiendo con Ustarroz (2011) para un biotipo de la misma especie en Córdoba, Argentina. Sin embargo, en estos tipos de estudios, al analizar cómo los factores ambientales modelan la germinación, es imprescindible tener en cuenta si la especie posee dormición. U. panicoides presenta dormición y para que la germinación ocurra los niveles de dormición deben disminuir (Benech-Arnold et al., 2000). La ruptura de la dormición es un proceso biológico que no ocurre simultáneamente en el 100 % de las semillas, a medida que disminuye el nivel de dormición y las condiciones ambientales son adecuadas se produce la germinación de diferentes proporciones de la población (Forcella et al. 2000; Grundy, 2003). La temperatura es el principal factor ambiental regulador de la dormición (Benech-Arnold et al., 2000) y puede estar modulado por la humedad del suelo (Batlla y Benech- Arnold, 2007). No obstante, esta respuesta no es extrapolable a todas las especies de verano (Kruk y Benech-Arnold, 1998). Ustarroz (2011) confirmó para el biotipo de Córdoba que una vez que las semillas son embebidas, deben acumular 250 GDDA para germinar.
En el biotipo tucumano en 2015-2016, una precipitación de 52 mm ocurrida en la primera quincena de agosto desencadenó en la segunda quincena de agosto y segunda de septiembre 2 cohortes que no superaron el 2 % de la emergencia total de la campaña (Figura 3.A). Esto difiere de los resultados observados por Ustarroz (2011) en el biotipo de Córdoba, donde a partir de la imbibición de las semillas y posterior acumulación de 250 GDDA ocurría una emergencia del 50% de la población. Lo que supone para el biotipo de Tucumán que un alto porcentaje de las semillas del banco no redujo los niveles de dormición en función de la temperatura (Bouwmeester y Karsen, 1993; Benech-Arnold et al., 2000). Continuando con el análisis de la campaña para el biotipo de Tucumán, durante la primera quincena de noviembre se registraron 180 mm de precipitaciones y con una acumulación de 213 GDDA, y que a partir de estas precipitaciones ocurrió la cohorte más importante con el 56 % de individuos emergidos, coincidiendo con los resultados de Ustarroz (2011) (Figura 3 y 4).
En 2016-2017, entre julio y la primera quincena de octubre no ocurrieron precipitaciones significativas y tampoco se observaron emergencias anticipadas como en la campaña anterior. Con 78 mm de lluvia acumulado entre la segunda quincena de octubre y primera quincena de noviembre, y posterior acumulación de 225 GDDA, emergió el 70 % del total de individuos de dicha campaña (Figura 3 y 4).
Con respecto a los GDDA, las emergencias más significativas ocurrieron con 213 y 225 GDDA, a partir de la imbibición de las semillas, con la salvedad que en la campaña 2015-2016 hubo cohortes insignificantes a partir de la ocurrencia de lluvias anticipadas. Estos resultados concuerdan con los encontrados por Ustarroz (2011), quien también indicó la necesidad de una imbibición en semillas despiertas para su posterior germinación. En el caso de las emergencias anticipadas con porcentajes insignificantes, estas también fueron observadas por Luna (2018) y nuevamente se confirma la teoría de que aun cuando las semillas están embebidas si no acumulan cierta cantidad de GDDA, el mayor porcentaje de la población sigue dormido (Forcella et al. 2000; Grundy, 2003; Luna, 2018). En cuanto a las emergencias según época del año y precipitaciones, en ambas campañas se observaron, en noviembre, emergencias del 56% y 70% a partir de la imbibición de semillas con precipitaciones de 180 mm y 78 mm, respectivamente. Antecedentes originados en Tucumán, para las campañas 2013 y 2014 también registraron en noviembre cohortes con porcentajes del 64% y 66% del total de individuos, con 69 mm y 62 mm acumulados desde setiembre, respectivamente (Cabrera y Villagrán, 2018) lo cual indicaría que la especie cumpliría alrededor de noviembre con la acumulación de temperatura y humedad necesaria para desencadenar una emergencia masiva.
Entonces, la dinámica de emergencia logra un mayor ajuste a la temperatura para semillas que rompieron dormición. Sin embargo, las precipitaciones juegan un rol crucial para desencadenar el proceso de germinación, por lo que para el análisis es imprescindible considerar ambos factores, concluyendo que en Tucumán las emergencias de U. panicoides se desencadenan de forma significativa a partir de las lluvias de primavera (Ustarroz, 2011; Cabrera y Villagrán, 2018; Luna, 2018). Lluvias esporádicas en los meses previos no generarían altos porcentajes de emergencias porque aún el mayor porcentaje de la población seguiría en estado de dormición.
Experimento con herbicidas residuales preemergentes
Campaña 2015-2016. En 2015-2016, a los 30 DDA, con 278 mm de precipitación acumulados se observaron diferencias significativas (p= <0.01) entre los tratamientos siendo los de mayor porcentaje de control clomazone 2.000 cm3 ha-1 (T2) e imazetapir (T4) ambos con 98,8 % de control, le siguieron clomazone 1.750 cm3 ha-1 (T1) y sulfometuron + clorimuron (T3), ambos con 95 %. Los tratamientos de control más bajo fueron s-metolacloro (T5) y diclosulam (T6) con 88,8 % y 91,3 % de control respectivamente, estos tratamientos solo se diferenciaron estadísticamente de los tratamientos 4 y 2 (Tabla 2).
Tabla 2 Porcentajes de control de los tratamientos herbicidas sobre la maleza Urochloa panicoides a los 30, 45 y 60 DDA. Tala Pozo, Tucumán, Argentina. Campañas 2015-2016 y 2016-2017.
| Trat. | Producto/DDA | 2015-2016 | 2016-2017 | ||||
| 30 | 45 | 60 | 30 | 45 | 60 | ||
| 1 | Clomazone 1750 cm3 ha-1 | 95,00 ab | 71,25 abc | 63,75 b | 96,25 a | 81,25 c | 68,75 b |
| 2 | Clomazone 2000 cm3 ha-1 | 98,75 b | 82,50 c | 61,25 b | 100,00 a | 88,75 b | 72,50 b |
| 3 | Sulfometuron + Clorimuron | 95,00 ab | 82,50 bc | 63,75 b | 98,75 a | 86,25 b | 76,25 b |
| 4 | Imazetapir | 98,75 b | 86,25 c | 81,25 a | 100,00 a | 95,00 a | 86,25 a |
| 5 | S-metalocloro | 88,75 a | 46,25 a | 10,00 d | 91,25 b | 63,75 d | 27,50 d |
| 6 | Diclosulam | 91,25 a | 63,75 ab | 45,00 c | 97,50 a | 78,75 c | 56,25 c |
*Letras distintas en cada fecha de evaluación indican diferencias significativas entre tratamientos, según test no paramétrico de Kruskall Wallis.
A los 45 DDA con 372 mm de precipitación acumulados, se observaron diferencias entre tratamientos (p = <0,001). En esta evaluación se destacaron imazetapir (T4), clomazone 2.000 cm3 ha-1 (T2) y sulfometuron + clorimuron (T3) con 86,3 %, 82,5 % y 82,5 % respectivamente. Sin diferencias significativas con los anteriores le siguió clomazone 1.750 cm3 ha-1 (T1) con 71,3 % de control. S-metolacloro (T5) con 63,8 % de control no registró diferencias significativas con los tratamientos 1 y 3. Por su parte diclosulam (T6) con 46,3 % de control fue el tratamiento con el porcentaje más bajo diferenciándose estadísticamente de 2, 4 y 3 (Tabla 2).
A los 60 DDA con 412 mm de precipitación acumulados imazetapir (T4) se destacó del resto de los tratamientos con un control del 81,3 % (p = 0,0009). Controles inferiores se registraron para sulfometuron + clorimuron (T3) con 63,8 %, clomazone 1.750 cm3 ha-1 (T1) con 63,8 % y clomazone 2.000 cm3 ha-1 (T2) con 61,3 %, todos ellos sin diferencias estadísticas significativas con el tratamiento 3. Diclosulam (T6) no superó el 45 % de control y no se diferenció estadísticamente de 4, 3, 1 y 2. Así también s-metolacloro (T5) no superó el 10 % de control y se diferenció estadísticamente de todos los tratamientos evaluados (Tabla 2).
Campaña 2016-2017. A los 30 DDA con 78 mm acumulados, se observaron diferencias significativas entre los tratamientos (p=<0,02). Los tratamientos con mayor porcentaje de control fueron imazetapir (T4), clomazone 2.000 cm3 ha-1 (T2) ambos con un 100 % y sulfometuron + clorimuron (T3) con un control del 98,8 %. Les siguieron diclosulam (T6) con un control del 97,5 % y clomazone 1.750 cm3 ha-1 (T1) con un control del 96,8 %. No se registraron diferencias significativas entre los tratamientos mencionados y los tratamientos 4, 2 y 3. Difiriendo estadísticamente de los tratamientos 4, 2 y 3 se registró a s-metolacloro (T5) con un 91,3 % de control, siendo este el porcentaje más bajo registrado (Tabla 2).
A los 45 DDA con 80 mm acumulados no se observaron diferencias entre los tratamientos de mayor porcentaje de control (p=<0,002) destacándose imazetapir (T4) con 95 %, clomazone 2.000 cm3 ha-1 (T2) con 88,8 % y sulfometuron + clorimuron (T3) con 86,3 % de control. Le siguieron clomazone 1.750 cm3 ha-1 (T1) y diclosulam (T6) con 81,3 % y 78,8 % de control respectivamente, estos solo se diferenciaron estadísticamente del tratamiento 4. El tratamiento con porcentaje de control más bajo fue s-metolacloro (T5) con 63,8 % de control diferenciándose estadísticamente de los tratamientos 4, 3 y 2 (Tabla 2).
A los 60 DDA con 163 mm acumulados se observaron diferencias entre los tratamientos (p=<0,001). Los tratamientos imazetapir (T4) con 86,3 % y sulfometurom + clorimuron (T3) con 76,3 % fueron los de mejor control. Le siguieron clomazone 2.000 cm3 ha-1 (T2) con un 72,5 % de control y clomazone 1.750 cm3 ha-1 (T1) con un 68,8 % de control, ambos sin diferencias estadísticas con los tratamientos 4 y 3. Por último, se registró a diclosulam (T6) con un control del 56,3 % y s-metolacloro (T5) con 27,5 % de control, ambos con diferencias estadísticas frente a los tratamientos 4 y 3 (Tabla 2).
En ambas campañas, hasta los 30 DDA, todos los tratamientos registraron una similar eficacia de control. A los 45 DDA, comenzaron a evidenciarse diferencias entre los tratamientos, siendo imazetapir (T4), clomazone 2.000 cm3 ha-1 (T2) y sulfometuron + clorimuron (T3) los de mejor respuesta con controles entre 82,5 % y 95 %. Para el mismo periodo de evaluación, clomazone 1.750 cm3 ha-1 (T1) registró controles del 71 % y 81 %, en cada campaña respectivamente, mientras que el resto de los herbicidas, en la primera campaña registraron un control por debajo del 63 % y en la segunda campaña un control por debajo del 56 %. Analizando el comportamiento de los diferentes tratamientos hasta los 60 DDA, nuevamente se destacó imazetapir (T4) con control superior al 80 % coincidiendo con las recomendaciones de este herbicida para la zona NOA (Courel et al., 2018). En otro estudio con Chloris virgata, otra gramínea anual, el control con imazetapir a igual dosis y periodo de evaluación no superó el 60 % de control (Ustarroz, 2015). Siguiendo con el análisis, a T4 le siguieron en orden de eficacia nuevamente sulfometuron + clorimuron (T3), clomazone 2.000 cm3 ha-1 (T2) y clomazone 1.750 cm3 (T1), todos con controles superiores a 60 %. En el caso de T3 y T2, lograron mayores controles en la segunda campaña siendo superiores al 70 %. En el caso de T1 y T2, una dosis mayor (2.000 cm3 ha-1) no significó un incremento significativo en el control. En cuanto a sulfometurom+ clorimuron (T3) los resultados obtenidos en este ensayo, coinciden con los obtenidos por Cortés et al. (2016) y por Ustarroz (2015) donde se lograron controles de 85 % (Cortés et al., 2016) y superiores al 90 % (Ustarroz, 2015) para C. virgata.
Por su parte diclosulam (T6) tanto en la primera como en la segunda campaña hasta las 30 DDA tuvo controles por encima del 90 %, sin embargo a partir de los 45DDA en la primera campaña su control disminuyó hasta un 63,8 % mientras que, en la segunda campaña se registró un control del 78,8 % siendo este resultado diferente a los datos obtenidos por Ustarroz (2015) para el control de C. virgata donde se logró controlar el 90 % hasta los 60 DDA.
El tratamiento con porcentaje de control más bajo fue s-metolacloro (T5), la eficacia de control fue similar al resto de los tratamientos a los 30 DDA, sin embargo, la diferencia porcentual con el resto de los tratamientos se acentuó a partir de los 45 DDA, registrando porcentajes de control del 46,3 % y 63,8 % para la primera y segunda campaña respetivamente, demostrando claramente la pérdida de la residualidad en esa evaluación. Datos similares para C. virgata a los 40 DDA se observaron en un experimento de Ustarroz (2015) donde en la campaña 2012-2013 no superó el 70 % de control y en la campaña 2014-2015 no superó el 60 % de control. Este herbicida también es citado en la bibliografía como herbicida de barbecho corto previo a la siembra del cultivo de verano debido a su residualidad (Courel et al., 2018).
Por último, también se observa que para todos los tratamientos los controles en la campaña 2015-2016 fueron menores que los observados en la campaña 2016-2017 lo cual puede estar asociado a la precipitación acumulada durante el desarrollo del experimento, que fue de 412 mm para la campaña 2015-2016 y 163 mm para la campaña 2016-2017. En clomazone y diclosulam el efecto es más marcado, ya que estos están clasificados como herbicidas con alto potencial de lixiviación (INTA, 2019).
En general, estos resultados coinciden, con antecedentes que destacan el excelente control de los herbicidas pertenecientes al grupo de inhibidores de ALS, en especial de las familias de las imidazolinonas y sulfonilureas sobre U. panicoides y otras gramíneas anuales (Pfeiffer, 2013; Ustarroz, 2015; Cortés et al., 2016; Lescano, 2017; Umeda, 2017). En este experimento se comprobó también que clomazone, una isoxazolidinona que actúa inhibiendo la síntesis de carotenoides, tiene un excelente desempeño para el control de la maleza estudiada.
Conclusiones
Para poder predecir la dinámica de emergencia de Urochloa panicoides debemos considerar a la temperatura como el principal factor para reducir los niveles de dormición, teniendo en cuenta a las precipitaciones como un segundo factor crucial que desencadena el proceso de germinación. Es fundamental también tener en cuenta el cálculo de la acumulación de los grados días, como factor predictor inmediatamente después de una precipitación. Lo anterior nos lleva a concluir que, en Tucumán, las emergencias de U. panicoides ocurren en altos porcentajes a partir de las lluvias que ocurren en primavera. Lluvias esporádicas en los meses de agosto-septiembre no las activarían de forma significativa, ya que el mayor porcentaje de la población se encontraría en dormición. En cuanto al control del biotipo resistente a glifosato, se dispone de herbicidas residuales eficientes, como imazetapir, sulfometuron + clorimuron y clomazone, que brindan una eficiencia superior al 80% hasta los 60DDA, mientras que el resto ofrece un buen control (por arriba del 88%) hasta los 30DDA y a partir de los 45DDA ya no realizan un control eficiente. De los tres herbicidas mencionados, dos pertenecen al grupo químico de inhibidores de la ALS, por lo que se corre el riesgo de seleccionar biotipos resistentes, si no rotamos los sitios de acción. Los resultados obtenidos muestran la importancia de considerar estos herbicidas en el control preemergente de biotipos de U. panicoides resistentes a glifosato. La alta eficacia obtenida en los tratamientos evaluados resulta una herramienta útil para el manejo de U. panicoides en barbechos previos y en los cultivos de soja y maíz.














