Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de nefrologia, dialisis y trasplante
versión On-line ISSN 2346-8548
Rev. nefrol. dial. traspl. vol.38 no.3 Ciudad Autónoma de Buenos Aires set. 2018
ARTÃCULO ORIGINAL
¿PODEMOS HABLAR HOY DE UN VALOR DE FÃSFORO COMO INDICADOR DE LA CALIDAD DEL TRATAMIENTO DIALÃTICO?
CAN WE SPEAK TODAY OF A PHOSPHORUS VALUE AS AN INDICATOR OF DIALYSIS TREATMENT QUALITY?
Esteban Siga 1, MarÃa Galarza2, Mario Jorge Galarza2, Hugo de Palma3, Cecilia Perli3,  Carlos Cusumano4, Marianao GarcÃa5, Miguel Fernández5, Ana Cusumano4
1) Diálisis Madariaga, Buenos Aires, Argentina
2) Centro de Estudios y Tratamiento Renal OlavarrÃa (CETRO), Buenos Aires, Argentina
3) Centro Nefrológico Azul, Buenos Aires, Argentina
4) Instituto de NefrologÃa Pergamino, Buenos Aires, Argentina
5) Centros de Estudios Nefro-Urológicos, Trenque Lauquen y General Villegas, Buenos Aires, Argentina
e-mail: siga@telpin.com.ar
Recibido: 14 de enero de 2018
Aceptación final: 17 de julio de 2018
RESUMEN
Introducción: El trastorno del metabolismo óseo y mineral constituye una grave complicación de la insuficiencia renal crónica. Respecto al fósforo, las nuevas GuÃas KDIGO sugieren disminuir la hiperfosfatemia, sin recomendar un valor determinado. Sin embargo, en Argentina se utiliza como indicador de calidad dialÃtica (IndCalDial) un valor de fósforo igual o inferior a 5 mg/dL. Nuestro objetivo fue evaluar si dicho  objetivo es actualmente válido como IndCalDial. Material y métodos: Estudio multicéntrico, de corte transversal. Se incluyeron pacientes mayores de 18 años, con más de 90 dÃas en hemodiálisis. Se tabularon datos demográficos y de laboratorio, comparándose normofosfatémicos contra hiperfosfatémicos. Según el método, en 3 centros el lÃmite superior de referencia fue 4.5 mg/dL y en cuatro 5.6 mg/dL, éstos últimos se analizaron como grupo separado F 5.6. Resultados: Se incluyeron 333 pacientes. Edad, sexo, porcentaje FAV, diabéticos, tiempo en diálisis, Kt/V, Hemoglobina y Albumina, fueron semejantes a los datos del registro. La mediana de fosfatemia fue 5.2 mg/dL, (rango: 2.3 a 10.6). Los pacientes hiperfosfatémicos presentaron menor edad, menos tiempo en diálisis y cifras mayores de hemoglobina y Albumina. En el grupo F 5.6 (n = 203), según KDIGO sólo el 33.7 % necesitarÃa tratamiento. De aplicarse el IndCalDial (fósforo menor a 5 mg/dL), el porcentaje serÃa de 55%, es decir, un 21.3% de pacientes normofosfatémicos deberÃan ser tratados. Conclusiones: DeberÃa estandarizarse la determinación de fosfatemia, previo a  utilizar un valor fijo como IndCalDial.
PALABRAS CLAVE: hemodálisis; GuÃas KDIGO; trastornos del metabolismo óseo y mineral; hiperfosfatemia; indicadores de calidad; calidad en diálisis; diálisis renal; fósforo
ABSTRACT
Introduction: Bone and mineral metabolism disorder is a serious complication of Chronic Kidney Disease. Concerning phosphorus, the new KDIGO Guidelines suggest a reduction of hyperphosphatemia, but they do not recommend a specific value. However, in Argentina, a phosphorus value of 5 mg/dL or less is used as a dialysis quality indicator (DiaQualInd). Our objective was to evaluate whether this goal is currently valid as a DiaQualInd. Methods: A multicentric, cross-sectional study was conducted. Patients older than 18 were included, with more than 90 days undergoing hemodialysis. Demographic and laboratory data were tabulated, comparing normophosphatemic with hyperphosphatemic values. According to this method, in 3 centers the upper reference limit was 4.5 mg/dL and in 4 centers it was 5.6 mg/dL. The latter were analyzed as a separate group (F 5.6). Results: There were 333 patients included in this study. Age, sex, AVF percentage, diabetes, time on dialysis, Kt/V, hemoglobin and albumin were similar to the registry data. The median phosphatemia was 5.2 mg/dL, (range: 2.3 to 10.6). The hyperphosphatemic patients were the youngest, spent less time on dialysis and showed higher hemoglobin and albumin values. In group F 5.6 (n = 203), according to KDIGO only 33.7% would need treatment. If this DiaQualInd were to be applied (phosphorus lower than 5 mg/dL), the percentage would be 55%, that is, 21.3% of normophosphatemic patients should be treated. Conclusions: Phosphatemia determination should be standardized before using a fixed value such as DiaQualInd.
KEYWORDS: hemodialysis; KDIGO Guidelines; disorders of bone and mineral metabolism; hyperfosfatemia; quality indicators; quality in dialysis; renal dialysis; phosphorus
INTRODUCCIÃN
El trastorno del metabolismo óseo y mineral (TMO) constituye una frecuente y grave complicación de la insuficiencia renal crónica. En numerosos estudios observacionales se ha demostrado que su presencia aumenta la mortalidad y la morbilidad en forma significativa, por lo que su diagnóstico y tratamiento constituyen una pieza fundamental del manejo del paciente con enfermedad renal crónica (ERC).(1-4) En particular, la hiperfosfatemia se asocia a mayor riesgo de enfermedad cardiovascular y cerebrovascular, enfermedad vascular periférica, amputaciones y mortalidad. Esto no sólo ocurre en pacientes con IRC, ya que aún en sujetos sin ERC, se ha encontrado que valores elevados de fosfatemia se asocian a incremento del riesgo cardiovascular.(5)
Por todo lo anterior, en hemodiálisis crónica, es necesaria la determinación rutinaria de calcemia, fosfatemia y paratohormona (PTH), de modo que es primordial realizar un adecuado diagnóstico y seguimiento. Sin embargo, en el momento de instaurar el tratamiento los criterios no son uniformes, ya que los valores aceptados como “normalidad” u objetivo han variado a lo largo del tiempo, modificándose a medida que se avanzan las investigaciones sobre el tema, dando lugar a la confección de varias guÃas y sus consecuentes modificaciones por comités de expertos.
Al respecto, reconociendo la importancia de estas alteraciones, las GuÃas KDIGO sobre TMO se han actualizado,(6) introduciendo cambios que modifican el enfoque diagnóstico y terapéutico de esta complicación de la IRC.
AsÃ, sobre la hiperfosfatemia, sugieren que en la IRC, estadios 3aâ5D:
1) El diagnóstico deberÃa realizarse basado en mediciones simultáneas de fósforo, calcio y PTH, tomando en cuenta la tendencia longitudinal de varias mediciones seriadas de estos elementos (apartado 4.1.1).
1) El tratamiento debe enfocarse endisminuir los valores de fósforo (P) hacia el rango normal y no en prevenir la hiperfosfatemia (apartado 4.1.2). Es necesario resaltar el sentido de esta recomendación: solo los pacientes con hiperfosfatemia deberÃan ser tratados, y se beneficiarÃan de un tratamiento activo con quelantes y dieta reducida en fósforo.(7)
En los pacientes en diálisis, donde la hiperfosfatemia es un hallazgo muy común,(8) también  sugieren disminuir la hiperfosfatemia, pero no recomiendan ningún rango de valores determinado. En la práctica diaria esto pareciera ser muy apropiado, dado que: a) se han observado variaciones de hasta 1 mg/dL en el mismo dÃa,(9) y b) los valores de referencia varÃan según los autores y/o el método de dosaje utilizado. En las GuÃas KDOQI de 2003 se recomendó mantener el fósforo entre 3.5 y 5.5 mg/dL,(19) en tanto que Block y col. definÃan la hiperfosfatemia por encima de 5 mg/dL.(11) En contraste, dos grandes estudios europeos recientes establecieron el lÃmite superior de normalidad en 4.5 mg/dL.(12-13) En Argentina, el método más utilizado para dosaje de fosfatemia es el colorimétrico, pero dependiendo del proveedor del reactivo, el valor de referencia superior es de 4.5 mg/dL o 5.6 mg/dL.
Dada la importancia de este tema, el propósito del presente trabajo es aportar, con datos reales de la práctica diaria, elementos objetivos para establecer un nuevo marco de discusión sobre el tratamiento de la fosfatemia, además de la utilización de un valor máximo como indicador de calidad dialÃtica.
MATERIAL Y MÃTODOS
Se diseñó un estudio multicéntrico, de corte transversal. Participaron 7 centros independientes distribuidos en una amplia región del interior de la provincia de Buenos Aires. Las caracterÃsticas de estos centros han sido publicadas anteriormente.(14) La recolección de datos se realizó en setiembre de 2017. Se incluyeron todos los pacientes que cumplieran los siguientes criterios: ser mayor de 18 años de edad y estar recibiendo tratamiento hemodiálitico crónico por más de 3 meses. Cada centro, identificado con un número, envió los datos preservando la identidad de los pacientes, quienes fueron registrados con sus iniciales. Luego los datos se unificaron en una base única, en la cual se eliminó el número del centro de modo de no identificar el centro de origen de los pacientes.
Se tabularon edad, tiempo en diálisis, sexo, etiologÃa diabética o no diabética, hemoglobina, albúmina sérica, acceso vascular, Kt/V y fosfatemia.
Respecto a la determinación de fósforo sérico, de los siete centros participantes, tres utilizan el método con valor superior de referencia de 4.5 mg/dL, y los cuatro restantes el de 5.6 mg/dL. Se analizaron todos los pacientes en conjunto y luego el subgrupo con valor de referencia superior de 5.6 mg/dL (F 5.6). Se estableció su asociación con la edad, tiempo en diálisis, hemoglobina y albuminemia. La fosfatemia se dividió en cuartiles y se comparó el cuartil inferior (primero) versus el superior (cuarto). La significancia estadÃstica se evaluó con el Test no paramétrico de Wilcoxon, un valor de P menor a 0.05 se consideró significativo.
Para el análisis estadÃstico se utilizó el programa Epi Dat 2.1.(15) Cuando el parámetro se ajustaba a la distribución normal, se presentaron los resultados como promedio y el intervalo de confianza fue del 95%. La fosfatemia no se ajustó a la distribución normal y por lo tanto se presenta su mediana y el valor mÃnimo y el máximo.Â
RESULTADOS
La muestra total estaba compuesta por 357 pacientes. Se excluyeron dos por ser menores de 18 años y 22, y por tener una antigüedad en diálisis menor a 90 dÃas. En la Tabla 1 se presentan los datos correspondientes a todos los pacientes incluidos (n = 333), y al grupo cuyo valor superior de normalidad fue de 5.6 mg/dL (F5.6).
Tabla 1. Datos demográficos y de laboratorio de la muestra estudiada
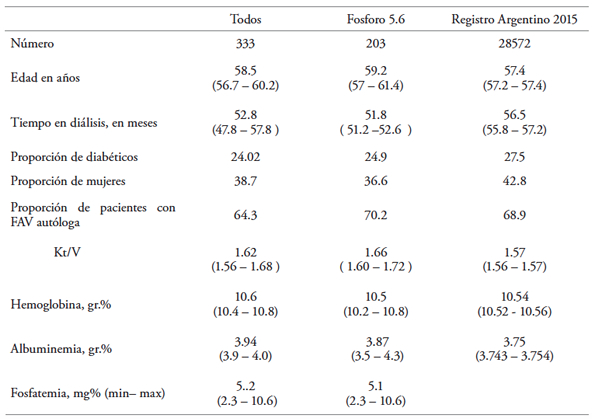
Fósforo 5.6 refiere al grupo con valor de referencia superior de 5.6 mg/dL. Los valores de fosfatemia representan mediana y (mÃnimo y máximo). No disponemos de mediana de fosfatemia del Registro Nacional(16). En el resto de los parámetros se presentan su media e (intervalo de confianza 95 %)
Como puede observarse, las caracterÃsticas demográficas (edad y sexo), el porcentaje de pacientes con acceso vascular autólogo y la prevalencia de diabéticos son similares a la del resto del paÃs.(16) El tiempo en diálisis fue ligeramente menor, aunque no es significativo. Respecto al Kt/V, hemoglobina y albúmina, la media y los intervalos de confianza de ambos grupos también son similares a los datos del registro nacional(16) y se encuentran dentro de los valores mÃnimos considerados como adecuados indicadores de calidad.
Sin embargo, la mediana de fosfatemia (5.2 mg/dL) excede el valor objetivo de 5 mg/dL, presentando un amplio rango de valores (desde 2.3 a 10.6 mg/dL). Los valores de fosfatemia son similares en los varones y en las mujeres, asà como en los diabéticos y no diabéticos. Además, el tipo de acceso vascular tampoco se asocia con diferencias significativas. Por el contrario, la Tabla 2 muestra claramente las diferencias encontradas entre el primer (ej.: fosfatemia normal) y el cuarto (ej.: hiperfosfatemia) cuartil de la muestra estudiada. Observamos que los pacientes con franca hiperfosfatemia (cuartil superior) son más jóvenes, han estado menor tiempo en diálisis y presentan mayor hemoglobinemia y mayor albuminemia
Tabla 2. Diferencias entre normo e hiperfosfatemia
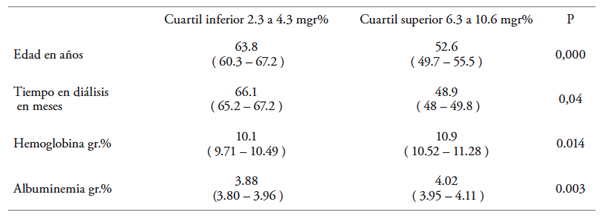
La muestra total de 333 pacientes se dividió en cuartiles. La Tabla muestra la media y el intervalo de confianza (95 %) del cuartil inferior (primero) y el superior (cuarto). Se compararon con el Test de Wilcoxon
La Figura 1 incluye sólo el subgrupo F5.6 (203 pacientes). El porcentaje de pacientes dentro de los valores de referencia del método (2.5 a 5.6 mg/dL) fue de 66.3%. O sea que fuera del rango se ubicaron solo el 33.7% (columna izquierda). En la columna de la derecha se observa el porcentaje (55%) que no cumple con el objetivo de fósforo menor a 5 mg/dL. Si aceptamos este valor como un indicador de calidad, deberÃan ser tratados un 21.3% de individuos con una fosfatemia en rango considerado normal por el método.
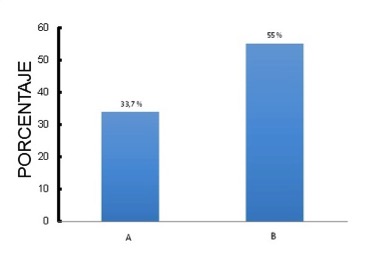
Figura 1. Figura 1. Distribución porcentual de pacientes del grupo F5.6 (n=203) que requerirÃan tratamiento según. A) GuÃas KDIGO, 2017(6). B) Documento de Calidad en Diálisis de la SAN, 2014(17)
DISCUSIÃN
La fosfatemia, en numerosas guÃas de práctica clÃnica, se utiliza como un indicador de calidad dialÃtica. En nuestro paÃs, la Sociedad Argentina de NefrologÃa, en su documento sobre los Indicadores mÃnimos aplicables a pacientes prevalentes en tratamiento de diálisis considera que al menos un 60% de los pacientes debe tener menos de 5 mgr% como valor superior de P y no más del 10% una fosfatemia mayor de 6 mgr/dl.(17)
El presente estudio es el primero en intentar analizar las diferencias que pueden aparecer en función del método de laboratorio en la determinación de los valores superiores de la normalidad para la fosfatemia y las consecuencias que ello podrÃa implicar cuando un determinado valor de fósforo sérico se utiliza como un indicador más de calidad dialÃtica.
Los otros resultados que surgen de este trabajo multicéntrico pueden resumirse en lo siguiente: los pacientes en diálisis con niveles mayores de fosfatemia (4to cuartil) son más jóvenes, y han estado menos tiempo bajo tratamiento hemodialÃtico, al mismo tiempo que tienen mejores niveles de Hb y de albuminemia. Por el contrario, los pacientes con valores más bajos de P (1er cuartil) tienen mayor edad, han estado en promedio más de cuatro años en diálisis y tienen valores más bajos de Hb y albuminemia con respecto a los anteriores.Â
Como ya se mencionó en la introducción, las nuevas guÃas K-DIGO(6) sugieren que el diagnóstico del TMO deberÃa basarse en mediciones seriadas de los niveles de fósforo, calcio y PTH, considerados en conjunto. Respecto al tratamiento, la anterior recomendación de mantener el fósforo en el rango normal fue dejada de lado, y la actual sugiere enfocar el tratamiento en los pacientes con hiperfosfatemia.
Esta nueva recomendación se basa en que cada uno de los tres tratamientos principales para prevenir la hiperfosfatemia: a) intensificación de la terapia dialÃtica; b) quelantes, y c) restricción dietética, tienen efectos secundarios. La intensificación de la diálisis, si bien se recomienda, es un mal tratamiento para reducir el P sérico porque disminuye la calidad de vida.(18) Los quelantes, ya sea que contengan o no calcio, producen alteraciones gastrointestinales y otros efectos secundarios especÃficos de cada producto.(19) Si bien es fundamental el rol del nutricionista en detectar fuentes de P de bajo impacto nutricional pero de alto contenido de fósforo (como los aditivos utilizados como mejoradores del sabor, para preservar la humedad o el color, etc.), la restricción dietética podrÃa inducir una menor ingestión de proteÃnas en pacientes con alto riesgo de malnutrición proteica.(20) Sin embargo, lo anterior no significa minimizar o desconocer las evidencias que asocian la hiperfosfatemia con mayor mortalidad.(1-4) En consecuencia, ésta debe ser tratada enérgicamente.
La recomendación de las recientes GuÃas KDIGO de disminuir los valores elevados de fósforo, presupone que un determinado rango de normalidad está establecido y es ampliamente aceptado. Ya hemos planteado en la introducción que en la literatura médica no existe certeza sobre cuál es el valor superior objetivo en la IRC,(21) pero incluso en nuestro propio paÃs se observan discrepancias al respecto. Como ejemplo, analizamos tres trabajos recientes:
a) Un elegante y detallado trabajo multicéntrico con 1.210 pacientes(22) que establece el rango normal entre 3.5-5.5 mg/dL.
b) Un segundo trabajo, que realiza un profundo análisis de los datos del trienio 2011-2013 del Registro Nacional de Diálisis(23) utiliza el mismo rango de referencia entre 3.5- 5.5.
c) El Registro Argentino de Diálisis Crónica 2014-2015(16) aplica un  rango de referencia de 3.6- 5.0. Nótese que el Registro Argentino, o sea la población nacional de los pacientes en diálisis, cambió su rango de referencia de un año a otro. Sin embargo, ninguno hace referencia al método de dosaje de la fosfatemia. Nuestro estudio demuestra que existen diferencias metodológicas en Argentina: para el 39.5% de nuestros pacientes el valor superior de normalidad es 4.5 mg/dL, pero para el 60.5% restante la fosfatemia es normal hasta 5.6 mg/dL.
A la luz de lo expuesto, surgen dos difÃciles preguntas:
1) ¿Cómo definir la hiperfosfatemia en pacientes en diálisis?
2) ¿Cómo estandarizar el dosaje de P entre los distintos laboratorios?
Hasta que ambas cuestiones no sean resueltas, consideramos que no deberÃa establecerse un valor fijo como objetivo de calidad dialÃtica. Sugerimos mientras tanto tratar firmemente la hiperfosfatemia, guiados por el rango de referencia del método utilizado.
Este trabajo tiene como fortalezas ser el primero en su tipo en plantearse las antedichas preguntas, y haber incluido la población total de pacientes adultos dializados en centros que vienen trabajando en forma colaborativa. Presenta, sin embargo, ciertas debilidades: no se realizó encuesta dietética en esos pacientes, y la población incluida, si bien es total, representa sólo un porcentaje pequeño del total de pacientes dializados en nuestro paÃs. Incluir el método utilizado para la determinación de la fosfatemia en la encuesta anual de seguimiento dialÃtico que realiza el Sistema Nacional de Información (SINTRA) permitirÃa verificar a nivel nacional lo observado en este estudio preliminar.
CONCLUSIONES
De un análisis de una muestra de 333 pacientes provenientes de 7 centros del interior de la provincia de Buenos Aires se observó que los valores superiores de normalidad de la fosfatemia variaban entre 4.5 y 5.6 según el proveedor del reactivo utilizado por el laboratorio interviniente. Esto causó que, si se tomara como valor óptimo para nuestros pacientes 5 mgr/dl, un 21.3 % estarÃa fuera de rango y necesitarÃa tratamiento, aun teniendo valores considerados como normales. Por tal razón creemos necesario que se estandaricen los métodos de laboratorio para el fósforo. Hasta su concreción, no deberÃa utilizarse un valor fijo de P como un indicador de calidad dialÃtica.
Conflicto de intereses: Los autores declaran no poseer ningún interés comercial o asociativo que presente un conflicto de intereses con el trabajo presentado.
1) Block GA, Kilpatrick RD, Lowe KA, Wang W, Danese MD. CKD-mineral and bone disorder and risk of death and cardiovascular hospitalization in patients on hemodialysis. Clin J Am Soc Nephrol. 2013;8(12):2132-40. [ Links ]
2) Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. Mortality risk for dialysis patients with different levels of serum calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis. 2008;52(3):519-30. [ Links ]
3) Eddington H, Hoefield R, Sinha S, Chrysochou C, Lane B, Foley RN, et al. Serum phosphate and mortality in patients with chronic kidney disease. Clin J Am Soc Nephrol. 2010;5(12):2251-7. [ Links ]
4) Fukagawa M, Kido R, Komaba H, Onishi Y, Yamaguchi T, Hasegawa T, et al. Abnormal mineral metabolism and mortality in hemodialysis patients with secondary hyperparathyroidism: evidence from marginal structural models used to adjust for time-dependent confounding. Am J Kidney Dis. 2014;63(6):979-87. [ Links ]
5) Dhingra R, Sullivan LM, Fox CS, Wang TJ, D'Agostino RB Sr, Gaziano JM, et al. Relations of serum phosphorus and calcium levels to the incidence of cardiovascular disease in the community. Arch Intern Med. 2007;167(9):879-85. [ Links ]
6) Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Update Work Group. KDIGO 2017 Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney DiseaseâMineral and Bone Disorder (CKD-MBD). Kidney Int Suppl. 2017;7(1):1-59.
7) Isakova T, Nickolas TL, Denburg M, Yarlagadda S, Weiner DE, Gutiérrez OM, et al. KDOQI US Commentary on the 2017 KDIGO Clinical Practice Guideline Update for the Diagnosis, Evaluation, Prevention, and Treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD). Am J Kidney Dis. 2017;70(6):737-51. [ Links ]
8) Grupo de Metabolismo Ãseo y Mineral, Sociedad Argentina de NefrologÃa. 2º Consenso de metabolismo óseo-mineral [Internet]. Resumen de bolsillo. Buenos Aires: SAN, 2017. 64 p. Disponible en: http://san.org.ar/2015/docs/consensos/B94_Consenso_SAN2.pdf [citado: 04/01/2018]. [ Links ]
9) Portale AA, Halloran BP, Morris RC Jr. Dietary intake of phosphorus modulates the circadian rhythm in serum concentration of phosphorus. Implications for the renal production of 1,25-dihydroxyvitamin D. J Clin Invest. 1987;80(4):1147-54. [ Links ]
10) National Kidney Foundation. K/DOQI clinical practice guidelines for bone metabolism and disease in chronic kidney disease. Am J Kidney Dis. 2003;42(4 Suppl 3):S1-201.
11) Block GA, Klassen PS, Lazarus JM, Ofsthun N, Lowrie EG, Chertow GM. Mineral metabolism, mortality, and morbidity in maintenance hemodialysis. J Am Soc Nephrol. 2004;15(8):2208-18. [ Links ]
12) Fernández-MartÃn JL, MartÃnez-Camblor P, Dionisi MP, Floege J, Ketteler M, London G, et al. Improvement of mineral and bone metabolism markers is associated with better survival in haemodialysis patients: the COSMOS study. Nephrol Dial Transplant. 2015;30(9):1542-51. [ Links ]        Â
13) Fouque D, Roth H, Darné B, Jean-Bouchet L, Daugas E, Drüeke TB, et al. Achievement of Kidney Disease: Improving Global Outcomes mineral and bone targets between 2010 and 2014 in incident dialysis patients in France: the Photo-Graphe3 study. Clin Kidney J. 2018;11(1):73-9. [ Links ]
14) Siga E, Fernández M, Galarza M, Mesina V, De Palma H, Coste R. Difference between true functional haemoglobin and pre-dialysis haemoglobin is associated with plasma volume variation: a multicentre study. Int Urol Nephrol. 2014;46(12):2379-84. [ Links ]
15) Epidat: programa para análisis epidemiológico de datos (versión 4.2, jul. 2016) [Internet]. ConsellerÃa de Sanidade, Xunta de Galicia(España); Organización Panamericana de la Salud (Ginebra); Universidad CES (Colombia). Disponible en: https://www.picuida.es/programa-estadistico-epidat-4-2-version-julio-2016/ [citado: 04/01/2018].
16) Marinovich S, Lavorato C, Celia E, Bisignano L, Soratti M, Hansen Krogh D, Tagliafichi V, Moriñigo C, Rosa Diez G, Fernández V. Registro Argentino de Diálisis Crónica SAN INCUCAI 2008 [Internet]. Sociedad Argentina de NefrologÃa e Instituto Nacional Central Ãnico Coordinador de Ablación e Implante. Buenos Aires; 2010. Disponible en: http://san.org.ar/2015/docs/registros/REGISTRO_ARGENTINO_dialConica2014_2015.pdf [citado: 04/01/2018]. [ Links ]
17) Tessey A, Celia E, Ducasse E. Calidad en diálisis. Indicadores mÃnimos aplicables a pacientes: prevalentes en tratamiento de diálisis [Internet]. Buenos Aires: Grupo de Trabajo Calidad en Diálisis, Sociedad Argentina de NefrologÃa; 2014. 27 p. Disponible en: http://san.org.ar/2015/docs/consensos/pub_SAN_ACQ.pdf [citado: 04/01/2018]. [ Links ]
18) Port FK, Morgenstern H, Bieber BA, Karaboyas A, McCullough KP, Tentori F, Pisoni RL, et al. Understanding associations of hemodialysis practices with clinical and patient-reported outcomes: examples from the DOPPS. Nephrol Dial Transplant. 2017;32(suppl_2):ii106-ii112. [ Links ]
19) Block GA, Wheeler DC, Persky MS, Kestenbaum B, Ketteler M, Spiegel DM, et al. Effects of phosphate binders in moderate CKD. J Am Soc Nephrol. 2012;23(8):1407-15. [ Links ]
20) Shinaberger CS, Greenland S, Kopple JD, Van Wyck D, Mehrotra R, Kovesdy CP, et al. Is controlling phosphorus by decreasing dietary protein intake beneficial or harmful in persons with chronic kidney disease? Am J Clin Nutr. 2008;88(6):1511-8. [ Links ]
21) Fouque D, Roth H, Pelletier S, London GM, Hannedouche T, Jean G, et al. Control of mineral metabolism and bone disease in haemodialysis patients: which optimal targets? Nephrol Dial Transplant. 2013;28(2):360-7. [ Links ]
22) Douthat WG, Castellano M, Berenguer L, Guzmán MA, De Arteaga J, Chiurchiu CR, et al. Elevada prevalencia de hiperparatiroidismo secundario en pacientes con enfermedad renal crónica en diálisis en Argentina. NefrologÃa (Madr.) 2013;33(5):657-66. [ Links ]
23) Marinovich SM, Negri AL. Trastorno mineral y óseo relacionado a la enfermedad renal crónica en pacientes prevalentes en diálisis crónica en el trienio 2011-2013 en Argentina. Rev Nefrol Dial Traspl. 2015;35(1):24-31. [ Links ]














