Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Lilloa
versión impresa ISSN 0075-9481versión On-line ISSN 2346-9641
Lilloa vol.55 no.1 San Miguel de Tucumán jun. 2018
http://dx.doi.org/D.O.I.:doi.org/10.30550/j.lil/2018.55.1/6
D.O.I.: doi.org/10.30550/j.lil/201 8.55.1/6
Morfoanatomía de las plántulas de dos especies de lupinos graníferos: Lupinus albus y L. angustifolius (Fabaceae, Faboideae)
Morphoanatomy of seedlings of two species of grain lupins: Lupinus albus and L. angustifolius (Fabaceae, Faboideae)
Seisdedos, Lina1,2*; Ana M. Planchuelo2*
1 Botánica Morfológica, Facultad de Ciencias Agropecuarias. Pje. Félix Aldo Marrone 746, Ciudad Universitaria, Córdoba. Argentina.
2 CREAN-IMBIV-CONICET-UNC, Fac. de Ciencias Agropecuarias, C.C. 509, (5000) Córdoba, Argentina.
* Autor corresponsal: linaseisdedos@gmail.com; aplanch@gmail.com
Resumen
Se describe y compara la morfoanatomía de las plántulas de dos especies de lupinos graníferos (Lupinus albus L. y L. angustifolius L.). Para obtener las plántulas se sembraron 60 semillas por especie en terrinas con arena gruesa. A los 20 días de la siembra se seleccionaron 15 plántulas y se midieron los largos de hipocótilos, epicótilos, y largos y anchos de folíolos, que mostraron diferencias significativas, excepto en longitudes de los folíolos. Se realizaron preparados para microscopía óptica de epidermis y cortes transversales de raíz primaria, hipocótilo, epicótilo, pecíolo y folíolo, que fueron analizados, diagramados y fotografiados. Ambas especies comparten la estructura diarca de raíz y las características de los folíolos anfiestomáticos, con estomas anomocíticos y con cara adaxial glabra. Las diferencias más notorias, son la presencia de una capa de colénquima laminar, un mayor número de haces vasculares en el hipocótilo y epicótilo de L. angustifolius y una vaina amilácea en el hipocótilo de L. albus. La forma cordada con lóbulos que emergen de un canal central en el pecíolo de L. angustifolius reafirman similitudes morfológicas con L. gibertianus. Las mayores diferencias en los folíolos son el ancho y la estructura del mesofilo que es dorsiventral en L. albus e isobilateral en L. angustifolius. Se describe por primera vez para Lupinus la presencia de un epitricopodio en los tricomas tricelulares que cubren la cara abaxial de los folíolos. Las estructuras anatómicas fueron comparadas y discutidas con otras especies del género, con condiciones ambientales y modificaciones logradas por mejoramiento vegetal. Este trabajo sirve como base de conocimientos para futuras investigaciones sobre posibles relaciones entre los tejidos de sostén y de conducción y el comportamiento de las plantas ante la infestación de patógenos y estrés hídrico.
Palabras clave: anatomía vegetal; germinación; Leguminosae; lupines.
Abstract
The morphoanatomy of seedlings of two cultivated grain lupines is described and compared (Lupinus albus L. and L. angustifolius L.). To obtain the seedlings, 60 seeds of each species were sown in terrines with a coarse sand substrate. After 20 days from sowing, 15 seedlings were selected and the lengths of hypocotyl, epycotyl were measured as well as, the length and width of leaflets, which showed significant differences except in the lengths of the leaflets. Optical microscope slides were done for the epidermis and cross-sections of primary root, hypocotyl, epycotyl, petiole and leaflet, the sections were analyzed, illustrated and photographed. Both species share the same structure of diarch root, glabrous adaxial face and anfistomatics characteristics with anomocytic stomata in leaflets epidermal layers. The most noticeable differences between the species seedlings are the presence of a laminar collenchyma layer and the larger number of vascular bundles in the hypocotyl and epycotyl of L. angustifolius and a starchy layer sheath in the hypocotyl of L. albus. The cordate form and the two lobes emerging from a center channel in the petiole of L. angustifolius, reaffirm other morphological similarities with the species L. gibertianus. The major differences in the leaflets are the width and the structure of the mesophyll which is dorsiventral in L. albus and is isobilateral in L. angustifolius. The structure of an epitricopodium in tricelular trichomes are described for the first time for the genus Lupinus. The anatomical structures were compared and discussed with those of other species of the genus, with environmental conditions and with modifications by plant breeding. This work serves as a basic knowledge for further research to find if there are relationship between support tissues and transport system with the plant protection strategies against pathogen infections and water stress.
Key words: germination; lupins; Leguminosae; plant anatomy.
INTRODUCCIÓN
Las especies del género Lupinus de origen europeo, conocidas vulgarmente con los nombres de lupinos, lupines, chochos o altramuces, se cultivan desde la antigüedad (Hort, 1916; Maurizio, 1932; Brehaut, 1933; Hedrick, 1972) como abono verde por ser mejoradoras de suelos arenosos y para la producción de granos de alto valor nutricio-nal, para la alimentación humana y animal (Gladstones, 1974). En Sudamérica el chocho, tarwi o tarhui (Lupinus mutabilis Sweet) fue uno de los ingredientes en las dietas de los Incas y otras civilizaciones de las altiplanicies andinas de Perú, Bolivia y Ecuador (Antúnez de Mayolo, 1982; Jacobsen y Mujica, 2006; Tapia, 2015). En tiempos modernos, el cultivo de lupinos no prosperó al ritmo de otras leguminosas, por el sabor amargo y la toxicidad de los granos, debida a los contenidos de alcaloides quinolicidínicos, que obligan a realizar varios métodos de lavados (Mohr, 1988). El mejoramiento vegetal a través de los años, logró un sinnúmero de variedades dulces de las especies nativas de la Subregión Mediterránea (Planchuelo, 1994), entre ellas Lupinus albus L. (lupino blanco), L. angustifolius L. (lupino de hojas angostas) y L. luteus L. (lupino amarillo) y de la especie andina L. mutabilis Sweet (lupino andino, chocho o tarwi). Estas especies de lupinos se cultivan actualmente en varios paises de climas templados fríos. Los granos son usados en la alimentación humana con múltiples usos culinarios y las harinas para productos panificables y manufacturados (Planchuelo y Fuentes, 2005).
Los avances de las investigaciones sobre las especies de Lupinus , están plasmadas en los trabajos publicados en los Proceeding de las «International Lupin Conferences», cuyos tópicos considerados tratan sobre recursos genéticos, mejoramiento vegetal, composición química de plantas y semillas, aspectos agronómicos del cultivo, y nutrición humana y animal. La mayoría de los trabajos sobre características morfoanatómicas de Lupinus están incluidos en forma dispersa en los numerosos tratamientos de la familia Leguminosas y en los textos y manuales de Anatomía Vegetal como Metcalfe y Chalk (1950) y Esau (1982). Entre las publicaciones que tratan temas morfoanatómicos exclusivamente de Lupinus se pueden citar los de Compton (1912), Boas y Merkenschlager (1923); Holden y Chesters (1925), Dracup y Kirby (1996); Acuña y Planchuelo (1999); Golov-chenko (2000); Briceño, Azócar, Fariñas y Rada (2000); Petrova (2002); Seisdedos y Planchuelo (2011, 2017) y Zamora-Natera y Terrazas (2012).
En Argentina no existen antecedentes de cultivos extensivos, salvo pequeñas superficies de L. albus destinadas a la industrialización de pickles, la comercialización de granos considerados medicinales y a la producción de píldoras de usos terapéuticos para combatir el ácido úrico y el colesterol (Planchuelo, 2007).
El objetivo de este trabajo es dar a conocer la morfoanatomía de las plántulas de las dos principales especies de lupinos europeos (Lupinus albus y L. angustifolius), que fueron introducidas para estudios experimentales y como cultivos inverno-primaverales en los sistemas agrícolas de la pradera pampeana (Ravelo y Planchuelo, 1999, 2003, 2006, 2011; Ravelo, Planchuelo, Zanvettor, 1999; Ravelo, 2015; Ravelo, Zanvettor, Seisdedos, Maich, Sánchez, 2015).
MATERIALES Y MÉTODOS
Se utilizaron semillas de los siguientes orígenes: para Lupinus albus la variedad Rex del fitomejorador von Baer de Temuco, Chile y para L. angustifolius la variedad Tango del Banco Nacional de Germoplasma de Polonia situado en «Wiatrowo Breeding Station», Polonia. Las muestras de semillas estuvieron almacenadas en contenedores a 5°C hasta el momento de la siembra. Para la germinación se tomaron 60 semillas al azar por especie, que fueron sembradas en tres repeticiones a razón de 20 semillas por terrinas de 20 x 30 cm, con un sustrato de arena comercial gruesa. Las terrinas fueron colocadas en una cámara de cultivo a 20° de temperatura, con un fotoperíodo de 8 h y con 16 h de oscuridad, según las recomendaciones del International Seed Testing Association (ISTA, 2012).
Se siguieron los mismos controles de humedad del sustrato con irrigación diaria de agua destilada, según las indicaciones de Planchuelo y Seisdedos (2015) para los ensayos en terrinas realizados con especies silvestres de Lupinus. A los 20 días de la siembra se seleccionaron 15 plántulas al azar (cinco de cada terrina) que fueron extraídas con un pan de sustrato. Las raíces se lavaron y se realizaron las mediciones de la elongación del hipocótilo, epicótilo y pecíolo con una regla flexible con precisión de 0,5 mm bajo lupa con 4x de aumento. Se seleccionó la tercera hoja y en el folíolo medio, se midió el largo y ancho máximo (parte distal del folíolo oblanceola-do). Esas mismas plántulas se utilizaron para los estudios realizados en material fresco y se eligió la más representativa de la muestra de cada especie para ilustrar gráficamente su morfología (Fig. 1). El resto de las plántulas se conservó en FAA (formaldehído, ácido acético, etanol 96°) para el análisis morfoanató-mico de cortes transversales de los órganos de las plántulas.
Con las plántulas recién extraídas, se realizaron las extracciones de las epidermis de las caras adaxial y abaxial de los folíolos por diversas técnicas histológicas, de raspado y breve macerado con hipoclorito de sodio, técnica de peeling (D'Ambrogio de Argüeso, 1986) y de peeling modificado (Zarlavsky, 2014). Las epidermis fueron teñidas con safranina y montadas en gelatina-glicerina. Se tomaron fotografías con microscopio óptico.
Se realizaron preparados semipermanen-tes de cortes transversales de la raíz primaria, hipocótilo, epicótilo, pecíolo y de la zona media del folíolo central del tercer nomofilo siguiendo las técnicas de D'Ambrogio de Ar-güeso (1986). Los cortes se tiñeron con la doble coloración de azul astral para identificar la celulosa en las paredes primarias y con safranina para la identificación de la lignina en las paredes secundarias lignifica-das (Schweingruber, 2007). Se utilizó una solución acuosa del reactivo de Lugol (iodo-ioduro de potasio) para la detección de almidón en los contenidos celulares.
Pequeños trozos de raíz primaria, hipo-cótilo, epicótilo, pecíolos y folíolos de las plántulas conservadas en FAA fueron deshidratados en una serie de concentraciones ascendentes de alcohol etílico/xilol, con la posterior inclusión en parafina (Johansen, 1940). Se realizaron cortes transversales de 12 a 14 /um de espesor con un micrótomo rotativo. Los cortes fueron teñidos con la doble coloración de azul astral y safranina y fueron montados con Bálsamo de Canadá sintético.
Los diagramas de los transcortes fueron realizados a escala mediante un tubo de dibujo adosado a un microscopio estereoscópico y la codificación de los tejidos es la propuesta por Metcalfe y Chalk (1950) con el agregado de un diseño original para el clorénquima esponjoso de los folíolos. Para una mejor nitidez de los diagramas no se representaron los tricomas epidérmicos.
18 mm
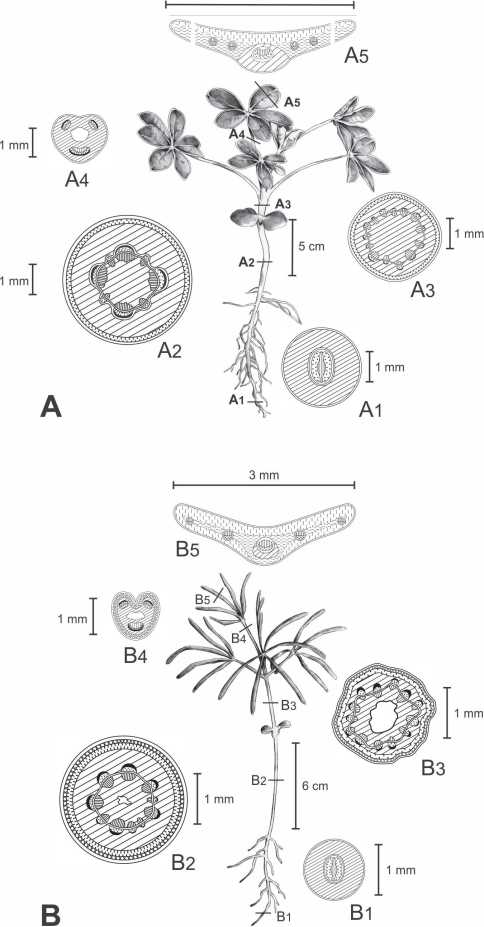
Fig. 1. Representación del estado de crecimiento promedio de las plántulas de L. albus (A) y L. angustifolius (B) a los 20 días después de la siembra y diagramas tisulares de las secciones transversales de los órganos según los patrones de Metcalfe & Chalk (1950), más esquemas especiales diseñados para el trabajo. A1, B1: Raíz primaria; A2, B2: Hipocótilo. A3, B3: Epicótilo. A4, B4: Pecíolo. A5, B5: Folíolo.
Todos los datos de mediciones fueron sometidos a un análisis estadístico para verificar si las diferencias de las medias aritméticas eran o no significativas, mediante el test de Tukey con el Programa InfoStat (Di Rienzo et al., 2012).
RESULTADOS Y DISCUSIÓN
1. Características del desarrollo
DE LAS PLÁNTULAS
Si bien la germinación comienza luego de la imbibición de la semilla cuando la radícula rompe la cubierta seminal en la zona hilar opuesta a la lente (Perissé, Planchuelo, Aiazzi, 2000); en las terrinas se hizo visible cuando parte del embrión afloró por encima del sustrato manteniendo una posición curva, porque los cotiledones eran empujados hacia arriba por el hipocótilo. En ambas especies la germinación es epigea, y perteneciente al tipo fanerocotilar según la clasificación de Duke y Polhill (1981) y de acuerdo a la clasificación de De Vogel, corresponden a los tipos morfológicos Sloanea, subtipo Sloanea (De Vogel, 1979, 1980) y al tipo Sophora según Ye (1983). La primera etapa del proceso de germinación es heterótrofa y los cotiledones reservantes proveen los nutrientes necesarios para el desarrollo de los primeros estadios de la plántula. A posterio-ri el hipocótilo se alarga manteniendo una posición curva hasta la emergencia de los cotiledones que retienen la cubierta seminal en forma de capuchón en su parte distal. Aproximadamente, a los 8 a 10 días después de la siembra, los cotiledones se liberan de la cubierta seminal, se separan entre sí, se expanden para dejar emerger al epicótilo y se tornan fotosintéticamente activos, dando comienzo a la etapa autótrofa.
El análisis cronológico del crecimiento de las plántulas mostró que las dos especies tienen un comportamiento similar. Luego de separados los cotiledones, aproximadamente a los 15 a 18 días después de la siembra, el hipocótilo sigue creciendo mientras que el epicótilo se mantiene poco desarrollado, pero portando entre dos y tres hojas bien expandidas.
Ambas especies tuvieron un porcentaje de emergencia de plántulas normales del 100 % en todas las terrinas, lo que demuestra un buen estado sanitario de las semillas que está correlacionado con el vigor necesario para el establecimiento de la planta en sistemas de cultivo en concordancia con lo evaluado por (Perissé, Lovey, Planchuelo, 2006).
2. MORFOANATOMíA DE LOS ÓRGANOS DE LAs plántulas
La Fig. 1 muestra dibujos de plántulas de Lupinus albus y L. angustifolius que son representativas de un estado de crecimiento promedio de 20 días después de la siembra. Se muestran también los diagramas tisula-res de los cortes transversales de raíz, hipo-cótilo, epicótilo, pecíolo y folíolo Como se puede observar hay diferencias de tamaño y estructuras entre las plántulas; las de L. angustifolius tienen órganos de mayor longitud que las de L. albus, pero toda la arquitectura de la plántula de esta última especie es más robusta. Estas diferencias pueden continuar siendo evidentes hasta el estadio de roseta basal y ser atribuidas a los tamaños de las semillas tal como lo describe Huyghe (1993). En el diagrama del folíolo de L. albus, (Fig. 1 A5) se realizaron dos interrupciones en la lámina debido al ancho del folíolo, que si fuera dibujado en su totalidad superaría el espacio de toda la ilustración.
La Tabla 1 muestra los valores promedios y los errores estándares de las longitudes de los hipocótilos, epicótilos, pecíolos y largo y ancho máximo de los folíolos medios de la tercera hoja, de una muestra de 15 plántulas de cada especie, a los 20 días de la siembra. Como se puede observar hay diferencias significativas (p<0,05) en todos los valores de los órganos evaluados, excepto en las longitudes de los folíolos.
Tabla 1. Características de las longitudes de hipocótilo, epicótilo, pecíolo y largo y ancho de los folíolos (media ± desvío estándar expresado en cm). Letras minúsculas diferentes indican que hay diferencias estadísticamente significativas entre las medias involucradas (test de Tukey, p < 0,05).
| Especie | Hipocótilo | Epicótilo | Pecíolo | Largo de folíolo | Ancho de folíolo |
| Lupinus albus | 5,19 ± 0,36 a | 1,25 ± 0,31 a | 7,39 ± 0,49 a | 3,37 ± 0,40 a | 1,83 ± 0,33 a |
| Lupinus angustifolius | 6,95 ± 0,21 b | 3,61 ± 0,39 b | 3,53 ± 0,59 b | 3,81 ± 0,63 a | 0,35 ± 0,07 b |
2.1. Estructura de la raíz.- La observación de las raíces a los 20 días luego de la siembra evidencia que L. albus consta de una raíz primaria bien desarrollada con un buen sistema de raíces laterales, en cambio el sistema radicular de L. angustifolius es menos desarrollado, con pocas raíces laterales, tal como fue señalado por Clemens, White, Buirchell (1993) (Fig. 1 A y B). Las raíces laterales son mucho más delgadas que la raíz principal coincidiendo con la típica estructura de un sistema alorrizo de raíz pivotante (Dracup y Kirby, 1996). El mejor desarrollo radicular que presenta L. albus puede influir favorablemente en los rendimientos de granos como lo sugieren Del Canto, Osorio, Ru-payán, Lichtin, Maureira-Butler (2015).
Ambas especies tienen una estructura anatómica diarca que es típica de los lupinos anuales de grano y perennes silvestres (Compton, 1912; Boas y Merkenschlager, 1923; Holden y Chesters, 1925; Petrova, 2002), con el metaxilema central bien desarrollado, el protoxilema en los extremos y el floema que se encuentra a cada lado del xilema (Fig. 1. A1, B1 y Fig. 2A y B). El periciclo es una capa uniestratificada de células parenquimáticas, en posición externa al floema y forma un conjunto pluriestratifi-cado frente a los polos del protoxilema. Por fuera del cilindro central está la endodermis con bandas de Caspary, que tiene tres capas en L. albus y dos capas en L. angustifolius coincidiendo exactamente con lo encontrado por (Petrova, 2002) (Fig.1, A1 y B1. Fig. 2 B). El parénquima cortical, con células poliédricas y grandes espacios intercelulares y la rizodermis, son semejantes en ambas especies (Fig. 2 A).
2.2. Estructura del hipocótilo.- Como se puede observar en la Tabla 1 los hipocóti-los de L. albus, son más cortos que los de L. angustifolius, pero la mayor elongación no está correlacionada con un buen desarrollo radicular, lo que podría sugerir un debilitamiento en la arquitectura de la plántula tal como lo señalan Dracup y Kirby (1996).
El corte transversal del hipocótilo de L. albus (Fig. 1 A2) muestra una amplia médula central de células parenquimáticas, mientras que en L. angustifolius la parte central de la médula es hueca (Fig. 1 B2). El sistema vascular es similar en ambas especies y está representado por haces vasculares colaterales abiertos interconectados por un cambium inter-fascicular bien desarrollado. Cada haz vascular tiene un casquete de fibras que cubre al floema (Fig. 2C). Hacia afuera se encuentra el parénquima cortical que está rodeado por una capa de clorénqui-ma que se hace visible en las plántulas que estuvieron expuestas a mayor cantidad de luz. Las características descriptas coinciden con los análisis de los sistemas vasculares de plántulas de varias especies de Lupinus realizadas por Compton (1912) y Holden y Chesters (1925) y difieren de lo encontrado en L. nanus Douglas ex Benth., originaria de California (Holden y Chesters, 1925). En L. angustifolius se observa una capa de colén-quima laminar en posición subepidérmica. La capa periférica en ambas especies es la epidermis uniestratificada. Las diferencias más notorias, son la presencia de la capa de colénquima laminar y el mayor número de haces vasculares en L. angustifolius (Fig. 1 B2 y Fig. 2 E) y una vaina uniestratificada amilácea, que fue identificada por reacción con lugol, en la zona basal del hipocótilo de L. albus (Fig. 1 A2 y Fig. 2 D) tal como fue señalado por Acuña y Planchuelo (1999). La capa subepidérmica de colénquima contribuye a un sistema de sostén que le permite reforzar los tejidos del hipocótilo a L. angustifolius por ser de mayor elongación y menor diámetro que el de L. albus. Por otro lado, el almidón de la vaina amilácea, puede considerarse como un proveedor de nutrientes para una mayor formación de raíces laterales en L. albus con respecto a la plántula de L. angustifolius.
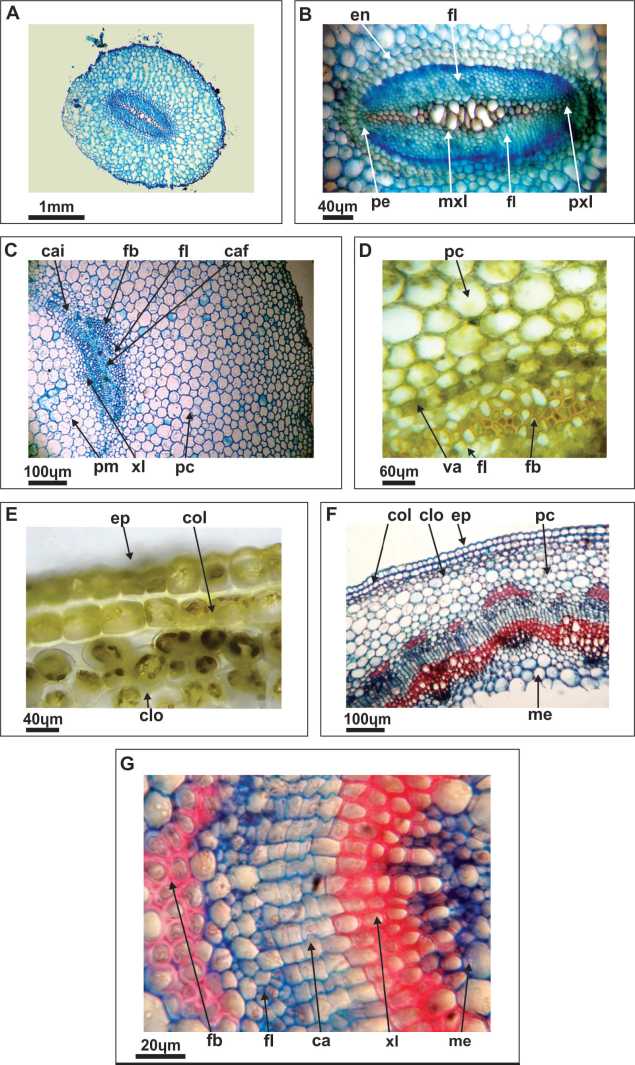
Fig. 2. Fotomicrografías de secciones transversales de raíz y tallo de plántulas. A-D). L. al-bus. E-G) L. angustifolius. A, B: Raíz primaria con detalle de cilindro central. C-E: Hipocótilo: Detalle de estela, médula y parénquima; detalle del parénquima y vaina amilácea; detalle de capa de coléquima. F, G: Epicótilo: Detalle de haces vasculares; detalle de un haz vascular. Referencias: ca, cambium; caf, cambium fascicular; cai, cambium interfascicular; clo, clo-rénquima; col, colénquima laminar; en, endodermis; ep, epidermis; fl, floema; fb, fibras; me, médula; mtx, metaxilema; pc, parénquima cortical; pe, periciclo; pm, parénquima medular; pxl, protoxilema; va, vaina amilácea; xl, xilema.
Falta comprobar si las diferencias estructurales entre ambas especies influyen en la resistencia al ataque del hongo Rhizoctonia solani cepa ZG3 que causa la enfermedad de la podredumbre del hipocótilo (Nelson y Delane, 1990).
2.3. Estructura del epicótilo.- El epicótilo de L. albus (Fig. 1 A3) muestra una amplia médula central de tejido parenquimático, mientras que en L. angustifolius la zona central es hueca. Los haces vasculares son iguales en su constitución pero de menor tamaño que los del hipocótilo (ver detalle en Fig. 2 G). Se graficó una capa de clorénquima que se observó en algunas plántulas que estaban más expuestas a la luz. El colénquima subepidérmico del hipocótilo también está presente en el epicótilo de L. angustifolius y está ausente en L. albus (Fig. 1 A3 y B3; Fig. 2 F y G).
2.4. Estructura del pecíolo.- El sistema vascular del pecíolo de ambas especies proviene de un nudo trilacunar que contiene tres haces vasculares bien diferenciados, dos pequeños y uno de mayor tamaño. En la zona central, el pecíolo presenta un espacio aéreo de origen lisígeno coincidiendo con lo observado por Zamora-Natera y Terrazas (2012). El corte transversal del pecíolo de L. albus (Fig. 1 A4, Fig. 3 A) tiene una pequeña escotadura poco profunda en la parte ventral a diferencia de L. angustifolius que presenta una forma cordada con dos lóbulos que emergen de un canal central (Fig. 1 B4, Fig. 3 B). Las características del pecíolo de L. angustifolius, reafirman otras similitudes morfológicas con la especie L. gibertianus
C.PSm., nativa de la Subregión Atlántica (Planchuelo, 1994), descriptas por Planchuelo (1996) en un estudio comparativo entre especies de origen europeo y americano.
2.5. Estructura de los folíolos.- Como se puede observar en la Fig. 1, A y B todas las hojas son palmaticompuestas con folíolos que nacen de un punto común en la zona distal del pecíolo, en donde se juntan los pulvínulos que están en la base de cada uno de los folíolos. No hay una clara diferencia entre las hojas de las plántulas como para clasificarlas en protofilos y nomofilos, pero sí se evidenció que solo tienen cinco folíolos, mientras que en ambas especies las hojas de las plantas adultas tienen entre siete y nueve folíolos. Con respecto a los tamaños de los folíolos se pone en evidencia en la Fig. 1 (A5 y B5) y en la Tabla 1 que las diferencias más significativas están en los anchos, ya que los largos de los folíolos son aproximadamente iguales en ambas especies, mientras que el ancho de los folíolos de L. albus es aproximadamente seis veces mayor que el de los folíolos de L. angustifolius.
El corte transversal del folíolo de L. albus (Fig. 1 A4, Fig. 3 C) muestra una estructura de mesofilo de disposición dorsiventral con dos capas de clorénquima en empalizada hacia la cara adaxial, que se continúa a la altura de la nervadura media y cuatro capas de clorénquima esponjoso interrumpido por células parenquimáticas incoloras que rodean a la nervadura central y se extienden hasta la cara abaxial.
La estructura foliar de L. angustifolius (Fig. 1 B4, Fig. 3 D) es isobilateral con un clorénquima en empalizada de aproximadamente tres capas hacia la cara adaxial que se continúa a lo largo de todo el ancho del folíolo, un clorénquima esponjoso de poco espesor que se extiende a la altura de la nervadura media hacia la cara abaxial, y una o dos capas de clorénquima en empalizada hacia la cara abaxial, en donde las células están separadas por grandes espacios intercelulares. El hacecillo vascular de la nervadura central en ambas especies es colateral con xilema hacia la cara adaxial y floema hacia la cara abaxial, posee grupos de fibras en relación al floema y está rodeado por una vaina de células parenquimáticas incoloras. Los hacecillos laterales son colaterales con pocos elementos conductores, sin fibras y también están rodeados de una vaina pequeña de células incoloras.
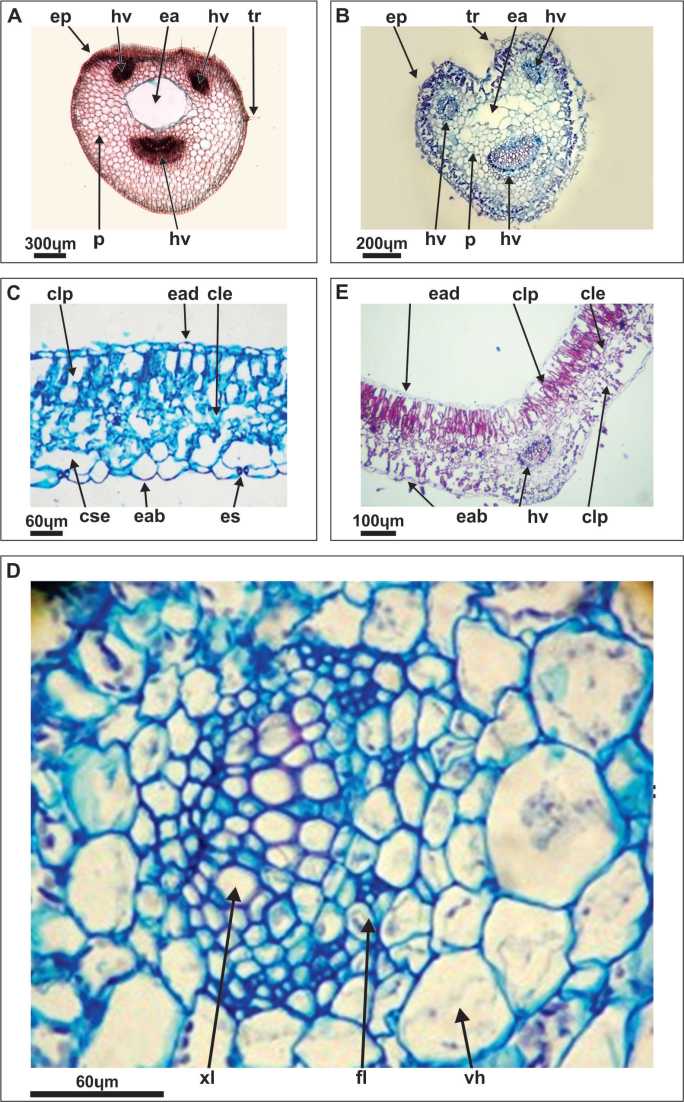
Fig. 3. Fotomicrografías de secciones transversales de hoja. A, C, D) L. albus. B, E) L. an-gustifolius. A, B: Pecíolo. C, E: Transcorte por lámina de folíolo. D: Transcorte mostrando un detalle del hacecillo medio. Referencias: cle, clorénquima esponjoso; clp, clorénquima en empalizada; cse, cámara subestomática; eab, epidermis abaxial, ead: epidermis adaxial; ea, espacio aéreo; ep, epidermis; es, estoma; fl, floema; hv, hacecillo vascular; p, parénquima; tr, tricoma; vh, vaina del haz; xl, xilema.
La epidermis adaxial de los folíolos de ambas especies es glabra con células de paredes poliédricas irregulares de contornos levemente ondulados (Fig. 4 A1, B1), en cambio la abaxial es pilosa, con tricomas adpresos, simples, tricelulares, formados por una célula basal globosa de mayor tamaño que las células epidérmicas, un epitricopo-dio de paredes engrosadas que se tiñen con safranina y una célula apical acicular (Fig. 4 C). Estas características de los tricomas se describen por primera vez para el género Lupinus y es una ampliación de las señaladas por Golovchenko (2000); Briceño et al. (2000); Seisdedos y Planchuelo (2011, 2017); Zamora-Natera y Terrazas (2012).
En L. albus, en vista superficial se observan entre nueve y diez células pentagonales que se disponen en forma radial en la base de los tricomas (Fig. 4. A2), mientras que en L. angustifolius las células que rodean a los tricomas son de forma irregular (Fig. 4 B2). Estos tipos de distribución de las células en la base de los tricomas fueron descriptas por Seisdedos y Planchuelo (2011) y Zamora-Natera y Terrazas (2012), y según Stenglein, Arambarri, Colares, Novoa, Vizcaino (2003) pueden contribuir a la sistemática de los diferentes grupos taxonómicos de Facaceae.
Los folíolos de ambas especies son anfies-tomáticos y presentan mayormente estomas anomocíticos comunes en otros géneros de Fabaceae (Taia, 2004; Freire et al., 2005) sin embargo, también se encontraron en ambas especies algunos estomas anisocíticos con tres células auxiliares lo que demuestra que este carácter de la epidermis no tiene un gran valor taxonómico. Los estomas están levemente hundidos en relación al nivel de las células epidérmicas en concordancia con lo observado por Golovchenko (2000), Seis-dedos y Planchuelo (2011) y Zamora-Natera y Terrazas (2012).
Las características foliares observadas muestran que si bien los folíolos tienen la cara adaxial glabra y expuesta a las condiciones ambientales, las hojas tienen la posibilidad de plegar los folíolos para reducir el área expuesta a la radiación directa del sol, variando el turgor de las células de los pulvínulos tal como lo describen Jaramillo-Pérez, Quintanar-Isaías, Fraile-Ortega, Mar-tínez-Bernal, Sepúlveda-Sánchez (2015) en las hojas compuestas de Alvaradoa amorphoi-des Liebm. El plegamiento de los folíolos le permite a la planta reducir la superficie de las hojas y los tricomas de la cara abaxial generan una protección que evita la plena exposición de la epidermis y disminuye los efectos del movimiento del aire que deseca la superficie (Jones, 1992; Ely y Torres, 2003; Yabuki, 2004). Estas características junto con los estomas levemente hundidos evitan el sobrecalentamiento que genera la atmósfera desecante (Medlyn et al., 2001). Lo anteriormente expuesto fue observado durante el curso del crecimiento de las plántulas lo que demuestra una estrategia de control termohídrico de la plántula.
Las grandes diferencias en el ancho y estructura de los foliolos entre L. albus y L. angustifolius son típicas de las especies y se manifiestan desde los primeros primodios foliares hasta las hojas de la planta adulta, y según los estudios de Cowling, Buirchell, Tapia (1998), pueden estar relacionadas con los distintos tipos de domesticación de las especies.
CONCLUSIONES
Las diferencias morfoanatómicas encontradas entre las dos especies de Lupinus, descriptas en estado de plántula muestran caracteres que pueden considerarse importantes en la estructura de la planta adulta como quedó manifiesto en el desarrollo del sistema radical en Lupinus albus respecto a L. angustifolius.
Este trabajo contribuye a identificar los tejidos normales de las especies en los estadios iniciales del desarrollo de la planta y sirve como base para futuras investigaciones sobre plántulas de otras especies de Lupinus. Se considera que los resultados pueden servir de soporte a los programas de mejoramiento vegetal y como patrones tisulares para determinar si existen relaciones entre los tejidos de conducción y de sostén y el comportamiento de las plantas ante el estrés hídrico y la infestación de patógenos.
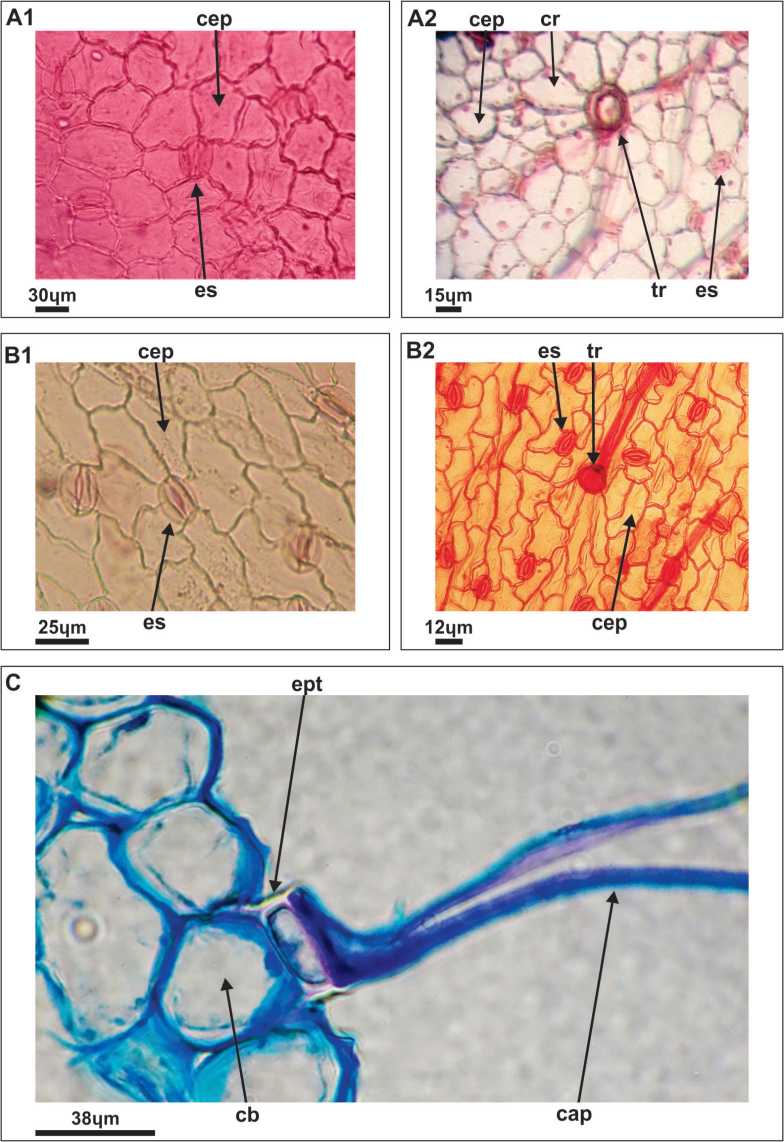
Fig. 4. Fotomicrografías de epidermis en vista superficial. A) L. albus. B) L. angustifolius A1, B1: Epidermis adaxial. A2, B2: Epidermis abaxial. Referencias: cep, célula epidérmica; es, estoma; cr células radiales. C) Corte transversal del folíolo mostrando la epidermis y un tricoma tricelular. Referencias: cap, célula apical; cb célula basal; ept, epitricopodium.
AGRADECIMIENTOS
Las autoras agradecen al Dr. Prof. Bogdan Wolko del Intitute of Plant Genetics de la Polish Academy of Science de Polonia y al Ing. Agr. y Fitomejorador Erik von Baer de «Semillas Baer» localizada en Gorbea, Provincia de Cautín en la Región de la Arau-canía, Chile, por la gentileza de facilitar la obtención de las muestras de semillas con las que se realizaron los ensayos. Nuestro especial agradecimiento al diseñador Alejandro Barbeito por su apoyo en la confección de las ilustraciones de este trabajo y al personal de la biblioteca de la Facultad de Ciencias Agropecuarias de la Universidad Nacional de Córdoba, por su apoyo en facilitar las referencias bibliográficas solicitadas. Esta investigación fue subsidiada por la Secretaría de Ciencia y Tecnología de la Universidad Nacional de Córdoba.
BIBLIOGRAFÍA
Acuña, N. y Planchuelo, A. M. (1999). Com-parative morphology of lupin seedling. In: G. Hill (Ed.), A crop for the Next Century. Proceeding International Lupin Conference. (pp. 386-393) Christchurch: Lincoln University.
Antúnez de Mayolo, S. (1982). Tarwi in An-cient Peru. In: R. Gross & E. S. Bun-ting (Eds.), Agricultural and Nutritional Aspects of Lupines. Proceedings I International Lupin Conference, 1980 (pp. 2-11). Lima-Cuzco: International Lupin Association.
Boas, F. y Merkenschlager, F. (1923). Die Lu-pine als Objekt der Pflanzenforschung. Morphologie, Anatomie, Physiologie und Pathologie der gelben Lupine: Berlin, Germany: Paul Parey.
Brehaut, E. (1933). (Trad.) Cato, the Censor, on farming. New York, USA: Columbia University Press.
Briceño, B., Azócar, A., Fariñas, M., y Rada, F. (2000). Características anatómicas de dos especies de Lupinus L. de los Andes venezolanos. Pittieria 1 (29-30): 21-35.
Clemens, J. C., White, P. F. y Buirchell, B. J. (1993). The root morphology of Lupinus angustifolius in relation to other Lupinus species. Australian Journal of Agricul-tural Research 44: 1367-1375.
Compton, R. H. (1912). An Investigation of the seedling structure in the Legumino-sae. Botanical Journal of the Linnean Society 41: 1-122.
Cowling, W. A., Buirchell, B. J. y Tapia, M. E. (1998). Lupin. Lupinus L. Promoting the conservation and use of underuti-lized and neglected crops. International Plant Genetic Resources Institute 23: 1-105.
D'Ambrogio de Argüeso, A. (1986). Manual de técnicas en histología vegetal. Buenos Aires, Argentina: Ed. Hemisferio Sur.
Del Canto, G., Osorio, C., Rupayan, A., Li-chtin, N. y Maureira-Butler, I. (2015). Assessing root variability, growth, morphology, and metabolite content, in a diverse germplasm collection of yellow lupin (Lupinus luteus, L.). In: J. Cap-raro, M. Duranti, C. Magni, A. Scara-foni (Eds.), Developing Lupin Crop into a Major and Sustainable Food and Feed Source (p. 42) Genoa: International Lupin Association.
De Vogel, E. F. (1979). Morphological types in dicot seedlings, with reference to their origin. Bulletin de la Société Botanique de France 126. Actualités Botaniques 3: 173-182.
De Vogel, E. F. (1980). Seedling of Dicoty-ledons: structure, development, types. Wageningen, Netherlands: Centre for Agricultural Publishing and Documenta-tion
Di Rienzo, J. A., Casanoves, F., Balzarini, M.
G. , González, L., Tablada, M. y Robledo, C. W. (2012). Grupo InfoStat. FCA, Un i v e rs ida d Na c i on a l de C ór do b a, Ar -gentina. Recuperado de http:// www. infostat.com.ar.
Dracup, M. y Kirby, E. J. M. (1996). Lupin Development Guide. Nedlands, Western Australia: University Western Australia Press.
Duke, J. A. y Polhill, R. M. (1981). Seedlings of Leguminosae. In: R. M. Polhill & P.
H. Raven (Eds.), Advances in Legume Systematics Part 2 (pp. 941-949). Kew, England: Royal Botanical Garden.
Ely, F. y Torres, F. (2003). Adaptaciones anatómico-estructurales foliares de Chaetolepis lindeniana (Naud.) Triana a lo largo de un gradiente altitudinal en el Páramo del Parque Nacional Sierra Nevada de Mérida (Venezuela). Plant 3 (2): 101-115.
Esau, K. (1982). Anatomía de las plantas con semilla. Buenos Aires, Argentina: Ed. Hemisferio Sur S. A.
Freire, S. E., Arambarri, A. M., Bayón, N.
D. , Sancho, G., Urtubey, E., Monti, C., Novoa, M. C., y Colares, M. N. (2005). Epidermal characteristics of toxic plants for cattle from the Salado river basin (Buenos Aires, Argentina). Boletín de la Sociedad Argentina de Botánica 40: 241-281.
Gladstones, J. S. (1974). Lupins of the Medi-terranean Region and Africa. Depart-ment of Agriculture and Food, Western Australia. Technical Bulletin 26: 1- 48.
Golovchenko, O. V. (2000). The morphology of the epidermis in some lupin species. In:
E. van Santen, M. Wink, S. Weissmann, P Roemer (Eds.), Lupin, an Ancient Crop for the New Millenium (p. 269). Canter-bury: International Lupin Association.
Hedrick, U. P. (1972). Sturtevant's edible plants of the World. New York, USA: Dover Publications, Inc.
Holden, H. S. y Chesters, A. E. (1925). The seedling anatomy of some species of Bo-tanical Journal of the Linnean Society 47: 41-53.
Hort, A. (1916). Greek and English text of Theophrastus's Enquiry into Plants (De H i sto r i a P l a n ta ru m ) . N e w Yo rk, U S A: Heinemann & G. P Putnam's Sons.
Huyghe, C. (1993). Growth of white lupin seedlings during the rosette stage as affected by seed size. Agronomie 13: 145-1 53.
International Rules for Seed Testing [ISTA]. (2012). Zurich, Switzerland. Interna-tional Seed Testing Association.
Jacobsen, S. y Mujica, A. (2006). El tarwi (Lupinus mutabilis Sweet.) y sus parientes silvestres. En: M. Moraes R., B. Ollgaard, L. P Kvist, F. Borchsenius y H. Balslev (Eds.), Botánica Económica de los Andes (pp. 458-482). La Paz: Universidad Mayor de San Andrés.
Jaramillo-Pérez, A. T., Quintanar-Isaías, A., Fraile-Ortega, M. E., Martínez-Bernal, A. y Sepúlveda-Sánchez, J. D. (2015). Morfoanatomía foliar de Alvaradoa amor-phoides Liebm. del estado de Morelos, México. Polibotánica 40: 79-98.
Johansen, D. A. (1940). Plant Microtech-nique. New York, USA: McGraw-Hill Co.
Jones, H. G. (1 992). Plants and microcli-mate, a quantitative approach to envi-ronmental plant physiology. New York, USA: Cambridge University Press.
Maurizio, A. (1932). Histoire de L' Alimenta-tion Végétale depuis la Préhistoire Jusq' a nos Jours. Paris, France: Bibliothe'que Scientifique.
Medlyn, B. E., Barton, C. V. M., Broadmead-ow, M. S. J., Ceulemans, R., De Ange-lis, P, Forstreuter, M., Freeman, M., Jackson, S. B., Kellomaki, A., Laitat, E., Rey, A., Roberntz, P, Sigurdsson, B. D., Strassemeyer, J., Wang, K., Curtis, P S. y Jarvis, P G. (2001). Stomatal Con-ductance of Forest Species after Long-Term Exposure to Elevated CO2 Concentraron: A Synthesis. New Phytologist 149: 247-264.
Metcalfe, C. R. y Chalk, L. (1950). Anatomy of the Dicotyledons, Vol 2. Oxford, Eng-land: Oxford & Clarendon Press.
Mohr, U. (1988). An Alternativa Debittering Process for L. mutabilis. In: W. Swie-cicki, K. Swiecicki, A. Micke (Eds.), Proceedings of V International Lupin Conference (pp. 701-705). Poznan: In-ternational Lupin Association.
Nelson, P y Delane, R. (1990). Producing lupins in Western Australia. Department of Agriculture, Western Australia. Bul-letin 4179 (161/30): 1-94.
Perissé, P, Lovey R. J. y Planchuelo, A. M. (2006). Seed vigour tests as tools for prediction field emergence in white lupin (Lupinus albus L.). In: E. van Santen & G. D. Hill (Eds.), Where Old and New World Lupins Meet (pp. 28-31). Guada-lajara: International Lupin Association.
Perissé, P, Planchuelo, A. M. y Aiazzi, M. (2000). Germination water requirements for Lupinus albus and L. angustifolius. In: E. van Santen, M. Wink, S. Weiss-mann, P Roemer P (Eds.), Lupin, an Ancient Crop for the New Millenium (pp. 352-354). Klink-Müritz: International Lu-pin Association.
Petrova, M. V. (2002). Anatomic structure. In: B. S. Kurlovich (Ed.), Lupins: Geog-raphy, Classification, Genetic Resources and Breeding (pp. 183-203). St. Peters-burg, Rusia: Publishing house «Intan».
Planchuelo, A. M. (1994). Wild lupins distri-bution and its implication as germplasm resources. In: J.M. Neves Martins, M.L. Beirao Da Costa (Eds.), Advances in Lu-pin Research (pp. 65-69). Évora: Inter-national Lupin Association.
Planchuelo, A. M. (1996). Relationship be-tween South American and European species of Lupinus. In: B. Pickergill & M. Lock (Eds.), Advances in Legume Systematics, Legumes of Economic Im-portance (pp. 109-116). Kew: Royal Bo-tanical Garden.
Planchuelo, A. M. (2007). Evaluación de los usos medicinales de las semillas de lupino blanco (Lupinus albus L.). Boletín Latino del Caribe Plantas Medicinales Aromáticas 6 (5): 213-215.
Planchuelo, A. M. y Fuentes, E. (2005). El tarwi o chocho: Una de las principales fuentes de proteína vegetal de las comunidades indígenas de los Andes Centrales. Revista Argentina de Antropología Biológica 7 (1): 159.
Planchuelo, A. M. y Seisdedos, L. (201 5). Germination of wild lupinus with ornamental features. In: J. Capraro, M. Duranti, C. Magni, A. Scafaroni (Eds.), Developing lupin crop into a major and sustainable food and feed source (p. 24). Milán: International Lupin Associa-tion.
Ravelo, A. C. (2015). Lupin and soybean global cropping evolution: lessons learned worldwide and in Argentina. In: J. Cap-raro, M. Duranti, C. Magni, A. Scara-foni (Eds.), Developing Lupin Crop Into a Major and Sustainable Food and Feed Source (p. 18). Milán: International Lupin Association.
Ravelo, A. C. y Planchuelo, A. M. (1999). Estimating growth stages in white lupin (Lupinus albus L.) In: G. Hill (Ed.), A crop for the Next Century (pp. 60-63). Christchurch: Lincoln University.
Ravelo, A. C. y Planchuelo, A. M. (2003). Aptitud agroecológica de la pradera pampeana argentina para el cultivo del lupino blanco (Lupinus albus L.). AgriSci-entia 20: 35-44.
Ravelo, A. C. y Planchuelo, A. M. (2006). Evaluation of agroecological conditions for selected cultivars of white lupin (Lu-pinus albus L.) in Argentina. In: E. van Santen & G. Hill (Eds.), Where Old and New World Lupins Meet (pp. 9-14). Guadalajara: International Lupin Asso-ciation.
Ravelo, A. C. y Planchuelo, A. M. (2011). Rainfall and temperature changes and drought occurrences redefine lupin crop zones in Argentina. In: B. Naganowska, P. Kachlicki & B. Wolko (Eds.), Lupin crops an opportunity for today, a promise for the future (pp.136-140). Poznan: International Lupin Association.
Ravelo, A. C., Planchuelo, A. M., y Zanvettor, R. (1999). Zonificación agroecológica del lupino blanco (Lupinus albus L.) para la Provincia de Córdoba (Argentina). Revista de la Facultad de Agronomía 19 (3): 243-450.
Ravelo, A. C., Zanvettor, R., Seisdedos, L., Maich, R. y Sánchez, M. (2015). Field assessment of narrow leave lupin (Lupinus angustifolius L.) in Córdoba. In: J. Capraro, M. Duranti, C. Magni, A. Sca-faroni (Eds.), Developing lupin crop into a major and sustainable food and feed source (p. 119). Milan: International Lupin Association.
Seisdedos, L. y Planchuelo, A. M. (2011). Morphological studies of leaflets epidermis as a contribution for understanding Lupinus taxonomy and phylogeny. In: B. Naganowska, P. Kachlicki & B. Wolko (Eds.), Lupin crops, an opportunity for today a promise for the future (p. 33). Poznan: International Lupin Association.
Seisdedos, L. y Planchuelo, A. M. (201 7). Características foliares de cinco especies de Lupinus nativas de los valles interandinos. Boletín de la Sociedad Argentina de Botánica 52 (Supl.): 30.
Schweingruber, F. H. (2007). Wood Structure and Environment. Berlin-Heidelberg, Alemania: Springer.
Stenglein, S. A., Arambarri, A., Colares, M. N., Novoa, M. C. y Vizcaino, C. E. (2003). Leaf epidermal characteristics of Lotus subgenus Acmispon (Fabaceae: Loteae) and numerical taxonomic evalu-ation. Canadian Journal of Botany 81: 933-944.
Taia, K. W. (2004). Leaf characters within tribe Trifolieae (family Leguminosae). Pakistan Journal of Biological Sciences 7: 1463-1472.
Tapia, M. E. (2015). El tarwi, lupino Andino. Tarwi, tauri o chocho (Lupinus mutabi-lis Sweet). Lima, Perú: Fondo Italo Peruano.
Yabuki, K. (2004). Photosynthetic Rate and Dynamic Environment. Dordrecht, Neth-erlands: Kluwer Academic Publishers.
Ye, N. (1983). Studies on the seedling types of dicotyledonous plants (Magnoliophyta, Mag-noliopsida). Phytologia 54: 161-189.
Zamora-Natera, J. F. y Terrazas, T. (201 2). Anatomía foliar y del pecíolo de cuatro especies de Lupinus (Fabaceae). Revista Mexicana de Biodiversidad 83: 687-697.
Zarlavsky, G. E. (2014). Histología vegetal. Técnicas simples y complejas. Buenos Aires, Argentina: Sociedad Argentina de Botánica.














