PUNTOS CLAVE
Conocimiento actual
• El síndrome de intestino corto se asocia con elevadas tasas de morbimortalidad en los pacientes pediátricos. El abordaje interdisciplinario mejora los resultados a corto y a largo plazo. Entre los recursos disponibles para el tratamiento se incluye el teduglutide, un análogo del péptido similar al glucagón tipo 2 (GLP-2).
Contribución del artículo al conocimiento actual
• A partir de la evidencia disponible y de la experiencia de expertos argentinos, se proponen recomendaciones para el uso de teduglutide, dirigidas a los profesionales de la salud que tratan a estos pacientes, así como a las autoridades sanitarias.
El síndrome de intestino corto (SIC) en los pa cientes pediátricos se asocia con elevadas tasas de morbimortalidad1,2. Recientes artículos, incluido un consenso argentino3, demuestran que el abordaje por equipos interdisciplinarios de expertos enfocados en la rehabilitación intestinal (RI) mejora los resultados a corto y largo plazo4,5. Entre los recursos terapéuticos se menciona el teduglutide, un análogo recombinante del péptido similar al glucagón tipo 2 (GLP-2) que presenta la sustitución de un aminoácido que le con fiere resistencia relativa a la degradación y prolonga su vida media6.
El teduglutide se une a los receptores del GLP-2, provocando la liberación de factor de crecimiento similar a la insulina tipo 1, óxido nítrico y factor de crecimiento de los queratinocitos. Estos mediadores estimulan el crecimiento de las células de las criptas y de la superficie de la mucosa intestinal, así como contribuyen a mejorar la absorción intestinal7.
Métodos
El modelo de la medicina basada en la evidencia ha optimizado la elaboración de documentos de alta ca lidad (revisiones sistemáticas, metaanálisis, guías de práctica clínica)8. Sin embargo, la adecuada interpreta ción de la información y las dificultades para adaptar la evidencia producida en otros contextos socioculturales representan todavía barreras para modificar la práctica profesional8.
En este marco, los consensos de expertos constituyen un mecanismo apropiado cuando se dispone de importan te experiencia local8. El método Delphi es una estrategia confiable y válida8 que consiste en un proceso estruc turado en el cual se emplean cuestionarios en etapas (“ruedas”) hasta lograr un consenso grupal por medio de técnicas estadísticas y retroalimentación controlada9,10. Se dispone de experiencias previas de su aplicación en Argentina, incluyendo consensos en pediatría3,11.
Un grupo de pediatras especializados en el manejo del SIC en pediatría conformaron un panel de expertos. Se efectuó una búsqueda bibliográfica en las bases de datos PubMed, Scielo e Imbiomed para la identificación de metaanálisis, revisiones sistemáticas, ensayos clínicos aleatorizados y estudios observacionales publicados en castellano, inglés y portugués hasta noviembre de 2020, acerca de la etiología y los objetivos del tratamiento de la falla intestinal (FI) en los pacientes de hasta 17 años, así como del abordaje farmacológico de esta afección en forma general y del uso de teduglutide en particular.
A partir de los artículos identificados, se elaboró un cuestionario de 29 preguntas (16 con opciones de res puesta mediante una escala de Likert de 1 a 10 puntos, ocho con respuesta dicotómica, una con respuesta tri cotómica y cuatro con desarrollo en forma de texto). El cuestionario fue remitido al panel de expertos a través de una plataforma digital que garantizaba el anonimato de las respuestas. Se consideró que se había alcanzado un consenso fuerte (muy alto) de expertos en una respuesta cuando esta obtenía un nivel de acuerdo no menor del 80%, o bien un consenso de expertos ante un nivel de acuerdo mayor del 70% con una tasa de abstención menor del 20% (Tabla 1).
Para las siete preguntas en las cuales no se alcanzó consenso en la primera rueda, se reformularon algunas respuestas mediante la introducción de las sugerencias del panel de expertos. Estas preguntas se enviaron nue vamente para su reconsideración por el panel de expertos en una segunda rueda. Se consideró como una medida de estabilidad para concluir los procesos de consulta cuando la proporción de expertos que no modificaron la respuesta respecto a la rueda precedente alcanzaba el 70%. Si bien se programó un potencial encuentro para debate abierto en torno a las preguntas que no hubieran alcanzado consenso, esta etapa no fue necesaria tras los resultados logrados después de la segunda rueda. Para todas las respuestas finales se obtuvo un consenso o consenso fuerte.
Finalmente, se elaboró un borrador de las recomen daciones generadas, las cuales fueron evaluadas y aprobadas por todos los expertos. En el marco de las restricciones propias de la pandemia por COVID-19, la totalidad del proceso fue realizado con una modalidad a distancia.
Los niveles de consenso propuestos para alcanzar el formato definitivo de estas recomendaciones se resumen en la Tabla 1 12. Este documento está dirigido a profesiona les que tratan a pacientes pediátricos con SIC, así como a las autoridades sanitarias.
Recomendaciones
#1. La FI se define como la reducción de la masa intestinal funcionante por debajo de la cantidad mínima necesaria para mantener la digestión y absorción de los alimentos, el balance hidroelectrolítico, el estado nutricional y el crecimiento, con necesidad de nutrición parenteral (NP)13.
Recomendación/afirmación con consenso fuerte de expertos.
#2. La causa más frecuente de FI es el SIC, que se produce principalmente como consecuencia de una resección masiva del intestino delgado que deja menos del 25% de la longitud esperada para la edad gestacio nal y/o cronológica. Además del largo intestinal, se debe considerar la funcionalidad del segmento remanente1,14.
Recomendación/afirmación con consenso fuerte de expertos.
#3. La etiología del SIC está asociada significativamen te con una mayor probabilidad de dependencia de la NP en los pacientes pediátricos con SIC15,16.
Recomendación/afirmación con consenso fuerte de expertos.
#4. La menor longitud del intestino remanente está asociada significativamente con una mayor probabilidad de dependencia de la NP en los pacientes pediátricos con SIC. También se deben considerar la ausencia de la válvula ileocecal, el sector de intestino remanente y el colon remanente. La probabilidad de dependencia de la NP es mayor cuando la longitud remanente es menor de 40 centímetros. Los pacientes con menos de 20 cm serán considerados casos de SIC ultracorto y tendrán dependencia prolongada o permanente de la NP2,17,18.
Recomendación/afirmación con consenso fuerte de expertos.
#5. En los pacientes quirúrgicos, la anatomía rema nente está asociada significativamente con una mayor probabilidad de dependencia de la NP en los pacientes con SIC. La anatomía de tipo 1 (yeyunostomía terminal) y de tipo 2 (anastomosis yeyunocólica), en ese orden, son las asociadas con una mayor probabilidad de dependencia de la NP19.
Recomendación/afirmación con consenso fuerte de expertos.
#6. El principal objetivo de la terapia de los pacientes con SIC es la rehabilitación intestinal (RI), entendida como la potenciación máxima de la capacidad absortiva y digestiva del tracto gastrointestinal remanente4, 20.
Recomendación/afirmación con consenso fuerte de expertos.
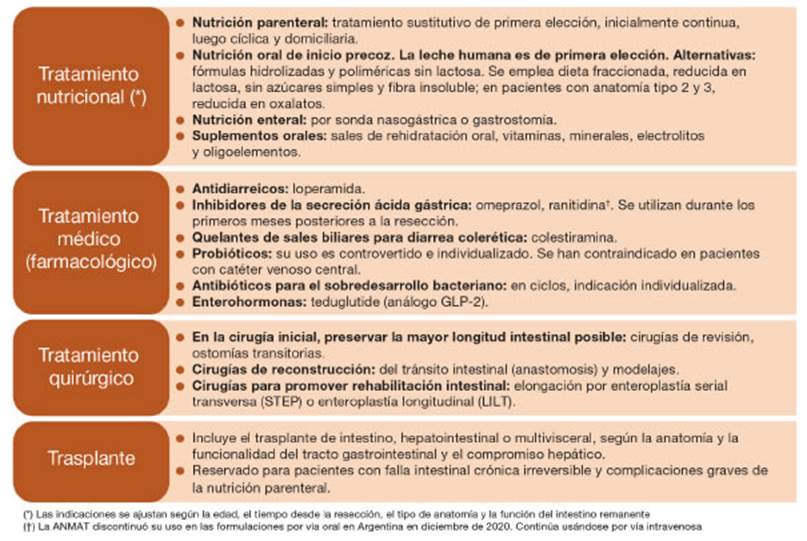
#7. El tratamiento de los pacientes con SIC debe ser llevado a cabo por un equipo multidisciplinario e incluye estrategias: [1] farmacológicas (antidiarreicos; antisecretores; antibióticos para el sobredesarrollo bacteriano; enterohormonas); [2] nutricionales (adecuación o mo dificaciones de la dieta, la nutrición enteral y/o la NP); [3] quirúrgicas (cirugía de reconstrucción, modelaje o elongación intestinal); [4] trasplante intestinal.
Recomendación/afirmación con consenso fuerte de expertos.
El manejo del SIC requiere equipos interdisciplina rios especializados para aumentar la probabilidad de RI y reducir las tasas de mortalidad y complicaciones. Estos equipos incluyen enfermeros, médicos (pediatras, gastroenterólogos, especialistas en nutrición, cirujanos), farmacéuticos, licenciados en nutrición, psicólogos y trabajadores sociales. Pueden contribuir también hemodi namistas, hematólogos, fonoaudiólogos, entre otros3,4,20.
El tratamiento se adecua a la fisiología intestinal dinámica posterior a una resección y se resume en la Figura 1 19,21,22.
#8. Para que un paciente con SIC se considere ade cuado para la terapia con teduglutide, deben reunirse las siguientes condiciones:
[A] El paciente debe encontrarse con necesidad permanente de NP y/o administración intravenosa (IV) de fluidos pese al tratamiento optimizado (incluidas las modificaciones dietéticas y las intervenciones farmacoló gicas) (recomendación/afirmación con consenso fuerte de expertos).
[B] El paciente debe encontrarse clínicamente estable (recomendación/afirmación con consenso fuerte de expertos).
[C] El paciente desea reducir o interrumpir la NP y/o administración IV de fluidos (recomendación/afirmación con consenso de expertos).
[D] El paciente no debe presentar enfermedad obs tructiva y/o maligna (recomendación/afirmación con consenso fuerte de expertos).
[E] El paciente debe estar dispuesto a administrarse diariamente las dosis subcutáneas con el compromiso de efectuar los controles solicitados por el equipo tratante para valorar la eficacia y seguridad, con eventual sus pensión ante la falta de adherencia a la terapia (recomen dación/afirmación con consenso fuerte de expertos).
La experiencia con teduglutide en la población pediá trica es aún limitada a nivel mundial. Algunas recomen daciones se extrapolan de la experiencia en adultos. Uno de los interrogantes se relaciona con cuáles pacientes de berían priorizarse para el tratamiento23 y en qué momento debería indicarse. Se pueden considerar dos escenarios:
• en los casos más graves, el objetivo es reducir el número de infusiones semanales de NP, para disminuir la tasa de complicaciones y mejorar la calidad de vida.
• en los pacientes con menor dependencia pero que no logran la autonomía, alcanzar el destete de la NP.
El teduglutide ha sido aprobado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Mé dica (ANMAT) en pacientes con SIC mayores de 1 año de edad. La terapia debe iniciarse bajo la supervisión de profesionales experimentados en el SIC pediátrico24, en coincidencia con el documento de aprobación de la Agencia Europea de Medicamentos (EMA)25. En la poso logía aprobada por la ANMAT y en las Guías Españolas26 se explicita que el tratamiento debe iniciarse cuando el paciente esté estable después de un período de adapta ción intestinal. Dichas guías definen la estabilidad como “que no haya tenido cambios superiores al 10% de los requerimientos de NP domiciliaria o nutrición enteral en los 3 meses previos al tratamiento con teduglutide”26. La estabilidad también se refiere a la recuperación tras una cirugía de RI o de elongación intestinal de al menos 3 a 6 meses, dependiendo del caso individual.
Al iniciar la terapia, el paciente debería estar libre de intercurrencias o complicaciones que puedan afectar la tolerancia o la respuesta. El mecanismo de acción de la droga y los datos de estudios en adultos sugieren el potencial de agravar procesos obstructivos y contribuir en la carcinogénesis27.
Para valorar la efectividad y seguridad de este tra tamiento novedoso y muy costoso, el paciente y sus cuidadores deben estar dispuestos a cumplir con la aplicación de inyecciones subcutáneas diarias y con los requerimientos de un monitoreo estrecho en domicilio y en consultorio.
#9. La edad mínima en que teduglutide puede indicarse en un paciente con SIC es de 12 meses.
Recomendación/afirmación con consenso fuerte de expertos.
La EMA (2016)25, la Food and Drug Administration (FDA) (2019)28 y la ANMAT24 han aprobado el uso de teduglutide para pacientes con SIC mayores de 1 año. Aquellos con SIC de inicio neonatal alcanzan la adapta ción intestinal con las estrategias que componen la RI en períodos variables. La mayor proporción de pacientes se adapta en los primeros dos años posteriores a la resec ción, pero numerosos casos lo hacen luego de varios años, hecho avalado por la experiencia en nuestro país. En pacientes con FI crónica por SIC sin complicaciones graves, podría esperarse al menos 2 años a que la adaptación permita la autonomía de la NP; en cambio, en aquellos con riesgo de alta morbilidad asociada a la NP, debería considerarse el tratamiento desde el año de vida. Se están llevando a cabo estudios en menores de 1 año para determinar la seguridad y eficacia del fárma co para potenciar el proceso de adaptación y reducir el tiempo en NP29.
#10. El teduglutide no debe administrarse a los pacientes con neoplasia maligna posible o activa, ni a aquellos con antecedentes de neoplasias malignas del tracto gastrointestinal (incluido el sistema hepatobiliar) en los últimos 5 años.
Recomendación/afirmación con consenso fuerte de expertos.
El teduglutide promueve la hiperplasia de la mucosa. Este mecanismo de acción y el uso a largo plazo potencial mente podrían asociarse a la formación y malignización de pólipos o promover el crecimiento de otros tumores6. En estudios con animales, se ha reportado la aparición de cáncer. En el estudio STEP-2 en adultos, la tasa de pólipos fue similar a la de la población general y a la del grupo placebo27. La Unión Europea contraindica su uso en pacientes con antecedentes de cáncer sospechado o activo y en aquellos con antecedentes de cáncer gastroin testinal, hepatobiliar o pancreático en los últimos 5 años25.
En pacientes pediátricos, la prevalencia de pólipos y el potencial de malignizarse es significativamente menor, excepto en aquellos con poliposis familiar. Extrapolando los hallazgos en adultos, se recomienda una colonoscopía previa al inicio del tratamiento en pacientes mayores de 12 años y repetirla al año y a los 5 años. En los menores de 12 años, se recomienda una determinación de sangre oculta en materia fecal (SOMF) antes del inicio y repetirla anualmente; en los casos positivos se realizará colonos copía. Si se encuentran pólipos, debe realizarse examen histopatológico antes de iniciar el tratamiento25,26.
#11. El tratamiento con teduglutide en pacientes con SIC puede resultar beneficioso con independencia de la longitud del intestino remanente y de la continuidad o no del colon.
Recomendación/afirmación con consenso fuerte de expertos.
Los pacientes con anatomía remanente menos fa vorable tendrían menos posibilidades de suspender el soporte parenteral, pero podrían tener un beneficio en la reducción de la cantidad de horas diarias de infusión y de infusiones semanales. Un grupo especial lo consti tuyen los pacientes con síndrome de intestino ultracorto; aunque su evolución ha mejorado en el tiempo, muestran menores tasas de supervivencia y adaptación30. En estos pacientes, el teduglutide podría reducir el requerimiento de NP, mejorar la calidad de vida y lograr el destete en algunos casos.
Los pacientes con duodeno terminal o anastomosis duodenocolónica no tendrían indicación de teduglutide por carecer del intestino remanente en el cual actúa este fármaco.
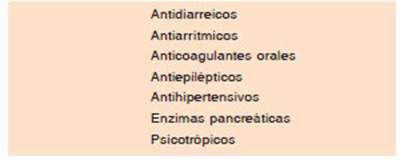
#12. Para los fármacos mencionados en la Tabla 2 se requiere monitoreo estricto en los pacientes que reciben concomitantemente teduglutide, debido a las modificacio nes que ocurren en la absorción intestinal.
Recomendación/afirmación con consenso fuerte de expertos.
#13. La dosis recomendada de teduglutide en los pacientes con SIC es de 0.05 mg/kg una vez al día, por vía subcutánea.
Recomendación/afirmación con consenso fuerte de expertos.
En un estudio multicéntrico realizado en pacientes pediátricos con SIC31, se determinó que la dosis usada en adultos (0.05 mg/kg/día) fue bien tolerada y se asoció con tendencia a la reducción del volumen de la NP. Un estudio posterior mostró iguales resultados a lo largo de 24 semanas32.
#14. En opinión del grupo de expertos, no se dispone aún de suficiente evidencia y/o experiencia del mundo real para mantener o interrumpir el tratamiento con teduglutide en los pacientes pediátricos a las 12 semanas en caso de no observarse mejoría (definida como falta de reducción del volumen de la NP ≥20% con respecto al basal). Se sugiere considerar el caso individual en función de los riesgos y beneficios potenciales de la intervención.
Recomendación/afirmación con consenso fuerte de expertos.
Algunos pacientes muestran respuesta temprana al tratamiento con teduglutide, obteniendo resultados antes de los 3 meses. En cambio, otros pacientes se comportan como respondedores tardíos33. El límite inicialmente propuesto para determinar la efectividad (12 semanas) debe ser evaluado en forma cuidadosa y, probablemente, proponer un uso más prolongado antes de considerar una falta de respuesta e indicar la suspensión34,35. De no mediar complicaciones, se recomienda un tratamiento de 6 a 12 meses, según la respuesta clínica y nutricional.
#15. De acuerdo con la evidencia y la experiencia actual, se reconocen ciertas características clínicas que permiten anticipar la respuesta de un paciente con SIC al tratamiento con teduglutide. Dichas características in cluyen el SIC con anatomía remanente tipo 1 (respuesta más rápida, pero con menor probabilidad de destete de la NP), el SIC con anatomía remanente tipo 2 y la ausencia de íleon distal (respuesta más lenta, pero con mayor probabilidad de destete de la NP).
Recomendación/afirmación con consenso fuerte de expertos.
La producción endógena de GLP-2 ocurre en las células L del íleon terminal y el colon proximal. Los pa cientes con anatomía remanente tipo 1 carecen de íleon y mostrarán una respuesta más rápida y favorable con el tratamiento con teduglutide. Sin embargo, al tratarse de pacientes con intestino más corto y ausencia de colon, la probabilidad final de suspensión total de la NP es menor36.
#16. El aumento gradual del peso con contenido calóri co estable de la NP se considera un parámetro importante en los pacientes tratados con teduglutide37.
Recomendación/afirmación con consenso fuerte de expertos.
#17. El aumento de la excreción urinaria, pese a mantener estable el volumen de la NP, se considera un parámetro importante en los pacientes tratados con teduglutide37.
Recomendación/afirmación con consenso fuerte de expertos.
#18. Otros parámetros utilizados para reducir la NP en los pacientes tratados con teduglutide incluyen:
[A] Reducción de las pérdidas fecales (recomendación/ afirmación con consenso fuerte de expertos).
[B] Posibilidad de disminuir el aporte hidroelectrolítico de la NP (recomendación/afirmación con consenso fuerte de expertos).
[C] Mejoría del apetito (recomendación/afirmación con consenso de expertos).
[D] Mejoría en la tolerancia a la alimentación digestiva (recomendación/afirmación con consenso de expertos).
Estos parámetros son ampliamente utilizados para el seguimiento de los pacientes en RI37-39. Se sugiere cuantificar el volumen y la consistencia del débito en los pacientes con ostomías, así como la cantidad (en forma semicuantitativa) y la consistencia de las deposiciones. La cuantificación de la diuresis no se realiza en forma rutinaria; se deja reservada para situaciones especiales y se complementa con la determinación diaria del peso en condiciones basales. En niños con adecuado control de esfínteres, se sugiere cuantificar la diuresis periódica mente y ante modificaciones en la NP.
#19. Se sugiere que el control del peso corporal de los pacientes tratados con teduglutide sea semanal du rante el primer mes, quincenal durante el segundo mes y luego mensual o en meses alternos, dependiendo de las modificaciones en el volumen y/o calorías de la NP o la alimentación digestiva.
Recomendación/afirmación con consenso de ex pertos.
La bibliografía disponible propone distintos intervalos para el control33,40. La presente recomendación se basa en las guías españolas26 y dependerá de las modificaciones observadas en cada paciente.
#20. Se sugiere que el control de los signos de sobre carga hídrica de los pacientes tratados con teduglutide sea semanal en el primer mes de tratamiento, semanal o quincenal en el segundo mes y luego mensualmente por el equipo tratante. Se sugiere el seguimiento diario por parte de los cuidadores en la primera semana de tratamiento, así como el seguimiento telefónico diario en los casos en que fuera posible, con pautas de alarma establecidas26.
Recomendación/afirmación con consenso de ex pertos.
#21. Se sugiere que el control de las variaciones de la excreción fecal o por un ostoma en un paciente con SIC tratado con teduglutide se realice de forma diaria por parte de familiares o cuidadores en un principio y de forma semanal por el equipo tratante durante el primer mes26.
Punto de buena práctica: en cualquier momento del tratamiento, los cuidadores deben informar al equipo si ocurren aumentos significativos de las pérdidas.
Recomendación/afirmación con consenso fuerte de expertos.
#22. Se sugiere el control de los electrolitos séricos en los pacientes tratados con teduglutide inicialmente en forma quincenal y luego cada mes, dependiendo de la evolución26.
Recomendación/afirmación con consenso de ex pertos.
#23. Se sugiere el control de la glucemia en los pa cientes tratados con teduglutide con la misma frecuencia que el resto de los controles de laboratorio26.
Recomendación/afirmación con consenso fuerte de expertos.
#24. Se sugiere el control de la función renal en los pa cientes tratados con teduglutide con la misma frecuencia que el resto de los controles de laboratorio26.
Recomendación/afirmación con consenso fuerte de expertos.
#25. Se sugiere el control de las transaminasas hepáticas en los pacientes tratados con teduglutide en forma mensual y luego cada 3 meses si sus niveles se mantienen estables32.
Recomendación/afirmación con consenso fuerte de expertos.
#26. Se sugiere el control de otros parámetros adicio nales en los pacientes tratados con teduglutide:
[A] SOMF basal, luego anual (recomendación/afirma ción con consenso fuerte de expertos).
[B] Ecografía abdominal basal, luego anual (recomen dación/afirmación con consenso fuerte de expertos).
[C] Amilasemia basal, luego repetida con igual frecuen cia que las transaminasas, o más frecuentemente en caso de alteración de los valores (recomendación/afirmación con consenso fuerte de expertos).
[D] Colonoscopía anual: se considera en pacientes de al menos 12 años de edad o en aquellos con pólipos en una endoscopía basal (recomendación/afirmación con consenso de expertos).
#27. De acuerdo con la evidencia actual y la experien cia en adultos, no existe un período máximo de tratamien to con teduglutide en los pacientes con SIC.
Recomendación/afirmación con consenso fuerte de expertos.
#28. En función de la experiencia en adultos, el tratamiento con teduglutide debería continuarse aún en aquellos pacientes que han logrado interrumpir por completo la NP.
Recomendación/afirmación con consenso fuerte de expertos.
#29. Se sugiere brindar las pautas de alarma descritas en la Tabla 3 a los pacientes y/o sus cuidadores acerca de los siguientes potenciales eventos adversos del trata miento con teduglutide31,32,40.
Recomendación/afirmación con consenso de ex pertos.