INTRODUCCIÓN
Un componente central en la determinación de la morbimortalidad de la pandemia por SARS-CoV-2, reconocido desde los inicios de su presentación es el estado hipercoagulable asociado, en especial el desarrollo de tromboembolismo pulmonar (TEP), que presenta una incidencia del 20 al 30% en los individuos hospitaliza dos evaluados mediante angiografías pulmonares por tomografía computarizada (AngioTC de tórax). 1,2
Los mecanismos fisiopatológicos propuestos pueden ser descritos siguiendo los componentes de la tríada de Virchow. 3 En primer lugar, la presencia de un estado de hipercoagulabilidad inducida por una tormenta de citoquinas que ha sido explicada por un síndrome de activación de macrófagos, 4 luego la lesión endotelial, que ha sido propuesta tras informarse niveles elevados de factor von Willebrand y factor VIII 5 y, por último, estasis del flujo sanguíneo, relacionada con los altos niveles de presión positiva al final de la espiración (PEEP) que son recomendados para la ventilación con parámetros protectores, y la restricción de líquidos. 3
Los pacientes con enfermedad por coronarvirus 2019 (COVID-19) grave presentan ciertas características que suponen un desafío para la evaluación diagnóstica con respecto a las situaciones habituales. 6 En primera instancia, los síntomas del TEP pueden imitar o superponerse con los de la infección por COVID-19; por otro lado, el estado hiperinflamatorio se acompaña de elevaciones de los niveles del dímero D. 3 Asociado a esto, las preocupaciones por una posible exposición del personal conllevan a que no se obtengan fácilmente las pruebas de diagnóstico con la celeridad debida, como podría ocurrir con la AngioTC de tórax o el ecocardiograma.
Por lo anteriormente expuesto, el presente trabajo busca caracterizar el comportamiento clínico, de diagnóstico y pronóstico de los pacientes con sospecha de TEP antes y durante la pandemia de SARS-CoV-2, haciendo una consideración especial sobre la precisión diagnóstica del dímero D y las reglas de predicción clínica.
MATERIALES Y MÉTODOS
Se llevó a cabo un estudio de cohorte prospectiva en el que se incluyeron pacientes hospitalizados en urgencias o sala general a los que se les hubiera realizado una angiografía pulmonar por tomografía computarizada (AngioTC de tórax) por sospecha de embolismo pulmonar en el Hospital San José de Bogotá (Colombia). La cohorte estuvo dividida en dos periodos de tiempo: a) fase pre-COVID-19, junio de 2018 a diciembre de 2019, y b) fase COVID-19, junio 2020 a diciembre de 2020. Durante esta fase se incluyeron solo pacientes con diagnóstico confirmado de infección por COVID-19 mediante la prueba de reacción en cadena de la polimerasa en tiempo real (RT-PCR) para SARS-CoV-2. Se excluyeron los casos con información incompleta para las variables del estudio.
Se llevó a cabo la identificación de los pacientes a partir de la revista clínica diaria de medicina interna y de los listados de pacientes sometidos a AngioTC de tórax en el servicio de Radiología. Luego se llevó a cabo la entrevista de los pacientes con el fin de obtener su firma autorizando el uso de sus datos en la investigación de acuerdo con la ley de Habeas Data. Se procedió a diligenciar un formato de recolección virtual en el que se incluía los datos demográficos, presentación clínica, factores de riesgo, examen físico, laboratorio e imágenes, así como los eventos clínicos intrahospitalarios.
Definición de eventos
Fueron tenidos en consideración los traslados a la unidad de cuidados intensivos y la mortalidad intrahospitalaria de acuerdo con lo consignado en la historia clínica.
Modelos de predicción clínica
Se llevó a cabo el cálculo de las siguientes reglas de predicción clínica de acuerdo con los datos de la historia clínica:
Criterios de Wells para TEP: 7 evalúa siete características clínicas de acuerdo con un sistema de puntuación que divide los pacientes en tres niveles de probabilidad en el modelo original, que posteriormente fue simplificado a dos clases, probable y no probable. Se tuvo en cuenta la clasificación mediante las dos formas de clasificación.
Puntuación de Ginebra para TEP: 8 sistema que evalúa ocho características clínicas para clasificar la probabilidad preprueba del TEP.
Regla PERC: 9 sistema para la exclusión clínica del TEP basado en la ausencia de ocho características clínicas.
Protocolo de adquisición de las imágenes
Mediante un tomógrafo Toshiba AQUILION PRIME multidetector de 80 canales, se practicaron cortes axiales del tórax, desde el opérculo torácico hasta el hemiabdomen superior, posterior a la administración de medio de contraste, con reconstrucciones multiplanares; Una vez obtenida la imagen se realizó la lectura por un médico radiólogo.
Dímero D
La prueba fue realizada mediante el reactivo D-Dimer HS 500 del laboratorio Werfen procesada en el equipo ACL TOP500. Tiene un límite de detección de 203 ng/mL con un límite superior del rango en 500 ng/mL.
Análisis estadístico
Las variables continuas fueron expresadas con medias y desviación estándar para las medidas de tendencia central, medianas y rango intercuartilo para las medidas de dispersión según su distribución. Las variables cualitativas fueron presentadas con frecuencias absolutas y relativas. Se efectuó análisis bivariado mediante T de Student o prueba U de Mann-Whitney para las variables cuantitativas y Chi cuadrado para las variables cualitativas, definiendo diferencia estadística significativa con una probabilidad <0,05.
Se graficaron los resultados del dímero D de los dos periodos de tiempo mediante un gráfico de caja. Se construyeron curvas ROC con respecto al diagnóstico de TEP mediante AngioTC de tórax para los diferentes valores de dímero D, y las puntuaciones de las reglas de predicción clínica Wells, Ginebra y PERC, y se calcularon as áreas bajo la curva (AUC) con sus respectivos intervalos de confianza del 95% (IC 95%); además, se obtuvo el valor de corte óptimo para el dímero D mediante la prueba de Youden. El análisis de los datos se realizó en el software SPSS 24® y en el programa R versión 4.0.2 (R Foundation, Vienna, Austria) usando los paquetes “pROC”, “ROCit” y “cutpointr”.
Consideraciones éticas
El presente estudio contó con la aprobación del comité de ética e investigaciones del Hospital San José de Bogotá y la Fundación Universitaria de Ciencias de la Salud. Numero de protocolo: 1201-3739-64. Aunque no se consideró que se requiriera firmar un consentimiento informado, si fue necesaria la autorización para el uso de los datos según la ley nacional de habeas data. Ante la situación de la pandemia por infección por COVID-19 se siguieron los protocolos de aislamiento y protección personal derivados de los protocolos institucionales.
RESULTADOS
La población total del estudio estuvo constituida por 357 pacientes que fueron evaluados mediante AngioTC de tórax bajo sospecha de TEP, 55 de ellos casos confirmados de infección por COVID-19 y 302 de la fase pre-COVID-19.
Las características clínicas de los pacientes se encuentran resumidas en las tablas 1 y 2. Los pacientes de la fase pre-COVID-19 tuvieron una media de 59,6 ± 17,7 años , 173 eran de sexo femenino (57,3%), el 89,4% presentaba disnea (n = 270) y el 39,7% manifestó dolor torácico (n = 120). El 30,5% padecía de cáncer (n = 92), el 14,2% tenía historia de trombosis venosa (n = 43), el 6,6% padecía de alguna enfermedad autoinmune (n=20) y solo hubo 3 mujeres gestantes. Noventa pacientes fueron diagnosticados con TEP (29,8%); la localización más común del defecto fue a nivel de las ramas lobares de la arteria pulmonar (43,2%).
| FASE PRE-COVID-19 | FASE COVID-19 | ||||||
|---|---|---|---|---|---|---|---|
| Característica | Todos los llevados a AngioTC de tórax (n = 302) | TEP descartado (n = 212) | TEP confirmado (n = 90) | Todos los llevados a AngioTC de tórax (n = 55) | TEP sospechoso (n = 43) | TEP confirmado (n = 12) | Valor p* |
| Edad en años, promedio (DE) | 59,61 (17,69) | 59,86 (18,26) | 59,01 (16,36) | 60,86 (15,97) | 61,12 (16,18) | 60,00 (15,89) | 0,937 |
| Sexo femenino, n (%) | 173 (57,3) | 90 (42,5) | 51 (56,7) | 27 (48,2) | 19 (44,2) | 8 (61,5) | 0,315 |
| Comorbilidades, n (%) | |||||||
| Enfermedad trombo-embólica | 43 (14,2) | 23 (10,8) | 20 (22,2) | 2 (3,6) | 2 (4,7) | 0 (0,0) | - |
| Falla cardiaca | 40 (13,2) | 33 (15,6) | 7 (7,8) | 3 (5,4) | 3 (7,0) | 0 (0,0) | - |
| Enfermedad pulmonar crónica | 51 (16,9) | 40 (18,9) | 11 (12,2) | 6 (10,7) | 5 (11,6) | 1 (7,7) | - |
| Diabetes | 51 (16,9) | 40 (18,9) | 11 (12,2) | 4 (7,1) | 3 (7,0) | 1 (7,7) | - |
| Hipertensión arterial | 128 (42,4) | 93 (43,9) | 35 (38,9) | 23 (41,1) | 19 (44,2) | 4 (30,8) | 0,692 |
| Cáncer | 92 (30,5) | 67 (31,6) | 25 (27,8) | 1 (1,8) | 1 (2,3) | 0 (0,0) | - |
| Trombofilia | 6 (2,0) | 3 (1,4) | 3 (3,3) | 0 (0,0) | 0 (0,0) | 0 (0,0) | - |
| Enfermedad autoinmune | 20 (6,6) | 14 (6,6) | 6 (6,7) | 3 (5,4) | 2 (4,7) | 1 (7,7) | 0,846 |
| Enfermedad cerebrovascular | 6 (2,0) | 5 (2,4) | 1 (1,1) | 1 (1,8) | 1 (2,3) | 0 (0,0) | - |
| Obesidad | 9 (3,0) | 5 (2,4) | 4 (4,4) | 4 (7,1) | 2 (4,7) | 2 (15,4) | 0,705 |
| Otros factores de riesgo, n (%) | |||||||
| Inmovilización por más de tres días | 63 (20,9) | 48 (22,6) | 15 (16,7) | 3 (5,4) | 1 (2,3) | 2 (15,4) | 0,846 |
| Cirugía reciente | 50 (16,6) | 34 (16,0) | 16 (17,8) | 1 (1,8) | 0 (0,0) | 1 (7,7) | 0,923 |
| Parálisis de extremidades | 3 (1,0) | 2 (0,9) | 1 (1,1) | 1 (1,8) | 1 (2,3) | 0 (0,0) | - |
| Presentación clínica, n (%) | |||||||
| Hemoptisis | 22 (7,3) | 16 (7,5) | 84 (93,3) | 2 (3,6) | 1 (2,3) | 1 (7,7) | 0,846 |
| Disnea | 270 (89,4) | 186 (87,7) | 6 (6,7) | 54 (96,4) | 0 (0,0) | 11 (84,6) | 0,295 |
| Dolor Torácico | 120 (39,7) | 76 (35,8) | 44 (48,9) | 12 (21,4) | 10 (23,3) | 2 (15,4) | 0,359 |
| Sincope | 11 (3,6) | 5 (2,4) | 6 (6,7) | 3 (5,4) | 2 (4,7) | 1 (7,7) | - |
| Hallazgos al examen físico Frecuencia cardiaca, promedio (DE) | 92,96 (18,90) | 92,07 (18,99) | 95,06 (18,60) | 89,04 (29,71) | 89,57 (21,18) | 87,31 (19,85) | 0,255 |
| Frecuencia respiratoria, promedio (DE) | 21,46 (10,07) | 20,73 (7,17) | 23,19 (14,75) | 20,38 (3,84) | 20,49 (3,95) | 20,00 (3,55) | 0,767 |
| Saturación de oxígeno, promedio (DE) | 88,42 (9,41) | 88,90 (7,75) | 87,26 (12,51) | 88,35 (7,20) | 88,67 (6,18) | 87,17 (10,32) | 0,293 |
| Sibilancias, n (%) | 16 (5,3) | 14 (6,6) | 2 (2,2) | 5 (8,9) | 5 (11,6) | 0 (0,0) | - |
| Edema unilateral pierna | 22 (7,3) | 15 (7,1) | 7 (7,8) | 2 (3,6) | 1 (2,3) | 1 (7,7) | 0,546 |
| Dolor a la palpación profunda extremidad inferior | 18 (6,0) | 10 (4,7) | 8 (8,9) | 1 (1,8) | 1 (2,3) | 1 (7,7) | 0,231 |
*Diferencia entre las poblaciones con diagnóstico final de TEP antes y durante el COVID-19. DE: desviación estándar
Tabla 2 Resultados de laboratorio, reglas de predicción clínica y desenlaces clínicos en los pacientes evaluados para confirmar la presencia de tromboembolismo pulmonar
| FASE PRE-COVID-19 | FASE COVID-19 | |||||||
|---|---|---|---|---|---|---|---|---|
| Característica | Todos los llevados a AngioTC de tórax (n = 302) | TEP descartado (n = 212) | TEP confirmado (n = 90) | Todos los llevados a AngioTC de tórax (n = 55) | TEP sospechoso (n = 43) | TEP confirmado (n = 12) | Valor p* | |
| Laboratorios | ||||||||
| Dimero D, mediana (RIC) Escalas de riesgo | 2205 (3885) | 1483 (3274) | 3951 (11377) | 1698 (4272) | 1538 (2774) | 5112 (16513) | 0,794 | |
| Wells original | 3,59 (2,11) | 3,19 (2,09) | 4,53 (1,84) | 3.55 (1,29) | 3,61 (1,19) | 3,34 (1,59) | 0,026 | |
| TEP alta probabilidad, n (%) | 90 (29,8) | 129 (60,8) | 83 (92,2) | 23 (41,8) | 19 (44,2) | 4 (33,3) | 0,655 | |
| Wells simplificado | 1,95 (1,01) | 1,80 (1,02) | 2,32 (0,89) | 1,57 (0,70) | 1,56 (0,70) | 1,62 (0,76) | 0,010 | |
| TEP probable, n (%) | 119 (39,4) | 129 (60,8) | 54 (60,0) | 26 (47,3) | 20 (46,5) | 6 (50,0) | 0,173 | |
| Ginebra original puntaje | 6,32 (2,22) | 6,04 (2,23) | 6,96 (2,05) | 4,30 (2,19) | 4,42 (2,06) | 3,92 (2,62) | 0,003 | |
| TEP probabilidad baja, n (%) | 29 (9,6) | 25 (11,8) | 4 (4,4) | 21 (38,2) | 13 (30,2) | 8 (66,7) | 0,054 | |
| TEP probabilidad intermedia, n (%) | 264 (87,4) | 182 (85,8) | 82 (91,1) | 32 (58,2) | 29 (67,4) | 3 (25,0) | 0,331 | |
| TEP probabilidad alta, n (%) | 7 (2,3) | 3 (1,4) | 4 (4,4) | 2 (3,6) | 1 (2,3) | 1 (8,3) | 0,845 | |
| PERC puntaje | 2,39 (0,97) | 2,25 (0,97) | 2,72 (0,89) | 2,11 (0,80) | 2,09 (0,71) | 2,15 (1,06) | 0,072 | |
| TEP probabilidad alta, n (%) | 295 (97,7) | 206 (95,3) | 89 (98,9) | 55 (100,0) | 43 (100,0) | 12 (100,0) | - | |
| PESI puntaje original | - | - | 107,9 (31,7) | - | - | 89,4 (18,9) | 0,011 | |
| Eventos clínicos | ||||||||
| Ingreso a cuidados intensivos, n (%) | 35 (11,6) | 18 (6,0) | 17 (5,6) | 33 (10,9) | 24 (55,8) | 9 (69,2) | 0,001 | |
| Muerte, n (%) | 13 (5,6) | 11 (3,6) | 5 (1,7) | 9 (3,0) | 9 (20,9) | 0 (0,0) | 0,900 | |
*Diferencia entre las poblaciones con diagnóstico final de TEP antes y durante el COVID-19.
RIC: rango intercuartílico
A 27 pacientes se les midió el dímero D (27,2%), y se obtuvo una mediana de 3951 (RIC 11 377) ng/dL (tabla 2). La troponina presentó una mediana de 12 (RIC 25) ng/dL. El promedio de la hemoglobina fue 13,3 ± 2,8 g/dL. Por su parte la creatinina registro un promedio de 0,77 ± 0,17 mg/dL ; la media del tiempo de protrombina fue de 12,4 ± 0,73 segundos y para la tromboplastina fue de 35,8 ± 14,7 segundos. Ninguno de los pacientes con diagnóstico de TEP falleció.
De los 55 pacientes del grupo COVID-19, la media de edad fue 60,9 ± 16,0 años, 27 eran de sexo femenino (48,2%), el 96,4% presentaba disnea y el 21,4% se manifestó con dolor torácico. El 1,8% tuvo historia de cáncer y 3,6% trombosis venosa, un 5,.4% padecía de alguna enfermedad autoinmune, y no se incluyeron mujeres en gestación (Tabla 1).
En la Figura 1 se muestra un gráfico de caja (boxplot) que revela que en la fase de COVID-19 la mediana de dímero D fue más alta en los pacientes confirmados con TEP que en aquellos sin la patología, mientras que en la fase previa no hubo diferencia significativa entre los pacientes con y sin TEP.
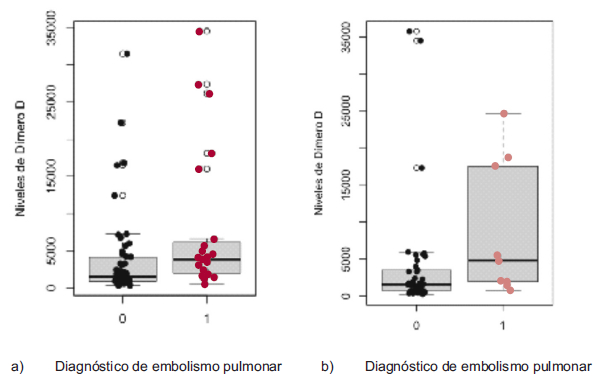
Fig. 1 Gráfico de cajas con los niveles de dímero D entre los pacientes llevados a angiografía pulmonar por tomografía que fueron diagnosticados (1) o no (0) con embolismo pulmonar. a) fase pre-COVID-19, b) fase COVID-1
La curva ROC para el desempeño diagnóstico de TEP de los niveles de dímero D se presenta en la Figura 2, con un desempeño moderado, similar en ambas fases: un AUC 0,73 (IC95% 0,62-0,84) en la fase pre-COVID-19 contra 0,75 (IC95% 0,58-0,92) en la fase COVID-19. El valor de corte óptimo calculado mediante la prueba de Youden fue de 23 850 pg./mL en la fase COVID-19 contra 19 460 pg./mL en la fase pre-COVID-19.
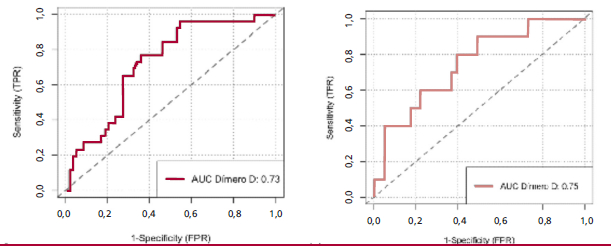
Fig. 2 Curvas ROC para los niveles del dímero D en el diagnóstico del embolismo pulmonar en pacientes llevados a angiografía pulmonar por tomografía. a) fase preCOVID-19, b) fase COVID-19
La Figura 3 y la Tabla 3 presentan las AUC de cada una de las reglas de predicción clínica pretest con sus respectivos IC95% en ambas fases del estudio: en la fase pre-COVID-19 el desempeño fue moderado a bajo (AUC 0,623 a 0,697), mientras que en la fase COVID-19 no fue discriminatoria (AUC 0,355 a 0,450). La mejor capacidad de discriminación la obtuvo el puntaje Wells con un AUC en la fase pre-COVID-19 0,697 (IC95%0,635-0,760).
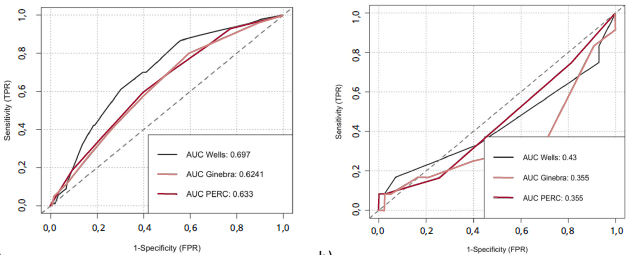
Fig. 3 Curvas ROC de las diversas reglas de predicción clínica en el diagnóstico del embolismo pulmonar en pacientes llevados a angiografía pulmonar por tomografía. a) fase pre-COVID-19, b) fase COVID-19
Tabla 3 Resultados de las áreas bajo la curva ROC de cada una de las reglas de predicción clínica pretest con sus respectivos intervalos de confianza en ambas fases del estudio
| Fase pre-COVID-19 | Fase COVID-19 | |||
|---|---|---|---|---|
| Regla de Predicción | AUC | IC del 95% | AUC | IC del 95% |
| Wells original | 0,697 | 0,635-0,760 | 0,434 | 0,231-0,637 |
| Ginebra original | 0,624 | 0,558-0,690 | 0,355 | 0,448-0,843 |
| PERC | 0,633 | 0,570-0,696 | 0,450 | 0,275-0,624 |
El puntaje PESI fue inferior en el grupo COVID-19 (90,00 ± 18,95 versus 107,88 ± 31,65), encontrándose diferencia significativa entre estos (p = 0,001).
El traslado a cuidados intensivos fue mayor en los pacientes con infección por COVID-19, 69,2% versus 18,9% (p = 0,001). La mortalidad intrahospitalaria fue del 5,6% (n = 5) en pacientes pre-COVID-19 y 0% en el periodo de COVID-19 (p= 0,90).
DISCUSIÓN
Dado que los síntomas de TEP se superponen en gran medida con los de la COVID-19 bajo el contexto de un estado inflamatorio, protrombótico por la disfunción endotelial, e hipercoagulabilidad, suele ser necesaria la evaluación diagnóstica de los pacientes en la búsqueda de esta complicación. 3 El presente trabajo expone una tendencia hacia una disminución no significativa en la tasa de diagnóstico del TEP desde el 29,8% en el periodo pre-COVID-19 al 21,8% en el periodo COVID-19 en los pacientes estudiados, condición que podría ser atribuida a un menor umbral clínico para la prescripción de la AngioTC de tórax ante los síntomas, y el reconocimiento del TEP como una complicación frecuente e importante, así como a la dificultad de interpretación del dímero D elevado en esta población, subestimando su verdadera incidencia. 10 Otros estudios han reportado incidencias similares, como los del grupo de Grillet con un 23% (23 de 100 pacientes) 1 y Poyiadji con 22% (72 de 377); 11 un reporte muy bajo fue el de Fauvel et al. en una cohorte multicéntrica de 24 hospitales franceses, con 8,3% (103 de 1240). 12El caso opuesto se da en varios otros estudios con una incidencia superior, tales como el de Léonard-Lorant et al. con 30% (32 de 106 pacientes) 2, Ventura-Díaz et al. con 30% (72 de 242), 13 Ramadan et al. con 28,7% (47 de 367) 14 y el de Ooi et al. con 38% (32 de 84). 15
En los dos periodos evaluados, predominó el sexo femenino entre los pacientes en que fue diagnosticado el TEP, (56,7% en la fase pre-COVID-19 vs 61,5%, en el periodo COVID-19), sin diferencia estadísticamente significativa. Los estudios en la población indican que comúnmente, las mujeres son más afectadas. 16,17. Este hallazgo no ha sido repetido en ninguno de los estudios reportados anteriormente ni en las revisiones sistemáticas 18. Los factores de riesgo tradicionales (trombosis previa, cirugías mayores e inmovilización) no mostraron una relación con el desarrollo de TEP, de forma similar a lo documentado por el trabajo del grupo de Fauvel et al. 12
Se documentaron consistentemente niveles más altos de dímero D en los pacientes en los que se confirmó la presencia de TEP respecto de aquellos en que se descartó, tanto en la fase pre-COVID-19 (medianas de 3951 vs. 1483 μg/L, p = 0,001), como en la fase COVID-19 (medianas de 5112 vs. 1538 vs μg/L, p = 0,014). El grafico de cajas confirma este hallazgo, aunque con cierta superposición de valores entre ambos grupos (figura 1). Una revisión sistemática que incluyó 11 estudios con 567 pacientes encontró que los niveles de dímero D fueron más altos en pacientes con TEP (7625 μg / L) que en aquellos sin TEP (1750 μg / L) 18. En nuestro estudio se documentó un resultado del AUC similar en ambos periodos evaluados (0,73 en fase pre-COVID-19 y 0,75 en el grupo COVID-19); dicho reporte es el mismo que se documentó en la revisión sistemática ya nombrada con 0,737, mientras que el valor de corte óptimo encontrado de 23 850 μg /L fue bastante elevado en comparación con el reportado en la revisión, de 4453 μg / L. 18
Se encontró un bajo rendimiento de las reglas de predicción clínica en los pacientes hospitalizados por infección por COVID-19, un AUC de 0,434 para el Wells original, 0,355 para el Ginebra y 0,450 para la regla PERC. Este hallazgo ya había sido sugerido para pacientes en condición crítica en varios ensayos clínicos. 19,20,21 Dos trabajos que evaluaron este aspecto en pacientes hospitalizados por infección por COVID-19 y llevados a AngioTC de tórax encontraron que las puntuaciones de Wells y Ginebra no mostraron ningún valor predictivo para la aparición de TEP, ya sea que se considerara un punto de corte estándar o ajustado por edad. 22,23
No hubo casos de mortalidad en el grupo de pacientes con infección por COVID-19 en los que se diagnosticó un TEP, resultado que pudiera ser atribuido a la identificación de casos más leves (PESI más bajo) tras una evaluación diagnóstica más cuidadosa en esta población. Se reconoce que en los pacientes con infección por COVID-19, la presencia de complicaciones embolicas se asocia con un franco aumento de la mortalidad, llegando a encontrarse un OR de 1.74 (IC95% 1,01-2,98, p = 0,04) en un metaanálisis que incluyó 42 estudios con 8271 pacientes. 24 Se pudo documentar un alto requerimiento de traslado a cuidados intensivos en los pacientes con infección por COVID-19, siendo más notorio este hallazgo en los que se diagnosticó TEP (69% de los casos requirieron cuidados intensivos); esto contrasta con un estudio que no encontró una diferencia significativa en los ingresos a la UCI, la necesidad de intubación o la duración de la intubación entre los pacientes que desarrollaron TEP , y en que el 72% (52 de 72) de los TEP se diagnosticaron en pacientes que no requirieron atención en Cuidados críticos. 11
Limitaciones
El presente estudio presenta varias limitaciones: el carácter unicéntrico determina la imposibilidad de poder generalizar los resultados a otras poblaciones y presenta el riesgo de selección, además de infravalorar la verdadera incidencia del TEP dado que no se realizó AngioTC de tórax sistemáticamente a todos los pacientes con infección por COVID-19 hospitalizados. Por otro lado, el pequeño número de pacientes limitó el poder en la determinación de las diferencias significativas entre los grupos evaluados. Consideramos como fortaleza la posibilidad de contar con un registro histórico de pacientes llevados a AngioTC de tórax que pudo servir de comparador para el comportamiento antes y durante la pandemia.
CONCLUSIONES
Los factores de riesgo tradicional fueron poco prevalentes en los pacientes con COVID-19 y diagnóstico confirmado de TEP. Aunque hubo una tendencia a niveles de dímero D más altos entre aquellos con TEP confirmado, la diferencia no fue estadísticamente significativa. Las reglas de predicción clínicas habitualmente aplicadas al diagnóstico del TEP mostraron un bajo poder discriminativo en los pacientes con COVID-19.















