Introducción
Las especies exóticas, alóctonas, introducidas o adventicias son aquellas ajenas a la biota nativa de un lugar y deben su presencia a la actividad involuntaria o intencional del ser humano que transporta los propágulos desde el área de origen hacia el ecosistema receptor, permitiendo que se superen barreras biogeográficas o largas distancias (Pyšek et al., 2004; Theoharides & Dukes, 2007; Milanović et al., 2020). Algunas de estas especies son “naturalizadas” ya que mantienen poblaciones viables sin intervención humana (Pyšek et al., 2004). Un subgrupo dentro de las especies naturalizadas son las especies invasoras que, una vez introducidas y establecidas, mantienen poblaciones viables sin asistencia humana y se expanden dentro del ecosistema receptor (Richardson et al., 2000; Rejmánek et al., 2005; Richardson & Rejmánek, 2011).
Desde un análisis ecológico, una especie invasora puede ser clasificada como transformadora o ingeniera al cambiar la fisonomía de la vegetación, la fenología de la comunidad, la estacionalidad del follaje, el ciclado de nutrientes, la hidrología o el régimen de disturbios entre otras características (Pyšek et al., 2004). En cambio, una mirada antropocéntrica permite clasificar las especies invasoras como problemáticas o no problemáticas, tomando en cuenta la presencia o ausencia de impactos negativos tanto económicos como ecológicos (Mack et al., 2000; Duboscq-Carra et al., 2021). Acorde a esta mirada, la Plataforma Intergubernamental sobre Biodiversidad y Servicios de los Ecosistemas clasifica a las invasiones biológicas como uno de los cinco impulsores directos del cambio global que actúan sinérgicamente amenazando la diversidad biológica y la provisión de servicios ecosistémicos a nivel mundial (IPBES, 2019).
Hay abundantes discusiones sobre las características que comparten las especies invasoras a pesar de la gran variabilidad pero, en líneas generales, lo esencial para su éxito es el acople de los atributos de la especie con las condiciones ambientales del lugar (Ríos & Vargas, 2003; Theoharides & Dukes, 2007). Algunas de las características que se repiten en muchas especies invasoras son la captación oportunista y rápida de recursos con una consecuente tasa de crecimiento alta, la producción de muchos propágulos y reproducción vegetativa (Grotkopp & Rejmánek, 2007; Tecco et al., 2010), también una aclimatación rápida y eficiente como consecuencia de su plasticidad fenotípica y de su flexibilidad funcional (Castro-Díez et al., 2005). En cuanto a la reproducción, la presencia de flores hermafroditas y sistemas sexuales monoicos junto con la capacidad de reproducción asexual son características asociadas a las especies de plantas invasoras que facilitarían la instalación de una población en un sitio nuevo (Marco & Páez, 2000; Herrera, 2009). La dispersión exitosa es clave para expandirse en el área colonizada e invadir áreas nuevas; en este sentido, las aves son el vector más eficiente ya que permiten el arribo de semillas a sitios con características ecológicas similares a donde se encuentra la población adventicia (e.g. de bosque a bosque). En segundo lugar, se encuentra el viento como vector de dispersión (Gosper et al., 2005; Vittoz & Engler, 2007; Richardson & Rejmánek, 2011). Sin embargo, las características intrínsecas de las especies no son los únicos factores determinantes en los procesos de invasiones biológicas. También hay otros factores que influyen en el éxito y son ajenos a la especie como la cantidad de eventos de ingresión, la liberación de enemigos naturales, la existencia de combinaciones de factores ambientales no explotado por ninguna especie nativa (“nicho vacío”), la ocurrencia de disturbios que liberan recursos y la resistencia biótica de la comunidad receptora (Elton, 1958; Stachowicz et al., 1999; Lockwood et al., 2005; Simberloff, 2009).
Aunque existen casos de especies exóticas herbáceas de gran impacto ecológico y/o económico (Valliant et al., 2007; Cipriotti et al., 2010; Duboscq-Carra et al., 2021), el estudio de las especies leñosas exóticas es prioritario para monitorear y prevenir la invasión o manejar y controlar el impacto de las invasiones. La invasión de especies arbóreas, que puede ser especialmente problemática en ambientes que naturalmente carecen o presentan escasas especies leñosas como pastizales y sabanas, conlleva un importante cambio fisonómico, por lo que los impactos de la invasión tienen mayor magnitud (Huxman et al., 2005; Rolhauser & Batista, 2014; Archer et al., 2017). La lignificación de las sabanas es un cambio drástico y conspicuo, pero existen otros más sutiles como la invasión de especies perennes en bosques caducifolios que modifican la cantidad de luz y temperatura del sotobosque (Aragón et al., 2014; Fernández et al., 2020), o la invasión de especies que fructifican en una estación diferente a la comunidad nativa (Lediuk et al., 2014).
Hasta el momento, no existe una lista comentada de las especies de árboles exóticos presentes en la Argentina. En este trabajo, compilamos la lista de todas las especies de árboles exóticos registrados para la flora argentina, las caracterizamos e identificamos el riesgo actual o potencial como especies problemáticas. Para cada especie identificamos las posibles vías de ingreso y las áreas con registro de colonización en Argentina, registramos algunas características consideradas importantes para el establecimiento y expansión de las poblaciones y evaluamos el estatus actual o potencial como especie invasora problemática en Argentina. Finalmente, proponemos cuáles serían los criterios para definir prioridades de monitoreo o control entre las especies estudiadas. La información aquí provista servirá para desarrollar planes para detección y control temprano de las especies potencialmente problemáticas y para evaluar planes de acción y mitigación del impacto de las especies ya problemáticas en alguna región de la Argentina.
Metodología
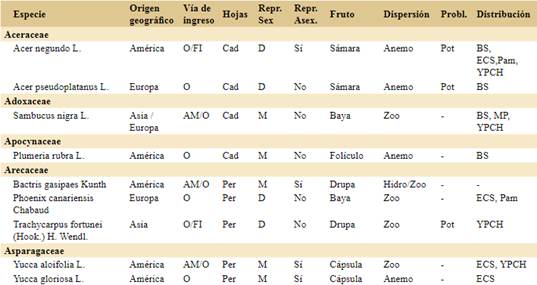
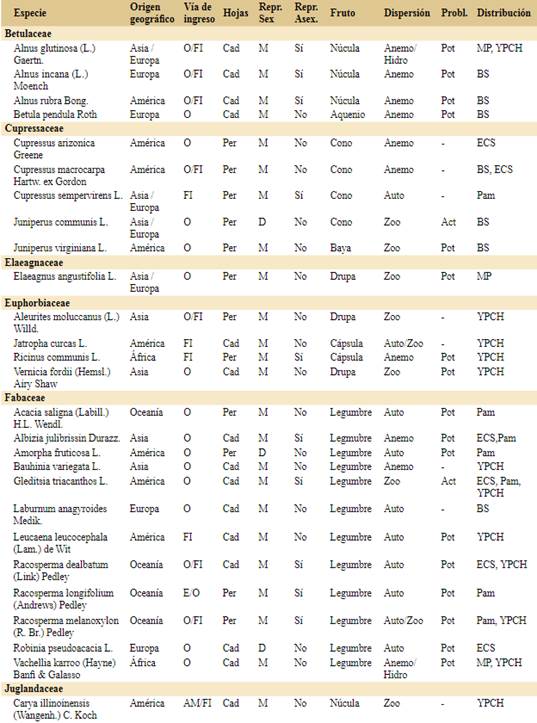
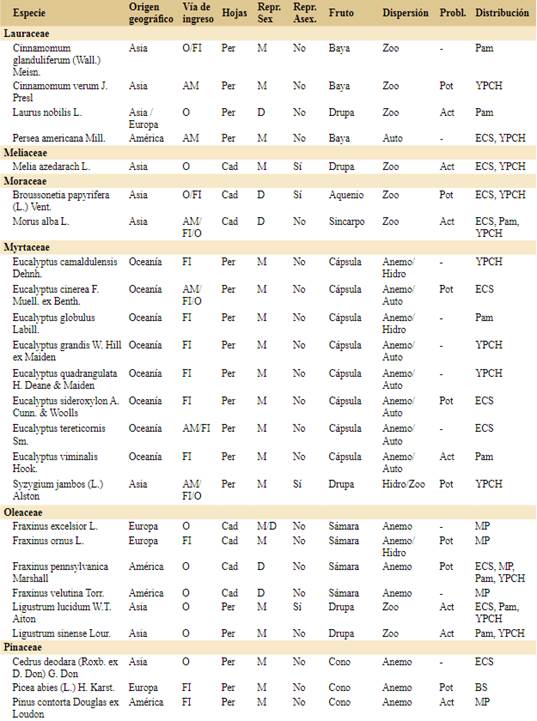
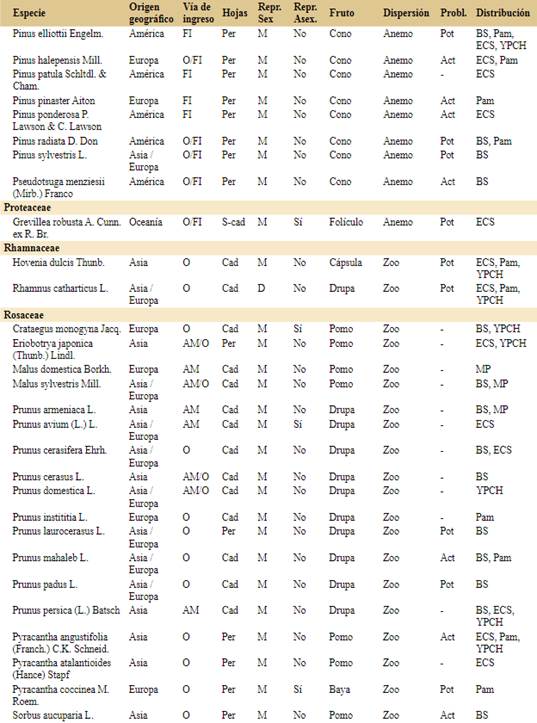
Para realizar este trabajo tomamos como base de datos inicial el registro de especies introducidas de hábito arbóreo compilado por Flora Argentina (http://www.floraargentina.edu.ar, último acceso octubre de 2021). Consideramos especies arbóreas a especies leñosas de más de 3 metros de altura que generalmente no ramifican del nivel del suelo. Completamos la lista con especies registradas en la bibliografía, en la Resolución Nº 109/2021 del Ministerio de Ambiente y Desarrollo Sostenible sobre la gestión integral de especies exóticas invasoras y potencialmente invasoras (MADS, 2021) y en Bentivegna & Zalba (2014). La base de datos final consta de 109 especies arbóreas introducidas en Argentina.
Para cada una de las especies realizamos una búsqueda bibliográfica y registramos el origen geográfico y vía de ingreso a la Argentina basados en el uso que tiene/tuvo en el país (e.g. ornamental, forestal e industrial, alimenticia y medicinal o ecológica) o ingreso accidental (e.g. contaminante de semillas o suelo importado). El uso ecológico incluye el control de la erosión, fijación de bordes de cursos de agua y la fijación de dunas (Giorgis & Tecco, 2010; Delucchi et al., 2011; Méndez, 2012). Hay especies que presentan más de una vía de ingreso identificada por lo que la suma total en la sección resultados (144) es mayor al número de especies (109). También caracterizamos a las especies en dioicas o monoicas (donde incluimos todas las variantes que incluyen los dos sexos en una misma planta) y por la presencia o ausencia de reproducción asexual (vegetativa) como indicadores de la facilidad para establecer una población (Tourn et al., 1999; Roiloa et al., 2015). Además registramos si el follaje es caducifolio o perennifolio. Registramos el tipo de fruto de cada especie a partir de las descripciones taxonómicas de cada especie e identificamos el síndrome de dispersión (anemocoria, autocoria, hidrocoria, zoocoria). En el caso de poseer más de un dispersor registrado, consideramos en los análisis el que alcanza mayor distancia.
Clasificamos a las especies en “problemáticas” y “no problemáticas”. Para ello, a partir de la búsqueda bibliográfica para cada especie, clasificamos como problemática a las especies para las que encontramos publicaciones que resaltaban los impactos negativos en cualquier parte del mundo. A estas especies problemáticas las dividimos en “actualmente problemáticas en Argentina” si hay registros de sus impactos negativos en Argentina y “potencialmente problemáticas en Argentina” si aún no hay registros de impacto negativo en Argentina, pero sí en otros países. Para la recopilación de la información utilizamos la base de datos de especies invasoras del Centro de Biociencia Agrícola Internacional (CABI, https://www.cabi.org), la información disponible del Instituto de Botánica Darwinion (http://www. floraargentina.edu.ar), el Sistema de Información de Biodiversidad (SIB, https://sib.gob.ar), ARBOREA (http://arborea.proyungas.org.ar) y búsqueda de publicaciones científicas por nombre científico de las especies en Google Académico (https://scholar. google.com) y Scopus (https://www.scopus.com).
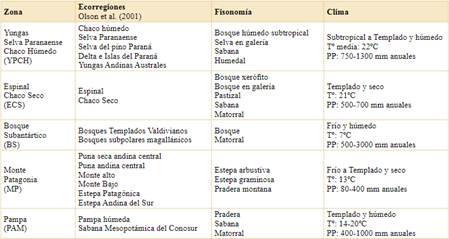
Tabla 1 Caracterización de las 5 zonas obtenidas agrupando según la densidad de árboles las ecorregiones de Olson et al. (2001) en Argentina.
Para compilar la información sobre la ubicación geográfica de cada especie en Argentina utilizamos principalmente los registros de ejemplares depositados en herbarios y almacenados en bases de datos como Global Biodiversity Information Facility (https://gbif.org), Instituto de Botánica Darwinion (http://www.floraargentina.edu.ar), Sistema de Información de Biodiversidad (https:// sib.gob.ar), complementando la búsqueda con publicaciones científicas específicas. En todos los casos confirmamos que los ejemplares correspondan a poblaciones naturalizadas y no a ejemplares cultivados. Para ubicar las especies en el mapa, agrupamos las regiones de Argentina según su fisonomía. Las regiones resultaron de aglomerar la clasificación de ecorregiones de Olson et al. (2001) en 5 zonas contrastantes que agrupan ecorregiones con fisonomías de la vegetación similares (Tabla 1). Para ello nos basamos principalmente en la densidad del estrato arbóreo con el fin de identificar a las especies que potencialmente podrían tener mayor impacto modificando la estructura de la vegetación del área invadida. Aquellas ecorregiones que no tienen especies arbóreas nativas podrían presentar un proceso de lignificación y cambio de fisonomía en una situación de invasión arbórea mientras que las ecorregiones típicamente con árboles podrían presentar cambios funcionales pero no fisonómicos (Archer et al., 2017).
Análisis de datos. Para comparar las características de la flora exótica realizamos pruebas de Chi2 con el programa estadístico R (R Core Team 2020).
Resultados
Confirmamos la presencia de 109 especies arbóreas introducidas en Argentina (Apéndice), pertenecientes a 28 familias. Las familias con mayor número de especies arbóreas introducidas son Rosaceae (n=18), Fabaceae (n=12), Pinaceae (n=11), Myrtaceae (n=9) y Salicaceae (n=8).
Las especies arbóreas introducidas provienen principalmente de Eurasia (62%) y en segundo lugar del continente americano (23%) (Fig. 1A; Apéndice). En cuanto a las vías de ingreso, el 53% de las especies exóticas arbóreas fueron introducidas con fines ornamentales; el 30% con fines forestales e industriales, el 14% con fines alimenticios y medicinales y el 3% restante, ecológicos (Fig. 1B; Apéndice).
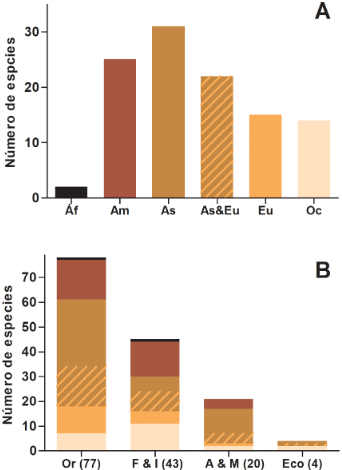
Fig. 1 A, origen geográfico de las especies arbóreas introducidas que se encuentran en la Argentina. B, caracterización de las cuatro principales vías de ingreso: Or: ornamental, F & I: forestal e industrial, A & M: alimenticio y medicinal y Ec: ecológico, de las especies de árboles introducidos en la Argentina según su origen geográfico; los colores de las regiones como en el panel A. Figura en color en la versión en línea http://www.ojs.darwin. edu.ar/index.php/darwiniana/article/view/1001/1246
Tanto las especies introducidas con fines ornamentales como alimenticios y medicinales se caracterizan por ser, en su mayoría, oriundas de Asia (Asia + Eurasia). En cambio, las especies introducidas con fines forestales e industriales provienen principalmente y en igual proporción de América y Asia.
Con relación a la fenología del follaje, aproximadamente la mitad de las especies arbóreas introducidas son caducifolias y la otra mitad son especies perennifolias (Fig. 2A; Apéndice). Con respecto a la reproducción, predominan las especies exóticas monoicas (79%) sobre las especies dioicas (21%). Además, el 29% de las especies exóticas tiene registros de reproducción vegetativa. Estas dos características son independientes (Fig. 2B, Chi2=0,039, p=0,844, 1gl); esto es, la presencia de reproducción vegetativa es independiente del tipo de flores en los árboles estudiados.
Los síndromes de dispersión más frecuentes entre las especies introducidas son anemocoria y zoocoria, y en tercer lugar de importancia, autocoria (Fig. 2C). El cuarto síndrome de dispersión es la hidrocoria, y aunque puede ser importante en algunos casos, como Gleditsia triacanthos, no hay especies que lo presenten como único mecanismo de dispersión. Un 24% de las especies analizadas cuenta con más de un síndrome de dispersión (Apéndice), aunque para el análisis se consideró la vía de dispersión que alcanzaría mayor distancia (anemocoria = zoocoria > hidrocoria > autocoria). En general, el tipo de fruto determina el síndrome de dispersión, con los frutos carnosos principalmente dispersados por animales y los secos por el viento. Sin embargo, hay mucha variedad entre esos grandes grupos (Apéndice), y existen excepciones sobre todo entre los frutos secos. El 37% de las especies arbóreas exóticas presentes en Argentina tienen frutos carnosos, el 39% de frutos secos dehiscentes y el 24% restante de frutos secos indehiscentes. La mayoría de las especies con frutos carnosos son dispersadas por animales seguidas por las especies de frutos secos dehiscentes o secos indehiscentes dispersados por el viento. La especie Persea americana, conocida como Paltero, es la única especie que presenta fruto carnoso con dispersión por autocoria (Wolstenholme & Whiley, 1999) aunque podría tener dispersión secundaria ocasional por animales.
De la totalidad de las especies analizadas, el 56% ya son reconocidas como problemáticas en algún lugar del mundo. Este subgrupo reúne 61 especies, de las cuales 17 ya fueron detectadas como un problema actual en la Argentina y las 44 restantes son problemáticas en otros países pudiendo implicar problemas dentro de Argentina en el futuro (Apéndice). Entre las especies actualmente problemáticas, Prunus mahaleb y Juniperus communis son las únicas que solamente implican un problema en Argentina ya que no encontramos registros en otros países.
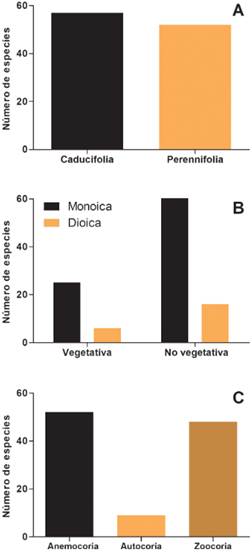
Fig. 2 A, caracterización de las especies arbóreas introducidas en Argentina según la fenología del follaje: caducifolia y perennifolia. B, clasificación de las especies de árboles introducidos en Argentina según su tipo de reproducción tanto sexual (monoica o dioica) como asexual (con o sin reproducción vegetativa). C, clasificación de las especies arbóreas introducidas en Argentina según los síndromes de dispersión anemocoria, autocoria y zoocoria. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index. php/darwiniana/article/view/1001/1246
Por otro lado, 19 especies ya fueron reconocidas como problemáticas en más de un continente: Gleditsia triacanthos, Laurus nobilis, Leucaena leucocephala, Ligustrum lucidum, Ligustrum sinense, Melia azedarach, Morus alba, Pinus contorta, Pinus radiata, Pinus halepensis, Pinus ponderosa, Pseudotsuga menziesii, Pyracantha angustifolia, Racosperma dealbatum, Racosperma longifolium, Tamarix chinensis, Tamarix ramosissima, Trachycarpus fortunei y Ulmus pumila.
Las especies presentes en la Argentina identificadas como problemáticas son en su mayoría monoicas (78%) pero estas características son independientes (Chi2=0,140, p=0,708, 1gl; Fig. 3A). Entre las especies identificadas como problemáticas es más frecuente que presenten reproducción vegetativa (Chi2=4,183, p=0,041, gl=1; Fig. 3B). La proporción de especies problemáticas dentro de las especies caducifolias es similar a la proporción dentro de las especies perennifolias (Chi2= 0,418, p= 0,518, 1gl; Fig. 3C). Por último, las especies problemáticas son dispersadas principalmente por el viento, en segundo lugar, por animales y por último, por la gravedad (Fig. 3D). Sin embargo, el carácter problemático de las especies tampoco está relacionado con el síndrome de dispersión (Chi2=1,271, p=0,530, 2gl).
En cuanto a la distribución de las especies arbóreas introducidas en Argentina, la mayoría tienen aún una distribución geográfica restringida. El 64% se encuentra únicamente en una zona, el 24% se encuentran en 2 zonas, el 9% en 3 zonas y solamente un 4% se encuentra en 4 zonas. Las 5 especies que se encuentran en 4 de las 5 zonas delimitadas son Acer negundo (BS, Pam, ECS, YPCH), Fraxinus pennsylvanica (ECS, MP, Pam YPCH), Pinus elliottii (BS, Pam, ECS, YPCH), Populus alba (BS, ECS, MP YPCH) y Salix fragilis (BS, MP, Pam YPCH). Encontramos una gran diferencia en número de especies introducidas entre zonas (Fig. 4), donde las zonas con la mayor cantidad (YPCH y ECS) tienen más del doble que la zona con menor número de especies (MP).
La situación de Argentina registra 17 especies actualmente problemáticas y 44 que implican un problema potencial (Apéndice).
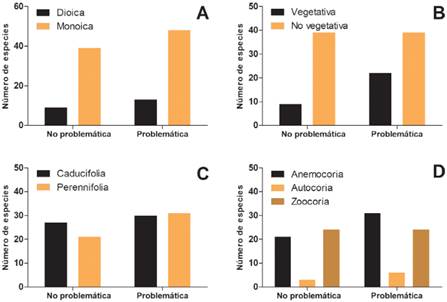
Fig. 3 Clasificación de las especies problemáticas y no problemáticas dentro del conjunto de especies de árboles exóticos en Argentina de acuerdo con A, la presencia de reproducción vegetativa, B, tipo de reproducción sexual, C, fenología del follaje y D, síndrome de dispersión. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/ index.php/darwiniana/article/view/1001/1246
Las especies actualmente problemáticas corresponden a 11 familias: Cupressaceae (1), Fabaceae (1), Lauraceae (1), Melicaceae (1), Moraceae (1), Myrtaceae (1), Oleaceae (2), Pinaceae (5), Rosaceae (3) y Ulmaceae (1). Se destaca la familia Pinaceae por contar con el mayor número de especies actualmente problemáticas (Pinus contorta, P. halepensis, P. pinaster, P. ponderosa y Pseudotsuga menziesii). De las especies de amplia distribución en la Argentina, sólo Pinus elliottii está registrada como especie problemática en la Argentina, mientras que Acer negundo, Fraxinus pennsylvanica y Populus alba son potencialmente problemáticas y Salix fragilis no sería problemática. La zona con mayor número de especies actualmente problemáticas así como potencialmente problemáticas en la Argentina es Pam.
Discusión
En este trabajo identificamos 109 especies exóticas de árboles en la Argentina pertenecientes a 28 familias. Actualmente muchas especies pueden llegar a una región nueva debido a la actividad humana pero no todas logran mantener poblaciones estables (naturalizarse) y menos aún, expandirse activamente (Pyšek et al., 2004; Rejmánek et al., 2005; Richardson & Rejmánek, 2011). Las 109 especies analizadas se encuentran naturalizadas en Argentina y 61 de ellas fueron clasificadas como problemáticas debido a que se expanden activamente y generan impactos negativos en alguna región del planeta. Sin embargo, solo 17 son actualmente problemáticas dentro de Argentina mientras que las 44 restantes son potencialmente problemáticas con impactos negativos registrados fuera de Argentina.
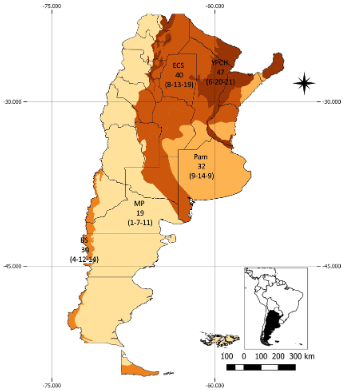
Fig. 4 Mapa de las ecorregiones de Argentina agrupadas en cinco zonas según la densidad de árboles en la vegetación dominante. El número de especies exóticas totales se refleja en el orden de colores donde las zonas más oscuras corresponden a un mayor número de especies. Las zonas son: YPCH (Yungas, Selva Paranaense y Chaco Húmedo), ECS (Espinal y Chaco Seco), Pam (Pampa), MP (Monte y Patagonia) y BS (Bosque Subantártico). El número total de especies se encuentra desagregado entre paréntesis (a-b-c): (a) número de especies actualmente problemáticas (b) número de especies potencialmente problemáticas y (c) número de especies no problemáticas. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/ darwiniana/article/view/1001/1246
Los resultados de este trabajo muestran que la mayoría de las especies arbóreas exóticas de Argentina son originarias de Eurasia, luego de América, Oceanía y, por último, África. La mayoría de las especies exóticas presentes en Latinoamérica fueron introducidas, intencional o accidentalmente, a finales del siglo XIX y principios del siglo XX como consecuencia del movimiento migratorio de pobladores europeos que traían especies europeas o asiáticas previamente introducidas en Europa por sus usos ornamentales (Speziale et al., 2012).
Esto se enmarca en el concepto “Imperialismo Ecológico” planteado por Alfred Cosby en 1986 (Foster & Clark, 2004) e implica la introducción de flora y fauna europea en gran parte del resto del mundo entre los años 900 y 1900 como parte de la expansión y migración europea hacia nuevas tierras (Mack et al., 2000; Foster & Clark, 2004). Por ejemplo, Melia azedarach (paraíso) es una especie originaria del sureste de Asia que fue introducida en Europa por sus usos agroforestales y también fines ornamentales, medicinales e insecticidas (Falasca et al., 2015) y luego fue introducida en Latinoamérica como consecuencia de la migración europea (Badalamenti et al., 2013). También Ligustrum lucidum (ligustro) originaria de China fue introducida en Argentina como ornamental a comienzos del siglo XX (Franco et al., 2018).
La introducción de plantas vasculares puede ser intencional, debido a causas comerciales (forestal, horticultura, silvicultura) u ornamentales, o puede ser accidental (Reichard & Hamilton, 1997; Figueroa & Marquet, 2004). Las especies herbáceas son en su mayoría introducidas accidentalmente (Oliván & Volponi, 2007) mientras que las especies leñosas son en su mayoría introducidas intencionalmente. A nivel global, la causa principal es la horticultura (ornamental), seguido por el uso forestal, el alimenticio y, por último, el agroforestal (Richardson & Rejmánek, 2011). Nuestros resultados coinciden con Richardson y Rejmánek (2011) y muestran que todas las introducciones fueron intencionales. Además, las 109 especies analizadas también fueron introducidas principalmente con fines ornamentales, seguido por forestal e industrial, en tercer lugar, alimentario y medicinal y, por último, ecológico.
Con respecto a las características recopiladas para las especies exóticas arbóreas, encontramos una mayor frecuencia de especies caducifolias, monoicas y zoócoras. En general se propone que las especies invasoras tienen capacidad de dispersarse largas distancia gracias a vectores muy eficientes para dichas distancias como las aves o el viento y tienen la capacidad de instalar una población a partir de pocos individuos (Gosper et al., 2005; Vittoz & Engler, 2007; Richardson & Rejmánek, 2011).
Esto último estaría facilitado por la presencia de flores hermafroditas o sistemas sexuales monoicos y por contar con reproducción asexual que facilitan el establecimiento en un nuevo sitio (Reichard, 1996; Marco & Páez, 2000; Ríos & Vargas, 2003; Castro-Díez, 2005; Díez et al., 2009; Herrera, 2009). Los resultados sobre la reproducción sexual están alineados con las características esperadas ya que muestran la predominancia de especies monoicas sobre las especies dioicas. Sin embargo, la caracterización de la reproducción asexual difiere de lo esperado al presentar una baja proporción de especies con reproducción vegetativa. Esta discrepancia junto con la independencia entre la caracterización de la reproducción sexual (monoica o dioica) y la presencia de la vía vegetativa podría deberse al mayor peso relativo de la influencia humana en la presencia de especies exóticas. Actualmente las invasiones biológicas están determinadas en mayor medida por la presión de propágulos (el número de individuos y la frecuencia de introducción, modelados por la actividad humana) que por las características intrínsecas de las especies (Lockwood et al., 2005; Seebens et al., 2018; Gallardo & Vilà, 2019). Sin embargo, aunque no encontramos relación entre invasión y reproducción, esta característica aún puede ser muy importante al momento de determinar la o las formas de control de una especie en un área invadida.
Los síndromes de dispersión más frecuentes de las especies analizadas en este trabajo son en primer lugar zoocoria seguido por la anemocoria. Estos dos síndromes permiten dispersar las semillas a largas distancias y, de todos los vectores existentes, las aves tienen la mayor eficiencia (Gosper et al., 2005; Richardson & Rejmanek, 2011). Estos resultados también coinciden con lo reportado por Richardson & Rejmanek (2011) a escala global.
El impacto de la invasora puede incrementarse si modifica la fenología del ecosistema, o la abundancia de un tipo fenológico particular. Un cambio fenológico puede magnificar cambios ambientales (e.g. modificar el ciclado de nutrientes o del agua y la disponibilidad lumínica) y cambios bióticos (e.g. composición florística) (Levine et al., 2003). En general, los tipos de ambientes que identificamos difieren en su fenología, inclusive dentro de un mismo tipo. Por ejemplo, la zona YPCH (Yungas-Paranaense-Chaco Húmedo) cuenta con las yungas con alta proporción de especies deciduas y con la Selva Paranaense, donde la mayoría de las especies nativas son perennes. Los resultados de este trabajo muestran que las especies actualmente más problemáticas, o con mayor registro de sus impactos negativos, son Ligustrum lucidum y tres especies de pinos: Pinus contorta, Pinus halepensis y Pinus ponderosa. Estas especies son todas perennes y están invadiendo tanto ecosistemas libres de árboles como sistemas caducifolios. Ligustrum lucidum invade principalmente la zona de Yungas (Zamora Nasca et al., 2014; Fernández et al., 2020) o los talares del NE de la provincia de Buenos Aires (Franco et al., 2018), mientras que las especies Pinus contorta y Pinus ponderosa invaden la meseta patagónica en la zona MP (Monte-Patagonia) (Raffaele et al., 2015) y la especie Pinus halepensis en la Reserva Natural Ernesto Tornquist en la zona Pam (Pampa) (Zalba et al., 2008). Por otro lado, la especie caducifolia Gleditsia triacanthos invade los pastizales típicamente sin árboles de la zona Pam (Ghersa et al., 2002). En algunos casos se estudió la fenología de la floración y fructificación de las especies invasoras y nativas de una comunidad (Lediuk et al., 2014; Vergara-Tabares et al., 2016). Los ejemplos mencionados antes, sugieren que aunque la fenología del follaje no fue propuesta como rasgo para estudiar en especies invasoras, es importante caracterizar su impacto en la comunidad invadida.
En cuanto a las especies detectadas como problemáticas, la mayoría (74%) fue clasificada como potencialmente problemática y el 26% restante como actualmente problemática en Argentina. Una de las razones por la cual no todas las especies problemáticas implican un problema actual en Argentina puede ser la variabilidad de ecosistemas receptores respecto a la invasibilidad, i.e. la susceptibilidad a la invasión (Rejmánek et al., 2005; Brook et al., 2008). La otra razón puede ser que las especies, aunque naturalizadas, aún no colonizaron las zonas más susceptibles. Ecosistemas con mayor biodiversidad contarían con una mayor resistencia a invasiones biológicas mientras que procesos como el cambio del uso del suelo, el aumento de la agricultura, la pérdida o fragmentación de hábitats, la creciente urbanización y el cambio climático disminuyen la resistencia y aumentan la invasibilidad (Brook et al., 2008; Chaneton et al., 2012). De esta manera, la historia y el manejo de los ecosistemas pueden alterar la invasibilidad entre ecosistemas similares. Las invasiones biológicas no son inmediatas y sus impactos están positivamente relacionados con el tiempo de residencia (Simberloff et al., 2013). Por ello, las especies actualmente problemáticas pudieron haber sido introducidas en los ambientes más susceptibles o son ingresiones más antiguas que las especies potencialmente problemáticas cuyos impactos negativos todavía son poco perceptibles (Pyšek & Jarošík, 2005). Un análisis más detallado de las fechas de ingreso de las especies podría aclarar este aspecto.
Las especies que tienen capacidad de reproducirse asexualmente pueden tener un crecimiento poblacional exponencial en situaciones de densidades poblacionales bajas y esto favorece su carácter de invasoras (Ríos & Vargas, 2003; Castro-Díez et al., 2005; Vilà et al., 2010; Datri et al., 2015). A su vez, los síndromes de dispersión zoocoria y anemocoria y la presencia de flores hermafroditas y sistemas monoicos también favorecen el carácter invasor de las especies (Ríos & Vargas, 2003; Gosper et al., 2005; Vittoz & Engler, 2007; Díez et al., 2009; Richardson & Rejmánek, 2011). Sin embargo, la independencia estadística entre todas estas características y el carácter de “problemática” muestran que la generalización de estrategias debe mirarse atendiendo a las singularidades de cada caso. Por ejemplo, la actividad humana es el factor clave en la distribución geográfica y expansión de las especies, mientras que las características intrínsecas de las especies, no serían el factor principal determinando la característica “problemática” (Seebens et al., 2018; Gallardo & Vilà, 2019).
En general, acorde al triángulo de Whittaker (1975) las precipitaciones definen la presencia de ecosistemas boscosos. En Argentina la diversidad de especies y la diversidad de árboles se encuentran en las regiones con mayores precipitaciones (Zuloaga et al., 1999) y encontramos que la riqueza de las leñosas exóticas sigue aproximadamente ese patrón (Yungas-Selva Paranaense-Chaco Húmedo > Espinal-Chaco Seco, Pampa, Bosques Subantárticos > Monte-Patagonia). Estos resultados podrían estar explicados por la disponibilidad de recursos, ya que una mayor disponibilidad de recursos como agua, luz y nutrientes aumenta la invasibilidad del ecosistema (Ríos y Vargas, 2003). Sin embargo, el impacto de las especies exóticas podría tener un patrón opuesto. La lignificación de ambientes que carecen o presentan escasas especies arbóreas conlleva un importante cambio fisonómico, por lo que los impactos en el funcionamiento y biodiversidad tienen mayor magnitud (Huxman et al., 2005; Rolhauser & Batista, 2014; Archer et al., 2017). Este proceso suele ser más drástico en sabanas o pastizales y más sutil en bosques caducifolios invadidos por especies perennes (Aragón et al., 2014; Fernández et al., 2020).
Conclusión
Este trabajo expone información sobre especies arbóreas, exóticas e invasoras en Argentina. Hay varios factores que determinan el éxito de una invasión biológica como las características intrínsecas de las especies, la presión de propágulos, la disponibilidad de recursos como también la ausencia de predadores y competidores y las nuevas asociaciones mutualistas. En este trabajo encontramos que 17 especies ya son problemáticas en Argentina y que ese número podría triplicarse con las 44 especies que son problemáticas en otras regiones del planeta. Todas las especies exóticas de árboles llegaron intencionalmente a Argentina y las características analizadas no definen su calidad de problemática, con la excepción de la reproducción vegetativa. Esto resalta que ante futuros planes de ingreso de nuevas especies, es prioritario analizar su comportamiento en otras regiones ya que los rasgos de invasoras no serían buenos predictores, al menos en periodos relativamente cortos de tiempo. Además, en este estudio nos enfocamos en algunas las características intrínsecas de las especies y, por ello, futuras investigaciones podrían centrarse en los factores restantes para tener una mirada complementaria y ampliar el conocimiento de la situación actual.
Por otra parte, el análisis geográfico de las especies es una herramienta clave para guiar los esfuerzos futuros de control de invasiones biológicas en el país. Hay varios indicadores que pueden ser tomados en cuenta para medir el riesgo que presenta una zona determinada ya que tanto la capacidad de invasión de cada especie y la invasibilidad de cada ecosistema son influyentes. En este trabajo los indicadores utilizados están relacionados con la cantidad de especies problemáticas por zona. Aunque en este trabajo encontramos información de localidades para todas las especies, la distribución podría estar algo subestimada debido a que muchas veces se evita coleccionar especies exóticas en las expediciones botánicas (Schmidt-Lebuhn et al., 2013). Futuras investigaciones podrían involucrar indicadores que reflejen la invasibilidad de los ecosistemas argentinos y consideren la presencia de disturbios o la disponibilidad de recursos, para mejorar los planes de control y manejo.
En un contexto de recursos limitados y con incipientes evaluaciones del costo asociado con las especies invasoras en Argentina (Duboscq-Carra et al., 2021) establecer prioridades de acción es imprescindible. Las especies que de acuerdo a nuestros resultados son prioritarias y requieren monitoreo urgente serían las que presentan un riesgo actual o potencial alto y que podrían implicar impactos negativos considerables. Por un lado, aquellas especies que son actualmente problemáticas y que implican cambios fisonómicos en la comunidad invadida (Pinus contorta en MP, Pinus halepensis, Pinus pinaster y Gleditsia triacanthos en PAM, etc.) requieren monitoreo constante, acciones para detener su expansión y, posiblemente, planes de restauración en áreas de alto valor económico o ecológico. Por otro lado, aquellas especies que son potencialmente problemáticas, que presentan características que favorecen su invasión y que ya se encuentran en 3 o 4 de las 5 zonas delimitadas en Argentina (e.g. Acer negundo, Fraxinus pennsylvanica, Pinus elliottii y Populus alba) serían las especies que requieren programas de monitoreo a gran escala con evaluación de impactos a los sectores productivos y la biodiversidad.












 uBio
uBio