PUNTOS CLAVE
Conocimiento actual
• La mitad de los pacientes con diabetes tipo 2 sufren un deterioro de la función renal. La evidencia reciente motivó un cambio del enfoque terapéutico glucocéntrico al cardiorrenometabólico con la inclusión en las reco mendaciones internacionales de nuevas terapias con beneficios cardiovasculares y renales
Contribución del artículo al conocimiento actual
• Se describen los efectos directos e indirectos de los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) según los estudios clínicos y de la vida real, que confirman sus efectos beneficiosos sobre la función renal en diabetes e introducen la expectativa de los estudios en curso con objetivos renales.
La diabetes mellitus tipo 2 (DM2) y sus complica ciones crónicas tienen gran impacto sobre la calidad y expectativa de vida de los pacientes, así como sobre los costos del sistema de salud. En el informe 2019 del Instituto Nacional Central Único Coordinador de Ablación e Implante (INCUCAI), la enfermedad renal diabética contribuyó al 36.6% de los ingresos a diálisis1, siendo también la causa más frecuente de consulta nefrológica en la actualidad en la mayoría de los países del mundo2, incluyendo Argentina. Asimismo, el grado de compromiso renal se considera el factor predictivo más importante para morbilidad y mortalidad precoz en los individuos con DM2, dada su asociación con la enfermedad cardiovas cular (ECV)3. Esta asociación también se demostró en el reciente subanálisis del estudio multinacional CAPTURE, en el cual la prevalencia de ECV y ECV aterosclerótica se incrementó en paralelo con las categorías de riesgo de la enfermedad renal crónica (ERC) según las categorías de riesgo desde bajo a muy elevado de la guía Kidney Disease: Improving Global Outcomes (KDIGO)4.
El control de los factores de riesgo modificables y el uso generalizado de inhibidores del sistema renina-angiotensina-aldosterona, estatinas e inhibidores plaque tarios, han ofrecido una perspectiva más optimista para estos pacientes5. Sin embargo, si se considera que, en Argentina, la prevalencia de ERC en los sujetos con DM2 varía del 22.6% al 68.8%6,7, es imperiosa la necesidad de un diagnóstico temprano y un tratamiento adecuado para mitigar la repercusión de esta enfermedad en las personas con DM2.
La creciente evidencia sobre los beneficios cardiorre nales de terapias como los inhibidores del cotransporta dor sodio-glucosa tipo 2 y los agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1) (AR-GLP1), desafía sin dudas el statu quo e impulsa un cambio de paradigma. Sin embargo, en la práctica clínica, el uso de estos fármacos continúa siendo muy bajo; en Argentina representan alrededor del 12%, independientemente de la presencia o ausencia de ECV8,9. En esta publicación, analizaremos el efecto de los AR-GLP1 en la fisiología renal, evaluando las vías directas e indirectas por las cuales pueden reducir la carga de la enfermedad renal diabética, así como la evidencia clínica que sustenta su relevancia en este grupo de pacientes.
Diagnóstico de ERC en la DM2
La ERC se define como la alteración de la estructura o la función renal que persiste durante al menos 3 meses y que ocasiona repercusiones sobre la salud. Se categoriza en función de la etiología, la tasa de filtrado glomerular estimado (TFGe) y el nivel de albuminuria (Figura 1)10.

Fig. 1 Categoría de enfermedad renal crónica de acuerdo con la tasa de filtrado glomerular y el nivel de albuminuria y frecuencia de visitas y derivación a nefrólogo
La enfermedad renal diabética hace referencia a cam bios renales estructurales y alteraciones funcionales en el contexto de la diabetes mellitus; se caracteriza por albuminuria, hipertensión arterial y reducción progresiva de la TFGe11.
Las vías y los procesos que conducen a la enfermedad renal diabética son heterogéneos e incluyen inflamación, fibrosis y lesión túbulo-glomerular. La hiperglucemia crónica (a través de la inflamación y de productos fina les de glicosilación avanzada) así como la obesidad, la dislipidemia, la hiperuricemia y la hipertensión arterial no controlada, que acompañan frecuentemente a la DM2, contribuyen al daño renal12.
El diagnóstico de la ERC es un procedimiento simple, económico y no invasivo que asocia dos mediciones de laboratorio que brindan información complementaria: la TFGe que valora función renal y la albuminuria que evalúa principalmente lesión de las estructuras glomerulares. La TFGe y los niveles de albuminuria son predictores de progresión de la enfermedad, como así también de las complicaciones asociadas. Sin embargo, tanto las lesio nes patológicas1,13 como la progresión pueden ocurrir en ausencia de albuminuria o con niveles bajos14 en cerca de la mitad de los casos.
En la enfermedad renal diabética establecida, se han descrito recientemente otros biomarcadores plasmáticos proinflamatorios y profibróticos, tales como: la molécula de injuria renal 1, el receptor de factor de necrosis tumoral tipo 1 y tipo 2, la proteína quimiotáctica de monocitos-1 y la glicoproteína de unión a heparina y quitina. Estas moléculas se relacionan con el inicio y la progresión de la enfermedad renal. El nivel elevado de receptor de factor de necrosis tumoral tipo 2 parece ser el marcador más adecuado de alto riesgo de progresión; sin embargo, to davía se requieren más estudios para confirmar su utilidad y costo/efectividad en la práctica clínica14.
La Sociedad Argentina de Nefrología y las sociedades científicas nacionales15,16 que nuclean a los bioquímicos recomiendan la evaluación sistemática de la función renal y la albuminuria una vez al año15 en los pacientes con DM sin antecedentes de anormalidades previas; en caso de presentar alguna alteración, la evaluación debería ser más frecuente17. Es aquí donde radica la gran responsa bilidad de los médicos del primer nivel de atención sobre la detección inicial o screening de la enfermedad renal en diabetes.
El rol metabólico y renal del GLP-1 nativo
El GLP-1 es una hormona secretada por las células L del íleon distal y el colon tras la ingesta. Forma parte de las llamadas genéricamente incretinas. Entre otras acciones, el GLP-1 estimula la secreción pancreática de insulina y reduce la liberación de glucagón, con la consecuente reducción de la glucemia posprandial; asimismo, se describe un enlentecimiento del vaciamiento gástrico, una supresión de la producción hepática de glucosa y un incremento de la saciedad18. Localmente en el intestino, regulan el transporte de nutrientes e intervienen en la barrera intestinal. Además de su acción sobre el sistema nervioso central, los efectos periféricos del GLP-1 inclu yen el efecto sobre el sistema vascular y la regulación de la excreción urinaria de líquidos y electrolitos según la ingesta19.
El GLP-1 circulante tiene una vida media muy corta (menos de 2 min) y se inactiva en forma rápida, prin cipalmente por la ubicua enzima proteolítica dipeptidil peptidasa tipo 4 (DPP-4) y, en menor grado, por otras endo y aminopeptidasas20. En los individuos con DM2, este efecto incretina está alterado, siendo hasta un 25 % menor21. En este blanco terapéutico, las terapias basadas en incretinas cobran especial relevancia, incluidos los AR-GLP1 resistentes a la degradación enzimática y los inhibidores de la DPP-4 (iDPP-4) que generan un aumento del tiempo de vida de GLP-1 nativo. Nos centraremos en las acciones de los AR-GLP-1, los cuales se dividen en dos grupos según su origen: derivados de exendinas (exenatida, lixisenatida y efpeglenatida) y análogos del GLP-1 humano (liraglutida, albiglutida, dulaglutida, se maglutida) (Figura 2).
Efectos de los AR-GLP-1 a nivel renal
Los AR-GLP-1 tienen efectos favorables sobre la función renal y sus posibles acciones protectoras son multifacto riales más allá del control glucémico. Se han identificado receptores de GLP-1 en las células del músculo liso de las arteriolas preglomerulares (arteriolas aferentes, interloba res y arcuatas)22, en las células yuxtaglomerulares y en el túbulo contorneado proximal23,24. Si bien los mecanismos de acción de estas hormonas no han sido aún dilucidados por completo, inducen natriuresis y aumento de la diuresis, lo que podría explicar parcialmente la reducción de la presión arterial observada con la administración crónica de estos fármacos.
La hemodinamia glomerular depende de acciones pre glomerulares, glomerulares y postglomerulares. Se postu la que estas hormonas inhiben el contra-transportador de sodio-hidrógeno (NHE3), expresado en el ribete en cepillo del túbulo contorneado proximal, generando natriuresis y provocando por retroalimentación túbuloglomerular, la vasocontricción de la arteriola aferente glomerular22. Paralelamente, el agonismo del receptor GLP-1 sobre el aparato yuxtaglomerular disminuye la actividad del sistema renina-angiotensina-aldosterona a nivel renal (sobreexpresado en pacientes con nefropatía), generando vasodilatación de la arteriola eferente glomerular, lo que constituye una clara acción postglomerular. En paralelo se produce la activación de receptores de GLP-1 en los miocitos de las arteriolas renales, que generan vasodilata ción y aumentan el filtrado glomerular22. Como resultante de estos agonismos con efectos tanto vasodilatadores como vasoconstrictores, la evidencia es de neutralidad en la hemodinamia glomerular. Otros mecanismos indirectos incluyen las modificaciones de los niveles circulantes de insulina, glucagón y adenosín trifosfato que regulan también la expresión del NHE3 y de los transportadores de sodio glucosa (SGLT)25, así como un efecto inhibitorio simpático a nivel central con estimulación de la diuresis y la natriuresis25,26 (Figura 3).
Al mismo tiempo, dada la estrecha relación entre el estado inflamatorio y la DM227,28, la presencia de cito quinas, células inflamatorias y factores de crecimiento estaría involucrada en la patogénesis de la enfermedad renal diabética a través del incremento de la inflamación y la fibrosis vascular29. Esta alteración se desencadena en el túbulo contorneado proximal como consecuencia de los fenómenos hemodinámicos y metabólicos ge nerados por el aumento de la actividad de los SGLT2 y otros transportadores como el NHE330. Los AR-GLP1 modulan la inflamación en múltiples sitios, incluyendo los riñones y vasos sanguíneos, activando diversas vías antiinflamatorias con reducción del estrés oxidativo31. Además, se propone una correlación entre la alteración de la composición de la microbiota con la enfermedad renal32, ya que su desequilibrio favorece el pasaje de mediadores inflamatorios a través del intestino. Se destaca que en las glándulas de Brunner se concentra la mayor cantidad de receptores de GLP-1 del cuerpo humano, por lo que su agonismo disminuiría el ingreso de dichas moléculas inflamatorias. Sin embargo, el mecanismo exacto aún no está claro y podría ser el resultado de modificaciones en la ingesta después del inicio de las terapias con AR-GLP124,34. Los efectos de los AR-GLP1 sobre la función tubular y vascular renal en las personas con DM2 se resumen en la Figura 4.
Evidencia de los estudios clínicos
Los efectos beneficiosos sobre la función renal en los pacientes con DM2 han sido demostrados en los estudios clínicos de eficacia y seguridad, así como también en los estudios de resultados cardiovasculares de los análogos del GLP-1 humano (liraglutida, albiglutida, dulaglutida, semaglutida) y recientemente también con efpeglenatida, un derivado de exendina. Aunque el diseño y el objetivo principal de la mayoría de los estudios de resultados cardiovasculares es establecer la no inferioridad con res pecto al placebo en términos de eventos cardiovasculares adversos mayores (MACE, por su sigla en inglés), todos estos estudios incorporaron criterios de valoración renales secundarios y exploratorios19 (Tabla 1).
El primer estudio de eficacia y seguridad con liraglu tida realizado en una cohorte de pacientes con deterioro moderado de la función renal (TFGe: 30-59 ml/min/m2) (LIRA-RENAL) demostró que la terapia con este AR-GLP1 se asoció a una reducción significativamente mayor de la glucemia en ayunas con menor riesgo de hipoglucemia y sin consecuencias negativas en la función renal34. En el estudio de resultados cardiovasculares LEADER, se siguió durante una media de 3.8 años a 9340 pacientes con DM2 mayores de 50 años con al menos una condición cardiovascular (CV), incluida la ERC (definida como una TFGe < 60 ml/min/1.73 m2 y/o un cociente albuminuria/ creatininuria [RAC] ≥ 30 mg/g)35. Los pacientes tratados con liraglutida presentaron una reducción significativa del 13% en los MACE (tasa combinada de mortalidad de causa CV, infarto de miocardio y accidente cerebro vascular no mortal) (hazard ratio [HR]: 0.87; intervalo de confianza del 95% [IC95%]: 0.78-0.97; p < 0.001 para no inferioridad; p = 0.01 para superioridad). Este estudio incluyó 2158 pacientes con TFGe < 60 ml/min/1.73 m2, los cuales presentaron una reducción de riesgo de MACE aún mayor que aquellos con una TFGe > 60 ml/min/1.73 m2 (HR: 0.69; IC95%: 0.57-0.85 vs HR: 0.94; IC95%: 0.83- 1.07; p para la interacción = 0.01). En el subgrupo de 1130 pacientes con alto riesgo renal (TFGe < 60 ml/min/1.73 m2 y micro o macroalbuminuria), liraglutida también redujo el riesgo de eventos CV adversos tan eficazmente como en los subgrupos sin tales riesgos (HR: 0.63; IC95%: 0.49-0.82)35. En este estudio se observó además una reducción del 22% en el criterio de valoración combinado renal (aparición de macroalbuminuria, duplicación de la creatininemia, TFGe ≤ 45 ml/min/1.73 m2, necesidad de terapia de reemplazo renal o mortalidad de causa renal) en el grupo tratado con liraglutida (HR: 0.78; IC95%: 0.67-0.92; p = 0.003). Este resultado fue impulsado principalmente por la reducción de la aparición de ma croalbuminuria persistente (HR: 0.74; IC95%: 0.60-0.91; p = 0.004)37 (Tabla 1).
Muchos de los mecanismos nefroprotectores hemodi námicos, metabólicos y antiinflamatorios30 que mejoran con la administración de liraglutida, también se han in formado posteriormente con dulaglutida y semaglutida38. La importante disminución de la albuminuria con el uso de estos fármacos no solo se relaciona con una menor progresión de la ERC, sino que también tiene un impacto CV39independiente de la caída de la TFG, jerarquizando así el síndrome cardiorrenal.
En el estudio de seguridad CV de semaglutida (SUS TAIN-6)40, de 104 semanas de duración en el que par ticiparon 3297 pacientes con DM2 y riesgo CV o ECV establecida, el 10.7% presentaban solo ERC, el 58.8% solo ECV y 13.4%, ambas. Semaglutida redujo un 26% el objetivo primario (MACE; HR: 0.74; IC95%: 0.58-0.95; p < 0.001 para no inferioridad), destacándose el alto riesgo CV de los pacientes incluidos (incidencia de MACE en el grupo placebo: 4.44 cada 100 personas/año, pese a recibir medicación cardioprotectora óptima en la mayoría de los casos). Asimismo, semaglutida redujo un 36% el riesgo del resultado renal compuesto, cuya definición fue similar a la del estudio LEADER (HR: 0.64; IC95%: 0.46-0.88; p = 0.005), impulsado igualmente por la reduc ción del 46% de la macroalbuminuria. Datos posteriores conjuntos de los resultados con semaglutida y liraglutida (Tabla 2) demostraron que los pacientes en tratamiento con estos fármacos presentaron menor riesgo de progre sión a micro o macroalbuminuria y mayor probabilidad de regresión en la categoría de albuminuria versus placebo. La probabilidad de alcanzar una reducción del RAC del 30% fue mayor con los AR-GLP-1 vs. placebo (p < 0.0001 para todos los subgrupos de RAC)41 (Figuras 5 y 6). En el estudio REWIND participaron 9901 pacientes con DM2 mayores de 50 años con un evento o un factor de riesgo CV; se observó una reducción del 12% de los MACE (HR 0.88; IC95%: 0.79-0.99; p = 0.026) en aque llos tratados con dulaglutida versus placebo. El 31.5% de la población incluida presentaba enfermedad CV previa y el 22.2% tenía una TFGe < 60 ml/min/1.73 m2. La incidencia del criterio combinado exploratorio renal (aparición de macroalbuminuria [RAC > 33.9 mg/dl], reducción sostenida de la TFGe ≥ 30% o necesidad de terapia de reemplazo renal) fue 15 % menor en la rama dulaglutida (HR: 0.85; IC95%: 0.77-0.93; p = 0.0004), después de una mediana de seguimiento de 5.4 años. Al igual que en los estudios previos, el efecto fue más acentuado para la macroalbuminuria (HR: 0.77; IC95%: 0.68-0.87; p < 0.0001)42 (Tabla 1).

Tabla 2 Estadio renal y de albuminuria basal de los pacientes de los estudios de seguridad cardiovascular SUSTAIN-6 y LEADER

Fig. 5 Progresión en la clasificación relación albuminuria/creatininuria con semaglutida o liraglutida vs. placebo, por albuminuria basal.

Fig. 6 Reducción persistente del 30% de relación albuminuria/creatininuria y regresión de la cla sificación de albuminuria con semaglutida o liraglutida versus placebo, por albuminuria basal
Por otro lado, hay evidencia de un efecto beneficioso de estas moléculas sobre la pérdida anual de la TFGe. Un análisis del estudio SUSTAIN-6 evidenció un enlen tecimiento del deterioro de la TFGe anual en la población general con semaglutida (diferencia estimada de trata miento [DET] media anual: 0.87 ml/min/1.73 m2). Este efecto pareció ser más pronunciado en el grupo con TFGe < 60 ml/min/1.73 m2 (DET anual: 1.62 ml/min/1.73m2); en el estudio LEADER, la reducción anual de la TFGe también fue más lenta con liraglutida frente a placebo en la población general, siendo el efecto más marcado en los pacientes con TFGe basal < 60 ml/min/1.73 m2 (DET anual: 0.67 ml/min/1.73 m2)43 (Figura 7). Asimismo, en el estudio AWARD-7, se evidenció una menor declinación en la TFGe en los pacientes tratados con dulaglutida en ambas dosis versus insulina glargina para niveles simi lares de control glucémico44.
El recientemente publicado metanálisis de Sattar y col., incluyendo los resultados del estudio AMPLITUD-O con epfeglenatida, confirmó un claro beneficio de la familia de AR-GLP-1 al reducir un 21% el desenlace compuesto renal (HR: 0.79; IC95%: 0.73-0.87; p < 0.0001), sin efecto en el empeoramiento de la función renal. Excluyendo al estudio ELIXA (en el cual se incluyeron pacientes con eventos coronarios recientes), los resultados mostraron una reducción del 22% del desenlace compuesto renal (HR: 0.78; IC95%: 0.71-0.87; p < 0.001) y una disminución del 18% del empeoramiento de la función renal (HR: 0.82; IC95%: 0.69-0.98; p = 0.03) (Figura 8). Estos resultados no se asociaron con un mayor riesgo de hipoglucemia severa, retinopatía o eventos adversos pancreáticos45.

Fig. 8 Metaanálisis de los efectos de los AR-GLP-1 sobre el resultado renal compuesto y la función renal
Resulta de interés señalar que el deterioro de la fun ción renal representa por sí mismo una barrera para la administración de algunos fármacos antidiabéticos; esto jerarquiza los efectos de estos fármacos que pueden ser utilizados de manera segura incluso ante una TFGe < 30 ml/min hasta el ingreso a la diálisis (Figura 9)46-49. En este sentido, el análisis conjunto de Cherney y col. de los programas SUSTAIN y PIONEER objetivó que la eficacia en la reducción de la hemoglobina glicosilada atribuida a la semaglutida fue independiente de la TFGe incluso cuando fue menor a 45 ml/min/1.73 m250. Asimismo, los objetivos metabólicos con esta familia de fármacos se logran con un bajo riesgo de hipoglucemias, incluso al complementar el tratamiento con insulina; este hecho es muy relevante al considerar la labilidad de los pacientes con enfermedad renal diabética avanzada. Se suma a esta evidencia la reciente publicación del estudio Glyce mia Reduction Approaches in Diabetes: A Comparative Effectiveness Study (GRADE) que comparó la efectividad de los fármacos comunes para tratar la DM2 durante un promedio de 5 años. Los resultados demostraron que la liraglutida fue tan efectiva en el control metabólico como la insulina, con el beneficio agregado de la reducción de las hipoglucemias51.
Finalmente, otra comorbilidad frecuente en esta población es la enfermedad vascular periférica. Tanto liraglutida como semaglutida redujeron los MACE de ma nera consistente tanto en los pacientes con enfermedad polivascular como con enfermedad vascular única, con resultados similares para MACE expandidos y muerte de causa CV52,53.
Guías de práctica clínica
La robusta evidencia sobre el impacto en el riesgo CV ha motivado la inclusión de los AR-GLP1 en el tratamiento de los pacientes con DM2 y ECV aterosclerótica y facto res de riesgo CV con un nivel A de recomendación, así como en aquellos con enfermedad renal54. Las recientes normativas de la American Diabetes Association (ADA)55, las guías conjuntas de la European Society of Cardiology (ESC) y la European Association for the Study of Diabetes (EASD)56, la guía de práctica clínica del programa Kidney Disease: Improving Global Outcomes (KDIGO)17 y las Guías de la Asociación Latinoamericana de Diabetes (ALAD)56 incluyen recomendaciones al respecto que se sintetizan en la Tabla 3.
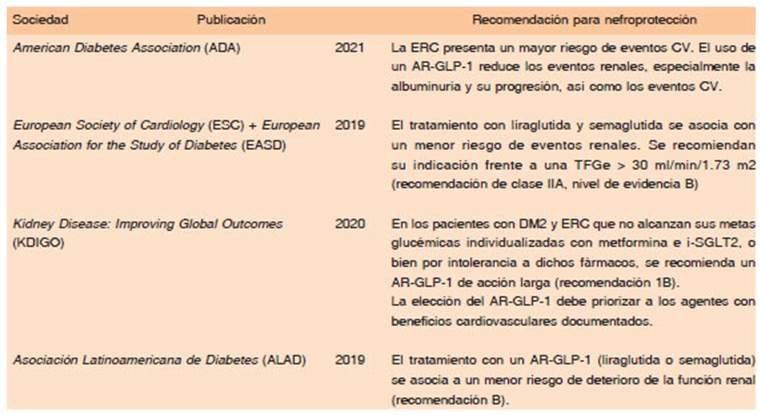
Tabla 3 Recomendaciones para la nefroprotección en los pacientes con DM2 de las asociaciones científicas internacionales51-55
Datos del mundo real y estudios en curso
Los iDPP-4 son agentes antidiabéticos que también actúan incrementando la concentración plasmática de las incretinas, fundamentalmente GLP-1, al impedir su degradación. Si bien los iDPP-4 se consideran fármacos seguros desde el punto de vista CV, no han demostrado una reducción del riesgo de MACE. Asimismo, los AR-GLP1 se asocian con un mayor control de la glucemia y una mayor disminución relativa del peso corporal, en comparación con los iDPP-457.
Estos datos se ratifican a partir de la evidencia de estudios de la vida real. En un análisis de una base de datos de prescripciones de fármacos antidiabéticos en el que se identificaron 3195 indicaciones de AR-GLP1, los pacientes bajo este tratamiento evidenciaron una reducción del riesgo de eventos CV en comparación con la terapia con iDPP-4 (HR: 0.73; IC95%: 0.57-0.96)58.
De igual forma, en un estudio de cohortes de la vida real en Suecia, Dinamarca y Noruega se incluyeron da tos de 38 731 nuevos usuarios de AR-GLP1 (liraglutida, exenatida, lixisenatida o dulaglutida en el 92.5%, 6.5%, 0.7% y 0.6% de los casos, respectivamente). Mediante el cálculo de un puntaje de propensión, se comparó a estos pacientes con un grupo de igual distribución por edad y sexo que empleaba iDPP-4. Se consideró como criterio principal de valoración combinado a la aparición de eventos renales graves (necesidad de terapia de re emplazo renal, mortalidad por causa renal, hospitalización por eventos renales). La terapia con AR-GLP1 se asoció con una reducción del 24% del riesgo combinado de estos eventos (HR: 0.76; IC95%: 0.68-0.85), equivalente a una diferencia absoluta de -1.5 eventos/1000 pacientes/año (IC95%: -2.1 a -0.9). Estos beneficios se atribuyeron a una disminución del 27% en el riesgo de progresión a terapia de reemplazo renal (HR: 0.73; IC95%: 0.62-0.87) y de hospitalización por eventos renales (HR: 0.73; IC95%: 0.65-0.83)59.
Como se describió anteriormente, los estudios de re sultados cardiovasculares como LEADER, SUSTAIN 6 y REWIND han mostrado que el tratamiento con AR-GLP1 puede estar asociado con un beneficio en los resultados de la función renal. Sin embargo, el efecto observado de semaglutida sobre la disminución de la TFGe y los criterios de valoración renales duros (por ejemplo, enfermedad renal terminal), requieren más estudio. Por esta razón actualmente se está llevando a cabo el estudio FLOW con un periodo de seguimiento más prolongado, que evaluará específicamente el efecto de este AR-GLP1 en los resultados renales de pacientes con DM2 y ERC preexistente60. Se agrega que el modo de acción detrás del posible efecto renal observado con los AR-GLP1 aún no está completamente entendido. Para brindar respuesta a este interrogante, actualmente también se encuentra en curso el estudio mecanístico REMODEL, el cual fue diseñado en base a la hipótesis de que semaglutida puede tener acciones directas sobre el riñón. Se espera que la inclusión de participantes de ambos estudios finalice en 202461.
Conclusiones
Los AR-GLP1 se asocian con beneficios CV y renales en las personas con DM2. Aunque su mecanismo de acción no depende del control glucémico, deberíamos también ampliar el concepto cardiorrenal a cardio-reno-metabólico, pues estos fármacos no pierden su eficacia hipogluce miante aun en estadios avanzados de ERC a diferencia de otros grupos terapéuticos. Este efecto, sumado al bajo riesgo de hipoglucemia, jerarquiza a los AR-GLP1 en esta población vulnerable de pacientes. En función de la evidencia farmacológica, de los datos de investigaciones clínicas y de estudios de vida real, los AR-GLP1 pueden considerarse como agentes nefroprotectores para los pacientes con DM2 y ERC, caracterizada por su elevada morbilidad secundaria al compromiso renal y CV.




















