Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Boletín de la Sociedad Argentina de Botánica
versão On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. vol.57 no.4 Córdoba dez. 2022
http://dx.doi.org/10.31055/1851.2372.v57.n4.37327
10.31055/1851.2372.v57.n4.37327
Ecología y conservación
Leucaena leucocephala (Fabaceae), especie invasora en la Argentina
Leucaena leucocephala (Fabaceae), an invasive species in Argentina
Favio G.Vossler
GustavoDelucchi
1. Laboratorio de Actuopalinología, Centro de Investigación Científica y de Transferencia Tecnológica a la Producción. Consejo Nacional de Investigaciones Científicas y Técnicas. CICYTTP (CONICET - Prov. ER - UADER), Dr. Materi y España, E3105BWA, Diamante, Entre Ríos, Argentina.
2. Facultad de Ciencias Agrarias y Forestales 60 y 119, Facultad de Ciencias Naturales y Museo, Paseo del Bosque s/n., La Plata, Buenos Aires, Argentina.
*favossler@yahoo.com.ar
Summary
Background and aims: Leucaena leucocephala (Fabaceae) has been considered one of the 100 most invasive species on a global scale. Despite its potential threat, its introduction is increasingly being promoted for agroforestry, ornamentation, shading and handicrafts in the warm and temperate forest regions of Argentina. The threat of Leucaena populations to biodiversity has been reported worldwide, where control was not effective. The aims of the present study were to update the record of naturalized populations in Argentina and provide information on the historical and current processes of naturalization and invasion.
M&M: The records were documented by collecting plant material in the field and examination of material housed in herbaria. Field observations were also made to observe current naturalization processes and interaction with dispersers/predators.
Results: The invasive condition was confirmed in Argentina and two introduction pathways were recognized. Based on the general appearance of the groves and the microhabitat that is generated in the invaded environments, it is considered a transformer species in Argentina. The reproductive characteristics and their interaction with other strata of regional biodiversity related to the invasive process are indicated.
Conclusions: The analysis of the herbarium labels allowed detecting that in 1921 this species was already naturalized in the country. The intervention of humans in its dispersal is discussed and future scenarios are proposed.
Key words: Biological invasion, invasive fodder species, invasive ornamental species, invasive tree, naturalization.
Resumen
Introducción y objetivos: Leucaena leucocephala (Fabaceae) ha sido considerada como una de las 100 especies más invasoras a escala global. A pesar de su amenaza potencial, su introducción se promueve cada vez más para la agrosilvicultura, la ornamentación, el sombreado y la artesanía en las regiones forestales cálidas y templadas de la Argentina. La amenaza a la biodiversidad de las poblaciones de Leucaena se ha informado en todo el mundo, donde el control no fue efectivo. Los objetivos del presente estudio fueron efectuar un registro actualizado de las poblaciones naturalizadas en Argentina, y brindar información sobre los procesos históricos y actuales de naturalización e invasión.
M&M: Los registros se documentaron mediante la recolección de material a campo y consulta de material depositado en herbarios. También se realizaron observaciones a campo para conocer los procesos actuales de naturalización y su interacción con dispersores/depredadores.
Resultados: Se estableció el estatus de invasora en Argentina y se reconocieron dos vías de introducción. En base al aspecto general de los bosquecillos y el microhábitat que se genera en los ambientes invadidos se considera a esta especie como transformadora en la Argentina. Se indican las características reproductivas y su interacción con otros estamentos de la biodiversidad regional relacionados con el proceso invasor.
Conclusiones: La interpretación de etiquetas de herbario permitió establecer que en 1921 ya estaba naturalizada en el país. Se discute la intervención del ser humano en su dispersión y se plantean futuros escenarios.
Palabras clave: Árbol invasor, especie forrajera invasora, especie ornamental invasora, invasión biológica, naturalización.
Introducción
Una de las principales causas de la pérdida de biodiversidad a escala global, la constituye la introducción de especies exóticas invasoras (Lowe et al., 2000; Sala et al., 2000). Las invasiones biológicas durante el Holoceno se han regido por cambios en el paisaje realizados por actividades humanas (Mooney & Drake, 1986; Olden et al., 2011; Hofman & Rick, 2018; Castro-Díez et al., 2019). Se considera que estos cambios generarán una extinción masiva de especies en las próximas décadas, varias veces más rápida que en épocas anteriores (Sala et al., 2000; Díaz et al., 2019). Desde el Neolítico, las plantas y los animales han seguido al ser humano en sus migraciones rompiendo las barreras geográficas y, en muchos casos, ocupando amplias regiones del mundo (Olden et al., 2011; Hofman & Rick, 2018).
Las plantas exóticas se pueden dispersar en forma deliberada (como ornamentales, alimenticias o forestales) o accidental (con las semillas de los cultivos, asociada al ganado doméstico o como plantas de acuario). Una vez que se introduce una especie, existe una amplia gama de posibilidades desde la no naturalización hasta convertirse en una especie invasora e incluso transformadora (Richardson et al., 2000; Pysek et al., 2004). Estas últimas tienen la capacidad de adaptarse muy bien al nuevo ecosistema, porque existen condiciones climáticas, edáficas o biológicas favorables y muchas veces bastante similares a las de su zona de origen geográfico.
Las especies exóticas pueden adquirir el estatus de naturalizadas, definidas por Pysek et al. (2004) como aquellas que pueden mantener poblaciones autosustentables por al menos 10 años sin intervención directa del hombre (o a pesar de la intervención humana), y mediante el reclutamiento a partir de semillas o estructuras vegetativas capaces de crecer de manera independiente. A su vez, tales especies podrían convertirse en invasoras-transformadoras, mostrando elevadas tasas de avance y dominio rápido en el nuevo entorno, perjudicando a las especies nativas y llevándolas en algunos casos a la reducción de sus poblaciones o a su extinción (Gerber et al., 2008; Bellard et al., 2016). Las especies invasoras, por otro lado, han sido definidas por Pysek et al. (2004) como un subconjunto de plantas naturalizadas que producen descendencia reproductiva frecuentemente en números muy elevados a distancias considerables de las plantas parentales y, por lo tanto, tienen el potencial de expandirse en un área extensa. A fines prácticos, para las especies naturalizadas cuya propagación es por semillas, se las considera invasoras si produce descendencia reproductiva a más de 100 m de los individuos progenitores en un período menor a 50 años (Richardson et al., 2000; Pysek et al., 2004). Las plantas transformadoras, a su vez, son un subconjunto de plantas invasoras que se caracterizan por modificar la estructura y servicios de los ecosistemas (Wells et al., 1986; Pysek et al., 2004), y de esta manera, se utiliza este término para denominar a las especies invasoras con efectos más profundos sobre la biodiversidad (Richardson et al., 2000).
Las especies invasoras son difíciles de controlar cuando están bien establecidas, ya que el monitoreo y manejo de sus poblaciones requieren de elevados costos económicos y grandes esfuerzos (Olckers, 2004; 2011). Este es el caso de Leucaena leucocephala (Lam.) de Wit (Fabaceae) considerado entre los100 organismos más invasores del mundo (Lowe et al., 2000). A pesar de ser considerada una "especie conflictiva" para la conservación de la biodiversidad y de difícil sino imposible erradicación (Rentería Bustamante et al., 2007; Olckers, 2011), sigue siendo altamente promocionada en todo el mundo, incluida la Argentina, como planta forrajera y abono verde (Valinotti & Heyn, 1991; Aguirre & Galván, 2012; Cook et al., 2014; Global Invasive Species Database, 2015; Glatzle et al., 2019; Radrizzani, 2019b). Su comportamiento invasivo fue reportado a nivel mundial, donde el control biológico, mecánico, herbicida y mediante incendios no ha sido efectivo (Rentería Bustamante et al., 2007; Olckers, 2011). En el caso de los agentes biológicos, principalmente insectos, llegaron a depredar incluso a otras especies de Leguminosas nativas (Olckers, 2011).
Leucaena leucocephala es originaria de los bosques del sur de México, Belice y Guatemala (Zárate Pedroche, 1994; Hughes, 1998). Se compone de tres subespecies: leucocephala, glabrata (Rose) Zárate y ixtahuacana C.E. Hughes (Hughes, 1997; 1998). La subespecie leucocephala, de hábito arbustivo, fue la primera en ser introducida, inicialmente en las islas Filipinas entre los años 1521 y 1815 durante la colonización española (Merrill, 1912) y posteriormente en África, Asia y el Caribe. La subespecie glabrata fue introducida desde fines del siglo XIX para reemplazar a leucocephala debido a su vigor superior y hábito arborescente más adecuado para fines agroforestales (Zárate Pedroche, 1994; Hughes, 1998) y es la que actualmente se halla invadiendo gran parte del mundo incluso el Cono Sur. La subespecie ixtahuacana sigue restringida a su pequeña área de origen en Guatemala y México (Hughes, 1998).
Las subespecies reportadas como invasoras (glabrata y leucocephala) se han naturalizado ampliamente en 125 países de zonas tropicales, subtropicales y templado-cálidos de todo el mundo, entre ellos Estados Unidos de América (Hughes, 1998), China (Weber et al., 2008), India (Vattakaven et al., 2016) y Australia (Western Australian Herbarium, 1998). Las mismas están amenazando en particular la biota de las islas oceánicas, particularmente en Hawai y otras islas del Pacífico donde es una de las especies invasoras dominantes (PIER, 2006; Rentería Bustamante et al., 2007).
Más recientemente, a partir del año 2000, se detectó la presencia de la subespecie glabrata en Europa, tanto insular (islas macaronésicas, Madeira y del Mediterráneo) como continental en España, Portugal e Italia (Dana et al., 2003; Sanz-Elorza et al., 2004; Euro+Med, 2006; Sánchez Gullón et al., 2017). Hasta el momento, la Antártida es el único continente con ausencia de esta especie invasora.
En América del Sur, hasta el momento han sido contabilizados numerosos registros de estas 2 subespecies, principalmente glabrata, y sus estatus de naturalización han sido tratados de diferente manera a lo largo del tiempo. Esta variación obedece tanto a las dudas planteadas por algunos autores sobre su real estatus y al continuum existente en la naturaleza entre naturalización e invasión. Esta especie se ha reportado naturalizada en todo América del Sur, donde se la menciona para Bolivia (Hughes, 1998; Saldias Paz, 1993; Jorgensen et al., 2014), Perú (Hughes, 1998), Ecuador Continental e Islas Galápagos (Rentería Bustamante et al., 2007), Colombia (Hughes, 1998), Venezuela (Hughes, 1998), las Guayanas (Hughes, 1998) y los países del Cono Sur: en Brasil, incluyendo a los biomas de Amazonia,
Caatinga, Cerrado y Mata Atlántica (Forzza et al., 2010; Fabricante, 2014; Costa et al., 2015; Zuloaga et al., 2019; Machado et al., 2020), Uruguay, en Isla Timoteo Domínguez (Ulibarri et al., 2002; Ulibarri, 2004), Paraguay, en Canindeyú, Cordillera y Presidente Hayes (Marín Ojeda, 2016) y Chile, en la Isla de Pascua (Rodríguez et al., 2018; Zuloaga et al., 2019).
En la Argentina se encuentra la subespecie glabrata con 6 registros (5 en Jujuy y 1 en Misiones) (Ulibarri, 2004; Zuloaga et al., 2008; 2019; Carranza et al., 2020; Documenta Florae Australis database [http://www.darwin.edu.ar/iris, última consulta abril 2021]). En las últimas décadas se ha observado un comportamiento invasor de esta especie en ecosistemas naturales y antropogénicos del centro y norte de Argentina, correspondiendo el material observado a la subespecie glabrata, cuyos nombres vulgares en la región son "aromo blanco", "leucaena", o "leucanea". De tal forma Delucchi et al. (2011) la han considerado como naturalizada en base a los criterios de Richardson et al. (2000) y de Pysek et al. (2004).
Los objetivos del presente estudio fueron efectuar un registro actualizado de las poblaciones naturalizadas en Argentina, y brindar información sobre los procesos históricos y actuales de naturalización e invasión de L. leucocephala.
Materiales y Métodos
Para la identificación botánica se consultó bibliografía sobre las especies del género Leucaena (Zárate Pedroche, 1994; Hughes, 1998). La documentación de registros se realizó a través de la fotografía de individuos y poblaciones y de la recolección de material vegetal depositado posteriormente en los herbarios LP y CTES. Se registraron la fenología reproductiva (meses de floración y fructificación), visitas florales, dispersión de semillas y frutos y depredación de semillas. Se consultaron ejemplares depositados en los herbarios BAB, CORD, SI, LP, CTES, F, JUA, MO, RB y NY (acrónimos según Thiers, 2020), y se evaluó la información de la etiqueta relacionada con las vías de introducción y dispersión, tiempo de residencia y el proceso de naturalización-invasión. Al respecto, se clasificó al material de herbario como cultivado o naturalizado teniendo en cuenta si esta información estaba explícita en la etiqueta o si la localización puntual del individuo colectado permite asignarlo (basado en su comportamiento invasor actual, es decir, se asumió su estatus naturalizado cuando estaba presente a orillas de cursos de agua, en barrancas, bordes de rutas, baldíos y sobre todo si el colector planteó dudas sobre su naturalización), y como estatus incierto cuando dicha descripción no permitió su asignación. Para evaluar parámetros referentes a la ecología de la invasión, se utilizó la terminología sugerida por Rejmánek (2000), Richardson et al. (2000; 2011) y Pysek et al. (2004). La distribución actual en Argentina se complementó mediante una revisión de la literatura incluyendo los catálogos de Flora del Cono Sur (Zuloaga et al., 2008; 2019) y Tropicos.org (https://www.tropicos.org/home), la base de datos Documenta Florae Australis database (http://www.darwin.edu.ar/iris), los herbarios virtuales CTES, NY y RB, y los registros de la base de datos disponibles en https://www.gbif.org/es/ (GBIF, 2020).
Resultados
Registros estudiados a partir de material de herbario
En Argentina se registró formalmente a L. leucocephala subsp. glabrata en 10 provincias (29 registros de naturalización confirmada, dos permanecieron con estatus incierto y siete son cultivados) (Anexo, Fig. 1, Tabla 1).
Observaciones a campo de individuos cultivados y naturalizados (Figs. 2-4)
Individuos cultivados ornamentales-forestales: Se registraron individuos cultivados en el arbolado urbano de las siguientes ciudades de Argentina: Juan José Castelli (Fig. 2B) (F G. Vossler 313, LP), Villa Río Bermejito, Resistencia, Corrientes, San Miguel de Tucumán (Figs. 3D-F), San Salvador de Jujuy, Santa Fe, Oro Verde y Paraná. Su uso en el arbolado urbano es una de las vías de introducción de esta especie en la región.
Individuos naturalizados a partir de ornamentales-forestales: En los últimos 15 años, se registraron además, más de 20 poblaciones naturalizadas en ambientes urbanos, periurbanos y naturales en seis provincias argentinas: Chaco: Juan José Castelli: bordes del cementerio (Fig. 2E), en tumbas antiguas (F. G. Vossler 644, CTES), en los perímetros y patios de viviendas en Barrios Nocayí y Curiyí, en zanjas periurbanas (Fig. 2F), en bordes de camino (Fig. 2D) (F. G. Vossler 413, LP), así como debajo de árboles cultivados (Fig. 2C) y en patios de viviendas; Villa Río Bermejito: barranca del río Bermejito (F. G. Vossler 633, CTES) en inmediaciones a árboles cultivados, y debajo de árboles cultivados en patio de viviendas (F. G. Vossler 411, LP); Resistencia: en zanjas aledañas al río Negro y en el cauce del río (F. G. Vossler 408, LP) (Figs. 2G, H) y en terreno lindante a Terminal de Ómnibus; Corrientes: Corrientes: barranca de la costanera; Entre Ríos: Paraná: rotonda y arroyo en acceso al túnel subfluvial Raúl Uranga-Carlos Sylvestre Begnis, arroyo La Santiagueña (F. G. Vossler 677, CTES), arroyo Antoñico, costanera del Río Paraná (F. G. Vossler 679, CTES), en bulevares de la ciudad (F. G. Vossler 432, LP) (Fig. 3I), y en veredas de la ciudad tanto en la cercanía como muy distantes de árboles cultivados (F. G. Vossler 678, CTES); Oro Verde: sobre Ruta Provincial 11 a 100 m de la Facultad de Ciencia y Tecnología (UADER); Piedras Blancas: barranca de costa del río Paraná; Jujuy: San Salvador de Jujuy: terreno lindante al río Xibi Xibi, bordes de la autopista ingreso a la ciudad, jardines alrededor de la vieja terminal; Perico: ingreso a la ciudad; Salta: borde de camino en un ambiente natural ecotonal Yungas-Chaco; Tucumán: San Miguel de Tucumán: en alcantarillas canalizadas en la ciudad (Fig. 3H), debajo de árboles cultivados en veredas (Fig. 3G), y en terrenos baldíos (Figs. 3A-C) (F. G. Vossler 382, LP); Lules: sobre el río Lules. Estas poblaciones forman parte de un continuum de naturalización-invasión originadas a partir del escape de semillas y frutos con semillas desde individuos cultivados como ornamentales en ciudades.
Individuos naturalizados a partir de cultivados como forraje-abono verde: Se registró su cultivo como forraje, abono verde y/o experimentación silvopastoril en más de 25 sitios en ocho provincias de Argentina. Los mismos pudieron documentarse a partir de información obtenida de la bibliografía y sitios de internet mediante la búsqueda de los términos "Leucaena"", "Leucaena leucocephala'", "Leucaena glabrata"", "Leucaena leucocephala subsp. glabrata"", "Leucaena leucocephala subsp. leucocephala"" (Gándara et al., 1986; 2019; Lacorte et al., 1987; Valinotti & Heyn, 1991; Roig, 1992; Goldfarb et al., 1993; 2005; Aguirre & Galván, 2012; Cook et al., 2014; Radrizzani & Nasca, 2014; Chará et al., 2019; Glatzle et al., 2019; Radrizzani, 2019a; b). Estos registros permitieron documentar otra de las vías de introducción en Argentina mediante la importación de un commodity.
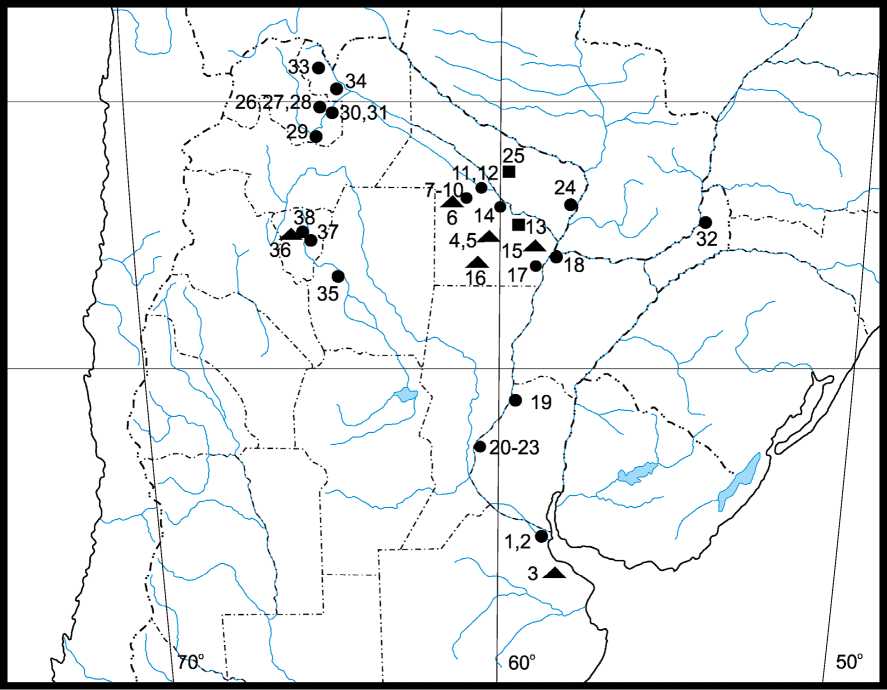
Fig. 1. Mapa de distribución de Leucaena leucocephala en Argentina, especificando el estatus de naturalización de los especímenes de herbario examinados (círculos: naturalizado; cuadrados: estatus incierto; triángulos: cultivado). Los números se corresponden con cada ejemplar depositado y se hallan referenciados en el texto (ver Anexo) y en la Tabla 1.
Reproducción, dispersión y depredación de semillas Tanto en individuos cultivados y naturalizados de la región chaqueña, se observaron ocasionales visitas florales de abejas de la tribu Meliponini y Apis mellifera L. Los individuos de L. leucocephala poseen una larga fenología floral y frutos casi todo el año con elevada producción de semillas (Figs. 2B, F; 3F; 4C), excepto luego de fuertes heladas cuando las flores y brotes se marchitan. La floración y fructificación se observa incluso en individuos juveniles, de muy baja estatura (Figs. 2D, F-G; 3I), y en ramas nuevas de árboles intensivamente podados.
Tanto los cursos de agua de ambientes urbanos (zanjas, alcantarillas y cordón-cuneta) y de ambientes naturales (ríos y arroyos) funcionan como rutas de dispersión o corredores hacia otros ambientes urbanos, periurbanos y naturales, a lo largo de los cuales se encontraron plántulas, renovales e individuos reproductivos establecidos (Figs. 2F-H; 3H). Esto refleja la importancia de la hidrocoria en la propagación de la especie. Además de este modo de dispersión, la barocoria y anemocoria también generan densas poblaciones en baldíos, veredas, patios y basurales en la cercanía de individuos establecidos (Fig. 3F-G). Las poblaciones densas evitan el crecimiento de otras especies, modificando en pocos años la fisonomía del ambiente, que adopta el aspecto de un bosquecillo monoespecífico con sotobosque cerrado, inaccesible y de aspecto sombrío, por lo que es considerada una especie invasora de tipo transformadora (Figs. 2D-E, H; 3A-C).
Tabla 1. Registros de material de herbario considerados como naturalizados, de estatus incierto y cultivados para Leucaena leucocephala subsp. glabrata en cada provincia de Argentina (BA: Buenos Aires; CH: Chaco; CTES: Corrientes; ER: Entre Ríos; FO: Formosa; JU: Jujuy; MI: Misiones; SA: Salta; S.EST.: Santiago del Estero; TU: Tucumán). Los números entre corchetes corresponden a cada ejemplar depositado (ver Anexo).
| ARGENTINA | |||||||||
| Asignación de estatus | BA | CH | CTES | ER FO JU | MI | SA | S.EST. | TU | TOTAL ARG |
| nnturaíÉaao | 2 | 8 | 1 | 5 1 6 | 1 | 2 | 1 | 2 | 29 |
| [1,2] | [7,8,9,10,11,12,14,17] | [18] | [19,20,21,22,23] [24] [26,27,28,29,30,31] | [32] | [33,34] | [35] | [37,38] | ||
| inniedo | 1 | 2 | |||||||
| [13] | [25] | ||||||||
| cultivado | 5 | 1 | 7 | ||||||
| [3] | [4,5,6,15,16] | [36] | |||||||
| TOTAL provincia | 3 | 14 | 1 | 5 2 6 | 1 | 2 | 1 | 3 | 38 |

Fig. 2. Leucaena leucocephala subsp. glabrata A: espécimen. B: individuo cultivado. C: población invasora debajo de la copa de individuo cultivado. C-H: poblaciones invasoras en diferentes ambientes naturales y periurbanos en la provincia de Chaco, Argentina. A-F: poblaciones de J.J.Castelli; G-H: de Resistencia.

Fig. 3. Leucaena leucocephala subsp. glabrata. A-H: poblaciones invasoras en San Miguel de Tucumán, Tucumán. A-C: bosquecillo con alta densidad poblacional; obsérvese la transformación del microambiente. D-E: montículos de ramas secas fructificadas producto de la poda, fuente importante de dispersión. D-G: importante banco de semillas debajo de árboles cultivados. G: plántulas debajo de los progenitores. H: renovales creciendo a lo largo de cursos de agua en alcantarillado urbano (visibles a través de la rejilla). I: individuo asilvestrado en Paraná, Entre Ríos; obsérvese la madurez reproductiva aun a baja estatura (1,50 m).
Los frutos aún verdes y las semillas fueron observados ser picoteados y consumidos por aves, tanto directamente en las ramas como en el suelo (Fig. 4E) tratándose de un mecanismo de depredación de semillas. Dicho comportamiento se observó en una localidad ribereña del Chaco y en la ciudad de Paraná, Entre Ríos. En Tucumán, se documentó el transporte de semillas y flores por hormigas del género Acromyrmex, que se observaron en abundancia en los senderos y orificios de hormigueros (Fig. 4F-G). Los nidos de estas hormigas son microhábitats fértiles, donde las semillas podrían germinar. También es posible que las semillas sólo sean almacenadas y utilizadas como alimento por la micobiota asociada a las hormigas.

Fig. 4. Leucaena leucocephala subsp. glabrata. A: aspecto general de la inflorescencia. B, D: granos de polen (señalados con flechas) recolectados por abejas nativas junto al polen de otras especies (observados al microscopio óptico). C: frutos maduros. E: frutos picoteados por aves para extraer semillas aún inmaduras. F-G: semillas y flores dispersadas por hormigas. Escalas= B, D: 30 pm.
Discusión y Conclusiones
La consulta de ejemplares de herbario atestigua que la especie ya estaba presente como árbol cultivado en la Argentina desde fines del siglo XIX (LPS 23770). Burkart (1952) señaló su presencia como cultivada en jardines de Salta, Tucumán, La Rioja, Chaco y Misiones. Asimismo, se han observado ejemplares cultivados como ornamentales que ratifican su presencia en el norte de Argentina desde comienzos del siglo XX: en San Miguel de Tucumán (Tucumán) desde 1917 (Lillo 18815, SI) y en Colonia Benítez (Chaco) desde 1933 (A. G. Schulz, SI 217600). Estos ejemplares fueron cultivados para sombra y adorno en calles, plazas, parques y jardines principalmente en regiones subtropicales de Argentina.
El primer registro argentino que se puede interpretar como naturalizado corresponde al ejemplar Venturi 778 (US) en la orilla del Río Salí (Tucumán) en 1921. Ya en 1934 el registro Meyer 943 (SI) muestra ciertas dudas sobre su estatus de naturalización en Formosa, y lo mismo sucede en los años 1979 y 1981 en Corrientes y Entre Ríos (Vanni 33, SI y Muñoz 1734, SI). Estas tres colecciones argentinas fueron reportadas como de naturalización dudosa (Ulibarri, 2004) y aquí son reinterpretadas como naturalizadas, debido a las observaciones de las etiquetas de herbario y al comportamiento invasivo de la especie en ambientes cálidos y húmedos. Los ejemplares de 1979 y 1981 estaban presentes a lo largo de las márgenes del río Paraná en Argentina y parece que en 1933 esta especie ya estaba presente en las costas del río Paraguay (en Paraguay, como consta en la etiqueta del material A. G. Schulz, SI 217600). Es muy probable que ya estuviera naturalizada en esos años lo que es compatible con el comportamiento invasivo y patrón de dispersión de frutos y semillas observado en la actualidad. Dos registros en una misma localidad (Ulibarri 1842, SI y Mollard et al. 6, SI en Zárate, provincia de Buenos Aires) confirmaron que este taxón se naturalizó en la zona del Delta del río Paraná recién a fines del siglo XX (al igual que el registro de Isla Timoteo Domínguez en Uruguay limitando con Isla Martín García en Argentina, mencionado por Ulibarri et al. [2002] y Ulibarri [2004]). Actualmente, su presencia en márgenes y riberas de arroyos y ríos está bien documentada. En sitios ribereños donde aún no está presente es fácilmente predecible su naturalización desde urbanizaciones cercanas a partir de ejemplares cultivados.
También en la década de 1930, se pudieron constatar los primeros registros de naturalización en dos de los países limítrofes de Argentina. Así, en Brasil, en el estado de Rio Grande do Sul, se la documenta desde 1932 (Machado et al., 2020), y en el estado de Paraná, el registro de herbario G. G. Hatschbach 16004 (NY) la documenta como subespontánea desde 1967. En la Isla de Pascua (Chile), su primer registro data de 1934 (CONAF, 2017), y en el norte desértico de Chile, entre 4 y 12 km al este de la ciudad de Arica, en el Valle de Azapa, las etiquetas de dos registros cultivados (J. Aronson 7773, 7777, MO) comentan que la especie se halla ampliamente naturalizada ya en el año 1989.
Como planta forrajera fue introducida en Argentina a finales de la década de 1960 a partir de semillas traídas de Australia y cultivadas en Paraguay y norte de Argentina para la alimentación del ganado (Cook et al., 2014; Radrizzani, 2019a; b) donde alcanzó gran difusión. Sin embargo, su éxito como excelente forrajera decayó cuando el ganado comenzó a presentar síntomas de pérdida de peso, caída del pelaje, entre otros, siendo su uso casi abandonado por los ganaderos (Radrizzani, 2019b). El cultivo no fue muy próspero durante los primeros 50 años desde su introducción (Radrizzani, 2019b). Sin embargo, desde el 2001 se promocionó en el Chaco paraguayo (y desde el 2010 en Argentina) la inoculación con la bacteria ruminal Synergistes jonesii que degrada la mimosina, el alcaloide que genera tales efectos indeseables en el ganado (Radrizzani & Nasca, 2014; Glatzle et al., 2019; Radrizzani, 2019b). Este nuevo paquete tecnológico, traído también de Australia, inició un nuevo auge del uso de L. leucocephala como forrajera.
En base a la información recopilada a partir del material depositado en herbarios y a las observaciones de campo se sugiere que la primera introducción en ambientes naturales de la Argentina fue a partir de individuos ornamentales (arbolado urbano) y la segunda debido a su uso agrosilvopastoril (alimentación del ganado y abono verde) (Cook et al., 2014; Radrizzani, 2019a; b). En el primer caso, su cultivo como árbol ornamental y de sombra en jardines, veredas, plazas urbanas, bordes de caminos, entre otros, es reportado para la subespecie glabrata debido a su hábito arbóreo y por lo tanto más apropiado en forestaciones urbanas que la subespecie leucocephala, además de poseer un mayor número de flores, frutos y follaje. El carácter invasor se constata al observar poblaciones densas con marcado crecimiento en baldíos, barrancas con cursos de agua, bordes de caminos y basurales, debido principalmente al descarte de las podas y residuos de frutos y semillas ya que se producen en abundancia prácticamente todo el año. La alta viabilidad de los bancos de semillas (15 a 20 años según Rentería Bustamante et al., 2007 y Global Invasive Species Database, 2015) es otro factor que incide en el exitoso establecimiento de sus poblaciones. En la región chaqueña, la presencia de individuos reproductivos establecidos a más de 100 m de sus progenitores, cultivados hace poco más de 15 años, sugiere el carácter de especie invasora, sensu Richardson et al. (2000) y Pysek et al. (2004). Este hecho también lo atestigua Marín Ojeda (2016) para Paraguay, donde se detectó el avance de individuos invasores unos 500 m en 25 años. Cabe destacar que los frutos y/o semillas de las especies leñosas climáxicas de los bosques secos estacionales neotropicales y el bosque chaqueño también son dispersados por el viento (Pennington et al., 2000). Esto podría tener implicancias en favorecer la invasión de L. leucocephala en estos ambientes nativos, por la semejanza de sus mecanismos de dispersión.
En el segundo caso, a partir de su cultivo como forraje y/o abono verde en sistemas agrosilvopastoriles, se puede generar el escape hacia ambientes nativos lindantes que, a través de corredores o de manera in situ, originan nuevas poblaciones invasoras como lo confirman los registros Vanni 33 (SI) y A. Schinini 26303 (MO) en los años 1979 y 1988, respectivamente.
En pocos casos la causa de introducción fue por otras razones, como la producción de semillas para artesanías (región del Chaco en Argentina), también documentado para Paraguay por Marín Ojeda (2016). En la Argentina, no se ha reportado aún la introducción de la especie para consumo de sus vainas inmaduras, como sucede en México (Zárate Pedroche, 1994; Hughes, 1998).
Las observaciones de visitas de abejas en las flores, la dispersión de semillas por hormigas y la depredación de semillas verdes por aves también se observó en Paraguay (Marín Ojeda, 2016). Además, granos de polen de esta especie fueron hallados en las reservas alimentarias de abejas nativas de la tribu Meliponini en el Chaco (tipo polínico M, ver en Vossler [2019] y Figs. 4B, D). Estas interacciones bióticas dan cuenta de que la especie ya forma parte de la red trófica de los ecosistemas argentinos, lo que debería ser tenido en cuenta al momento de realizar medidas para su control.
Posiblemente en décadas futuras este taxón estará presente en la mayoría de los ambientes ribereños, así como en otros principalmente antrópicos (como baldíos y zanjas en los alrededores de las ciudades) y será un elemento común de la flora del norte de Argentina, similar a lo que sucedió en las Filipinas, las islas Galápagos y la isla de Pascua (Merrill, 1912; Hughes, 1998; Rentería Bustamante et al., 2007; CONAF, 2017). Muchas áreas naturales protegidas de la Argentina son atravesadas por ríos y otros cuerpos de agua, los que favorecen la dispersión de esta especie como el recientemente fundado Parque Nacional El Impenetrable (Chaco). Su propagación incentivada con fines forrajeros puede llegar a escalas aún más importantes, ya que el norte de Argentina y otras áreas cálidas del Cono Sur son regiones con larga historia de cultura ganadera (Bilbao, 1967). La falta de conocimiento y concientización del efecto sobre la flora nativa de una especie arbórea con elevado carácter invasor es evidente, y es necesario tomar medidas urgentes si se desea conservar la flora nativa. Por lo tanto, se puede decir que debería ser necesario evitar más introducciones y comenzar los esfuerzos para manejar estas poblaciones. Para evitar más cultivos, eliminar individuos cultivados y naturalizados, es necesaria la concientización de toda la comunidad (Schreck Reis et al., 2013; Davis et al., 2018), incluyendo tanto a la sociedad rural como urbana, universidades, viveristas, guardaparques, agrónomos, científicos, gobiernos, entre otros.
Contribución de los Autores
FGV coleccionó el material de campo, realizó las observaciones a campo y consulta de herbarios virtuales. GD consultó los herbarios SI y LP. Ambos autores realizaron la investigación y redacción del manuscrito.
Agradecimientos
Los autores agradecen al personal de los herbarios SI y LP por permitir la revisión del material depositado. Al herbario LP por gestionar el montaje de los especímenes recolectados. A E. Burghardt, A. Vossler y L. Gómez por su colaboración al recolectar el material durante los viajes de campo en Chaco.
Bibliografía
AGUIRRE, S. & G. A. GALVÁN. 2012. Instalación de sistemas de silvopastoreo con productores ganaderos de Colonia Gestido (Uruguay). Agroecología 7: 111-121.
BELLARD, C., P. CASSEY & T. M. BLACKBURN. 2016. Alien species as a driver of recent extinctions. Biol. Lett. 12: 20150623. http://dx.doi.org/10.1098/rsbl.2015.0623 BILBAO, S. A. 1967. Poblamiento y actividad humana en el extremo norte del Chaco santiagueño. Cuad. Inst. Nac. Antropol. 5: 143-206.
BURKART, A. 1952. Las Leguminosas argentinas silvestres y cultivadas. Acme, Buenos Aires. CARRANZA, A. V, L. H. ARMELLA & Á. E. ZENÓN. 2020. Fabaceae del distrito inferior de las Yungas (Selva Pedemontana) de la provincia de Jujuy (Argentina). Bol. Soc. Argent. Bot. 55: 587-604. https://doi.org/10.31055/1851.2372.v55.n4.27705 CASTRO-DÍEZ, P., A. S. VAZ, J. S. SILVA, M. VAN LOO, Á. ALONSO, C. APONTE, Á. BAYÓN, P. J. BELLINGHAM, M. C. CHIUFFO, N. DIMANNO, K. JULIAN, S. KANDERT, N. LA PORTA, H. MARCHANTE, H. G. MAULE, M. M. MAYFIELD, D. METCALFE, M. C. MONTEVERDI, M. A. NÚÑEZ, R. OSTERTAG, I. M. PARKER, D. A. PELTZER, L. J. POTGIETER, M. RAYMUNDO, D. RAYOME, O. REISMAN-BERMAN, D. M. RICHARDSON, R. E. ROOS, A. SALDAÑA, R. T. SHACKLETON, A. TORRES, M. TRUDGEN, J. URBAN, J. R. VICENTE, M. VILÁ, T. YLIOJA,
R. D. ZENNI & O. GODOY. 2019. Global effects of non-native tree species on multiple ecosystem services. Biol. Rev. 94: 1477-1501. https://doi.org/10.1111/brv.12511
CHARÁ, J., J. RIVERA, R. BARAHONA, E. MURGUEITIO, Z. CALLE & C. GIRALDO. 2019. Intensive silvopastoral systems with Leucaena leucocephala in Latin America. Trop. Grasslands -Forrajes Trop. 7: 259-266. https://doi.org/10.17138/tgft(7)259-266
CONAF. 2017. Elaboración del Plan de Manejo del Parque Nacional Rapa Nui. Corporación Nacional Forestal. COOK, S, J. M. PECCI, M. FERNÁNDEZ & C. PECCI. 2014. Experiencias con Leucaena leucocephala en el Nordeste de Formosa. Argentina [online]. Disponible en: http://www.veterinariargentina.com/ revista/wp284/wp-content/uploads/LEUCAENA-en-FORMOSA-ARGENTINA.pdf COSTA, J. T., I. C. B. FONSECA & E. BIANCHINI. 2015. Population structure of the invasive species Leucaena leucocephala (Fabaceae) in a seasonal semi-deciduous forest, southern Brazil. Austral. J. Bot. 63: 590-596. https://doi.org/10.1071/BT14308 DANA, E., R. P. RANDALL, M. SANZ-ELORZA & E. SOBRINO. 2003. First evidences of the invasive behaviour of Leucaena leucocephala in Europe. Oryx 37: 14.
DAVIS, E., J. M. CAFFREY, N. E. COUGHLAN, J. T. A. DICK & E. L. FRANCES. 2018. Communications, outreach and citizen science: spreading the word about invasive alien species. Managem. Biol. Invas. 9: 515-525. https://doi.org/10.3391/mbi.2018.9.4.14 DELUCCHI, G., F. BUET COSTANTINO & E. L. GUERRERO. 2011. Leguminosas adventicias de la República Argentina. Una categorización. Hist. Nat. (Tercera Serie) 1: 75-84.
DÍAZ, S., J. SETTELE, E. S. BRONDÍZIO, H. T. NGO, J. AGARD, A. ARNETH, P. BALVANERA, K. A. BRAUMAN, S. H. M. BUTCHART, K. M. A. CHAN, L. A. GARIBALDI, K. ICHII, J. LIU, S. M. SUBRAMANIAN, G. F. MIDGLEY, P. MILOSLAVICH, Z. MOLNÁR, D. OBURA, A. PFAFF, S. POLASKY, A. PURVIS, J. RAZZAQUE, B. REYERS, R. R. CHOWDHURY, Y.-J. SHIN, I. VISSEREN-HAMAKERS, K. J. WILLIS & C. N. ZAYAS. 2019. Pervasive human-driven decline of life on Earth points to the need for transformative change. Science 366: 1-10. https://doi.org/10.1126/science.aax3100
DOCUMENTA FLORAE AUSTRALIS DATABASE. 2021. [online]. Disponible en: http://www.darwin. edu.ar/iris [última consulta abril 2021]. EURO+MED. 2006. Euro+Med PlantBase - the information resource for Euro-Mediterranean plant diversity [online]. Disponible en: http://ww2.bgbm. org/EuroPlusMed/PTaxonDetail.asp?NameId=481 56&PTRefFk=8500000 [consulta diciembre 2020].
FABRICANTE, J. 2014. Plantas exóticas e exóticas invasoras da Caatinga, Vol. 4. Bookess, Florianópolis.
FORZZA, R. C., et al. 2010. Catálogo de plantas e fungos do Brasil, Vol. 2. Instituto de Pesquisas Jardim Botánico do Rio de Janeiro, Andrea Jakobsson Estúdio, Rio de Janeiro.
GÁNDARA, F. R., M. C. GOLDFARB, A. A. ARIAS & W. M. RAMIREZ. 1986. Leucaena leucocephala (Lam.) de Wit como banco de proteína invernal de un campo natural de la provincia de Corrientes. Revista Argent. Prod. Anim. 6: 562-572. GÁNDARA, L., M. M. PEREIRA & M. STUP. 2019. A preliminary study of spatial distribution and plant density in a leucaena-grass planting in north Corrientes, Argentina. Trop. Grasslands - Forrajes Trop. 7: 143-145. https://doi.org/10.17138/tgft(7)143-145 GBIF: THE GLOBAL BIODIVERSIT Y INFORMATION FACILITY. 2020. ¿Qué es GBIF? [online]. Disponible en: https://www.gbif.org/what-is-gbif [última consulta diciembre 2020].
GERBER, E., C. KREBS, C. MURRELL, M. MORETTI, R. ROCKLIN & U. SCHAFFNER. 2008. Exotic invasive knotweeds (Fallopia spp.) negatively affect native plant and invertebrate assemblages in European riparian habitats. Biol. Conservation 141: 646-654. https://doi.org/10.1016/j.biocon.2007.12.009
GLATZLE, A. F., A. N. CABRERA, A. NAEGELE & N. KLASSEN. 2019. Leucaena feeding systems in Paraguay. Trop. Grasslands - Forrajes Trop. 7: 397-402. https://doi.org/10.17138/tgft(7)397-402
GLOBAL INVASIVE SPECIES DATABASE (GISD). 2015. Species pro file Leucaena leucocephala [online]. Disponible en: http://www.iucngisd.org/ gisd/species.php?sc=23 [consulta junio 2020] GOLDFARB, M. C., J. F. CASCO & F. R. GÁNDARA. 1993. Introducción de especies y cultivares forrajeras para el noroeste de la Provincia de Corrientes, período 1978-1990. Producción Animal, Serie Técnica N° 6. INTA Corrientes, Argentina. GOLDFARB, M. C., L. I. GIMÉNEZ, J. F. CASCO & F. NÚNEZ. 2005. Utilización de Leucaena leucocephala cv. Cunningham. Avances de la producción vegetal y animal en el NOA 2003-2005, Tucumán, Argentina.
HOFMAN, C. A. & T. C. RICK. 2018. Ancient biological invasions and island ecosystems: Tracking translocations of wild plants and animals. J. Archaeol. Res. 26: 65-115. https://doi.org/10.1007/s10814-017-9105-3
HUGHES, C. 1997. Species delimitation, and new taxa and combinations in Leucaena (Leguminosae). Contr. Univ. Michigan Herb. 21: 277-290.
HUGHES, C. 1998. Monograph of Leucaena (Leguminoae-Mimosoideae). Syst. Bot. Monogr. 55: 1-244.
J0RGENSEN, P. M., M. H. NEE & S. G. BECK (eds.). 2014. Catálogo de las Plantas Vasculares de Bolivia. Monogr. Syst. Bot. Missouri Bot. Gard. 127: i-viii, 1-1744. St. Louis: Missouri Botanical Garden Press.
LACORTE, S. M., P. E. MARTINEZ & F. L. FERNÁNDEZ. 1987. Uso de leucaena como banco de proteínas en Misiones. Nota Técnica 38. Estación Experimental Agropecuaria INTA, Cerro Azul, Misiones, Argentina.
LOWE, S., M. BROWNE, S. BOUDJELAS & M. DE POORTER. 2000. 100 of the World's worst invasive alien species. A selection from the Global Invasive Species Database. The Invasive Species Specialist Group (ISSG) a specialist group of the Species Survival Commission (SSC) of the World Conservation Union (IUCN).
MACHADO, M. T. S., J. A. DRUMMOND & C. G. BARRETO. 2020. Leucaena leucocephala (Lam.) de Wit in Brazil: history of an invasive plant. Estud. Ibero-Amer. 46: 1-20, e-33976. https://doi.Org/10.15448/1980-864X.2020.1.33976
MARÍN OJEDA, G. E. C. 2016. Leucaena leucocephala (Lam.) de Wit. Nuevo género y nueva especie adventicia naturalizada en Paraguay. Revista Soc. Ci. Paraguay 21: 73-84.
MERRILL, E. D. 1912. Notes on the flora of Manila with special reference to the introduced element. Philipp. J. Sci., C. 7: 145-208.
MOONEY, H. A. & J. A. DRAKE. 1986. Ecology of biological invasions of North America and Hawaii. Springer-Verlag, New York. https://doi.org/10.1007/978-1-4612-4988-7
OLCKERS, T. 2004. Targeting emerging weeds for biological control in South Africa: the benefits of halting the spread of alien plants at an early stage of their invasion. S. African J. Sci. 100: 64-68.
OLCKERS, T. 2011. Biological control of Leucaena leucocephala (Lam.) de Wit (Fabaceae) in South Africa: A tale of opportunism, seed feeders and unanswered questions. African Entomol. 19: 356-365. https://doi.org/10.4001/003.019.0219
OLDEN, J. D., J. L. LOCKWOOD & C. L. PARR. 2011. Biological invasions and the homogenization of faunas and floras. In: LADLE R. J. & R. J. WHITTAKER (eds.), Conservation Biogeography, 1a edición, pp. 224-243. Blackwell Publishing Ltd., UK. https://doi. org/10.1002/9781444390001.ch9
PENNINGTON, R. T., D. E. PRADO & C. A. PENDRY. 2000. Neotropical seasonally dry forests and Quaternary vegetation changes. J. Biogeogr. 27: 261-273. https://doi.org/10.1046/j.1365-2699.2000.00397.x PIER (PACIFIC ISLAND ECOSYSTEMS AT RISK). 2006. Leucaena (Lam.) de Wit, Fabaceae [online]. Disponible en: http://www.hear.org/pier/species/ leucaena_leucocephala.htm
PYSEK, P., D. M. RICHARDSON, M. REJMÁNEK, G. WEBSTER, M. WILLIAMSON & J. KIRSCHNER. 2004. Alien plants in checklists and floras: towards better communication between taxonomists and ecologists. Taxon 53: 131-143. https://doi.org/10.2307/4135498
RADRIZZANI, A. & J. A. NASCA. 2014. The effect of Leucaena leucocephala on beef production and its toxicity in the Chaco Region of Argentina. Trop. Grasslands - Forrajes Trop. 2: 127-129. https://doi.org/10.17138/tgft(2)127-129
RADRIZZANI, A., A. PACHAS, L. GÁNDARA, C. GOLDFARB, A. PERTICARI, S. LACORTE & D. PUEYO. 2019a. Leucaena feeding systems in Argentina. I. Five decades of research and limitations for adoption. Trop. Grasslands - Forrajes Trop. 7: 381-388. https://doi.org/10.17138/tgft(7)381-388 RADRIZZANI, A., A. PACHAS, L. GÁNDARA, F. NENNING & D. PUEYO. 2019b. Leucaena feeding systems in Argentina. II. Current uses and future research priorities. Trop. Grasslands - Forrajes Trop. 7: 389-396. https://doi.org/10.17138/tgft(7)389-396
REJMÁNEK, M. 2000. Invasive plants: approaches and predictions. AustralEcol. 25: 497-506. https://doi.org/10.1046/j.1442-9993.2000.01080.x RENTERÍA BUSTAMANTE, J. L., R. ATKINSON & C. BUDDENHAGEN. 2007. Estrategias para la erradicación de 21 especies de plantaspotencialmente invasoras en Galápagos. Fundacion Charles Darwin. https://doi.org/10.13140/24.1846.2727 RICHARDSON, D. M., P. PYSEK, M. REJMÁNEK, M. G. BARBOUR, F. D. PANETTA & C. J. WEST. 2000. Naturalization and invasion of alien plants: concepts and definitions. Diversity & Distrib. 6: 93-107. https://doi.org/10.1046/j.1472-4642.2000.00083.x
RICHARDSON, D. M., P. PYSEK & J. T. CARLTON. 2011. A compendium of essential concepts and terminology in invasion ecology. In: RICHARDSON D. M. (ed.), Fifty Years of Invasion Ecology: The Legacy of Charles Elton, pp. 409-420. Blackwell Publishing Ltd., Chichester. https://doi.org/10.1002/9781444329988.ch30
RODRÍGUEZ, R., C. MARTICORENA, D. ALARCÓN, C. BAEZA, L. CAVIERES, V. L. FINOT, N. FUENTES, A. KIESSLING, M. MIHOC, A. PAUCHARD, E. RUIZ, P. SANCHEZ & A. MARTICORENA. 2018. Catálogo de las plantas vasculares de Chile. Gayana, Bot. 75: 1-430. http://dx.doi.org/10.4067/S0717-66432018000100001 ROIG, C. A. 1992. Efecto de la Leucaena leucocephala (Lam.) de Wit. combinada con pasto Pangola y pasturas naturales en la producción de carne. Estación Experimental Agropecuaria INTA, El Colorado, Formosa, Argentina.
SALA, O. E., F. STUART CHAPIN III, J. J. ARMESTO, E. BERLOW, J. BLOOMFIELD, R. DIRZO, E. HUBER-SANWALD, L. F. HUENNEKE, R. B. JACKSON, A. KINZIG, R. LEEMANS, D. M. LODGE, H. A. MOONEY, M. OESTERHELD, N. LEROY POFF, M. T. SYKES, B. H. WALKER, M. WALKER & D. H. WALL. 2000. Global biodiversity scenarios for the year 2100. Science 287: 1770-1774. https://doi.org/10.1126/science.287.5459.1770
SALDIAS PAZ, M. 1993. Mimosoideae. En: Killeen,
T. J., E. García Estigarribia & S. G. Beck (eds.), Guía de Árboles de Bolivia, pp. 420-456. Herbario Nacional de Bolivia & Missouri Botanical Garden, Edit. Quipus srl., La Paz.
SANZ-ELORZA, M., E. D. DANA SÁNCHEZ & E. SOBRINO VESPERINAS (eds.). 2004. Atlas de las Plantas Alóctonas Invasoras en España. Dirección General para la Biodiversidad, Madrid.
SÁNCHEZ GULLÓN, E., F. VERLOOVE & V. SILVA. 2017. New records of interesting xenophytes in the Iberian Península. VII. Folia Bot. Extremadurensis 11: 39-50.
SCHRECK REIS, C., H. MARCHANTE, H. FREITAS & E. MARCHANTE. 2013. Public perception of invasive plant species: assessing the impact of workshop activities to promote young students' awareness. Int. J. Sci. Educ. 35: 690-712. https://doi.org/10.1080/09500693.2011.610379 THIERS, B. [permanentemente actualizado, consulta 2014]. Index Herbariorum: a global directory of public herbaria and associated staff. New York Botanical Garden's Virtual Herbarium. http:// sweetgum.nybg.org/ih
TROPICOS.ORG. MISSOURI BOTANICAL GARDEN. 2020. [online]. Disponible en: http://www.tropicos. org [consulta noviembre 2020]
ULIBARRI, E. A. 2004. Leucaena leucocephala (Leguminosae-Mimosoideae) adventicia en Argentina. Hickenia 3: 221-224.
ULIBARRI, E. A., E. V. GÓMEZ-SOSA, A. M. CIALDELLA, R. H. FORTUNATO & D. BAZZANO. 2002. Leguminosas nativas y exóticas. En: Hurrell J. A. & H. B. Lahitte (eds.), Biota Rioplatense VII. LOLA, Buenos Aires. VALINOTTI, P. & R. HEYN. 1991. Adaptación y producción de forraje de ecotipos de Leucaena en Barrerito, Paraguay. Pasturas Trop. 13: 41-43. VATTAKAVEN, T., R. GEORGE, D. BALASUBRAMANIAN, M. RÉJOU-MÉCHAIN, G. MUTHUSANKAR, B. RAMESH & R. PRABHAKAR. 2016. India Biodiversity Portal: An integrated, interactive and participatory biodiversity informatics platform. Biodivers. Data J. 4: e10279. [online]. Disponible en: https://doi.org/10.3897/ BDJ.4.e10279 [consulta diciembre 2020]
VOSSLER, F. G. 2019. Native and ornamental exotic resources in pollen loads and garbage pellets of four stingless bees (Apidae, Meliponini) in an urban environment with riparian native forest. Anais Acad. Brasil. Ci. 91: e20190360. https://doi.org/10.1590/0001-3765201920190360
WEBER, E., S.-G. SUN & B. LI. 2008. Invasive alien plants in China: diversity and ecological insights. Biol. Invas. 10: 1411-1429. https://doi.org/10.1007/s10530-008-9216-3 WELLS, M. J., R. J. POYNTON, A. A. BALSINHAS, C. F. MUSIL, H. JOFFE, E. VAN HOEPEN & S. K. ABBOTT. 1986. The history of introduction of invasive alien plants to southern Africa. En: MAC DONALD I. A. W., F. J. KRUGER & A. A. FERRAR (eds.), The Ecology and Management of Biological Invasions in Southern Africa, pp. 21-35. Oxford University Press, Cape Town.
WESTERN AUSTRALIAN HERBARIUM. 1998. FloraBase-the Western Australian Flora. Department of Biodiversity, Conservation and Attractions [online]. Disponible en: https://florabase. dpaw.wa.gov.au/ [consulta diciembre 2020] ZÁRATE PEDROCHE, S. 1994. Revisión del género Leucaena Benth. en México. Anales Inst. Biol. Univ. Nac. Auton. Mexico, Bot. 65: 83-162.
ZULOAGA, F. O., O. MORRONE & M. BELGRANO. 2008. Catálogo de las plantas vasculares del Cono Sur (Argentina, sur de Brasil, Chile, Paraguay y Uruguay). Monographs in Systematic Botany from the Missouri Botanical Garden Press., St. Louis, USA. ZULOAGA, F. O., M. J. BELGRANO & C. A. ZANOTTI. 2019. An update of the catalogue of the vascular plants of the Southern Cone. Darwiniana, N. S. 7: 208-278. https://doi.org/10.14522/darwiniana.2019.72.861
anexo
Material examinado (los números entre corchetes al final de cada ejemplar examinado están referenciados en la Tabla 1 y Fig. 1):
ARGENTINA. Prov. Buenos Aires: Pdo. Zárate, Zárate, Paseo de la Cruz, "barrancas, escapado de cultivo, flor blanquecina y con frutos, arbolito de 1 m altura", 06/XI/2002, Ulibarri 1842 (SI) [1]. Zárate, Parque de la Cruz, "escapado de cultivo en la Barranca del Paraná", 25/XI/2002, Mollard et al. 6 (SI) [2]. Pdo. La Plata, La Plata, "culta", IX/1898 (LPS 23770) [3]. Prov. Chaco: Dpto. Comandante Fernández, Presidencia Roque Sáenz Peña, "EEA Sáenz Peña", 19/XII/1983, A. O. Bordón (CTES 408777) [4], "EEA Sáenz Peña", 18/III/1981, F. Gilbert (CTES 408784) [5]. Dpto. General Güemes, Juan José Castelli, "cultivada, flores blancas", 01/IX/2004, F G. Vossler 313 (LP) [6], "individuos naturalizados en borde zanja en cruce de Ruta 9 y Av. San Martín (ingreso a la ciudad), cerca de individuos cultivados en la Virgen del Valle", 21/X/2019, F G. Vossler 414 (LP) [7], "población invasora en terreno baldío centro de la ciudad (sobre calle Mariano Moreno entre calles Salta y Rivadavia)", 22/X/2019, F. G. Vossler 412 (LP) [8], "población invasora en bordes de camino de tierra y en terrenos baldíos, cerca de árboles cultivados", 22/X/2019, F G. Vossler 413 (LP) [9], "individuos arborescentes de 5 m creciendo sobre tumbas en ruinas en Cementerio J.J. Castelli, espontáneo", 17/XII/2021, F G. Vossler 644 (CTES) [10]. Villa Río Bermejito, "espontánea en el patio de una casa, debajo de árbol cultivado. Semillas de frutos verdes y maduros picoteados por aves", 08/IX/2018, F. G. Vossler 411 (LP) [11], "renovales entre 1 y 2 m fructificados, invasores, creciendo en las barrancas y costa del río Bermejito", 16/XII/2021, F G. Vossler 633 (CTES) [12]. Dpto. Libertador General San Martín, Gral. José de San Martín, 27/VIII/2004, C. R. Salgado 289 (CTES) [13]. Ea. La Leonor, Costa inundable del río Bermejo, "Arbolito 2-3 m alt.; flores blancas", 25-26/ V/1988, A. Schinini 26303 (MO) [14]. Dpto. 1° de Mayo, Colonia Benítez, "Árbol aquí cultivado, procede del Paraguay, orilla río Paraguay, frente a Formosa", II/1933 y IV/1933, A. G. Schulz (SI 217600) [15]. Dpto. Mayor Luis Jorge Fontana, Enrique Urién, "Cultivado, procede de México. Lo trajo Carlos Schulz, allí es silvestre. Arbolito, 3-4 m alt", 31/VII/1974, A. G. Schulz 18794 (F) [16]. Dpto. San Fernando, Resistencia, "Población invasora en banquinas sobre Ruta Nacional 11 y en zanjas aledañas que se conectan con el Río Negro, observable desde el puente del Río Negro y Ruta Nacional 11", 23/X/2019, F. G. Vossler 408 (LP) [17]. Prov. Corrientes: Dpto. San Cosme, Arroyo San Juan y Río Paraná, "Árbol de 5 m de altura. Flores blancas", 4/IV/1979, Vanni 33 (SI) [18]. Prov. Entre Ríos: Dpto. La Paz, La Paz, "Costa del río", 25/VII/1981, Muñóz 1734 (SI) [19]. Dpto. Paraná, Paraná, "Arbusto sobre boulevard calle Antonio Crespo casi Av. Francisco Ramírez, individuo naturalizado de 1,5 m florecido y fructificado", 01/XII/2019, F. G. Vossler 432 (LP) [20], "porte arbóreo, invasor barrancas de Arroyo La Santiagueña, formando densas poblaciones", 28/III/2022, F. G. Vossler 677 (CTES) [21], "individuo 4 m, florecido y fructificado, creciendo espontáneamente en cantero junto a un árbol cultivado de "fresno" del arbolado urbano de la ciudad", 28/III/2022, F. G. Vossler 678 (CTES) [22], "individuo asilvestrado porte arbóreo 4 m, florecido, en la costa del río Paraná junto a vegetación ribereña, camino de la Costanera", 28/III/2022, F. G. Vossler 679 (CTES) [23]. Prov. Formosa: Dpto. Capital, Formosa, "se lo cultiva en plazas y paseos ¿silvestre?", 23/ VI/1934, Meyer 943 (SI) [24]. Dpto. Patiño, Ea. Canesin-Welsh, por ruta 95 a 7 Km N del cruce de las rutas 95 y 81, "Ruderal. Cultivado", 29/III/1992, Renée H. Fortunato et al. 3310 (BAB, G, MO, SI) [25]. Prov. Jujuy: Dpto. Ledesma, Ledesma, "vías férreas, estación Ledesma, árbol aproximadamente 5 m altura, flores blanquecinas con frutos del año anterior, asilvestrada forma pequeños matorrales", 21/II/2004, Ulibarri 1867 (SI) [26], "Cercanías del barrio San Antonio, al borde de canales de riego en cañaverales. Camino al río Aguas Negras, asilvestrada, flor blanquecina", 24/II/2004, Ulibarri 1887 (SI) [27]. Parque Nacional Calilegua, Yacimiento Caimancito, Este Caimancito, Pozo 40 (23°38'31,4" 64°35'52,8"O, 550 m s. m.), 18/ III/2020, Carranza et al. 4680 (JUA) [28]. Dpto. San Pedro, El Cuarteadero, (24°21'31,6"S, 64°57'49,1"O, 836 m s. m.), 23/X/2017, Carranza 4678 (JUA) [29]. Dpto. Santa Bárbara, 20 Km de Caimancito en dirección a Agua Caliente (23°43'60"S 64°33'59"O, 363 m), 27/IX/2015, R. Fortunato et al. 12932 (BAB) [30]. El Piquete, 05/VII/1977, Breglia 148 (JUA) [31]. Prov. Misiones: Dpto. Eldorado, Eldorado, H. A. Keller 5902 (CTES) [32]. Prov. Salta: Dpto. Orán, Cerca de Aguas Blancas, estación de aforo (-22,725493 -64,365178), 31/X/2013, A. A. Cocucci & A. N. Sérsic 5302 (CORD) [33]. Orán, "3,65 Km al W de Orán por camino vecinal en dirección a Santa María" (-23,18333 -64,33333, 490 m), 17/XII/2002, R. Fortunato et al. 7853 (MO) [34]. Prov. Santiago del Estero: Dpto. Capital, Santiago del Estero, borde del camino de la Costanera cerca de Av. Alsina. "Probablemente cultivados, pero con vías de ser adventicios", 01/XII/2003, Ulibarri 1860 (SI) [35]. Prov. Tucumán: Dpto. Capital, San Miguel de Tucumán, 14/IV/1917, Lillo 18815 (SI) [36], Río Salí, "orilla del río, arbusto, 1,50 m, flores blancas", 30/IV/1921, S. Venturi 778 (US) [37], "Población asilvestrada (denso bosquecillo invasor) en los alrededores del CIIDEPT (Av. José Ingenieros 260) cerca de la Terminal de Ómnibus. En cercanía a árboles cultivados", 12/IX/2019, F. G. Vossler 382 (LP) [38].
Material adicional examinado:
BRASIL. Estado de Paraná: Antonina, "Arbusto 1m50, flor creme, terrenos baldios", 17/II/1967, G. G. Hatschbach 16004 (NY). CHILE. Región de Arica y Parinacota: Valle de Azapa, 4-12 Km E of Arica, 18°30'S 70°13'O (-18.5000000, -70.2166667), 125 m s. m., "Arbolito 2-4 m; flowers white. Cultivated in Arica and in the Valle de Azapa. Widely naturalized in the valley. Seed attacked by bruchids", 14/II/1989, J. Aronson 7773 (MO), J. Aronson 7777 (MO).














