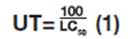Introdugao
A interpretado dos possíveis efeitos deletérios de efluentes sanitários e industriais na biota de ecossistemas estuarinos ainda recorre a indicadores tradicionais, limitando-se geralmente a parámetros microbiológicos e físico químicos.
Os testes ecotoxicológicos avaliam o impacto da contaminado/ poluigao em organismos teste constituindo uma aproximado realista das con-sequéncias da exposigao de seres vivos a contaminantes (Kalloul et al. 2012). A importáncia dos testes ecotoxicológicos tem sido reconhecida pelos órgaos ambientais brasileiros, através da sua insergao nas resolugoes de monitoramento ambiental exigidas pelo órgao federal regulador -Conselho Nacional do Meio Ambiente (CONAMA 2005, 2011,2012).
Assim, a implementagao de uma abordagem ecotoxicológica para analisar a deterioragao da qualidade da água em rios e regiSes costeiras do Brasil é atual e vém sendo incluida em estudos realizados em diferentes ecossistemas aquáticos (Pereira et al. 2015; Pimentel et al. 2016; Cappa-relli et al. 2021). Contudo, em particular na regiao nordeste do Brasil, sao poucos os estudos realizados em áreas estuarinas (Nilin et al. 2013, 2019; Oliveira et al. 2014). A padronizagao das espécies de organismos teste utilizados em ensaios de toxicidade é essencial para, internacionalmente, se compararem resultados. Porém é importante assinalar que o uso de espécies-chave locais, aumenta a representatividade do ecossistema e a extrapolagao dos resultados torna-se mais fiável (Martins e Bianchini 2011).
Os organismos a utilizar em testes de toxicidade devem: (i) ser sensíveis a diversos agentes químicos, (ii) ter um ciclo de vida curto, (iii) ser abundantes e com larga distribuigao geográfica, (iv) ter estabilidade genética, (v) ser representativos de seu nível trófico e (vi) facilmente cultivados em laboratório (Zagatto e Bertoletti 2008). Invertebrados tais como crustáceos e moluscos vém sendo muito usados em testes ecotoxicológicos simples ou envolvendo cadeias alimentares (Dahms et al. 2016). Porém, poucas espécies brasileiras sao utilizadas, sobretudo para avaliar ambientes ma-rinhos e estuarinos (Artal et al. 2019). O crustáceo (Malacostraca) Misydopsis juniae, padronizado pela Associagao Brasileira de Normas Técnicas (ABNT, 2011) para análise de águas salobras/ salinas, tem sido usado com sucesso para testar o efeito de diversos compostos químicos ou misturas complexas (Badaró-Pedroso et al. 2002), incluindo efluentes sanitários e industriais (Nico-demo 2010) e amostras ambientais estuarinas (Nilin et al. 2019).
Em ensaios ecotoxicológicos de ambientes ma-rinhos e estuarinos, também sao usados certos copépodes que atendem as caraterísticas su-pracitadas, além de serem de suma importáncia na cadeia alimentar, ligando os produtores (fito-pláncton) aos altos predadores, como camarSes, peixes e até baleias (Lavorante et al. 2013; Kwok et al. 2015). Diferentes copépodes vém sendo frequentemente utilizados como organismos teste em várias partes do mundo: Acartia tonsa (Kusk e Petersen 1997; Palma Lopes et al. 2018) e Tisbe battagliai (Diz et al. 2009) em diferentes países europeus; Acartia sinjiensis na Austrália (Gissi et al. 2013); Nitocra spinipes na Austrália e alguns países europeus (Simpson e Sapadaro 2011; Koch e Schamphelaere 2021; Moeris et al. 2021); Quinquelaophonte sp. na Nova Zelándia (Charry et al. 2018); Tigriopus japonicus em países orientais (Wong et al. 2020, Yu et al. 2020); Tisbe biminiensis em países da América do Norte e América do Sul (Araújo et al. 2013; Costa et al. 2014; Souza Santos et al. 2015); e Nitoera sp., utilizado principalmente com sedimentos no Brasil (Capparelli et al. 2021; Ferraz et al. 2021, Mendonga et al. 2021). Contudo, ainda nao foi avaliada a utilizagao de Nitoera sp. no monitoramento ecotoxicológico de águas superficiais. Assim, o objetivo deste estudo incidiu na análise e argumentagao do uso de Nitoera sp. como organismo teste na avaliagao ecotoxicológica da qualidade de águas superficiais estuarinas. Nesse sentido os ensaios realizados com Nitoera sp. foram comparados com ensaios realizados com Misydopsis juniae, organismo teste padronizado para este tipo de amostras ambientais (ABNT 2011).
2. Material e métodos
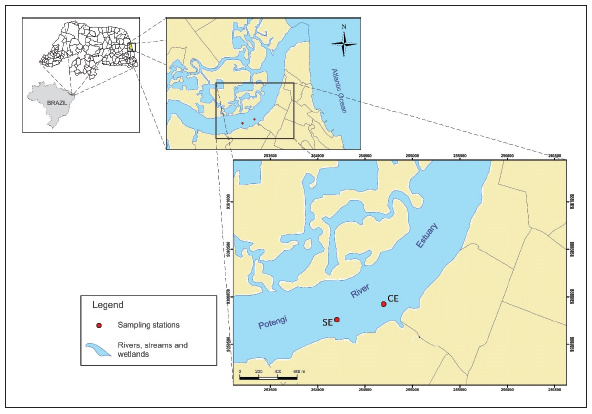
2.1 Área de estudo e amostragem de águas superficiaisAmostras de água superficial do baixo estuário Junadiaí-Potengi (EJP) foram coletadas mensalmente entre junho de 2015 e dezembro de 2016, durante a maré baixa, em dois pontos de amostragem (Figura 1): SE, situado a montante da estagao de tratamento de esgoto (ETE) do Baldo (5o47'21.70"S, 35013,11.18"O) que nao recebe esgoto tratado e CE, nas ime-diagoes da ETE, onde desagua o canal que recebe os efluentes tratados (5°47'20.49"S, 35°12'88.93"O).
Figura 1: Geolocalizagao dos pontos de coleta de água superficial no complexo estuarino Jundiaí-Potengi (EJP), Natal/ RN: SE a montante de uma descarga de efluente tratado e, CE na zona de descarga do referido efluente.
2.2 Ensaios ecotoxicológicos
O microcrustáceo Mysidopsis juniae encontra-se em regioes marinhas costeiras e estuarinas do Brasil (Miyashita e Calliari 2016). De habitat ben-tonico, estes microcrustáceos medem cerca de 4 a 5 mm de comprimento e em laboratorio tem um ciclo de vida de 28 a 30 dias. Testes ecotoxi-cológicos com M. juniae foram realizados seguin-do o protocolo padronizado descrito na norma 15.308/2011 - Toxicidade aguda - Método de ensaio com misidaceos (Crustacea) da Associa-gao Brasileira de Normas Técnicas (ABNT 2011). Em frascos de vidro de 500 mL prepararam-se triplicatas de 400 mL das diferentes concentra-goes da amostra ambiental: 100, 50, 25, 12,5% e controle negativo (0%). A cada frasco previamente preparado adicionaram-se 10 espécimes jovens de M. juniae (de 5 a 7 dias). As amostras de água estuarina foram mantidas nas seguin-tes condigoes experimentais: salinidade - 34 ± 2 %0; temperatura - 25 ± 2 °C; incubagao - 96 h com fotoperíodo 12:12 h luz:escuro. Terminado o ensaio, contabilizaram-se os organismos mortos em cada frasco.
Nitocra sp. é um pequeno copépode (cerca de 1 mm) bentonico estuarino de fácil cultivo em laboratorio com um ciclo de vida de cerca de 20 dias; estes copépodes sobrevivem em' salinidades de 5 a 30 %o (Lotufo e Abessa 2002;Zaroni et al. 2012). Os testes com Nitocra sp. foram realizados seguindo o protocolo descrito por Lotufo e Abessa (2002) para águas intersticial. Em frascos de polietileno com capacidade de 30 mL, colocaram-se em triplicata, 10 mL de cada concentragao da amostra ambiental previamente preparadas (diluigoes de 50, 25, 12,5 e 6,25%, além do controle negativo). Em cada um destes frascos introduziram-se 10 femeas ovadas de Nitoera sp. Todo o sistema experimental (15 frascos) foi incubado a 25 ± 2 °C durante 96 h nas seguintes condipoes: salinidade - 17 ± 2 %0; fotoperíodo - 12:12h luz:escuro. A manutenpao da salinidade das amostras foi ajustada por adipao de salmoura ou de água destilada.
No final dos ensaios com Nitoera sp., as femeas vivas foram contabilizadas para determinar o efeito letal. Os náuplios que eclodiram em cada réplica foram fixados pela adipao, a cada frasco, de for-maldeído (10%) e corante rosa-bengala (0,1%), sendo a contagem feita ao estereomicroscópio (Coleman, modelo XTB-2B) para determinapao da taxa de reprodupao (n° de náuplios por femea). A salinidade, pH e oxgenio dissolvido (OD) foram parámetros determinados no inicio dos bioen-saios nas diferentes concentrapoes. A toxicidade aguda expressa-se como sendo a concentrapao da amostra na qual a mortalidade dos organismos presentes é de 50% (CL50-96h). Os dados expressos em CL50-96h foram transformados em Unidades Tóxicas - UT (equapao 1) de acordo com Bertolleti e Zagatto (2006).
O efeito subletal das amostras ambientais na re-produpao de Nitoera sp. é expresso pela maior concentrapao na qual nao se observa efeito (No Observed Effeet Coneentration - NOEC) e pela menor concentrapao na qual se observa efeito (Lowest Observed Effeet Coneentration - LOEC). A água do mar utilizada para cultivo e bioensaios foi coletada na praia da Via Costeira (alto mar; ±3 km; ± 35 %o), na cidade de Natal/RN, filtrada em sistema de carvao ativado e esterilizada por radiapao ultravioleta (UV). A água assim tratada foi armazenada em barriletes de PVC (policloreto de vinila), com capacidade de 20 e 40 L, previamente higienizados e sob aerapao.
O controle de qualidade dos ensaios e a viabi-lidade dos organismos teste foram avaliados mensalmente através de bioensaios utilizando como substáncias de referencia, dicromato de potássio (K,Cr2O7) para Nitoera sp. e sulfato de zinco heptahidratado (ZnSO4.7H2O) para M. ju-niae, seguindo as recomendapoes da normativa 15.308 (ABNT 2011) e do protocolo descrito por Lotufo e Abessa (2002).
2.3 Análises físico-químicas e microbiológicas
Diferentes parámetros físico-químicos para ca-racterizapao das amostras de água coletadas no EJP foram determinados de acordo com Standard Methods for the Examination of Water and Wastewater (APHA 2012). O pH das amostras de água foi determinado com um potenciómetro (modelo pH-Tec) e a salinidade (Sal, %o) com um refratómetro (Vodex, vx100sg). O oxigenio dissolvido (OD, mg L-1) foi medido com um oxímetro digital portátil (instrutherm MO-900), e os valores determinados foram confirmados por titulapao, sempre que possivel. A quantificapao (mg L-1) de Óleos e graxas (OG), sólidos suspensos (SS) e sólidos totais (ST) foi feita por gravimetria. Os sólidos sedimentáveis (SSe) foram determinados por sedimentapao no cone Imhoff.
Após submeter as amostras a respectivamente, (i) um reagente combinado (ácido ascórbico, molibdato de amónio e o antimónio tartarato de potássio), (ii) corante azo púrpura averme-lhado, e (iii) solupao alcalina de tartarato duplo de sódio e potássio, os teores em fósforo (P), nitrito (NO2-) e nitrato (NO3-) foram determinados por colorimetria. Os teores em nitrogenio total (N), nitrogenio amoniacal (NH3-N), nitrogenio orgánico (NO), nitrogenio amoniacal total (NAT), demanda bioquímica de oxigenio (DBO5) foram determinados por titulapao e o potássio (K) por fotometria de chama.
A detecpao de coliformes totais (CT) e de coli-formes termotolerantes (CTe) recorreu a técnica de tubos múltiplos, utilizando como meios de cultura, caldo verde brilhante bile 2% (CVVB) e caldo Eseheriehia eoli (EC), que avaliam respectivamente, a presenpa de coliformes totais e termotolerantes.
2.4 Análise de dados
Os parámetros físico-químicos e microbiológicos determinados foram comparados com os valores de referencia para águas salinas classe 2 presentes na resolupao brasileira n° 357/2005 (CONAMA 2005).
O cálculo da CL50-96h recorreu ao método esta-tístico Trimmed Spearman-Karber (Hamilton et al. 1977), através do programa TOXTAT 3.5®. Os valores de NOEC e lOeC foram obtidos por análise de variáncia ANOVA one way para os resultados paramétricos, e para os nao paramétricos foi utilizado o teste Kruskal-Wallis on Ranks. A comparapao post hoc entre grupos foi realizada utilizando o teste de Dunnett's para dados paramétricos, e o método de Dunn's para os nao paramétricos. O programa estatístico utilizado foi o Statistic 7.0.
A avaliapao de Nitoera sp. como bioindicador de toxicidade de efeito letal (teste agudo) e subletal (teste crónico) das amostras de água superficial foram comparados com testes de toxicidade aguda normalizados pela ABNT 15.308/2011, que usam Mysidopsis juniae como organismo teste. Os resultados ecotoxicológicos analisados fo-ram representados pela taxa de sobrevivencia ou reprodupao. O efeito observado nos ensaios foi calculado considerando a percentagem de sobrevivente e/ ou nauplii em relapao ao grupo controle, ou seja, as taxas de sobrevivencia e re-produpao foram estimadas considerando o número de sobreviventes e de náuplios (respectivamente), contabilizados nas amostras ambientais diluidas de 1:2 em relapao aos contabilizados no grupo controle. A análise estatistica dos parámetros ecotoxicológicos e fisico-quimicos recorreu ao teste U de Mann-Whitney e a amplitude do efeito calculada mediante o coeficiente d de Cohen. O software utilizado foi o SPSS v26.
Resultados e discussao
3.1 Cartas - controle
A sensibilidade dos organismos teste utilizados e a reprodutibilidade dos resultados foram avahadas por testes de referencia que permitiram a elaborapao de cartas controle (Figura 2a e 2b). De acordo com as respetivas cartas controle, a LC50-96h para Nitocra sp. em K2Cr2O7 foi de 9,12 ± 2,35 mg L-1 (n=14) e a LC50-96h para M. juniae em ZnSO4 foi de foi de 0,35 ± 0,04 mg L-1 (n=18).
Figura 2: Cartas-controle de Nitocra sp. (a) e M. juniae (b). Concentrapao letal (LC-96h) das substáncias de referencia, respectivamente, dicromato de potássio (K2Cr2O7) e sulfato de zinco heptahidratado (ZnSO4.7H2O). Valor médio cíe LC50-96h - linha laranja; faixa de sensibilidade entre linhas amarela e azul (± 2 desvios padrao).
Contudo, no quinto teste de referencia para Nitocra sp. a LC50-96h ultrapassou o limite superior estabelecido pela faixa de sensibilidade da carta controle do cultivo (Figura 2a), levando a suspensao dos testes com amostras ambientais até retorno da sobrevivencia dos organismos teste, dentro da faixa de sensibilidade estimada (4,89 - 13,36 mg L-1), o que ocorreu já no sexto teste. A boa reprodutibilidade sugere que durante o periodo experimental, os dois organismos teste perma-neceram saudáveis.
A LC50-96h determinada neste estudo para Nitocra sp. em K2Cr2O7 (9,12 ± 2,35 mg L-1) foi cerca de duas vezes inferior a 15,94 ± 3,46 mg L-1, LC-50-96h determinada por Krull et al. (2014). Para o copépode Tisbe biminiensis, a LC50-96h em foi de 9,45 ± 1,68 mg L-1 (Araújo-Castro et al. 2009) e de 10,5 ± 0,14 mg L-1 (Régis et al. 2018), valores próximos aos determinados neste estudo para Nitocra sp.
Em testes de referencia para avaliar a resposta de M. juniae a sulfato de Zinco (ZnSO4) a LC50-96h foi de 0,35 ± 0,04 mg L-1 (Nilin et al. 2019) e 0,33 mg L-1 (Resgalla et al. 2021). Usando dicromato de potássio como substáncia de referencia (de acordo com a norma adotada há mais de 10 anos pelo ECOTOX-Lab), a LC50-96h de M. juniae foi de 4,12 mg L-1 (Resgalla et al. 2021), cerca de metade da LC50-96h determinada no presente estudo para Nitocra sp. com K2Cr2O7, o que sugere a maior sensibilidade de M. juniae do que Nitocra sp. a esta substáncia de referencia.
3.2 Parámetros físico-químicos e microbiológicos
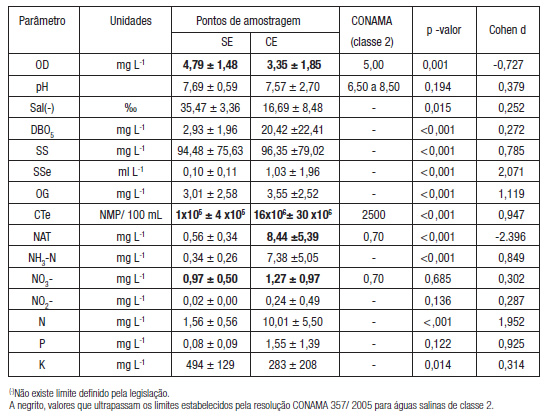
Parámetros fisico-quimicos e microbiológicos das amostras de água superficial do baixo EJP coletadas nos pontos CE e SE (Tabela 1) foram determinados e confrontados com a resolupao ambiental vigente (resolupao n° 357/05, CONAMA 2005) para esse tipo de corpo hidrico.
O monitoramento de OD e DBO5 em corpos hidricos é de grande importáncia já que ambos tem sido relacionado com a mortalidade de organismos aquáticos (Munna et al. 2013; Matos etal. 2017). Relativamente a OD, em 50% das amostras SE e 80% das amostras CE foram determinados valores inferiores ao limite estabelecido de 5 mg L-1 (CONAMA 357/ 05). Ao longo do período monitorado, uma grande variabilidade nos níveis de DBO5 foi observada (DP = 22,41 mg L-1). As concentrares de DBO5 foram, em média, cerca de 7 vezes superiores em CE em relagao a SE, sendo a diferenga entre as amostras, significativa (p< 0,001).
Tabela 1: Valores médios (± desvio padrao) de parámetros físico-químicos e microbiológicos de amostras de água superficial do estuário Jundiaí/ Potengi (n = 18) coletadas a montante da descarga do efluente tratado (SE) e na zona de descarga (CE), ao longo do período experimental (junho de 2015 e dezembro de 2016).
A negrito, valores que ultrapassam os limites estabelecidos pela resolugao CONAMA 357/ 2005 para águas salinas de classe 2.
A salinidade média das amostras SE foi de 35,47 ± 3,36 %o, correspondendo a valores que carac-terizam águas salinas. Nesta regiao do baixo estuário EJP, Souza et al (2010) e Lopes et al (2018) determinaram valores de salinidade de 32 a 37 %0 e 22 a 35 %o, respectivamente. Nas amostras CE a salinidade média foi aproximadamente, metade da determinada em SE (p< 0,01). A menor salinidade das amostras CE pode estar relacionada com a influencia da variagao da vazao da descarga de “água doce” da ETE do Baldo no rio Potengi. Considerados indicadores de poluigao urbana devida a emissao de esgoto sanitário (Marins et al. 2007; Barletta et al. 2019; Nilin et al. 2019) os parámetros SSe, CT, CTe, NA, NAT, NO3-, N e K, atingiram valores significativamente superiores em CE, mas apenas NAT e CT excederam os limites impostos pela legislagao brasileira (CONAMA 2005). As concentragoes de P nao diferiram significativamente, no entanto, o tamanho de efeito quando comparados os grupos foi considerado grande (cohen d = 0,925). Os nitratos excederam os limites impostos pela legislagao em vigor nos dois pontos de amostragem. Apesar de, para os teores de nitrato nao terem sido determinadas diferengas estatisticamente significativas entre SE e CE, em CE o teor de nitrato foi, em média, mais elevado.
Os teores de óleos e graxas (OG) nao apresentaram diferenga significativa entre os pontos SE e CE, e a análise visual, recomendada pela resolugao n°357 (CONAMA 2005), nao indicou a presenga de OG. Na regiao portuária do EJP, a cerca de 1,6 km a jusante do ponto CE, Souza e Neto (2019) determinaram em 2016, teores médios (n = 30) de OG de 1,81 e 0,98 mg L-1, cerca de 2 a 3 ve-zes inferiores aos determinados nos pontos de amostragem analisados neste trabalho.
3.3 Bioensaios ecotoxicológicos
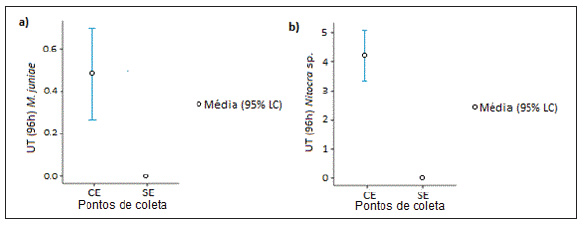
Entre os pontos CE e SE foram determinadas di-ferengas estatisticamente significativas (p< 0,001) para a toxicidade aguda expressa em unidades tóxicas (UT) para os dois organismos teste (Figura 3a e 3b). O efeito, expresso como coeficiente de Cohén d, foi de 1,82 UT para M. juniae e de 0,85 UT para Nitocra sp.
As amostras CE (ponto receptor de efluente sanitário tratado), causaram efeito letal (mor-talidade) em ambos os organismos teste, com um padrao de resposta diferenciado: Nitocra sp. evidenciou menor sensibilidade do que M. juniae (Tabela 2).
Figura 3: Médias de Unidades tóxicas (UT) para M. juniae (a) e Nitocra sp. (b), considerando as amostras de água superficial do baixo estuário do Jundiai/ Potengi (n=18), coletadas a montante da ETE (SE) e na zona de descarga do efluente tratado (CE) entre junho de 2015 e dezembro de 2016. Limite de confianga (LC) = 95 %.
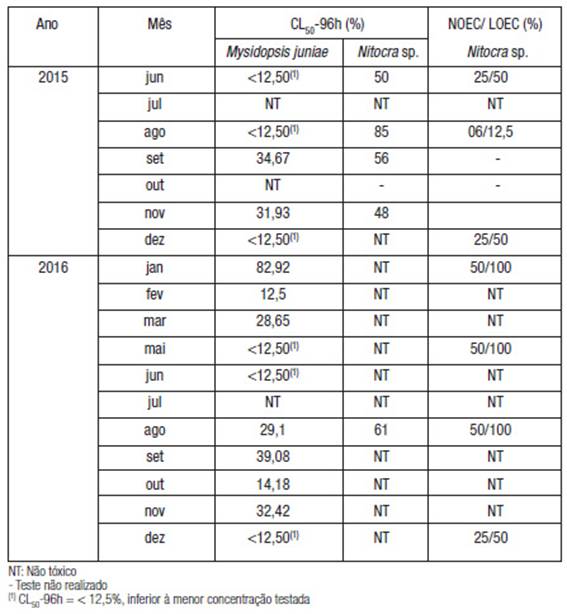
Tabela 2: Efeito letal (CL50-96h, %) de amostras de água superficial do baixo estuário Jundiai/ Potengi, coletadas na zona de descarga do efluente tratado (CE) em Mysidopsis juniae e Nitocra sp. e subletal (NOEC/ LOEC, %) em Nitocra sp., durante o período amostral.
As amostras SE nao causaram efeito letal nos organismos teste, exceto na amostra de janeiro de 2016; nesta amostra o número de nauplii de Nitoera sp. reduziu significativamente a partir da concentrado 50% (LOEC = 50%), traduzindo-se em efeito subletal.
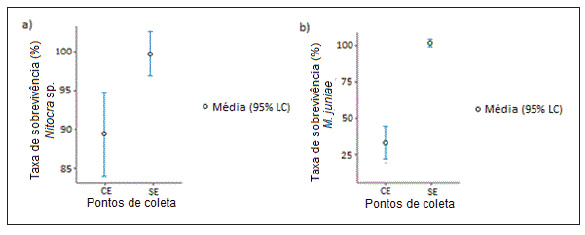
As taxas de sobrevivencia de M. juniae e o Nitoera sp., também apresentaram diferengas significativas (Figura 4a e 4b); a taxa de sobrevivencia média de Nitoera sp. nas amostras CE foi de 89,4% e nas amostras SE de 99,5%. Para M. juniae a taxa de sobrevivencia média foi de 33,5% e 102,3%, respectivamente nas amostras CE e SE.
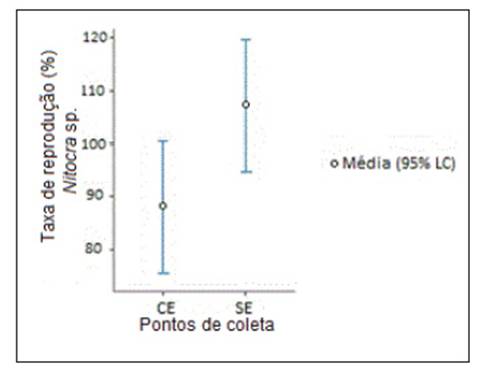
As diferengas estatisticamente significativas (p < 0,03) das médias da taxa de reprodugao de Nitoera sp. (87,3% em CE e de 107,3% em SE) apontam para a influencia negativa do efluente descartado em CE (Figura 5).
Figura 4: Taxas de sobrevivencia média (%) de Nitoera sp. (a) e M. juniae (b) em amostras de água superficial do baixo estuário do Jundiaí/ Potengi (n=18), coletadas a montante da ETE (SE) e na zona de descarga do efluente tratado (CE) entre junho de 2015 e dezembro de 2016. Limite de confianga (LC) = 95 %.
Figura 5: Taxa de reprodugao média (%) de Nitoera sp. em amostras de água superficial do baixo estuário do Jundiaí/ Potengi (n=17), coletadas a montante da ETE (SE) e na zona de descarga do efluente tratado (CE) entre junho de 2015 e dezembro de 2016. Limite de confianga (LC) = 95 %.
Esta regiao é de extrema importancia ambiental global e de subsistencia para as populagoes ri-beirinhas. Já se sabe que regioes que recebem efluentes sanitários e escoamentos da drenagem urbana convivem com o risco de ocorrencia de Nao sao muitos os estudos sobre a avaliagao ecotoxicológica de águas superficiais de regiSes estuarinas do Brasil (Araújo e Souza-Santos 2013; Nilin etal. 2019) e sao ainda menos os realizados com águas superficiais do baixo EJP. Contudo distúrbios bioquímicos e fisiológicos em sua biota (Silva e Abessa 2019). Gurgel et al. 2016 deter-minaram taxas de mortalidade de M. juniae seis vezes superiores as do grupo controle quando exposto a águas superficiais do rio Jundiaí, um afluente do EJP receptor de efluentes industriais. Ensaios ecotoxicológicos com o sedimento do EJP, em pontos próximos da área estudada nes-te trabalho, relatam toxicidade aguda para Ti-buronella viscana e Leptocheirus plumulosus, e crónica para Nitocra sp. e Lytechinus variegatus (Buruaem et al. 2013; Souza et al. 2016; Lopes et al. 2018). Mendonga et al. 2021 realizaram ensaios ecotoxicológicos com Nitocra sp. para avaliar a qualidade do sedimento do baixo EJP, e nenhuma das amostras coletas nas quatro campanhas de amostragem foi tóxica para os organismos teste, apesar das amostras terem apresentado elevada contaminagáo por metais e matéria orgánica. Ainda no EJP há registro de contaminado de ostras da espécie Crassostrea rhizophorae por metais Cd, Cr, Zn, Cu, Pb e Ni (Senez-Mello et al. 2020).
Estudos próximos a áreas de descarga de efluentes domésticos realizados em sedimentos ou em águas intersticiais (Araujo et al. 2013; Camargo et al. 2015; Campos et al. 2016; Ferraz et al. 2017), identificaram através do método de avahado da identificado da toxicidade (AIT) metais, compostos voláteis, compostos orgánicos, surfactantes e amonia, como responsáveis pelos efeitos causados nos organismos. As elevadas concentragóes de amonia determinadas no ponto CE do baixo EJP podem ter contribuido para a toxicidade destas amostras manifestada pela menor taxa de reprodugao dos organismos teste. O uso de espécies nativas é de suma importáncia em bioensaios para monitoramento ambiental, uma vez que como representantes da biota local geram dados mais realistas, permitindo uma me-lhor avaliagao da qualidade ambiental (Stringer et al. 2014). Assim é possivel estabelecer valores limite para poluentes individuais utilizando espécies teste brasileiras (Artal et al. 2019).
No Brasil, o copépode estuarino Nitocra sp. está bem estabelecido como organismo teste em bioensaios ecotoxicológicos com sedimentos, por ser de fácil manuseio; contudo ainda nao está padronizado para testes de toxicidade pelas normas brasileiras (Silva et al. 2018; Artal et al. 2019) e a referida espécie ainda nao foi determinada. As duas espécies presentes no Brasil usadas nestes ensaios ecotoxicológicos responderam de modo diferente as amostras ambientais (águas superficiais do baixo EJP). A menor sensibilidade de Nitocra sp. avaliando a letalidade pode estar associada a uma maior toleráncia deste organismo a amonia nao ionizada, considerada por Ferraz et al. 2021, um parámetro adequado para avaliar a toxicidade das fases líquida ou sólida de uma matriz sedimentar. A presenga de amo-nia em ambientes estuarinos nao degradados é natural, e resulta do processo de decomposigao da vegetagao de manguezal e da excregao dos animais, sendo estimada em 0,2 mg L-1 (Braga et al. 2000). O efeito tóxico da N-NH3 naturalmente presente no estuário é menor do que a quantidade presente em efluentes sanitários.
Maior resistencia de copépodes bentonicos ao anti-incrustante tributilestanho em relagao a menor resistencia de copépodes planctónicos foi relatada por Costa et al. (2014). Estes autores relacionaram a maior resistencia de copépodes bentonicos a um sistema de desintoxicagao mais eficiente, eventualmente devido ao distancia-mento filogenético entre estes taxa de diferentes nichos ecológicos.
Entretanto, em ensaios com corantes orgánicos dispersos, Nitocra sp. se mostrou mais sensivel que o anfípodo Parhyale hawaiensis, o que nao ocorreu quando exposto ao metal zinco, apesar do resultado ter sido considerado similarmente responsivo (Artal et al. 2019). Os bioensaios que analisam efeitos subletais sao muito mais sensíveis do que os que analisam efeitos letais, indicados para ambientes em que é necessária a protegao ambiental máxima (Stringer et al. 2014). E por isso necessário cuidado ao utilizar apenas Nitocra sp. para avaliar ambientes estuarinos.
O uso de náuplios do copépode Tisbe biminiensis em testes letais em vez de femeas ovadas e/ ou a observagao da taxa de reprodugao se mostrou mais sensível do que organismos adultos (Lavo-rante et al. 2013; Souza-Santos et al. 2015; Régis et al. 2018). Assim em futuros trabalhos o uso de náuplios de Nitocra sp. em área estuarina deverá ser considerado. Ferraz et al. (2021) utilizaram náuplios de Nitocra sp. com o objetivo de avaliar a toxicidade da água dos poros de sedimentos estuarinos próximos a um sistema portuário, po-rém como nao utilizaram femeas ovadas nao é possível comparar a sensibilidade dos náuplios com a de organismos adultos.
Na mesma linha, vem sendo publicados estudos (Nicodemo 2010; Vaz et al. 2013) relatando o sucesso e propondo métodos que utilizam M. juniae em testes cronicos. Este organismo é ideal para águas estuarinas com salinidade próxima a 35 ± 2 %0, como é o caso do baixo EJP, pois as amostras nao precisam de ser diluídas.
Já Nitoera sp. pode ser utilizado para analisar amostras entre 5 e 30 %o, faixa de sobrevivencia da espécie determinada por Lotufo e Abessa (2002). Dada a gama de concentrado de sais em que Nitoera sp. sobrevive, é possível a análise de um maior número de amostras ao longo do corpo hídrico em direpao a nascente sem ha-ver necessidade de aumentar a salinidade das amostras. No entanto, o cultivo experimental de Nitoera sp. no ECOTOXLab-UFRN em sali-nidade de 22 e 30 %o nao apresentou o mesmo sucesso reprodutivo quando comparados a 17 %0, salinidade final adotada para manutenpao do cultivo e realizapao dos testes.
CONCLUSOES
Os copépodes do genero Nitoera encontrados no Brasil tem sido cultivados com sucesso para ensaios ecotoxicológicos de sedimentos e águas intersticiais. A sobrevivencia destes organismos em águas de salinidade inferior a da água do mar (salinidade ótima 17%0; salinidade máxima 30), torna-os bons candidatos a bioensaios para ava-liapao de ambientes estuarinos. Neste trabalho, Nitoera sp. foi usado como organismo teste na análise ecotoxicológica de amostras de águas superficiais do EJP A boa reprodutibilidade dos ensaios realizados com a substancia de referencia (dicromato de potássio) também salienta o seu potencial como organismo teste. Nos ensaios com água superficial estuarina Nitoera sp. foi menos sensível as amostras receptoras de efluente tratado (CE) do que M. juniae, ou seja, apresentou maior taxa de sobrevivencia. Mas considerando a diminuipao da taxa de eclosao de náuplios de Nitoera sp., estes organismos teste foram consi-deravelmente sensíveis, sugerindo a importancia da sua utilizapao juntamente com outras espécies de organismos. O uso simultaneo de diferentes organismos teste corroborará a representatividade dos efeitos da poluipao e seus potenciais impactos na biota da área em estudo. O estabelecimento desta espécie brasileira como organismo teste padronizado para ensaios ecotoxicológicos de amostras de águas estuarinas superficiais, neces-sita de mais estudos, incluindo o uso de náuplios de Nitoera sp. na avaliapao de toxicidade aguda e a determinapao da espécie que tem vindo a ser utilizada no Brasil.
Agradecimentos
Os autores gostariam de agradecer ao professor Denis Abessa, da UNESP (Universidade de Sao Paulo) e colaborador pes-quisador do Instituto de Pesquisa Oceanográfica (Universidade de Sao Paulo), pela doapao dos organismos de Nitoera sp. Ao CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico) pelo apoio ao projeto [430383/2018-5].
Recibido: 04/02/2022
Aceptado: 26/07/2022
Editores: Susana García y Laura Lanari












 uBio
uBio