Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.62 n.4 Ciudad Autónoma de Buenos Aires jul./ago. 2002
Actualización en polimialgia reumática
Pablo Przygoda1, Luis J. Catoggio1, 2, 4, Enrique R. Soriano1, 2, 4, Patricia M. Imamura1, 2, 4, Luis A. Camera1, Roberto Kaplan1, 3, Luis M. Mayorga1
1Servicio de Clínica Médica,
2Sección Reumatología y
3Sección Geriatría, Hospital Italiano de Buenos Aires;
4Fundación Dr. Pedro M. Catoggio para el Progreso de la Reumatología, Buenos Aires
Dirección postal: Dr. Pablo Przygoda, Servicio de Clínica Médica, Hospital Italiano de Buenos Aires, Gascón 450, 1181 Buenos Aires, Argentina.Fax: (54-11) 4958-2923 e-mail: pprzygoda@intramed.net.ar
Resumen
La polimialgia reumática (PMR) es una enfermedad inflamatoria que afecta generalmente a personas mayores de 50 años y se caracteriza por dolor y entumecimiento doloroso de los músculos proximales junto con la elevación de la velocidad de sedimentación globular en la 1º hora. Si bien cada vez se diagnostica más frecuentemente, la PMR sigue siendo un diagnóstico de exclusión y los criterios diagnósticos propuestos no son universalmente aceptados. Si bien es reconocida la asociación de PMR con arteritis de células gigantes (ACG), la biopsia sistemática de la arteria temporal no está indicada en los pacientes con PMR que no presentan síntomas de ACG. El diagnóstico precoz y el tratamiento con esteroides en dosis bajas provocan una mejoría muy importante en los síntomas y la capacidad funcional de los pacientes con PMR. El tratamiento suele durar entre 12 y 24 meses y un alto porcentaje de los pacientes logra la suspensión definitiva del mismo.
Palabras clave: Polimialgia reumática; Tratamiento corticoesteroideo
Abstract
Polymyalgia rheumatica revisited. Polymyalgia rheumatica is an inflammatory disorder that usually affects persons over the age of 50 causing proximal muscle pain and stiffness, and an elevated erythrocyte sedimentation rate. Although increasingly recognized in this age group, it remains a diagnosis of exclusion and although several diagnostic criteria have been proposed, none has been clearly accepted. While polymyalgia rheumatica is associated with giant cell arteritis, obtaining a temporal artery biopsy is not recommended in patients with polymyalgia rheumatica without symptoms of giant cell arteritis. Early diagnosis and low dose corticosteroid therapy improve patients' clinical features and functional status. Treatment usually lasts between 12 and 24 months and the majority of patients manage to discontinue treatment completely.
Key words: Polymyalgia rheumatica; Corticosteroid therapy
La polimialgia reumática (PMR) es un síndrome clínico caracterizado por dolor y rigidez del cuello y de las cinturas escapular y pelviana. La rigidez muscular matinal generalizada puede estar acompañada por fiebre o febrícula, astenia y pérdida de peso. Inicialmente descripta en 1888 como "gota reumática senil"1, ganó su nombre actual recién en 19572. Hasta la década de 1960 los pacientes con PMR recibían el diagnóstico de artritis reumatoidea (AR). La PMR se asocia fuertemente a la arteritis de células gigantes (ACG) y muchos expertos las consideran diferentes manifestaciones clínicas de un mismo proceso subyacente3. Más aún, algunos usan el término polimialgia reumática/arteritis de células gigantes como una única denominación que incluye a ambos síndromes4. Si bien el mecanismo fisiopatogénico de la PMR no ha sido aún establecido, se cree que ésta obedece principalmente a una respuesta autoinmunitaria, probándose frecuentemente la presencia de sinovitis y tenosinovitis en los individuos afectados.
Epidemiología
La incidencia de PMR aumenta con la edad. Es una enfermedad casi exclusiva de los mayores de 50 años y el 90% de los pacientes tienen más de 60 años al diagnóstico5. La distribución geográfica es heterogénea y varía mucho según el origen de los distintos estudios observacionales que la describen6. En un trabajo prospectivo que incluyó a los habitantes de diferentes regiones de Dinamarca la incidencia de PMR fue 41.3 casos por cada 100,000 habitantes7. En otro realizado entre 1970 y 1991 en el condado de Olmsted del estado de Minnesota en los Estados Unidos de América, la incidencia fue de 52.5 casos por cada 100.000 habitantes8. La PMR afecta más a las mujeres que a los hombres en todos los grupos etarios y si bien la proporción de mujeres portadoras de la enfermedad varía en los distintos informes, ésta es aproximadamente de 3 a 17, 8, 9. La distribución racial es también asimétrica siendo más susceptibles los individuos de raza blanca9.
Fisiopatología
La etiología de la PMR es desconocida, sin embargo, mucho se ha avanzado en los últimos años en el conocimiento de los fenómenos inflamatorios e inmunitarios que ocurren en los pacientes afectados por la enfermedad. El dolor musculoesquelético es el resultado de sinovitis, tenosinovitis y bursitis; al microscopio los tejidos afectados presentan un infiltrado macrofágico y de linfocitos T asociados a proliferación vascular10. Si bien los pacientes con PMR no tienen compromiso evidente de las grandes arterias, sí en cambio, pueden presentar cambios microscópicos. No se han podido encontrar asociaciones concluyentes entre PMR y la presencia de alelos HLA específicos. Sin embargo, últimamente, algunos informes evidenciaron asociación entre los antígenos HLA DRB1 y PMR11. El patrón abrupto de inicio de síntomas de la PMR, la presencia en individuos portadores de PMR de una mayor seroprevalencia de anticuerpos contra los virus sincicial respitatorio y adenovirus12, y la coincidencia de epidemias de infecciones por Mycoplasma pneumoniae, Parvovirus B19 y Chlamydia pneumoniae han sido interpretados como evidencia de una posible relación causal entre algunas infecciones y la PMR, en individuos genéticamente susceptibles. Sin embargo, las pruebas son poco concluyentes y ningún estudio demostró con certeza estas hipótesis hasta al fecha.
Cuadro clínico y criterios diagnósticos
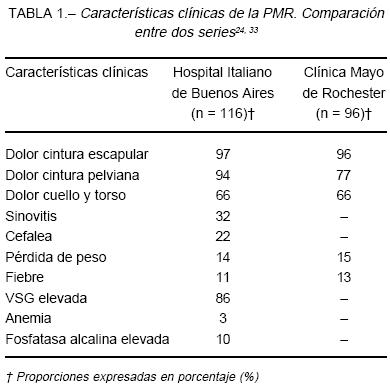
La presentación clínica de la PMR incluye una amplia constelación de signos y síntomas típicamente asociados con alteraciones de laboratorio tales como la anemia y la elevación de la VSG. Los síntomas principales de la PMR son el dolor y la rigidez de las cinturas escapular y pelviana. Estos síntomas predominan en horas matinales y mejoran, en general, a medida que el paciente desarrolla su actividad física diaria. El dolor suele ser más intenso en el cuello, hombros, torso, nalgas y los grupos musculares proximales, y puede ser de inicio agudo o insidioso. Asimismo, éste puede presentarse unilateral o bilateralmente, pero casi siempre luego de unos días se torna bilateral. El entumecimiento doloroso debe ser interrogado con cuidado porque es sumamente característico y orientador. Con frecuencia, el paciente refiere que su cónyuge debe ayudarlo a levantarse de la cama; una vez logrado lo previo, el entumecimiento suele remitir parcialmente con el uso. Un fenómeno similar ocurre luego de que el paciente permanece sentado cierto tiempo. El dolor es muchas veces seguido por malestar general y febrícula. Algunos pacientes experimentan también tumefacción y edema de manos y pies13. Debe tenerse en cuenta que el diagnóstico diferencial más frecuente y más difícil es precisamente con la AR. Salvo en los casos en los que el tratamiento es iniciado precozmente, los síntomas son referidos como intensos e interfieren con las actividades habituales, hecho que se objetiva con la disminución considerable de la capacidad funcional14. En la Tabla 1 se resumen los porcentajes correspondientes a las incidencias de los signos y síntomas.
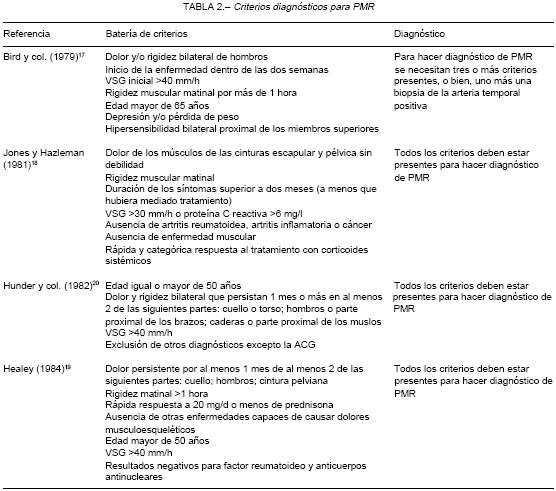
El diagnóstico de PMR es clínico porque no existen pruebas diagnósticas para confirmarlo, no hay un patrón de oro. La PMR es un ejemplo de "diagnóstico por descarte", ya que la presencia de varias entidades como AR, polimiositis, infección crónica y cáncer descartan, por definición, la PMR15, 16. Han habido varios intentos de construir conjuntos de criterios diagnósticos de PMR (Tabla 2). Bird y col.17 formularon en 1979 el primero que adquirió cierta difusión. Este primer intento sistemático para detectar pacientes con PMR no tomó en cuenta la respuesta inicial al tratamiento con corticoides (hoy aceptada como prueba terapéutica). Este modelo tampoco requiere la exclusión de otras enfermedades que causan dolor y rigidez. Los criterios que se formularon posteriormente18, 19 y alcanzaron cierto grado de consenso, exigen la exclusión de otra enfermedad muscu-loesquelética como condición necesaria para el hallazgo de PMR y la favorable respuesta al tratamiento con corticoides por vía oral (CO). Pocos autores vincularon a la PMR con la ACG en algún conjunto de criterios diagnósticos a pesar de las evidencias que indican categóricamente que ambas entidades están epidemioló-gicamente asociadas20.
La alteración de laboratorio más frecuente es el incremento de la VSG. Se constata entre 87 y 96% de los pacientes con PMR21, 22 y es ampliamente utilizada como criterio diagnóstico. El porcentaje restante de los pacientes con PMR nunca presentan elevación de la VSG. En la actualidad el valor de corte más aceptado es 40 milímetros en la primera hora (mm/h)23, valor que resulta superior a los previamente usados. Esta convención explica en parte, las diferencias entre las distintas series de pacientes con PMR con VSG normal, ya que la proporción de éstos es mayor cuanto mayor es el valor de corte utilizado. Si bien en la mayoría de los pacientes el descenso de la VSG acompaña a la mejoría clínica, esto no ocurre en todos los casos ya que el 10% de los pacientes permanecen con la VSG elevada al tercer mes de iniciado el tratamiento24. No se ha podido correlacionar la intensidad de los síntomas con la VSG inicial. No obstante, algunos autores sostienen que el valor de la VSG al diagnóstico es un factor pronóstico de duración de tratamiento con corticoides para la PMR25. Un trabajo demostró que durante las recaídas luego de una respuesta inicial favorable a los corticoides, la VSG se mantiene normal en alrededor de la mitad de los casos26 por más de que la misma hubiera estado elevada al diagnóstico. Nuestra experiencia, sin embargo, muestra que cuando el paciente tuvo una VSG elevada inicialmente, recae también con elevación de la VSG. Como esto no ocurre siempre, el manejo de las recaídas se dificulta. Como resumen, la VSG es el parámetro de laboratorio más útil para el diagnóstico y seguimiento de PMR y su empleo como parámetro pronóstico es discutido.
La proteína C reactiva también suele estar elevada en pacientes con PMR, pero su determinación no aporta mejor información que la de la VSG, que es un estudio más sencillo y barato. Las enzimas hepáticas pueden encontrarse levemente elevadas en pacientes con PMR. El hallazgo más frecuente es el aumento del nivel de la fosfatasa alcalina, que suele comportarse como un reactante de fase aguda aunque esta enzima no lo es3, 4, 6, 16.
Si bien en la mayoría de los casos, los pacientes se presentan con un grado leve a moderado de anemia de las enfermedades crónicas (ferremia baja, ferritina sérica normal o elevada, transferrinemia baja y disminución de la capacidad total de fijación de hierro), hay pacientes en los que el hematocrito es menor de 30%, hallazgo que suele correlacionar con demoras en el diagnóstico de la enfermedad y puede inducir a sospechar la presencia de una enfermedad maligna. Sin embargo, la anemia asociada a la PMR se corrige rápidamente con la remisión de la enfermedad. La fisiopatología de la anemia es multifactorial y se debe a un acortamiento de la vida media de los glóbulos rojos, una disminución de la capacidad eritropoyética de la médula ósea, y un déficit de la reutilización del hierro27.
En suma, los estudios de laboratorio suelen ser más útiles para descartar otras enfermedades, que para confirmar el diagnóstico de PMR (Tabla 3).

En este artículo se revisan distintos aspectos de la PMR pero se mencionan adicionalmente los puntos de superposición con la ACG. Algunos individuos presentan al diagnóstico síntomas de ambas entidades simultáneamente. En otras ocasiones, la segunda enfermedad se agrega luego de transcurrido cierto tiempo. Se estima que alrededor de la mitad de los pacientes con ACG desarrollan PMR a lo largo del transcurso de su enfermedad y que cerca de 10% de los portadores de PMR presentan ACG en su evolución. La realización sistemática de una biopsia de la arteria temporal en sujetos con PMR no se encuentra recomendada por la mayoría de los autores. Esto obedece a que si bien es cierto que aproximadamente 10% de los pacientes con PMR sin evidencia clínica de ACG tienen una biopsia positiva, el pronóstico de quienes tienen PMR coexistente con ACG asintomática parecería ser igual que el de aquellos con PMR sin ACG asociada. De no ser esto así se esperaría que hubiese muchos más episodios de ACG en individuos con PMR tratados con dosis bajas de corticoides. No hay una explicación clara para ello. Una especulación es que, realmente no hay tanta ACG como algunos trabajos han demostrado biopsiando sistemáti-camente a sujetos con PMR, o bien, que simplemente esta ACG "menor" responde bien a las dosis bajas de esteroides usadas en la PMR. Los resultados clínicos parecen sustentar esto último. Finalmente, la ceguera es muy infrecuente como manifestación inicial de ACG y es precedida, por lo general, por otros síntomas de ACG28.
De cualquier manera, con todos los portadores de PMR siempre se debe estar atento a la aparición de síntomas sugestivos de ACG para realizar una biopsia de arteria temporal y comenzar con el tratamiento específico con dosis más altas de corticoides.
Tratamiento y pronóstico
Está descripto que los antiinflamatorios no esteroides (AINE) pueden usarse en los pacientes con PMR. Sirven para disminuir los requerimientos de CO, especialmente en quienes requieren dosis más altas que las usuales. Lamentablemente, los ancianos también son más susceptibles a los efectos adversos de los AINE ya que inciden negativamente en la evolución de otras afecciones comórbidas, como la insuficiencia renal, la hipertensión arterial, la insuficiencia cardiaca congestiva, y los síntomas de reflujo gastroesofágico29. Los antiinflamatorios que inhiben selectivamente a la ciclooxigenasa 2 (Cox-2) podrían ser una alternativa más segura por su perfil más favorable de efectos adversos (aunque no están exentos de los mismos30), pero se necesitará mucha más investigación para recomendar su uso en pacientes con PMR. Nosotros no usamos los AINE en esta enfermedad por lo que no podemos aportar nuestra experiencia.
El tratamiento actual más habitual de la PMR se realiza con CO en dosis bajas. Los textos clásicos recomiendan el uso inicial de 10 a 20 miligramos por día (mg/d) de prednisona o equivalente. Lamentablemente, el uso crónico de CO facilita el desarrollo de osteoporosis, diabetes, cataratas e hipertensión, todos trastornos altamente prevalentes en la ancianidad. La tasa de efectos adversos del tratamiento con CO es alta, aun cuando la tendencia actual está orientada a disminuir la dosis diaria y el tiempo total de tratamiento. A pesar de ello, no existe consenso generalizado acerca de cuál es el mejor régimen terapéutico con CO para el tratamiento de la PMR. Hay quienes sostienen que lo importante no es tanto la dosis inicial como lo es el descenso lento de los corticoides en los primeros meses. Entre ellos nos contamos y nuestra experiencia en más de 100 pacientes ha podido sustentar el uso de dosis que no superan los 8 mg/d de metilprednisona o equivalente, con éxito en más del 87% de nuestros pacientes31, 32.
Como mencionamos antes, la dosis inicial de CO utilizada por nosotros es de 8 mg/d de metilprednisona que equivale a 10 mg/d de prednisona. Una proporción pequeña de pacientes que ronda el 10% de los casos necesitará un incremento de esta dosis inicial que en general no supera los 12 mg/d de metilprednisona (o 15 mg/d de prednisona). Insistimos en no reducir la dosis inicial de CO durante los 3 primeros meses de tratamiento, independientemente de si disminuyó o no la VSG (lo cual ocurre al mes de iniciado el tratamiento en la mayoría de los pacientes), porque es precisamente en este lapso cuando se producen la mayor cantidad de las recaídas24, 31.
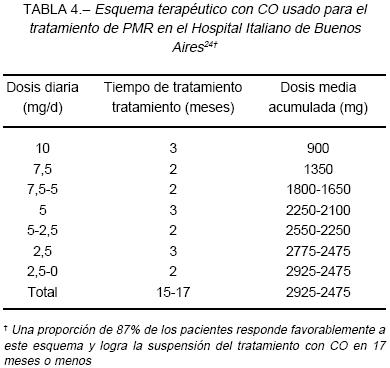
Luego de lograda la respuesta inicial se debe disminuir progresivamente la dosis de CO después de transcurridos los 90 días de iniciado el tratamiento. Se sugiere que el seguimiento de los pacientes con PMR incluya visitas frecuentes. Para los casos con respuesta favorable, recomendamos una visita al mes del inicio del tratamiento. Asimismo, es en ese momento cuando se recibe el segundo estudio de VSG. Esta es nuestra práctica, por lo cual no tenemos datos de descensos de VSG previos al mes, ni creemos que sean necesarios, salvo en casos de mala evolución. Las visitas y los estudios de VSG ulteriores están relacionados con las citas para control y con el plan de reducir la dosis de CO. En la tabla 4 presentamos el esquema tentativo de reducción de dosis de CO usado en nuestro centro24.
En los casos en que la dosis mencionada no logre el control de los síntomas, el diagnóstico de PMR deberá reverse y deberá considerarse la realización de una biopsia de la arteria temporal para descartar ACG. Los pacientes con PMR que desarrollan ACG requerirán tratamiento con CO en dosis altas adecuadas al diagnóstico, tema que escapa de los límites de esta revisión.
Las complicaciones más frecuentes del uso crónico de CO son la osteoporosis, la diabetes metacorticoidea, la hipertensión arterial, las cataratas, las fracturas y las infecciones. Hay muy pocos trabajos que analizaron la relación entre la dosis inicial y media acumulada, con las tasas de recaídas y la prevalencia de efectos adversos al tratamiento. La tasa de efectos adversos derivados del uso de CO sería menor cuanto menor es la dosis media acumulada de CO utilizada. En nuestra serie24 de 116 pacientes la tasa de efectos adversos fue 11%, número sustancialmente menor que el 69% descripto en otra serie de 175 pacientes de la Clínica Mayo en Rochester33. En ambas series, la dosis media acumulada de CO fue 3.5 y 8.4 gramos de prednisona, respectivamente. Esto demostró claramente que la tasa de efectos adversos se puede reducir sin pérdida de la efectividad del tratamiento utilizando el esquema propuesto por nosotros.
Actualmente no se discute la necesidad de realizar tratamiento profiláctico para la osteoporosis en pacientes con PMR que reciben CO y se recomienda el uso combinado de vitamina D y calcio34. Se ha demostrado también que el tratamiento profiláctico con bisfosfonatos atenúa la disminución de la densidad mineral ósea en pacientes en tratamiento con CO en forma prolongada35, 36, 37. Por este motivo, aunque el consenso no es absoluto, muchos expertos recomiendan el uso sistemático de bisfosfonatos para la prevención de la osteoporosis inducida por corticoides38, 39.
La magnitud de las complicaciones derivadas del uso prolongado de CO ha llevado a buscar tratamientos adyuvantes o alternativos para evitarlas. El uso de metotrexato en asociación con CO ha demostrado poca utilidad en limitar la dosis media acumulada de CO en pacientes con PMR40 y su empleo se encuentra muy limitado. Otras drogas como la dapsona y la azatioprina, que reducen los requerimientos de esteroides en varias enfermedades, han sido probadas en PMR pero la evidencia es aún escasa para recomendar su uso. En nuestra experiencia anecdótica, el uso de antipalúdicos ha permitido discontinuar los CO en algunos casos.
Conclusiones
La PMR es una enfermedad inflamatoria de etiología aún desconocida. El diagnóstico de PMR es básicamente clínico y de descarte, resultando sencillo en la mayoría de los casos. En general, cuando un paciente se presenta con un cuadro clínico compatible con PMR, y la respuesta a los CO es favorable en los primeros días, no son necesarios demasiados exámenes complementarios para arribar al diagnóstico (bastan un hemograma, un proteinograma electroforético y la medición de la VSG). En la última década, los esfuerzos de muchos investigadores clínicos en terapéutica de la PMR se orientaron a definir la dosis mínima de CO capaz de controlar adecuadamente los síntomas, que a la vez no provocara un incremento marcado en la tasa de recaídas41. Este objetivo se ha logrado en parte poniendo énfasis en la necesidad de realizar un descenso muy gradual de la dosis de CO a lo largo del tratamiento. Nuestra experiencia permite afirmar que 87% de los pacientes pueden tratarse exitosamente con 10 mg/d de prednisona o menos, con 11% de efectos adversos. Queda pendiente la realización de ensayos clínicos diseñados para concluir si es posible, además, reducir significativamente el tiempo total de tratamiento. La reducción de la dosis media acumulada de CO conllevará una disminución importante de la comorbilidad derivada de los efectos adversos de los esteroides.
1. Bruce W. Senile rheumatic gout. BMJ 1888; 2: 811-3. [ Links ]
2. Barber HS. Myalgic syndrome with constitutional effects: polymyalgia rheumatica. Ann Rheum Dis 1957;16: 230-7. [ Links ]
3. Meskinem S, Cook TD, Blake RL. Management of giant cell arteritis and polymyalgia rheumatica. Am Fam Physi-cian 2000; 62: 789-96. [ Links ]
4. Salvarani C, Macchioni P, Boiardi L. Polymyalgia rheuma-tica. Lancet 1997; 350: 43-7. [ Links ]
5. Bahlas S, Ramos-Remus C, Davis P. Clinical outcome of 149 patients with polymyalgia rheumatica and giant cell arteritis. J Rheumatol 1998; 25: 99-104. [ Links ]
6. Hunder GG. Giant cell arteritis and polymyalgia rheu-matica. Med Clin North Amer 1997; 81: 195-219. [ Links ]
7. Elling P, Olsson AT, Elling H. Synchronous variations of the incidence of temporal arteritis and polymyalgia rheumatica in different regions of Denmark; association with epidemics of Mycoplasma pneumoniae infection. J Rheumatol 1996; 23: 112-9. [ Links ]
8. Salvarani C, Gabriel SE, O'Fallon WM, et al. Epidemiology of polymyalgia rheumatica in Olmsted County, Minnesota, 1970-1991. Arthritis Rheum 1995; 38: 369-73. [ Links ]
9. Goodwin JS. Progress in gerontology: polymyalgia rheumatica and temporal arteritis. J Am Geriatr Soc 1992; 40: 515-25. [ Links ]
10. Salvarani C, Cantini F, Olivieri I, et al. Proximal bursitis in active polymyalgia rheumatica. Ann Int Med 1997; 127: 27-31. [ Links ]
11. Haworth S, Ridgeway J, Stewart I, et al. Polymyalgia rheumatica is associated with both HLA-DRB1*0401 and HLA-DRB1*0404. Br J Rheumatol 1996; 35: 632-5. [ Links ]
12. Cimmino MA, Grazi G, Balistreri M, Accardo S. Increased prevalence of antibodies to adenovirus and respiratory syncytial virus in polymyalgia rheumatica. Clin Exp Rheumatol 1993; 11: 309-13. [ Links ]
13. Salvarani C, Gabriel S, Hunder GG. Distal extremity swelling with pitting edema in polymyalgia rheumatica. Report on nineteen cases. Arthritis Rheum 1996; 39: 73-80. [ Links ]
14. Kalke S, Mukerjee D, Dasgupta B. A study of the health assessment questionnaire to evaluate functional status in polymyalgia rheumatica. Rheumatology (Oxford) 2000; 39: 883-5. [ Links ]
15. Epperly TD, Moore KE, Harrover JD. Polymyalgia rheumatica and temporal arteritis. Am Fam Physician 2000; 62: 789-96. [ Links ]
16. Evans JM, Hunder GG. Polymyalgia rheumatica and giant cell arteritis. Rheum Dis Clin North Amer 2000; 26: 493-515. [ Links ]
17. Bird HA, Esselinckx W, Dixon ASJ, Mowart AG, Wood PHN. An evaluation of criteria for polymyalgia rheumatica. Ann Rheum Dis 1979; 38: 434-9. [ Links ]
18. Jones JG, Hazleman BL. Prognosis and management of polymyalgia rheumática. Ann Rheum Dis 1981; 40:1-5. [ Links ]
19. Healey LA. Long term follow-up of polymyalgia rheumatica: evidence for synovitis. Semin Arthritis Rheum 1984;13: 322-8. [ Links ]
20. Chuang TY, Hunder GG, Ilstrup DM, Kurland LT. Polymyalgia rheumatica: a 10-year epidemiologic and clinical study. Ann Intern Med 1982; 97: 672-80. [ Links ]
21. Ellis ME, Ralston S. The ESR in the diagnosis and management of the polymyalgia rheumatica/giant cell arteritis syndrome. Ann Rheum Dis 1983; 42: 168-170. [ Links ]
22. Brittain GP, McIlwaine GG, Bell JA, Gibson JM. Plasma viscosity or erythrocyte sedimentation rate in the diagnosis of giant cell arteritis. Br J Ophthalmol. 1991; 75: 656-9. [ Links ]
23. Jones JG, Hazleman BL. ESR in polymyalgia rheumatica and giant cell arteritis. Ann Rheum Dis 1983; 42: 702-3. [ Links ]
24. Catoggio LJ, Soriano ER, Imamura PM. Efficacy of low dose steroids in polymyalgia rheumatica (PMR). Proceedings of the 19th ILAR Rheumatology, Singapore, ILAR 1997: 104-8. [ Links ]
25. Pountain G, Hazleman BL. Erythrocyte sedimentation rate (ESR) at presentation is a prognostic indicator for duration of treatment in polymyalgia rheumatica. Br J Rheumatol 1996; 36: 508-9. [ Links ]
26. Kyle V, Cawston TE, Hazleman BL. Erythrocyte sedimen-tation rate and C reactive protein in the assessment of polymyalgia rheumatica/giant cell arteritis on presentation and during follow up. Ann Rheum Dis 1989; 48: 667-71. [ Links ]
27. Means RT. Advances in the anemia of chronic disease. Int J Hematol 1999; 70: 7-12. [ Links ]
28. Sorensen PS, Lorenzen I. Giant-cell arteritis, temporal arteritis and polymyalgia rheumatica: a retrospective study of 63 patients. Acta Med Scand 1977; 201: 207-13. [ Links ]
29. Labbe P, Harduoin P. Epidemiology and optimal manage-ment of polymyalgia rheumatica. Drugs Ageing 1998; 13: 109-18. [ Links ]
30. Whelton A. Cyclooxygenase-2 inhibition and renal function. Ann Intern Med 2001; 134: 1077-8. [ Links ]
31. Soriano ER, Catoggio LJ, Imamura PM, Cámera LA. Polimialgia reumática (PMR) y arteritis a células gigantes (ACG): características clínicas y evolución. Programa científico del XXX Congreso Argentino de Reumatología, Sociedad Argentina de Reumatología; Rosario, Argentina, 1990: 32. [ Links ]
32. Catoggio LJ, Soriano ER, Imamura PM. Polimialgia reumática (PMR): tratamiento exitoso con bajas dosis iniciales de corticoides (1983-1994). Rev Arg de Reumatología 1994; 5 (supl.): 12. [ Links ]
33. Gabriel SE, Sunku J, Salvarini C, O'Fallon WM, Hunder GG. Adverse outcomes of antiinflammatory therapy among patients with polymyalgia rheumatica. Arthritis Rheum 1997; 40: 1873-8.
34. The Cochrane Library, Oxford, issue 4, 2001. Homik J, Suarez-Almazor ME, Shea B, Cranney A, Wells G, Tugwell P. Calcium and vitamin D for corticosteroid-induced osteoporosis (Cochrane Review), at http://www.update-software.com/abstracts/ab001347.htm. [ Links ]
35. Skingle SJ, Crisp AJ. Increased bone density in patients on steroids with etidronate [letter]. Lancet 1994; 344: 543-4. [ Links ]
36. Adachi JD, Bensen WG, Brown J, et al. Intermittent eti-dronate therapy to prevent corticosteroid-induced osteoporosis. N Engl J Med 1997; 337: 382-7. [ Links ]
37. Saag KG, Emkey R, Schnitzer TJ, Brown JP, Hawkins F, Goemaere S, et al. Alendronate for the prevention and treatment of glucocorticoid-induced osteoporosis. Glucocorticoid-induced ospteoporosis intervention study group. N Engl J Med 1998; 339: 292-9. [ Links ]
38. American College of Rheumatology. Recommendations for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheum 1996; 39: 1791-801. [ Links ]
39. The Cochrane Library, Oxford, issue 4, 2001. Homik J, Cranney A, Shea B, et al. Bisphosphonates for steroid induced osteoporosis (Cochrane Review), at http://www.update-software.com/abstracts/ab000952.htm. [ Links ]
40. Feinberg HL, Sherman JD, Schrepferman CG, Dietzen CJ, Feinberg GD. The use of methotrexate in polymyalgia rheumatica. J Rheumatol 1996; 23: 1550-2. [ Links ]
41. Catoggio LJ, Soriano ER, Imamura PM. Treatment of polymyalgia rheumatica: lower initial dose. Br J Rheumatol 1991; 30: 393-5. [ Links ]
42. Chuang TY, Hunder GG, Ilstrup DM, Kurland LT. Polymyalgia rheumatica: a 10-year epidemiologic and clinical study. Ann Intern Med 1982 Nov; 97: 672-80. [ Links ]
43. Mazanec DJ. Evaluating back pain in older patients. Cleve Clin J Med 1999; 66: 89-91. [ Links ]
44. Klippel JH, Arassi T. Polymyalgia rheumatica and giant cell arteritis. In: Grimley Evans J, Franklin Williams T, Lynn Beattie B, Michel JP, Wilcock GK (eds.). Oxford textbook of geriatric medicine. 2nd ed. Oxford: Oxford University Press, 2000, p 580-4. [ Links ]
Recibido: 15-10-2001
Aceptado: 9-04-2002














