Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.66 n.1 Buenos Aires ene./feb. 2006
Giardia y giardiasis
Hugo D. Luján
Instituto de Investigaciones Médicas Mercedes y Martín Ferreyra (INIMEC-CONICET), Córdoba
Dirección postal: Dr. Hugo D. Luján, Instituto de Investigaciones Médicas Mercedes y Martín Ferreyra (INIMEC-CONICET), Friuli 2434, Parque Vélez Sarsfield, 5016 Córdoba, Argentina. E-mail: hlujan@immf.uncor.edu
Resumen
Giardia lamblia es un protozoario parásito que habita el intestino delgado de los seres humanos y de muchos otros vertebrados y es una de las más comunes causas de diarrea en todo el mundo. Durante su ciclo de vida Giardia sufre significativos cambios bioquímicos y morfológicos que le permiten sobrevivir en ambientes y condiciones que de otro modo lo destruirían. Para sobrevivir fuera del intestino del hospedador, los trofozoítos de Giardia se diferencian a quistes, los que se caracterizan por poseer una rígida pared glicoproteica externa que les permiten sobrevivir inclusive frente a la acción de los desinfectantes más comunes. Otro de los mecanismos de adaptación de este parásito es la variación de los antígenos de superficie que le permite a los trofozoítos evadir la respuesta inmune del huésped y generar infecciones tanto agudas como crónicas o recurrentes en individuos infectados. Durante los últimos años se han producido importantes avances en el conocimiento de las bases moleculares de los procesos de enquistamiento y variación antigénica en Giardia que pronostican el pronto hallazgo de nuevos agentes quimioterapéuticos y/o inmunoprofilácticos contra este importante parásito intestinal.
Palabras clave: giardiasis, diarrea, quistes, parásito, diferenciación celular
Abstract
Giardia and giardiasis Giardia lamblia is a protozoan parasite that inhabits the upper small intestine of humans and several other vertebrates and one of the most frequent cause of intestinal disease worldwide. During its life cycle, G. lamblia undergoes significant biochemical and morphological changes that allow the parasite to survive under hostile environmental conditions. To survive outside the hosts intestine, Giardia differentiates into resistant cysts, which are characterized by a rigid extracellular cyst wall that protect the parasite even to the action of the most common chemical disinfectants. Another adaptive mechanism of Giardia is the switching of its surface antigens, a mechanism that allows the trophozoites to evade the hosts immune responses and produce acute, chronic and/or recurrent infections. During the last years, important advances in the knowledge of the molecular basis underlying the mechanisms of encystation and antigenic variation in Giardia suggest that novel chemotherapeutic and/or immunoprophylactic reagents against this important human pathogen could soon be available.
Key words: giardiasis, diarrhea, cysts, parasite, cellular differentiation
Una particular característica de los organismos parásitos es su gran capacidad de adaptación a cambios del medio ambiente. La mayoría de los parásitos, ya sean unicelulares como los protozoarios o multicelulares como los helmintos, ocupan diferentes nichos durante su travesía por vectores y hospedadores, por lo que han desarrollado extraordinarios mecanismos de adaptación que les permiten sobrevivir en condiciones ambientales que de otro modo los destruirían1. Durante una infección, la supervivencia de los organismos patógenos depende no sólo de su habilidad para colonizar un individuo sino también de su capacidad para contrarrestar los mecanismos de defensa que el hospedador genera. Así, la patogenicidad o virulencia de los parásitos refleja la interacción dinámica entre ellos y el hospedador y su capacidad de respuesta a los sistemas defensivos, condición necesaria para la supervivencia parasitaria y el mantenimiento y/o transmisión de la infección2.
Con la intención de conocer más acerca de los mecanismos de defensa y adaptación parasitaria que ocurren durante la infección, nuestro equipo de trabajo se encuentra estudiando desde hace varios años los procesos de adaptación celular del parásito Giardia lamblia (sin. G. duodenalis, G. intestinalis).
G. lamblia es un protozoario binucleado y flagelado que habita el intestino delgado de humanos y otros mamíferos y es el agente responsable de la giardiasis, una patología que se presenta con manifestaciones clínicas que varían desde la infección asintomática a la enfermedad aguda o crónica asociada con diarrea y mala absorción de nutrientes3. La infección con G. lamblia es una de las enfermedades parasitarias más comunes en todo el mundo y se inicia por la ingestión de los quistes del parásito, los cuales se desenquistan durante su pasaje por el contenido ácido del estómago, liberando los trofozoítos (Fig. 1). Estos colonizan el intestino delgado superior y se adhieren a la superficie del epitelio intestinal mediante una organela característica llamada disco ventral o de adhesión4.
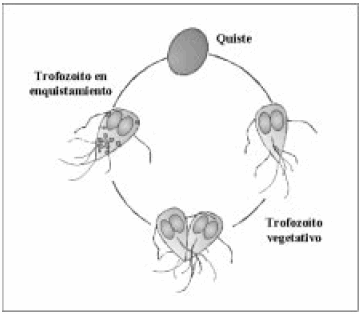
Fig. 1.- Ciclo de vida de Giardia lamblia. Esquema representativo del ciclo vital de Giardia: La infección se inicia con la ingesta de los quistes, los que desenquistan en el intestino superior liberando los trofozoítos, la forma del parásito que prolifera en el intestino y es responsable de los síntomas de la enfermedad. Al descender por la luz intestinal, algunos trofozoítos comienzan a enquistarse, lo cual se manifiesta por la aparición de gránulos de secreción específicos que transportan los materiales que luego formarán la pared del quiste maduro y que protegen al parásito fuera del intestino del hospedador.
Debido a las diferencias en las condiciones sanitarias, en los países subdesarrollados es mayor la prevalencia que en los países avanzados. No obstante, en estos últimos las infecciones humanas se hallan en turistas, homosexuales y personas en asilos o guarderías. En algunos países pobres, la giardiasis en niños afecta a cerca del 100% de la población. Grandes epidemias han ocurrido por contaminación fecal de alimentos y reservorios de agua, infectando en algunos casos a miles de personas. Este parásito constituye un importante problema de salud pública global5-7, además, en los EE.UU. se considera a Giardia un posible agente de bioterrorismo por su capacidad de ser transmitido por el agua, por su potencial de ser genéticamente manipulado, y por la posibilidad de reproducir totalmente su ciclo vital en el laboratorio8-9.
Aunque en la Argentina no existen estudios sobre la prevalencia de este parásito, de acuerdo a relevamientos realizados en diferentes partes del país la infección con Giardia sería la causa de numerosos casos de diarrea y mala absorción y/o de contaminación fecal de productos para el consumo humano. Más del 50% de los niños argentinos estarían infectados con G. lamblia, y sería una causa de desnutrición infantil 10, 11. Los animales domésticos y balnearios turísticos son fuentes de transmisión del parásito, y muchas agencias de viajes internacionales indican a Giardia como un potencial "peligro" para sus viajeros a la Argentina. Por otro lado, otro factor a considerar es que la infección de animales de producción (especialmente chinchillas y conejos) y domésticos (perros y gatos) produce pérdidas económicas de importancia. Estudios realizados por nuestro laboratorio a pedido de productores de la región identificaron a Giardia como el agente causal de numerosos casos de diarrea y pérdida de peso en chinchillas de criaderos para la producción de pieles. Además, la inmensa mayoría de los bioterios del país que mantienen animales para experimentación y que fueron analizados durante los últimos años mantenían ratas, ratones y conejos infectados con Giardia.
Hasta el presente, la única posibilidad de controlar la giardiasis es utilizando medicamentos cuyos principios activos no son altamente eficaces, pueden presentar un gran número de efectos secundarios y ya se han registrado cepas de Giardia resistentes a los mismos12. Además, es frecuente la re-infección luego del tratamiento debido a que estos individuos no generan mecanismos de defensas eficaces para eliminar el parásito.
Además de su importancia médica y veterinaria, Giardia es de gran interés en biología puesto que es una de las células eucariotas más primitivas que se conocen13. Giardia utiliza dos bien conocidos mecanismos de adaptación a los cambios ambientales que confronta durante su ciclo de vida, ya sea para sobrevivir dentro del intestino del huésped como es la variación de sus antígenos de superficie4, 14 o, fuera del mismo, la diferenciación de trofozoíto a quiste15, 16.
El mecanismo de adaptación de Giardia conocido como enquistamiento es esencial para que el parásito pueda sobrevivir fuera del intestino del hospedador, ya que los trofozoítos son sumamente sensibles a los cambios de temperatura, humedad y a la presencia de agentes químicos4. En este proceso, los trofozoítos descienden por el intestino del hospedador, y al encontrar un ambiente pobre en colesterol, se induce su diferenciación a quiste17, los cuales son eliminados con las heces (Fig. 1). La principal característica de la forma quística es la presencia de una rígida pared glicoproteica externa que protege al parásito en condiciones ambientales muy hostiles, inclusive a la acción de desinfectantes4. En los últimos años, utilizando métodos bioquímicos, inmunológicos y de biología molecular, nuestro equipo de trabajo ha identificado el estímulo que inicia el enquistamiento de Giardia17 y caracterizado moléculas cuya expresión es inducida específicamente en este proceso18-20. Además, dilucidamos varios eventos moleculares comprometidos en el transporte, secreción y ensamblado de la pared quística extracelular21-25. Es importante destacar que a partir de estos estudios sobre la biología, bioquímica y genética del parásito, hemos desarrollado herramientas diagnósticas (anticuerpos monoclonales específicos contra el quiste de Giardia y proteínas recombinantes de la pared del quiste) que son utilizados por varias empresas internacionales para la elaboración de equipos diagnósticos de inmunofluorescencia y ELISA.
Por otro lado, para sobrevivir dentro del hospedador y evadir la respuesta inmune, Giardia manifiesta lo que se conoce como variación antigénica (Fig. 2). Los trofozoítos se encuentran recubiertos de una determinada proteína de superficie que forma una verdadera interfaz entre el parásito y el medio, y que pertenece a una familia de proteínas denominadas proteínas variables de superficie (Variant-Specific Surface Protein, VSPs). Giardia contiene en su genoma un repertorio de entre 150 a 200 genes que codifican estas proteínas4, 26, 27, pero solamente una VSP se expresa en la superficie de los trofozoítos en un momento dado14 (Fig. 2). Estas proteínas, a pesar de ser antigénicamente diferentes entre sí y ser heterogéneas en lo que respecta a su tamaño molecular, poseen un dominio transmembrana altamente conservado y una porción carboxilo-terminal citosólica compuesta por sólo cinco aminoácidos (CRGKA)14. Su región N-terminal es altamente variable (dándole a cada una de estas proteínas la característica de ser antigénicamente diferente), pero todas son ricas en cisteína (~12%), incluyendo una alta incidencia del motivo CXXC (donde X representa cualquier aminoácido). La purificación y análisis de una de estas proteínas, la VSP GS/H7, demostró que la misma no está glicosilada y que une Zn2+ y Fe2+ por coordinación a los dominios CXXC28. Esa sería la razón de la deficiencia de esos minerales observada en pacientes con giardiasis crónica.

Fig. 2.- Variación antigénica de Giardia lamblia. Imagen representativa del proceso de variación antigénica en Giardia. Trofozoítos en cultivo fueron marcados para la detección de la proteína variable de superficie 9B10 usando un anticuerpo monoclonal específico y con DAPI para resaltar los núcleos del parásito. En esta población algunos trofozoítos han dejado de expresar la VSP9B10, expresando en su superficie otra VSP no detectada por el anticuerpo anti-VSP9B10.
Giardia cambia espontáneamente la expresión de sus VSPs ya sea en cultivo o en respuesta al ataque inmunológico que estos antígenos inducen tanto en humanos como en animales de experimentación14. La variación antigénica se acompaña de la pérdida del ARNm del gen que codifica para una determinada VSP con la concomitante aparición de los transcriptos derivados de la expresión de una nueva VSP4, 14. El mecanismo por el cual los trofozoítos cambian su cubierta de superficie no se conoce, pero se cree que la variación antigénica le permite a Giardia evadir la respuesta inmune del hospedador y por ello producir infecciones crónicas y recurrentes.
Desde su descubrimiento hace más de 20 años29, varios investigadores han intentado dilucidar los eventos moleculares involucrados en el mecanismo de variación antigénica de Giardia, pero sus esfuerzos han sido infructuosos por la carencia de las herramientas necesarias para realizar estos estudios, además de un modelo animal eficiente4, 14. Hasta el presente, la mayoría de los estudios para comprender la variación antigénica en Giardia se basaron en la premisa de que el cambio de expresión de los genes que codifican VSP se realizaba en la trascripción4; es decir, que regiones o dominios reguladores en estos genes debían contener la información necesaria para su expresión diferencial; sin embargo los genes que codifican VSP tienen gran variabilidad en esas regiones y en muchos casos ellas ni siquiera existen4.
Es posible especular que el mecanismo de regulación de la expresión de las VSPs podría ser controlado de manera post-transcripcional. En este sentido, en los últimos años se ha avanzado considerablemente en la comprensión de mecanismos de este tipo de regulación en otras células eucariotas. Se conoce, por estudios realizados en organismos más evolucionados, que copias repetidas u homólogas de genes, ya sea en tándem o dispersos en el genoma, son habitualmente reconocidas por la célula y silenciados30. Cuando la regulación de la expresión génica es post-transcripcional, se ha observado que la generación de un ARN anti-sentido homólogo a la secuencia a silenciar conduce a la formación de ARN de doble hebra (dsRNA) que es rápidamente degradado por una ARNasa específica llamada Dicer, impidiendo su normal procesamiento y con ello la inhibición de la expresión del gen en cuestión30-33.
La hipótesis de que un mecanismo post-transcripcional regula el proceso de variación antigénica en Giardia ha sido confirmada en nuestro laboratorio (Slavin I y col., material aún no publicado). En este caso, todas las VSPs son transcriptas al mismo tiempo y luego silenciadas. En este escenario debe dilucidarse aún cómo es posible el silenciamiento de todos, excepto uno, de los genes que codifican VSPs de manera que sólo un transcripto maduro del repertorio que se transcribe en el núcleo sea traducido para generar la única VSP que será posteriormente expresada en la superficie del trofozoíto. De nuestros resultados queda claro que el mecanismo por el cual Giardia regula la expresión de sus proteínas variables de superficie es similar al ARN de interferencia, y que involucra enzimas tales como ARN polimerasa dependiente de ARN (RdRP), ARN helicasas y Dicer. Al conocer las bases moleculares del proceso de variación antigénica en Giardia, es posible extrapolar los resultados al diseño de herramientas que evitan la infección desarrollando una vacuna. Por ejemplo, si logramos inhibir la acción de la RdRP, no habría silenciamiento génico, todos los genes que codifican VSP se traducirían en proteínas y éstas a su vez se expresarían en la superficie del parásito. La utilización de estas VSPs como antígenos en la formulación de una vacuna permitirá al hospedador generar anticuerpos y células reactivas contra todo el repertorio de VSPs, que contrarresten la infección y/o las manifestaciones clínicas de la enfermedad.
Los estudios preliminares realizados por nuestro laboratorio en ese sentido y los promisorios resultados alcanzados en la generación de un modelo experimental murino34 sugieren que generar una vacuna contra Giardia es una meta alcanzable en el mediano plazo. Como se describió anteriormente, la giardiasis es una de las infecciones parasitarias más comunes en todo el mundo y si bien la enfermedad asociada a la infección con Giardia es muy frecuente, su importancia va más allá de lo estrictamente médico para convertirse en una infección que involucra a sectores productivos tales como la generación de agua potable, el turismo y la cría de animales para consumo o experimentación y la producción agro-pecuaria. Esperamos que las herramientas y conocimientos derivados de estudios básicos sobre los mecanismos de adaptación de este parásito permitan en el futuro el control, tanto de la diseminación de la enfermedad como de las manifestaciones clínicas que ella genera.
Nota: Hugo D. Luján es Miembro de la Carrera del Investigador del CONICET e International Research Scholar of Howard Hughes Medical Institute.
Bibliografía
1. Losick R, Shapiro L. Microbial Development. Cold Spring Harbor Laboratory. New York Cold Spring Harbor 1984 [ Links ]
2. Deitsch KW, Moxon ER, Wellems TE. Shared themes of antigenic variation and virulence in bacterial, protozoal, and fungal infections. Microb Mol Biol Rev 1997; 61: 281-93. [ Links ]
3. Thompson RCA. Giardiasis as a re-emerging disease and its zoonotic potential. Int J Parasitol 2000; 30: 1259-67. [ Links ]
4. Adam R. Biology of Giardia lamblia. Clin Microbiol Rev 2001; 14: 447-75. [ Links ]
5. Thompson RCA Monis PT. Variation in Giardia: Implications for taxonomy and epidemiology. Adv Parasitol 2004; 58: 69-137. [ Links ]
6. Addis D, David P, Roberts JM, Mast E. Epidemiology of Giardiasis in Wisconsin: increasing incidence of reported cases and unexplained season trends. Am J Trop Med Hyg 1992; 47: 13-9. [ Links ]
7. Fayer R, Dubey J Lindsay D. Zoonotic protozoa: from land to sea. Trends Parasitol 2004; 20: 531-6. [ Links ]
8. Carus S. Bioterrorism and Biocrimes. Working paper. Center for Counter Proliferation Research. Washington DC: National Defense University, 2001. [ Links ]
9. Braden JB Duchin JS. Preparing for and responding to Bioterrorism. Information for the Public Health Workforce. Northwest Center for Public Health Practice. University of Washington, 2002. [ Links ]
10. Hunter PR. Waterborne disease. Epidemiology and ecology. Chichester: John Wiley and Sons, 1997. [ Links ]
11. Satterthwaite D, Hart R, Levy C, et al. eds. The Environment for children. New York: UNICEF, 1996, p 284. [ Links ]
12. Petri W. Therapy of intestinal protozoa. Trends Parasitol 2003; 19: 523-6. [ Links ]
13. Sogin, ML, Gunderson JH, Elwood HJ, Alonso RA, Peattie DA. Phylogenetic meaning of the kingdom concept: an unusual ribosomal RNA from Giardia lamblia. Science 1989; 243: 75-7. [ Links ]
14. Nash TE. Antigenic variation in Giardia lamblia and the hosts immune response. Phil Trans R Soc Lond B 1997; 352: 1369-75. [ Links ]
15. Luján HD, Mowatt MR, Nash TE. The mechanisms of Giardia lamblia differentiation into cysts. Microbiol Mol Biol Rev 1997; 61: 294-304. [ Links ]
16. Luján, H.D, Mowatt MR, Nash TE. The molecular mechanisms of Giardia encystation. Parasitol Today 1997; 14: 446-50. [ Links ]
17. Luján HD, Mowatt MR, Byrd LG, Nash TE. Cholesterol starvation induces differentiation of the intestinal parasite Giardia lamblia. Proc Natl Acad Sci USA 1996; 93: 7628-33. [ Links ]
18. Mowatt MR, Luján HD, Cotten DB, et al. Developmentally regulated expression of a Giardia lamblia cyst wall protein gene. Mol Microbiol 1995; 15: 955-63. [ Links ]
19. Luján HD, Mowatt MR, Conrad JT, Bowers B, Nash TE. Identification of a novel Giardia lamblia cyst wall protein with leucine-rich repeats. J Biol Chem 1995; 270: 29307-13. [ Links ]
20. Touz MC, Gottig N, Nash TE, Lujan, HD. Identification and characterization of a novel secretory granule calcium-binding protein from the early branching eukaryote Giardia lamblia. J Biol Chem 2002; 277: 50557-63. [ Links ]
21. Carranza PG., Feltes G, Ropolo A, Quintana SMC, Touz MC, Lujan HD. Simultaneous expression of different variant-specific surface proteins in single Giardia lamblia trophozoites during encystation. Infect Immunol 2002; 70: 5265-8. [ Links ]
22. Touz MC, Nores MJ, Slavin I, et al. The Activity of an encystation-specific cysteine proteinase is required for cyst wall formation in the primitive eukaryote Giardia lamblia. J Biol Chem 2002; 277: 8474-81. [ Links ]
23. Touz MC, Nores MJ, Slavin I, et al. Membrane-associated dipeptidyl-peptidase IV is involved in encystation-specific gene expression during Giardia differentiation. Biochem J 2002; 364: 703-10. [ Links ]
24. Luján HD, Mowatt MR, Conrad JT, Nash TE. Increased expression of the molecular chaperone BiP/GRP78 during the differentiation of a primitive eukaryote. Biol Cell 1996; 86: 11-8. [ Links ]
25. Luján HD, Touz MC. Protein trafficking in Giardia lamblia. Cell Microbiol 2002; 5: 427-34. [ Links ]
26. Pimenta PFP, Pinto da Silva P, Nash TE. Variant surface antigens of Giardia lamblia are associated with the presence of a thick coat. Infect Immun 1991; 59: 3989-96. [ Links ]
27. Adam RD. The Giardia lamblia genome. Int J Parasitol 2000; 30: 475-84. [ Links ]
28. Luján HD, Mowatt MR, Wu J, et al. Purification of a variant-specific surface protein of Giardia lamblia and characterization of its metal-binding properties. J Biol Chem 1995; 270: 13807-13. [ Links ]
29. Nash T, Gillin FD Smith PD. Excretory-secretory products of Giardia lamblia. J Immunol 1983; 4: 2004-10. [ Links ]
30. Cogoni C, Macino G. Homology-dependent gene silencing in plants and fungi: a number of variations of the same theme. Curr Opin Microbiol 1999; 2: 657-62. [ Links ]
31. Faergeron G. Diversity of homology-dependent gene silencing strategies in fungi. Curr Opin Microbiol 2000; 3: 141-8. [ Links ]
32. Chicas A, Macino G. Characteristics of post-transcriptional gene silencing. EMBO Rep 2001; 2: 992-6. [ Links ]
33. Tang G. siRNA and miRNA: an insight into RISCs. Trends. Biochem. Sci. 2005; 30: 106-14. [ Links ]
34. Ropolo A, Saura A, Carranza P, Luján HD. Identification of variant-specific surface proteins in Giardia muris trophozoites. Infect Immunol 2005; 73: 5208-11. [ Links ]
Recibido: 14-09-2005
Aceptado: 1-11-2005














