Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.38 n.2 La Plata mar./jun. 2004
SECCIÓN PERMANENTE LATINOAMERICANA
Métodos de detección de sangre en heces: Interés y problemas
N. Kapel1
1. Laboratoire de Coprologie Fonctionnelle, Grupo Hospitalicia Piedad Salpêtrière, París.
1. MÉTODOS DISPONIBLES
1.1. Métodos cromogénicos
1.2. Métodos inmunológicos
2. PRESTACIONES DE LAS PRUEBAS
2.1. Pruebas cromogénicas
2.2. Pruebas inmunológicas
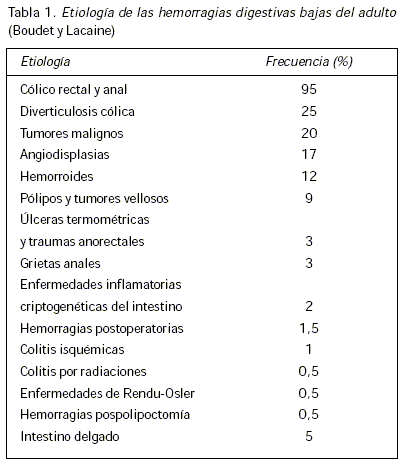
Una hemorragia gastrointestinal oculta es una pérdida de sangre en el tubo digestivo sin sangrado visible. Su etiología es la misma que la de las hemorragias macroscópicas (Tabla 1). Esta condición se sospecha ante una prueba de búsqueda de sangre en heces positiva o ante una anemia ferropénica. Habiendo evolucionado en los últimos años las características técnicas de las pruebas de investigación de sangre en heces, es importante comprender bien sus principios para aprovechar sus prestaciones diagnósticas y utilizarlas eficazmente.
Se trata de
- pruebas cromogénicas basadas en la detección de la actividad pseudoperoxidásica de la hemoglobina;
- pruebas inmunoquímicas basadas en el empleo de anticuerpos policlonales o monoclonales dirigidos contra la hemoglobina humana.
La lista de las pruebas registradas por el AFSSAPS (Agencia Francesa de Seguridad Sanitaria de Productos de Salud) aparece en la Tabla 2.
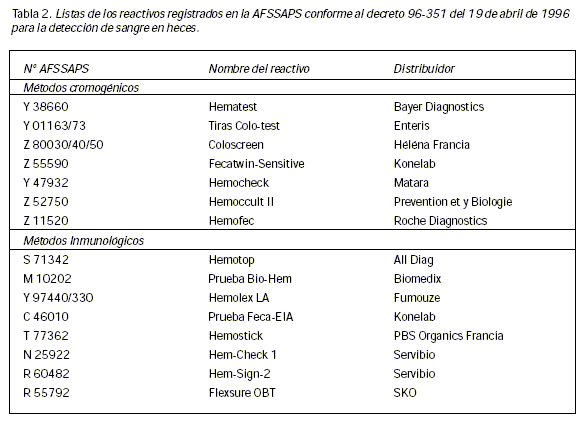
Según una investigación nacional hecha por la AFSSAPS en 1998 en los laboratorios clínicos, el reactante más utilizado por los laboratorios es una prueba inmunológica de aglutinación de partículas de látex (Hemolex®LA, Fumouze). Le siguen, por orden de menor uso, una prueba inmunocromatográfica (Hem-Check 1®, Servibio) y dos pruebas que utilizan un método cromogénico (Hemocult II®, Prévention et Biologie y Hematest®, Bayer diagnostic)I. El estudio de la distribución de la utilización de estas pruebas mostró que las pruebas inmunológicas fueron con mucho las más utilizadas por los laboratorios privados, mientras que las pruebas cromogénicas fueron algo más utilizadas en los hospitales y mucho más en los centros de medicina preventiva. Finalmente, según este estudio, el 52% de las pruebas las realizaron los laboratorios privados, el 27% los laboratorios de hospitales y el 21% los centros de medicina preventiva.
La primera razón de prescripción de estas pruebas es el cribado del cáncer colorrectal, (CCR) que representa una de las primeras causas de mortalidad por cáncer en Francia con más de 33.000 nuevos casos por año, de los que el 65% se localizan en el colon. La supervivencia a 5 años se estima en un 35%. La filiación adenoma-cáncer no ofrece duda, aunque solamente una pequeña proporción de los adenomas desarrollarán un cáncer. Muy pocos datos permiten estimar sin embargo, la duración de la filiación adenoma-cáncer si bien el estudio de registro de los pólipos en Costa de Oro lo evalúa en 9 años. Sea como fuere, dado que la historia natural del cáncer a menudo empieza por un adenoma benigno, es lícito pensar que una detección precoz pueda reducir la mortalidad tanto más, cuanto que el pronóstico depende mucho del estadio de extensión de la enfermedad en el momento del diagnóstico. La investigación de una hemorragia oculta representa la prueba de elección y será seguida obligatoriamente, en una segunda fase, de un examen de detección si la primera prueba es positiva. Esta aproximación ha sido validada por bastantes ensayos controlados randomizados, tanto americanos como europeos (ingleses y daneses), que han mostrado la eficacia teórica de la práctica bienal de una investigación de sangre en heces con la prueba Hémoccult II, basándose en la mortalidad específica inducida por el CCR en el intervalo de edad de 50-74 años (Mandel 1993, Hardcastle, 1996, Kronborg, 1996). Según estos estudios de cohortes, después de un seguimiento de 10 años dicha mortalidad se estima en un 18%. Sin embargo, en este caso es necesario también, conocer bien los límites de estas pruebas de despistaje. En efecto, su tasa de positividad en las diferentes campañas de cribado es alta (hasta el 2,4% en el estudio de Mandel, 1993) y también una muy alta proporción de estos resultados son falsos positivos en términos de despistaje de cáncer, o sea, un resultado positivo en ausencia de toda afectación neoplásico colo-rectal (adenoma o cáncer). Así, el análisis comparativo de los datos de los estudios inglés y danés muestra que por cada 100 personas a las que se les practicó un despistaje bienal durante 10 años, se evita una muerte por CCR (Gotzshe) 1997.
1.1. MÉTODOS CROMOGÉNICOS
El principio de estas pruebas es simple. Se basa en la aparición de una coloración azul en un papel reactivo impregnado de resina de guayaco o de ortotoluidina en presencia de una sustancia con actividad pseudoperoxidásica como el hemo, después de añadir algunas gotas de una solución alcohólica de agua oxigenada. Su sensibilidad se estima entre 2 y 10 mg de hemoglobina por gramo de heces. Estas pruebas tienen la ventaja de ser simples, rápidas y poco onerosas. Sin embargo, la coloración azul que indica la positividad de la prueba puede ser discreta y hay cierta subjetividad en su interpretación, por lo que la lectura requiere personal con experiencia. Además, las pruebas débilmente positivas pueden negativizarse si es demasiado largo el lapso entre la realización de la prueba y su lectura. Este inconveniente se palia con la rehidratación de la prueba, utilizada en algunos estudios americanos, aunque este procedimiento tiene el inconveniente de conllevar una tasa de positividad muy alta generando un número de falsos positivos demasiado elevado. Finalmente, hay que saber que las pruebas cromogénicas son no sólo positivizadas por la hemoglobina humana, sino también por las hemoglobinas animales, las moléculas emparentadas presentes en la carne de animales o las que tienen propiedades peroxidásicas, de suerte que se recomienda un régimen alimenticio adecuado en las 48 horas que precedan a la prueba (Tabla 3).

Sin embargo, en el marco de los estudios de cohortes, un metanálisis ha mostrado que la ausencia de restricción alimenticia permite aumentar la tasa de respuesta durante las campañas de despistaje del CCR, sin alteración significativa de la tasa de positividad. Si el hierro es clásicamente descrito como generador de falsos positivos in vitro, no parece que la ingestión por los pacientes de terapéuticas a base de hierro perturbe los resultados. Al contrario, se tendrá en cuenta la toma de antiinflamatorios no esteroideos (AINES), de aspirina o de anticoagulantes. Aunque en circunstancias normales, estas moléculas sólo inducen sangrados menores, es difícil valorar actualmente su influencia en la positividad de las pruebas. Igualmente, las sustancias con actividad antioxidante, tipo la vitamina C (>250 mg/día), pueden inducir falsos negativos. En nuestra experiencia, fue bastante frecuente observar falsos negativos (en comparación con las pruebas inmunológicas) en período invernal.
1.2. MÉTODOS INMUNOLÓGICOS
Estas pruebas se han desarrollado hace una decena de años para paliar los inconvenientes de las pruebas cromogénicas. Se basan en el empleo de anticuerpos policlonales o monoclonales específicos de la hemoglobina humana y utilizan diferentes tecnologías (ELISA, aglutinación de partículas de látex sensibilizadas, inmunocromatografía). Su sensibilidad analítica, medida con una disolución de hemoglobina humana, es mayor que la de las pruebas cromogénicas, del orden de 0,04 a 1 mg de hemoglobina por gramo de heces y de ahí su interés en el cribado de las poblaciones con riesgo elevado. Tienen el inconveniente de ser más caros que los métodos cromogénicos, pero tienen la ventaja de sólo ser sensibles a la hemoglobina humana digerida. Las interferencias analíticas con las hemoglobinas no humanas o las moléculas emparentadas son eliminadas de suerte que no es necesario considerar restricciones alimenticias para su realización. Son mucho menos sensibles a los sangrados de origen alto porque la hemoglobina que proviene del tracto digestivo alto, por lo general está desnaturalizada y tiene destruídos los epitopos reconocidos por los anticuerpos (Harewood y al., 2002). Finalmente, la lectura de estas pruebas se ha mejorado progresivamente. Siendo delicada en ciertos casos en las pruebas de aglutinación de partículas de látex, la lectura ha sido facilitada mediante la generación de las pruebas inmunocromatográficas y la automatización. Estas pruebas sin embargo, no han sido todavía objeto de evaluaciones en cohortes importantes.
2. Prestaciones de las pruebas
Cualquiera que sea la prueba considerada, las nociones de sensibilidad y especificidad son difíciles de interpretar y comparar en la medida en que no existe una técnica de referencia fiable al 100%. La sensibilidad de todas las pruebas parece excelente para la detección de la sangre no degradada de origen cólico. Sin embargo, la sangre procedente del tracto gastrointestinal alto puede positivar las pruebas cromogénicas a diferencia de las pruebas inmunológicas, por lo que cuando se usan hará falta prestar atención antes de atribuir un resultado positivo a un sangrado (Favennec et al., 1992). Sin embargo, es necesario que el sangrado sea importante, ya que un estudio ha mostrado que una ingestión de 20 ml de sangre durante 3 días no dio positivo el Hémoccult II®más que en el 16% de los voluntarios sanos (Rockey et al., 1999).
2.1. PRUEBAS CROMOGÉNICAS
Lo esencial de los datos de la literatura sobre el cribado del CCR y particularmente todos los estudios de cohortes, se han obtenido con el empleo de estas pruebas con guayacol, a menudo con el Hémoccult II®. En el marco de estas investigaciones, la tasa de positividad de las investigaciones de sangre oculta en heces se encuentra en alrededor del 2% (Tabla 4). Para el diagnóstico de las lesiones digestivas, estas pruebas presentan una sensibilidad bastante mediocre debido a la ausencia de sangrado de ciertas lesiones, el carácter intermitente de éstas cuando existe y el reparto no homogéneo de la sangre en heces. Varía mucho según los estudios. Se la puede estimar en alrededor del 50% para la detección del CCR con el empleo de la prueba Hémoccult II® no rehidratado y del 10 al 20% para los pólipos adenomatosos de más de 1 cm. Un trabajo realizado a partir de los datos recogidos en la región de Calvados estima la sensibilidad de la prueba Hemoccult II® no rehidratado en 48% (30% - 66%) ligeramente superior para el colon proximal (55%) que para el colon distal (49%) y el recto (50%) (Launoy et al., 1997). Es muy importante resaltar que la existencia de una investigación de sangre oculta negativa no permite excluir la presencia de pólipos adenomatosos e incluso de cáncer (Towler, 1998; Simón, 1998; Souques, 2000). La gran mayoría de los estudios publicados muestran una especificidad superior al 95%.
Tabla 4. Resultados de las principales campañas de cribado utilizando la prueba Hémoccult Il® sin rehidratación.
De manera general, los valores predictivos positivos de estas diferentes pruebas de detección de un CCR son débiles, del orden del 5 al 10% (Tabla 4), debido a la multiplicidad de las etiologías susceptibles de provocar un sangrado digestivo (Mandel 1993; Hardcastle, 1996; Kronborg, 1996). Así, en Francia, 5 campañas de cribado de masa se hicieron en Saona y Loira entre 1988 y 1996 sobre la base de una búsqueda bienal utilizando la prueba Hémoccult II®. En estos estudios, el valor predictivo positivo medio de una prueba positiva fue del 11,4% para un cáncer, el 17,1% para un adenoma >1 cm y el 11,1% para un adenoma < 1 cm (Tazi, 2000). Así, incluso con una buena especificidad de las pruebas, el número de colonoscopias realizadas se revela injustificado. Inversamente, del 40 al 50% de los cánceres se diagnostican más o menos tardíamente con una prueba Hémoccult II® negativa (Hardcastle 1996; Kronborg, 1996). La sensibilidad de estas pruebas para otras lesiones digestivas no es conocida. Si bien la técnica de rehidratación del Hémoccult II® utilizada en bastantes estudios realizados en Estados Unidos permite aumentar claramente esta sensibilidad, esto se consigue a costa de la especificidad y el valor predictivo positivo de la prueba deviene entonces inaceptable.
2.2. PRUEBAS INMUNOLÓGICAS
Pocos estudios importantes se han hecho con las pruebas inmunológicas, pruebas que no están siendo utilizadas actualmente a gran escala más que en Japón. Además, la mayoría de los trabajos publicados en la literatura hacen referencia a pruebas no comercializadas en Francia, particularmente la prueba Immudia-HemSP basada en el principio de la hemaglutinción pasiva. El estudio realizado por Favennec, en 1992, evaluó la prueba inmunológica (Hemolex®) en 165 pacientes hospitalizados que no siguieron régimen particular alguno, comparándola con 3 pruebas cromogénicas; la especificidad y el valor predictivo positivo de las pruebas inmunológicas se revelaron netamente mejores, aunque a costa de una disminución moderada de la sensibilidad. La especificidad y el valor predictivo positivo de la prueba inmunológica fueron, respectivamente, 98% y 92%, incluidas todas las patologías digestivas, mientras que para las pruebas cromogénicas fueron, respectivamente, 71% y 44%. Resultados similares se obtuvieron en un estudio más reciente hecho en colaboración con el servicio de gastroenterología del Hospital Louis Mourier de Colombes. Las pruebas utilizadas fueron, de una parte, las pruebas inmunológicas Hemolex® y Hemcheck® y de otra parte, las pruebas cromogénicas Hémoccult II® y Hemofec®. El valor predictivo positivo, incluidas todas las patologías digestivas potencialmente hemorrágicas, fue del 78 al 89% en esta población, para las pruebas inmunológicas y del 66 al 71% para las pruebas cromogénicas (Jouet 2000). La mejor especificidad de las pruebas tiene que ser considerada como crucial en la medida en que induce un aumento del valor predictivo positivo, lo que tiene como corolario una reducción del número de colonoscopias. Sin embargo, esta ganancia no debe hacerse a costa de la sensibilidad de las pruebas que ya es relativamente baja. Las pruebas inmunológicas comercializadas se caracterizan por una sensibilidad analítica muy variable y lo importante actualmente, es hacer estudios de cohortes a gran escala para evaluar las prestaciones en términos de sensibilidad, especificidad, valores predictivos positivos y negativos.
La investigación de sangre oculta en heces se prescribe frecuentemente, pero sus características son mal conocidas. Si bien está demostrado que una estrategia de cribado a gran escala del CCR con una prueba cromogénica bienal puede disminuir la mortalidad que le es imputable, este hecho queda muy aminorado por las prestaciones relativamente modestas de las pruebas utilizadas, lo que comporta un número importante de colonoscopías inútiles. Es por lo tanto importante tratar de mejorar las prestaciones de las pruebas, lo que ha llevado al desarrollo de las pruebas inmunológicas. Sólo las pruebas inmunológicas deben utilizarse en los laboratorios clínicos franceses ya que son las únicas reconocidas por la Nomenclatura de actos de biología médica.
Gracias a su mayor especificidad, en la práctica médica permiten confirmar o excluir la existencia de una hemorragia digestiva en el marco de un paciente particular y en un contexto clínico definido. Sin embargo, su costo es más elevado que el de las pruebas cromogénicas. Igualmente, su practicabilidad no es tan buena, aun a pesar de los progresos importantes que se han realizado en este campo. Finalmente, hay un gran déficit en la literatura internacional en lo que se refiere al cribado del CCR. Sea como fuere, no hay que olvidar que todo paciente con una prueba de investigación de sangre positiva, cualquiera que sea la metodología utilizada, deberá ser objeto de exámenes complementarios del tipo de la colonoscopía o, en su defecto, de enema con sales de bario.
1. Boudet MJ, Lacaine E Diagnostic et traitement des hémorragies coliques et ano-rectales. Rey Prat 1995; 45: 2307-23 12.
2. Favennec L, Kapel N, Meillet D, Chochillon C, Gobert JG. Detection of occult blood in stools: comparison of three gaiac tests and a latex agglutination test. Ann Biol Clin 1992; 50: 311-3 13.
3. Gotzshe P. Correspondance. Lancet 1997; 349: 356.
4. Hardcastle JD, Chamberlain JO, Robinson MHE, Moss SM, Amar SS, Balfour TW, et al. Randomised controlled trial of faecaloccult blood screening for colorectal cancer. Lancez' 1996; 348 1472-1477.
5. Harewood GC, McConnell JP, Harrington JJ, Mahoney DW, Ahlquist DA. Detection of occult upper gastrointestinal tract bleeding: performance differences in fecal occult blood tests. Mayo Clin Proc 2002; 77: 23-28.
6. Jouet P, Kapel N, Andant C, Gorbatchef C, Gobert JG, Soule C. Tests immunologiques de détection de sang dans les selles: un progrès par rapport aux tests au gaïac ?. Gastroenterol Clin Biol, 2000; 24: A129.
7. Kronborg O, Fenger C, Olsen J, Jorgensen OD, Sondergaard O. Randomised study of screening for colorectal cancer with faecaloccult-blood test at Funen in Denmark. Lancez' 1996; 348: 1467-147 1.
8. Launoy G, Smith TC, Duffy SW, Bouvier V. Colorectal cancer mass screening: estimation of fecal occult blood test sensitivity taking into account cancer mean sojoum time. Int J Cancer 1997; 73: 220-224.
9. Mandel JS, Bond JH, Church TR, Snover DC, Bradley GM, Schuman LM, Ederer E. Reducing mortality from colorectal cancer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N EngI J Med. 1993; 328 1365-137 1.
10. Rockey DC, Auslander A, Greenberg PD. Detection of upper gastrointestinal blood with fecal occult blood tests. Am J Gastroenterol 1999; 94: 344-350.
11. Simon JB. Fecal occult blood testing: clinical values and limitations. Gastroenterologist 1998; 6: 66-78.
12. Souques M, Zummer K. Le test Hémoccult Il®: résultats de 16 ans de pratique dans le Service de Prévention et Dépistage des Tumeurs de la Ville de Paris. Presse Med 2000; 29: 983-986.
13. Towler B, Irwig L, Glasziou P, Kewenter J, WelIer D, Silagy C. A systematic review of the effect of screening for colorectal cancer using the faecal occult blood test, Hemoccult. BMJ 1998; 317: 559-565














