Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.40 n.3 La Plata jul./sep. 2006
TEMAS DE INTERÉS
Guía de consenso para el diagnóstico y seguimiento de la enfermedad tiroidea*
EDITORES
Liliana M. Bergoglio. Bioquímica. Endocrinóloga.
Jorge H. Mestman. Médico. Endocrinólogo.
* Reproducido con permiso de la National Academy of Clinical Biochemistry, Washington, D.C.
ÍNDICE
Presentación de la Edición en Idioma Español
Prefacio
Traducción de la Edición en Idioma Inglés
Sección 1. Prólogo e Introducción
Sección 2. Factores pre-analíticos
Sección 3. Ensayos tiroideos para el bioquímico y el médico
A. Tiroxina Total (T4T) y Triyodotironina Total (T3T)
B. Tiroxina Libre (T4L) y Triyodotironina Libre (T3L)
C. Tirotrofina (TSH)
D. Anticuerpos Antitiroideos:
• Anticuerpos anti-Peroxidasa Tiroidea (TPOAb)
• Anticuerpos anti-Tiroglobulina (TgAb)
• Anticuerpos anti-Receptor de TSH (TRAb)
E. Tiroglobulina (Tg)
F. Calcitonina (CT) y Proto-oncogen RET
G. Yodo urinario
H. Punción Aspirativa con Aguja Fina (PAAF) y Citología Tiroidea
I. Screening de Hipotiroidismo Congénito
Sección 4. Importancia del contacto entre el Laboratorio y los Médicos
Apéndices y Glosario
Referencias
* NOTA de la Redacción de ABCL:
A partir de este número y en ediciones sucesivas se publicará por partes la presente Guía de Consenso.
Presentación de la Edición en Idioma Español
EDITORES
• Liliana M. Bergoglio, Bioquímica Endocrinóloga, Universidad Nacional de Córdoba, Córdoba, Argentina .
• Jorge H. Mestman, Médico Endocrinólogo, Universidad del Sur de California, Los Angeles, CA, Estados Unidos.
Mencionamos con reconocimiento los nombres de los profesionales que participaron en la revisión de la traducción del documento original sobre el cual está basada esta monografía:
• Claudio Aranda, Hospital Carlos C. Durand, Buenos Aires, Argentina
• Aldo H. Coleoni, Universidad Nacional de Córdoba, Córdoba, Argentina
• N. Liliana F. de Muñoz, Hospital de Niños de la Santísima Trinidad, Córdoba, Argentina
• Silvia Gutiérrez, Hospital Carlos C. Durand, Buenos Aires, Argentina
• H. Rubén Harach, Hospital Dr. A. Oñativia, Salta, Argentina
• Gustavo C. Maccallini, Hospital Carlos C. Durand, Buenos Aires, Argentina
• Mirta B. Miras, Hospital de Niños de la Santísima Trinidad, Córdoba, Argentina
• Hugo Niepomniszcze, Universidad Nacional de Buenos Aires, Buenos Aires, Argentina
• Adriana Oneto, Hospital Carlos C. Durand, Buenos Aires, Argentina
• Eduardo Pusiol, Universidad Nacional de Cuyo, Mendoza, Argentina
• Gerardo C. Sartorio, Hospital J. M. Ramos Mejía, Buenos Aires, Argentina
Prefacio
Las pruebas bioquímicas constituyen el pilar fundamental para el diagnóstico y seguimiento de la enfermedad tiroidea. A pesar de los avances en los instrumentos de medición y las mejoras en la sensibilidad y especificidad de los ensayos actuales, todavía se observa variabilidad método a método y susceptibilidad a las interferencias.
La amplia variedad de herramientas disponibles para evaluar la función tiroidea, generó por parte de numerosas organizaciones profesionales la idea de racionalizar su uso mediante recomendaciones prácticas que no excluyeran la relación costo-beneficio.
La National Academy of Clinical Biochemistry (NACB), integrante de la Asociación Americana de Química Clínica, continuando con el propósito de ofrecer pautas de consenso sobre pruebas de laboratorio relacionadas con distintas patologías, alentó y respaldó la elaboración de esta monografía, dedicada a médicos y profesionales del laboratorio clínico. Sin duda, de las recomendaciones elaboradas por la NACB hasta el presente, las de Tiroides han sido las más difundidas.
Las recomendaciones surgieron a partir de un proceso colaborativo que involucró a múltiples organizaciones de todo el mundo dedicadas a estudiar los problemas de tiroides. Miembros de la Asociación Americana de Química Clínica, Asociación Americana de Endocrinología Clínica, Asociación de Tiroides de Asia y Oceanía, Asociación Americana de Tiroides, Asociación Británica de Tiroides, Sociedad Americana de Endocrinología, Asociación Europea de Tiroides y Asociación Latinoamericana de Tiroides dedicaron tiempo y experiencia a la elaboración o a la crítica del texto final y son reconocidos en el apéndice A.
El objetivo era establecer pautas de consenso a nivel internacional, y paralelamente identificar los aspectos para los cuales un consenso era muy difícil de lograrse a causa de las asimetrías culturales, político-económicas, medioambientales y nutricionales entre los distintos países.
Con la conciencia de estas divergencias, el proceso de revisión global fue considerado crítico. Pero sorprendentemente, la mayoría de las pautas contenidas en esta monografía alcanzaron un consenso superior al 95%.
El proceso llevó dos años. El primer borrador se elaboró con el valioso aporte de los manuscritos solicitados a los expertos reconocidos en el Prólogo, y fue distribuido en el Congreso Internacional de Tiroides en Kyoto en octubre del 2000 y exhibido en el sitio web de la NACB (www.nacb.org) durante el año 2001 para su discusión. Las recomendaciones básicas también fueron presentadas en sesiones destinadas a edificar el consenso en varios eventos científicos durante el mismo año.
Los resultados de estas sesiones, junto con los de la revisión electrónica, fueron utilizados para desarrollar un segundo borrador que fue puesto en el sitio web de la NACB en enero del 2002 para el comentario final. El texto fue concluido para la publicación y la visualización electrónica en junio del 2002, y fue publicado como el número de enero del 2003 de la revista Thyroid (Thyroid 2003; 13: 4-126).
La presente traducción al idioma español corresponde a esa actualización. La monografía ha sido traducida también a los siguientes idiomas: polaco, ruso, francés, y está en proceso la versión en chino.
Las recomendaciones están orientadas a integrar los aspectos técnicos de las pruebas bioquímicas y citológicas para evaluar la función tiroidea, con los criterios de comportamiento analítico necesarios para su óptima utilización clínica en un entorno global cada vez más sensible a los costos. Están diseñadas para ofrecer a médicos y bioquímicos una descripción de la robustez y de las limitaciones de estas pruebas. En este contexto, es deseable que la información presentada ayude a los médicos a actuar en forma conjunta y eficaz con el laboratorio cuando se introduzca o se cambie un método, o cuando un resultado sea discordante con la clínica del paciente. Los laboratorios, a su vez, deberían poder definir, a partir de ellas, su perfil de eficiencia óptimo.
La importancia de esta relación entre el laboratorio y los médicos se enfatiza en cada capítulo.
La monografía provee información bioquímica y clínica actualizada contenida en secciones referidas a Factores Pre-analíticos, determinación de Hormonas Tiroideas Totales y Libres, Anticuerpos Antitiroideos, TSH, Tiroglobulina, Calcitonina y proto-oncogen RET, mediciones de Yodo, Punción Aspirativa con Aguja Fina (PAAF) y Screening para el Hipotiroidismo Congénito.
Estas recomendaciones fueron objeto de unanimidad en cuanto a su necesidad, pero de manera esperable apareció la primera limitación que es la de conciliar esa necesidad con su insuficiencia actual para abarcar una realidad global.
En los intentos de consensuar, nunca es posible unificar de manera ideal todas las opiniones, especialmente cuando existen asimetrías como las mencionadas entre distintos países, por lo cual, realidades muy diferentes deberían continuar siendo abordadas de maneras originales.
Sin embargo, los procesos de consenso conllevan una necesaria gradualidad, continuando con la cual, los diálogos críticos podrán incrementarse en la medida en que con la traducción a más idiomas, la información presentada tenga aún mayor difusión.
Por otra parte, ninguna pauta debería ser estática, y es en este sentido, que se espera que los comentarios y las críticas, que puedan sumarse luego de la lectura del texto en español, puedan contribuir al enriquecimiento de una futura versión.
Liliana M. Bergoglio
Jorge H. Mestman
Carole A. Spencer
Traducción de la Edición en Idioma Inglés
EDITORES
• Laurence M. Demers, Ph.D., F.A.C.B.
• Carole A. Spencer Ph.D., F.A.C.B.
Expresamos nuestro agradecimiento a los siguientes profesionales que aportaron los manuscritos originales sobre los que se basa esta monografía:
Zubair Baloch, M.D., Ph.D. Dept. of Pathology and Laboratory Medicine, University of Pennsylvania Medical Center, Filadelfia, PA, EE.UU.
Laurence M. Demers, Ph.D., F.A.C.B. Pennsylvania State University College of Medicine
M. S. Hershey Medical Center, Hershey, PA, EE.UU.
Pierre Carayon, M.D., D.Sc. U555 INSERM and Department of Biochemistry & Molecular Biology, University of the Medeiterranea Medical School, Marsella, Francia
Bernard Conte-Devolx, M.D. Ph.D. U555 INSERM and Department of Endocrinology, University of the Medeiterranea Medical School, Marsella, Francia
Ulla Feldt Rasmussen, M.D. Department of Medicine, National University Hospital, Copenhague, Dinamarca
Jean-François Henry M.D. U555 INSERM and Department of Endocrine Surgery, University of the Medeiterranea Medical School, Marsella, Francia
Virginia LiVolsi, M.D. Dept. of Pathology and Laboratory Medicine, University of Pennsylvania Medical Center, Filadelfia, PA, EE.UU.
Patricia Niccoli-Sire, M.D. U555 INSERM and Departments of Endocrinology and Surgery, University of the Medeiterranea Medical School, Marsella, Francia
Rhys John, Ph.D., F.R.C.Path, University Hospital of Wales, Cardiff, Gales, Reino Unido
Jean Ruf, M.D. U555 INSERM and Department of Biochemistry & Molecular Biology, University of the Medeiterranea Medical School, Marsella, Francia
Peter PA Smyth, M.S., Ph.D. University College Dublin, Dublín, Irlanda
Carole A. Spencer, Ph.D., F.A.C.B. University of Southern California, Los Angeles, CA, EE.UU.
Jan R. Stockigt, M.D., F.R.A.C.P., F.R.C.P.A., Ewen Downie Metabolic Unit, Alfred Hospital, Melbourne, Victoria, Australia
Sección 1. Prólogo e Introducción
Los médicos necesitan el respaldo de un laboratorio de alta calidad para lograr un diagnóstico preciso y un manejo efectivo, y a un costo razonable de los problemas tiroideos. En algunos casos, cuando hay una sospecha clínica fuerte de disfunción tiroidea, por ejemplo en el hipertiroidismo clínico en un adulto joven, o ante la presencia de una masa tiroidea de crecimiento rápido, las pruebas de laboratorio simplemente confirman la sospecha clínica. Pero en la mayoría de los pacientes, los síntomas son tan sutiles que la patología sólo se puede detectar mediante una evaluación bioquímica o citopatológica. Independientemente de cuán evidente o poco claro sea el problema, es fundamental lograr la amplia colaboración entre médicos y profesionales del laboratorio para alcanzar un manejo óptimo y efectivo en costos del paciente.
La disfunción tiroidea, en especial el hipotiroidismo causado por deficiencia de yodo, es un problema mundial de la salud pública, pero la carencia de yodo no es un problema que afecta de manera homogénea a la población de un mismo país. Estudios tanto europeos como estadounidenses sugieren que esta deficiencia debería considerarse más bien como un "problema localizado", es decir que puede tener una mayor prevalencia en algunas áreas de un país que en otras (1-3). La creación de esta Monografía de Consenso es el resultado de un esfuerzo conjunto que involucró a muchos especialistas en tiroides de una serie de organizaciones profesionales mundiales dedicadas a la patología tiroidea: American Association of Clinical Endocrinologists (AACE), Asia & Oceania Thyroid Association (AOTA), American Thyroid Association (ATA), British Thyroid Association (BTA), European Thyroid Association (ETA) y Latin American Thyroid Society (LATS). Estas organizaciones son líderes en materia de tiroides y han publicado normas para el tratamiento de la enfermedad tiroidea en cada región del mundo. Debido a que los factores geográficos y económicos influyen en el uso de los métodos para explorar la función tiroidea, esta monografía se centrará en los aspectos técnicos de dichas pruebas y en los criterios de calidad necesarios para su utilización óptima en un entorno global cada vez más afectado por los costos. Los médicos y los laboratorios del mundo se inclinan de manera individual por diferentes estrategias para evaluar la función tiroidea (4). La presente Guía de Consenso no puede abarcar toda esta gama de opiniones, sin embargo, se espera que sus lectores aprecien los esfuerzos realizados para conciliar algunas de estas diferencias en una estrategia recomendable. El texto incluye la mayoría de los ensayos y procedimientos en general realizados para diagnosticar y tratar la enfermedad tiroidea, de manera que pueda ofrecer tanto al bioquímico como al médico un panorama general de la capacidad y de las limitaciones actuales de aquellos de uso más generalizado. Las recomendaciones se acordaron con un 95% de consenso, a menos que se indique lo contrario. Se halla abierta la recepción de comentarios que pudieran mejorar la presente monografía para una próxima revisión.
A. Recursos adicionales
Las recomendaciones clínicas vigentes, están publicadas en las referencias (4-11). Además, los libros de texto "Thyroid" y "The Thyroid and Its Diseases" (www.thyroidmanager.org) son también referencias útiles (12)(13). El sitio web de la American Thyroid Association (ATA) (www.thyroid.org) ofrece una lista de los síntomas que sugieren enfermedad tiroidea, junto con los códigos ICD-9 recomendados a Medicare. Las recomendaciones pueden variar en función de las diferentes regiones del mundo. Se puede obtener mayor información en cada una de las organizaciones nacionales e internacionales de tiroides: Asia & Oceania Thyroid Association (AOTA: www.dnm.kuhp.kyoto-u.ac.jp/AOTA); American Thyroid Association (ATA: www.thyroid.org); European Thyroid Association (ETA: www.eurothyroid.com) y Latin American Thyroid Society (LATS: www.lats.org).
B. Perspectiva histórica
Durante los últimos cuarenta años los avances en la sensibilidad y especificidad de los métodos bioquímicos para evaluar la función tiroidea, el desarrollo de la punción aspirativa con aguja fina (PAAF) y las mejoras en las técnicas citológicas han tenido un notable impacto en las estrategias clínicas para diagnosticar y tratar la enfermedad tiroidea. En la década del 50 sólo se disponía de una prueba tiroidea sérica, una estimación indirecta de la concentración de tiroxina total circulante (TT4) (libre y unida a proteínas), mediante la técnica del yodo unido a proteínas (PBI). En la actualidad, la concentración urinaria de yodo se determina directamente mediante las técnicas de cenizas secas o húmedas y se la utiliza para calcular la ingesta de yodo en la dieta. El desarrollo de inmunoensayos competitivos a principios de la década del 70 y más recientemente de ensayos inmunométricos sandwich no competitivos (IMA) ha mejorado gradualmente la especificidad y sensibilidad de los ensayos tiroideos. Actualmente están disponibles las determinaciones séricas de hormonas tiroideas circulantes totales (T4T y T3T) y libres (T4L y T3L) (14)(15). Además, se cuenta con las determinaciones de proteínas transportadoras de hormonas tiroideas: Globulina transportadora de tiroxina (TBG), Transtiretina (TTR)/Prealbúmina (TBPA) y Albúmina (16). Los avances en la sensibilidad de los ensayos de Tirotrofina (TSH), posibilitaron su uso para la detección tanto del hiper como del hipotiroidismo. Además, las determinaciones séricas de Tiroglobulina (Tg), proteína precursora de las hormonas tiroideas, y de Calcitonina (CT) se han convertido en importantes marcadores tumorales para el manejo de pacientes con carcinomas tiroideos diferenciados y medulares, respectivamente. El reconocimiento de que la autoinmunidad es una causa muy importante de disfunción tiroidea ha conducido al desarrollo de métodos más sensibles y específicos para autoanticuerpos anti-peroxidasa tiroidea (TPOAb), anti-tiroglobulina (TgAb) y anti-receptor de TSH (TRAb). Actualmente, los ensayos tiroideos de rutina se realizan en muestras de suero por métodos automáticos o manuales que utilizan anticuerpos específicos (17). La metodología continúa evolucionando a medida que se establecen normas de calidad y se desarrollan nuevas tecnologías e instrumentos.
Sección 2. Factores pre-analíticos
Afortunadamente, la mayor parte de las variables pre-analíticas tienen poco efecto en la determinación de TSH, el análisis más comúnmente utilizado para evaluar el estado tiroideo en pacientes ambulatorios. Las variables analíticas, y la presencia de sustancias interferentes en la muestra, pueden influir en la unión de las hormonas tiroideas a las proteínas plasmáticas, y así disminuir la exactitud de un diagnóstico basado en las determinaciones de hormonas tiroideas totales y libres más que en las de TSH (Tabla I). Como se discutirá más adelante [Sección-2 B2 y Sección-3 B3(c)viii] los valores de T4L y de TSH pueden conducir a diagnósticos erróneos en pacientes hospitalizados con enfermedades severas no tiroideas (NTI). De hecho, estos pacientes eutiroideos, con frecuencia presentan valores anormales de TSH y/o de hormonas tiroideas totales y libres. Lo mismo puede ocurrir por ingestión de medicamentos que interfieren con la secreción o la síntesis hormonal. Cuando existe una sospecha importante de que alguna de estas variables pudiera afectar los resultados de los ensayos, es necesario consultar con el médico o el bioquímico especialistas.
Tabla I. Causas de discordancia entre T4L y TSH en ausencia de enfermedad grave asociada.

Además de la variabilidad fisiológica intrínseca, factores individuales, tales como anormalidades genéticas en las proteínas transportadoras, o enfermedades severas no tiroideas (NTI) pueden influir en la sensibilidad y en la especificidad clínicas de un ensayo. Asimismo, factores iatrogénicos como la administración de medicamentos tiroideos y no tiroideos (por ejemplo: glucocorticoides, betabloqueantes), y otros factores en la muestra, como la presencia de autoanticuerpos anti-hormonas tiroideas, anti-Tg, y anticuerpos heterófilos (HAMA) puede afectar la exactitud del diagnóstico al conducir a una interpretación errónea del resultado de un ensayo. La Tabla II enumera los factores pre-analíticos que se deben considerar en la interpretación de los ensayos tiroideos.
Recomendación Nº 1. Orientación General para los Laboratorios y los Médicos
• Los laboratorios deberían conservar (entre 4 y 8 ºC) las muestras de suero utilizadas para los ensayos tiroideos por lo menos durante una semana después de que se hayan informado los resultados a fin de permitir a los médicos solicitar pruebas adicionales.
• Las muestras provenientes de pacientes con cáncer diferenciado de tiroides (CDT) enviadas para determinaciones de Tiroglobulina (Tg) sérica se deberían conservar (a -20 °C) durante seis meses como mínimo.

Tabla II.
A. Variables fisiológicas
En la práctica, en los adultos ambulatorios, variables como edad, sexo, raza, estación del año, fase del ciclo menstrual, hábito de fumar, actividad física, ayuno o estasis venosa inducida por la flebotomía, ejercen efectos menores sobre los rangos de referencia de los ensayos tiroideos (18). Dado que las diferencias debido a estas variables fisiológicas son menores que las diferencias entre los distintos métodos de ensayo, se las considera insignificantes, en la práctica clínica.
1. Relación TSH / T4L
La comprensión de la relación normal que existe entre los niveles séricos de T4 libre (T4L) y TSH es esencial para la interpretación de los ensayos tiroideos. Un eje hipotálamo-hipofisario intacto es un requisito necesario si se quieren usar las determinaciones de TSH para diagnosticar disfunción tiroidea primaria (19). Varias condiciones clínicas y agentes farmacológicos pueden alterar la relación T4L / TSH. Como muestra la Tabla I es más frecuente encontrar falsos resultados en la determinación de T4L que en la de TSH.
Cuando la función hipotálamo-hipofisaria es normal, se produce una relación logarítmica / lineal inversa entre la TSH y la T4L séricas por la retroalimentación negativa que ejercen las hormonas tiroideas inhibiendo la secreción de TSH hipofisaria. Por lo tanto, la función tiroidea se puede determinar directamente, midiendo el producto primario de la glándula tiroides, T4 (preferentemente como T4 libre) o indirectamente, midiendo TSH, que refleja (de manera inversa) la concentración de la hormona tiroidea detectada por la hipófisis. De esto se desprende que una TSH elevada y una T4L baja son características del hipotiroidismo, mientras que una TSH baja y una T4L elevada lo son del hipertiroidismo. De hecho, desde que ha mejorado la sensibilidad y especificidad de los ensayos de TSH, se acepta que el procedimiento indirecto (determinación de TSH sérica) ofrece una mayor sensibilidad para la detección de disfunción tiroidea que el procedimiento directo (determinación de T4L) (10).
Existen dos razones para utilizar una estrategia diagnóstica basada en la TSH para pacientes ambulatorios:
1) Como lo muestra la Figura 1, las concentraciones séricas de TSH y de T4L presentan una relación inversa logarítmica / lineal, de manera tal que ligeras modificaciones en la T4L producirán una respuesta mucho mayor (amplificada) en la TSH (20).

Fig 1. Relación entre la TSH y la T4L séricas en individuos que presentan un estado tiroideo estable y una función hipotálamo-hipofisaria normal. Adaptado de la referencia (20).
2) Las variaciones individuales en los valores de los ensayos tiroideos junto con estudios realizados en gemelos sugieren que cada individuo tiene un nivel propio de T4L genéticamente determinado (21)(22). Cualquier exceso o deficiencia leves de T4L será detectado por la hipófisis con relación al valor de T4L propio de ese individuo en particular, y provocará una respuesta amplificada e inversa en la secreción de TSH. aEn consecuencia, en las primeras etapas de la disfunción tiroidea, una anormalidad en la TSH precederá a una anormalidad en la T4L, ya que la TSH responde exponencialmente a cambios sutiles de la T4L que aún se halla dentro de los límites de referencia de la población. Esto se debe a que los límites de referencia de T4L de la población son amplios, y reflejan los diferentes niveles individuales de la cohorte de sujetos normales incluidos en el estudio para determinar el rango de referencia.
Recomendación Nº 2. Ensayos para evaluar la función tiroidea en pacientes ambulatorios
• Pacientes con estado tiroideo estable: Cuando el estado tiroideo es estable y la función hipotálamo-hipofisaria está intacta, la determinación de TSH es más sensible que la de T4L para detectar exceso o deficiencia leves (subclínicos) de hormonas tiroideas. La mayor sensibilidad diagnóstica de la TSH refleja la relación logarítmica/ lineal que existe entre TSH y T4L, y la gran sensibilidad de la hipófisis para detectar las anormalidades de T4L en relación con el nivel genéticamente determinado para cada individuo.
• Pacientes con estado tiroideo inestable: La determinación de T4L es un indicador más confiable del estado tiroideo que la TSH cuando el estado tiroideo es inestable, como por ejemplo durante los 2 ó 3 primeros meses de tratamiento para el hipo o el hipertiroidismo. Los pacientes con hipotiroidismo severo crónico pueden desarrollar hiperplasia del tirotrofo hipofisario que quizás simule un adenoma hipofisario, pero que se resuelve después de varios meses de tratamiento con L-T4. En pacientes hipotiroideos en los que se sospecha falta de cumplimiento con la terapia de reemplazo con L-T4, el seguimiento se debería realizar con ambas determinaciones: TSH y T4L, ya que estos pacientes pueden presentar valores discordantes de TSH y de T4L (TSH elevada / T4L elevada) debido a un desequilibrio persistente entre ambas.
En la actualidad, la determinación de TSH sérica es el indicador más confiable del estado tiroideo a nivel tisular. En los estudios de exceso o deficiencia leves de hormona tiroidea (TSH anormal / T4L y T3L normales) se observan anormalidades en los marcadores de acción de la hormona tiroidea en diversos tejidos (corazón, cerebro, hueso, hígado y riñón). Estas anormalidades generalmente se revierten cuando se inicia el tratamiento para normalizar la TSH (23-26).
Es importante reconocer las situaciones clínicas en las que los valores de TSH o de T4L pueden generar un diagnóstico erróneo. Entre ellas se incluyen anormalidades en la función hipotalámica o hipofisaria, incluyendo tumores hipofisarios productores de TSH (27-29). Además, como se muestra en la Figura 2, los valores de TSH resultan equívocos para el diagnóstico durante los períodos transitorios de estado tiroideo inestable, como el que se presenta en la fase temprana del tratamiento para el hiper o el hipotiroidismo, o en el cambio de dosis de L-T4. Se necesitan entre 6 y 12 semanas para que la TSH hipofisaria se reequilibre de acuerdo al nuevo estado de hormonas tiroideas (30). Estos períodos de estado tiroideo inestable también pueden presentarse luego de una tiroiditis, incluyendo la tiroiditis post parto durante la cual es posible observar discordancia entre TSH y T4L.
Las drogas que influyen en la secreción hipofisaria de TSH (por ejemplo, dopamina, glucocorticoides, etc.) o que alteran la unión de las hormonas tiroideas a las proteínas plasmáticas, también pueden provocar valores discordantes de TSH [Sección-3 B3(c)vi].

Fig 2. Demora en la reestabilización de la TSH hipofisaria durante los períodos de transición con estado tiroideo inestable posteriores al tratamiento del hiper o del hipotiroidismo.
2. Efectos de la edad cronológica sobre los rangos de referencia de los ensayos tiroideos
(a) Adultos
A pesar de que ciertos estudios muestran diferencias leves entre individuos jóvenes y de mayor edad, no es necesario desarrollar rangos de referencia ajustados por edad en adultos, para hormonas tiroideas ni para TSH (18)(31-33). Con respecto a los individuos añosos eutiroideos, el valor medio de TSH aumenta cada década, lo mismo que la prevalencia de concentraciones bajas y altas, en comparación con individuos más jóvenes (18)(34)(35). A pesar de la amplia variabilidad de TSH sérica observada a su vez en individuos de mayor edad, tampoco parece justificarse el uso de un rango de referencia más amplio ni ajustado por edad en estos individuos (31)(32). Este enfoque conservador se justifica en base a estudios que sostienen que la TSH sérica ligeramente suprimida o elevada se asocia con un aumento en la morbilidad y mortalidad cardiovasculares (36)(37).
(b) Neonatos, infantes y niños
En los niños, el eje hipotálamo-hipófiso-tiroideo sufre una maduración y un cambio progresivos. Específicamente, hay una continua disminución en la relación TSH/T4L desde la mitad de la gestación hasta que se completa la pubertad (38-43). Como resultado, en los niños habitualmente se observan concentraciones más altas de TSH (44). Este proceso de maduración determina el uso en pediatría de límites de referencia específicos para cada edad. Sin embargo, existen diferencias significativas entre las determinaciones de T4L y de TSH en función de los métodos empleados [ver Secciones 3B y 3C]. Debido a que la mayoría de los fabricantes de equipos de reactivos no ha establecido intervalos de referencia específicos para cada edad, estos pueden ser calculados para los diferentes ensayos ajustando los límites superior e inferior del rango de referencia adulto por medio de la relación entre los valores de niños vs adultos, como se indica en la Tabla III.
Durante el período neonatal, en la deprivación calórica y en las personas añosas, se observa una disminución en la T3 sérica total y libre (determinadas por la mayoría de los métodos) En el último trimestre del embarazo la T3 libre también se encuentra disminuida (15). Además, es típico observar concentraciones más elevadas de T3 total y libre en niños eutiroideos. Esto sugiere que el límite superior de T3 para pacientes jóvenes (menores de 20 años) debería establecerse como un gradiente: entre 6,7 pmol/L (4,4 pg/mL) para los adultos y 8,3 pmol/L (5,4 pg/mL) para los niños menores de 3 años de edad (45).
Las concentraciones de TSH y T4L son más altas en niños, especialmente en la primera semana de vida y durante el primer año. No reconocer esto podría provocar la pérdida del diagnóstico o el subtratamiento de casos de hipotiroidismo congénito.
Deberían usarse valores de referencia ajustados por edad para todos los ensayos (Tabla III).

Fig 2. Demora en la reestabilización de la TSH hipofisaria durante los períodos de transición con estado tiroideo inestable posteriores al tratamiento del hiper o del hipotiroidismo.
Recomendación Nº 3. Ensayos para evaluar la función tiroidea en niños
El eje hipotálamo-hipófiso-tiroideo madura durante la infancia hasta el final de la pubertad.
• Las concentraciones de TSH y T4L son más altas en niños, especialmente en la primera semana de vida y durante el primer año. No reconocer esto podría provocar la pérdida del diagnóstico o el subtratamiento de casos de hipotiroidismo congénito.
• Deberían usarse valores de referencia ajustados por edad para todos los ensayos. (Ver Tabla III)
3. Embarazo
Durante el embarazo, la producción de estrógenos aumenta progresivamente, elevando la concentración de TBG. Los valores de TBG aumentan al doble o triple de los niveles previos al embarazo, y alcanzan un plateau hacia las 20 semanas de gestación (46)(47). Este aumento de TBG provoca un cambio en los rangos de referencia de T4T y T3T hacia las 16 semanas de gestación de aproximadamente 1,5 veces con respecto a los niveles de no embarazadas (48-50). Estos cambios se asocian con una disminución en la TSH sérica durante el primer trimestre, de modo que es posible observar valores subnormales de TSH en aproximadamente el 20% de los embarazos normales (46)(47)(51). Esta disminución en la TSH se atribuye a la actividad estimulante de la tiroides de la gonadotropina coriónica humana (hCG), que tiene homología estructural con la TSH (52)(53). El pico de hCG y el nadir de TSH se producen simultáneamente alrededor de las 10 a 12 semanas de gestación. En aproximadamente el 10% de esos casos (es decir, en el 2% de todos los embarazos), el aumento de T4 libre alcanza valores supranormales, que cuando se prolongan, pueden provocar un síndrome denominado "tirotoxicosis gestacional transitoria" (TGT) caracterizado por síntomas y signos más o menos pronunciados de tirotoxicosis (52-54). Esta condición se asocia con frecuencia con hiperemesis en el primer trimestre del embarazo (55)(56).
La disminución de TSH durante el primer trimestre del embarazo se asocia con un modesto aumento de T4L (46)(47)(51). A partir de entonces, en el segundo y tercer trimestres se ha consensuado una disminución de T4L y T3L de aproximadamente entre el 20 y el 40 por ciento por debajo de la media normal, disminución que se intensifica cuando el estado nutricional de la madre con respecto al yodo está restringido o es deficiente (46)(47)(51). En algunos casos, la T4L puede caer por debajo del límite inferior de referencia para pacientes no embarazadas (51, 57-60). La frecuencia de concentraciones de T4L subnormales es dependiente del método utilizado para la determinación (57)(59)(60). Las pacientes que reciben terapia de reemplazo con L-T4 y quedan embarazadas pueden necesitar un aumento en la dosis para mantener los niveles de TSH normales (61)(62). El estado tiroideo de dichas pacientes se debería controlar con TSH + T4L en cada trimestre. La dosis de L-T4 se debería ajustar para mantener normales las concentraciones de TSH y de T4L. Las concentraciones séricas de Tg, en general aumentan durante el embarazo normal (46). Las pacientes con carcinoma diferenciado de tiroides (CDT) con tejido tiroideo remanente, muestran un incremento característico de dos veces en la Tg sérica, que vuelve al nivel basal hacia las 6 a 8 semanas después del parto.
La disminución en la disponibilidad de hormonas tiroideas maternas puede ser un factor crítico que dañe el desarrollo neurológico del feto en las etapas iniciales de gestación, antes de que la glándula tiroides fetal se active. Varios estudios recientes informan aumento de pérdida fetal y déficit del coeficiente intelectual en los infantes nacidos de madres con hipotiroidismo no diagnosticado, T4L baja o TPOAb positivos (63-65). Sin embargo, un estudio sugiere que el diagnóstico y tratamiento precoces del hipotiroidismo leve pueden evitar los efectos a largo plazo de los niveles bajos de hormonas tiroideas sobre los sistemas sicomotor y auditivo de los neonatos (66).
Recomendación Nº 4. Ensayos para evaluar la función tiroidea en pacientes embarazadas
Es cada vez mayor la evidencia que sugiere que el hipotiroidismo durante los primeros meses de embarazo tiene un efecto perjudicial sobre el feto (pérdida fetal) y sobre el infante (menor coeficiente intelectual).
• Es importante realizar un screening para disfunción tiroidea determinando TSH y TPOAb antes del embarazo o durante el primer trimestre, tanto para detectar insuficiencia tiroidea leve (TSH > 2,5 mUI/L) como para evaluar el riesgo de tiroiditis post parto (TPOAb elevados).
• Debería considerarse un tratamiento con levotiroxina (L-T4) si el nivel de TSH sérica es >2,5 mUI/L en el primer trimestre de embarazo.
• Una concentración elevada de TPOAb durante el primer trimestre es un factor de riesgo para tiroiditis post parto.
• La TSH debería utilizarse para evaluar el estado tiroideo durante cada trimestre cuando las embarazadas reciben tratamiento con L-T4, con determinaciones más frecuentes si se cambia la dosis.
• Deberían utilizarse intervalos de referencia específicos para cada trimestre en los ensayos para embarazadas.
• Las determinaciones de T4T y T3T pueden resultar útiles durante el embarazo si no se dispone de determinaciones confiables de T4L, siempre que los rangos de referencia se aumenten 1,5 veces en relación con los rangos de no embarazadas.
• Los rangos de referencia de T3L y T4L durante el embarazo son dependientes del método empleado y deberían establecerse para cada uno de ellos.
• Deberían evitarse las determinaciones de tiroglobulina sérica (Tg) en los pacientes con CDT durante el embarazo. La Tg sérica se eleva durante el embarazo normal y vuelve a los niveles basales después del parto. Este aumento también se observa en las pacientes con CDT, con tiroides normal remanente o con tejido tumoral presente, y esto no debe ser necesariamente una causa de alarma.
B. Variables patológicas
1. Medicamentos
Los medicamentos pueden provocar efectos tanto in vivo como in vitro en los ensayos tiroideos. Esto puede generar una interpretación errónea de los resultados de laboratorio, diagnósticos inadecuados, pruebas adicionales innecesarias y aumento en los costos de salud (67)(68).
(a) Efectos in vivo
En general, los medicamentos afectan más las concentraciones de hormonas tiroideas que las de TSH (Tabla I). Por ejemplo, el aumento de TBG inducido por estrógenos incrementa los niveles de T4T pero no afecta la concentración de TSH, porque la secreción hipofisaria de TSH es controlada por la T4L independientemente de los efectos de las proteínas transportadoras. Los glucocorticoides en dosis elevadas pueden disminuir el nivel de T3 sérica e inhibir la secreción de TSH (69)(70). También la dopamina inhibe la secreción de TSH e incluso puede enmascarar el aumento del nivel de TSH del hipotiroidismo primario en pacientes enfermos hospitalizados (71). El propranolol, a veces utilizado para tratar las manifestaciones de tirotoxicosis tiene un efecto inhibitorio de la conversión de T4 a T3, y administrado en dosis altas a individuos sin enfermedad tiroidea, puede provocar una elevación de TSH como resultado de esta conversión alterada (72).
El yodo, contenido en las soluciones desinfectantes de la piel, en los medios de contraste radiopacos usados en las coronariografías y en las tomografías computadas, puede provocar hiper e hipotiroidismo en individuos predispuestos (73). Además, la amiodarona (medicamento antiarrítmico que contiene yodo) utilizado para el tratamiento de las cardiopatías tiene efectos complejos sobre la función tiroidea y puede producir tanto hipo como hipertiroidismo en individuos predispuestos, con TPOAb positivos (74-78). Los pacientes tratados con L-T4 que toman amiodarona pueden tener niveles de TSH anormalmente elevados en relación con su concentración de T4L (75). Dos tipos de hipertiroidismo inducido por amiodarona (HIA) pueden desarrollarse durante el tratamiento, aunque se observan formas mixtas en el 20% de los casos. A veces A veces es difícil distinguir entre los dos tipos. Un flujo sanguíneo reducido en el examen por Doppler Color y el aumento de interleuquina-6 sugieren el Tipo II (79)(80). Si la etiología es incierta, se debe orientar el tratamiento hacia los Tipos I y II.
• Tipo 1: El HIA parece inducido en las glándulas tiroides anormales por el exceso de yodo que contiene el medicamento. Se ha utilizado una combinación de tionamidas y perclorato de potasio para tratar estos casos.
• Tipo II: El HIA parece resultar de una tiroiditis destructiva que generalmente se trata con prednisona y tionamidas. Algunos estudios informan niveles elevados de IL-6 en el Tipo II (79). La T3 sérica (libre y total) es típicamente baja durante el tratamiento. Un valor de T3 paradójicamente normal o elevado es útil para reforzar el diagnóstico de hipertiroidismo inducido por amiodarona.
Recomendación Nº 5. Ensayos para evaluar la función tiroidea en pacientes tratados con amiodarona
El tratamiento con amiodarona puede inducir el desarrollo de hipo-o hipertiroidismo entre el 14 y el 18% de los pacientes con glándula tiroides aparentemente normal o con anormalidades preexistentes
• Antes de instaurar el tratamiento. Examen físico completo de tiroides y determinaciones de TSH y TPOAb basales. Las determinaciones de T4L y de T3L sólo son necesarias si la TSH es anormal. Los TPOAb positivos son un factor de riesgo para el desarrollo de disfunción tiroidea durante el tratamiento.
• Primeros 6 meses. Se pueden observar pruebas de laboratorio anormales en los primeros seis meses de iniciada la terapia. La TSH puede ser discordante con las hormonas tiroideas (TSH elevada/ T4 elevada / T3 baja), y generalmente se normaliza durante el curso de un tratamiento a largo plazo si los pacientes permanecen eutiroideos.
• Seguimiento a largo plazo. Controlar el estado tiroideo cada 6 meses con TSH. La TSH es el indicador más confiable del estado tiroideo durante el tratamiento.
• Hipotiroidismo. Una tiroiditis de Hashimoto preexistente y/o un valor positivo de TPOAb es un factor de riesgo para el desarrollo de hipotiroidismo en cualquier momento del tratamiento.
• Hipertiroidismo. Un valor bajo de TSH sugiere hipertiroidismo. La T3 (total y libre) generalmente permanece baja durante el tratamiento pero puede ser normal. Una T3 alta sugiere hipertiroidismo.
Durante el tratamiento, es posible que se desarrollen dos tipos de hipertiroidismo inducido por amiodarona, si bien es frecuentge observar formas mixtas (en el 20% de los casos). La distinción entre los dos tipos, con frecuencia es difícil. Un flujo sanguíneo reducido en el examen por Doppler Color y la elevación de interleuquina-6 sugieren el Tipo II. Si la etiología es incierta dirigir el tratamiento a los dos tipos, I y II.
** Tipo I = Inducido por yodo. El tratamiento recomendado es la administración simultánea de tionamidas y perclorato de potasio (si está disponible). Algunos recomiendan ácido iopanoico antes de la tiroidectomía. La mayoría de los grupos recomienda la interrupción de la amiodarona. El tipo I se observa con mayor frecuencia en zonas de baja ingesta de yodo. Sin embargo, en áreas donde el aporte de yodo es suficiente, las captaciones de yodo radiactivo pueden ser bajas excluyendo el radioyodo como opción terapéutica. En regiones con deficiencia de yodo, las captaciones pueden ser normales o elevadas.
Tipo Ia: Bocio nodular. Más frecuente en zonas geográficas con deficiencia de yodo, por ejemplo en Europa.
Tipo Ib: Enfermedad de Graves. Más frecuente en zonas geográficas suficientes en yodo, por ejemplo en Estados Unidos.
** Tipo II = tiroiditis destructiva inducida por amiodarona, enfermedad auto limitada.
Tratamiento recomendado: glucocorticoides y/o betabloqueantes si el estado cardíaco lo permite. Cuando el hipertiroidismo es severo, se puede considerar la cirugía con pre-tratamiento con ácido iopanoico. La captación de yodo radiactivo es típicamente baja o inhibida. El Tipo II se observa con mayor frecuencia en áreas suficientes en yodo.
El tratamiento con Litio puede causar hipo o hipertiroidismo en por lo menos el 10% de los pacientes, especialmente en aquellos con TPOAb detectables (81-83). Algunos agentes terapéuticos y diagnósticos (por ejemplo, Fenitoína, Carbamazepina o Furosemida) pueden inhibir competitivamente la unión de la hormona tiroidea a las proteínas transportadoras en la muestra, y provocar un aumento agudo de T4L que resulta en una disminución de T4T por un mecanismo de retroalimentación (disminución de TSH) y de una mayor eliminación de T4 [ver Sección-3 B3(c)vi].
(b) Efectos in vitro
La administración de Heparina por vía intravenosa, puede liberar ácidos grasos libres (FFA) por la estimulación in-vitro de la lipoproteína lipasa, que inhibe la unión de la T4 a las proteínas séricas, y eleva artificialmente la T4L [Sección-3 B3(c)vii] (84). En ciertas condiciones patológicas como la insuficiencia renal, elementos séricos anormales como el ácido indol acético, se pueden acumular e interferir con la unión de las hormonas tiroideas (85). Los métodos de ensayos tiroideos que utilizan señales fluorescentes pueden ser sensibles a la presencia en la muestra de agentes fluorósforos terapéuticos o de diagnóstico (86).
2. Enfermedades no tiroideas (NTI).
Los pacientes en estado grave a menudo presentan anormalidades en sus pruebas de laboratorio tiroideas pero normalmente no tienen disfunción tiroidea (87)(88). Estas anormalidades se observan en las enfermedades críticas tanto agudas como crónicas, y se consideran el resultado de una inhibición central "desadaptada" de las hormonas liberadoras del hipotálamo, incluido el TRH (89)(90). Para describir este subgrupo de pacientes a menudo se utilizan los términos "enfermedad no tiroidea", (nonthyroidal illness o NTI) así como también "enfermo eutiroideo" y "síndrome de T3 baja" (91). Como se muestra en la Figura 3, el espectro de cambios en los ensayos tiroideos se relaciona tanto con la severidad como con la etapa de la enfermedad, así como con factores técnicos que afectan los métodos y en ciertos casos, con los medicamentos administrados a estos pacientes.
Se ha demostrado que las determinaciones de T4L y de TSH tienen una especificidad reducida para detectar disfunción tiroidea en los pacientes que tienen NTI severas, en comparación con los pacientes ambulatorios (20)(92)(93). Generalmente se recomienda que la evaluación de la función tiroidea en pacientes hospitalizados se limite a los que tienen síntomas clínicos o antecedentes de disfunción tiroidea (93). Las razones que explican la especificidad reducida de los ensayos tiroideos en estas circunstancias son multifactoriales. Muchos de estos pacientes reciben medicamentos tales como dopaminérgicos, glucocorticoides, furosemida o heparina que inhiben directamente la secreción hipofisaria de TSH o indirectamente la unión de T4 a proteínas, como se describió anteriormente. Además, se ha demostrado que en ciertas condiciones patológicas, las afinidades de las proteínas transportadoras están reducidas, posiblemente por la presencia de inhibidores endógenos circulantes (60)(85)(94-96).
La mayoría de los pacientes hospitalizados tienen T3T y T3L bajas, determinadas por la mayoría de los métodos (14)(97). A medida que aumenta la severidad de la enfermedad, generalmente cae también la T4T debido a una ruptura de las afinidades de las proteínas transportadoras, causada probablemente por los inhibidores de la unión de T4 presentes en la circulación (91)(98)(99). Cabe observar que los valores subnormales de T4T sólo se manifiestan cuando la gravedad de la enfermedad es crítica (generalmente en las sepsis). Este tipo de pacientes habitualmente está en la UTI (unidad de terapia intensiva). Si una T4T baja no se asocia con una TSH alta (>20mUI/L) y el paciente no está gravemente enfermo, se debería considerar un diagnóstico de hipotiroidismo central secundario a una deficiencia hipofisaria o hipotalámica.
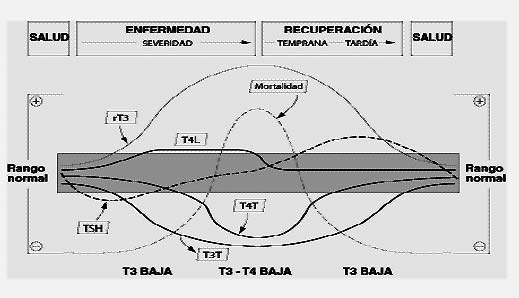
Fig. 3. Cambios en los resultados de los ensayos tiroideos durante el curso de una NTI.
Las estimaciones de los valores de T4L y de T3L dependen del método utilizado, y pueden estar falsamente elevados o disminuidos en función de los principios metodológicos en los que se basa el ensayo. Por ejemplo, los ensayos de T4L no son confiables si el método es sensible a la liberación de ácidos grasos libres generados in vitro después de la inyección de heparina intravenosa [ver Sección-3 B3(c)vii], o a los artefactos de dilución (84)(94) (97)(98)(100)(101). Los métodos de T4L como la diálisis de equilibrio y la ultrafiltración que separan físicamente la hormona libre de la unida a proteínas, habitualmente generan valores normales o elevados en pacientes en estado crítico [véase Sección-2 B2 y Sección-3 B3(c)viii] (94)(102). Los valores elevados, a menudo representan los efectos de la heparina administrada por vía intravenosa (101).
Las concentraciones de TSH sérica permanecen dentro de los límites normales en la mayoría de los pacientes con NTI, siempre que no se les administre dopamina ni glucocorticoides (87)(93). Sin embargo, en las NTI agudas, puede haber una disminución leve y transitoria de TSH en el rango de 0,02-0,3 mIU/L, seguido de un rebote a valores ligeramente elevados durante la fase de recuperación (103). En el ambiente hospitalario, es fundamental usar un ensayo de TSH con sensibilidad funcional óptima: < 0,02 mIU/L. Sin esta sensibilidad, es imposible diferenciar de manera confiable los pacientes hipertiroideos enfermos con valores realmente bajos de TSH
(< 0,02 mUI/L), de los pacientes que simplemente tienen una supresión leve y transitoria originada por la NTI (0,02-0,3 mUI/L). Las elevaciones menores de TSH son menos confiables para el diagnóstico de hipotiroidismo en el medio hospitalario. Los pacientes hipotiroideos enfermos presentan típicamente una combinación característica de T4 baja y TSH elevada (> 20 mUI/L) (92).
Es claro que el diagnóstico y tratamiento de la disfunción tiroidea en presencia de una NTI severa no es simple y que requiere la intervención de un especialista endocrinólogo. El tratamiento empírico del estado de T4T baja en las NTI no ha producido mejoras (en la supervivencia por ejemplo), y aún se lo considera experimental (104-106). Para evaluar a estos pacientes, los ensayos de T4T pueden resultar más útiles que los inmunoensayos de T4L actualmente disponibles, los cuales presentan una importante variabilidad en la eficiencia diagnóstica, siempre que los valores de T4T sean interpretados en relación con la gravedad de la enfermedad. Por ejemplo, un valor bajo de T4T en las NTI se observa fundamentalmente en los pacientes graves, en general en la unidad de cuidados intensivos (71). Valores bajos de T4T en pacientes hospitalizados que no se encuentran gravemente enfermos deberían instar a la búsqueda de un hipotiroidismo. Aunque la especificidad diagnóstica de la TSH se reduce en presencia de enfermedades somáticas, un valor detectable en el rango de 0,02-20 mUI/L, obtenido con un ensayo con sensibilidad funcional < 0,02 mUI/L, normalmente excluye una disfunción tiroidea significativa, siempre que la función hipotálamo-hipofisaria esté intacta y que el paciente no esté recibiendo medicamentos que afecten la secreción hipofisaria de TSH. Sin embargo, es mejor evitar en lo posible las pruebas tiroideas de rutina en pacientes hospitalizados.
Recomendación Nº 6. Ensayos para evaluar la función tiroidea en pacientes hospitalizados con enfermedad no tiroidea (NTI)
• Las enfermedades no tiroideas agudas o crónicas tienen efectos complejos sobre los resultados de los ensayos de la función tiroidea. Siempre que sea posible, las pruebas diagnósticas deberían postergarse hasta la resolución de la enfermedad, excepto cuando los antecedentes del paciente o su cuadro clínico sugieran la presencia de disfunción tiroidea.
• Los médicos deberían reconocer que ciertos ensayos tiroideos son fundamentalmente no interpretables en pacientes gravemente enfermos o a quienes se están administrando numerosos medicamentos.
• La TSH en ausencia de la administración de dopamina o de glucocorticoides, es la determinación más confiable en pacientes con NTI.
• Las estimaciones de T4 libre o las determinaciones de T4 total en presencia de una NTI deberían interpretarse con cuidado, y en conjunción con la TSH sérica. Las determinaciones combinadas de T4 + TSH constituyen el modo más confiable de distinguir una verdadera disfunción tiroidea primaria (anormalidades concordantes T4/TSH) de las anormalidades transitorias resultantes de las NTI per se (anormalidades discordantes T4/TSH).
• Un ensayo de T4L anormal en presencia de una enfermedad somática severa no es confiable, ya que los métodos de T4L utilizados por los laboratorios clínicos carecen de especificidad diagnóstica para evaluar este tipo de pacientes.
• Un resultado de T4L anormal en un paciente hospitalizado se debería confirmar con una T4T "refleja". Es posible que exista patología tiroidea si los valores de T4T y T4L son anormales (en el mismo sentido). Si hay discordancia entre los valores de T4T y T4L, es probable que la anormalidad en la T4L no se deba a una disfunción tiroidea sino que sea consecuencia de la enfermedad, de los medicamentos administrados o de un artefacto del método.
• Las anormalidades de T4T deberían ser interpretadas en relación con la severidad de la enfermedad, ya que una T4T baja en presencia de NTI generalmente sólo se ve en pacientes severamente enfermos con una alta tasa de mortalidad. Una T4T baja en un paciente que no está en la unidad de cuidados intensivos indica sospecha de hipotiroidismo.
• Un aumento de T3 total o libre es un indicador útil de hipertiroidismo en un paciente hospitalizado, pero una T3 normal o baja no lo descarta.
• La determinación de T3 reversa (r-T3) rara vez es útil en el ambiente hospitalario, porque valores paradójicamente normales o bajos pueden resultar de un daño en la función renal o de las concentraciones bajas de proteínas transportadoras. Además, el ensayo no está directamente disponible en la mayoría de los laboratorios.
C. Variables de las muestras
1. Estabilidad
Pocos estudios han examinado los efectos de la conservación de las muestras de sangre sobre las concentraciones de las hormonas tiroideas séricas totales y libres, de TSH y de Tg (107). En general, estos estudios sugieren que las hormonas tiroideas son relativamente estables si la muestra es conservada a temperatura ambiente, refrigerada o congelada. Ciertos estudios han mostrado que la T4 sérica es estable durante meses a +4 ºC o durante años a -10 ºC (108)(109). La TSH y T4T de las gotas secas de sangre total utilizadas en el screening del hipotiroidismo neonatal también son estables durante meses si se las conserva con un desecante. Se ha informado que la TSH sérica es ligeramente más estable que la T4 (110). No obstante, es importante destacar, como se discutió anteriormente, que las muestras no congeladas de pacientes que reciben heparina pueden generar in vitro ácidos grasos libres, que pueden provocar una falsa elevación de T4L cuando es determinada por ciertas técnicas (84).
2. Constituyentes del suero
En general, la hemólisis, lipemia e hiperbilirrubinemia no provocan una interferencia significativa en los inmunoensayos. Sin embargo, los ácidos grasos libres pueden desplazar a la T4 de las proteínas de transporte séricas, lo cual explicaría parcialmente los valores de T4T bajos que se observan con frecuencia en las NTI (100).
3. Anticuerpos heterófilos (HAMA)
El suero de los pacientes puede contener anticuerpos heterófilos que pueden ser de dos clases (111). Algunos son anticuerpos débilmente reactivos, multiespecíficos y polirreactivos que frecuentemente corresponden a un factor reumatoideo (de tipo IgM), y, otros, pueden ser muy reactivos, inducidos por infecciones o exposición a tratamientos con anticuerpos monoclonales (112-114). Este segundo grupo recibe a veces el nombre de anticuerpos humanos anti-ratón (HAMA). Alternativamente estos anticuerpos pueden corresponder a inmunoglobulinas humanas específicas anti-animal (HAAA) producidas contra antígenos específicos bien definidos luego de una exposición a un agente terapéutico que contenga antígenos de origen animal (por ejemplo, anticuerpos murinos) o por una inmunización ocasional ocurrida por exposición en el lugar de trabajo (por ejemplo, trabajadores que manipulan animales) (115). Tanto los HAMA como los HAAA afectan a los ensayos inmunométricos (IMA) más que a los inmunoensayos competitivos, al formar un puente entre los anticuerpos de captura y de señal, y generar una falsa señal que provoca un valor inapropiadamente alto del analito (116)(117). El resultado erróneo puede no ser necesariamente anormal, sino que puede ser también inapropiadamente normal. En la actualidad, los fabricantes de reactivos están empleando diversos procedimientos para abordar el problema de los HAMA y neutralizar sus efectos sobre los métodos, con resultados variables, que incluyen por ejemplo el uso de combinaciones quiméricas de anticuerpos y de agentes bloqueantes (118).
4. Recolección y procesamiento de la muestra
La mayoría de los fabricantes recomienda utilizar suero preferentemente a plasma obtenido con heparina o EDTA. Para resultados óptimos y un máximo rendimiento del suero, se recomienda que las muestras de sangre total se dejen coagular por lo menos durante 30 minutos antes de centrifugarlas y separarlas. El suero se puede conservar entre 4 y 8 ºC hasta una semana. Si el ensayo se realiza después de una semana, se recomienda conservar el suero a -20 ºC. La obtención del suero en tubos con barrera de gel puede afectar los resultados de algunos ensayos tiroideos.
5. Parámetros de rendimiento de los ensayos tiroideos
(a) Variación biológica
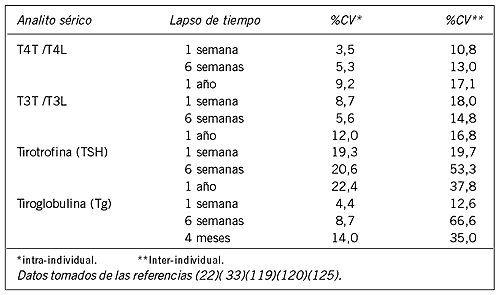
Los niveles séricos de las hormonas tiroideas como de su proteína precursora, la tiroglobulina (Tg) son bastante estables dentro de un mismo individuo en el período de 1 a 4 años de edad (Tabla IV) (22)(119). Todos los analitos tiroideos muestran una mayor variabilidad inter-individual que intra-individual (Tabla IV) (33)(119) (120). La estabilidad de las concentraciones intra-individuales de T4 sérica refleja la vida media larga (7 días) de la tiroxina y el nivel individual de T4L genéticamente determinado (21). La estabilidad intra-individual de las concentraciones de T3 refleja la autorregulación del grado de conversión de T4 a T3 (121). La variabilidad inter-individual es particularmente importante para las concentraciones de Tg sérica, porque los individuos de una población presentan diferencias en cuanto a la masa tiroidea, el nivel de TSH, y pueden tener patologías asociadas con lesión tiroidea (por ejemplo tiroiditis), condiciones que influyen en las concentraciones de Tg (122). Los valores séricos de TSH también muestran gran variabilidad, tanto en el mismo individuo como entre un individuo y otro (22). Esto refleja básicamente la vida media de la TSH (~60 minutos) junto con sus variaciones circadianas y diurnas. Los niveles alcanzan un pico durante la noche y un nadir aproximadamente entre las 10.00 y las 16.00 horas (123)(124). La amplitud de la variabilidad diurna de TSH a lo largo de un período de 24 horas es aproximadamente del doble (123)(124). Sin embargo, como este cambio cae dentro del rango de referencia normal de TSH para el conjunto de la población (~0,4 a 4,0 mIU/L), no compromete la utilidad de un valor individual de TSH para diagnosticar disfunción tiroidea. Además, la TSH se determina habitualmente durante el día en los pacientes ambulatorios cuando su variabilidad es menor.
El comportamiento de un ensayo de laboratorio se puede evaluar biológica y analíticamente. La Tabla IV muestra la variación biológica de diversos analitos tiroideos en suero, expresada en términos de variabilidad inter-individual e intra-individual, a lo largo de diferentes períodos de tiempo (22)(33)(119)(120) (125). El comportamiento analítico se evalúa típicamente en el laboratorio mediante los siguientes parámetros:
• Precisión intra- e inter-ensayo evaluada a diferentes concentraciones del analito
• Límite de detección (sensibilidad analítica) (126)(127)
• Sensibilidad funcional (definida como la mínima concentración del analito que puede determinarse con un dado CV% interensayo, el cual está relacionado con la variabilidad metodológica y con la variabilidad biológica específica para ese analito
• Linealidad de las mediciones a lo largo del rango reportable de trabajo
• Recuperación del analito agregado a la matriz del estándar
• Intervalo normal de referencia (media +/-2 desvíos estándar de los valores) para una cohorte de individuos sanos
• Correlación con un método de referencia
Tabla IV. Variabilidad intra e inter-individual de los ensayos tiroideos.
Recomendación Nº 7. Evaluación de resultados discordantes en los ensayos tiroideos
Los resultados discordantes en los ensayos tiroideos pueden deberse a interferencia técnica o a condiciones clínicas raras
• Interferencias técnicas: A veces una interferencia técnica puede ser detectada realizando la determinación por otro método, ya que la magnitud de la mayoría de las interferencias depende del método utilizado. Alternativamente la no linealidad en las diluciones de la muestra pueda indicar una interferencia técnica en las determinaciones de T4T, T3T o TSH. Nota: Una dilución 1 en 100 de un suero "normal" teóricamente produce una reducción insignificante (<2%) en la concentración de T4L. No se recomienda hacer diluciones de las muestras en los ensayos de T4L y T3L utilizados de rutina por los laboratorios clínicos, porque esos ensayos están influidos por la concentración de las proteínas de transporte y no dan respuestas lineales a las diluciones.
• Condiciones clínicas raras: Es posible observar valores anormales o discordantes en los ensayos tiroideos en ciertas patologías inusuales pero clínicamente significativas como el hipotiroidismo central, los tumores hipofisarios secretantes de TSH, la resistencia a las hormonas tiroideas, la presencia de anticuerpos heterófilos (HAMA) o de autoanticuerpos anti-hormonas tiroideas (T4 y/o T3).
Aunque los parámetros analíticos de comportamiento son el fundamento de los controles de calidad de la mayoría de los laboratorios y de los programas de aseguramiento de calidad, es ampliamente aceptado que los comportamientos analíticos ideales deberían establecerse sobre la base de principios biológicos (variación intra e inter-individuos) y en función de las necesidades clínicas (33). Se ha propuesto que el error analítico total debería ser idealmente menor que la mitad del coeficiente de variación biológica (% CV) intra-individual (33)(125)(128-130).
Para fines diagnósticos, los resultados de los ensayos tiroideos se informan junto con un rango de referencia "normal" que refleja la variabilidad inter-individual. Este rango provee un punto de referencia para detectar casos anormales. No obstante, los rangos de referencia no se pueden utilizar para determinar si las diferencias existentes entre los resultados de dos ensayos consecutivos realizados durante el seguimiento del tratamiento del paciente constituyen un cambio clínicamente significativo, o simplemente reflejan la variabilidad técnica (imprecisión inter-ensayo) o biológica (variabilidad intra-individual) de la determinación (131). El intervalo "normal" de referencia generalmente carece de importancia durante el manejo clínico post-quirúrgico cuando se utilizan marcadores tumorales como la Tg (132). Claramente el desvío del método y la precisión requerida no deben ser tan estrictos cuando se utiliza el ensayo para diagnóstico como cuando se lo utiliza en determinaciones seriadas para el seguimiento de pacientes. Si bien el intervalo de referencia "normal" que aparece en el informe habitual de laboratorio ayuda al médico a establecer un primer diagnóstico, no ofrece información relevante para ayudarlo a evaluar el significado de los cambios resultantes del tratamiento.
La Tabla V muestra los desvíos y las precisiones ideales para los principales ensayos tiroideos utilizados tanto para diagnóstico como para seguimiento. Los valores que se muestran se calcularon a partir de estudios de las estimaciones de precisión intra- e inter-individuales y se basan en conceptos bien establecidos (22)(33)(119) (120)(130)(133)(134).
La Tabla V y la Recomendación Nº 8 muestran la magnitud del cambio en dos resultados consecutivos (que estén aproximadamente en la concentración media del rango normal del analito) que es clínicamente significativa para cada ensayo (22)(120). Estos patrones de referencia deberían ayudar al médico a juzgar la importancia clínica de los cambios observados durante el seguimiento seriado en el tratamiento de pacientes con problemas tiroideos.
Tabla V. Desvío y Precisión ideales requeridos para los ensayos tiroideos.

Recomendación Nº 8. Recomendaciones para la interpretación de los resultados de ensayos tiroideos
• Para los ensayos tiroideos con fines diagnósticos (búsqueda de casos anormales), los resultados típicamente se informan junto con un intervalo de referencia "normal" que refleja la variabilidad entre individuos.
• El intervalo de referencia "normal" no indica la magnitud de la diferencia que debe existir entre los resultados de dos ensayos en un paciente individual para considerar en él un cambio clínicamente significativo.
La variabilidad analítica junto con las estimaciones de la variabilidad biológica inter- e intra-individuales sugieren que las magnitudes de las diferencias entre dos resultados de ensayos tiroideos que sean clínicamente significativas, cuando se evalúa la respuesta de un paciente al tratamiento son:
T4T = 28 (2,2) nmol/L (µg/dL)
T4L = 6 (0,5) pmol/L (ng/dL)
T3T = 0,55 (35) nmol/L (ng/dL)
T3L = 1,5 (0,1) pmol/L (ng/dL)
TSH = 0,75 mUI/L
Tg = 1,5 µg/L (ng/mL)
Referencias bibliográficas
1. Nohr SB, Laurberg P, Borlum KG, Pedersen Km, Johannesen PL, Damm P. Iodine deficiency in pregnancy in Denmark. Regional variations and frequency of individual iodine supplementation. Acta Obstet Gynecol Scand 1993; 72: 350-3.
2. Glinoer D. Pregnancy and iodine. Thyroid 2001; 11: 471-81.
3. Hollowell JG, Staehling NW, Hannon WH, Flanders DW, Gunter EW, Maberly GF, et al. Iodine nutrition in the Unites States. Trends and public health implications: iodine excretion data from National Health and Nutrition Examination Surveys I and III (1971-1974 and 1988-1994). J Clin Endocrinol Metab 1998; 83: 3398-400.
4. Wartofsky L, Glinoer D, Solomon d, Nagataki S, Lagasse R, Nagayama Y, et al. Differences and similarities in the diagnosis and treatment of Graves disease in Europe, Japan and the United States. Thyroid 1990; 1: 129-35.
5. Singer PA, Cooper DS, Levy EG, Ladenson PW, Braverman LE, Daniels G, et al. Treatment guidelines for patients with hyperthyroidism and hypothyroidism. JAMA 1995; 273: 808-12.
6. Singer PA, Cooper DS, Daniels GH, Ladenson PW, Greenspan FS, Levy EG, et al. Treatment Guidelines for Patients with Thyroid Nodules and Well-differentiated Thyroid Cancer. Arch Intern Med 1996; 156: 2165-72.
7. Vanderpump MPJ, Ahlquist JAO, Franklyn JA, Clayton RN. Consensus statement for good practice and audit measures in the management of hypothyroidism and hyperthyroidism. Br Med J 1996; 313: 539-44.
8. Laurberg P, Nygaard B, Glinoer D, Grussendorf M, Orgiazzi J. Guidelines for TSH-receptor antibody measurements in pregnancy: results of an evidence-based symposium organized by the European Thyroid Association. Eur J Endocrinol 1998; 139:584-6.
9. Cobin RH, Gharib H, Bergman DA, Clark OH, Cooper DS, Daniels GH, et al. AACE/AAES Medical/Surgical Guidelines for Clinical Practice: Management of Thyroid Carcinoma. Endocrine Pract 2001; 7: 203-20.
10. Ladenson PW, Singer PA, Ain KB, Bagchi N, Bigos ST, Levy EG, et al. American Thyroid Association Guidelines for detection of thyroid dysfunction. Arch Intern Med 2000; 160: 1573-5.
11. Brandi ML, Gagel RJ, Angeli A, Bilezikian JP, Beck-Peccoz P, Bordi C, et al. Consensus Guidelines for Diagnosis and Therapy of MEN Type 1 and Type 2. J Clin Endocrinol Metab 2001; 86: 5658-71.
12. Werner and Ingbar's "The Thyroid". A Fundamental and Clinical Text. Braverman LE and Utiger RD eds. Philadelphia: Lippincott-Raven; 2000.
13. DeGroot LJ, Larsen PR, Hennemann G, eds. The Thyroid and Its Diseases. (www.thyroidmanager.org) 2000.
14. Piketty ML, D'Herbomez M, Le Guillouzic D, Lebtahi R, Cosson E, Dumont A, et al. Clinical comparison of three labeled-antibody immunoassays of free triiodothyronine. Clin Chem 1996; 42: 933-41.
15. Sapin R, Schlienger JL, Goichot B, Gasser F and Grucker D. Evaluation of the Elecsys free triiodothyronine assay; relevance of age-related reference ranges. Clin Biochem 1998; 31: 399-404.
16. Robbins J. Thyroid hormone transport proteins and the physiology of hormone binding. In "Hormones in Blood". Gray CH, James VHT, eds. London: Academic Press; 1996. pp 96-110.
17. Demers LM. Thyroid function testing and automation. J Clin Ligand Assay 1999; 22: 38-41.
18. Hollowell JG, Staehling NW, Hannon WH, Flanders WD, Gunter EW, Spencer CA, et al. Serum thyrotropin, thyroxine and thyroid antibodies in the United States population (1988 to 1994): NHANES III. J Clin Endocrinol Metab 2002; 87: 489-99.
19. Wardle CA, Fraser WD, Squire CR. Pitfalls in the use of thyrotropin concentration as a first-line thyroid-function test. Lancet 2001; 357: 1013-4.
20. Spencer CA, LoPresti JS, Patel A, Guttler RB, Eigen A, Shen D, et al. Applications of a new chemiluminometric thyrotropin assay to subnormal measurement. J Clin Endocrinol Metab 1990; 70: 453-60.
21. Meikle AW, Stringham JD, Woodward MG, Nelson JC. Hereditary and environmental influences on the variation of thyroid hormones in normal male twins. J Clin Endocrinol Metab1 1988; 66: 588-92.
22. Andersen S, Pedersen KM, Bruun NH and Laurberg P. Narrow individual variations in serum T4 and T3 in normal subjects: a clue to the understanding of subclinical thyroid disease. J Clin Endocrinol Metab 2002; 87: 1068-72.
23. Cooper DS, Halpern R, Wood LC, Levin AA, Ridgway EV. L-thyroxine therapy in subclinical hypothyroidism. Ann Intern Med 1984; 101: 18-24.
24. Biondi B, Fazio E, Palmieri EA, Carella C, Panza N, Cittadini A, et al. Left ventricular diastolic dysfunction in patients with subclinical hypothyroidism. J Clin Endocrinol Metab 1999; 2064-7.
25. Hak AE, Pols HAP, Visser TJ, Drexhage HA, Hofman A, Witteman JCM. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women: the Rotterdam Study. Ann Intern Med 2000; 132: 270-8.
26. Michalopoulou G, Alevizaki M, Piperingos G, Mitsibounas D, Mantzos E, Adamopoulos P, et al. High serum cholesterol levels in persons with 'high-normal' TSH levels: should one extend the definition of subclinical hypothyroidism? Eur J Endocrinol 1998; 138: 141-5.
27. Beck-Peccoz P, Brucker-Davis F, Persani L, Smallridge RC, Weintraub BD. Thyrotropin-secreting pituitary tumors. Endocrine Rev 1996; 17: 610-38.
28. Brucker-Davis F, Oldfield EH, Skarulis MC, Doppman JL, Weintraub BD. Thyrotropin-secreting pituitary tumors: diagnostic criteria, thyroid hormone sensitivity and treatment outcome in 25 patients followed at the National Institutes of Health. J Clin Endocrinol Metab 76 1999; 1089-94.
29. Oliveira JH, Persani L, Beck-Peccoz P, Abucham J. Investigating the paradox of hypothyroidism and increased serum thyrotropin (TSH) levels in Sheehan's syndrome: characterization of TSH carbohydrate content and bioactivity. J Clin Endocrinol Metab 2001; 86: 1694-9.
30. Uy H, Reasner CA, Samuels MH. Pattern of recovery of the hypothalamic-pituitary thyroid axis following radioactive iodine therapy in patients with Graves' disease. Ame J Med 1995; 99: 173-9.
31. Hershman JM, Pekary AE, Berg L, Solomon DH and Sawin CT. Serum thyrotropin and thyroid hormone levels in elderly and middle-aged euthyroid persons. J Am Geriatr Soc 1993; 41: 823-8.
32. Fraser CG. Age-related changes in laboratory test results. Clinical applications. Drugs Aging 1993; 3: 246-57.
33. Fraser CG. Biological Variation: from principles to practice. Washington DC: AACC Press; 2001.
34. Drinka PJ, Siebers M, Voeks SK. Poor positive predictive value of low sensitive thyrotropin assay levels for hyperthyroidism in nursing home residents. South Med J 1993; 86: 1004-7.
35. Vanderpump MPJ, Tunbridge WMG, French JM, Appleton D, Bates D, Rodgers H, et al. The incidence of thyroid disorders in the community; a twenty year follow up of the Whickham survey. Clin Endocrinol 1995; 43: 55-68.
36. Sawin CT, Geller A, Kaplan MM, Bacharach P, Wilson PW, Hershman JM, et al. Low serum thyrotropin (thyroid stimulating hormone) in older persons without hyperthyroidism. Arch Intern Med 1991; 151: 165-8.
37. Parle JV, Maisonneuve P, Sheppard MC, Boyle P. Franklyn JA. Prediction of all-cause and cardiovascular mortality in elderly people from one low serum thyrotropin result: a 10-year study. Lancet 2001; 358: 861-5.
38. Nelson JC, Clark SJ, Borut DL, Tomei RT, Carlton EI. Age-related changes in serum free thyroxine during childhood and adolescence. J Pediatr 1993; 123: 899-905.
39. Adams LM, Emery JR, Clark SJ, Carlton EI, Nelson JC. Reference ranges for newer thyroid function tests in premature infants. J Pediatr 1995; 126: 122-7.
40. Lu FL, Yau KI, Tsai KS, Tang JR, Tsao PN, Tsai WY. Longitudinal study of serum free thyroxine and thyrotropin levels by chemiluminescent immunoassay during infancy. T'aiwan Erh K'o i Hseh Hui Tsa Chih 1999; 40: 255-7.
41. Zurakowski D, Di Canzio J, Majzoub JA. Pediatric reference intervals for serum thyroxine, triiodothyronine, thyrotropin and free thyroxine. Clin Chem 1999; 45: 1087-91.
42. Fisher DA, Nelson JC, Carlton EI, Wilcox RB. Maturation of human hypothalamic-pituitary-thyroid function and control. Thyroid 2000; 10: 229-34.
43. Fisher DA, Schoen EJ, La Franchi S, Mandel SH, Nelson JC, Carlton EI et al. The hypothalamic-pituitary-thyroid negative feedback control axis in children with treated congenital hypothyroidism. J Clin Endocrinol Metab 2000; 85: 2722-7.
44. Penny R, Spencer CA, Frasier SD, Nicoloff JT. Thyroid stimulating hormone (TSH) and thyroglobulin (Tg) levels decrease with chronological age in children and adolescents. J Clin Endocrinol Metab 1983; 56: 177-80.
45. Verheecke P. Free triiodothyronine concentration in serum of 1050 euthyroid children is inversely related to their age. Clin Chem 1997; 43: 963-7.
46. Glinoer D, De Nayer P, Bourdoux P, Lemone M, Robyn C, van Steirteghem A, et al. Regulation of maternal thyroid function during pregnancy. J Clin Endocrinol Metab 1990; 71: 276-87.
47. Glinoer D. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocrinol Rev 1997; 18: 404-33.
48. Weeke J, Dybkjaer L, Granlie K, Eskjaer Jensen S, Kjaerulff E, Laurberg P, et al. A longitudinal study of serum TSH and total and free iodothyronines during normal pregnancy. Acta Endocrinol 1982; 10: 531-7.
49. Pedersen KM, Laurberg P, Iversen E, Knudsen PR, Gregersen HE, Rasmussen OS, et al. Amelioration of some pregnancy associated variation in thyroid function by iodine supplementation. J Clin Endocrinol Metab 1993; 77: 1078-83.
50. Nohr SB, Jorgensen A, Pedersen KM, Laurberg P. Postpartum thyroid dysfunction in pregnant thyroid peroxidase antibody-positive women living in an area with mild to moderate iodine deficiency: Is iodine supplementation safe? J Clin Endocrinol Metab 2000; 85: 3191-8.
51. Panesar NS, Li CY, Rogers MS. Reference intervals for thyroid hormones in pregnant Chinese women. Ann Clin Biochem 2001; 38: 329-32.
52. Nissim M, Giorda G, Ballabio M, D'Alberton A, Bochicchio D, Orefice R, et al. Maternal thyroid function in early and late pregnancy. Horm Res 1991; 36: 196-202.
53. Talbot JA, Lambert A, Anobile CJ, McLoughlin JD, Price A, Weetman AP, et al. The nature of human chorionic gonadotrophin glycoforms in gestational thyrotoxicosis. Clin Endocrinol 200; 55: 33-9.
54. Jordan V, Grebe SK, Cooke RR, Ford HC, Larsen PD, Stone PR, et al. Acidic isoforms of chorionic gonadotrophin in European and Samoan women are associated with hyperemesis gravidarum and may be thyrotrophic. Clin Endocrinol 1999; 50: 619-27.
55. Goodwin TM, Montoro M, Mestman JH, Pekary AE, Hershman JM. The role of chorionic gonadotropin in transient hyperthyroidism of hyperemesis gravidarum. J Clin Endocrinol Metab 1992; 75: 1333-7.
56. Hershman JM. Human chorionic gonadotropin and the thyroid: hyperemesis gravidarum and trophoblastic tumors. Thyroid 1999; 9: 653-7.
57. McElduff A. Measurement of free thyroxine (T4) in pregnancy. Aust NZ J Obst Gynecol 1999; 39: 158-61.
58. Christofides, N, Wilkinson E, Stoddart M, Ray DC, Beckett GJ. Assessment of serum thyroxine binding capacity-dependent biases in free thyroxine assays. Clin Chem 1999; 45: 520-5.
59. Roti E, Gardini E, Minelli R, Bianconi L, Flisi M,. Thyroid function evaluation by different commercially available free thyroid hormone measurement kits in term pregnant women and their newborns. J Endocrinol Invest 1991; 14: 1-9.
60. Stockigt JR. Free thyroid hormone measurement: a critical appraisal. Endocrinol Metab Clin N Am 2001; 30: 265-89.
61. Mandel SJ, Larsen PR, Seely EW, Brent GA. Increased need for thyroxine during pregnancy in women with primary hypothyroidism. N Engl J Med 1990; 323: 91-6.
62. Burrow GN, Fisher DA, Larsen PR. Maternal and fetal thyroid function. N Engl J Med 1994; 331: 1072-8.
63. Pop VJ, De Vries E, Van Baar AL, Waelkens JJ, De Rooy HA, Horsten M, et al. Maternal thyroid peroxidase antibodies during pregnancy: a marker of impaired child development? J Clin Endocrinol Metab 1995; 80: 3561-6.
64. Haddow JE, Palomaki GE, Allan WC, Williams JR, Gagnon J, O'Heir CE, et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child. N Engl J Med 1999; 341: 549-55.
65. Pop VJ, Kuijpens JL, van Baar AL, Verkerk G, van Son MM, de Vijlder JJ, et al. Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin Endocrinol 1999; 50: 147-8.
66. Radetti G, Gentili L, Paganini C, Oberhofer R, Deluggi I, Delucca A. Psychomotor and audiological assessment of infants born to mothers with subclinical thyroid dysfunction in early pregnancy. Minerva Pediatr 2000; 52: 691-8.
67. Surks MI, Sievert R. Drugs and thyroid function. N Engl J Med 1995;333:1688-94.
68. Kailajarvi M, Takala T, Gronroos P, Tryding N, Viikari J, Irjala K, et al. Reminders of drug effects on laboratory test results. Clin Chem 2000; 46: 1395-400.
69. Brabant A, Brabant G, Schuermeyer T, Ranft U, Schmidt FW, Hesch RD, et al. The role of glucocorticoids in the regulation of thyrotropin. Acta Endocrinol 1989; 121: 95-100.
70. Samuels MH, McDaniel PA. Thyrotropin levels during hydrocortisone infusions that mimic fasting-induced cortisol elevations: a clinical research center study. J Clin Endocrinol Metab 1997; 82: 3700-4.
71. Kaptein EM, Spencer CA, Kamiel MB, Nicoloff JT. Prolonged dopamine administration and thyroid hormone economy in normal and critically ill subjects. J Clin Endocrinol Metab 1980; 51: 387-93.
72. Geffner DL, Hershman JM. Beta-adrenergic blockade for the treatment of hyperthyroidism. Am J Med 1992; 93: 61-8.
73. Meurisse M, Gollogly MM, Degauque C, Fumal I, Defechereux T, Hamoir E. Iatrogenic thyrotoxicosis: causal circumstances, pathophysiology and principles of treatment- review of the literature. World J Surg 2000; 24: 1377-85.
74. Martino E, Aghini-Lombardi F, Mariotti S, Bartelena L, Braverman LE, Pinchera A. Amiodarone: a common source of iodine-induced thyrotoxicosis. Horm Res 1987; 26: 158-71.
75. Martino E, Bartalena L, Bogazzi F, Braverman LE. The effects of amiodarone on the Thyroid. Endocrinol Rev 2001; 22: 240-54.
76. Daniels GH. Amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 2001; 86: 3-8.
77. Harjai KJ, Licata AA. Effects of amiodarone on thyroid function. Ann Intern Med 1997; 126: 63-73.
78. Caron P. Effect of amiodarone on thyroid function. Press Med 1995; 24: 1747-51.
79. Bartalena L, Grasso L, Brogioni S, Aghini-Lombardi F, Braverman LE, Martino E. Serum interleukin-6 in amiodarone-induced thyrotoxicosis. J Clin Endocrinol Metab 1994; 78: 423-7.
80. Eaton SE, Euinton HA, Newman CM, Weetman AP, Bennet WM. Clinical experience of amiodarone-induced thyrotoxicosis over a 3-year period: role of colour-flow Doppler sonography. Clin Endocrinol 2002; 56: 33-8.
81. Lazarus JH. The effects of lithium therapy on thyroid and thyrotropin-releasing hormone. Thyroid 1998; 8: 909-13.
82. Kusalic M, Engelsmann F. Effect of lithium maintenance therapy on thyroid and parathyroid function. J Psych Neurosci 1999; 24: 227-33.
83. Oakley PW, Dawson AH, Whyte IM. Lithium: thyroid effects and altered renal handling. Clin Toxicol 2000;38:333-7.
84. Mendel CM, Frost PH, Kunitake ST, Cavalieri RR. Mechanism of the heparin-induced increase in the concentration of free thyroxine in plasma. J Clin Endocrinol Metab 1987; 65: 1259-64.
85. Iitaka M, Kawasaki S, Sakurai S, Hara Y, Kuriyama R, Yamanaka K, et al. Serum substances that interfere with thyroid hormone assays in patients with chronic renal failure. Clin Endocrinol 1998; 48: 739-46.
86. Bowie LJ, Kirkpatrick PB, Dohnal JC. Thyroid function testing with the TDx: Interference from endogenous fluorophore. Clin Chem 1987; 33: 1467.
87. DeGroot LJ, Mayor G. Admission screening by thyroid function tests in an acute general care teaching hospital. Ame J Med 1992; 93: 558-64.
88. Kaptein EM. Thyroid hormone metabolism and thyroid diseases in chronic renal failure. Endocr Rev 1996; 17: 45-63.
89. Van den Berghe G, De Zegher F, Bouillon R. Acute and prolonged critical illness as different neuroendocrine paradigms. J Clin Endocrinol Metab 1998; 83: 1827-34.
90. Van den Berhe G. Novel insights into the neuroendocrinology of critical illness. Eur J Endocrinol 2000; 143: 1-13.
91. Wartofsky L, Burman KD. Alterations in thyroid function in patients with systemic illness: the "euthyroid sick syndrome". Endocrinol Rev 1982; 3: 164-217.
92. Spencer CA, Eigen A, Duda M, Shen D, Qualls S, Weiss S, et al. Sensitive TSH tests - specificity limitations for screening for thyroid disease in hospitalized patients. Clin Chem 1987; 33: 1391-6.
93. Stockigt JR. Guidelines for diagnosis and monitoring of thyroid disease: nonthyroidal illness. Clin Chem 1996; 42: 188-92.
94. Nelson JC, Weiss RM. The effects of serum dilution on free thyroxine (T4) concentration in the low T4 syndrome of nonthyroidal illness. J Clin Endocrinol Metab 1985;61: 239-46.
95. Chopra IJ, Huang TS, Beredo A, Solomon DH, Chua Teco GN. Serum thyroid hormone binding inhibitor in non thyroidal illnesses. Metabolism 1986; 35: 152-9.
96. Wang R, Nelson JC, Wilcox RB. Salsalate administration- a potential pharmacological model of the sick euthyroid syndrome. J Clin Endocrinol Metab 1998; 83: 3095-9.
97. Sapin R, Schliener JL, Kaltenbach G, Gasser F, Christofides N, Roul G, et al. Determination of free triiodothyronine by six different methods in patients with non-thyroidal illness and in patients treated with amiodarone. Ann Clin Biochem 1995; 32: 314-24.
98. Docter R, van Toor H, Krenning EP, de Jong M, Hennemann G. Free thyroxine assessed with three assays in sera of patients with nonthyroidal illness and of subjects with abnormal concentrations of thyroxine-binding proteins. Clin Chem 1993; 39: 1668-74.
99. Wilcox RB, Nelson JC, Tomei RT. Heterogeneity in affinities of serum proteins for thyroxine among patients with non-thyroidal illness as indicated by the serum free thyroxine response to serum dilution. Eur J Endocrinol 1994; 131: 9-13.
100. Liewendahl K, Tikanoja S, Mahonen H, Helenius T, Valimaki M, Tallgren LG. Concentrations of iodothyronines in serum of patients with chronic renal failure and other nonthyroidal illnesses: role of free fatty acids. Clin Chem 1987; 33: 1382-6.
101. Sapin R, Schlienger JL,Gasser F, Noel E, Lioure B, Grunenberger F. Intermethod discordant free thyroxine measurements in bone marrow-transplanted patients. Clin Chem 2000; 46: 418-22.
102. Chopra IJ. Simultaneous measurement of free thyroxine and free 3,5,3'-triiodothyronine in undiluted serum by direct equilibrium dialysis/radioimmunoassay: evidence that free triiodothyronine and free thyroxine are normal in many patients with the low triiodothyronine syndrome. Thyroid 1998; 8: 249-57.
103. Hamblin PS, Dyer SA, Mohr VS, Le Grand BA, Lim C-F, Tuxen DB, et al. Relationship between thyrotropin and thyroxine changes during recovery from severe hypothyroxinemia of critical illness. J Clin Endocrinol Metab 1986; 62: 717-22.
104. Brent GA, Hershman JM. Thyroxine therapy in patients with severe nonthyroidal illnesses and low serum thyroxine concentrations. J Clin Endocrinol Metab 1986; 63:1-8.
105. De Groot LJ. Dangerous dogmas in medicine: the nonthyroidal illness syndrome. J Clin Endocrinol Metab 1999; 84: 151-64.
106. Burman KD, Wartofsky L. Thyroid function in the intensive care unit setting. Crit Care Clin 200; 17: 43-57.
107. Behrend EN, Kemppainen RJ, Young DW. Effect of storage conditions on cortisol, total thyroxine and free thyroxine concentrations in serum and plasma of dogs. J Am Vet Med Assoc 1998; 212: 1564-8.
108. Oddie TH, Klein AH, Foley TP, Fisher DA. Variation in values for iodothyronine hormones, thyrotropin and thyroxine binding globulin in normal umbilical-cord serum with season and duration of storage. Clin Chem 1979; 25: 1251-3.
109. Koliakos G, Gaitatzi M, Grammaticos P. Stability of serum TSH concentration after non refrigerated storage. Minerva Endocrinol 1999; 24: 113-5.
110. Waite KV, Maberly GF, Eastman CJ. Storage conditions and stability of thyrotropin and thyroid hormones on filter paper. Clin Chem 1987; 33: 853-5.
111. Levinson SS. The nature of heterophilic antibodies and their role in immunoassay interference. J Clin Immunoassay 1992;15: 108-15.
112. Norden AGM, Jackson RA, Norden LE, Griffin AJ, Barnes MA, Little JA. Misleading results for immunoassays of serum free thyroxine in the presence of rheumatoid factor. Clin Chem 1997; 43: 957-62.
113. Covinsky M, Laterza O, Pfeifer JD, Farkas-Szallasi T, Scott MG. Lambda antibody to Esherichia coli produces false-positive results in multiple immunometric assays. Clin Chem 2000; 46: 1157-61.
114. Martel J, Despres N, Ahnadi CE, Lachance JF, Monticello JE, Fink G, et al. Comparative multicentre study of a panel of thyroid tests using different automated immunoassay platforms and specimens at high risk of antibody interference. Clin Chem Lab Med 2000; 38: 785-93.
115. Howanitz PJ, Howanitz JH, Lamberson HV, Ennis KM. Incidence and mechanism of spurious increases in serum Thyrotropin. Clin Chem 1982; 28: 427-31.
116. Boscato LM, Stuart MC. Heterophilic antibodies: a problem for all immunoassays. Clin Chem 1988; 34: 27-33.
117. Kricka LJ. Human anti-animal antibody interference in immunological assays. Clin Chem 1999; 45: 942-56.
118. Sapin R, Simon C. False hyperprolactinemia corrected by the use of heterophilic antibody-blocking agent. Clin Chem 2001; 47: 2184-5.
119. Feldt-Rasmussen U, Petersen PH, Blaabjerg O, Horder M. Long-term variability in serum thyroglobulin and thyroid related hormones in healthy subjects. Acta Endocrinol (Copenh) 1980; 95: 328-34.
120. Browning MCK, Ford RP, Callaghan SJ, Fraser CG. Intra-and interindividual biological variation of five analytes used in assessing thyroid function: implications for necessary standards of performance and the interpretation of results. Clin Chem 1986; 32: 962-6.
121. Lum SM, Nicoloff JT. Peripheral tissue mechanism for maintenance of serum triiodothyronine values in a thyroxine-deficient state in man. J Clin Invest 1984; 73: 570-5.
122. Spencer CA, Wang CC. Thyroglobulin measurement: Techniques, clinical benefits and pitfalls. Endocrinol Metab Clin N Amer 1995; 24: 841-63.
123. Weeke J, Gundersen HJ. Circadian and 30 minute variations in serum TSH and thyroid hormones in normal subjects. Acta Endocrinol 1978; 89: 659-72.
124. Brabant G, Prank K, Hoang-Vu C, von zur Muhlen A. Hypothalamic regulation of pulsatile thyrotropin secretion. J Clin Endocrinol Metab 1991; 72: 145-50.
125. Fraser CG, Petersen PH, Ricos C, Haeckel R. Proposed quality specifications for the imprecision and inaccuracy of analytical systems for clinical chemistry. Eur J Clin Chem Biochem 1992; 30: 311-7.
126. Rodbard D. Statistical estimation of the minimal detectable concentration ("sensitivity") for radioligand assays. Anal Biochem 1978; 90: 1-12.
127. Ekins R, Edwards P. On the meaning of "sensitivity". Clin Chem 1997; 43: 1824-31.
128. Fuentes-Arderiu X, Fraser CG. Analytical goals for interference. Ann Clin Biochem 1991; 28: 393-5.
129. Petersen PH, Fraser CG, Westgard JO, Larsen ML. Analytical goal-setting for monitoring patients when two analytical methods are used. Clin Chem 1992; 38: 2256-60.
130. Fraser CG, Petersen PH. Desirable standards for laboratory tests if they are to fulfill medical needs. Clin Chem 1993; 39: 1453-5.
131. Stockl D, Baadenhuijsen H, Fraser CG, Libeer JC, Petersen PH, Ricos C. Desirable routine analytical goals for quantities assayed in serum. Discussion paper from the members of the external quality assessment (EQA) Working Group A on analytical goals in laboratory medicine. Eur J Clin Chem Clin Biochem 1995; 33: 157-69.
132. Plebani M, Giacomini A, Beghi L, de Paoli M, Roveroni G, Galeotti F, et al. Serum tumor markers in monitoring patients: interpretation of results using analytical and biological variation. Anticancer Res 1996; 16: 2249-52.
133. Browning MC, Bennet WM, Kirkaldy AJ, Jung RT. Intra-individual variation of thyroxin, triiodothyronine and thyrotropin in treated hypothyroid patients: implications for monitoring replacement therapy. Clin Chem 1988; 34: 696-9.
134. Harris EK. Statistical principles underlying analytic goal-setting in clinical chemistry. Am J Clin Pathol 1979; 72: 374-82.














