Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.1 La Plata ene./mar. 2013
TEMAS DE INTERÉS
Guías de práctica del laboratorio clínico
Uso de marcadores tumorales en cáncer de testículo, próstata, colorrectal, mama y ovario
Capítulos 1 y 2
EDITADO POR
Catharine M. Sturgeon
Eleftherios P. Diamandis
Catharine M. Sturgeon
Department of Clinical Biochemistry, Royal Infirmary of Edinburgh, Edinburgh, Reino Unido.
Michael J. Duffy
Department of Pathology and Laboratory Medicine, St Vincent's University Hospital and UCD School of Medicine and Medical Science, Conway Institute of Biomolecular and Biomedical Research, University College Dublin, Dublin, Irlanda.
Ulf-Håkan Stenman
Department of Clinical Chemistry, Helsinki University Central Hospital, Helsinki, Finlandia.
Hans Lilja
Departments of Clinical Laboratories, Urology and Medicine, Memorial Sloan-Kettering Cancer Center, New York, NY 10021.
Nils Brünner
Section of Biomedicine, Department of Veterinary Pathobiology, Faculty of Life Sciences, University of Copenhagen, Dinamarca.
Daniel W. Chan
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Richard Babaian
Department of Urology, The University of Texas M. D. Anderson Cancer Center, Houston, TX.
Robert C. Bast, Jr
Department of Experimental Therapeutics, University of Texas M. D. Anderson Cancer Center, Houston, TX.
Barry Dowell
Abbott Laboratories, Abbott Park, IL.
Francisco J. Esteva
Departments of Breast Medical Oncology, Molecular and Cellular Oncology, University of Texas M. D. Anderson Cancer Center, Houston, TX.
Caj Haglund
Department of Surgery, Helsinki University Central Hospital, Helsinki, Finlandia.
Nadia Harbeck
Frauenklinik der Technischen Universität München, Klinikum rechts der Isar, Munich, Alemania.
Daniel F. Hayes
Breast Oncology Program, University of Michigan Comprehensive Cancer Center, Ann Arbor, MI.
Mads Holten-Andersen
Section of Biomedicine, Department of Veterinary Pathobiology, Faculty of Life Sciences, University of Copenhagen, Dinamarca.
George G. Klee
Department of Laboratory Medicine and Pathology, Mayo Clinic College of Medicine, Rochester, MN.
Rolf Lamerz
Department of Medicine, Klinikum of the University Munich, Grosshadern, Alemania.
Leendert H. Looijenga
Laboratory of Experimental Patho-Oncology, Erasmus MC-University Medical Center Rotterdam, and Daniel den Hoed Cancer Center, Rotterdam, Holanda.
Rafael Molina
Laboratory of Biochemistry, Hospital Clinico Provincial, Barcelona, España.
Hans Jørgen Nielsen
Department of Surgical Gastroenterology, Hvidovre Hospital, Copenhagen, Dinamarca.
Harry Rittenhouse
Gen-Probe Inc, San Diego, CA.
Axel Semjonow
Prostate Center, Department of Urology, University Clinic Muenster, Muenster, Alemania.
Ie-Ming Shih
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Paul Sibley
Siemens Medical Solutions Diagnostics, Glyn Rhonwy, Llanberis, Gwynedd, Reino Unido.
György Sölétormos
Department of Clinical Biochemistry, Hillerød Hospital, Hillerød, Dinamarca.
Carsten Stephan
Department of Urology, Charité Hospital, Universitätsmedizin Berlin, Berlin, Alemania.
Lori Sokoll
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Barry R. Hoffman
Department of Pathology and Laboratory Medicine, Mount Sinai Hospital, and Department of Laboratory Medicine and Pathobiology, University of Toronto, Ontario, Canadá.
Eleftherios P. Diamandis
Department of Pathology and Laboratory Medicine, Mount Sinai Hospital, and Department of Laboratory. Medicine and Pathobiology, University of Toronto, Ontario, Canadá.
Copyright © 2011 by the American Association for Clinical Chemistry, Inc and the American Diabetes Association. Todos los derechos reservados.
The National Academy of Clinical Biochemistry Board of Directors aprobó este documento (PID 6278) en enero de 2011.
La NACB es la Academia de la Asociación Norteamericana de Bioquímica Clínica.
Este documento ha sido traducido con permiso de la National Academy of Clinical Biochemistry (NACB).
La NACB no se hace responsable de la exactitud de la traducción. Los puntos de vista presentados son los de los autores y no necesariamente los de la NACB.
TABLA DE CONTENIDOS
1. Introducción
2. Marcadores Tumorales en Cáncer de Testículo
3. Marcadores Tumorales en Cáncer de Próstata
4. Marcadores Tumorales en Malignidad Colorrectal
5. Marcadores Tumorales en Cáncer de Mama
6. Marcadores Tumorales en Cáncer de Ovario
Referencias
Agradecimientos
Capítulo 1
Introducción
Les presentamos a los bioquímicos, médicos, y otros profesionales del laboratorio clínico la última actualización de las Laboratory Medicine Practice Guidelines (LPMG) de la National Academy of Clinical Biochemistry (NACB) para el uso de marcadores tumorales en cáncer de testículos, de próstata, colorrectal, de mama, y de ovario. Estas guías tratan de alentar el uso de pruebas de marcadores tumorales por parte de los médicos de la atención primaria, médicos y cirujanos en hospitales, oncólogos y otros profesionales de la salud.
Las guías de práctica clínica son declaraciones que se desarrollan sistemáticamente para ayudar a médicos y pacientes en la toma de decisiones sobre la atención sanitaria apropiada en circunstancias específicas (1). En la introducción a LMPG de Marcadores Tumorales: Requerimientos de calidad, que se puede encontrar en el sitio web de la NACB (2) y como Apéndice de este documento, se puede encontrar una explicación de la metodología usada al desarrollar estas Guías. Como es de esperar, muchas de las recomendaciones de la NACB son similares a aquellas realizadas por otros grupos, tal como se ve claramente en las comparaciones tabulares presentadas para cada tumor maligno (2). Para preparar estas guías, se revisó la literatura relevante al uso de marcadores tumorales. Se le dio especial atención a las revisiones, inclusive a las pocas revisiones sistemáticas y a las guías usadas por los paneles de expertos. Cada vez que fue posible, estas recomendaciones de consenso de los paneles de la NACB estuvieron basadas en la evidencia. Las LMPG de Marcadores Tumorales: Requerimientos de Calidad presenta recomendaciones de la NACB referidas a requerimientos generales de calidad para la medición de tumores, e incluye la tabulación de importantes causas de resultados de marcadores tumorales falso positivos (por ejemplo, debido a interferencia de anticuerpos heterófilos, "efectos "hook" por dosis altas") que también deben tenerse en cuenta (3).
Capítulo 2
Marcadores tumorales en cánceres de testículo
Ulf-Håkan Stenman, Rolf Lamerz,
y Leendert H. Looijenga
Antecedentes
Aproximadamente el 95% de todos los tumores malignos de testículo se originan en células germinales, aunque la mayor parte de los restantes son linfomas, tumores de células de Leydig o de Sertoli y mesoteliomas. Los tumores de células germinales en adolescentes y adultos se clasifican en dos tipos principales, seminomas y cánceres de células germinales no seminomatosas (NSGCT). Los cánceres de testículo representan alrededor del 1% de todos los tumores malignos en hombres pero son los más comunes entre 15 y 35 años de edad. Constituyen una importante causa de muerte en este grupo etario a pesar del hecho de que en la actualidad el 90% de los casos tiene cura (4). Los tumores de células germinales también pueden tener su origen en sitios extragonadales (por ejemplo, en la región sacrococcígea, el mediastino y la glándula pineal (5)). Los del sacro se encuentran predominantemente en hombres jóvenes. Sobre la base de la histología, la edad del paciente al momento del diagnóstico, el comportamiento frente al diagnóstico, la conducta clínica y la constitución cromosómica, estos tumores pueden subdividirse en tres entidades diferentes con características clínicas y biológicas distintas (6-9): teratomas y tumores de saco vitelino de recién nacidos y niños; seminomas y no-seminomas de adolescentes y adultos jóvenes; y seminoma espermatocítico de los adultos mayores. Los seminomas y no-seminomas en la adolescencia y adultez fueron el foco de atención cuando se desarrollaron estas recomendaciones.
La incidencia de cánceres de testículo varía de manera considerable en los distintos países. En los Estados Unidos se diagnostican aproximadamente 7.200 casos nuevos por año (4) y la incidencia ajustada por la edad es 5,2/100.000. La incidencia es aproximadamente 4 veces más alta en los hombres de raza blanca que en los de raza negra. En Europa, la incidencia ajustada por la edad es más baja en Lituania (0,9/100.000), intermedia en Finlandia (2,5/100.000), y más alta en Dinamarca (9,2/100.000) (10). La incidencia en varios países de Europa ha aumentado de 2% a 5% por año. En los Estados Unidos, la incidencia aumentó un 52% desde mediados de 1970 a mediados de los años 82
90 (11). La causa de los tumores de células germinales es desconocida, pero se ha observado que asociación familiar, y criptorquidismo y síndrome de Klinefelter son factores predisponentes (4). En su presentación, la mayoría de los pacientes tienen inflamación testicular difusa, dureza y dolor. En una etapa temprana, una masa testicular indolora es un hallazgo patognomónico pero una masa testicular la mayoría de las veces tiene su origen en una epididimitis infecciosa o una orquitis. El diagnóstico a menudo puede ser confirmado por ultrasonografía. Si se sospecha cáncer de testículos, deben determinarse las concentraciones en suero de a-fetoproteíana (AFP), gonadotrofina coriónica humana (hCG), y lactato deshidrogenasa (LDH) antes de la terapia. Como regla, la orquiectomía se realiza antes de cualquier otro tratamiento, pero puede postergarse hasta después de la quimioterapia en los individuos con enfermedad metastásica que ponga en riesgo su vida. Después de la orquiectomía, alguna terapia adicional dependerá del tipo y estadio de la enfermedad. Es creciente el uso de vigilancia para pacientes con seminoma con enfermedad en estadio I, pero se usa también radiación de los nódulos linfáticos pélvicos retroperitoneales e ipsilaterales, siendo éste el tratamiento estándar para los estadios IIa y IIb de la enfermedad, así como el carboplatino de curso corto (único) (12). Entre 4% y 10% de los pacientes sufren una remisión y más del 90% de los mismos se curan con quimioterapia. Entre 15% y 20% de los seminomas estadio I bajo vigilancia sufren remisión y necesitan tratamiento con quimioterapia.
Los pacientes con tumores no-seminomatosos estadio I reciben tratamiento con orquiectomía. Luego de la orquiectomía, se aceptan como prácticas de tratamiento optativas, la vigilancia y la disección de los nódulos linfáticos retroperitoneales con preservación del nervio. Alrededor del 20% de los pacientes bajo vigilancia tendrán una remisión y requerirán quimioterapia. Los pacientes con tumores no-seminomatosos son tratados con quimioterapia o disección de nódulos linfáticos retroperitoneales. Los pacientes con cáncer testicular con enfermedad avanzada son tratados con quimioterapia (4). Los marcadores tumorales séricos tienen un papel importante en el manejo de los pacientes con cáncer testicular, lo que contribuye al diagnóstico, estadio, evaluación del riesgo, evaluación de la respuesta a la terapia y detección temprana de la remisión. El incremento en las concentraciones de los marcadores es suficiente para iniciar el tratamiento. AFP, hCG, y LDH son marcadores en suero establecidos. La mayoría de los casos de tumores de células germinales no-seminomatosas (NSGCT) tienen niveles séricos elevados (NSGCT) de uno o más de estos marcadores, mientras que LDH, y hCG son útiles en los seminomas. Se han evaluado otros marcadores pero ofrecen información clínica adicional limitada.
Para preparar estas guías, se ha revisado la literatura relevante para el uso de marcadores tumorales en cáncer de testículo. Se le dio particular atención a las revisiones, pruebas aleatorias prospectivas que incluían el uso de marcadores, y guías publicadas por paneles de expertos. Se identificó sólo una revisión sistemática relevante (109). Cada vez que fue posible, las recomendaciones consensuadas del panel de la NACB estuvieron basadas en la evidencia.
Marcadores para cáncer de testículo actualmente disponibles
La Tabla I presenta una lista de los marcadores tumorales para cáncer de testículo basados en tejidos y en suero que han sido más ampliamente investigados. Además, se presenta en la lista la fase de desarrollo de cada marcador así como el nivel de evidencia (LOE) para su uso clínico.
Tabla I. Marcadores séricos y tisulares para tumores de testículo actualmente disponibles
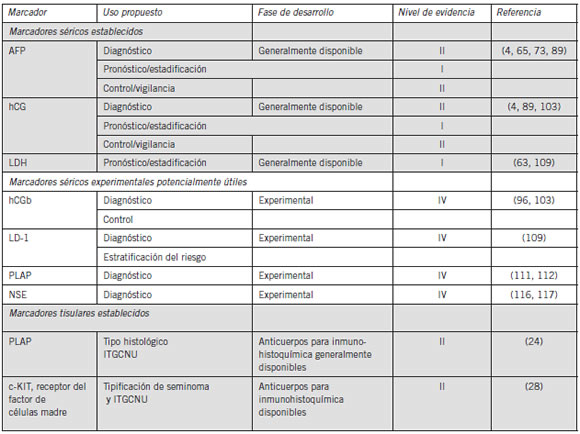
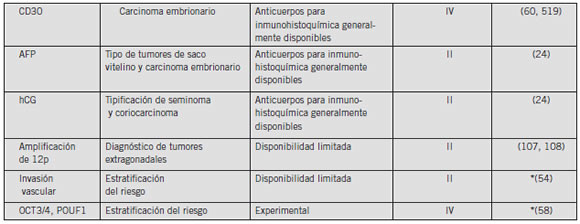
Abreviaturas: AFP, a-fetoproteína; hCG, gonadotrofina coriónica humana ; hCGb, subunidad ßlibre de la gonadotrofina coriónica humana; LDH, deshidrogenasa láctica; NSE, enolasa específica neuronal; NSGCT, tumores de células germinales; PLAP, fosfatasa alcalina placentaria (célula germinal).
NOTA. LOE, nivel de evidencia (120), nivel de evidencia desde un estudio único, de alto poder, prospectivo y controlado que está diseñado específicamente para controlar al marcador, o la evidencia de una meta-análisis, análisis en conjunto o una visión general de los estudios de niveles II o III, nivel II, evidencia de un estudio en el que los datos del marcador están determinados en relación con prueba terapéutica prospectiva para evaluar la hipótesis terapéutica pero no específicamente diseñada para evaluar la utilidad del marcador; nivel III, evidencia de grandes estudios prospectivos; estudios de niveles; nivel V, evidencia de pequeños estudios piloto.
Marcadores tumorales en cáncer de testículo: recomendaciones de la NACB
La Tabla II presenta un resumen de las recomendaciones de guías representativas publicadas acerca del uso de marcadores tumorales en el cáncer de testículo. Esta Tabla también sintetiza las guías de la NACB para el uso de marcadores en esta malignidad. Varios grupos han realizado recomendaciones detalladas con respecto al manejo del cáncer de testículos (13-21), algunas de las cuales referidas al uso de los marcadores tumorales se sintetizan en la Tabla III. La Tabla IV sintetiza la significancia pronóstica de los marcadores tumorales en suero en el cáncer de testículos, de acuerdo con la declaración de consenso de la Germ Cell Consensus Classification (IGCCC), que sigue siendo la piedra fundamental para el diagnóstico y tratamiento de tumores de células germinales. Más abajo, se revisan los tipos histológicos de cáncer de testículo y presenta una discusión más detallada sobre los marcadores listados en estas Tablas.
Tabla II. Recomendaciones para el uso de marcadores tumorales en cáncer de testículos por diferentes grupos de expertos
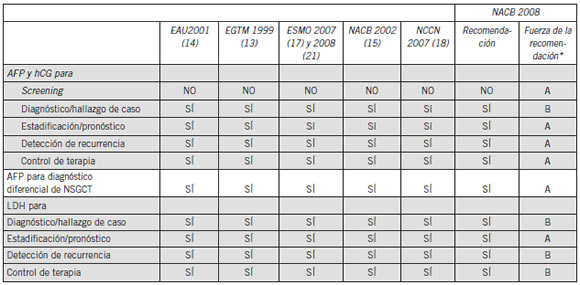
Abreviaturas: AFP, a-fetoproteína; hCG, gonadotrofina coriónica humana; LDH, deshidrogenasa láctica; EGTM, European Group on Tumor Markers, EAU, European Association of Urologists; NACB, National Academy of Clinical Biochemistry
*Fuerza de la recomendación (520): A= Alta [Es altamente improbable que posteriores investigaciones cambien la confianza del Panel en la estimación del efecto]; B =Moderada [Es probable que posteriores investigaciones tengan un impacto importante en la Confianza del Panel en estimar el efecto y probablemente cambie la estimación; C= Baja [Es muy probable que posteriores investigaciones tengan un importante efecto de la confianza del Panel en la estimación del efecto y probablemente cambie la estimación; D = Muy baja [Es muy incierta cualquier estimación del efecto].
Tabla III. Frecuencia recomendada de mediciones de marcadores tumorales en el seguimiento de pacientes con cáncer de testículo (16)

Abreviaturas: NSGCT, tumores de células germinales no seminomatosos; RPLND, disección de nódulo linfático retroperitoneal.
a Mediciones cada dos meses recomendada; mediciones una vez por mes durante los primeros seis meses aconsejable.
b Mediciones cada tres meses recomendada; mediciones cada dos meses aconsejable.
c Una medición una vez al año es aconsejable.
Tabla IV. Clasificación de tumores de células germinales metastásicas en distintos grupos de riesgo de acuerdo a la International Germ Cell Consensus Classification (66)*

*Adaptado de Referencia (66) y reproducido con permiso.
Abreviaturas: AFP, a-fetoproteína; hCG, gonadotrofina coriónica humana; hCGß; LDH, deshidrogenasa láctica; N: limite superior del normal; PFS: sobrevida libre de progresión.
Tipos histológicos de cáncer de testículo
En una clasificación más reciente de Mostofi-OMS (8)(22), los cánceres de testículo están subdivididos en dos tipos importantes, seminomas y NSGCT, los que difieren con respecto tanto a la expresión del marcador como al tratamiento del mismo. La incidencia de seminoma alcanza su nivel máximo en la cuarta década de vida y la de NSGCT en la tercera. Los seminomas pueden ser seminomas puros o los seminomas espermatocíticos raros que se presentan en grupos de mayor edad. La mayoría de los NSGCT son una mezcla de tipos histológicos (es decir, carcinomas embrionarios, coriocarcinomas, teratomas, y tumores de saco vitelino). Alrededor del 10% al 20% de los no-seminomas también contienen un componente de seminoma. Se los clasifica como tumores combinados de acuerdo a la clasificación británica (23), pero como no seminomas de acuerdo al sistema de clasificación de la OMS (22). Los teratomas se subdividen además en maduros o inmaduros. Los cánceres somáticos de distinto tipo ocasionalmente se desarrollan de un teratoma y se los clasifica como malignidades de células no germinales. Las metástasis pueden contener cualquier componente que se presente en el tumor primario y ocasionalmente componentes que no son detectados en el tumor primario (22). Menos del 10% de los NSGCT contienen un tipo tisular único y deberían describirse todos los tipos histológicos de tejido (24).
La lesión precursora de los seminomas y no seminomas testiculares es un carcinoma in situ (CIS) (25), también conocido como neoplasia de células germinal intratubular no clasificada (ITGCNU) y neoplasia intratubular testicular (TIN). Las células CIS se encuentran dentro del nicho de espermatogonias del túbulo seminífero en el testículo del adulto, en proximidad con las células de Sertoli, las células que asisten en la espermatogénesis (26). Las células CIS pueden detectarse en el parénquima adyacente de los tumores más invasivos, y están más frecuentemente asociados con los NSGCT que con los seminomas (27). Se considera que la ITGCNU representa la contraparte pre-cancerígena de la célula germinal embrionaria, muy probablemente una célula germinal primordial o gonocito. Esta teoría está apoyada en múltiples hallazgos, entre ellos la epidemiología, la morfología, la inmunohistoquímica y la caracterización molecular (28)(29).
Los datos recientes indican que los hombres infértiles con microlitiasis bilateral tienen un mayor riesgo (hasta 20%) de desarrollar seminomas testiculares y NSGCT (30). En esta circunstancia se indica biopsia quirúrgica para evaluar la presencia de ITGCNU (31).
Marcadores tisulares para cáncer de testículo
ABERRACIONES GENÉTICAS
Se observa una ganancia de 12p en los tumores celulares germinales tanto de origen testicular como extragonadal. Esto indica que una ganancia de secuencias 12p puede ser de importancia crucial para el desarrollo de este cáncer y, de hecho, este hallazgo se usa para diagnosticar tumores de células germinales en sitios extragonadales (32). Sin embargo, la expresión nivel de secuencias 12p no se correlaciona con el estadio de la enfermedad y la sensibilidad/resistencia al tratamiento (33-35). El determinante crucial de la respuesta a los compuestos basados en cisplatino parece producirse cuesta debajo de la unión del ADN en las vías intrínsecas o extrínsecas de la apoptosis o de la reparación del ADN (36-38).
Mientras que la mayoría de los tumores de células germinales muestran un desajuste en una vía de reparación de ADN intacto, se ha observado un defecto que da lugar a inestabilidad de los microsatélites en los tumores refractarios a cisplatino (39-41). Otros hallazgos potencialmente relevantes en el contexto de la sensibilidad y resistencia al tratamiento tienen que ver con un posible defecto en la función de la caspasa 9 (42). Todos estos factores podrían ser importantes y es improbable que uno solo determine la sensibilidad o la resistencia al tratamiento. Esto se ilustra por medio del hallazgo de que los teratomas maduros son resistentes a varios protocolos de tratamiento que dañan el ADN (38), posiblemente debido a cambios epigenéticos que se dan durante la diferenciación somática. La mayoría de los seminomas y no seminomas invasivos contienen copias adicionales del cromosoma X (43). Es interesante, ya que durante un desarrollo normal (femenino) se puede producir la inactivación de X en estos tumores, en los que XIST es el gen regulatorio (6). Se ha sugerido que la detección de ADN XIST no metilado en plasma es útil para el diagnóstico molecular y el control de pacientes con GCT testicular (44). Esta observación amerita posteriores investigaciones.
En una serie de estudios se ha relacionado el desarrollo de los tumores de células germinales a un control G1/S desregulado, posiblemente relacionado con una falta de un gel regulador del ciclo celular del retinoblastoma (RB) (45) y consecuentemente sin regulación de p21 luego de inducción de daño al ADN. Las células sin p21 muestran una menor capacidad de reparación del daño al ADN inducido por cisplatino y una mayor sensibilidad al cisplatino (46). Los teratomas maduros resistentes al tratamiento muestran, en contraste con otros componentes invasivos, tinción positiva para múltiples proteínas potencialmente relacionadas con la resistencia al tratamiento. Además, son positivos para el gen RB y p21 lo que les posibilita detener el arresto del ciclo G1/S (47)(48). Esto podría explicar la observación acerca de que el teratoma maduro residual se encuentra en alrededor del 30% al 40% de los remanentes de las metástasis iniciales después de quimioterapia. Se ha desarrollado un modelo predictivo para la histología de una masa retroperitoneal residual, basado en una histología de tumor primario, marcadores pre-quimioterapia, tamaño de la masa, y reducción del tamaño con quimioterapia (49). Se ha identificado a la ausencia de elementos de teratoma o de células viables para cáncer en el tumor primario como el predictor más poderoso para tejido residual benigno (50). No obstante, se pide precaución ya que las pequeñas áreas de teratoma pueden haberse perdido en el tumor primario, y la ausencia de elementos de teratoma no excluye la aparición de células malignas en masas residuales. Estos hallazgos nuevamente pueden estar relacionados con el origen de estos tumores (51) ya que la expresión RB no se encuentra en gonocitos fetales humanos ni en ITGCNU (52)(53).
INVASIÓN VASCULAR
Se debe prestar particular atención a la presencia o ausencia de invasión vascular como un predictor de proliferación metastásica y metástasis ocultas (54). Distinguir invasión venosa de linfática no agrega ningún tipo de información relativa al riesgo de metástasis oculta.
Aparte de invasión vascular, la alta actividad proliferativa (evaluada con el anticuerpo monoclonal MIB-1), y en menor medida la presencia de carcinoma embrionario en el tumor primario y un estadio patológico alto, han demostrado ser predictores de una diseminación sistémica en NSGCT en estadio I (para una revisión, ver (55)). Sin embargo, es limitado el valor predictivo de este modelo ya que el grupo definido como de alto riesgo de hecho tiene un 50% de riesgo de metástasis oculta, y el grupo de riesgo bajo, un 16% de riesgo. La evaluación prospectiva de los factores de riesgo para remisión en NSGCT en estadio clínico I también mostró que la invasión vascular era el factor predictivo más fuerte (56). Con el agregado de otros dos parámetros de riesgo (score MIB-1, >70% y carcinoma embrionario =50%), el valor predictivo positivo aumentó a 63,6%. Por lo tanto, inclusive con una combinación óptima de factores pronósticos y patología de referencia, más de un tercio de los pacientes para los que se predijo un estadio II patológico o una recaída durante el seguimiento no tendrán enfermedad metastásica y recibirán sobre-tratamiento con terapia adyuvante. Contrariamente, la predicción de los pacientes con bajo riesgo será más precisa (86,5%), lo que sugiere que la vigilancia puede ser una opción para los pacientes altamente adaptables. Recientemente, se ha usado el algoritmo de agrupamiento para identificar subgrupos de pronóstico en pacientes con carcinoma embrionario (57).
Marcadores séricos para cáncer de testículo
EXPRESIÓN DEL MARCADOR Y TIPO DE TUMOR
Ciertos marcadores han demostrado ser informativos para la clasificación de los seminomas y los NSGCT. En la mayoría de los seminomas y los carcinomas embrionarios se detecta fosfatasa alcalina de células germinales/placentales (PLAP), en 50% de los tumores de saco vitelino y coriocarcinomas, pero sólo rara vez en los teratomas. La gonadotrofina coriónica humana (hCG) se expresa por sinciciotrofoblastos coriocarcinoma y aproximadamente 30% de seminomas. De los otros marcadores tisulares, el receptor de factores de células madre (c-KIT) se ha usado principalmente para detectar ITGCNU y seminoma, CD30 para detectar carcinoma embrionario y a-fetoproteína (AFP) para detectar tumores de saco vitelino y un sub-conjunto de 10% a 20% de carcinomas embrionarios y teratomas. Recientemente, se ha identificado un marcador OCT3/4 potencialmente valioso, también conocido como POU5F1 (58-61).
A pesar de que se ha estudiado un gran número de marcadores en suero, hasta el momento sólo, hCG, AFP, y lactato deshidrogenasa (LDH) han demostrado tener valor diagnóstico y pronóstico independiente (Tablas II y III). Resta establecer el valor clínico de otros marcadores. La Tabla V sintetiza las limitaciones analíticas de los ensayos disponibles para algunos de los marcadores tumorales más importantes, establecidos y experimentales. Las implicancias de estas limitaciones para el uso de marcadores tumorales en la práctica de rutina se discuten luego más detalladamente.
Tabla V. Requerimientos analíticos y factores potenciales que interfieren en la determinación de marcadores séricos establecidos y experimentales para tumores en células germinales

Abreviaturas: AFP, a-fetoproteína; hCG, gonadotrofina coriónica humana; hCGß, sub-unidad-ßde gonadotrofina coriónica humana; hCGa, subunidad a libre de gonadotrofina crónica humana; LDH, deshidrogenasa láctica; NSE, enolasa neurona específica; PLAP, fosfatasa alcalina (de células germinales) placentaria
Aplicaciones clínicas de los marcadores tumorales séricos en cáncer de testículo
DIAGNÓSTICO
Los pacientes con tumor de células germinales de testículo pueden presentar una masa testicular indolora, mientras que otros también tienen síntomas causados por enfermedad metastásica. La rutina clínica incluye examen físico, ultrasonido de testículos, y tomografía computada (TC) de la pelvis, abdomen y pecho (62). Es obligatoria en todos los pacientes la determinación de hCG, AFP y LDH en suero antes de la terapia. La concentración de marcadores en suero es dependiente del tipo histológico y de la carga tumoral (es decir, el estadio). En un estudio amplio colaborativo reciente 64% de los tumores fueron NSGCT y 36% seminomas (63). De los últimos, 77% presentaron enfermedad en estadio I (es decir, tumor localizado en los testículos), y 21% tuvieron niveles de hCG elevados en suero. De aquellos con NSGCT, 52% tuvieron enfermedad en estadio I y 79% tu vieron niveles elevados de marcadores (tanto hCG como AFP elevadas en 44%, sólo AFP en 26% y sólo hCG en 9% (63). En pacientes con seminoma las concentraciones de hCG son usualmente inferiores a 300 U/L. Niveles de 1000 U/L están mayormente asociados con NSGCT. Los niveles de 10000 U/L se ven principalmente en pacientes con coriocarcinoma puro pero ocasionalmente pueden darse en seminoma. La LDH se encuentra elevada en 40-60% de los pacientes con seminoma o NSGCT (64). La clasificación de un tumor se basa en un examen histológico, pero si la AFP en suero está elevada, un tumor clasificado como seminoma se reclasifica como NSGCT y se lo trata en consecuencia (4).

ESTADIOS, ESTRATIFICACIÓN Y SELECCIÓN DE LA TERAPIA
Las concentraciones elevadas en suero de AFP, hCG y LDH están asociadas con pronósticos adversos (65)(66). Una concentración elevada en suero es un fuerte factor pronóstico, y el riesgo de recurrencia aumenta a medida que aumenta la concentración (67). El International Germ Cell Cancer Collaborative Group (IGCCCG) ha incorporado las concentraciones de hCG, AFP, y LDH en suero en un esquema para la clasificación de tumores de células germinales metastásicas (Tabla IV). Los tumores se clasifican de acuerdo a si tienen un pronóstico bueno, intermedio o pobre, basado en los niveles de los marcadores, el sitio primario del tumor y la presencia o ausencia de metástasis viscerales no-pulmonares (66).
La selección del tratamiento se basa en el tipo de tumor y el pronóstico. Los seminomas estadio I pueden ser tratados solamente con orquiectomía, lo que lleva a la cura en 80% a 85% de los pacientes. La orquiectomía en combinación con radioterapia de los nódulos linfáticos del abdomen lleva a la cura en 97% a 99% de los pacientes, y este abordaje se usa de rutina en muchos centros. Sin radioterapia, 15% a 20% de los pacientes sufre una recaída, pero la mayoría de ellos se curan en la terapia de segunda línea. Por consiguiente, una alternativa a la radioterapia es la vigilancia con mayor frecuencia. Cuando el tratamiento consiste en orquiectomía solamente, los pacientes en NSGCT estadio I tienen un 30% de riesgo de recaída. El riesgo es mayor (50%) si hay infiltración perivascular con relación a si la misma está ausente (15% a 20% de riesgo). El riesgo de recaída es muy bajo si se realiza la disección de nódulo linfático retroperitoneal (RPLND) en conexión con terapia primaria. Este procedimiento está asociado con la morbilidad y por consiguiente se usa vigilancia como alternativa de la RPLND. La quimioterapia es otra alternativa de la RPLND, pero los tumores retroperitoneales residuales están constituidos por teratomas, los que tienen que ser tratados con cirugía, tal como se observa a menudo. Si los niveles de marcadores en suero no se normalizan o aumentan después de la RPLND, muy probablemente haya presentes nódulos linfáticos retroperitoneales o enfermedad sistémica que requiera de quimioterapia (68)(69).
MAYOR ESTRATIFICACIÓN DEL RIESGO
El carcinoma embrionario es el tipo celular más común en NSGCT. Es totipotencial y los tumores con carcinoma embrionario puro están asociados con enfermedad metastásica temprana. Existe por consiguiente la necesidad de estimar el pronóstico de manera más precisa en tumores que contengan este tipo de células. El algoritmo de agrupamiento de marcadores en suero AFP y hCG en combinación con los marcadores tisulares p53, Ki67, y el índice de apoptosis sugieren que un patrón con Ki67 alto, apoptosis baja, y p53 baja se encuentra asociado con mejor sobrevida que otros patrones. Se ha informado que la clasificación con este algoritmo es independiente de la clasificación IGCCCG (67). Si se pueden confirmar estos resultados, se podría contar con una terapia más precisa acorde a cada paciente.
CONTROL DE RESPUESTA A LA TERAPIA
Si AFP o hCG en suero se encuentran elevadas antes de la terapia, la tasa de disminución del marcador refleja la respuesta a la terapia. Una persistente elevación del marcador luego de la quimioterapia indica enfermedad residual y la necesidad de una posterior terapia (70)(71). La quimioterapia puede inducir un aumento o sobrecarga transitoria en las concentraciones de los marcadores durante la primera semana del tratamiento (72).

En ausencia de enfermedad residual después de la orquidectomía, la vida media de la hCG es aproximadamente 1,5 días y la de la AFP es 5 días (73)(74). Durante la quimioterapia, las media vidas >3,5 días para hCG o >7 días para AFP predicen recurrencia y un pronóstico adverso (75). La vida media del marcador se calcula a partir de la pendiente del logaritmo de la concentración del marcador versus el tiempo. Es preferible usar concentraciones de marcadores a distintos tiempos y calcular la vida media a partir de la pendiente de la curva de regresión (64). La vida media debe determinarse luego del aumento inicial del marcador durante dos ciclos de quimioterapia entre los días 7 y 56. Una tasa lenta de reducción del marcador es de uso potencial en pacientes con bajo riesgo y puede implicar la necesidad de una terapia más agresiva (75).

VIGILANCIA
Luego de una terapia primaria exitosa, todos los pacientes son controlados con examen físico, determinaciones de marcadores tumorales, y tomografía computarizada. Con tal vigilancia, en la mayoría de los casos se detecta la recaída antes de que aparezcan los síntomas clínicos. La mayoría de las recaídas ocurren dentro del primer año y las recaídas después de los 2 años son raras pero algunos casos pueden ocurrir inclusive después de 10 años. Se adapta la vigilancia para tener en cuenta el tipo de tumor, el estadio, el tratamiento y la posibilidad de remisión (Tabla III). Los pacientes con enfermedad de bajo riesgo tratados con cirugía solamente se controlan con más frecuencia (por ejemplo, cada 1-2 semanas durante los primeros 6 meses). Algunos centros recomiendan controles semanales para poder detectar una remisión antes de que el tumor aumente a un tamaño asociado con pronóstico adverso, tal como lo estiman las concentraciones en suero de AFP >500 kU/L y de hCG> 1.000 U/L (76). En todos los pacientes el control continúa durante 5 años (16).
CONSIDERACIONES ANALÍTICAS
Las mediciones de marcadores tumorales son obligatorias en el tratamiento de los pacientes con cáncer de testículo. Es por consiguiente apropiado revisar en mayor detalle los requisitos analíticos para estas importantes pruebas.

AFP
Bioquímica y biología. La AFP es un homólogo de la albúmina y se cree que actúa como proteína transportadora en el feto. Durante el embarazo, la AFP es producida inicialmente el saco vitelino v y posteriormente en el hígado del feto (77). Las concentraciones en el plasma del feto alcanzan niveles de 3 g/L entre las 12 y las 14 semanas de embarazo y disminuyen de ahí en delante a 10 cada 200 mg/L a término (78). Luego del nacimiento, las concentraciones circulantes disminuyen con una vida media de 5 días, con una caída a niveles adultos a los 8 a 10 meses de edad (79)(80). Deben recordarse los valores altos que son normales en la infancia temprana cuando se usa AFP como marcador para tumores de saco vitelino, el neoplasma testicular más común en infantes (81)(82).
Métodos de ensayo, estandarización y valores de referencia. La AFP se cuantifica por medio de ensayos inmunométricos de dos sitios que emplean anticuerpos monoclonales o combinaciones de anticuerpos monoclonales y policlonales. Los resultados son generalmente comparables con los obtenidos con el formato de radioinmunoensayo competitivo (RIA) usado previamente. El estándar 72/225 de la OMS, en el que una Unidad Internacional (U) de AFP corresponde a 1,21 ng, se usa para calibración. Los laboratorios informan valores en unidades de masa (ng/mL ó µg/L) ó kU/L. Los valores de referencia deben establecerse para cada ensayo para reflejar las diferencias entre los sesgos de los mismos. La mayoría de los centros citan un límite de referencia superior para AFP en el rango de 10 a 15 µg/L. Las concentraciones en circulación aumentan levemente con la edad: en un estudio el límite de referencia superior aumentó de 9,3 kU/L en sujetos menores de 40 años a 12,6 kU/L en aquellos mayores de 40 (83).
Resultados falso positivos. Los niveles crecientes de AFP en suero indican tumores de células germinales persistentes, inclusive en ausencia de evidencia radiográfica de la enfermedad, siempre y cuando se puedan excluir otras causas posibles (ver más abajo) (4). Los niveles de AFP moderadamente elevados pueden persistir inclusive luego de la quimioterapia, particularmente cuando la enfermedad persistente tiene un gran componente de quistes, sirviendo como reservorio que envía AFP a la circulación (84). Concentraciones elevadas de AFP en suero se presentan en la mayoría de los carcinomas hepatocelulares y en el 10% a 30% de los otros cánceres gastrointestinales, pero estas enfermedades son raras en pacientes con cáncer de testículo. Los valores de AFP elevados pueden no reflejar cáncer, y es por consiguiente importante identificar los resultados positivos causados por otras enfermedades y por interferencias no específicas. La enfermedad hepática benigna, en particular la hepatitis, y el daño hepático inducidos por quimioterapia están a menudo asociados con niveles de AFP en suero moderadamente elevados, y pueden dar por resultado interpretaciones confusas especialmente si los niveles están en aumento (85)(86).
La composición de carbohidratos del AFP derivada del hígado y el saco vitelino son diferentes (87). La unión a la lectina puede diferenciar a los niveles en aumento causados por cáncer de testículo y enfermedad hepática (88), pero tales métodos no se utilizan de rutina. Los pacientes que tienen inicialmente niveles de AFP elevados pueden tener niveles normales durante una remisión si la terapia ha eliminado los elementos que producen la AFP pero no todos los otros componentes (89). Los valores moderadamente elevados que permanecen estables usualmente no indican remisión (86).
HCG Y HCGb
Bioquímica y biología. La hCG es miembro de la familia de hormonas glicoproteína, que incluye a la hormona luteinizante (LH), la hormona estimulante de folículos (FSH), y la hormona estimulante de tiroides (TSH). Las cuatro contienen una subunidad a común. Las subunidades ßdistintivas confieren actividad biológica y muestran distintos grados de homología, que es del 80% aproximadamente entre las subunidades ßde LH (LHß) y hCG (hCGß). La hCGßcontiene una extensión C-terminal de 24 aminoácidos ausente en LHß, entonces los anticuerpos para esta parte de la molécula son específicos para hCG. Mientras que las subunidades carecen de la actividad hCG, la hCGßha demostrado mejorar el crecimiento de las células tumorales en cultivo al prevenir la apoptosis (90). La hCG se expresa en concentraciones muy altas por la placenta y tumores trofoblásticos incluyendo el coriocarcinoma de testículos. La hCG es altamente glicosilada, la hCGßcontiene 6 y la hCGa 2 cadenas de carbohidratos. La glicosilación de hCG secretada por tumores es a menudo diferente de la hCG del embarazo. Un anticuerpo, el B152, detecta sólo una variante hiperglicosilada de hCG. Esta forma predomina al comienzo del embarazo y es posiblemente más específica del cáncer que la hCG "normal" (91).
Nomenclatura, métodos de ensayo, estandarización y valores de referencia. La determinación específica de hCG se basa en anticuerpos que reaccionan con la hCGß(92). Esto ha causado confusión en la nomenclatura de los ensayos de hCG—las expresiones "ß-hCG" o "ensayo hCG-beta" pueden denotar ensayos que miden tanto hCG como hCGßo solamente hCGß. De acuerdo a la nomenclatura recomendada por la International Federation of Clinical Chemistry (IFCC), hCG denota el heterodímero aßintacto, hCGßla subunidad ßlibre y hCGa la subunidad a libre (93). Los ensayos deben ser definidos de acuerdo a lo que miden (es decir, hCG y hCGßseparadamente o hCG y hCGßjuntas (64)(94)).
Los ensayos para hCG están actualmente calibrados con los Fourth International Standards (IS 75/589), en los que las concentraciones se expresan en U basadas en la bioactividad. Sin embargo, es difícil comparar las concentraciones de hCG con aquellas de hCGßy hCGa las que se expresan en diferentes unidades arbitrarias de los International Standards relevantes (IS 75/551 e IRP 75/569, respectivamente). Los reactivos de referencia de la OMS recientemente establecidos tienen valores asignados en concentraciones molares, que deberían facilitar la comparación directa de concentraciones de hCG y hCGßen el futuro (93)(95).
Debido a que los seminomas pueden producir solamente hCGßy no hCG intacta, es esencial que tanto hCG y hCGßsean medidas cuando se controla cáncer de testículo (14)(96). Se han publicado las recomendaciones sobre combinaciones de anticuerpos que reconocen las formas más importantes de isoformas relacionadas con la hCG y son apropiadas para el uso en oncología (94). Los ensayos que reconocen tanto hCG y hCGßa menudo utilizan anticuerpos para el epítope de los péptidos C-terminal de hCGß, pero las afinidades relativamente bajas de estos anticuerpos pueden limitar la sensibilidad de los ensayos (94). Teóricamente, debería ser posible mejorar la detección de cáncer de testículo usando ensayos separados para hCG y hCGß(64)(96) pero esto tienen que ser confirmado todavía.
La hCG es secretada a bajos niveles por la pituitaria, lo que produce niveles en plasma que son mensurables por métodos sensibles. Las concentraciones en suero pueden aumentar con la edad, particularmente en las mujeres después de la menopausia (97)(98). Para la mayoría de los ensayos, el límite de referencia superior de hCG se establece de 5 a 10 U/L. Cuando se lo determina por métodos ultrasensibles, el límite superior para las mujeres pos menopáusicas es 5 U/L mientras que es 3 U/L en mujeres menstruando. El límite de referencia superior para hombres menores de 50 años es 0,7 U/L y para hombres mayores de 50 años es 2,1 U/L (98).
Valores de corte menores que los 5 a 10 U/L comúnmente usados pueden usarse para diagnosticar a los pacientes con cáncer de testículo. Sin embargo, a pesar de que la mayoría de los hombres con cáncer de testículo son jóvenes, sus niveles de hCG pueden elevarse debido a malfuncionamiento testicular. Por consiguiente, el diagnóstico de la enfermedad activa en un paciente con historia de tumor celular germinal requiere determinaciones secuenciales y valores en aumento. El límite de detección de la mayoría de los ensayos comerciales no permite la medición confiable de niveles por debajo de 5 U/L y debe determinarse la utilidad de los ensayos ultrasensibles y los valores de corte más bajos (64). Cuando se lo expresa en concentraciones molares, 5 U/L de hCG corresponde a 15 pmol/L. El límite de referencia superior para hCGßes 2 pmol/L y es independiente de la edad y el sexo (98).
Especificidad y factores de confusión. Es importante notar que la quimioterapia a menudo causa la supresión gonadal que incrementa los niveles de hCG. Tal hipogonadismo puede también ser espontáneo. Se lo puede confirmar con la medición de LH y FSH en suero y, de ser necesario, supresión con reemplazo de testosterona (99). Por consiguiente, el aumento desde niveles inferiores a 2 hasta 5 u 8 U/L durante la quimioterapia es a menudo iatrogénico y no necesariamente indica remisión. Los niveles moderadamente elevados de hCG pueden ser de origen pituitario, especialmente si los niveles en suero de LH y FSH que acompañan exceden 30 o 50 U/L y son atribuidos a la interrupción de la inhibición feedback por las gónadas. Esto puede confirmarse por medio del tratamiento con testosterona a corto plazo, que suprime la secreción de hCG de la pituitaria (100)(101).
Los tumores no-trofoblásticos pueden en casos muy raros producir hCG, mientras que hCGßes a menudo expresada en niveles moderados por una gran variedad de tumores, entre ellos, el cáncer de ovario, gastrointestinal, de vejiga, y de cabeza y cuello (101). Algunos pacientes con esos tumores tendrán niveles de hCG elevados cuando se realice la medición por medio de un ensayo que reconozca tanto hCG como hCGß.
Los resultados falsamente elevados para hCG en suero pueden ser originados por anticuerpos heterofílicos. Esto sólo se ha informado en mujeres (102) pero no existe ninguna razón por la cual no debiera ocurrir en hombres. Los resultados falso-positivos pueden ser identificados por análisis de hCG en orina o por repetición del ensayo luego de agregar un agente bloqueador (por ejemplo, IgG de ratón no-inmune) a la muestra para bloquear la interferencia (64)(102).
Los resultados aparentemente falso-negativos se obtendrán con ensayos que midan solamente la hCG si el tumor produce hCGßpero no hCG. Mientras que es más común en el seminoma (103) puede también ocurrir en los pacientes NSGCT (104).
LDH
Bioquímica y biología. LDH en circulación existe como un tetrámero que puede contener varias combinaciones de dos subunidades, LDH-A y LDH-B. Las distintas subunidades pueden combinarse en cinco isoenzimas. LDH-1 [que consiste en cuatro subunidades B (B4)], LDH-2 (B3 A1), LDH-3 (B2 A2 ); LDH-4 (B1 A3 ); y LDH-5 ( A4 ). El gen que codifica LDH-A está localizado en el cromosoma 11 mientras que el gen para LDH-B está localizado en el brazo corto del cromosoma 12 (es decir, 12p) (105). Es interesante notar que todos los seminomas invasivos y NSGCT muestran copias adicionales de este brazo de cromosoma (106), lo que sugiere que puede cumplir una función en la progresión de la enfermedad. No se detecta ninguna ganancia de 12p en ITGCNU (107)(108). Se ha informado una correlación entre el número de copia de 12p, la invasividad del tumor, y el nivel en suero de LDH-1, pero hasta ahora no han sido identificados los genes 12p relevantes (109). Aunque son en teoría interesantes, todavía queda confirmar estos hallazgos.
Especificidad y factores de confusión. Las concentraciones de LDH en suero se miden enzimáticamente y los valores son dependientes del método. El grado de elevación se expresa por consiguiente de un modo más conveniente en relación con el límite de referencia superior. LDH-1 puede determinarse por zimografía o por inmunoprecipitación de las otras enzimas y la determinación de la actividad catalítica residual. LDH se expresa en muchos tejidos y los niveles elevados pueden estar ocasionados por una gran variedad de enfermedades. A pesar de su falta de especificidad, LDH es un marcador útil, especialmente para los estadios del seminoma y NSGCT (108). La hemólisis puede causar valores falsamente elevados y debe evitarse.
FOSFATASA ALCALINA DE LA PLACENTA
Bioquímica y biología. Una isoenzima de fosfatasa alcalina asociada a tumores fue descripta por primera vez en un paciente con cáncer de pulmón y posteriormente detectada en el suero de pacientes con otros cánceres e identificada como fosfatasa alcalina placentaria (PLAP) (100). De hecho, dos genes codifican las proteínas detectadas como actividad PLAP (es decir, enzimas PLAP y de células germinales [GCAP]). Ambos genes mapean al cromosoma 2 y no se pueden distinguir las proteínas unas de otras usando métodos enzimáticos de rutina o inmunohistoquímicos (111). PLAP está elevada más frecuentemente en pacientes con seminoma (60% a 70%) (112)(113), y menos frecuentemente en aquellos con otros tumores de células germinales, entre ellos ITGCNU (24). Se puede usar un método enzimático para detectar células ITGCNU en secciones de tejido congelado (114).
Métodos de ensayo, estandarización y valores de referencia. PLAP ha estado usualmente determinado por zimografía pero también puede medirse por inmunoensayo o enzimáticamente luego de inmunocaptura (113). El resultado debe compararse con valores de referencia localmente determinados. Debido a la homología con otras isoenzimasde fosfatasa alcalina, la selección de anticuerpos es crítica. Sin embargo, los anticuerpos disponibles hasta la actualidad no pueden distinguir entre isoenzimas PLAP y GCAP. Por consiguiente, PLAP denota ambas isoenzimas.
Especificidad y factores de confusión. Las concentraciones de PLAP en suero están elevadas hasta 10 veces en los fumadores y su medición es por consiguiente de poco valor para este grupo (113). Esto y la escasez de ensayos comerciales limitan su aplicación clínica y los ensayos en suero para PLAP no están incluidos de rutina en la evaluación diagnóstica de los pacientes con cáncer de testículo.
OTROS MARCADORES
A pesar de que la glicoproteína beta-1 específica del embarazo (o SP1) y la hCG están ambas expresadas en las células trofoblásticas, hCG es el marcador superior (115). En consecuencia, SP1 no se mide de rutina. La enolasa neurona-específica (NSE) se encuentra elevada en aproximadamente 30% a 50% de los pacientes con seminomas y con menos frecuencia en los pacientes NSGCt (116)(117), pero a pesar de estos resultados promisorios, el uso de NSE es limitado.
Puntos clave: marcadores tumorales en cáncer de testículo
Los marcadores tumorales son de central importancia en el diagnóstico, estadio, evaluación del riesgo y control de los pacientes con cáncer de testículo. Se han descripto varios marcadores en suero pero sólo se han validado minuciosamente AFP, hCG y LDH y han demostrado tener valor pronóstico independiente. Varios marcadores tisulares pueden probar ser clínicamente importantes en el diagnóstico y clasificación de tumores de células germinales de testículo. Los tumores de células germinales también muestran anomalías cromosómicas típicas y amplificaciones de 12p suficientemente características como para ser útiles en la clínica para identificar tumores de células germinales extratesticulares. Los desarrollos de diagnósticos basados en ADN han revelado una cantidad de cambios que en el futuro pueden permitir una estratificación del pronóstico más precisa.
1. Field M, Lorh K, eds. Clinical practice guidelines: Directions for a New Program. Washington DC: National Academy Press, 1990.
2. Diamandis EP, Hoffman BR, Sturgeon C. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for the Use of Tumor Markers. Clin Chem 2008; 54: 1935-9.
3. Sturgeon CM, Hoffman BR, Chan DW, Ch'ng S-L, Hammond E, Hayes DF, et al. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for Use of Tumor Markers in Clinical Practice: Quality Requirements. Clin Chem 2008; 54: e1-10.
4. Bosl GJ, Motzer RJ. Testicular germ-cell cancer. N Engl J Med 1997; 337: 242-53.
5. Mead GM, Stenning SP. Prognostic factors in metastatic nonseminomatous germ cell tumours: the Medical Research Council studies. Eur Urol 1993; 23: 196-200.
6. Looijenga LH, Gillis AJ, van Gurp RJ, Verkerk AJ, Oosterhuis JW. X inactivation in human testicular tumors. XIST expression and androgen receptor methylation status. Am J Pathol 1997;151: 581-90.
7. Looijenga LH, Oosterhuis JW. Pathobiology of testicular germ cell tumors: views and news. Anal Quant Cytol Histol 2002; 24: 263-79.
8. Woodward P, Heidenreich A, Lhj L. Testicular germ cell tumors: views and news. Lyon: IARC Press, 2004.
9. Oosterhuis JW, Looijenga LH, van EJ, de JB. Chromosomal constitution and developmental potential of human germ cell tumors and teratomas. Cancer Genet Cytogenet 1997; 95: 96-102.
10. Huyghe E, Matsuda T, Thonneau P. Increasing incidence of testicular cancer worldwide: a review. J Urol 2003; 170: 5-11.
11. McGlynn KA, Devesa SS, Sigurdson AJ, Brown LM, Tsao L, Tarone RE. Trends in the incidence of testicular germ cell tumors in the United States. Cancer 2003; 97: 63-70.
12. Oliver RT, Mason MD, Mead GM, von der Maase H, Rustin GJ, Joffe JK, et al. Radiotherapy versus single-dose carboplatin in adjuvant treatment of stage I seminoma: a randomised trial. Lancet 2005; 366: 293-300.
13. Tumour markers in germ cell cancer: EGTM recommendations. Anticancer Res 1999; 19: 2795-8.
14. Laguna MP, Pizzocaro G, Klepp O, Algaba F, Kisbenedek L, Leiva O. EAU guidelines on testicular cancer. Eur Urol 2001; 40: 102-10.
15. Fleisher M, Dnistrian A, Sturgeon C, Lamerz R,Witliff J. Practice guidelines and recommendations for use of tumor markers in the clinic. Tumor Markers: Physiology, pathobiology, technology and clinical applications, Vol. Washington: AACC Press, 2002: 33-63.
16. Schmoll HJ, Souchon R, Krege S, Albers P, Beyer J, Kollmannsberger C, et al. European consensus on diagnosis and treatment of germ cell cancer: a report of the European Germ Cell Cancer Consensus Group (EGCCCG). Ann Oncol 2004; 15:1377-99.
17. Testicular seminoma: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol 2007; 18 Suppl 2: ii40-1.
18. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology, Testicular Cancer. Version 1. 2007.http://www.nccn.org/professionals/physician_ gls/PDF/testicular.pdf (Accessed (Accessed 19th June 2007).
19. Mixed or non-seminomatous germ-cell tumors: ESMO Clinical Recommendations for diagnosis, treatment and follow-up. Ann Oncol 2007; 18 Suppl 2: ii42-3.
20. Albers P, Albrecht W, Algaba F, Bokemeyer C, Cohn-Cedermark G, Horwich A, et al. Guidelines on testicular cancer. Eur Urol 2005; 48: 885-94.
21. Huddart R, Kataja V. Testicular seminoma: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2008;19 Suppl 2: ii49-51.
22. Mostofi FK, Sesterhenn IA, Davis CJ, Jr. Developments in histopathology of testicular germ cell tumors. Semin Urol 1988; 6: 171-88.
23. Pugh R. Combined Tumours. Pathology of testis,Vol. Blackwell: Oxford, 1976: 245-58.
24. Mostofi FK, Sesterhenn IA, Davis CJ, Jr. Immunopathology of germ cell tumors of the testis. Semin Diagn Pathol 1987; 4: 320-41.
25. Skakkebaek NE. Possible carcinoma-in-situ of the testis. Lancet 1972; 2: 516-7.
26. Gondos B, Hobel CJ. Ultrastructure of germ cell development in the human fetal testis. Z Zellforsch Mikrosk Anat 1971; 119: 1-20.
27. Oosterhuis JW, Kersemaekers AM, Jacobsen GK, Timmer A, Steyerberg EW, Molier M, et al. Morphology of testicular parenchyma adjacent to germ cell tumours. An interim report. APMIS 2003; 111: 32-40.
28. Rajpert-De ME, Skakkebaek NE. Expression of the c-kit protein product in carcinoma-in-situ and invasive testicular germ cell tumours. Int J Androl 1994; 17: 85-92.
29. van Gurp RJ, Oosterhuis JW, Kalscheuer V, Mariman EC, Looijenga LH. Biallelic expression of the H19 and IGF2 genes in human testicular germ cell tumors. J Natl Cancer Inst 1994; 86: 1070-5.
30. de Gouveia Brazao CA, Pierik FH, Oosterhuis JW, Dohle GR, Looijenga LH,Weber RF. Bilateral testicular microlithiasis predicts the presence of the precursor of testicular germ cell tumors in subfertile men. J Urol 2004; 171: 158-60.
31. Dieckmann KP, Classen J, Loy V. Diagnosis and management of testicular intraepithelial neoplasia (carcinoma in situ)—surgical aspects. APMIS 2003; 111: 64-8.
32. Motzer RJ, Rodriguez E, Reuter VE, Samaniego F, Dmitrovsky E, Bajorin DF, et al. Genetic analysis as an aid in diagnosis for patients with midline carcinomas of uncertain histologies. J Natl Cancer Inst 1991; 83: 341-6.
33. Rao PH, Houldsworth J, Palanisamy N, Murty VV, Reuter VE, Motzer RJ, et al. Chromosomal amplification is associated with cisplatin resistance of human male germ cell tumors. Cancer Res 1998; 58: 4260-3.
34. Roelofs H, Mostert MC, Pompe K, Zafarana G, van Oorschot M, van Gurp RJ, et al. Restricted 12p amplification and RAS mutation in human germ cell tumors of the adult testis. Am J Pathol 2000; 157: 1155-66.
35. Zafarana G, Gillis AJ, van Gurp RJ, Olsson PG, Elstrodt F, Stoop H, et al. Coamplification of DAD-R, SOX5, and EKI1 in human testicular seminomas, with specific overexpression of DAD-R, correlates with reduced levels of apoptosis and earlier clinical manifestation. Cancer Res 2002; 62: 1822-31.
36. Spierings DC, de Vries EG, Vellenga E, de Jong S. The attractive Achilles heel of germ cell tumours: an inherent sensitivity to apoptosis-inducing stimuli. J Pathol 2003; 200: 137-48.
37. Masters JR, Koberle B. Curing metastatic cancer: lessons from testicular germ-cell tumours. Nat Rev Cancer 2003; 3: 517-25.
38. Mayer F, Honecker F, Looijenga LH, Bokemeyer C. Towards an understanding of the biological basis of response to cisplatin based chemotherapy in germ-cell tumors. Ann Oncol 2003; 14: 825-32.
39. Mayer F, Gillis AJ, Dinjens W, Oosterhuis JW, Bokemeyer C, Looijenga LH. Microsatellite instability of germ cell tumors is associated with resistance to systemic treatment. Cancer Res 2002; 62: 2758-60.
40. Velasco A, Riquelme E, Schultz M, Wistuba, II, Villarroel L, Koh MS, Leach FS. Microsatellite instability and loss of heterozygosity have distinct prognostic value for testicular germ cell tumor recurrence. Cancer Biol Ther 2004; 3: 1152-8; discussion 1159-61.
41. Velasco A, Riquelme E, Schultz M, Wistuba, II, Villarroel L, Pizarro J, et al. Mismatch repair gene expression and genetic instability in testicular germ cell tumor. Cancer Biol Ther 2004; 3: 977-82.
42. Mueller T, Voigt W, Simon H, Fruehauf A, Bulankin A, Grothey A, Schmoll HJ. Failure of activation of caspase-9 induces a higher threshold for apoptosis and cisplatin resistance in testicular cancer. Cancer Res 2003; 63: 513-21.
43. van Echten J, Oosterhuis JW, Looijenga LH, van de Pol M, Wiersema J, te Meerman GJ, et al. No recurrent structural abnormalities apart from i(12p) in primary germ cell tumors of the adult testis. Genes Chromosomes Cancer 1995; 14: 133-44.
44. Kawakami T, Okamoto K, Ogawa O, Okada Y. XIST unmethylated DNA fragments in male-derived plasma as a tumour marker for testicular cancer. Lancet 2004; 363: 40-2.
45. Strohmeyer T, Reissmann P, Cordon-Cardo C, Hartmann M, Ackermann R, Slamon D. Correlation between retinoblastoma gene expression and differentiation in human testicular tumors. Proc Natl Acad Sci U S A 1991; 88: 6662-6.
46. Fan S, Chang JK, Smith ML, Duba D, Fornace AJ, Jr., O'Connor PM. Cells lacking CIP1/WAF1 genes exhibit preferential sensitivity to cisplatin and nitrogen mustard. Oncogene 1997; 14: 2127-36.
47. Bartkova J, Thullberg M, Rajpert-De Meyts E, Skakkebaek NE,Bartek J. Cell cycle regulators in testicular cancer: loss of p18INK4C marks progression from carcinoma in situ to invasive germ cell tumours. Int J Cancer 2000; 85: 370-5.
48. Mayer F, Stoop H, Scheffer GL, Scheper R, Oosterhuis JW, Looijenga LH, Bokemeyer C. Molecular determinants of treatment response in human germ cell tumors. Clin Cancer Res 2003; 9: 767-73.
49. Steyerberg EW, Keizer HJ, Habbema JD. Prediction models for the histology of residual masses after chemotherapy for metastatic testicular cancer. ReHiT Study Group. Int J Cancer 1999; 83: 856-9.
50. Suurmeijer AJ, Oosterhuis JW, Sleijfer DT, Koops HS, Fleuren GJ. Non-seminomatous germ cell tumors of the testis: morphology of retroperitoneal lymph node metastases after chemotherapy. Eur J Cancer Clin Oncol 1984; 20: 727-34.
51. Rajpert-De Meyts E, Bartkova J, Samson M, Hoei-Hansen CE, Frydelund-Larsen L, Bartek J, Skakkebaek NE. The emerging phenotype of the testicular carcinoma in situ germ cell. Apmis 2003;111: 267-278; discussion 278-9.
52. Bartkova J, Thullberg M, Rajpert-De Meyts E, Skakkebaek NE, Bartek J. Lack of p19INK4d in human testicular germ-cell tumours contrasts with high expression during normal spermatogenesis. Oncogene 2000; 19: 4146-50.
53. Bartkova J, Rajpert-De Meyts E, Skakkebaek NE, Lukas J, Bartek J. Deregulation of the G1/S-phase control in human testicular germ cell tumours. Apmis 2003;111: 252-265; discussion 265-6.
54. Freedman LS, Parkinson MC, Jones WG, Oliver RT, Peckham MJ, Read G, et al. Histopathology in the prediction of relapse of patients with stage I testicular teratoma treated by orchidectomy alone. Lancet 1987; 2: 294-8.
55. Vergouwe Y, Steyerberg EW, Eijkemans MJ,Albers P, Habbema JD. Predictors of occult metastasis in clinical stage I nonseminoma: a systematic review. J Clin Oncol 2003; 21: 4092-9.
56. Albers P, Siener R, Kliesch S, Weissbach L, Krege S, Sparwasser C, et al. Risk factors for relapse in clinical stage I nonseminomatous testicular germ cell tumors: results of the German Testicular Cancer Study Group Trial. J Clin Oncol 2003; 21: 1505-12.
57. Mazumdar M, Bacik J, Tickoo SK, Dobrzynski D, Donadio A, Bajorin D, et al. Cluster analysis of p53 and Ki67 expression, apoptosis, alpha-fetoprotein, and human chorionic gonadotrophin indicates a favorable prognostic subgroup within the embryonal carcinoma germ cell tumor. J Clin Oncol 2003; 21: 2679-88.
58. Looijenga LH, Stoop H, de Leeuw HP, de Gouveia Brazao CA, Gillis AJ, van Roozendaal KE, et al. POU5F1 (OCT3/4) identifies cells with pluripotent potential in human germ cell tumors. Cancer Res 2003; 63: 2244-50.
59. Cheng L, Thomas A, Roth LM, Zheng W, Michael H, Karim FW. OCT4: a novel biomarker for dysgerminoma of the ovary. Am J Surg Pathol 2004; 28: 1341-6.
60. Jones TD, Ulbright TM, Eble JN, Baldridge LA, Cheng L. OCT4 staining in testicular tumors: a sensitive and specific marker for seminoma and embryonal carcinoma. Am J Surg Pathol 2004; 28: 935-40.
61. Rajpert-De ME, Hanstein R, Jorgensen N, Graem N, Vogt PH, Skakkebaek NE. Developmental expression of POU5F1 (OCT-3/4) in normal and dysgenetic human gonads. Hum Reprod 2004; 19: 1338-44.
62. Scottish Intercollegiate Guidelines Network (SIGN): SIGN 28. Management of adult testicular germ cell tumours. 1998.http://www.sign.ac.uk/ (Accessed 18th October 2007).Guías y recomendaciones para el uso de marcadores tumorales en cáncer de testículo, próstata, colorrectal, mama y ovario 181 Acta Bioquím Clín Latinoam 2013; 47 (1): 165-82
63. Germa-Lluch JR, Garcia del Muro X, Maroto P, Paz-Ares L, Arranz JA, Guma J, et al. Clinical pattern and therapeutic results achieved in 1490 patients with germ-cell tumours of the testis: the experience of the Spanish Germ-Cell Cancer Group (GG). Eur Urol 2002; 42:553-562; discussion 562-3.
64. Stenman UH, Alfthan H, Diamandis EP, Fritsche HA, Lilja H, Chan DW, Schwartz MK. Markers for testicular cancer. Tumor Markers Physiology, Pathobiology, Technology, and Clinical Applications Vol. Washington: AACC Press, 2002: 351-9.
65. Bosl GJ, Lange PH, Fraley EE, Goldman A, Nochomovitz LE, Rosai J, et al. Human chorionic gonadotropin and alphafetoprotein in the staging of nonseminomatous testicular cancer. Cancer 1981; 47: 328-32.
66. International Germ Cell Consensus Classification: A prognostic factor-based staging system for metastatic germ cell cancers. International Germ Cell Cancer Collaborative Group. J Clin Oncol 1997; 15: 594-603.
67. Vogelzang NJ. Prognostic factors in metastatic testicular cancer. Int J Androl 1987;10: 225-37.
68. Davis BE, Herr HW, Fair WR, Bosl GJ. The management of patients with nonseminomatous germ cell tumors of the testis with serologic disease only after orchiectomy. J Urol 1994; 152: 111-113; discussion 114.
69. Rabbani F, Sheinfeld J, Farivar-Mohseni H, Leon A, Rentzepis MJ, Reuter VE, et al. Low-volume nodal metastases detected at retroperitoneal lymphadenectomy for testicular cancer: pattern and prognostic factors for relapse. J Clin Oncol 2001; 19: 2020-5.
70. Toner GC, Geller NL, Tan C, Nisselbaum J, Bosl GJ. Serum tumor marker half-life during chemotherapy allows early prediction of complete response and survival in nonseminomatous germ cell tumors. Cancer Res 1990; 50: 5904-10.
71. Coogan CL, Foster RS, Rowland RG, Bihrle R, Smith ER, Jr., Einhorn LH, et al. Postchemotherapy retroperitoneal lymph node dissection is effective therapy in selected patients with elevated tumor markers after primary chemotherapy alone. Urology 1997; 50: 957-62.
72. Vogelzang NJ, Lange PH, Goldman A, Vessela RH, Fraley EE, Kennedy BJ. Acute changes of alpha-fetoprotein and human chorionic gonadotropin during induction chemotherapy of germ cell tumors. Cancer Res 1982; 42: 4855-61.
73. Kohn J. The dynamics of serum alpha-fetoprotein in the course of testicular teratoma. Scand J Immunol 1978; 8 (Suppl 8): 103.
74. Lange PH, Vogelzang NJ, Goldman A, Kennedy BJ, Fraley EE. Marker half-life analysis as a prognostic tool in testicular cancer. J Urol 1982; 128: 708-11.
75. Mazumdar M, Bajorin DF, Bacik J, Higgins G, Motzer RJ, Bosl GJ. Predicting outcome to chemotherapy in patients with germ cell tumors: the value of the rate of decline of human chorionic gonadotrophin and alpha-fetoprotein during therapy. J Clin Oncol 2001; 19: 2534-41.
76. Seckl MJ, Rustin GJ, Bagshawe KD. Frequency of serum tumour marker monitoring in patients with non-seminomatous germ cell tumours. Br J Cancer 1990; 61: 916-8.
77. Abelev GI. Alpha-fetoprotein as a marker of embryo-specific differentiations in normal and tumor tissues. Transplant Rev 1974; 20: 3-37.
78. Gitlin D, Boesman M. Serum alpha-fetoprotein, albumin, and gamma-G-globulin in the human conceptus. J Clin Invest 1966; 45: 1826-38.
79. Brewer JA, Tank ES. Yolk sac tumors and alpha-fetoprotein in first year of life. Urology 1993; 42: 79-80.
80. Blohm ME, Vesterling-Horner D, Calaminus G, Gobel U. Alpha 1-fetoprotein (AFP) reference values in infants up to 2 years of age. Pediatr Hematol Oncol 1998; 15: 135-42.
81. Carroll WL, Kempson RL, Govan DE, Freiha FS, Shochat SJ, Link MP. Conservative management of testicular endodermal sinus tumor in childhood. J Urol 1985; 133: 1011-4.
82. Huddart SN, Mann JR, Gornall P, Pearson D, Barrett A, Raafat F, et al. The UK Children's Cancer Study Group: testicular malignant germ cell tumours 1979-1988. J Pediatr Surg 1990; 25: 406-10.
83. Christiansen M, Hogdall CK, Andersen JR, Norgaard-Pedersen B. Alpha-fetoprotein in plasma and serum of healthy adults: preanalytical, analytical and biological sources of variation and construction of age-dependent reference intervals. Scand J Clin Lab Invest 2001; 61: 205-15.
84. Beck SD, Patel MI, Sheinfeld J. Tumor marker levels in postchemotherapy cystic masses: clinical implications for patients with germ cell tumors. J Urol 2004; 171: 168-71.
85. Germa JR, Llanos M, Tabernero JM, Mora J. False elevations of alpha-fetoprotein associated with liver dysfunction in germ cell tumors. Cancer 1993; 72: 2491-4.
86. Morris MJ, Bosl GJ. Recognizing abnormal marker results that do not reflect disease in patients with germ cell tumors. J Urol 2000; 163: 796-801.
87. Ruoslahti E, Adamson E. Alpha-fetoproteins produced by the yolk sac and the liver are glycosylated differently. Biochem Biophys Res Commun 1978; 85: 1622-30.
88. de Takats PG, Jones SR, Penn R, Cullen MH. Alpha-foetoprotein heterogeneity: what is its value in managing patients with germ cell tumours? Clin Oncol (R Coll Radiol) 1996; 8: 323-6.
89. Perlin E, Engeler JE, Jr., Edson M, Karp D, McIntire KR, Waldmann TA. The value of serial measurement of both human chorionic gonadotropin and alpha-fetoprotein for monitoring germinal cell tumors. Cancer 1976; 37: 215-9.
90. Butler SA, Ikram MS, Mathieu S, Iles RK. The increase in bladder carcinoma cell population induced by the free beta subunit of human chorionic gonadotrophin is a result of an antiapoptosis effect and not cell proliferation. Br J Cancer 2000; 82: 1553-6.
91. Birken S, Yershova O, Myers RV, Bernard MP, Moyle W. Analysis of human choriogonadotropin core 2 o-glycan isoforms. Mol Cell Endocrinol 2003; 204: 21-30.
92. Vaitukaitis JL. Human chorionic gonadotropin as a tumor marker. Ann Clin Lab Sci 1974; 4: 276-80.182 Sturgeon CM y Diamandis EP Acta Bioquím Clín Latinoam 2013; 47 (1): 165-82
93. Birken S, Berger P, Bidart JM, Weber M, Bristow A, Norman R, et al. Preparation and characterization of new WHO reference reagents for human chorionic gonadotropin and metabolites. Clin Chem 2003; 49: 144-54.
94. Berger P, Sturgeon C, Bidart JM, Paus E, Gerth R, Niang M, et al. The ISOBM TD-7 Workshop on hCG and related molecules. Towards user-oriented standardization of pregnancy and tumor diagnosis: assignment of epitopes to the three-dimensional structure of diagnostically and commercially relevant monoclonal antibodies directed against human chorionic gonadotropin and derivatives. Tumour Biol 2002; 23: 1-38.
95. Bristow A, Berger P, Bidart JM, Birken S, Norman R, Stenman UH, Sturgeon C. Establishment, value assignment, and characterization of new WHO reference reagents for six molecular forms of human chorionic gonadotropin. Clin Chem 2005; 51: 177-82.
96. Mann K, Saller B, Hoermann R. Clinical use of HCG and hCG beta determinations. Scand J Clin Lab Invest Suppl 1993; 216: 97-104.
97. Stenman UH, Alfthan H, Ranta T, Vartiainen E, Jalkanen J, Seppala M. Serum levels of human chorionic gonadotropin in nonpregnant women and men are modulated by gonadotropinreleasing hormone and sex steroids. J Clin Endocrinol Metab 1987; 64: 730-36.
98. Alfthan H, Haglund C, Dabek J, Stenman UH. Concentrations of human choriogonadotropin, its beta-subunit, and the core fragment of the beta-subunit in serum and urine of men and nonpregnant women. Clin Chem 1992; 38: 1981-7.
99. Lempiainen A, Hotakainen K, Blomqvist C, Alfthan H, Stenman UH. Increased human chorionic gonadotropin due to hypogonadism after treatment of a testicular seminoma. Clin Chem 2007; 53: 1560-1.
100. Catalona WJ, Vaitukaitis JL, Fair WR. Falsely positive specific human chorionic gonadotropin assays in patients with testicular tumors: conversion to negative with testosterone administration. J Urol 1979; 122: 126-8.
101. Stenman UH, Alfthan H, Hotakainen K. Human chorionic gonadotropin in cancer. Clin Biochem 2004; 37: 549-61.
102. Cole LA, Rinne KM, Shahabi S, Omrani A. False-positive hCG assay results leading to unnecessary surgery and chemotherapy and needless occurrences of diabetes and coma. Clin Chem 1999; 45: 313-4.
103. Saller B, Clara R, Spottl G, Siddle K, Mann K. Testicular cancer secretes intact human choriogonadotropin (hCG) and its free beta-subunit: evidence that hCG (_hCG-beta) assays are the most reliable in diagnosis and follow-up. Clin Chem 1990; 36: 234-9.
104. Summers J, Raggatt P, Pratt J,Williams MV. Experience of discordant beta hCG results by different assays in the management of non-seminomatous germ cell tumours of the testis. Clin Oncol (R Coll Radiol) 1999; 11: 388-92.
105. Li SS, Luedemann M, Sharief FS, Takano T, Deaven LL. Mapping of human lactate dehydrogenase-A, -B, and -C genes and their related sequences: the gene for LDHC is located with that for LDHA on chromosome 11. Cytogenet Cell Genet 1988; 48: 16-8.
106. Looijenga LH, Zafarana G, Grygalewicz B, Summersgill B, biec-Rychter M, Veltman J, et al. Role of gain of 12p in germ cell tumour development. APMIS 2003; 111: 161-71.
107. Rosenberg C, van Gurp RJ, Geelen E, Oosterhuis JW, Looijenga LH. Overrepresentation of the short arm of chromosome 12 is related to invasive growth of human testicular seminomas and nonseminomas. Oncogene 2000; 19: 5858-62.
108. Summersgill B, Osin P, Lu YJ, Huddart R, Shipley J. Chromosomal imbalances associated with carcinoma in situ and associated testicular germ cell tumours of adolescents and adults. Br J Cancer 2001; 85: 213-20.
109. von Eyben FE. A systematic review of lactate dehydrogenase isoenzyme 1 and germ cell tumors. Clin Biochem 2001; 34: 441-54.
110. Fishman WH. Perspectives on alkaline phosphatase isoenzymes. Am J Med 1974; 56: 617-50.
111. Roelofs H, Manes T, Janszen T, Millan JL, Oosterhuis JW, Looijenga LH. Heterogeneity in alkaline phosphatase isozyme expression in human testicular germ cell tumours: An enzyme-/immunohistochemical and molecular analysis. J Pathol 1999; 189: 236-44.
112. Lange PH, Millan JL, Stigbrand T, Vessella RL, Ruoslahti E, Fishman WH. Placental alkaline phosphatase as a tumor marker for seminoma. Cancer Res 1982; 42: 3244-7.
113. De Broe ME, Pollet DE. Multicenter evaluation of human placental alkaline phosphatase as a possible tumor-associated antigen in serum. Clin Chem 1988; 34: 1995-9.
114. Mosselman S, Looijenga LH, Gillis AJ, van Rooijen MA, Kraft HJ, van Zoelen EJ, Oosterhuis JW. Aberrant platelet-derived growth factor alpha-receptor transcript as a diagnostic marker for early human germ cell tumors of the adult testis. Proc Natl Acad Sci U S A 1996; 93: 2884-8.
115. de Bruijn HW, Sleijfer DT, Schraffordt Koops H, Suurmeijer AJ, Marrink J, Ockhuizen T. Significance of human chorionic gonadotropin, alpha-fetoprotein, and pregnancy-specific beta-1- glycoprotein in the detection of tumor relapse and partial remission in 126 patients with nonseminomatous testicular germ cell tumors. Cancer 1985; 55: 829-35.
116. Kuzmits R, Schernthaner G, Krisch K. Serum neuron-specific enolase. A marker for responses to therapy in seminoma. Câncer 1987; 60: 1017-21.
117. Fossa SD, Klepp O, Paus E. Neuron-specific enolase—a serum tumour marker in seminoma? Br J Cancer 1992; 65: 297-9.














