Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión On-line ISSN 1851-7617
Rev. argent. microbiol. vol.42 no.3 Ciudad Autónoma de Buenos Aires jul./set. 2010
AGENTES ANTIMICROBIANOS
Staphylococcus aureus: nuevos y antiguos antimicrobianos
B. Perazzi1 *, M. Camacho1, K. Bombicino1, Z. Flores1, C. Vay1, A. Famiglietti1
1Laboratorio de Bacteriología Clínica, Departamento de Bioquímica Clínica, Hospital de Clínicas, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Av. Córdoba 2351 (1120) Ciudad Autónoma de Buenos Aires.
*Correspondencia. E-mail: hugodandrea@ciudad.com.ar
RESUMEN
El objetivo del trabajo fue evaluar la sensibilidad a antiguos y nuevos antimicrobianos de aislamientos de Staphylococcus aureus resistentes a la oxacilina, de origen hospitalario (SAOR-H) y adquiridos en la comunidad (SAOR-AC), y también en aislamientos sensibles a la oxacilina (SAOS). Se estudió en forma prospectiva la concentración inhibitoria mínima a diversos antimicrobianos en 118 aislamientos consecutivos por dilución seriada en agar según las indicaciones del CLSI. En los aislamientos de SAOR sin resistencia acompañante se determinó la presencia de los genes mec A, leucocidina de Panton Valentine (LPV) y γ-hemolisina por PCR, y del cassette SCC mec por PCR múltiple. De los 118 aislamientos estudiados, 44 fueron SAOR-H, 16 SAOR-AC y 58 SAOS. Los aislamientos de SAOR-H presentaron resistencia simultánea a eritromicina, clindamicina, gentamicina, ciprofloxacina, levofloxacina y moxifloxacina, y todos fueron sensibles a tigeciclina (TIG), vancomicina, teicoplanina y linezolid (LZD). Los aislamientos de SAOR-AC fueron resistentes solamente a OXA y sensibles a todos los antimicrobianos ensayados. En todos ellos se detectaron los genes mec A, LPV, γ-hemolisina y el cassette SCC mec IV. En SAOS y en SAOR-AC todos los antimicrobianos no ß-lactámicos ensayados presentaron excelente actividad in vitro, mientras que en SAOR-H sólo los antiguos antimicrobianos como glucopéptidos, doxiciclina, rifampicina y trimetoprima-sulfametoxazol presentaron buena actividad in vitro, al igual que LZD y TIG entre los nuevos antimicrobianos. El fenotipo de SAOR sin resistencia acompañante fue altamente predictivo de SAOR-AC, ya que fue confirmado por presentar el cassette SCC mec IV.
Palabras clave: Staphylococcus aureus; Sensibilidad cuantitativa; Antimicrobianos
ABSTRACT
Staphylococcus aureus: new and old antimicrobial agents. The objective of the study was to evaluate the susceptibility to old and new antimicrobial agents against hospital-acquired oxacillin-resistant Staphylococcus aureus (HA-ORSA), community-acquired oxacillin-resistant S. aureus (CA-ORSA), and oxacillin-susceptible S. aureus (OSSA). The minimum inhibitory concentration of different antimicrobial agents against 118 S. aureus consecutive and prospective isolates was studied by the CLSI agar dilution method. In ORSA isolates without accompanying resistance, the mec- A gene, the Panton-Valentine leukocidin gene (PVL), and the γ-hemolysin gene were determined by PCR, and the SCC cassette mec gene by multiplex PCR. Out of the 118 isolates, 44 were HA-ORSA, 16 were CA-ORSA, and 58 corresponded to OSSA. The HA-ORSA isolates presented simultaneous resistance to erythromycin, clindamycin, gentamicin, ciprofloxacin, levofloxacin, and moxifloxacin whereas all of them were susceptible to tigecycline (TIG), vancomycin, teicoplanin and linezolid (LZD). The CA-ORSA isolates were only resistant to OXA and presented susceptibility to all the antimicrobial agents assayed. In all of them, the mec-A gene, the PVL gene, the γ-hemolysin gene and the SCC cassette mec type IV gene were detected. With the OSSA and CA-ORSA isolates, all the non- β- lactam antimicrobial agents assayed exhibited excellent in vitro activity. However, in the HA-ORSA isolates, only the old antimicrobial agents such as glycopeptides, doxyciclin, rifampin, and trimethoprim-sulfamethoxazole and the new antimicrobial agents LZD and TIG, presented good in vitro activity. The ORSA phenotype without accompanying resistance was highly predictive of CA-ORSA as confirmed by a positive SCC cassette mec type IV.
Key words: Staphylococcus aureus; Dilution susceptibility test; Antimicrobial agents
Staphylococcus aureus es un importante patógeno causante de infecciones adquiridas en la comunidad y hospitalarias. S. aureus constituye uno de los patógenos más frecuentemente aislados en infecciones sanguíneas, en infecciones de piel y partes blandas y en neumonías (11). Desafortunadamente, este patógeno ha ido desarrollando resistencia a los antimicrobianos de un modo muy eficiente. Desde el primer aislamiento de S. aureus resistente a la oxacilina (SAOR) obtenido en Inglaterra en 1961, se ha ido incrementando el número de casos de aislamientos resistentes hasta llegar a la actualidad, en la que este microorganismo se encuentra distribuido en todo el mundo en porcentajes variables (9). Tanto es así, que en la actualidad SAOR constituye un patógeno hospitalario frecuente, que produce estancias en el hospital más largas y costos de salud crecientes, con una proporción de mortalidad alta. De esta forma, se hace necesario el reconocimiento temprano de pacientes colonizados o infectados con SAOR para seleccionar la terapia antimicrobiana precisa y tomar la decisión de comenzar procedimientos de aislamiento. Además, SAOR de origen hospitalario (SAOR-H) muestra resistencia a múltiples antibióticos, con lo que se limitan las alternativas terapéuticas y quedan los antiguos antimicrobianos, como los glucopéptidos, como una de las pocas opciones válidas para el tratamiento de infecciones graves, o bien antimicrobianos como la tetraciclina, la doxiciclina, la rifampicina y la trimetoprima-sulfametoxazol (9). Los nuevos antimicrobianos como el linezolid y la tigeciclina podrían ser de utilidad en reemplazo de los glucopéptidos en determinadas situaciones. De esta forma, se ha ido incrementando el uso de vancomicina en infecciones graves, con lo que se va generando una presión selectiva para el desarrollo de resistencia a este antibiótico (14).
Por otra parte, en los últimos años SAOR ha adquirido importancia también como patógeno adquirido en la comunidad (SAOR-AC); se han notificado infecciones de piel y partes blandas y, en menor proporción, neumonías necrotizantes en pacientes sin factores de riesgo, especialmente en niños y adolescentes (1, 15). Estos aislamientos se caracterizan por no presentar resistencias acompañantes a la mayoría de los antibióticos no β-lactámicos y por presentar, generalmente, diversos factores de virulencia, entre ellos la leucocidina de Panton Valentine (LPV) y un cassette cromosomal mayormente de tipo IV o V (SCC mec A IV o V), los que son utilizados para su caracterización (15). Las primeras infecciones invasoras y mortales por SAOR-AC fueron documentadas entre 1997 y 1999 en cuatro niños internados en hospitales de Minnesota y Dakota del Norte (1). Estas infecciones, consideradas un peligro potencial, han sido descritas posteriormente en muchos países del mundo, con cifras en incremento en estos últimos años (15).
El objetivo de este trabajo fue evaluar la sensibilidad de SAOR-H, SAOR-AC y S. aureus sensible a la oxacilina (SAOS) frente a antiguos y nuevos antimicrobianos.
Se estudiaron prospectivamente 118 aislamientos consecutivos de S. aureus en el período comprendido entre agosto y octubre de 2006. Los aislamientos provenían de diversas muestras clínicas correspondientes a pacientes ambulatorios e internados atendidos en el Hospital de Clínicas "José de San Martín" de la ciudad de Buenos Aires.
Los microorganismos fueron conservados en leche descremada a -70 °C y subcultivados en agar base Columbia (Laboratorios Britania, Buenos Aires, Argentina) con 5% de sangre para su posterior identificación y prueba de sensibilidad, y en agar Mueller Hinton (Difco Laboratories, EE.UU.) para la PCR.
El género Staphylococcus fue identificado con las siguientes pruebas bioquímicas: producción de catalasa y resistencia a la bacitracina 0,04 UI (Laboratorios Britania). La identificación de la especie se realizó a través de las siguientes pruebas bioquímicas: producción de coagulasa y de acetoína (Difco Laboratories, EE.UU.), resistencia a la polimixina B - 300 UI (Laboratorios Britania) y producción aeróbica de ácido a partir del manitol, trehalosa y maltosa (Difco Laboratories).
Se determinó la concentración inhibitoria mínima (CIM) por dilución seriada en agar según las indicaciones de CLSI (2) de los siguientes antimicrobianos: oxacilina (OXA), eritromicina (ERI), clindamicina (CLI), gentamicina (GEN), tetraciclina (TET), doxiciclina (DOX), tigeciclina (TIG), trimetoprima-sulfametoxazol (TMS), ciprofloxacina (CIP), levofloxacina (LEV), moxifloxacina (MOX), vancomicina (VAN), teicoplanina (TEI), rifampicina (RIF), linezolid (LZD) y cloranfenicol (CLO). Se utilizaron como cepas control los aislamientos de S. aureus ATCC 29213 (OS) y de S. aureus ATCC 43300 (OR). Los puntos de corte utilizados fueron los recomendados por el CLSI (3).
La detección del fenotipo de resistencia a macrólidos se realizó utilizando los discos de eritromicina (15 μg) y de clindamicina (2 μg) a una distancia de 15 a 26 mm de borde a borde entre ambos discos. Se consideró fenotipo de resistencia constitutivo (cMLSB) cuando se observó resistencia a eritromicina y clindamicina; fenotipo de resistencia inducible (iMLSB) cuando se observó resistencia a eritromicina y sensibilidad a clindamicina, con achatamiento en el halo de inhibición; fenotipo M cuando resultó resistente a la eritromicina y sensible a la clindamicina, sin achatamiento. Para detectar el fenotipo L se utilizó el disco de lincomicina (15 μg), este fenotipo se evidencia al observarse sensibilidad a eritromicina, resistencia a lincomicina y respuesta sensible, intermedia o resistente a la clindamicina.
Para confirmar las infecciones adquiridas en la comunidad, en los aislamientos de SAOR sin resistencia acompañante, inicialmente se determinó el gen de resistencia mec A y los genes de virulencia LPV y γ-hemolisina por reacción de polimerasa en cadena (PCR) convencional con cebadores específicos (8, 10, 13). Posteriormente se determinó la presencia del cassette SCC mec por PCR múltiple (12).
Para comparar los porcentajes de resistencia a los diferentes antibióticos entre SAOR-H y SAOS y entre SAOR-H y SAOR-AC se utilizó el test exacto de Fisher.
De los 118 aislamientos, 44 (37%) presentaron el fenotipo SAOR-H (multirresistente), 16 (14%) el fenotipo SAOR-AC (sin resistencia acompañante) y 58 (49%) fueron SAOS. En los 16 aislamientos de SAOR-AC se detectó la presencia de los genes mec A, LPV, γ-hemolisina y del cassette SCC mec tipo IV.
Los aislamientos SAOR-H presentaron resistencia simultánea a ERI, CLI, GEN y fluoroquinolonas, mientras que el 100% fueron sensibles a VAN y TEI y a nuevos antimicrobianos como TIG y LZD (Tabla 1).
Tabla 1. Concentración inhibitoria mínima (CIM) de diferentes antibióticos en los aislamientos de Staphylococcus aureus sensibles a la oxacilina (SAOS), resistentes a la oxacilina de origen hospitalario (SAOR-H) y resistentes a la oxacilina adquiridos en la comunidad (SAOR-AC)
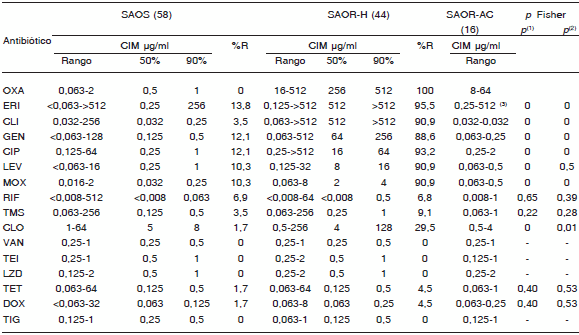
(1) p resultante de la comparación de número de resistentes para cada antibiótico entre SAOS y SAOR-H.
(2) p resultante de la comparación de número de resistentes para cada antibiótico entre SAOR-H y SAOR-AC.
(3) 1 cepa: iMLSB
Tanto en SAOR-AC como en SAOS se observó sensibilidad a la mayoría de los antimicrobianos no ß-lactámicos, aunque en SAOS la resistencia a ERI, CLI, GEN y fluoroquinolonas se observó en alrededor del 10% de los aislamientos. Un perfil semejante mostraron los aislamientos de SAOR-AC, excepto para oxacilina (Tabla 1).
La resistencia a los viejos antimicrobianos como RIF, TMS, TET y DOX fue menor del 10% en los 3 fenotipos de S. aureus (Tabla 1).
La prevalencia de SAOR se ha incrementado en todo el mundo, según lo documentan distintos estudios multicéntricos, aunque existen diferencias entre los países (4). Las mayores prevalencias de SAOR han sido notificadas en países desarrollados, especialmente en la región del oeste del Pacífico, con porcentajes que varían desde 23,6% en Australia a más del 70% en Japón y Hong Kong, tanto en infecciones adquiridas en la comunidad como en infecciones nosocomiales (4). En Europa las prevalencias varían desde ≤ 2% en Suiza a 54,4% en Portugal, y en Canadá y Estados Unidos son de 5,7% y 34,2%, respectivamente (4). Los países de América Latina con mayor prevalencia de SAOR son Brasil, Argentina y Chile, para los que se han informado valores de 33,7%, 42,7% y 46,3% respectivamente, que son similares a los obtenidos en esta investigación (4).
En este estudio se observaron mayores porcentajes de resistencia a GEN, ERI, CLI y fluoroquinolonas en SAOR-H respecto de SAOR-AC y SAOS, al igual que lo describen otros autores (4, 6, 7). El estudio multicéntrico de Diekema et al. (4) documentó resistencias similares a las nuestras en SAOR-H, excepto en Estados Unidos, donde la resistencia a GEN fue menor (35%). Al igual que en nuestro estudio, en dicha investigación se hallaron menores resistencias a GEN, ERI, CLI y CIP entre los aislamientos SAOS (4). Otro estudio efectuado por Huang et al. (7) en Sacramento, Estados Unidos, documentó mayores resistencias a CIP en SAOR-H respecto de SAOR-AC, 86% y 47%, respectivamente. Sin embargo, la resistencia a CIP en SAOR-AC documentada en Sacramento es mayor que la descrita en la literatura. Ese mismo estudio describió también elevadas resistencias a ERI (93%) en SAOR-AC en contraste con lo descrito en la literatura (7). En nuestro estudio, en SAOR-AC sólo un aislamiento presentó resistencia a eritromicina (CIM = 512 μg/ml) con fenotipo iMLSB. Asimismo, el perfil fenotípico predominante de resistencia a macrólidos en los 42 aislamientos de SAOR-H resistentes fue constitutivo (40 aislamientos) y sólo 2 mostraron resistencia inducible. No se detectó la presencia del fenotipo M, excepto en un aislamiento de SAOS, ni el fenotipo L en ninguno de los 118 aislamientos, en coincidencia con lo que describe la literatura (6). La MOX fue la fluoroquinolona con mayor actividad frente a los aislamientos sensibles (CIM90 de MOX, LEV y CIP = 0,25; 1 y 1 μg/ml, respectivamente).
Los bajos porcentajes de resistencia a RIF, TMS, TET y DOX (< 10%) en SAOR-H nos permiten inferir que continúa circulando en nuestro medio el clon cordobés (5), que reemplazó al sudamericano multirresistente previamente descrito (3).
En nuestro estudio, todos los fenotipos de S. aureus tuvieron CIM de VAN y TEI menor que 2 μg/ml, resultados similares a los descritos por Holmes et al. (6) y por el estudio multicéntrico de Diekema et al. (4) en Estados Unidos, América Latina y Oeste del Pacífico. Según este último estudio, en Europa la CIM90 de VAN en SAOR-H se elevó a 2 μg/ml (4). En nuestra serie, el 21% de SAOS, el 16% de SAOR-H y el 13% de SAOR-AC presentaron CIM de VAN = 1 μg/ml. Este hallazgo, especialmente en los aislamientos resistentes a oxacilina, podría asociarse con fracasos terapéuticos cuando en las infecciones graves se utiliza VAN y las concentraciones de este antimicrobiano en el valle son inferiores a 20 μg/ml. Por otra parte, cabe aclarar que los aislamientos hetero-VISA presentan CIM de VAN ≤ 2 μg/ml, es decir, que son categorizados como sensibles según el CLSI (2), pero contienen subpoblaciones con sensibilidad disminuida (CIM = 4-8 μg/ml) y pueden presentar una CIM de VAN entre 1 y 2 μg/ml. Al igual que con los aislamientos VISA, el tratamiento con VAN puede fracasar en los hetero-VISA, y es necesario recurrir a otros antimicrobianos para erradicar la infección. Por lo expuesto, frente a infecciones graves por SAOR tratadas con VAN es necesario monitorear la terapéutica a través de la CIM de VAN y la vancocinemia, para adecuar el tratamiento antibiótico.
Con respecto a nuevos antimicrobianos como LZD y TIG, ninguno de los fenotipos de S. aureus presentaron resistencia, con valores de CIM ≤ 2 y ≤ 1 μg/ml, respectivamente.
Cabe destacar que en este trabajo, todos los antimicrobianos no ß-lactámicos ensayados presentaron excelente actividad in vitro contra SAOS y SAOR-AC, mientras que en SAOR-H antiguos antimicrobianos como glucopéptidos, DOX, RIF y TMS y nuevos antimicrobianos como LZD y TIG presentaron buena actividad in vitro. El fenotipo de SAOR sin resistencia acompañante fue altamente predictivo de SAOR-AC, ya que fue confirmado por presentar el cassette SCC mec tipo IV. Además, sería necesario efectuar estudios epidemiológicos y moleculares que permitan conocer si SAOR-AC se ha diseminado en el ámbito hospitalario.
1. Centers for Disease Control and Prevention: Morbidity and Mortality Weekly Report. Four pediatric deaths from community- acquired methicillin-resistant Staphylococcus aureus- Minnesota and North Dakota, 1997-1999. 1999; JAMA 282:1123-5. [ Links ]
2. Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically, 19th ed. Approved standard M7-A8, 2009; Wayne, Pa, USA. [ Links ]
3. Da Silva Coimbra M, Texeira LE, Ramos RLB, Predari SC, Castello L, Famiglietti A, et al. Spread of the brazilian epidemic clone of a multiresistant MRSA in two cities in Argentina. J Med Microbiol 2000; 49: 187-92. [ Links ]
4. Diekema DJ, Pfaller MA, Schmitz FJ, Smayevsky J, Bell J, Jones RN, et al, SENTRY Participants Group. Survey of infections due to Staphylococcus species: frequency of occurrence and antimicrobial susceptibility of isolates collected in the United States, Canada, Latin America, Europe, and the Western Pacific region for the SENTRY Antimicrobial Surveillance Program, 1997-1999. Clin Infect Dis 2001; 32 (Suppl 2): S114-32. [ Links ]
5. Gardella N, Picasso R, Predari SC, Lasala M, Foccoli M, Benchetrit G, et al. Methicillin-resistant Staphylococcus aureus strains in Buenos Aires Teaching Hospitals: replacement of the multidrug resistant South American clone by another susceptible to rifampin, minocycline and trimethoprim-sulfamethoxazole. Rev Argent Microbiol 2005; 37: 156-60. [ Links ]
6. Holmes RL, Jorgensen JH. Inhibitory activities of 11 antimicrobial agents and bactericidal activities of vancomycin and daptomycin against invasive methicillin-resistant Staphylococcus aureus isolates obtained from 1999 through 2006. Antimicrob Agents Chemother 2008; 52: 757-60. [ Links ]
7. Huang H, Flynn NM, King JH, Monchaud C, Morita M, Cohen SH. Comparisons of community-associated methicillin-resistant Staphylococcus aureus (MRSA) and hospital-associated MSRA infections in Sacramento, California. J Clin Microbiol 2006; 44: 2423-7. [ Links ]
8. Johnsson D, Mölling P, Strålin K, Söderquist B. Detection of Panton-Valentine leukocidin gene in Staphylococcus aureus by LightCycler PCR: clinical and epidemiological aspects. Clin Microbiol Infect 2004; 10: 884-9. [ Links ]
9. Lowy F. Antimicrobial resistance: the example of Staphylococcus aureus. J Clin Invest 2003; 111: 1265-73. [ Links ]
10. Murakami K, Minamide W, Wada K, Nakamura E, Teraoka H, Watanabe S. Identification of methicillin-resistant strains of staphylococci by polymerase chain reaction. J Clin Microbiol 1991; 29: 2240-4. [ Links ]
11. Naber CK, Baddour LM, Giamarellos-Bourboulis EJ, Gould IM, Herrmann M, Hoen B, et al. Clinical consensus conference: survey on gram-positive bloodstream infections with a focus on Staphylococcus aureus. Clin Infect Dis 2009; 48: S260-70. [ Links ]
12. Oliveira DC, de Lencastre H. Multiplex PCR strategy for rapid identification of structural types and variants of the mec element in methicillin-resistant Staphylococcus aureus. Antimicrob Agents Chemoter 2002; 46: 2155-61. [ Links ]
13. von Eiff C, Friedrich AW, Peters G, Becker K. Prevalence of genes encoding for members of the staphylococcal leukotoxin family among clinical isolates of Staphylococcus aureus. Diagn Microbiol Infect Dis 2004; 49:157-62. [ Links ]
14. Walsh TR, Howe RA. The prevalence and mechanisms of vancomycin resistance in Staphylococcus aureus. Annu Rev Microbiol 2002; 56: 657-75. [ Links ]
15. Zetola N, Francis JS, Nuermberger EL, Bishai WR. Community- acquired meticillin-resistant Staphylococcus aureus: an emerging threat. Lancet Infect Dis 2005; 5: 275-86. [ Links ]
Recibido: 16/02/10
Aceptado: 21/07/10














