Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
RIA. Revista de investigaciones agropecuarias
versión On-line ISSN 1669-2314
RIA. Rev. investig. agropecu. vol.38 no.2 Ciudad Autónoma de Buenos Aires mayo/ago. 2012
ARTÍCULOS
Capacidad de las macrofitas Lemna minor y Eichhornia crassipes para eliminar el níquel
Bres P.; Crespo, D.; Rizzo, P.; La Rossa, R.
Instituto Nacional de Tecnología Agropecuaria (INTA) - Instituto de Microbiología y Zoología Agrícola (IMYZA). Dirección: Nicolas Repetto y De los Reseros S/N.º 1712 Castelar, Argentina. E-mail pbres@cnia.inta.gov.ar
Recibido 09 de marzo de 2011
Aceptado 14 de octubre de 2011
Publicado online 11 de abril de 2012
RESUMEN
El objetivo de este trabajo fue estudiar la capacidad de dos especies de macrofitas, Lemna minor y Eichhornia crassipes, para eliminar el níquel. Se realizaron cuatro tratamientos durante dos semanas para cada una de las especies. Las plantas fueron incubadas con 0, 1, 3 y 6 mg l-1 de Ni. Ambas especies mostraron, en todos los tratamientos con Ni, una reducción en la concentración a lo largo del tiempo. L. minor mostró ser más eficiente para remover este ión a la más baja concentración. Sin embargo, en concentraciones más elevadas no se observaron diferencias entre ambas especies. El análisis del tejido de las plantas mostró que las mismas acumulaban el metal, en los tres casos evaluados con concentraciones diferentes.
Palabras clave: Fitorremediación; Metales pesados; Plantas acuáticas; Acumulación.
ABSTRACT
The aim of this work was to study the capacity of two macrophyte species, Lemna minor and Eichhornia crassipes to remove nickel. Four treatments were carried out for two weeks with each species: plants were either incubated with 0, 1, 3 and 6 mgl-1 de Ni. All treatments with both plants showed a decrease in Ni concentration over time. L. minor proved to be more efficient to remove the ion at the lowest concentration. At higher concentrations, however, no differences were observed between both species. The analysis of plant tissue showed that plants accumulated the metal at the three concentrations evaluated.
Keywords: Phytoremediation; Heavy metals; Aquatic plants; Accumulation.
INTRODUCCIÓN
La contaminación del agua causada por metales pesados es uno de los mayores problemas a nivel mundial. Las aguas residuales y los tratamientos ineficientes de las aguas industriales contribuyen continuamente a diseminar contaminantes orgánicos e inorgánicos (peligrosos para el ecosistema y la salud humana). A diferencia de los contaminantes orgánicos, los metales pesados persisten y tienden a acumularse en el ambiente. El níquel es un micronutriente esencial que juega un papel importante en la actividad catalítica de los sistemas enzimáticos de las plantas. Sin embargo, a dosis más elevadas, este metal es fitotóxico causando efectos negativos en las funciones fisiológicas de las plantas (Gardea-Torresdey et al., 2005).
En el agua natural las concentraciones de Ni son generalmente bajas (2-10 μg l-1). Sin embargo, en los últimos años, las concentraciones de este metal en agua se incrementaron notablemente debido a la combustión de combustibles fósiles, procesos de revestimiento y acabado, explotación minera, refinería del níquel, incineración de residuos y, por supuesto, por la descarga de residuos industriales y municipales (Xiaolei, 1998). Una gran parte de las pilas y baterías híbridas Ni-Cd o Ni-Metal son desechadas en basurales. Una vez liberados, esos metales se convierten en un riesgo para el medio ambiente, ya que pueden llegar a acuíferos y, por lo tanto, afectar la calidad del agua (Rydh y Karlstrom, 2002; Ris, 2007).
La fitorremediación se basa en el uso de plantas para remover contaminantes del ambiente (Suthersan, 2002). Esta tecnología ha demostrado ser una opción viable para purificar el agua contaminada con trazas de elementos, debido a su relación costo-beneficio y al impacto positivo que tiene sobre el ambiente (Raskyn et al., 1997).
Numerosos estudios han reportado el uso de macrofitas para la remediación de agua contaminada con metales pesados como ser Pb, Cd, Cu, Fe, Ni, Mn, Zn y Cr VI (Nasu y Kugimoto, 1981; Wang et al., 1997; Maine et al., 2001; Miretzky et al., 2004).
Las macrofitas, Eichhornia crassipes y determinadas especies de la familia Lemnaceae, tales como Spirodela sp, Lemna gibba y L. minor, han sido estudiadas para la remoción de determinados metales (Gardea-Torresdey et al., 2005; Del Campo Marín y Oron, 2007; Rhaman et al., 2007). Mishra y Tripathi (2008) demostraron que E. crassipes es más eficiente que P. stratiotes y Spirodela polyrrhiza para eliminar diferentes metales (Fe, Zn, Cu, Cr y Cd). Por otra parte, Axtell et al. (2003) evidenciaron que L. minor es efectiva en la remoción de Ni, y que es capaz de eliminar entre el 50 y 90% de este metal dentro de las primeras 24 horas.
El objetivo de este estudio fue evaluar la capacidad de remediación de L. minor y E. crassipes cuando son expuestas a diferentes concentraciones de níquel.
MATERIALES Y MÉTODOS
La especie E. crassipes (Mart) Solms (Pontederiaceae) fue recolectada en el río Paraná de las Palmas (Escobar, provincia de Buenos Aires, Argentina) y la especie L. minor (Lemnaceae) en un estanque cercano a la ciudad de Castelar (provincia de Buenos Aires, Argentina).
Previo al ensayo, las plantas fueron aclimatadas durante quince días en bandejas rectangulares (1.52 x 0.6 x 0.1 m) conteniendo agua corriente. Se agregó 1 kg de lombricompuesto por bandeja cada 7 días (pH 7.56; CE 4.47 mS.cm-1; COT 36.69% NTK 3.83%; C/N 9.57).
El estudio fue realizado en febrero (2006) en un invernadero donde el fotoperíodo, la temperatura y la humedad fueron registrados diariamente (Datalogger AZ 8829).
Las plantas fueron sacadas de las bandejas de cultivo, lavadas con agua destilada para eliminar resto de sedimentos y luego secadas con papel absorbente. En el caso de que alguna planta presentase tejido dañado o deteriorado, éste fue descartado para el ensayo.
Las plantas seleccionadas (30 gr de peso húmedo/especie) fueron colocadas en recipientes cilíndricos plásticos (diámetro: 13 cm, capacidad: 1 litro) con 700 ml de una solución de Ni2+. Cada solución de Ni2+ (NiSO4.6H20) fue preparada en una solución nutritiva (Hoagland and Arnon, 1950) para asegurar el aporte de nutrientes durante el experimento.
Cada especie fue sometida a cuatro tratamientos, con 0, 1, 3 y 6 mg l-1 de Ni. Además, para cada concentración de Ni, se realizó un control sin planta para evaluar el fenómeno de adsorción del contaminante en la superficie interior del recipiente plástico.
El experimento consistió en un diseño completamente aleatorio, con tres repeticiones para cada tratamiento. Se tomaron muestras a las 0, 3, 20, 24, 48, 72, 168 y 336 horas de incubación para cada tratamiento y control.
La pérdida de agua por procesos de transpiración y evaporación fue compensada diariamente con solución nutritiva, a fin de evitar el efecto de concentración del contaminante. El volumen perdido de la solución en cada muestreo no fue compensado, siendo un 5,7% del volumen total, al final del ensayo. La concentración de metal en la solución fue determinada por espectrofotometría de absorción atómica (Perkin Elmer, AAnalyst 100; CNEA- Comisión Nacional de Energía Atómica -; límite de detección para Ni: 0,2 mgl-1)
Al final del experimento las plantas fueron retiradas de los recipientes con la solución, lavadas con agua destilada y secadas con papel absorbente. Luego, el tejido de la planta fue secado a 105 °C hasta obtener un peso constante, triturado y digerido con ácido nítrico (HNO3), según métodos normalizados por la APHA (1992).
La concentración de Ni en las plantas fue determinada por espectrofotometría de absorción atómica. La masa de Ni en las plantas fue calculada a partir de estos datos obtenidos y comparados con la masa inicial del metal en la solución para cada tratamiento.
Un análisis de regresión fue llevado a cabo para comparar las curvas de concentración de Ni en solución en función del tiempo. Se calculó el tiempo necesario para eliminar el 50% del Ni en la solución.
El ANOVA y el Test de Student fueron utilizados para comparar la masa inicial de Ni en solución con la masa incorporada de Ni por las plantas al final de la experiencia. Se utilizó el paquete estadístico Infostat V 08. En todos los casos, el nivel de significancia empleado fue del 5%.
RESULTADOS Y DISCUSIÓN
Remoción de Ni en solución
Los registros en el invernadero indicaron temperaturas promedio de 27 ºC, 70% de humedad relativa y fotoperíodos de 14 horas.
La concentración de Ni en los controles sin plantas se mantuvo aproximadamente constante durante todo el ensayo. Los valores obtenidos fueron los siguientes: 1,0 ± 0,02 mg l-1, 2,76 ± 0,03 mg l-1 y 5,4 ± 0.11mg l-1 para 1, 3 y 6 mg l-1, respectivamente. En consecuencia, el metal no fue adsorbido en la superficie de los recipientes plásticos y, por lo tanto, la concentración de Ni en la solución se mantuvo estable.
Las figuras 1 a, b y c muestran las curvas de concentración de Ni (1, 3 y 6 mg l-1) obtenidas en función del tiempo para ambas especies y sus controles. Las curvas fueron ajustadas según el modelo exponencial negativo: y=a+b.e(-cx) (R2> 90%).
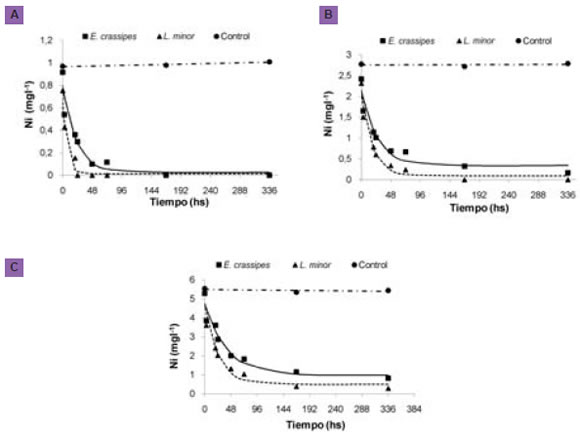
Figura. 1 Variación de Ni en los tratamientos con 1 mg l-1 (a), 3 mg l-1 (b), 6 mg l-1 (c) y sus respectivos controles en función del tiempo, debido a la presencia de Lemna minor y Eicchornia crassipes. Fuente: Bres, P.
La concentración de Ni en los controles con plantas (L. minor y E. crassipes sin contaminantes) estuvo por debajo del límite de detección (<0.2 mg l-1). Sin embargo, en todos los tratamientos llevados a cabo con el contaminante, la concentración de Ni se redujo significativamente en el tiempo para L. minor (F (6;15) = 47.77, P<0.001) y E. crassipes (F (6;15) = 58.98, P<0.001).
Los porcentajes de remoción fueron del 100%, 100% y 95% en 1, 3 y 6 mg l-1, respectivamente para L. minor al final del ensayo. Estos porcentajes fueron similares a los obtenidos por Axtell et al. (2003), que estudió la eliminación de Ni en L. minor con diferentes concentraciones de Pb y encontró una tasa de eliminación similar. Los resultados mostraron que esta planta elimina un 80% y 87% de Ni en 2,5 y 5 mg l-1, respectivamente. Estos resultados demostraron la absorción preferencial de Ni en lugar del Pb. Los valores superiores encontrados en este estudio podrían atribuirse a la exposición de esta especie a un solo contaminante, evitando así posibles efectos de antagonismo/sinergismo.
Los porcentajes de remoción fueron del 100%, 93% y 85% en los tratamientos 1, 3 y 6 mg.l-1 respectivamente para E. crassipes, al final del ensayo. Hadad et al. (2011) expuso a E. crassipes a concentraciones de Ni de 1 mg.l-1 por 30 días y obtuvo un 95% de eliminación al final del ensayo. Esta alta eliminación de Ni fue consistente con los resultados obtenidos en este experimento.
La tasa de remoción de Ni fue dependiente de la concentración inicial. Cuando la concentración inicial fue baja, la tasa de eliminación del metal fue mayor que para concentraciones más elevadas. Si bien ambas especies fueron capaces de eliminar Ni de la solución, L. minor fue más eficiente (F (3; 10) = 5.97, P< 0.002) que E. crassipes en el tratamiento con 1 mg l-1. En lo que respecta a los tratamientos con 3 y 6 mg l-1 no se obtuvieron diferencias significativas entre ambas especies (F (3;10)=3.05, P=0.0788 y F(3;10)= 3.47, P= 0.0585). En consecuencia, para elevadas concentraciones, la capacidad de eliminación fue similar.
Otros autores han encontrado que E. crassipes es más eficiente para eliminar este ión metálico que L. minor (Upadhyay et al., 2007). Probablemente, esta diferencia podría deberse a que en nuestro estudio el Ni fue el único metal involucrado, mientras que estos autores trabajaron con aguas residuales municipales que contenían diferentes metales. Es posible que ciertos mecanismos de competitividad y selectividad jueguen un rol importante cuando existen varios contaminantes involucrados.
Cuando se compararon ambas especies en relación al tiempo necesario para obtener una reducción del 50% en la concentración del ión, los datos obtenidos evidenciaron que L. minor requirió un menor tiempo en los tres tratamientos (tabla 1). Si bien no se encontraron diferencias significativas con respecto a la capacidad de eliminación entre ambas especies, con 3 y 6 mg l-1, el tiempo necesario para eliminar el 50% de la concentración con E. crassipes fue 1.5 veces mayor que el registrado en L. minor.
Tabla 1. Tiempo (h) de L. minor and E. crassipes para remover el 50% de Ni en las tres concentraciones iniciales. Fuente: Bres, P

Se determinó además, que ambas especies removieron el 50% del ión metálico dentro de las primeras 24 horas. Esto fue consistente con los resultados obtenidos por Axtell et al. (2003) y Hadad et al. (2009), donde la eliminación se produjo muy rápidamente en las primeras 24 horas, siendo 50-90% para L. minor y 62% para E. crassipes.
La incorporación del metal en el tejido de la planta en ese período de tiempo sugiere que el tiempo de exposición al contaminante podría acortarse. La inducción de síntomas de toxicidad producidos por tiempos de exposición mayores, como la clorosis y el deterioro de las raíces, podrían, por lo tanto, evitarse. Además, la descomposición de tejidos vegetales (hojas y raíces) puede liberar el metal al medio, quedando disponible para otros organismos de la cadena trófica (Burke et al., 2000; Miretzky et al., 2004).
Análisis del tejido de la planta
La concentración de Ni en los controles fue por debajo de los límites de detección (<0.2 mg l-1) en ambas especies, tanto al inicio como al final del ensayo, y por lo tanto, no fue considerado en este estudio.
Los valores de masa inicial de Ni en solución y en el tejido de las plantas al final del experimento, son mostrados en la tabla 2 para L. minor y E. crassipes.
Tabla 2. Masa inicial de Ni en solución y en el tejido vegetal al final del experimento para L. minor y E. crassipes. Fuente: Bres, P.
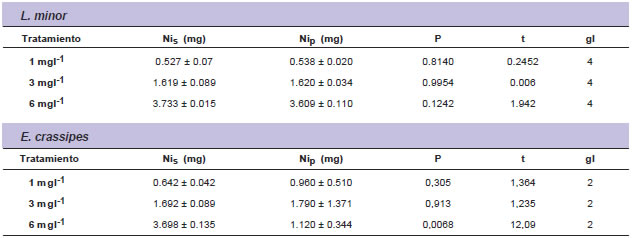
Nis (mg)= miligramos de Ni en solución al comienzo del ensayo.
Nip (mg)= miligramos de Ni en el tejido de la planta al final del ensayo.
P= probabilidad.
t= valor del test de student.
gl= grado de libertad
El análisis estadístico demostró que no hubo diferencias significativas entre la concentración inicial de Ni en la solución y aquella que se encontró en el tejido vegetal de L. minor al final de la incubación. Las plantas acumularon Ni en sus tejidos en los tres tratamientos y fueron por tanto responsables de la eliminación de este ión metálico.
Los resultados mostraron que la incorporación del metal fue dependiente de la concentración inicial. Saygideger et al. (2005) estudió la adsorción de los iones Cd, Ni y Cu en especies de L. minor para evaluar el efecto de la concen tración inicial del contaminante. Este estudio demostró que la concentración inicial del metal tiene un papel importante para la transferencia de masa entre las fases acuosa y sólida. El equilibrio de la capacidad de adsorción de la biomasa fue incrementada con el aumento de la concentración inicial del metal.
El análisis del tejido de E. crassipes mostró que toda la masa inicial de Ni en solución fue incorporada por la planta en los tratamientos con 1 y 3 mg l-1. Sin embargo, hubo diferencias significativas entre la masa inicial de Ni en la solución y la encontrada en el tejido de la planta al final del experimento para el tratamiento con 6 mg l-1. Hubo una eliminación del 85% de Ni en solución para este tratamiento (fig. 1), sin embargo, la masa de Ni incorporada por la planta fue menor a la esperada. Esto podría deberse a que fue analizada en conjunto la parte aérea y las raíces. La digestión ácida de una pequeña fracción del tejido de E. crassipes, formada por estructuras histológicas más diferenciadas que en L. minor, podría proporcionar valores poco representativos de la acumulación de Ni en la biomasa total.
Sería recomendable analizar la parte aérea y las raíces por separado en futuros ensayos. Esto permitiría determinar la zona de acumulación de este metal en la planta e identificar los diferentes mecanismos de fitorremediación involucrados (fitoacumulación o rizofiltración, entre otros) Por otra parte, E. crassipes podría requerir una digestión ácida más fuerte para alcanzar una mineralización completa y para reducir la variabilidad encontrada entre las réplicas para cada tratamiento.
CONCLUSIONES
Ambas especies de plantas, L. minor y E. crassipes son capaces de eliminar el Ni presente en solución. La capacidad de eliminación es mayor durante las primeras 24 horas de exposición al contaminante. La especie L. minor fue más eficiente en remover Ni que E. crassipes cuando es expuesta a bajas concentraciones. Estos resultados demuestran que L. minor y E. crassipes pueden ser utilizadas para la fitorremediación de aguas contaminadas con metales.
AGRADECIMIENTOS
El estudio fue financiado por la Universidad de Morón y el Fondo para las Américas. Queremos agradecer al Sr. Luis Díaz por su participación en la preparación del experimento y la recolección de muestras.
BIBLIOGRAFÍA
1. APHA. 1992. Standard Methods for the Examination o Water and Wastewaters. Part.3030. American Public Health Association, (ed) Díaz de Santos, Madrid, España. [ Links ]
2. AXTELL, N.R.; STERNBERG, S.P.K.; CLAUSSEN, K. 2003. Lead and nickel removal using Microspora and Lemna minor. Bioresource Technol 89, 41-48. [ Links ]
3. BURKE, D.J.; WEIS, J.S.; WEIS, P. 2000. Release of metal by the leaves of the salt marsh grasses Spartina alterniflora and Phragmites australis. Estuar Coast Shelf S 51, 153-159. [ Links ]
4. DEL CAMPO MARÍN, C.M.; ORON, G. 2007. Boron removal by duckweed Lemna gibba: A potential method for the remediation of boron-polluted waters. Water res 41, 4579-4584. [ Links ]
5. GARDEA-TORRESDEY, J.L.; PERALTA-VIDEA, J.R.; DE LA ROSA, G.; PARSONS, J.G. 2005. Phytoremediation of heavy metals and study of the metal coordination by X-ray absorption spectroscopy. Coordin Chem Rev 249, 1797-1810. [ Links ]
6. HADAD, H.R.; MAINE, M.A.; PINCIROLI, M. 2009. Nickel and phosphorous sorption efficiencies, tissue accumulation kinetics and morphological effects on Eichhornia crassipes. Ecotoxicology 18, 504-513. [ Links ]
7. HADAD, H.R; MAINE, M.A; MUFARREGE, M.M; DEL SASTRE, M.V; DI LUCA, G.A. 2011. Bioaccumulation kinetics and toxic effects of Cr, Ni and Zn on Eichhornia crassipes. Journal Hazardous Materials 190, 1016-1022. [ Links ]
8. HOAGLAND, D.R.; ARNON, D.I. 1950. The water culture method for growing plant without soil. California Agricultural Experiment Station, Berkeley. Circular 347, pp. 32. [ Links ]
9. MAINE, M.A.; DUARTE, M.V.; SUÑÉ, N.L. 2001. Cadmium uptake by floating macrophytes. Water Res 35, 2629-2634. [ Links ]
10. MIRETZKY P.; SARALEGUI A.; FERNÁNDEZ CIRELLI A. 2004. Aquatic macrophytes potential for the simultaneous removal of heavy metals (Buenos Aires, Argentina). Chemosphere 57, 997- 1005. [ Links ]
11. MISHRA, V.K.; TRIPATHI B.D. 2008. Concurrent removal and accumulation of heavy metals by the three aquatic macrophytes. Bioresource Technol 99, 7091-7097. [ Links ]
12. NASU, Y.; KUGIMOTO, M.; TANAKA, O.; TAKIMOTO A. 1983. Comparative studies on the absorption of cadmium and copper in Lemna paucicostata. Environ Pollut A 32 (3), 201-209. [ Links ]
13. RAHMAN, M.A.; HASEGAWA, H.; UEDA, K.; MAKI, T.; OKUMURA, C.; RAHMAN, M.M. 2007. Arsenic accumulation in duckweed (Spirodela polyrhiza): A good option for phytoremediation. Chemosphere. 69, 493-499. [ Links ]
14. RASKYN, I.; SMITH, R.; SALT, D. 1997. Phytoremediation of metals: using plants to remove pollutant from the environment. Curr Opin Biotechnol 8, 221-226. [ Links ]
15. RIS INTERNATIONAL, LTD. 2007. Canadian consumer battery baseline study. Final report. 77 p. [ Links ]
16. RYDH, C.J.; KARLSTROM, M. 2002. Life cycle inventory of recycling portable nickel-cadmium batteries. Resour Conserv Recy 34 (4), 289-309. [ Links ]
17. SUTHERSAN, S.S. 2002. Phytoremediation. In: Natural and enhanced remediation systems. [ Links ]
18. SUTTERSAN, S.S. (ed) Arcadis Lewis Publishers, Washington DC, pp. 239-268. [ Links ]
19. SAYGIDEGER, S.; GULNAZ, O.; ISTIFLI, E.S.; YUCEL, N. 2005. Adsorption of Cd (II), Cu (II) and Ni (II) ions by Lemna minor L.: Effect of physicochemical environment. Journal of Hazardous Materials 126, 96-104. [ Links ]
20. UPADHYAY, A.R.; MISHRA, V.K.; PANDEY, S.K.; TRIPATHI, B.D. 2007. Biofiltration of secondary treated municipal wastewater in a tropical city. Ecol Eng 30, 9-15. [ Links ]
21. WANG, W.; GORSUCH, J.W.; HUGHES, J.S. 1997. Plant for Environmental Studies. CRC, New York, Lewis, pp. 563. [ Links ]
22. XIAOLEI, J. 1998. Nickel toxicity and mechanisms of nickel resistance in Scendesmus acutus F. alternans. Thesis for the degree of Doctor Philosophy. Department of Botany. University of Toronto. National Library of Canada. Acquitions and Bibliographic Services. 238 p. [ Links ]














