INTRODUCCIÓN
Las enfermedades cardiovasculares, en especial la cardiopatía isquémica y sus consecuencias a largo plazo, siguen siendo las patologías con mayor número de muertes a nivel mundial.1) El aumento del tono simpático y la reducción del tono parasimpático en la disautonomía que se encuentra en las enfermedades cardiovasculares empobrecen el pronóstico de las mismas.2,3
Ante la caída brusca o gradual del gasto cardíaco en la cardiopatía isquémica, se inician mecanismos neurohumorales de compensación, que buscan sostener la presión arterial y la perfusión de órganos nobles evitando caer en el fallo cardíaco.4 Sin embargo, la activación neurohumoral prolongada, particularmente del sistema nervioso simpático, genera una espiral descendente que agudiza la insuficiencia cardíaca al aumentar la resistencia vascular periférica y expandir el volumen extracelular.5 Los aumentos consecuentes de la precarga y la poscarga impactan de manera negativa en el metabolismo y la función cardíaca. Además de estos mecanismos fisiopatológicos sistémicos, la estimulación simpática cardíaca directa busca aumentar la contractilidad por activación de la vía del receptor β-adrenérgico-Gs-adenilato ciclasa. Pero la estimulación simpática prolongada aumenta la demanda miocárdica de oxígeno, pudiendo paradójicamente deteriorar más aún la función cardíaca.6
Es bien conocido que la activación simpática es un marcador del estado de la insuficiencia cardíaca y un factor pronóstico negativo de morbilidad y mortalidad. 7 Tanto el bloqueo beta adrenérgico como la activación parasimpática demostraron efectos favorables en la cardiopatía isquémica y la insuficiencia cardíaca. 6,8,9,10,11) Sin embargo, el pronóstico de un grupo numeroso de pacientes con cardiopatía isquémica sigue siendo muy desfavorable, lo cual genera la necesidad de profundizar en los mecanismos fisiopatológicos en busca de nuevas opciones terapéuticas.
En este trabajo nuestro objetivo fue estudiar el tamaño del infarto y la función ventricular izquierda en un modelo de ratones transgénicos con sobreexpresión de la proteína Gs-α cardíaca en el contexto de la isquemia y la reperfusión miocárdica y el infarto crónico. Estos ratones transgénicos se caracterizan por una mayor activación beta adrenérgica selectiva en el corazón, manifestada por una mayor respuesta cronotrópica e inotrópica. 12 Sin embargo, no se demostró previamente si esta estimulación simpática específica en el corazón repercute en cambios en el tamaño del infarto y la función ventricular en la cardiopatía isquémica.
MATERIALES Y MÉTODOS
Diseño experimental: Se utilizaron ratones macho, de 2 a 4 meses de edad, transgénicos (TG), que sobreexpresan selectivamente a nivel cardíaco la subunidad alfa de la proteína G estimulante guanosina 5’-trifosfato (Gs-α) y se los comparó con ratones no transgénicos (wild-type, WT). 13 Para los experimentos agudos, los ratones fueron anestesiados con pentobarbital sódico a una dosis de 90 mg/kg. Para los experimentos crónicos, los ratones fueron anestesiados con ketamina y xilazina (35 y 5 mg/kg, respectivamente). Se administraron dosis adicionales de mantenimiento según requerimiento. Se generó una isquemia miocárdica regional ingresando al tórax a través del cuarto espacio intercostal izquierdo. Aquellos animales con seguimiento crónico, luego del cierre por planos anatómicos de la incisión quirúrgica, fueron recuperados de la anestesia en jaulas individuales y se les administró una dosis de 50 µg/g de tramadol como analgésico y 50 µg/g de cefazolina sódica como antibiótico.9,10
Protocolos experimentales (Figura 1): En los experimentos agudos, luego de un período de estabilización, se ocluyó la arteria interventricular anterior. En los grupos agudos, la isquemia fue de 30 minutos, seguido de reperfusión (IR) durante 2 horas (WT IR-2hs y TG IR-2hs); mientras que en los grupos crónicos la isquemia fue sin reperfusión (I), con un seguimiento durante 28 días (WT I-28d y TG I-28d). Cada grupo experimental con isquemia fue acompañado de un grupo control (WT/TG Sham-2hs y WT/TG Sham-28d).
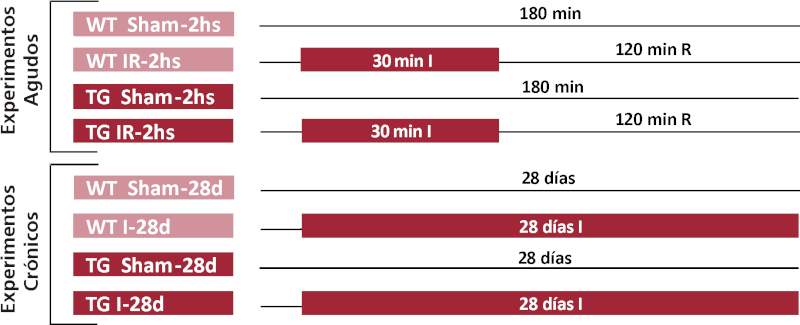
Fig.1. Esquema representativo del diseño experimental. WT: ratones wild-type; TG: ratones transgénicos; IR: Isquemia y reperfusión; min: minutos; d: días; hs: horas; I: Isquemia; R: Reperfusión.
Medición del tamaño de infarto: Pasadas 2 horas de reperfusión, los animales de los protocolos agudos fueron eutanasiados con una sobredosis de ketamina y xilazina. La arteria reperfundida fue ligada nuevamente, y se infundió una solución de azul de Evans por la arteria aorta ascendente con el fin de marcar el área de riesgo (área no teñida). Posteriormente el ventrículo izquierdo (VI) fue seccionado en cortes transversales, incubados en una solución al 1% de Cloruro de 2,3,5-Trifeniltetrazolio (TTC) 8 durante 20 minutos con el objeto de determinar el área infartada. Mediante imágenes digitales y el software Image-Pro Plus (versión 6.0), se calculó el área de riesgo (AR) que fue expresada como un porcentaje del área total de la pared ventricular izquierda y el tamaño de infarto (TI) expresado como porcentaje del área de riesgo del ventrículo izquierdo. 10
Mediciones Hemodinámicas: Se disecó la arteria carótida común derecha, a través de la cual se introdujo un catéter hasta el VI unido a un preamplificador y un equipo (PowerLab) conectado a una computadora con el software LabChart. Durante todo el protocolo agudo y al final de los protocolos crónicos, se registraron la frecuencia cardíaca (FC), la presión sistólica del ventrículo izquierdo (PSVI), la +dP/dtmáx, la -dP/ dtmáx y la presión de fin de diástole del ventrículo izquierdo (PFDVI). 10
Mediciones ecocardiográficas: Luego de 28 días de seguimiento posterior a la isquemia, los ratones fueron anestesiados con 0,3 mg/kg de una solución al 2,5% de Avertin (2,2,2-Tribromoetanol)(Sigma-Aldrich). 14 Para llevar a cabo el estudio ecocardiográfico se utilizó un equipo Acuson Sequoia C512, equipado con un transductor de ultrasonido lineal de 14 MHz. Se calcularon la fracción de eyección ventricular izquierda (FE), la fracción de acortamiento (FA), y los cambios del área fraccional del VI (CAF) para evaluar la función sistólica. 9
Análisis estadístico: Los resultados se expresaron como la media aritmética y el error estándar de la media. Las variables hemodinámicas fueron analizadas utilizando análisis de la varianza para medidas repetidas, seguido de la prueba pos hoc de Bonferroni. Los resultados del AR y TI, fueron analizados mediante el Test de Student. Se consideró una diferencia significativa cuando el valor de p fue menor a 0,05.
Consideraciones éticas: El modelo experimental de este proyecto fue aprobado por el Comité de Cuidado Animal de la Facultad de Medicina de la Universidad de Buenos Aires (Res CD nro. 339/18).
RESULTADOS
Efectos de la sobreexpresión de Gs-α sobre el tamaño de infarto y la función ventricular en experimentos agudos:
La Fig. 2, panel A muestra el AR de los grupos WT y TG de 2 horas de seguimiento posterior a la reperfusión. Como era de esperar, no presentan diferencias significativas (IR-2h WT: 43±2,5%; IR-2h TG: 41,9 ± 3%. p = NS) lo que permite la comparación de los siguientes tamaños de infarto. La sobreexpresión de la subunidad alfa de la proteína Gs no modificó de forma significativa el TI medido luego de 30 minutos de isquemia y 2 horas de reperfusión (IR-2hs WT 59,2 ± 2,5% vs IR-2hs TG 57,3 ± 3,5%; p = NS). (Fig. 2 panel B)

Fig. 2 Área de riesgo (Panel A) y tamaño del infarto (Panel B) de los grupos agudos wild type (WT) y transgénicos (TG) con dos horas de reperfusión posterior a 30 min de isquemia. AR: Área de riesgo. AI: Área de Infarto. IR: Isquemia y reperfusión. VI: Ventrículo izquierdo.
La Tabla 1 muestra los valores basales de la FC, PSVI, PFDVI, +dP/dtmáx y -dP/dtmáx de los cuatro grupos experimentales con 2 horas de reperfusión, tras 30 minutos de isquemia. Solo se observa una diferencia significativa en la FC de los grupos TG en comparación con los ratones WT. Este efecto cronotrópico positivo que se mantiene a lo largo de todo el experimento es esperable en los ratones transgénicos.
Durante la isquemia, la PFDVI se eleva significativamente tanto en el grupo IR-2hs WT (6,9 ± 1 mmHg) como en el IR-2 hs TG (7,66 ± 0,7 mmHg) en relación a sus respectivos grupos Sham (Sham-2 hs WT: 2,74 ± 0,1 mmHg y Sham-2hs TG: 3,62 ± 0,2 mmHg) (p <0,05). A su vez, ambos grupos con isquemia presentan una elevación significativa de la PFDVI con respecto a sus valores basales (IR-2hs WT: Basal 3,03 ± 0,2 mmHg vs 30 min Isquemia 6,9 ± 1 mmHg; p <0,05); (IR-2 hs TG: Basal 2,64 ± 0,2 mmHg vs 30 min Isquemia 7,66 ± 0,7; p <0,05). No se encontraron diferencias durante la isquemia ni en la reperfusión entre los valores de PFDVI y dP/dtmáx de los ratones TG y WT.
Efectos de la sobreexpresión de Gs-α sobre la función ventricular en los experimentos crónicos:
La Figura 3 muestra los valores de la FE (panel A), la FA (panel B) y CAF (panel C). En comparación con los grupo Sham, los grupos I-28d muestran una disminución significativa de la FE (WT: Sham-28d 82 ± 2,4% vs I-28d 44 ± 4% y TG: Sham-28d 89 ± 2% vs I-28d 42 ± 3%), una disminución de la FA (WT: Sham28d 44 ± 2,6% vs I-28d 17 ± 2% y TG: Sham-28d 52 ± 2,7% vs I-28d 16,7 ± 1,2%) y de la CAF (WT: Sham-28d 50 ± 2,6% vs I-28d 28,6 ± 2,6% y TG: Sham-28d 61,8 ± 5% vs I-28d 26,5 ± 2,5%) (p<0,05). No se observan diferencias significativas entre los grupos WT y TG luego de 28 días de evolución.
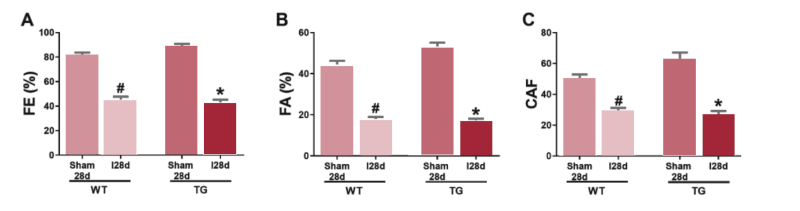
Fig. 3 Valores de Fracción de Eyección (FE%) (panel A), Fracción de Acortamiento (FA%) (panel B) y Cambio del Área Fraccional del VI (CAF) (panel C) en los animales WT y TG de los grupos Sham-28d y I28d. Análisis estadístico mediante ANOVA seguido del test post hoc de Bonferroni. WT: ratones wild-type; TG: ratones transgénicos; I: Infarto de reperfusión; d: Días.
La Tabla 2 muestra los parámetros hemodinámicos obtenidos a partir del cateterismo del VI luego de 28 días de infarto. La FC es mayor en los ratones TG con respecto a los WT. Se observa una caída en la +dP/ dtmáx y la -dP/dtmáx en los grupos con isquemia. No se observan diferencias significativas en la PSVI entre los grupos. Se observa un aumento en la PDFVI en los grupos con isquemia respecto a sus grupos control (WT: Sham-28d 3±0,2 mmHg vs I-28d 12 ± 2 mmHg y TG: Sham-28d 3,1 ± 0,3 mmHg vs I-28d 9 ± 0,9 mmHg) (p <0,05).
Tabla 1 Función ventricular y frecuencia cardíaca de los ratones wild-type (WT) y transgénicos (TG) con 2 horas de seguimiento posterior a la reperfusión. IR: Isquemia y reperfusión. Isq: isquemia; Rep: reperfusión; Min: minutos; FC: frecuencia cardíaca; PSVI: presión sistólica del ventrículo izquierdo; PFDVI: presión de fin de diástole del ventrículo izquierdo; dP/dt: derivada de la curva de presión ventricular izquierda; lpm: latidos por minuto. Valores expresados como Media ± Error estándar. Método estadístico aplicado: ANOVA para medidas repetidas seguido del Test de Bonferroni
| GRUPOS | Basal | 30 min Isq | 5 min Rep | 60 min Rep | 120 min Rep | ||
|---|---|---|---|---|---|---|---|
| FC (lpm) | WT | Sham-2hs | 488 ± 26 | 490 ± 29 | 489 ± 29 | 498 ± 20 | 490 ± 22 |
| IR-2hs | 459 ± 22 | 461 ± 14 | 481 ± 11 | 487 ± 15 | 489 ± 15 | ||
| TG | Sham-2hs | 653 ± 32*‡ | 649 ± 32*‡ | 653 ± 30*‡ | 652 ± 31*‡ | 664 ± 31*‡ | |
| IR-2hs | 654 ± 15*‡ | 666 ± 15*‡ | 672 ± 18*‡ | 645 ± 17*‡ | 621 ± 26*‡ | ||
| PSVI (mmHg) | WT | Sham-2hs | 100 ± 7 | 98 ± 2 | 97 ± 5 | 99 ± 2 | 96 ± 2 |
| IR-2hs | 90 ± 3 | 70 ± 5* | 72 ± 5* | 80 ± 4* | 79 ± 5 | ||
| TG | Sham-2hs | 88 ± 4 | 89 ± 4 | 89 ± 3 | 87 ± 4 | 89 ± 5 | |
| IR-2hs | 86 ± 3 | 76 ± 2 | 77 ± 3 | 77 ± 3 | 77 ± 3 | ||
| PFDVI (mmHg) | WT | Sham-2hs | 2,74 ± 0,1 | 3,25 ± 0,2 | 3,42 ± 0,3 | 3,12 ± 0,3 | 3 ± 0,4 |
| IR-2hs | 3,03 ± 0,2 | 6,9 ± 1*† | 5,68 ± 2 | 4,14 ± 1 | 4,21 ± 1 | ||
| TG | Sham-2hs | 3,62 ± 0,2 | 3,25 ± 0,2 | 2,78 ± 0,2 | 3,09 ± 0,3 | 3,34 ± 0,4 | |
| IR-2hs | 2,64 ± 0,2 | 7,66 ± 0,7§¶ | 7,2 ± 1,3 | 6,06 ± 0,9 | 6,04 ± 0,9 | ||
| +dP/dtmáx (mmHg/seg) | WT | Sham-2hs | 8843 ± 952 | 8330 ± 238 | 8243 ± 557 | 8566 ± 416 | 7642 ± 425 |
| IR-2hs | 6231 ± 398 | 4561 ± 471* | 4619 ± 503* | 5338 ± 423* | 5139 ± 582 | ||
| TG | Sham-2hs | 8258 ± 713 | 8365 ± 694 | 8237 ± 807 | 8337 ± 751 | 8284 ± 732 | |
| IR-2hs | 7889 ± 544 | 7006 ± 472 | 6386 ± 614 | 6454 ± 385 | 6423 ± 508 | ||
| -dP/dtmáx (mmHg/seg) | WT | Sham-2hs | -6563 ± 511 | -6986 ± 95 | -6917 ± 301 | -7337 ± 203 | -6892 ± 188 |
| IR-2hs | -6039 ± 350 | -4190 ± 456* | -4382 ± 516* | -5237 ± 464* | -5059 ± 678 | ||
| TG | Sham-2hs | -6746 ± 220 | -6600 ± 419 | -6882 ± 233 | -6712 ± 247 | -6775 ± 408 | |
| IR-2hs | -6607 ± 262 | -5760 ± 471 | -5963 ± 494 | -6124 ± 446 | -6031 ± 562 | ||
* p <0,05 vs Sham-2hs WT; ‡ p <0,05 vs IR-2hs WT; †p <0,05 vs Basal IR-2hs WT; § p <0,05 vs Sham-2hs TG; p <0,05 vs Basal IR-2hs TG
Tabla 2 Función ventricular y frecuencia cardíaca de los ratones WT y TG con 28 días de seguimiento posterior a la isquemia regional permanente. WT: ratones wild-type; TG: ratones transgénicos; I: infarto de reperfusión; d: días; FC: frecuencia cardíaca; lpm: latidos por minuto; PSVI: presión sistólica del ventrículo izquierdo; PFDVI: presión de fin de diástole del ventrículo izquierdo; dP/dt: derivada de la curva de presión ventricular izquierda.
| Grupos | FC | PSVI | PFDVI | +dP/dtmáx | -dP/dtmín | |
|---|---|---|---|---|---|---|
| (lpm) | (mmHg) | (mmHg) | (mmHg/seg) | (mmHg/seg) | ||
| WT | Sham-28d | 462 ± 6 | 100 ± 3 | 3 ± 0,2 | 8561 ± 674 | 7619 ± 287 |
| I-28d | 432 ± 18* | 74 ± 4 | 12 ± 2* | 4269 ± 285* | -4174 ±237* | |
| TG | Sham-28d | 485 ± 17 | 94 ±4 | 3,1 ± 0,3 | 8281 ± 1212 | -7551 ± 260 |
| I-28d | 540 ± 7*‡ | 84 ± 5 | 9 ± 0,9† | 6442 ± 710 | -5645 ± 389 |
*p <0,05 vs Sham-28d WT; ‡p <0,05 vs I28d WT; †p <0,05 vs Sham-28d TG
DISCUSIÓN
En este estudio demostramos que la hiperactividad simpática cardíaca basal por sobreexpresión de la proteína Gs-α ligada al receptor β-adrenérgico no modifica el tamaño del infarto ni la función ventricular izquierda luego de 30 minutos de isquemia y 2 horas de reperfusión. También, observamos que la sobreexpresión de la proteína Gs-α no modifica la función ventricular en un modelo de infarto crónico sin reperfusión, evaluado por cateterismo y ecocardiograma. Tal como fue demostrado en trabajos previos, estos ratones transgénicos tienen una función cardíaca basal mayor en comparación con los animales no transgénicos, manifiesta por una frecuencia cardíaca más alta y una mayor reserva inotrópica. 12,15,16 El aumento del gasto cardíaco implica un mayor consumo miocárdico de oxígeno, que en el contexto de la isquemia/reperfusión miocárdica, implicaría un mayor daño, lo cual no se ve reflejado en el tamaño del infarto evaluado en nuestro modelo experimental. Esto sugiere que existen mecanismos compensadores que impiden un daño miocárdico mayor por la hiperactividad β-adrenérgica, al menos en animales jóvenes y en un período de evolución de un mes. Sería interesante evaluar estos experimentos en un seguimiento más prolongado en que los corazones tengan un mayor grado de descompensación.
Contrariamente a lo que observamos en este proyecto con experimentos en animales jóvenes, la sobreexpresión de la proteína Gs-α lleva a una progresiva miocardiopatía y descompensación de los corazones de animales de mayor edad.16 Se demostró la presencia de fibrosis, hipertrofia de los miocitos y alteraciones en la función ventricular, como consecuencia de la estimulación simpática crónica.16 Es por ello que en nuestro trabajo se usaron animales antes de la presencia de la cardiopatía de base que luego desarrollarán.
Aunque los ratones TG tienen una mayor frecuencia cardíaca basal y una mayor respuesta inotrópica, los valores de presión sistólica ventricular son similares a los de los animales WT. En este mismo sentido, previamente se demostró que estos ratones transgénicos tienen cifras de presión arterial media ligeramente superiores, sugiriendo que la resistencia vascular periférica podría ser superior.15 Si bien no fue nuestro objetivo estudiar comparativamente la participación de la activación simpática cardíaca local o sistémica, es posible que la activación selectiva de la vía β1 adrenérgica no sea la principal causa de daño en la cardiopatía isquémica, como sí lo sería la activación neurohumoral sistémica. Una profundización de este estudio podría aportar nuevos conocimientos del rol del sistema nervioso simpático en el daño y la protección miocárdica.















