Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Boletín de la Sociedad Argentina de Botánica
versión On-line ISSN 1851-2372
Bol. Soc. Argent. Bot. v.44 n.3-4 Córdoba ago./dic. 2009
ANATOMÍA Y MORFOLOGÍA
Identificación y sitios de acumulación de sustancias ergásticas en tallos de Cuphea Glutinosa (Lythraceae). Variaciones debidas a la madurez y al ambiente
Ana C. Martínez Tosto 1, Cristina Yagueddú1 y Mirta O. Arriaga2
1 Lab. Botánica - Departamento de Biología. Universidad Nacional de Mar del Plata. Funes 3250 B7602AY -Mar del Plata -Argentina - Emails: amtosto@mdp.edu.ar, yagueddu@mdp.edu.ar
2 Laboratorio de Anatomía Vegetal. Museo Argentino de Ciencias Naturales "Bernardino Rivadavia". Av. Angel Gallardo 470 -C1405DJR - Buenos Aires - Argentina - Email: marriaga@macn.gov.ar
Resumen: Cuphea glutinosa Cham. et Schltdt. es una especie ampliamente distribuida en América templada, presente en las sierras bonaerenses, potencialmente importante desde el punto de vista industrial y medicinal. El presente trabajo tiene por objeto determinar las sustancias ergásticas presentes en los tallos, los sitios de acumulación de las mismas y las características anatómicas de tallos maduros y jóvenes de plantas creciendo en diferentes condiciones de humedad y luz. Se muestrearon tallos jóvenes y maduros de plantas de Sierra Bachicha, Sierra de los Padres y Sierra de los Difuntos. Se realizaron cortes a mano alzada para el estudio de la anatomía del tallo y la aplicación de test histoquímicos para identificar almidón, grasas-aceites, mucílago y taninos. Se confirma la presencia de grasas-aceites y mucílagos en células de los pelos glandulares y gotas exudadas; amiloplastos y taninos en distintos tejidos. Los tallos jóvenes provenientes de suelos húmedos presentan mayor cantidad de drusas que aquellos de suelos secos, mientras que los tallos adultos de suelos húmedos, mayor cantidad de amiloplastos que aquellos de suelos secos. Los tallos adultos, especialmente aquellos de suelos húmedos presentan mayor abundancia de taninos. Las diferencias estructurales halladas, tanto en tallos jóvenes como en adultos pueden ser atribuidas a las diferentes condiciones ambientales que afectan los sitios individuales de crecimiento.
Palabras clave: Cuphea glutinosa; Anatomía caulinar; Localización de sustancias ergásticas; Diferencias de maduración; Diferencias ecológicas.
Summary: Identification and accumulation sites of ergastic substances in Cuphea glutinosa (Lythraceae) stems. Variations due to maturity and environment. Cuphea glutinosa Cham. et Schltdl. is widely distributed in temperate areas of America, present in the southeast sierras of Buenos Aires Province, and potentially important from industrial and medicinal points of view. The aim of this work was to determine the accumulation sites of ergastic substances and the anatomical characteristics of mature and young stem of plants growing at different conditions of water and light. Mature and young stems of plants from Sierra Bachicha, Sierra de los Padres and Sierra de los Difuntos were used. Free hand cuts were made in order to study the stem anatomy, and histochemical techniques were applied to identify starch, fats, mucilages and tannins. We confirm the presence of fats and mucilages in cells from glandular hairs and exuded drops; starch grains and tannins in different tissues. Young stems from plants growing on humid soils present more abundance of druses versus those from dry soils; while adult stems from plant growing on humid soils present more abundance of tannins. The structural differences observed either in young stems or in matures ones, may be attributed to different environment conditions that affect the individuals growth sites.
Key words: Cuphea glutinosa; Stem anatomy; Ergastic substances location; Maturity differences; Ecological differences.
INTRODUCCIÓN
Cuphea glutinosa Cham. et Schltdl., comúnmente llamada "siete sangrías" y usada en medicina popular, es originaria de regiones de América con temperaturas templadas. En Argentina se la encuentra desde los 0 a los 1000 m s.n.m., en las provincias de Buenos Aires, Chaco, Córdoba, Corrientes, Entre Ríos, Formosa, La Rioja, Misiones, Santa Fé, San Luis y Tucumán (Zuloaga et al., 2008).
Esta especie no se encuentra citada en la Farmacopea Nacional Argentina debido a que se desconoce el principio activo y su localización dentro de la planta, pero es bien conocido el uso tradicional por sus características diuréticas e hipotensoras (Marzocca, 1997).
Cuphea glutinosa pertenece a la familia Lythraceae. Esta familia, entre otras, ha sido mencionada por Okuda (2005) por presentar taninos c-glicosídicos. Este autor ha reportado que los taninos y sus precursores poseen propiedades antioxidantes, antibacterianas, antivirales, antiflogísticas e hipotensoras.
Estudios fitoquímicos previos han mostrado que el género Cuphea elabora ácidos grasos, esteroles, triterpenos, taninos y flavonoides como metabolitos secundarios (Castorena & Maldonado, 2003). Además, se conoce que los niveles de taninos están influenciados por el clima, suelo, disponibilidad de agua, y otros factores como la edad de la planta y la madurez de las hojas (Makkar & Becker, 1998).
Existen estudios sobre la arquitectura de plantas y morfología de los tallos de C. glutinosa en relación a la vegetación acompañante (Yagueddú et al., 2006), así como una breve descripción anatómica del tallo (Barboza et al. 2001) donde se menciona la presencia de pelos glandulares en los que se han detectado exudados mucilaginosos.
Acorde a los antecedentes mencionados, el objetivo de este trabajo fue identificar las sustancias ergásticas presentes en tallos de Cuphea glutinosa, los sitios de acumulación y sus variaciones en relación a su madurez y al ambiente en el que crecen las plantas.
MATERIALES Y MÉTODOS
Materiales y sitios de muestreo
Se recolectaron tallos de ejemplares de Cuphea glutinosa Cham. et Schltdl. (Lythraceae) pertenecientes a poblaciones que crecen en sierras del Sistema de Tandilia: Sierra Bachicha ( 58º 11' 30" W ; 37º 49' S ) en el Partido de Balcarce, y Sierra de los Padres (57º 46' 45" W; 37º 56' 45" S) y Sierra de los Difuntos (57° 50' W; 37° 53' 30" S) en el Partido de General Pueyrredón (Yagueddú et al. (2006), Fig. 1).
Anatomía del Tallo
Se trabajó con tallos jóvenes (con felógeno no diferenciado) y maduros (con comienzo de formación de peridermis) de plantas provenientes de suelos con buen drenaje y escasa humedad (suelos secos) y suelos con alto contenido de humedad, a capacidad de campo y a veces encharcados (suelos húmedos).
Las muestras fueron colectadas en el campo e inmediatamente fijadas en FAA. Posteriormente se efectuaron cortes a mano alzada los que se montaron directamente en gelatina - glicerina con el fin de analizar las características de los distintos tejidos que componen el tallo.
Las fotografías fueron tomadas en microscopio Olympus CX 21 con cámara fotográfica digital Olympus SP 350 y lupa Kyowa SDZ-TR-PL con cámara Kyowa RFB-7.
Pruebas Histoquímicas
Sobre cortes a mano alzada de material fresco, se realizaron las siguientes pruebas: para detectar almidón se utilizó una solución de Iodo - Ioduro de Potasio (Sass, 1964); para taninos cloruro férrico - carbonato de sodio; para confirmar la existencia de grasas y aceites se empleó Sudan IV y se usó Azul de Cresyl para comprobar la presencia de sustancias mucilaginosas (D' Ambrogio,1986).

Fig. 1 Cuphea glutinosa. A-B: Tallo joven en vista superficial, con epi-iluminación. Exudados (ex) de los pelos glandulares con reacción positiva al Sudán IV (A) y al Azul de Cresyl (B). C, E, F, J: Secciones transversales de tallos maduros que crecen en sitios con suelo húmedo. D, H: Secciones transversales de tallos jóvenes que crecen en sitios con suelo húmedo. G, I: Secciones transversales de tallos que crecen en sitios con suelo seco. C: Presencia de taninos en radios xilemáticos (flecha), reacción positiva a la prueba histoquímica con cloruro férrico - carbonato de sodio. D: Detalle en el que se observan células de la vaina amilífera conteniendo amiloplastos (flecha) y taninos (T). E: Inicio de formación de peridermis (Pe). Nótese la diferencia en los contenidos de taninos entre los tallos provenientes de suelos húmedos (F, H) con respecto a los provenientes de suelos secos (G, I). J: Detalle de la región medular: Vainaperimedular (VPM) y célula de la médula (flecha) con taninos, parénquima medular (PM) con abundantes amiloplastos; Escalas: 250 µm (A, B), 100 µm (F - I), 50 µm (J), 25 µm (C - E).
RESULTADOS
Pruebas histoquímicas
Se confirmó que los contenidos de las células que forman los pelos glandulares y las gotas exudadas reaccionan positivamente al tratamiento con Sudán IV, tiñéndose de color rojizo anaranjado (Fig. 1A), y con Azul de Cresyl presentando una coloración azul francia (Fig. 1B). Estos resultados evidencian la presencia de grasas - aceites y mucílagos en los contenidos de los pelos glandulares.
Se evidenció con solución de Iodo - Ioduro de Potasio la presencia de gránulos de almidón en las células de la vaina amilífera (endodermis) y en células de la vaina perimedular y de la médula, en algunos casos, los que se tiñeron de color pardo oscuro.
La prueba con cloruro férrico - carbonato de sodio indicó la presencia de taninos al dar una coloración gris azulada en células epidérmicas, en algunos casos en células del parénquima cortical, células de la vaina amilífera, en radios y células parenquimáticas del tejido floemático externo e interno, en los radios del xilema y en la médula (Fig. 1C).
Anatomía del Tallo
Los tallos presentan epidermis con pelos glandulares y eglandulares, éstos últimos más abundantes. Los pelos eglandulares son de tipo uniseriado 1-4 celular. Se observó la presencia de taninos en las células epidérmicas tanto en tallos jóvenes como en maduros. La epidermis presenta una gruesa cutícula.
En posición subepidérmica, los cortes analizados presentan entre 1 a 3 capas de clorénquima (constituido por células pequeñas) con abundante cantidad de cloroplastos. Este tejido se continúa internamente con 4 a 6 capas de células parenquimáticas grandes sin cloroplastos, donde en algunos casos se observa gran cantidad de células con contenidos de taninos. Una vaina amilífera (endodermis según Strasburger, 1997), rodea al floema externo en tallos jóvenes. Las células de la vaina amilífera que contienen amiloplastos alternan con células con contenidos de taninos (Fig. 1D). En radios y células parenquimáticas del floema externo se observó la presencia de amiloplastos y taninos. Tanto en el xilema como en el floema interno las células parenquimáticas presentaron variaciones en sus contenidos de taninos.
La peridermis se origina a partir de células parenquimáticas del floema externo (Fig. 1E). A medida que aumentan las capas de suber, parte del floema externo, la vaina amilífera y las células parenquimáticas corticales se comprimen, aumenta el contenido de taninos en toda la corteza, hasta que estos tejidos se desgarran y desprenden.
Se observó la presencia de una vaina perimedular cuyas células contienen taninos (Fig. 1D) y amiloplastos, a veces dispuestas en forma alternada. La zona medular interna, en tallos jóvenes presentó mayor cantidad de drusas en plantas de suelos húmedos con respecto a las de suelos secos, en tanto que en tallos maduros se observó este mismo tipo de variación respecto a los amiloplastos.
El contenido de taninos fue variable, evidenciándose mayor cantidad en tallos maduros y en general en tallos de suelos húmedos (Fig.1F y G). A medida que los tejidos maduran, se observó un incremento en la abundancia de los taninos, en tallos provenientes de las tres sierras muestreadas. Además en tallos jóvenes se observó mayor cantidad de taninos en aquellos provenientes de suelos húmedos con respecto a los de suelos secos (Fig. 1H e I y Tablas 1,2 y 3).
En muestras de Sierra Bachicha y Sierra de los Difuntos se observó abundante cantidad de amiloplastos en parénquima medular de tallos maduros (Fig. 1J y Tablas 1 y 2), mientras que en muestras de Sierra de los Padres también fueron abundantes en vaina perimedular, floema interno, radios xilemáticos y floemáticos, y parénquima floemático (Tabla 3).

Tabla 1. Presencia de taninos y Amiloplastos en los diferentes tejidos de tallos jóvenes y maduros de plantas de Cuphea glutinosa que crecen en distintos suelos de Sierra Bachicha. Amil= amiloplastos, ME= muy escaso, E= escaso, A= abundante.

Tabla 2. Presencia de taninos y amiloplastos en los diferentes tejidos de tallos jóvenes y maduros de plantas de Cuphea glutinosa que crecen en distintos suelos de Sierra de los Difuntos. Amil= amiloplastos, ME= muyescaso, E= escaso, A= abundante, V= variable.
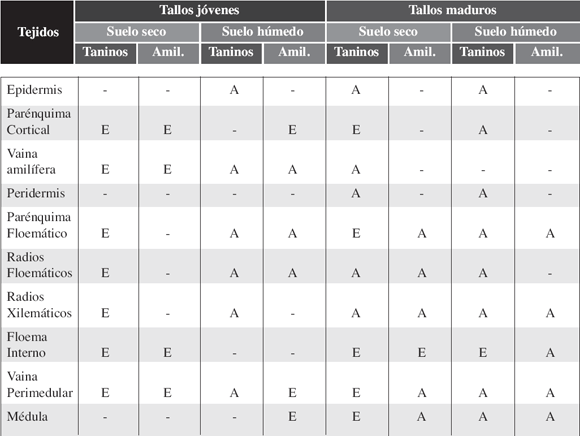
Tabla 3. Presencia de taninos y amiloplastos en los diferentes tejidos de tallos jóvenes y maduros de plantas de Cuphea glutinosa que crecen en distintos suelos de Sierra de los Padres. Amil= amiloplastos, E= escaso, A= abundante.
DISCUSIÓN Y CONCLUSIONES
La descripción general del tallo de Cuphea glutinosa concuerda con la realizada por Barboza et al. (2001). Respecto a los contenidos celulares, dichos autores citan presencia de almidón en posición subepidérmica pero no mencionan taninos ni ninguna otra sustancia, sí destacan la presencia de drusas en el parénquima. En nuestro caso sólo se observó en el material recolectado en Sierra Bachicha y Sierra de los Padres la presencia de 1 a 3 capas de parénquima clorofiliano en posición subepidérmica, como así también la presencia de escasas drusas en el parénquima cortical formado por células grandes sin cloroplastos.
Los diferentes estudios histoquímicos realizados confirmaron la presencia de grasas - aceites en los pelos glandulares, almidón principalmente en médula y vaina amilífera, y taninos en células de la epidermis, vaina perimedular, radios parenquimá-ticos, floema, vaina amilífera y parénquima cortical.
La alternancia de células con contenidos de taninos y células con amiloplastos en la vaina amilífera, concuerda con la hipótesis que sostiene que el tanino actúa como sustancia de reserva relacionada, en alguna forma aún indeterminada, al metabolismo del almidón y/o como sustancia asociada con la formación y el transporte de los azúcares (Esau, 1976).
Las diferencias en el contenido de taninos en los tallos, estarían relacionadas con el aumento de la madurez de los mismos, de acuerdo a lo planteado por Makkar & Becker (1998) con variaciones en la temperatura (Ehlke y Legare, 1993) o bien con una condición de exceso de humedad en el suelo, ya que una de las posibles funciones que se le asigna a la presencia de taninos en los tejidos vegetales sería la protección contra el ataque de hongos y bacterias (Taiz and Zeiger, 1998), además de proteger contra la desecación y de la destrucción por animales (Esau,1976, Fahn, 1982).
En futuros trabajos se contempla el estudio de estos taninos, ya que son compuestos importantes como probables principios activos o precursores de ellos.
AGRADECIMIENTOS
El presente trabajo se realizó en el marco del proyecto "Estudio integral de especies medicinales autóctonas: Cuphea glutinosa Cham. et Schltdl. nativa de las sierras bonaerenses" con subsidio otorgado por la Universidad Nacional de Mar del Plata.
BIBLIOGRAFÍA
1. BARBOZA, G.; N. BONZANI, E. FILIPPA, M. LUJÁN, R. MORERO, M. BUGATTI, N. DECOLATTI & L. ARIZA ESPINAR. 2001. Atlas histo-morfológico de plantas de interés medicinal de uso corriente en Argentina. Universidad Nacional de Córdoba. Argentina. [ Links ]
2. CASTORENA, A. L. & E. MALDONADO. 2003. Triterpenes and flavonoid glycosides from Cuphea wrightii. Biochem. System. and Ecol. 31: 331-334. [ Links ]
3. D' AMBROGIO DE ARGÜESO, A. 1986. Manual de técnicas en histología vegetal. Editorial Hemisferio Sur S. A., Buenos Aires. [ Links ]
4. EHLKE, N.J. & D.G. LEGARE. 1993. The effects of temperature and soil stresses on the production of tannins in birdsfoot trefoil (Lotus coniculatus L.). Lotus Newsletter Vol. 24. [ Links ]
5. ESAU, K. 1976. Anatomía Vegetal. Segunda edición. Ed. Omega, Barcelona. [ Links ]
6. FAHN, A. 1982. Plant Anatomy. 3rd edition. Pergamon Press, Oxford. [ Links ]
7. MAKKAR, H. P. S. & K. BECKER. 1998. Do tannins in leaves of trees and shrubs from African and Himalayan regions differ in level and activity?. Agroforestry Systems 40: 59-68. [ Links ]
8. MARZOCCA, A. 1997. Vademécum de malezas medicinales de la Argentina indígenas y exóticas. Orientación gráfica editora. Buenos Aires, Argentina. [ Links ]
9. OKUDA, T. 2005. Systematics and health effects of chemically distinct tannins in medicinal plants. Phytochemistry 66: 2012-2031. [ Links ]
10. SASS, J. E. 1964. Botanical microtechnique. Third edition. Iowa State University Press. [ Links ]
11. STRASBURGER, E., F. NOLL, H. SCHENCK & A.F.W SCHIMPER. 1997. Tratado de Botánica. 8ª edición. Editorial Omega, S. A. [ Links ]
12. TAIZ, L. & E. ZEIGER. 1991. Plant Physiology. Benjamin Cummings Publishing Company Inc. [ Links ]
13. YAGUEDDÚ, C., V. M. COMPARATORE, F. CARDINALI, J.; A. C. MARTÍNEZ TOSTO & S. V. BEVACQUA. 2006. Cuphea glutinosa (Lythraceae) en Sierras del Sistema de Tandilla: morfología y ambiente. Bol. Soc. Argent. Bot. 41 (3-4): 285 - 292. [ Links ]
14. ZULOAGA, F., MORRONE, O. Y M. J. BELGRANO. 2008. Catálogo de las Plantas vasculares del Cono Sur. Missouri Botanical Garden Press. [ Links ]
Recibido el 22 de mayo de 2009
Aceptado el 28 de octubre de 2009.














