Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de dermatología
versión On-line ISSN 1851-300X
Rev. argent. dermatol. vol.92 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2011
ARTÍCULOS ORIGINALES
Enfermedad de Fabry. Comunicación de ocho casos
Fabry disease. Report of eight cases
M Palombo * y RE Achenbach **
* Médica Concurrente. Unidad Dermatología Hospital Dr. I. Pirovano.
** Jefe de Unidad Dermatología. Hospital Dr. I. Pirovano.
Av, Monroe 3550. Ciudad Autónoma de Buenos Aires. Argentina.
e-mail: rachenbach@hotmail.com
Los autores no poseen conflictos de interés.
RESUMEN
La Enfermedad de Fabry (EF) constituye una alteración hereditaria del metabolismo de los glicoesfingolípidos, debida a la deficiencia parcial o completa de la enzima alfa-galactosidasa A. Es una enfermedad de transmisión genética ligada a X, que afecta universalmente a todas las etnias humanas con una incidencia comunicada de 1 cada 100.000 nacimientos, aunque es probable que esta cifra subestime la real prevalencia de la enfermedad, especialmente por el gran número de casos no diagnosticados.
La EF se manifiesta en su forma más florida, en varones homocigotas que carecen completamente de actividad alfa-galactosidasa A, provocando una miríada de alteraciones, incluyendo anomalías renales (proteinuria progresiva e insuficiencia renal), cardiovasculares (cardiopatías, arritmias, accidentes cerebrovasculares), neurológicas (dolor acral y abdominal), y cocleo-vestibulares, entre las más importantes. Sin embargo, la afectación cutánea constituye la alteración más específica de la enfermedad y es en general, la que conduce a la sospecha diagnóstica.
La EF no tratada reduce francamente la expectativa de vida de acuerdo a la severidad de la afectación renal y cardiovascular, si bien la terapia con reemplazo enzimático puede modificar e incluso detener el curso de la enfermedad.
En 2010, una paciente de 28 años oriunda de la Provincia de Santa Fe, consultó porangioqueratomas, que condujeron al diagnóstico de enfermedad de Fabry. Desde entonces hemos estudiado y tratado a toda la familia, con ocho casos confirmados a la fecha y otros tantos en evaluación.
PALABRAS CLAVE: Angioqueratomas; Reemplazo enzimático; Ocho casos.
SUMMARY
Fabry disease (Online Mendelian Inheritance in Man No. 301500) is an X-linked inherited condition due to absence or reduction of ɑ galactosidase activity in lysosomes that results in accumulation of globotriaosylceramide and related neutral glycosphingolipids (storage disorder). It is estimated to occur in 1 in 40.000 to 117.000 live male births, although a more recent screening study in newborns suggests a much higher incidence. The main clinical traits include cutaneous lesions (angiokeratomas), progressive renal damage with proteinuria, painful neuropathy predominantly affecting the hands and feet (acroparesthesias), myocardial hypertrophy, gastrointestinal manifestations, corneal dystrophy and hypohidrosis. This entails severe progressive multi-system involvement leading to premature death. More than 600 mutations have been described worldwide most of which are private or particular mutations of a single family. We report a 28 years-old woman who consulted to one of us and since 2010 eight cases of the same family were studied and treated with support and enzyme replacement therapy in order to delay the damage to the end organ.
KEY WORDS: Angiokeratomas; Enzyme replacement therapy; Eigth cases
INTRODUCCIÓN
La enfermedad de Anderson-Fabry o enfermedad de Fabry fue descrita en 1898 por dos dermatólogos de forma independiente1,2. Se agrupa dentro de las llamadas enfermedades por depósito lisosomal y es la segunda en frecuencia dentro de estas infrecuentes entidades, después de la enfermedad de Gaucher3. Se produce por un déficit en la actividad de la enzima alfa-galactosidasa A, que provoca acumulación progresiva de glicoesfingolípidos en el interior de los lisosomas, llevando al deterioro de la función y posteriormente a la muerte celular4. Se transmite de forma genética con herencia ligada al cromosoma X, por lo que se manifiesta de forma completa en los varones homocigotos, alcanzando distintos grados de afectación en mujeres "portadoras"5.
El depósito de moléculas no metabolizables se pone de manifiesto produciendo atrofia, isquemia e insuficiencia funcional a nivel de distintos tejidos, particularmente en riñón, sistema cardiovascular y sistema nervioso, lo que deteriora gravemente la calidad de vida de los pacientes y reduce su expectativa de vida6.
La incidencia de la EF se estima en 1 cada 100.000 nacidos vivos, si bien probablemente esta cifra constituya una subestimación del número real de pacientes afectados7 dado que existen dificultades con el diagnóstico, relacionadas con la multiplicidad y baja especificidad de los signos y síntomas de la enfermedad, la gran variabilidad en el grado de afectación entre los pacientes y la falta de información acerca de la enfermedad dentro de la comunidad médica8. De acuerdo con estadísticas locales no oficiales, en la Argentina se conocen 210 pacientes con Fabry9. Teniendo en cuenta que la incidencia probable citada más arriba, para 40 millones de habitantes tendrían que existir al menos 400 casos, lo que demuestra que en nuestro país hay más de 100 pacientes con Fabry no diagnosticados.
Dado que el diagnóstico se realiza la mayoría de las veces gracias a los angioqueratomas extendidos característicos, el dermatólogo juega un papel importantísimo en esta patología.
Durante los últimos años se ha investigado incesantemente, sobre el tratamiento de reemplazo enzimático con enzima recombinante, demostrándose resultados significativos en relación a la disminución de la morbilidad, mejoras en la calidad de vida y aumento en la expectativa de vida10, por lo que el diagnóstico precoz es parte esencial del manejo de la enfermedad de Fabry.
En 2010, una paciente de 28 años de Acebal, una población rural de 6000 habitantes a 30 km de Rosario, consulta por la presencia de lesiones "vasculares-pigmentadas" en la piel. Consultó por éste y otros síntomas asociados sin éxito durante más de 10 años. Las lesiones resultaron ser angioqueratomas, que nos permitieron confirmar luego el diagnóstico de Enfermedad de Fabry. Desde entonces, uno de nosotros (PM) ha podido estudiar ocho casos, existiendo más en el grupo familiar.
Comunicamos la experiencia con estos primeros ocho casos y revisamos el tema bibliográficamente.
MATERIAL Y MÉTODOS
Para la descripción de los casos, se realizó una evaluación exhaustiva de las historias clínicas de los ocho pacientes diagnosticados y tratados, amén de todos los que aún se encuentran en evaluación.
Para la revisión bibliográfica, se utilizaron todos los artículos de revisión que surgieron de una búsqueda en Pubmed con "Fabry" y "Disease" como palabras clave. Se fijaron como límites: idioma inglés, Journal y revistas de medicina interna y dermatología, años 2000 hasta la fecha (Tabla I). Se citaron además algunos otros artículos y capítulos de libros considerados relevantes aunque no estuvieran presentes en la búsqueda original. Estas fuentes se encuentran citadas en la Bibliografía.
Tabla I. Lista de artículos entregado por PubMed frente a las palabras clave "Fabry" y "Disease" entre los años 2010 y 2000 (Límites: Reviews, Journals Medicina Interna y Dermatología, en Inglés)


CASOS CLÍNICOS
La primera paciente es una mujer de 28 años de edad, nacida en Acebal, Santa Fe, sin antecedentes personales de relevancia, consultó en Junio del 2010 por presentar pápulas puntiformes de color rojo a negro de pocos milímetros de diámetro que no desaparecían con la presión, localizadas con distribución "en traje de baño". Las pápulas habían aparecido alrededor de los 14 años de edad. Del mismo tiempo de evolución presentaba hipohidrosis generalizada, intolerancia al calor severa y parestesias acrales, que se exacerbaban con la temperatura. Por último, manifestaba episodios de dolor abdominal postprandial tipo cólico, refractario al tratamiento con analgésicos y antiespasmódicos comunes, acufenos, y fotopsias.
Había realizado múltiples consultas con distintos especialistas, en relación a los síntomas que presentaba, sin obtener diagnóstico.
Luego de examinar extensamente a la paciente, surgió la fuerte sospecha de enfermedad de Fabry; se procedió entonces a la biopsia de una de las lesiones en piel, que informó epidermis con discreta hiperqueratosis laxa, dermis superior con vasos telangiectásicos con discreto engrosamiento de la pared y presencia de escasas microvacuolas a nivel de células endoteliales. El diagnóstico anatomopatológico fue angioqueratoma.
Luego se procedió al dosaje de la enzima alfa galactosidasa A en sangre en papel de filtro (método de Chamoles), para arribar al diagnóstico de certeza de enfermedad de Fabry; se demostró una clara disminución de la actividad de la enzima, con valores de 0,2 umoles/l.h en papel de filtro para un normal de 2,10 como mínimo. Por tratarse de una mujer, se realizó un examen extra de confirmación que demostró la mutación genética c.680G > A del gen GLA de la enfermedad de Fabry.
Para evaluar el grado de afectación sistémica de la enfermedad, se le realizaron análisis de sangre y orina, radiografía de tórax, electrocardiograma, ecocardiograma doppler, ecografía renal bilateral, oftalmoscopía con fondo de ojo, estudio de umbrales sensitivos (QST) y angioresonancia de cerebro. Tanto el laboratorio como la radiografía de tórax y el ECG fueron normales. Lo mismo ocurrió con el doppler y la ecografía renal. En la oftalmoscopía se evidenció córnea verticillata, patognomónica del Fabry y en el estudio de umbrales sensitivos alteración de fibras A, Delta y C en miembros superiores y de fibras A y Delta en miembros inferiores.
Actualmente la paciente se encuentra en tratamiento con terapia de reemplazo enzimática, lleva ocho infusiones con Replagal (agalsidasa alfa 0,2mg/kg) endovenoso por infusión cada quince días, pregabalina 150 mg / día para las acroparestesias y enalapril 1,25 mg/día vía oral para protección de la función renal.
El segundo paciente es un varón de 26 años de edad, hermano de la paciente anterior, sin antecedentes patológicos conocidos. Fue traído a la consulta por su hermana en Julio del 2010, un mes después del primer diagnóstico, por presentar en piel lesiones de las mismas características clínicas pero de distinta localización, ya que en él predominaban en el labio superior de la boca, ombligo, zona genital y rodilla derecha. Habían aparecido hacía más de quince años junto con otros síntomas como: intolerancia severa a los cambios de temperatura y al ejercicio, episodios repetidos de hipertermia, hipohidrosis y acroparestesias, las que señaló como sumamente incapacitantes. A este cuadro se le habían agregado paulatinamente acufenos, hipoacusia y dolores posprandiales tipo cólico.
Se le realizó en la primera consulta la biopsia de piel en una lesión periumbilical, la que confirmó el diagnóstico de angioqueratoma.
Luego se procedió al dosaje de la enzima alfa galactosidasa A en sangre en papel de filtro y en leucocitos para arribar al diagnóstico de certeza de enfermedad; en ambos los registros demostraron una clara disminución de la actividad de la enzima, con valores indetectables en papel de filtro y de 22,64 nmoles/mg.h en leucocitos en sangre periférica (valor normal de 395,11 nmoles/mg.h como límite inferior). A este paciente, por ser el primer varón diagnosticado, se lo consideró como el caso índice de la evaluación genética familiar; se le realizó la determinación de la mutación en el gen de alfa-galactosidasa A en sangre, el que informó homocigota para la mutación c.680G > A del exón 5 del gen GLA de enfermedad de Fabry. Dicha mutación ocasiona un cambio del aminoácido arginina de la posición 227 por glutamina (p.arg227gln).
Para evaluar el grado de afectación sistémica de la enfermedad, se le realizaron las mismas pruebas que al paciente anterior: análisis de sangre y orina, radiografía de tórax, electrocardiograma, ecocardiograma doppler, ecografía renal bilateral, oftalmoscopía con fondo de ojo, estudio de umbrales sensitivos (QST) y angioresonancia de cerebro. Los estudios evidenciaron hemograma normal, aumento de la microalbuminuria de 24 hs (349ug/ml), leve aumento de la TSH con T3 y T4 normal. La radiografía de tórax y el ECG fueron normales. Lo mismo ocurrió con el ecocardiograma doppler y la ecografía renal. En la oftalmoscopía se evidenció cornea verticillata y en el estudio de umbrales sensitivos, alteración de fibras A delta y C (fibras finas) en manos y A delta (fibras finas) en el pie.
El paciente también comenzó tratamiento con terapia de reemplazo enzimático. De hecho, por tener una deficiencia mucho mayor de la actividad enzimática en cuestión, se comenzó antes con él que con su hermana. Actualmente lleva doce infusiones con Replagal (agalsidasa alfa 0,2mg/kg) endovenoso por infusión cada quince días y se realiza tratamiento de soporte con pregabalina 300mg/día para las acroparestesias y enalapril 5 mg/día vía oral para protección de la función renal. Está siendo manejado en forma multidisciplinaria por una dermatóloga, cardiólogo, nefrólogo y neurólogo y ha mejorado francamente su sintomatología desde entonces.
La tercera paciente consultó en el mes de Octubre de 2010. Corresponde a una mujer de 52 años, madre de los pacientes anteriores. Con antecedentes de hipertensión esencial de larga data, dislipemia, obesidad, tabaquismo de diez cigarrillos por día, depresión y dos partos, refería haber comenzado en la infancia con dolor quemante en manos y piernas, los que fueron mejorando con el correr de los años. Presentaba un leve disconfort ante cambios bruscos de temperatura, además de hipohidrosis e intolerancia al calor. Sus síntomas más discapacitantes eran la hipoacusia, los acufenos y episodios esporádicos de vértigo. No presentaba angioqueratomas en el examen físico de la piel. Al momento de la consulta estaba medicada con atenolol 50 mg/día, enalapril 10mg/día y una aspirineta diaria. Dentro de los antecedentes familiares de relevancia refirió que su madre, fallecida a los 62 años por un accidente cerebrovascular, manifestaba síntomas similares a los que presentan ella y sus hijos.
Como en los casos anteriores se dosó la enzima alfa galactosidasa A en sangre en papel de filtro, donde el valor hallado fue de 0,89 umoles/l.h, francamente disminuido. Para confirmar la enfermedad se determinó la mutación en el gen de alfa galactosidasa A, la que informó paciente heterocigota para c.680G > A del gen GLA de la enfermedad de Fabry.
Los exámenes complementarios que se le solicitaron para evaluar el compromiso sistémico fueron: análisis de sangre y orina, radiografía de tórax, electrocardiograma, ecocardiograma doppler, oftalmoscopía con fondo de ojo, potencial evocado auditivo de tronco y miogénico vestibular, estudio de umbrales sensitivos (QST) y angioresonancia de cerebro.
Los estudios evidenciaron en el hemograma normal, con un leve aumento de la microalbuminuria de 24hs (23microg/min). En el estudio de umbrales sensitivos se puso de manifiesto una alteración de las fibras A delta (fibras finas) en el pie y en la mano y C en mano derecha; además evidenció síndrome del túnel carpiano bilateral y compromiso axonal de las fibras sensitivas de ambos nervios cubitales. El potencial evocado miogénico vestibular fue normal, hallándose en el potencial evocado auditivo de tronco compromiso de la vía auditiva bilateral, a expensas del componente periférico. La angioresonancia de cerebro demostró leve disminución del calibre de las arterias cerebrales medias. El ecocardiograma doppler informó trivial insuficiencia mitral y tricuspidea con leve alteración de la función diastólica y leve hipertrofia concéntrica del ventrículo izquierdo. El examen con lámpara de hendidura mostró la presencia de córnea verticillata. En el resto de los estudios no se evidenciaron alteraciones.
Actualmente la paciente se encuentra en plan de tratamiento con terapia de reemplazo enzimático y continúa con su medicación habitual a la que se le agregó atorvastatina 20mg/día. Como el resto de los pacientes, es manejada en forma multidisciplinaria por un equipo de médicos de diferentes especialidades, con orientación a las enfermedades lisosomales. Este caso constituye un Fabry sin angioqueratomas.
Varón de 48 años de Rosario, con antecedentes personales de dolor precordial atípico crónico, múltiples internaciones por fibrilación auricular de alta respuesta ventricular (la última en Abril de 2011), EPOC, depresión, y tabaquismo severo de veinte cigarrillos por día (suspendido en 2008). En el mes de Noviembre de 2010 acudió a la consulta, por presentar síntomas similares a los de su hermana, la paciente del Caso 3. Sus síntomas eran severos y de gran intensidad y habían comenzado en su juventud. Incluían dolores quemantes en manos y pies que se exacerbaban con las altas temperaturas, intolerancia al calor, hipohidrosis, episodios repetidos de hipertermia y dolor abdominal tipo cólico postprandial. También presentaba lesiones compatibles con angioqueratomas en región del abdomen, sobre todo de localización periumbilical. Además refirió haber comenzado en la segunda década de la vida con acufenos, disminución de la audición y fotopsias. El último síntoma en instalarse fue orina espumosa de un año de evolución.
Por la sintomatología que presentaba había consultado en múltiples ocasiones a diferentes especialistas, sin encontrar solución a sus síntomas.
Al momento de la consulta estaba medicado con salbutamol en aerosol tres veces al día, una aspirineta diaria, lorazepan 0,5 mg/día y amiodarona, la que había suspendido sin indicación médica hacía algunos meses.
Como antecedentes familiares de relevancia presentaba la hermana y dos sobrinos con enfermedad de Fabry de reciente diagnóstico y madre fallecida a los 62 años por un accidente cerebrovascular, con síntomas similares a los que ellos presentaban.
En su primera consulta se le realizó la biopsia de piel de una de las lesiones de localización periumbilical, confirmándose el diagnóstico de angioqueratoma.
Se procedió a dosar de la enzima alfa galactosidasa A en sangre en papel de filtro y en leucocitos; ambos registros demostraron una clara disminución de la actividad enzimática con valores indetectables en sangre en papel de filtro y de 29,73 nmoles/mg.h en leucocitos en sangre periférica. Se realizó la determinación de la mutación en el gen de alfa-galactosidasa A en sangre, la que informó homocigota para la mutación c.680G>A del exón 5 del gen GLA de enfermedad de Fabry.
Una vez confirmado el diagnóstico, para evaluar el grado de afectación sistémica de la enfermedad, se le realizaron análisis de sangre y orina, radiografía de tórax, electrocardiograma, ecografía reno-vesico-prostatica, ecocardiograma doppler, oftalmoscopía con fondo de ojo, potencial evocado auditivo de tronco y miogénico vestibular, estudio de umbrales sensitivos (QST) y angioresonancia de cerebro.
Los estudios evidenciaron en el hemograma una leve anemia con valores de HB 12.5 g/dl y Hcto 39%, alteración en la función renal con uremia 53mg/dl y creatinemia 2,23 mg/dl, proteinuria de 24hs 2,54 g/24hs, ECG ritmo sinusal PR corto, bloqueo de rama derecha y onda T negativa en cara inferior. En el estudio de umbrales sensitivos se demostró una alteración de las fibras A delta (fibras finas) en el pie y en la mano. En el potencial evocado miogénico vestibular se halló moderado compromiso de la vía inferior del lado izquierdo, siendo el potencial evocado auditivo de tronco encefálico normal. El ecocardiograma informó dilatación moderada de aurícula izquierda, hipertrofia concéntrica de ventrículo izquierdo severa, leve insuficiencia mitral y leve hipertrofia de pared libre de ventrículo derecho. Por último, la ecografía renovesicoprostática evidenció el riñón derecho de forma y tamaño normal con dos colecciones líquidas de 10 mm de diámetro a nivel del parénquima, el riñón izquierdo de forma y tamaño normal, con aumento en el parénquima renal tanto del espesor como de la ecogenicidad y una colección líquida de 7 mm de diámetro con ectasia piélica. La vejiga presentaba en pared lateral izquierda una imagen compatible con ureterocele. La resonancia magnética de cerebro y el examen oftalmológico fueron normales.
Debido a la sintomatología y al compromiso de órganos vitales se le indicó en forma inmediata el tratamiento de soporte con atenolol 50mg diario, enalapril 10mg/día, atorvastatina 20mg/día, aspirina 325mg diarios, carbamacepina y tramadol. Luego de cuatro meses se instituyó la TRE por donación a cargo del laboratorio Shire, hasta que el paciente concretara el trámite para obtener cobertura social. Hasta el momento el paciente recibió seis infusiones con Replagal (agalsidasa alfa) 0,2mg/kg dosis endovenosa cada quince días.
Caso Nº 5:
Corresponde a una joven de 22 años de edad, hija del paciente anterior y prima del caso índice, sin antecedentes personales de relevancia. Al interrogatorio dirigido la paciente se encontraba totalmente asintomática y al examen físico dermatológico no presentaba lesiones patológicas.
Se procedió al dosaje de la enzima alfa galactosidasa A en sangre en papel de filtro, que evidenció una actividad enzimática reducida (0,64 umoles/l.h) y se confirmó el diagnóstico constatándose la mutación genética familiar en cuestión.
En la actualidad se encuentra en plan de evaluación para determinar el grado de afectación sistémica y eventualmente comenzar el tratamiento con reemplazo enzimático.
Se trata de la hermana menor de la paciente anterior, de 4 años de edad, prima del caso índice. Al momento de la consulta se encontraba asintomática y con examen físico completamente normal. La determinación de la actividad enzimática y la mutación genética están siendo evaluadas en laboratorio. Aunque aún no existe una confirmación formal bioquímica o genética de la enfermedad, se la considera positiva por ser hija mujer de un varón confirmado; esto es por la transmisión hereditaria ligada a X, que transforma en positivas a todas las hijas mujeres de padres enfermos.
Mujer de 61 años también de Rosario, prima hermana de la abuela del caso índice (nieta de la tatarabuela del caso índice, Gráfico II). Al momento de la consulta también estaba asintomática y con examen físico normal. Se le realizó la determinación genética de la enfermedad siendo heterocigota para la mutación familiar en cuestión. La paciente se negó a realizarse estudios clínicos para evaluar la afectación sistémica de la enfermedad y se encuentra sin ningún tipo de tratamiento.
Caso Nº 8:
Paciente de 40 años, también rosarina, sobrina de la paciente anterior (bisnieta de la tatarabuela del caso índice). Refiere un antecedente de relevancia: su padre murió a los 64 años por un IAM luego de haber padecido por décadas síntomas de enfermedad de Fabry, aunque nunca tuvo diagnóstico. Al momento de la evaluación también se encontraba asintomática con examen físico normal; actualmente se le están realizando estudios para la evaluación de daño sistémico, luego de determinarse positiva la mutación genética familiar.
Otros casos:
Además de estos ocho pacientes, se realizó la investigación enzimática y genética de toda la familia, incluyendo los familiares vivos de las cinco generaciones en cuestión, siendo negativos todos los casos restantes. Quedan pendientes de evaluación solamente tres pacientes, que corresponden a los hijos de la paciente del Caso número 7, un varón y una mujer de 30 y 31 años respectivamente y su nieta.
Tabla II. Resultados clínicos en los casos positivos para Fabry

(Angioquer: Angioqueratomas; Lab: Laboratorio; QST: Estudio de umbrales sensitivos; Pot. Evoc.: Potenciales evocados cocleovestibulares; Microalb.: Microalbuminuria; BRD: Bloqueo de rama derecha; IVM: Insuficiencia válvula mitral; HCVI: Hipertrofia concéntrica de ventrículo izquierdo; P: Pendiente de evaluación).
COMENTARIO
Epidemiología:
La incidencia de la enfermedad de Fabry es de alrededor de 1 en 100.000 nacidos vivos, de acuerdo a la mayoría de los autores. Sin embargo, todos coinciden que esta cifra tiende a subestimar el número real de casos, dada la existencia de casos leves no diagnosticados, de casos tratados por profesionales que desconocen la enfermedad y de casos diagnosticados de forma tardía.
Afecta principalmente a la raza blanca, aunque existen descripciones de la enfermedad en todas las etnias con distribución universal.
Etiopatogenia:
La enfermedad de Fabry constituye una enfermedad metabólica, causada por el déficit parcial o completo de la enzima alfa-galactosidasa A. Como consecuencia de la actividad disminuida de esta enzima, se produce una acumulación progresiva de glicoesfingolípidos en lisosomas de distintos tejidos, provocando el mal funcionamiento y posteriormente la muerte celular11, siendo los sitios más afectados el endotelio vascular renal, miocitos cardíacos, células ganglionares del sistema nervioso autónomo y músculo liso microvascular.
Dado que se trata de una enfermedad hereditaria con transmisión ligada al cromosoma X 12, se manifiesta en forma completa en los hijos varones de madres afectadas, mal llamadas portadoras; sin embargo ha sido plenamente demostrado que éstas pueden mostrar grados variables de expresión de la enfermedad, de acuerdo con la magnitud relativa del déficit de actividad enzimática de alfa-galactosidada A 6.
El gen de Fabry corresponde al gen GAL de la alfa-galactosidasa, ubicado en la región Xq22.1. Existen más de 300 mutaciones demostradas para este gen, siendo la mayoría mutaciones familiares "privadas", es decir, restringidas a cada familia afectada.
Manifestaciones Clínicas:
Afectación cutánea: los angioqueratomas constituyen una marca distintiva del Fabry 13,14, si bien no son patognomónicos15,16,17. Están presentes en la mayoría de los pacientes y se ubican típicamente en la parte inferior del tronco y región genital ("en traje de baño"), palmas y alrededor de la boca18. Al microscopio los angioqueratomas se caracterizan por una delgada capa de epidermis, que cubre una dermis con vasos sanguíneos dilatados (Fig 1). Puede observarse hiperqueratosis cuando la lesión tiene mayor tiempo de evolución. Las células endoteliales, periteliales, glandulares ecrinas y musculares lisas presentan a mayor aumento típicas vacuolas citoplasmáticas cargadas de glucolípidos (Fig 2). A la microscopía electrónica pueden verse los cuerpos de inclusión concéntricos o laminares, correspondientes a los depósitos moleculares no metabolizables.

Fig 1
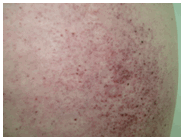
Fig 2
Figs 1 y 2: angioqueratomas en la paciente del Caso 1.
Se describe también, dentro del compromiso cutáneo, cierto dismorfismo facial 19,20 con arcos superciliares prominentes, cejas pobladas, edema peripalpebral y ptosis leve, en especial en varones con sintomatología florida. Sin embargo este dismorfismo no es tan claro, como ocurre en otras enfermedades metabólicas por depósito lisosomal.
Además, los pacientes suelen presentar claras manifestaciones cutáneas relacionadas con la disfunción del sistema nervioso, como la hipohidrosis y las acroparestesias, desarrolladas más abajo en esta sección.

Fig 3: H&E 40X.

Fig 4: H&E 400X.
Figs 3 y 4: microscopía óptica de la biopsia del mismo paciente. Se evidencia una delgada capa de epidermis que cubre una dermis con vasos sanguíneos dilatados. A mayor aumento puede observarse una vacuola lipídica en el endotelio capilar (Figuras histopatológicas gentileza de la Dra. Graciela F. Sánchez).
Afectación Neurológica y Cerebrovascular:
El dolor neuropático de distribución acral corresponde al síntoma más prevalente de la EF, afectando a más del 80% de los pacientes21,22. Aparece en la adolescencia y típicamente se manifiesta con mayor intensidad frente a los cambios de temperatura23. Ocurre por afectación de las fibras nerviosas intradérmicas7,24 y con el tiempo suele tender a la remisión, al menos parcial, por destrucción completa de la inervación epidérmica25.
La hipohidrosis e intolerancia al ejercicio, constituyen otros síntomas típicos relacionados con el depósito de lípidos en capilares cutáneos, sistema nervioso autónomo26 y las glándulas sudoríparas.
Los accidentes isquémicos transitorios (AIT) y los accidentes cerebrovasculares son frecuentes en pacientes con EF y se han reportado incluso en niños21. Más de la mitad de los varones y un tercio de las mujeres presentan su primer episodio cerebrovascular, antes de tener el diagnóstico de EF 27
Afectación Renal:
La afectación de la función renal ocurre en más del 50% de los pacientes con EF, siendo la proteinuria el hallazgo más común. Si bien la proteinuria franca se evidencia en pacientes mayores de 30 años, es común observar microalbuminuria en niños y adolescentes28. En la actualidad, la insuficiencia renal progresiva en pacientes con Fabry ha cedido su puesto como principal causa de morbi-mortalidad frente a las manifestaciones cardiovasculares, probablemente por el mejor entendimiento y manejo de la afectación renal en estos pacientes.
Afectación Cardíaca:
Todos los tejidos del corazón se encuentran afectados en la EF, incluyendo miocardio, sistema de conducción y válvulas 29. Es común la presencia de angor e infarto de miocardio, especialmente relacionados a la afectación microvascular coronaria 30. También son frecuentes las arritmias, siendo la fibrilación auricular y la taquicardia ventricular intermitente, las formas más comunes de presentación. También es común la hipertrofia ventricular izquierda y la dilatación de la raíz de la aorta.
Afectación Gastrointestinal:
Alrededor de la mitad de los pacientes refieren síntomas gastrointestinales 31, incluyendo dolor postprandial crónico y diarrea como los más comunes. Los síntomas aparecen en la adolescencia y persisten toda la vida 32.
Afectación Ocular y Auditiva:
La córnea "verticillata" es patognomónica de EF y ocurre en más del 70% de los pacientes. Otras alteraciones oculares observadas a veces son tortuosidad capilar retiniana y cataratas. La tortuosidad capilar diagnosticada en la infancia pronostica un fenotipo de afectación severo 33.
La pérdida progresiva de la audición de tipo sensoneural, corresponde a una manifestación común del Fabry, lo mismo que los acufenos 34.
Afectación de la Calidad de Vida y Depresión:35
La depresión es frecuente y en general subvalorada en pacientes con EF y puede llegar a ser grave 36. Se desconoce si es una manifestación primaria de la enfermedad o se relaciona con la clara disminución de la calidad de vida que experimentan los pacientes, que puede ser comparable a la que reportan pacientes con esclerosis múltiple, artritis reumatoidea o SIDA 37.
Diagnóstico:
El diagnóstico de la enfermedad de Fabry, se realiza demostrando la deficiencia de la actividad de la alfa galactosidasa A en sangre desecada sobre papel de filtro y en leucocitos 14. El estudio sobre papel de filtro es relativamente sencillo y se utiliza como método de "screening" en casos sospechados. En mujeres sin embargo, dado que la actividad enzimática puede ser normal o casi normal, se requiere una prueba confirmatoria extra, que es la demostración de la mutación en la región q22 del cromosoma X por técnicas de ingeniería genética 38,39.
Si bien el diagnóstico puede llevarse a cabo de forma prenatal a través de la biopsia de las vellosidades coriónicas de la placenta, en general se realiza de forma muy tardía 40, con una latencia estimada de quince años entre el comienzo de los síntomas y el diagnóstico de certeza 8. Esto ocurre por la variabilidad y la multiplicidad de síntomas y signos y por el bajo índice de sospecha de los profesionales que reciben las consultas de estos pacientes, que conducen a falta de diagnóstico y a errores en el diagnóstico.
Los síntomas cutáneos y neurocutáneos son de aparición temprana y en general motivan la consulta más o menos rápidamente, de ahí la importancia del dermatólogo en la pesquisa y el diagnóstico precoz de la enfermedad.
Tratamiento:
El tratamiento de la EF puede dividirse en dos: el tratamiento de soporte (TS), que incluye medidas destinadas a paliar los síntomas y suplir las funciones deterioradas de los sistemas afectados por la enfermedad y el tratamiento de reemplazo enzimático (TRE), que permite restablecer el correcto funcionamiento metabólico tisular evitando el deterioro progresivo, que en algunos casos hace involucionar el daño ocasionado por la acumulación de glicoesfingolípidos (Gb3).
En ambos casos, es de vital importancia la participación de un equipo multidisciplinario altamente capacitado 41 que abarque las áreas de nefrología, neurología, cardiología, dermatología, genética y enfermería profesional.
Tratamiento de Sostén o de "Soporte" (TS):
Los angioqueratomas pueden tratarse con crioterapia, electrocoagulación o resección quirúrgica; sin embargo el tratamiento de elección es el tratamiento con láser (neodimio:YAG, colorante laser, KTP 532nm, cobre, argón, candela v) 42. En algunas ocasiones los angioqueratomas pueden sufrir trombosis y desaparecer solos43,44.
Los dolores acrales y la intolerancia al calor pueden aliviarse con fenitoina, carbamacepina, gabapentina o actualmente con pregabalina. Es de suma importancia la identificación y supresión de los estímulos desencadenantes de cada paciente en particular, modificando los hábitos de vida. Los antiinflamatorios no esteroideos (AINES) están contraindicados por su ineficacia y su potencial daño adicional a la función renal. Deben evitarse los narcóticos por los problemas potenciales de dependencia 45.
Dado que el deterioro renal es crucial en el deterioro progresivo que provoca la enfermedad, el control de la presión intraglomerular a través de una dieta hipoproteica y el uso de inhibidores de la enzima convertidora de angiotensina está indicado siempre 46 y tiende a disminuir y retrasar la magnitud de la microalbuminuria 47. En casos de insuficiencia renal crónica, el tratamiento consiste en hemodiálisis o trasplante renal.
Para los síntomas digestivos pueden ser útiles las drogas proquinéticas, como la metoclopramida o el cisapride.
Desde el punto de vista cardiovascular, el mantenimiento de una presión normal es clave para evitar el daño adicional al miocardio y al nefrón. También es importante el monitoreo y tratamiento de las arritmias que puedan surgir y la adopción de un estilo de vida saludable, manteniendo un peso adecuado y realizando actividad física habitualmente.
En algunos casos puede ser necesaria la utilización de antiagregantes plaquetarios, como clopidrogrel para la prevención de recidiva de ACV o la oclusión de la arteria central de la retina.
Terapia de Reemplazo Enzimático (TRE):
La alfa glucosidasa recombinante se utiliza desde el año 2001 con éxito para el tratamiento de la enfermedad de Fabry. Existen en el mercado dos tipos de enzima recombinante: agalsidasa alfa (Replagal, Shire HGT Inc.) y agalsidasa beta (Fabrazyme, Genzyme Corp.) 48,50.
La agalsidasa alfa se obtiene a partir de líneas celulares humanas y se administra 0,2mg/kg por infusión endovenosa durante 40 min cada quince días; no necesita premedicación. En cambio la agalsidasa beta se produce a partir de células de ovario de hámster chino y la dosis que se infunde es de 1mg/kg durante un periodo de 4 hs cada quince días; en este caso si se requiere premedicación 51,52.
Las enzimas se distribuyen ampliamente por todo el organismo luego de su infusión endovenosa, excepto a nivel del sistema nervioso central, dado que son macromoléculas proteicas incapaces de atravesar la barrera hematoencefálica.
En varios estudios clínicos se demostró que el tratamiento de restitución enzimática, permite reducir la cantidad de glucolipidos almacenados en los tejidos. Disminuye en frecuencia e intensidad los episodios de dolor acral, mejora la calidad de vida, estabiliza la función renal y reduce el exceso de masa cardiaca; mejora también la sintomatología a nivel digestivo y la hipohidrosis 53. El TRE reduce además el depósito de glucoesfingolípidos en la piel.
Hay controversia acerca del momento adecuado para comenzar el tratamiento, en especial en mujeres y en pacientes con enfermedad leve. Los efectos adversos observados hasta el momento se relacionan predominantemente con la infusión (urticaria, prurito, fiebre y escalofríos) y responden a la premedicación con antihistamínicos y a la disminución de la velocidad de infusión.
Una nueva estrategia de tratamiento de esta enfermedad es la terapia enzimática con moléculas de chaperonas, la que puede solo utilizarse en pacientes con una mutación específica. Las chaperonas son pequeñas moléculas que rescatan enzimas mal plegadas o mal transportadas de los lisosomas y los transportan hacia el retículo endoplasmático. El principal beneficio de esta terapia es que puede administrarse por vía oral y que atraviesa la barrera hematoencefalica 54, 55. En el caso de la enfermedad de Fabry el uso de chaperonas demostró un aumento en la actividad de la alfa galactosidasa A y reducción de los niveles urinarios de glucoesfingolípidos 56.
Asesoramiento Genético:
Toda familia con un miembro afectado con enfermedad de Fabry, debe recibir asesoramiento genético en relación a las posibilidades de transmitir la enfermedad a sus hijos. La enfermedad de Fabry es de transmisión ligada al cromosoma X (Gráfico I), por lo que las pacientes mujeres (XX) tienen un 50% de probabilidad de trasmitir el gen defectuoso a sus hijos de ambos sexos. Los pacientes varones (XY) trasmiten en cambio la enfermedad a todas sus hijas mujeres y no la trasmiten a sus hijos varones 5.

Gráfico I: Transmisión genética ligada al cromosoma X

Grafico II. Árbol genealógico familiar y transmisión del gen mutante de enfermedad de Fabry.
COMENTARIOS
Si bien la enfermedad de Fabry fue descripta hace más de un siglo 1,2, el análisis de los resultados de este trabajo demuestra que aún existen varios puntos de controversia en torno a esta patología.
En primer lugar, varios autores le asignan a la EF el rótulo de enfermedad hereditaria de transmisión autosómica recesiva 58,59. Sin embargo, dentro de la familia presentada existen varias mujeres, obviamente heterocigotas para el cromosoma X (XX), con grados variables de expresión de la enfermedad; se evidenciaron tanto pacientes con cuadros floridos similares al presentado por los varones homocigotas (XY), como casos con formas aparentemente benignas paucisintomáticas. Esto parece demostrar que la expresión del gen GAL mutante es variable y no depende solamente del número de copias del gen en el código genético, sino a una suma de factores posiblemente genéticos y ambientales y desestima el título de "portadoras", que se les asigna habitualmente a las mujeres con Fabry.
Otro punto controversial a tener en cuenta es el referido a la incidencia calculada de la enfermedad, que la mayoría de los autores estiman 1 cada 100000 nacidos vivos. Teniendo en cuenta la existencia de presentaciones poco sintomáticas no diagnosticadas, es probable que esta cifra sea mucho mayor 7,8. Además, existen numerosos casos con sintomatología plena, que a pesar de ello permanecen sin diagnóstico o con diagnósticos erróneos por décadas, lo que suma al número de pacientes "ocultos" en las incidencias estimativas. Esta situación se ve reflejada en varios de los casos presentados (Casos 1, 2, 3, 4), que llevaban años con signos y síntomas francos de EF y con numerosas consultas en su haber. Incluso es dable pensar según las historias clínicas familiares referidas, que algunos parientes ya fallecidos hayan padecido enfermedad de Fabry toda su vida sin saberlo.
Desde hace diez años, se encuentra disponible para uso clínico una terapéutica eficaz para el tratamiento de la enfermedad, capaz de frenar e incluso hacer retroceder los efectos deletéreos de la acumulación de glucoesfingolípidos en el interior celular 54. De este modo, el diagnóstico precoz se ha vuelto una prioridad para la EF. Aquí se pone de manifiesto la importancia del rol del dermatólogo en esta patología, dado que muchas veces las consultas iniciales se refieren a la aparición progresiva de síntomas cutáneos y neurocutáneos. Así, la presencia de angioqueratomas, tanto como la de acroparestesias, hipohidrosis o intolerancia al calor, deben generar la sospecha diagnóstica que finalmente conduzca al diagnóstico definitivo. Llama la atención en este contexto que, en relación a la revisión bibliográfica realizada en este trabajo, se hayan encontrado menos de diez artículos de revisión publicados en Pubmed en los últimos diez años en revistas de dermatología. Probablemente este déficit se refleje más tarde en las dificultades que se evidencian entre los dermatólogos en relación al diagnóstico de la enfermedad.
Ninguna de las manifestaciones de la enfermedad de Fabry, salvo quizás la córnea verticillata, es patognomónica ni constante. Incluso el angioqueratoma, la lesión más característica de la enfermedad, puede aparecer en otras variadas enfermedades tanto como faltar en el Fabry. Entre los casos presentados, se evidenciaron pacientes con angioqueratomas difusos, especialmente los que presentaban cuadros más floridos y pacientes sin rastros de patología cutánea evidente. El índice de sospecha clínica y el conocimiento profundo de la enfermedad es esencial para el diagnóstico certero y oportuno.
El caso presentado número 6 corresponde a una niña asintomática de 4 años. Es probable que, sin tratamiento, esta niña evolucionara como la paciente 1 al llegar a los 30 años y como la paciente 3 al llegar a los 60, que dejara sin saberlo ni planificarlo descendientes con la enfermedad y que finalmente muriera de forma precoz por patología cerebrovascular, renal o cardíaca. El hecho de haber descubierto la enfermedad en esta niña permitirá asignarle oportunamente un tratamiento adecuado, que prevendrá el progresivo deterioro orgánico y de calidad de vida de la paciente, además de brindarle asesoramiento genético en cuanto a su descendencia. Probablemente este sea el caso ideal dentro del espectro de pacientes con Fabry y en ese sentido deberían dirigirse los esfuerzos.
CONCLUSIÓN
La enfermedad de Fabry es una patología multisistémica severa y progresiva, que se manifiesta de forma clínica desde la niñez o la adolescencia. La progresión de la enfermedad depende de la acumulación de productos no metabolizables en el interior celular. Los casos más graves se destacan por la aparición muy temprana de los síntomas neurocutáneos, como acroparestesias, hipohidrosis o intolerancia al calor y al ejercicio, asociándose más tarde a complicaciones renales, cardiovasculares y cerebrovasculares graves, que deterioran la calidad de vida de los pacientes afectados y en general, reducen su expectativa de vida de forma notable.
Si bien se la considera como una enfermedad metabólica rara ("enfermedades huérfanas"), su incidencia está seguramente subestimada dado lo inespecífico de sus síntomas y signos, al igual que el bajo índice de sospecha de los profesionales que se enfrentan con pacientes afectados.
Si bien se ha dicho que corresponde a una patología con herencia autosómica recesiva, está claro que las mujeres heterocigotas pueden presentar grados variables de afectación, incluyendo formas graves.
Cuando se realiza el diagnóstico en un paciente, debería llevarse a cabo una evaluación clínica exhaustiva para determinar el grado de afectación sistémica de la enfermedad, pesquisar a toda la familia en busca de otros casos y brindar asesoramiento genético, dada su clara forma de transmisión hereditaria ligada al cromosoma X.
La terapia de reemplazo enzimático ha cambiado el horizonte de la enfermedad, permitiendo detener e incluso hacer retroceder el daño sistémico, mejorar la calidad de vida y aumentar la expectativa de vida haciéndola comparable con la de la población normal. El diagnóstico temprano crucial para disminuir el impacto de la enfermedad y mejorar las perspectivas del tratamiento.
Probablemente el dermatólogo sea el profesional que tenga más posibilidades de reducir la latencia de más de diez años, que existe hoy entre la aparición de las primeras manifestaciones y el diagnóstico de certeza, por lo que es de gran importancia continuar con la investigación y la divulgación científica de esta patología dentro de la especialidad.
1. Anderson W. A case of "angeio-keratoma". Br J Dermatol 1898; 10:113-117. [ Links ]
2. Fabry J. Ein Beitrag zur Keinntnis der Purpura haemorrhagica nodularis (Purpura papulosa haemorrhagica Hebrae). Arch Dermatol Syph 1898; 43: 187-200. [ Links ]
3. Zarate YA y Hopkin RJ. Fabry's disease. Lancet. 2008; 18: 372 (9647):1427-1435. [ Links ]
4. Clarke JT. Narrative review: Fabry disease. Ann Intern Med 2007; 20: 146 (6): 425-433. [ Links ]
5. Lyon MF. Gene action in the X-chromosome of the mouse (Mus musculus L.). Nature 1961; 22: 190: 372-373. [ Links ]
6. Wang RY, Lelis A, Mirocha J y Wilcox WR. Heterozygous Fabry women are not just carriers, but have a significant burden of disease and impaired quality of life. Genet Med 2007; 9 (1): 34-45. [ Links ]
7. Hauser AC, Lorenz M y Sunder-Plassmann G. The expanding clinical spectrum of Anderson-Fabry disease: a challenge to diagnosis in the novel era of enzyme replacement therapy. J Intern Med 2004; 255 (6): 629-636. [ Links ]
8. Desnick RJ, Brady R, Barranger J, Collins AJ, Germain DP, Goldman M y col. Fabry disease, an under-recognized multisystemic disorder: expert recommendations for diagnosis, management, and enzyme replacement therapy. Ann Intern Med 2003; 18: 138 (4): 338-346. [ Links ]
9. DIEL/LISIN Laboratorio de investigaciones del sistema inmune. Facultad de Ciencias Exactas, Universidad de la Plata, 2011. [ Links ]
10. Mehta A, Beck M, Elliott P, Giugliani R, Linhart A, Sunder-Plassmann G y col. Enzyme replacement therapy with agalsidase alfa in patients with Fabry's disease: an analysis of registry data. Lancet 2009; 12: 374 (9706): 1986-1996. [ Links ]
11. Asfaw B, Ledvinova J, Dobrovolny R, Bakker HD, Desnick RJ, van Diggelen OP y col. Defects in degradation of blood group A and B glycosphingolipids in Schindler and Fabry diseases. J Lipid Res 2002; 43 (7): 1096-1104. [ Links ]
12. Happle R. X-chromosome inactivation: role in skin disease expression. Acta Paediatr Suppl 2006; 95 (451): 16-23. [ Links ]
13. Mohrenschlager M, Henkel V y Ring J. Fabry disease: more than angiokeratomas. Arch Dermatol 2004; 140 (12): 1526-1528. [ Links ]
14. Larralde M, Boggio P, Amartino H y Chamoles N. Fabry disease: a study of 6 hemizygous men and 5 heterozygous women with emphasis on dermatologic manifestations. Arch Dermatol 2004; 140 (12): 1440-1446. [ Links ]
15. Molho-Pessach V, Bargal R, Abramowitz Y, Doviner V, Ingber A, Raas-Rothschild A y col. Angiokeratoma corporis diffusum in human beta-mannosidosis: Report of a new case and a novel mutation. J Am Acad Dermatol 2007; 57 (3): 407-412. [ Links ]
16. Kelly B y Kelly E. Angiokeratoma corporis diffusum in a patient with no recognizable enzyme abnormalities. Arch Dermatol 2006; 142 (5): 615-618. [ Links ]
17. Vargas-Diez E, Chabas A, Coll MJ, Sanchez-Perez J, Garcia-Diez A y Fernández-Herrera JM. Angiokeratoma corporis diffusum in a Spanish patient with aspartylglucosaminuria. Br J Dermatol 2002; 147 (4): 760-764. [ Links ]
18. Mohrenschlager M, Braun-Falco M, Ring J y Abeck D. Fabry disease: recognition and management of cutaneous manifestations. Am J Clin Dermatol 2003; 4 (3):189-196. [ Links ]
19. Wraith JE. Lysosomal disorders. Semin Neonatol 2002; 7 (1): 75-83. [ Links ]
20. MacDermot KD, Holmes A y Miners AH. Anderson-Fabry disease: clinical manifestations and impact of disease in a cohort of 98 hemizygous males. J Med Genet 2001; 38 (11): 750-760. [ Links ]
21. Mehta A, Ricci R, Widmer U, Dehout F, García de Lorenzo A, Kampmann C y col. Fabry disease defined: baseline clinical manifestations of 366 patients in the Fabry Outcome Survey. Eur J Clin Invest 2004; 34 (3): 236-242. [ Links ]
22. Hoffmann B, Beck M, Sunder-Plassmann G, Borsini W, Ricci R y Mehta A. Nature and prevalence of pain in Fabry disease and its response to enzyme replacement therapy--a retrospective analysis from the Fabry Outcome Survey. Clin J Pain 2007; 23 (6): 535-542. [ Links ]
23. Hilz MJ. Evaluation of peripheral and autonomic nerve function in Fabry disease. Acta Paediatr Suppl 2002; 91 (439): 38-42. [ Links ]
24. Al Aboud D, Broshtilova V, Al Aboud K y Al Hawsawi K. Dermatological aspects of cerebrovascular diseases. Acta Dermatovenerol Alp Panonica Adriat 2005; 14 (1): 9-14. [ Links ]
25. Cleeland CS. Pain assessment: the advantages of using pain scales in lysosomal storage diseases. Acta Paediatr Suppl 2002; 91 (439): 43-47. [ Links ]
26. Shelley ED, Shelley WB y Kurczynski TW. Painful fingers, heat intolerance, and telangiectases of the ear: easily ignored childhood signs of Fabry disease. Pediatr Dermatol 1995; 12 (3): 215-219. [ Links ]
27. Sims K, Politei J, Banikazemi M y Lee P. Stroke in Fabry disease frequently occurs before diagnosis and in the absence of other clinical events: natural history data from the Fabry Registry. Stroke 2009; 40 (3): 788-794. [ Links ]
28. Ramaswami U. Fabry disease during childhood: clinical manifestations and treatment with agalsidase alfa. Acta Paediatr Suppl 2008; 97 (457): 38-40. [ Links ]
29. Linhart A, Magage S, Palecek T y Bultas J. Cardiac involvement in Fabry disease. Acta Paediatr Suppl 2002; 91 (439):15-20. [ Links ]
30. Shah JS, Lee P, Hughes D, Thaman R, Sachdev B, Pellerin D y col. The natural history of left ventricular systolic function in Anderson-Fabry disease. Heart 2005; 91 (4): 533-534. [ Links ]
31. Hoffmann B y Keshav S. Gastrointestinal symptoms in Fabry disease: everything is possible, including treatment. Acta Paediatr Suppl 2007; 96 (455): 84-86. [ Links ]
32. Ramaswami U, Whybra C, Parini R, Pintos-Morell G, Mehta A, Sunder-Plassmann G y col. Clinical manifestations of Fabry disease in children: data from the Fabry Outcome Survey. Acta Paediatr 2006; 95 (1): 86-92. [ Links ]
33. Sodi A, Ioannidis AS, Mehta A, Davey C, Beck M y Pitz S. Ocular manifestations of Fabry's disease: data from the Fabry Outcome Survey. Br J Ophthalmol 2007; 91 (2): 210-214. [ Links ]
34. Germain DP, Avan P, Chassaing A y Bonfils P. Patients affected with Fabry disease have an increased incidence of progressive hearing loss and sudden deafness: an investigation of twenty-two hemizygous male patients. BMC Med Genet 2002; 11: 3-10. [ Links ]
35. Gold KF, Pastores GM, Botteman MF, Yeh JM, Sweeney S, Aliski W y col. Quality of life of patients with Fabry disease. Qual Life Res 2002; 11 (4): 317-327. [ Links ]
36. Cole AL, Lee PJ, Hughes DA, Deegan PB, Waldek S y Lachmann RH. Depression in adults with Fabry disease: a common and under-diagnosed problem. J Inherit Metab Dis 2007; 30 (6): 943-951. [ Links ]
37. Miners AH, Holmes A, Sherr L, Jenkinson C y MacDermot KD. Assessment of health-related quality-of-life in males with Anderson Fabry Disease before therapeutic intervention. Qual Life Res 2002; 11 (2): 127-133. [ Links ]
38. Aerts JM, Hollak CE, van Breemen M, Maas M, Groener JE y Boot RG. Identification and use of biomarkers in Gaucher disease and other lysosomal storage diseases. Acta Paediatr Suppl 2005; 94 (447): 43-46; discussion 37-8. [ Links ]
39. Cox TM. Biomarkers in lysosomal storage diseases: a review. Acta Paediatr Suppl 2005; 94 (447): 39-42; discussion 37-8. [ Links ]
40. Desnick RJ y Brady R. Fabry disease in childhood. J Pediatr 2004; 144 (5) :S20-6. [ Links ]
41. Weidemann F, Sommer C, Duning T, Lanzl I, Mohrenschlager M, Naleschinski D y col. Department-related tasks and organ-targeted therapy in Fabry disease: an interdisciplinary challenge. Am J Med 2010; 123 (7): 658 e1- e10. [ Links ]
42. Breathnach SM, Black MM y Wallace HJ. Anderson-Fabry disease. Characteristic ultrastructural features in cutaneous blood vessels in a 1-year-old boy. Br J Dermatol 1980; 103 (1): 81-84. [ Links ]
43. Bang DS, Choi YS y Song MS. Transepidermal elimination of thrombi in three cases of thrombotic angiokeratoma: an incidental histopathologic finding of angiokeratoma. J Dermatol 1991; 18 (10): 605-609. [ Links ]
44. Goldman L, Gibson SH y Richfield DF. Thrombotic angiokeratoma circumscriptum simulating melanoma. Arch Dermatol 1981; 117 (3): 138-139. [ Links ]
45. Ries M, Mengel E, Kutschke G, Kim KS, Birklein F, Krummenauer F y col. Use of gabapentin to reduce chronic neuropathic pain in Fabry disease. J Inherit Metab Dis 2003; 26 (4) :413-414. [ Links ]
46. Flyvbjerg A. Inhibition and reversibility of renal changes: lessons from diabetic kidney disease. Acta Paediatr Suppl 2006; 95 (451): 83-92. [ Links ]
47. Schieppati A y Remuzzi G. Proteinuria and its consequences in renal disease. Acta Paediatr Suppl 2003; 92 (443): 9-13; discussion 5. [ Links ]
48. Martins AM, D'Almeida V, Kyosen SO, Takata ET, Delgado AG, Goncalves AM y col. Guidelines to diagnosis and monitoring of Fabry disease and review of treatment experiences. J Pediatr 2009; 155 (4 Suppl): S19-31. [ Links ]
49. Hughes DA. Early therapeutic intervention in females with Fabry disease? Acta Paediatr Suppl 2008; 97 (457): 41-47. [ Links ]
50. Burrow TA, Hopkin RJ, Leslie ND, Tinkle BTy Grabowski GA. Enzyme reconstitution/replacement therapy for lysosomal storage diseases. Curr Opin Pediatr 2007; 19 (6): 628-635. [ Links ]
51. Beck M. Agalsidase alfa--a preparation for enzyme replacement therapy in Anderson-Fabry disease. Expert Opin Investig Drugs 2002; 11 (6): 851-858. [ Links ]
52. Schiffmann R, Askari H, Timmons M, Robinson C, Benko W, Brady RO y col. Weekly enzyme replacement therapy may slow decline of renal function in patients with Fabry disease who are on long-term biweekly dosing. J Am Soc Nephrol 2007; 18 (5): 1576-1583. [ Links ]
53. Banikazemi M, Bultas J, Waldek S, Wilcox WR, Whitley CB, McDonald M y col. Agalsidase-beta therapy for advanced Fabry disease: a randomized trial. Ann Intern Med 2007; 16:146 (2):77-86. [ Links ]
54. Ishii S, Chang HH, Kawasaki K, Yasuda K, Wu HL, Garman SC y col. Mutant alpha-galactosidase A enzymes identified in Fabry disease patients with residual enzyme activity: biochemical characterization and restoration of normal intracellular processing by 1-deoxygalactonojirimycin. Biochem J 2007; 1: 406 (2): 285-295. [ Links ]
55. Shin SH, Kluepfel-Stahl S, Cooney AM, Kaneski CR, Quirk JM, Schiffmann R y col. Prediction of response of mutated alpha-galactosidase A to a pharmacological chaperone. Pharmacogenet Genomics 2008; 18 (9): 773-780. [ Links ]
56. Germain DP y Fan JQ. Pharmacological chaperone therapy by active-site-specific chaperones in Fabry disease: in vitro and preclinical studies. Int J Clin Pharmacol Ther 2009; 47 Suppl 1: S111-117. [ Links ]
57. Hughes DA y Mehta AB. Vascular complications of Fabry disease: enzyme replacement and other therapies. Acta Paediatr Suppl 2005; 94 (447): 28-33; discussion 9-10. [ Links ]
58. Whybra C, Kampmann C, Willers I, Davies J, Winchester B, Kriegsmann J y col. Anderson-Fabry disease: clinical manifestations of disease in female heterozygotes. J Inherit Metab Dis 2001; 24 (7): 715-724. [ Links ]
59. Whybra C, Wendrich K, Ries M, Gal A y Beck M. Clinical manifestation in female Fabry disease patients. Contrib Nephrol 2001; 136: 245-250. [ Links ]














