Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista argentina de endocrinología y metabolismo
versión On-line ISSN 1851-3034
Rev. argent. endocrinol. metab. vol.50 no.2 Ciudad Autónoma de Buenos Aires abr./jul. 2013
CABE-FASEN
Tratamiento del hipertiroidismo por Enfermedad de Graves en pacientes adultos no embarazadas
Coordinadora:
Alicia Gauna
Expertos:
Ana Fadel A, Silvia Gutiérrez, José L. Novelli, Ana M. Orlandi, Ricardo Parma, María del Carmen Silva Croome
Colaboradores:
Graciela Chebel, Mayra Guardia, Paula Guido, María Gilligan, Miguel Vásquez, Adriana Vázquez
RESUMEN
La tirotoxicosis tiene múltiples etiologías y manifestaciones clínicas, así como distintas opciones terapéuticas. El apropiado tratamiento dependerá de un diagnóstico certero y también de la preferencia y características clínicas de cada paciente individual. En este artículo se describe una guía clínica basada en la evidencia para el tratamiento del hipertiroidismo por Enfermedad de Graves, dirigida a médicos generalistas, clínicos, endocrinólogos y otros especialistas que traten a pacientes con Enfermedad de Graves.
Métodos: El desarrollo de la guía se llevó a cabo por expertos médicos endocrinólogos miembros de la Sociedades filiales de la Federación Argentina de Endocrinología y Metabolismo. El grupo de trabajo conformado examinó la literatura utilizando una búsqueda sistemática en Pubmed y Cochrane. La evidencia recolectada junto con la experiencia y conocimiento de los expertos fue utilizada para el desarrollo de cinco tópicos principales con sus respectivas recomendaciones. La fuerza de las recomendaciones y la calidad de la evidencia que respalda a cada una de ellas fueron clasificadas en forma sistemática por el grupo de expertos y se detalla en el texto.
Resultados: Los cinco tópicos principales desarrollados en esta guía para la Enfermedad de Graves incluyen el tratamiento con drogas antitiroideas y sus efectos adversos, el tratamiento con Iodo 131 y el tratamiento quirúrgico, así como el tratamiento adyuvante con b-bloqueantes, compuestos iodados, corticoides, litio y perclorato.
Conclusiones: Se desarrollaron en total 47 recomendaciones basadas en la evidencia para el tratamiento de los pacientes con Enfermedad de Graves hipertiroideos.
ÍNDICE
A. Método de desarrollo de la guía
B. Clasificación de las recomendaciones
II. TRATAMIENTO CON DROGAS ANTITIROIDEAS
III. EFECTOS ADVERSOS DE DROGAS ANTITIROIDEAS
A. Monitoreo de efectos adversos mayores
B. Monitoreo de efectos adversos menores
A. Preparación del paciente con enfermedad de Graves para recibir Iodo 131
C. Paciente con enfermedad de Graves que busca gesta
E. Oftalmopatía de Graves y Iodo 131
A. Preparación de los pacientes con enfermedad de Graves para la tiroidectomía
C. El procedimiento quirúrgico y la elección del cirujano
F. Manejo de nódulos tiroideos en la enfermedad de Graves
La tirotoxicosis es una condición con múltiples etiologías que cursa con aumento de los niveles circulantes de hormonas tiroideas. El apropiado tratamiento de la tirotoxicosis requiere un diagnóstico etiológico certero. El término hipertiroidismo hace referencia a una forma de tirotoxicosis debido a un aumento en la síntesis y secreción de hormonas tiroideas. La enfermedad de Graves (EG) es la causa más común de hipertiroidismo en menores de 40 años, con predominio femenino y con una prevalencia de aproximadamente 0,1-0,5 % en la población general.
El hipertiroidismo de la EG no tiene un único tratamiento ideal. Existen actualmente distintas opciones terapéuticas con ventajas y desventajas, y a su vez cada una de ellas puede llevarse a cabo con distintas modalidades. Las opciones terapéuticas son el tratamiento médico con drogas antitiroideas (DAT) y el tratamiento radical quirúrgico o con radioyodo (I131).
Es de elección el tratamiento con DAT en pacientes de inicio, con alta probabilidad de remisión (especialmente mujeres, con enfermedad leve, bocios pequeños, y anticuerpos antireceptor de tirotrofina (TRAb) negativos o títulos bajos) y en los pacientes con oftalmopatía de Graves (OG) activa moderada a severa o en aquellos con contraindicación de radioyodo o cirugía. Es contraindicado este tratamiento en aquellos pacientes con antecedente de reacción adversa mayor a antitiroideos.
El tratamiento con radioyodo es de indicación ante la recidiva del hipertiroidismo, en los pacientes que no cumplen el tratamiento médico o tienen contraindicación de antitiroideos. El I131 está contraindicado en embarazo, lactancia y en personas que no puedan cumplir con las normas de seguridad de la radiación.
El tratamiento de elección es quirúrgico ante síntomas compresivos o bocios grandes (= 80 g), indicación de tratamiento radical en pacientes con captación baja de yodo radiactivo, ante sospecha o confirmación de enfermedad maligna tiroidea o si coexiste hiperparatiroidismo que requiere cirugía. Es controvertida la elección de cirugía en pacientes con OG activa moderada a severa y está contraindicada en pacientes con comorbilidades que la inhabiliten.
La selección del tratamiento dependerá de múltiples consideraciones, tanto de las características clínicas de los pacientes como de la experiencia del médico tratante. En esta guía se plantearon interrogantes sobre distintas cuestiones de interés para cada tratamiento. Cabe aclarar que no es la intención de la guía reemplazar el juicio clínico y la toma de decisiones personales, o los deseos del paciente o la familia.
I.A. Método de desarrollo de la guía basada en la evidencia
La Federación Argentina de Endocrinología y Metabolismo (FASEN) designó un coordinador quien invitó a 6 expertos en el tema para el desarrollo y difusión de la presente guía. Cada experto nombró un colaborador, quienes en algunas situaciones fueron también expertos en el tema. El grupo de trabajo pactó reuniones periódicas en la sede de la Sociedad Argentina de Endocrinología y Metabolismo (SAEM) desde marzo de 2011 hasta septiembre de 2012 para discutir el desarrollo de la guía. Se plantearon cinco tópicos principales y luego se enumeraron preguntas a responder para cada uno de ellos. Se realizó una búsqueda sistemática en Pubmed y Cochrane. Se desarrollaron las recomendaciones basadas en la literatura y en la opinión de los expertos.
I.B. Clasificación de las recomendaciones
Esta guía se desarrolló para combinar y clasificar las referencias bibliográficas con la experiencia de los expertos. El grupo de trabajo optó para clasificar a las recomendaciones según el sistema desarrollado por The Grading of Recommendations, Assessment, Development, and Evaluation Group(1) con modificación en el grado de evidencia según Guyatt G. y colaboradores(2). Para clasificar la calidad de la evidencia se tuvo en cuenta el diseño y la calidad del estudio, la consistencia de los resultados, y la veracidad de las pruebas. En la tabla siguiente se describen los criterios para la clasificación.
II. TRATAMIENTO CON DROGAS ANTITITROIDEAS
Óptimamente, el tratamiento debe inducir una cura rápida, fácil, efectiva y permanente de la enfermedad, con baja tasa de complicaciones y, de ser posible a bajos costos. La remisión del hipertiroidismo en pacientes bajo tratamiento exclusivo con propranolol, droga carente de efectos antitiroideos e inmunosupresivos, sugirió que esta remisión podía ser espontánea, pero solo en pacientes con formas más leves de la enfermedad. Si bien un 20-30 % de pacientes pueden entrar en remisión, aun sin el tratamiento específico(3), es necesario asegurar el eutiroidismo en el 100 % de los pacientes dado el impacto clínico del mismo.

En la mayoría de los pacientes la intervención apropiada con antitiroideos conduce rápidamente al eutiroidismo, el cual permanece estable bajo medicación y aún por períodos variables de tiempo luego de suspendidos los mismos. No obstante, en ausencia de tratamientos ablativos, la cura permanente solo puede ser alcanzada en una minoría de los casos. Hay quienes consideran "curación" que el paciente no esté más hipertiroideo, incluidos aquellos bajo tratamiento de reemplazo con levotiroxina por hipotiroidismo permanente inducido por el radioyodo o postiroidectomía casi total. No puede dejar de considerarse que esta situación reemplaza una severa enfermedad por otra, si bien con otras implicancias.
- Recomendación 1: Los pacientes con hipertiroidismo por enfermedad de Graves deben ser tratados con alguna de las siguientes modalidades terapéuticas: drogas antitiroideas, I131, o tiroidectomía. 1/+++
Como se analizará más adelante, actualmente las drogas de elección son el carbimazol y su metabolito el metilmercaptoimidazol (MMI) en una equivalencia de dosis de 10 mg a 6 mg respectivamente(4). La droga a emplear dependerá de la preferencia personal y de la accesibilidad a la misma. En nuestro medio el MMI es el único antitiroideo disponible.
- Recomendación 2: El metimazol es el único antitiroideo disponible en Argentina y a su vez es de primera elección en el tratamiento del hipertiroidismo. Por lo cual se debe utilizar en prácticamente todos los pacientes en que se opte por el tratamiento médico. Los pacientes deben ser informados de los efectos secundarios de los fármacos antitiroideos. 1/+++
Décadas atrás se usaban dosis de 40 a 60 mg/d de MMI(5-11). Dosis más elevadas tienen la ventaja de arribar más rápidamente al eutiroidismo, pero recientemente(12-18) se describieron mayor número de complicaciones en relación directa con las mayores dosis empleadas.
Si bien las Guías de la American Thyroid Association (ATA) y la American Association of Clinical Endocrinologists (AACE)(19) recientemente publicadas sugieren una dosis inicial de 10-20 mg/d, la experiencia clínica demuestra que las mismas son insuficientes para cierto grupo de pacientes. En aquellos severamente tóxicos con grandes bocios, oftalmopatía, T3 basal superior a 325 ng/dL(20) o elevada por más de 2,7 veces el límite superior normal y/o pacientes provenientes de áreas iodo suficientes(21-22), el tiempo requerido para alcanzar el eutiroidismo con estas dosis puede ser exagerado. Asimismo, portadores de patologías asociadas capaces de agravarse con la prolongación del estado hipertiroideo también podrían beneficiarse con mayores dosis iniciales. Recientemente se ha publicado un metanálisis(23) que halló un incremento del 20 % de la mortalidad en el hipertiroidismo clínico(24).
Dosis iniciales más elevadas tienen la ventaja de arribar más rápidamente al eutiroidismo. Algunos ensayos randomizados controlados (RCT) han evaluado la relación entre el tiempo necesario para normalizar hormonas tiroideas en función de la dosis utilizada. Reinwein, en 1993(25) había comunicado que el 68 % de los pacientes alcanzaban el eutiroidismo con 10 mg/d de MMI en 3 semanas. Es de hacer notar que la mayoría de los centros incorporados pertenecían a países iodo deficientes o moderadamente iodo suficientes y por lo tanto, más sensibles a la acción de los DAT(21). Benker y col. (22) en un estudio multicéntrico europeo hallaron que el 40 % vs. el 65 % de los pacientes alcanzaron el eutiroidismo con 10 y 40 mg/d de MMI en 3 semanas y el 78 vs. 93 % luego de 6 semanas, respectivamente. En un estudio sueco prospectivo randomizado, dosis de inicio de 20 mg/d (10 mg cada 12 hs) no permiten alcanzar el eutiroidismo dentro de las 12 semanas en un 14 % de los pacientes. El propiltiouracilo (PTU) en dosis de 200 mg/d resultó aún menos eficaz. En cambio, 22/23 pacientes evolucionaban al eutiroidismo o hipotiroidismo en igual lapso con 30 mg/d de MMI o 300 de PTU divididos en 3 dosis(26). Similar porcentaje de falta de remisión a igual período de tratamiento (14 %) fue reportado en un trabajo japonés con 15 mg/d(27). Iniciar el tratamiento con metimazol e ioduro de potasio (KI) pareciera acortar el período necesario para alcanzar el eutiroidismo sin inducir resistencia al antitiroideo ni agravar el hipertiroidismo(28).
- Recomendación 3: Dosis iniciales de 20-30 mg de metimazol diarios suelen ser apropiadas. Dosis más elevadas son necesarias en pacientes severamente tóxicos o con patologías asociadas, mientras que pueden resultar exageradas en casos leves, sobre todo si provienen de áreas iodo deficientes. 2/++
II.C. Asociación de hormonas tiroideas al antitiroideo vs. tratamiento único con antitiroideos titulados
A fines de los años 70 aparecieron publicaciones que demostraban "in vitro" efectos inmunomoduladores directos de las tionamidas tanto a nivel de inmunidad humoral como mediada por células(29): Regresión de timo postratamiento(30), descenso de TRAb a lo largo del mismo(31), disminución de linfocitos T helpers y células T activadas intratiroideas(32), reducción de células NK(33-34), de ICAM-1(35), interleuquina-2(36), interleuquina-6 y sus receptores(37), menor expresión de HLA clase II(38), aumento de células T supresoras(32) y apoptosis de linfocitos intratiroideos(39). A raíz de estas evidencias, surge la hipótesis de que los antitiroideos en altas dosis asociados a hormonas tiroideas para evitar hipotiroidismo iatrogénico, podrían mejorar las tasas de remisión en la enfermedad de Graves. Basándose en ésto, algunos investigadores asociaron T3 al tratamiento con altas dosis de MMI con el objetivo de mantener a la T4 sérica por debajo del límite inferior normal (bloqueo) (5) y obtuvieron una tasa de remisión de 75,4 % vs. 41,6 % con MMI solo. Posteriormente, los mismos autores no hallaron diferencias en las tasas de remisión entre altas y bajas dosis de MMI mientras se mantuviera el bloqueo(7).
Por otra parte, no hay trabajos "in vivo" que hayan logrado demostrar el efecto inmunomodulador de las tionamidas. Las concentraciones molares alcanzadas "in vitro" son mayores a las logradas "in vivo" con dosis farmacológicas y algunos autores como Volpé(40-41) consideran que el eutiroidismo per se es el verdadero responsable de regular la respuesta inmune ya que la remisión es independiente del tipo y dosis de droga y el descenso de TRAb sigue al eutiroidismo tanto luego del tratamiento médico como quirúrgico.
En la última década diversas publicaciones sugieren que el tratamiento de la Enfermedad de Graves con antitiroideos en combinación con hormona tiroidea no redunda en mayores beneficios que los observados con regímenes de tratamiento de antitiroideos titulados. Ésto surge de los reportes de similares tasas de remisión a largo plazo con ambos tratamientos y de mayores efectos colaterales en los casos de tratamiento combinado como fue comunicado en un reiteradamente citado metanálisis de P. Abraham publicado en la base de datos Cochrane(42-43). En realidad, dicho metaanálisis compara RCT de tratamiento combinado a ALTAS dosis con regímenes de antitiroideos titulados a BAJAS dosis y aun así el único efecto adverso significativamente más frecuente fue el rash. Asimismo, si se excluyen 2 RCT de tratamiento combinado a muy altas dosis: 60 a 100 mg/d (esta última actualmente en desuso) dicha diferencia deja de ser significativa(44).
No hay RCT con datos comparativos sobre:
- Curso de oftalmopatía
- Calidad de vida
- Costos
- Incidencia de hipotiroidismo intratratamiento
- Variaciones en el peso intratratamiento
En trabajos con menos de dos años de seguimiento la tasa de remisión resultó significativamente mayor en el tratamiento combinado, pero dicha significancia se diluyó en los trabajos con mayor tiempo de seguimiento(12-15,17,42-43). Ésto sugiere la posibilidad que el tratamiento combinado pueda retrasar la aparición de la recurrencia, situación ventajosa en ciertos casos.
Recientemente, Laurberg(45) publicó sus observaciones en 108 pacientes con oftalmopatía moderada a severa en tratamiento combinado mayor a 24 meses (4,5 a 9,5 años) y con seguimiento mayor a 2 años. El 90 % de estos pacientes se mantuvo eutiroideo con consultas anuales y con escasas fluctuaciones de TSH; ninguno empeoró su oftalmopatía. En 22 pacientes que aceptaron suspender el tratamiento luego de 6 años (los restantes no lo hicieron, lo cual habla de una buena adherencia), solo el 10 % recayó a los dos años y no empeoraron la oftalmopatía.
Otro reciente trabajo observacional(46) se realizó en pacientes con severa oftalmopatía bajo tratamiento combinado-dosis fijas de MMI (30 mg) y T4- en forma sostenida hasta la finalización de los tratamientos específicos de la oftalmopatía. En este estudio, se incluyeron 73 pacientes tratados durante 2 a 11 años (X = 3,4 años) con 1-14 años de seguimiento; se obtuvo una tasa de remisión del 63 % y sin agravamiento de la oftalmopatía, aún en los que recibieron radioablación.
Actualmente uno de los objetivos principales del tratamiento combinado apunta quizás a la sustentabilidad del eutiroidismo(45) de manera tal de evitar fluctuaciones en la función tiroidea, reduciendo el número de consultas y determinaciones hormonales. Debería ser tenido en cuenta en aquellas situaciones en que se desea evitar un ascenso de TSH como es el caso de los pacientes que presentan oftalmopatía activa moderada a severa o cuando se opta por un tratamiento prolongado con antitiroideos, ya sea por elección del paciente o por inaccesibilidad al radioyodo o cirugía.
- Recomendación 4: Ante la falta de evidencia a favor de la superioridad de uno u otro esquema terapéutico (titulado o combinado) en relación a la tasa de remisión, queda a criterio del médico tratante emplear aquel con cuyo manejo tenga mayor experiencia. Debe considerarse que en casos de oftalmopatía moderada a severa y en pacientes inestables, el tratamiento combinado puede ofrecer ventajas. 2/+
II.D. Duración del tratamiento
Se considera que un paciente se encuentra en remisión si presenta valores normales de TSH, T4 y T3 por un año luego de discontinuar el tratamiento con drogas antitiroideas. La tasa de remisión varía considerablemente según las áreas geográficas. En EE.UU. aproximadamente un 20-30 % remiten después de 12-18 meses de tratamiento(47). La tasa de remisión reportada en Europa y Japón es más elevada. En un estudio a largo plazo europeo se evidenció una tasa de remisión de 50-60 % después de 5-6 años de tratamiento
El metanálisis de P. Abraham(42-43) sostiene que prolongar la terapia más allá de 12-18 meses no aumenta la tasa de remisión luego de la suspensión del tratamiento(57-58). Sin embargo, recientes publicaciones(48, 59-61), comunicaron mayores tasas de remisión luego de tratamientos prolongados. Un trabajo retrospectivo de un grupo italiano(48) comunicó la evolución de 207 pacientes mayores de 35 años tratados con dosis decrecientes de MMI (dosis iniciales: 15-30 mg/d) que alcanzaron el eutiroidismo bajo 5 mg /día dentro de los 18 meses. Ochenta y seis de 115 pacientes (74,8 %) tratados durante una media de 53,4 meses con 2,5-5 mg/d permanecieron eutiroideos vs. 52 de 92 (56,5 %) que suspendieron el tratamiento de 5 mg/d antes de los 15 meses y recidivaron con una media de 25,4 meses después. En los menores de 35 años prolongar el tratamiento por más de 15 meses empleando las mismas dosis de MMI no redundó en menor tasa de recurrencia.
Las guías de la Asociación Japonesa de Tiroides del año 2006(63) recomiendan suspender el tratamiento antitiroideo luego de un período mínimo de 3-6 meses de eutiroidismo bajo dosis de MMI de 5 mg/día por medio. Konishi y col.(60) trataron de evaluar si mejoraba la tasa de remisión con la prolongación de dicho período y observaron una diferencia estadísticamente significativa entre las tasas de remisión de pacientes tratados por 19 meses o más vs. los que recibieron tratamiento por seis meses o menos.
Por su parte Azizi(59), evaluó comparativamente diversas variables (episodios de disfunción tiroidea, lípidos, densidad mineral ósea y deoxipyridinolina, ecocardiograma y doppler, costos, score de calidad de vida y psicológicos) en pacientes recidivados bajo tratamiento prolongado con dosis de MMI de 2,5-10 mg/d vs. pacientes bajo T4 por hipotiroidismo postdosis terapéutica de I131, durante 10 años. Observó diferencias significativas en el porcentaje de pacientes que sufrieron hipotiroidismo, hipertiroidismo, dislipidemia al final del tratamiento y costos insumidos a favor del grupo mantenido con antitiroideos. Si bien el número de pacientes es de 26 y 25 para el grupo de MMI y T4 respectivamente, el período de observación fue prolongado.
La normalización definitiva de la función tiroidea en ausencia de todo tratamiento es una meta difícil de alcanzar con cualquiera de las tres modalidades terapéuticas disponibles: antitiroideos, radioyodo o cirugía y la morbilidad de estos dos últimos puede igualar o superar a la del tratamiento prolongado con antitiroideos(20,59).
El momento óptimo para la suspensión del tratamiento con antitiroideos es difícil de determinar ya que no existen parámetros precisos predictivos de remisión(18,53-54). La negativización de TRAb al final del tratamiento sería el mejor parámetro de ellos, sin embargo según analizan Feldt-Rasmussen y col. en su metanálisis(62) un 25 % de pacientes TRAb positivos remitieron mientras que el 25 % de aquellos con TRAB negativos, recidivaron, evidenciando la relativamente baja efectividad para ser utilizado aisladamente como predictor de remisión
- Recomendación 5: Si el metimazol es elegido como tratamiento primario de la enfermedad de Graves, el medicamento no debe ser administrado por menos de 6 meses y puede suspenderse en aproximadamente 12-18 meses. Un tratamiento más prolongado puede inducir mayor tasa de remisión. 2/++
- Recomendación 6: Antes de suspender el metimazol, se sugiere la medición de los niveles de TRAb, ya que valores elevados se asocian con mayor riesgo de persistencia de la enfermedad. 2/++
- Recomendación 7: Si un paciente con enfermedad de Graves desarrolla hipertiroidismo después de completar un curso de metimazol, se debe considerar el tratamiento con yodo radiactivo o tiroidectomía. Un segundo curso de tratamiento con metimazol no debe ser descartado en pacientes con bajos requerimientos, pero que no remitieron y prefieren esta modalidad terapéutica o tienen contraindicaciones para el tratamiento radical. 2/++
III. EFECTOS ADVERSOS DE DROGAS ANTITIROIDEAS
Las drogas antitiroideas se asocian con una variedad de efectos adversos, los cuales se dividen en "menores" y "mayores" según la gravedad de las complicaciones y/o del riesgo de vida(63,64).
Los efectos "menores" ocurren en aproximadamente el 5 % de pacientes tratados, con igual frecuencia para todas las tionamidas(63). Ante la aparición de alguno de ellos, los mismos pueden resolverse con la administración de un antialérgico, mientras la terapia puede ser continuada(63-65).
TABLA I. Efectos adversos de las tionamidas (Adaptado de Cooper D) (65)
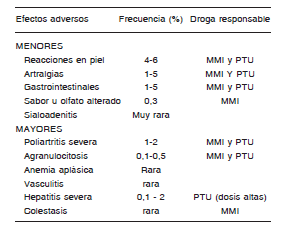
Dentro de los efectos "mayores", la agranulocitosis, es el más temido, siendo su ocurrencia de aproximadamente de 0,35 a 0,5 % en grandes series de pacientes tratados(66-69). La mayoría de los casos de agranulocitosis se presentan en los primeros dos a tres meses de tratamiento antitiroideo(68, 70-71), siendo más frecuente ante dosis mayores del fármaco(68,71) y en pacientes de mayor edad(67). El mayor riesgo de los primeros meses de tratamiento se mantiene con cada nuevo inicio de tratamiento(66).
La hepatotoxicidad es otro de los efectos adversos "mayores", cuya frecuencia estimada se encuentra entre el 0,1 al 0,2 %(63), evento que puede desarrollarse en los tres primeros meses de tratamiento y que cursa con laboratorio demostrativo de injuria hepatocelular(72).
Respecto a la vasculitis (el 3er efecto adverso mayor), se encuentra más relacionado con el PTU que con el MMI(73).
Los efectos adversos de las DAT están subestudiados y la falta de bases de datos sobre estudios prospectivos, randomizados, impide cualquier comparación de estos fármacos(74).
III.A. Monitoreo de efectos adversos mayores
Considerando que no hay consenso sobre la utilidad del monitoreo periódico de glóbulos blancos para predecir el inicio temprano de una reacción adversa a la medicación antitiroidea; una vez iniciado el tratamiento antitiroideo, ¿cuál es la utilidad de realizar hemograma de rutina en las primeras fases del mismo?.
Existen una buena cantidad de trabajos en la literatura que evalúan en forma retrospectiva la aparición de agranulocitosis en pacientes bajo drogas antitiroideas, algunos de ellos con escaso número de pacientes(70,75,76) y otros con grandes poblaciones de más de 5000 enfermos(67,68). No pueden dejar de mencionarse las experiencias de Tajiri y col.(66) y de Watanabe y col.y con más de 30.000 y 50.000 pacientes respectivamente.
En casi todas las series analizadas, la cuenta de blancos se realizó en forma basal y rutinariamente cada 1 a 2 semanas previo al diagnóstico de agranulocitosis(68-71). La mayoría de los autores consideró que la aparición de este fenómeno es rápida y que una leucopenia no necesariamente indica evolución a agranulocitosis. La misma se desarrolló entre 2-20 semanas luego de iniciado el tratamiento. La realización del hemograma basal, así como el control periódico en las primeras fases de la terapia antitiroidea, no sirvió para prevenir o predecir la aparición de este evento(66-68,70,71).
Existe consenso en que un control basal de glóbulos blancos debería realizarse, pero la mayoría de los expertos no recomienda monitoreo de rutina de los granulocitos durante el tratamiento. Los pacientes deberían ser instruídos de suspender la medicación y requerir atención médica urgente si desarrollan fiebre o dolor de garganta, los cuales son los síntomas más frecuentes de posible agranulocitosis(65-67,69-70,77).
- Recomendación 8: Recomendamos efectuar hemograma basal y destacamos la necesidad de realizar hemograma urgente y suspensión inmediata de metimazol ante la aparición de síntomas de agranulocitosis (fiebre y/o dolor de garganta). 1/+++
Si bien la hepatotoxicidad es bien conocida por el uso del PTU, ¿Existe fuerte evidencia de que el MMI no la produzca y podría ser usado ante aparición de este efecto adverso?
La hepatotoxicidad por PTU se puede presentar con una hepatitis leve, con ligera elevación de las transaminasas hasta una necrosis hepática masiva, evidenciable por biopsia y pudiendo requerir un transplante hepático(65). Es identificada como la tercera causa más frecuente de trasplante hepático inducida por fármacos en los Estados Unidos(78). Recientemente la FDA alertó sobre su uso, dado el creciente número de casos de hepatitis fulminante(79).
Los niños en tratamiento con PTU, presentan una tasa de insuficiencia hepática 17 veces superior con respecto a los no expuestos(80).
No hay claros lineamientos respecto al uso del MMI en caso de disfunción hepática. En una revisión de la literatura se registran varios trabajos que reportan la descripción de la aparición de ictericia y prurito con este agente terapéutico(80-86).
En las experiencias de Casallo Blanco S y col.(81), Majeed M y col.(84), Zhang M y col.(85) y Gallelli L y col.(86), todos los pacientes tenían pruebas de función hepática previas al inicio del tratamiento; mientras que en los reportes de Mikhail N(87), Ramos-Bonner LS(83) y Majeed M(84) no se hace mención de este estudio. Los síntomas más frecuentemente mencionados en los trabajos fueron: ictericia, prurito, coluria, acolia, fiebre y debilidad generalizada. Las pruebas de función hepática estaban alteradas (TGO, TGP, FAL, Bilirrubina total y conjugada) en grado diverso según las experiencias. La biopsia hepática, cuando fue realizada mostró signos de colestasis intrahepática. Las alteraciones aparecieron entre 2 a 4 semanas de iniciado el tratamiento y se observó retraso en la normalización de la función hasta 8 semanas de suspendido el antitiroideo(65,81,82).
Si bien es conocida la hepatotoxicidad del PTU, existen varios reportes en la literatura de casos provocados por MMI. El estudio de la función hepática, durante el seguimiento, puede ser útil, pero no se considera necesario hacer un seguimiento de las pruebas de función hepática durante el tratamiento con metimazol en virtud de la baja calidad de la evidencia.
- Recomendación 9: Se debe alertar al paciente sobre la aparición de síntomas tales como fiebre, dolor abdominal, coluria y/o acolia ante los cuales debe consultar al médico tratante. Sugerimos realizar un estudio basal de función hepática, sin necesidad del seguimiento rutinario con hepatograma durante el tratamiento con metimazol. 2/+
Existen escasas referencias de Vasculitis asociada a drogas antitiroideas y es considerado un efecto adverso muy raro. Por otra parte, está mayormente ligado al uso de PTU, como lo demuestra una revisión de Gunton y col.(73) de 1999. En ella, sobre 27 casos presentados, el PTU estuvo implicado en el 82 %. El anticuerpo anticitoplasma de neutrófilos (ANCA) positivo se observó en más del 80 % de los pacientes afectados. El tratamiento debió ser suspendido y el agregado de esteroides y/o ciclofosfamida dependió de la gravedad del cuadro.
Más recientemente se mostró que pacientes tratados con PTU desarrollaron Anticuerpos antimieloperoxidasa (MPO) - ANCA en un 25 % respecto del 3,4 % de los tratados con MMI. En esta serie, si bien hubo una alta prevalencia de ANCA (+), el desarrollo de vasculitis ANCA (+) fue excepcional(88).
- Recomendación 10: La vasculitis y/o la aparición de ANCA + están más relacionadas con el uso de propiltiouracilo, y su aparición bajo tratamiento con metimazol es excepcional. Se recomienda la suspensión del fármaco antitiroideo. 2/+
Con respecto a la artritis, en una revisión de la literatura, Bajaj y col. describieron 21 casos de artritis bajo tionamidas, las cuales se desarrollaron en número equivalente con PTU y/o MMI. Este efecto adverso apareció en los primeros dos meses de tratamiento antitiroideo, en la mayoría de los casos en pacientes bajo altas dosis de DAT y se evidenció una fuerte reacción cruzada(89).
- Recomendación 11: La artritis es un efecto adverso ligado casi indistintamente al uso de propiltiouracilo y/o metimazol. Presenta una fuerte reacción cruzada y es necesaria la suspensión del antitiroideo. 2/+
III.B. MONITOREO EFECTOS ADVERSOS MENORES
Ante la persistencia de efectos adversos menores, ¿existe evidencia que recomiende cambiar de estrategia terapéutica?. La mayoría de los efectos adversos menores se resuelve espontáneamente, con la disminución de la droga o con el agregado de antihistamínicos. Las reacciones cruzadas se reconocen hasta en 50 % de los pacientes, por lo que de persistir las mismas debería pensarse en tratamiento definitivo con I131 o cirugía(65).
Dada la falta de estudios con baja o muy baja calidad de evidencia, se recoge información inconsistente o incompleta proveniente de opiniones de expertos en revisiones sistemáticas
- Recomendación 12: Las reacciones cutáneas leves pueden tratarse con antihistamínicos sin suspender el antitiroideo. Ante la persistencia de los efectos secundarios se sugiere el cese de la medicación y el cambio a yodo radiactivo o cirugía. 2/+
El I131 es utilizado desde hace más de 6 décadas(90), ha demostrado ser clínicamente exitoso, seguro y de bajo costo-beneficio. En 1991, una encuesta efectuada entre los miembros de las Asociaciones de Tiroideólogos de América del Norte, Europa y Japón, demostró que el uso del radioyodo es más popular en América del Norte con un 69 % de especialistas que recomiendan este tratamiento como primera opción en la Enfermedad de Graves típica, mientras que en Europa lo indican el 22 % y solo el 11 % en Japón(91). Es administrado oralmente en dosis única de Ioduro de sodio marcado con I131 en forma líquida o en cápsula.
Existen contraindicaciones absolutas para su utilización: embarazo, lactancia, coexistencia de cáncer tiroideo o sospecha del mismo, pacientes que no puedan cumplir las medidas de seguridad y pacientes con intención de embarazo en los próximos 6-12 meses.
IV.A. Preparación de los pacientes con enfermedad de Graves para el tratamiento con I131
Establecido el diagnóstico de enfermedad de Graves debemos realizar varios pasos indispensables para un adecuado tratamiento:
- Efectuar una captación y centellograma con I131 para poder calcular la actividad a administrar
- En la mujer en edad fértil descartar embarazo (subunidad B-HCG).
- Explicar al paciente qué tratamiento se le va a realizar, ventajas e inconvenientes, posibilidad de evolución de la enfermedad por sí misma al hipotiroidismo o como consecuencia del tratamiento con radioyodo, así como la posibilidad de recidiva del hipertiroidismo
- Indicaciones de aislamiento y de contracepción por el término de 6-12 meses.
- Firma del consentimiento para realizar el tratamiento.
Se han descripto casos de exacerbación del hipertiroidismo luego de la administración de una dosis terapéutica de I131 causados por la disrupción o liberación a la circulación de la hormona tiroidea almacenada en el tirocito. Con la administración de beta bloqueantes se consigue una rápida mejoría de los síntomas y signos derivados de la actividad adrenérgica sin modificar el curso de la enfermedad. Su utilización puede preceder, acompañar y aún mantenerse luego de la administración del I131.
Puede considerarse el uso de MMI antes y/o después del I131 especialmente en pacientes añosos, hipertiroideos severos, y con comorbilidades. Éstos tienen mayor riesgo de complicaciones al exacerbarse el hipertiroidismo luego de la administración de la dosis terapéutica de I131 (fibrilación auricular, fallo cardíaco, hipertensión pulmonar, insuficiencia renal, infecciones, descompensación de diabetes y enfermedades cerebro-vasculares y respiratorias)
- Recomendación 13: Los pacientes con enfermedad de Graves sintomáticos o que están en mayor riesgo de complicaciones ante la exacerbación transitoria del hipertiroidismo, deben ser tratados con bloqueantes beta-adrenérgicos antes de la terapia con radioyodo. 1/+
- Recomendación 14: El pretratamiento con metimazol previo a la terapia con radioyodo para la enfermedad de Graves debe ser considerado en pacientes que están en mayor riesgo de complicaciones (pacientes con hipertiroidismo severo, añosos o con comorbilidades). 1/+
La dosis ideal es aquella dosis de I131, que lleva rápidamente el eutiroidismo, evitando el hipotiroidismo. Sin embargo, en casos de reacciones adversas a los antitiroideos debe llevarse al paciente al hipotiroidismo. Chen y col., sugieren la optimización de la actividad de I131 a administrar con el fin de reducir el hipotiroidismo y alcanzar un incremento en la tasa de eutiroidismo postdosis terapéutica(91).
Existen dos formas de decidir la dosis a administrar: dosis fijas (semicuantitativas) o dosis calculadas según el tamaño glandular, la captación del I131 y la actividad de I131 que se debe administrar por gramo de tejido.
Las dosis fijas están en el rango de 5,10 o 15 mCi (185,370 o 555 MBq) basadas en el tamaño glandular. Utilizando dosis en el rango de 5 a 10 mCi se calcula una dosis absorbida de 50 a 100 Gy aproximadamente(77).
En el método de dosis calculada, por lo general se calcula entregar 80 a 200 uCi/g (3,0 a 7,5 MBq/g) de tejido, corrigiendo por la captación a 24 h.

Un cálculo más exacto es aquél que permite conocer la dosis absorbida (Gy) por el tejido tiroideo. Se utiliza la fórmula de Marinelli-Quimby(93,94). requiriendo conocer la vida media efectiva del I131.
Dosis absorbidas de 200 -300 Gy se requieren en áreas iodo deficientes para controlar el hipertiroidismo en el 80 % de los pacientes y no debe exceder 100 Gy en áreas iodo suficientes. Esta diferencia puede explicarse por el mayor tamaño glandular en las zonas iodo deficientes(95). Los autores concluyen que dosis de 250 Gy son necesarias para lograr hipotiroidismo en áreas medianamente iodo deficientes en pacientes con glándulas hasta 40 ml. Pacientes con mayor tamaño glandular requieren dosis de hasta 300 Gy.
- Recomendación 15: Debe ser administrada suficiente radiación en una dosis única para lograr el eutiroidismo. No sugerimos llevar al hipotiroidismo en forma sistemática a todos los pacientes. 2/+
- Recomendación 16: Se debe obtener una prueba de embarazo 48 horas antes del tratamiento con radioyodo, en toda mujer en edad fértil. El médico nuclear debe obtener esta prueba y comprobar un resultado negativo antes de la administración de yodo radiactivo (Resolución de Autoridad Regulatoria Nacional -Revisión 1 Norma AR 8.2.4 -). 1/++
- Recomendación 17: El médico que administra el radioyodo debe informar por escrito sobre las precauciones de seguridad de radiación después del tratamiento. Si las precauciones no se pueden cumplir, debe considerarse una terapia alternativa.1/+
IV.C. Paciente con enfermedad de Graves que busca gesta
Las dosis terapéuticas de I131 producen efectos biológicos que incluyen la necrosis, inhibición de la replicación celular, atrofia, fibrosis e inducción de una respuesta inflamatoria crónica que pueden resultar en la falla permanente de la función tiroidea. Estos fenómenos pueden inducir cambios en la autoinmunidad tiroidea, con incremento de los niveles TRAb con actividad estimulante o aparición de novo de anticuerpos con actividad bloqueante.
La terapia con radioyodo se recomienda a pacientes jóvenes que buscan gesta con el fin de evitar problemas en un futuro embarazo. Sin embargo, se ha reportado elevación de los niveles de TRAb en forma significativa entre los 3-6 meses luego de la dosis terapéutica con I131, normalizándose entre los 18 y 24 meses en algunos casos o permaneciendo elevados por años en otros. Niveles elevados de TRAb en el embarazo son indicadores sensibles de riesgo de hipertiroidismo neonatal(96). Por lo tanto, estas mujeres deben ser monitoreadas con niveles de TRAb durante el embarazo y seguir cuidadosamente al feto, si aún están presentes.
- Recomendación 18: Sugerimos no indicar en forma sistemática la terapia con radioyodo en aquellas pacientes jóvenes que buscan gesta. Dicho tratamiento no asegura un mejor seguimiento de la unidad materno-fetal. 2/+
IV.D. Seguimiento post iodo I131
- Recomendación 19: El control a los 30 a 60 días después del tratamiento con radioyodo debe incluir una evaluación de T4 total o libre y T3 total. Según el estado funcional del paciente se determinará la periodicidad del control y tratamiento posteriores. 2/+
IV.E. Oftalmopatía de Graves e I131
Tratamientos como medidas locales, corticoterapia, radiación orbitaria y cirugía no aseguran mejorar la calidad de vida de los pacientes con oftalmopatía. Por lo tanto debe evitarse la progresión o desarrollo de la oftalmopatía en pacientes con hipertiroidismo. Deben identificarse factores de riesgo como tabaquismo, valores altos de T3 y TRAb pretratamiento e hipotiroidismo postratamiento.
Debemos considerar el Consenso de EUGOGO sobre el manejo de la oftalmopatía de la Enfermedad de Graves. Los escasos RCT disponibles sobre el efecto de radioablación en la OG muestran que una proporción de pacientes (aproximadamente el 15 %) desarrollan enfermedad de novo o sufren progresión de la preexistente después de la radioablación(97) y aproximadamente el 5 % presentan empeoramiento durante el primer año requiriendo tratamiento adicional. Este riesgo disminuye administrando un curso corto (alrededor de 3 meses) de corticoterapia oral después de la radioablación y evitando el hipotiroidismo posterior. Períodos más cortos de administración (1 a 2 meses) pueden ser igualmente protectores pero no han sido sistemáticamente investigados.
En pacientes con OG activa moderada a severa, la elección del tratamiento es más controvertida. Estos pacientes requieren tratamiento oportuno para la OG. El tratamiento de primera línea, es la administración de glucocorticoides preferentemente endovenosos con o sin radioterapia orbital asociada(98,99).
Aunque no existen trabajos randomizados, un importante argumento en favor del tratamiento con DAT es la pronta corrección de hipertiroidismo.
Los cambios oculares son más severos en pacientes con OG que permanecen con hiper o hipotirodismo persistente que en lo pacientes que logran el eutiroidismo. Por lo tanto, la restauración y mantenimiento del eutiroidismo es fundamental para la oftalmopatía. Además, los pacientes con OG activa moderada a severa requieren el tratamiento de su oftalmopatía(95), al cual debe darse prioridad y aplazarse la resolución definitiva del hipertiroidismo por radioablación o tiroidectomía, hasta la inactivación permanente de OG(100).
Por otra parte, se argumenta que la ablación tiroidea elimina los linfocitos T autoreactivos y antígenos tiroideos (compartidos por la órbita), ayudando a mitigar el proceso orbital(101). Basándose en estos supuestos, una segunda línea de pensamiento sugiere que, después de lograr el eutiroidismo con DAT, en pacientes con OG activa moderada a severa, la tiroides debe ser prontamente ablacionada y la OG debe ser concomitantemente tratada con terapias adecuadas(102). Debemos considerar que la ablación tiroidea total se logra con la tiroidectomía total o casi total seguida del tratamiento con radioyodo, dado que ninguno de estos procedimientos en forma aislada logran la ablación tiroidea total aun en presencia de hipotiroidismo.
- Recomendación 20: Debe lograrse y mantenerse rápidamente el eutiroidismo en los pacientes con oftalmopatía o con riesgo de desarrollarla. 1/+++
- Recomendación 21: Debe aconsejarse a los pacientes fumadores suspender el tabaquismo y conectarlos con centros especializados. Los pacientes fumadores pasivos deben ser identificados e informados sobre el efecto negativo de la exposición al tabaco. 1/++
- Recomendación 22: En pacientes no fumadores sin oftalmopatía clínicamente aparente o en aquellos con oftalmopatía inactiva, el tratamiento con I131 (sin administración de corticoides) o metimazol, o tiroidectomía son opciones terapéuticas igualmente aceptables. 1/++
- Recomendación 23: En los pacientes con hipertiroidismo de Graves que tienen oftalmopatía leve activa y sin factores de riesgo para el deterioro de su enfermedad ocular, el tratamiento con I131, metimazol o la tiroidectomía deben considerarse como opciones terapéuticas igualmente aceptables. 1/++
- Recomendación 24: Los pacientes con hipertiroidismo por Enfermedad de Graves y oftalmopatía activa leve que no tienen otros factores de riesgo para el deterioro de su enfermedad ocular y eligen la terapia con radioyodo, deben ser considerados para el tratamiento concomitante con corticosteroides. 2/++
- Recomendación 25: Los pacientes con enfermedad de Graves y oftalmopatía activa leve que fuman o tienen otros factores de riesgo para oftalmopatía de Graves y eligen tratamiento con radioyodo deben recibir corticosteroides. 1/++
- Recomendación 26: Los pacientes con Enfermedad de Graves y oftalmopatía activa moderada a severa, o con amenaza de su visión deben ser tratados con metimazol excepto contraindicación absoluta y posponer el tratamiento definitivo. 1/+
La tiroidectomía ya no es la elección preferida en la terapia del hipertirodismo por enfermedad de Graves. No obstante puede ser el procedimiento adecuado para pacientes con esta enfermedad que no responden o manifiestan reacciones adversas al tratamiento con drogas antitiroideas, portan grandes bocios, presentan nódulos sospechosos de malignidad, se niegan a recibir terapia con I131 o recidivan al tratamiento médico o con radioyodo, o en algunos casos de oftalmopatía moderada a severa(103-106).
V.A. Preparación de los pacientes con Enfermedad de Graves para la tiroidectomía
Los pacientes con EG deben estar eutiroideos al momento de la tiroidectomía. Estos pacientes son preparados para la cirugía con tionamidas, completándose con la administración de Solución de Lugol (iodoiodurada) entre 1 y 3 días previos a la cirugía(104) (las dosis han sido descriptas en el capítulo II. TRATAMIENTO CON DROGAS ANTITIROIDEAS). El tratamiento preoperatorio con solución de Lugol disminuye la vascularización de la glándula y por lo tanto, la pérdida sanguínea intraoperatoria, mejorando las condiciones quirúrgicas(107,108). En cuanto a las DAT, la duración previa del tratamiento con MMI o PTU tiene directa relación con la reducción del sangrado intraoperatorio(109).
En los pacientes tóxicos que requieren cirugía de urgencia se pueden utilizar ß-bloqueantes, tionamidas, litio y/o glucocorticoides (para la modalidad de su empleo remitirse al apartado VI. TRATAMIENTO ADYUVANTE).
- Recomendación 27: Los pacientes con enfermedad de Graves deben estar eutiroideos para la tiroidectomía. El clínico endocrinólogo es el que debe preparar al paciente para la cirugía. En pacientes con tratamiento previo con metimazol, el yoduro de potasio se debe dar en el período preoperatorio inmediato. 1/++
- Recomendación 28: En caso de necesidad de cirugía de urgencia en pacientes hipertiroideos, en el tratamiento preoperatorio inmediato se pueden utilizar solución saturada de yoduro de potasio, corticoides, beta bloqueantes, litio y tionamidas. 2 /++
Se sugiere iniciar la premedicación anestésica con benzodiacepinas el día anterior a la cirugía. La medicación antitiroidea y los ß-adrenérgicos deben administrarse hasta la mañana de la intervención. Se deben evitar fármacos estimuladores del sistema nervioso simpático (SNS) en la inducción anestésica. Hay que recordar que los pacientes hipertiroideos son hipovolémicos crónicos, por vasodilatación permanente, lo que puede llevar a una respuesta hipotensiva mayor durante la inducción anestésica. Por tal motivo se sugiere administrar soluciones cristaloides previo a la misma (solución fisiológica o Ringer).
Es importante llevarlos al plano anestésico adecuado antes de intentar manipulación para la intubación, ya que la descarga simpática puede empeorar el cuadro. Durante la intubación debe obtenerse una adecuada profundidad anestésica antes de la laringoscopía, para evitar taquicardia, hipertensión y arritmias ventriculares. Cualquiera que sea la técnica utilizada hay que procurar un despertar rápido, tranquilo, sin accesos de tos ni excitación, extubación en quirófano y comprobación de la movilidad de las cuerdas vocales mediante laringoscopía directa. El paciente debe ser trasladado a la unidad de recuperación post-anestésica para su observación.
V.C. El procedimiento quirúrgico y la elección del cirujano
La revisión bibliográfica de los últimos años avala la tiroidectomía total como tratamiento definitivo. El procedimiento de elección es la tiroidectomía total o casi total(110). En los pacientes hipertiroideos aumentan las posibilidades de complicaciones quirúrgicas (lesión del nervio recurrente y de las glándulas paratiroides); por ello, el tratamiento quirúrgico debe ser realizado por un cirujano experimentado. En centros especializados la tasa de complicaciones periquirúrgicas está entre el 1 % y 5 %(111,112).
En las tiroidectomías subtotales, con poco tejido tiroideo hiperfuncionante remanente, las recidivas se tratan con dosis de I131. La reintervención quirúrgica aumenta las complicaciones locales(113).
- Recomendación 29: Si la cirugía es indicada como tratamiento definitivo de la enfermedad, el procedimiento de elección es la tiroidectomía total o casi total. 1/+++
- Recomendación 30: El tratamiento quirúrgico debe ser realizado por un cirujano de tiroides con experiencia. 2/+++
El cuidado posoperatorio debe incluir la evaluación del metabolismo fosfocálcico dosando calcemia y/o PTH sérica, y suplementar calcio y calcitriol en base a estos resultados. No debe suspenderse el beta-bloqueante en forma brusca posterior a la cirugía. Se sugiere reducir la dosis en forma paulatina, de acuerdo a la evolución clínica, hasta la suspensión definitiva. Finalmente se iniciará tratamiento con levotiroxina sódica a dosis sustitutivas (1,6 mg/kg/día) midiendo TSH sérica a las 6-8 semanas de iniciado el tratamiento.
- Recomendación 31: En los cuidados posoperatorios debe asegurarse la normocalcemia y el eutiroidismo. 1/++
- Recomendación 32: En el posoperatorio, el reemplazo con hormona tiroidea debe ser de inicio a dosis plena. 1/+
V.E. Pacientes con oftalmopatía
En los pacientes con oftalmopatía de Graves, la extensión de la cirugía corresponde a una tiroidectomía total o casi total(110, 114-117).
Es indiscutible, como posibilidad terapéutica, la indicación de tiroidectomía total para asegurar el tratamiento del hipertiroidismo en pacientes con oftalmopatía, pero es controvertido que la cirugía tiroidea sea la terapéutica de elección para la oftalmopatía severa.
- Recomendación 33: En pacientes con Oftalmopatía de Graves en quienes se decide tratamiento quirúrgico también se recomienda tiroidectomía total o casi total. 1/++
V.F. Manejo de los nódulos tiroideos en pacientes con enfermedad de Graves
Si bien pueden hallarse nódulos en alrededor del 25 % al 28 % de los pacientes con EG(118), el porcentaje de carcinomas oscila entre el 1 y el 10 % de los casos(119). En términos operativos, todo nódulo en un paciente con EG debe ser evaluado ecográficamente y, ante la sospecha de malignidad, biopsiarlo, siguiendo el protocolo habitual de estudio de cualquier nódulo tiroideo(120).
La citología tiroidea puede resultar confusa por factores externos (cambios citomorfológicos de la EG misma, el tratamiento previo con I131 y más frecuentemente el tratamiento simultáneo con MMI) que en ocasiones provocan cambios citológicos que semejan un carcinoma papilar de tiroides(121). Sin embargo, ajustándose a criterios citológicos muy estrictos y contando con citólogos experimentados, es posible una buena correlación citohistológica.
- Recomendación 34: Está indicada la punción aspirativa con aguja fina ante un nódulo en pacientes con EG. La conducta diagnóstica y terapéutica se adscribe a la utilizada en patología nodular en general. 1/++
Los tratamientos adyuvantes son aquellos tratamientos dirigidos a atenuar el impacto del hipertiroidismo por enfermedad de Graves, por mecanismos diferentes a la disminución de la síntesis de hormonas tiroideas.
Pueden actuar inhibiendo los efectos hiperadrenérgicos, la liberación de hormonas tiroideas, alterando el metabolismo de las hormonas tiroideas (ya sea inhibiendo la conversión periférica de T4 a T3 o incrementando su clearence) y/o disminuyendo la vascularización o a través de mecanismos inmunosupresores. Estas terapias se utilizan asociadas a las DAT, al tratamiento con radioyodo o la cirugía tiroidea, pero tienen un rol principal en los casos en que exista contraindicación del uso de terapias convencionales ya sea por razones de atopía como por la aparición de efectos colaterales severos.
Cobran importancia cuando se requiere rápida estabilización del paciente con hipertiroidismo severo, comorbilidades de base o previo al tratamiento definitivo.
Los pacientes con tirotoxicosis presentan un estado hiperadrenérgico. Se reportó cambio en la afinidad de las catecolaminas por sus receptores, aumento del número de los mismos así como modificaciones de los mecanismos postreceptor(122-124), lo cual explica el aumento de síntomas adrenérgicos aun con niveles de catecolaminas normales(125-126). Por lo tanto el bloqueo de estos receptores es útil en el tratamiento sintomático del hipertiroidismo.
Si bien estos agentes no tienen efectos sobre la producción de hormona tiroidea, el propanolol a muy altas dosis demostró disminuir la conversión periférica de T4 a T3(127).
Dado que no disminuyen la síntesis de hormonas tiroideas, ni la liberación de las mismas, ni la captación de I131, no modifican el curso de la enfermedad sino que permiten un control de los signos y síntomas hasta que se logre el eutiroidismo. Pueden iniciarse previamente, conjuntamente o en el curso de los tratamientos antitiroideos (MMI, radioyodo o cirugía), ya que no interfieren con la acción de los mismos.
Son particularmente importantes en situaciones donde no puedan utilizarse tratamientos convencionales. También cuando a causa del hipertiroidismo exista descompensación cardiovascular (aleteo auricular, fibrilación auricular, insuficiencia cardiaca congestiva). Los ß bloqueantes pueden inducir crisis asmáticas así como descompensación de pacientes con insuficiencia cardíaca. La aparición de ß bloqueantes selectivos ß1 ha hecho su uso más seguro en pacientes asmáticos. En la parálisis periódica hipokalémica del hipertiroidismo se reportó que los ß bloqueantes revierten rápidamente la parálisis sin rebote hiperkalémico(128-132).
- Recomendación 35: El bloqueo ß adrenérgico debe ser considerado en todos los pacientes con tirotoxicosis sintomática confirmada o sospechada. Las dosis sugeridas son: Propanolol 40-80 mg dos a tres veces por día o atenolol 50 a 100 mg/día. 1/++
- Recomendación 36: Debe descartarse insuficiencia cardíaca moderada a severa así como hiperreactividad bronquial previo al uso de betabloqueantes. 1/++
- Recomendación 37: En la parálisis periódica del hipertiroidismo la dosis sugerida para su reversión es propranolol 160-240 mg/día. 2/+
- Recomendación 38: En crisis tirotóxica o hipertiroidismo severo se sugiere utilizar propranolol hasta 200mg 4 veces por día, vía oral o endovenosa (1-3 mg hasta 6mg) a pasar en 3 a 10 min y repetir c/6 hs (bajo monitoreo ECG) o esmolol 50-100mcg/Kg/min endovenoso por bomba de infusión continua. 2/+
En dosis supra fisiológicas el yodo actúa disminuyendo la síntesis de novo y la liberación de hormona preformada (efecto Wolff-Chaikoff)(133), efecto que comienza a las 24 horas de su uso con una duración máxima de 10 días. Por este fenómeno de escape al efecto inhibitorio de los mismos, la duración del tratamiento con yoduros aconsejable es menor a 10 días(134). Es útil en el tratamiento del hipertiroidismo severo asociado a antitiroideos o cuando hay contraindicación para los mismos. En caso de no recibir tratamiento previo con drogas antitiroideas existe el riesgo de empeorar el hipertiroidismo por aumento de sustrato para la síntesis de hormona tiroidea (efecto Jod-Basedow)(135).
A la vez estudios experimentales reportan que un alto contenido de yodo intratiroideo disminuye la eficiencia del metimazol si bien ésto en la clínica es controvertido. En un trabajo publicado por Takata se observó que el tratamiento conjunto con MMI e ioduro de K mejoró a corto plazo el control de la enfermedad de Graves, no siendo asociado con empeoramiento del cuadro ni con inducción de resistencia a tionamidas(28).
El uso de compuestos yodados, como el KI o la solución de lugol (iodoiodurada) en el prequirúrgico ayudarían a disminuir la friabilidad y la vascularización de la glándula tiroides(136).
El ácido iopanoico y el iopodato demostraron que no solo disminuían la síntesis de hormona tiroidea, sino también la conversión de T4 a T3. La administración de ácido iopanoico 500mg a 1g produce una disminución de T3 dentro de las 6 h con una disminución de hasta 50 % a las 24 h(137). Por este efecto potente y agudo para disminuir T3, son excelentes para cuando se requiera mejorar rápidamente el hipertiroidismo. Se discontinuó su producción en el año 2000.
Los contrastes yodados endovenosos tienen el mismo efecto que el ácido iopanoico y el iopodato sobre la inhibición de la liberación de hormonas tiroideas y la conversión de T4 a T3, pero no hay evidencia clínica que avale o contraindique su uso(138). Las dosis sugeridas son: solución saturada de ioduro de potasio (SSKI) (35-50mg iodo por gota) una gota vía oral (VO) tres veces al día; solución de lugol (8 mg iodo por gota) tres a cinco gotas VO tres veces al día; ácido iopanoico (solo en áreas disponibles) 500mg VO dos veces al día (5 días prequirúrgico)(136).
- Recomendación 39: Se sugiere el uso de compuestos yodados previo a la tiroidectomía o en los casos donde se requiera evitar la liberación de hormona tiroidea ya formada. 2/+
- Recomendación 40: En hipertiroidismo severo/crisis tirotóxica se recomienda utilizar ioduro asociado a metimazol. El aporte deberá ser realizado posterior al inicio de MMI. 1/+
Los corticoides son utilizados para el tratamiento de soporte hemodinámico del paciente. Estas drogas, en especial dexametasona e hidrocortisona, disminuyen la conversión periférica de T4 a T3 siendo útiles en el tratamiento de pacientes con tormenta tiroidea(139,140).
Los corticoides usados simultáneamente con betabloqueantes son útiles en la preparación de pacientes hipertiroideos tanto en el prequirúrgico de patología tiroidea o extratiroidea(136,137).
Las dosis sugeridas son: hidrocortisona 100mg VO/EV cada 8 h; dexametasona 2 mg VO/EV cada 6 h; betametasona 0,5mg VO/EV/IM cada 6 h(136). Realizar descenso paulatino luego de las 72 h de realizado tratamiento definitivo
- Recomendación 41: En el hipertiroidismo severo/crisis se sugiere usar corticosteroides. 2/+
El principal mecanismo del litio en el tratamiento del hipertiroidismo es la inhibición de la liberación de hormona tiroidea, pero tiene varios mecanismos de acción y efectos colaterales que se resumen en la Tabla 2:
El litio puede aumentar el riesgo de falla renal (riesgo absoluto bajo). No se asoció con aumento de riesgo de malformaciones congénitas, ni alopecia ni desórdenes de la piel(145). La dosis sugerida es de 300 mg VO 3 o 4 veces al día (dosis total diaria de 800 a 1200 mg/d)(146). Además, se puede utilizar litio para aumentar la efectividad de la dosis de radioyodo y evitar la exacerbación del hipertiroidismo tras la suspensión de MMI. Los esquemas proponen iniciar tratamiento con 900 mg/d de carbonato de litio a partir del día de la dosis o durante 5-6 días previo a la dosis (desde la suspensión de MMI) y hasta 7 a 14 días posdosis.
- Recomendación 42: Se sugiere uso de carbonato de litio en hipertiroidismo severo, asociado a MMI o previo al tratamiento radical. También ante la falta de respuesta al metimazol o neutropenia. 2/+
- Recomendación 43: Se recomienda realizar controles de litemia con el fin de tenerla en rango terapéutico 0,6 a 1,2de mEq/L y advertir al paciente sobre los efectos colaterales del carbonato de litio. 1/++
- Recomendación 44 Se sugiere uso de carbonato de litio en el hipertiroidismo, cuando se requiera aumentar la efectividad de la dosis de I131. 2/ +
- Recomendación 45: Previo al tratamiento con litio se recomienda obtener laboratorio clínico con: Urea, creatinina, densidad urinaria, ionograma, calcemia, fosfatemia. 1/++
El perclorato de potasio ejerce su acción inhibiendo la captación de iodo por la tiroides, mientras que la organificación es inhibida por el metimazol. Actualmente, en nuestro país, el hipertiroidismo yodo inducido se observa luego de la administración de contrastes yodados o de amiodarona (hipertiroidismo amiodarona inducido tipo I). En casos leves pueden usarse ß bloqueantes solos. Particularmente en cardiópatas con Enfermedad de Graves tratados con amiodarona, un regimen de perclorato y metimazol normaliza los niveles de hormonas tiroideas de manera exitosa dentro de las 4 semanas. Con este esquema de tratamiento, no se refirieron efectos adversos del perclorato (anemia aplásica y síndrome nefrótico)(147,148).
- Recomendación 46: Para el tratamiento del hipertiroidismo inducido por iodo deberían utilizarse según la etiología, bloqueantes ß adrenérgicos solos o en combinación con metimazol y/o perclorato. 1/++
La plasmaféresis ha sido utilizada en algunos casos para remover las hormonas tiroideas circulantes cuando ha fallado la terapia convencional(139), pero sus resultados son discordantes(149-151).
El desarrollo de nuevos tratamientos inmunosupresores como el Rituximab (anticuerpo monoclonal contra los linfocitos CD20), demostró en algunos casos de Enfermedad de Graves inducir mejoría de la oftalmopatía, así como también disminución de los anticuerpos antitiroideos y menor frecuencia de recidivas(152,153).
Otros abordajes propuestos incluyen la inhibición del receptor de TSH por medio de una pequeña molécula "agonista alostérico inverso" del receptor de TSH(154).
- Recomendación 47: En casos de fracaso de las alternativas de tratamiento del hipertiroidismo referidas y cuando esté en riesgo la vida del paciente, evaluar el uso de otras terapéuticas como la plasmaféresis. 2/+
1. Atkins D. y col. Systems for grading the quality of evidence and the strength of recommendations I: critical appraisal of existing approaches The GRADE Working Group. BMC Health Serv Res 4:38, 2004 [ Links ]
2. Guyatt G. y col. Grading strength of recommendations and quality of evidence in clinical guidelines: report from an american college of chest physicians task force. Chest 129:174-81, 2006 [ Links ]
3. Codaccioni J.L y col. Lasting remissions in patients treated for Graves' hyperthyroidism with propranolol alone: a pattern of spontaneous evolution of the disease. J Clin Endocrinol Metab 67: 656-62, 1988 [ Links ]
4. Jansson R, Dahlberg P, Lindstrom B. Comparative bioavailability of carbimazole and methimazole. Int J Clin Pharmacol Ther Toxicol 21:505-10, 1983 [ Links ]
5. Romaldini J.H. y col. Comparison of effects of high and low dosage regimens of antithyroid drugs in the management of Graves' hyperthyroidism. J Clin Endocrinol Metab 57:563-70, 1983 [ Links ]
6. Roti E. y col. Comparison of methimazole, methimazole and sodium ipodate, and methimazole and saturated solution of potassium iodide in the early treatment of hyperthyroid Graves' disease. Clin Endocrinol (Oxf) 28:305-14, 1988 [ Links ]
7. Werner RS. y col. Serum thyroid-stimulating antibody, thyroglobulin levels, and thyroid suppressibility measurement as predictors of the outcome of combined methimazole and triiodothyronine therapy in Graves' disease. Thyroid 1:293-9, 1991 [ Links ]
8. Weetman AP. y col. Treatment of Graves' disease with the block-replace regimen of antithyroid drugs: the effect of treatment duration and immunogenetic susceptibility on relapse. Q J Med 87:337-41, 1994 [ Links ]
9. Leclere J. Treatment of Basedow disease with synthetic antithyroid drugs. Evaluation of the dose on the efficacy of the long term treatment]. Ann Endocrinol (Paris)55:11-4, 1994 [ Links ]
10. Lucas A. y col. Medical therapy of Graves' disease: does thyroxine prevent recurrence of hyperthyroidism? J Clin Endocrinol Metab 82:2410-3, 1997 [ Links ]
11. Laurberg P. y col. TSH-receptor autoimmunity in Graves' disease after therapy with anti-thyroid drugs, surgery, or radioiodine: a 5-year prospective randomized study. Eur J Endocrinol 158:69-75, 2008 [ Links ]
12. Edmonds CJ, M. Tellez. Treatment of Graves' disease by carbimazole: high dose with thyroxine compared to titration dose. Eur J Endocrinol 131:120-4, 1994 [ Links ]
13. Jorde R. y col. Short-term treatment of Graves' disease with methimazole in high versus low doses. J Intern Med 238:161-5, 1995 [ Links ]
14. McIver B. y col. Lack of effect of thyroxine in patients with Graves' hyperthyroidism who are treated with an antithyroid drug. N Engl J Med 334:220-4, 1996 [ Links ]
15. Wilson R. y col. Do higher doses of carbimazole improve remission in Graves' disease? QJM 89:381-6, 1996 [ Links ]
16. Benker G. y col. Is there a methimazole dose effect on remission rate in Graves' disease? Results from a long-term prospective study. The European Multicentre Trial Group of the Treatment of Hyperthyroidism with Antithyroid Drugs. Clin Endocrinol (Oxf) 49:451-7, 1998 [ Links ]
17. Grebe SK. y col. A randomized trial of short-term treatment of Graves' disease with high-dose carbimazole plus thyroxine versus low-dose carbimazole. Clin Endocrinol (Oxf) 48:585-92, 1998 [ Links ]
18. Nedrebo BG. y col. Predictors of outcome and comparison of different drug regimens for the prevention of relapse in patients with Graves' disease. Eur J Endocrinol 147:583-9, 2002 [ Links ]
19. Bahn RS. y col. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr Pract 17:456-520, 2011 [ Links ]
20. Laurberg P, Andersen S, Karmisholt J. Antithyroid drug therapy of Graves hyperthyroidism: realistic goals and focus on evidence. Expert Review of Endocrinol Metab 1:91-102, 2006 [ Links ]
21. Azizi F. Environmental iodine intake affects the response to methimazole in patients with diffuse toxic goiter. J Clin Endocrinol Metab 61:374-7, 1985 [ Links ]
22. Benker G. y col. Response to methimazole in Graves' disease. The European Multicenter Study Group. Clin Endocrinol (Oxf) 43:257-63, 1995 [ Links ]
23. Brandt F. y col. A critical review and meta-analysis of the association between overt hyperthyroidism and mortality. Eur J Endocrinol 165:491-7, 2011 [ Links ]
24. Brandt F. y col. A critical review and meta-analysis of the association between overt hyperthyroidism and mortality. Eur J Endocrinol 165:491-7, 2011 [ Links ]
25. Reinwein D. y col. A prospective randomized trial of antithyroid drug dose in Graves' disease therapy. European Multicenter Study Group on Antithyroid Drug Treatment. J Clin Endocrinol Metab 76:1516-21, 1993 [ Links ]
26. Kallner G, Vitols S, Ljunggrenm J. Comparison of standardized initial doses of two antithyroid drugs in the treatment of Graves' disease. J Intern Med 239:525-9, 1996 [ Links ]
27. Nakamura H. Guideline for the treatment of Graves' disease with antithyroid drug. Nihon Rinsho 64: 2189-93, 2006 [ Links ]
28. Takata K. y col. Benefit of short-term iodide supplementation to antithyroid drug treatment of thyrotoxicosis due to Graves' disease. Clin Endocrinol (Oxf) 72:845-50, 2010 [ Links ]
29. Weetman AP. The immunomodulatory effects of antithyroid drugs. Thyroid 4:145-6, 1994 [ Links ]
30. Simpson JG. y col. The influence of preoperative drug treatment on the extent of hyperplasia of the thymus in primary thyrotoxicosis. Clin Exp Immunol 22:249-55, 1975 [ Links ]
31. McGregor AM. y col. Carbimazole and the autoimmune response in Graves' disease. N Engl J Med 303:302-7, 1980 [ Links ]
32. Totterman TH. y col. Induction of circulating activated suppressor-like T cells by methimazole therapy for Graves' disease. N Engl J Med 316: 15-22, 1987 [ Links ]
33. Wang PW. y col. Depressed natural killer activity in Graves' disease and during antithyroid medication. Clin Endocrinol (Oxf) 28:205-14, 1988 [ Links ]
34. Corrales JJ. y col. Methimazole therapy in Graves' disease influences the abnormal expression of CD69 (early activation antigen) on T cells. J Endocrinol 155:491-500, 1997 [ Links ]
35. Sonnet E. y col. Longitudinal study of soluble intercellular adhesion molecule-1 (ICAM-1) in sera of patients with Graves' disease. J Endocrinol Invest 22:430-5, 1999 [ Links ]
36. Tsatsoulis A. y col. Increased serum interleukin-1 beta during treatment of hyperthyroidism with antithyroid drugs. Eur J Clin Invest 25:654-8, 1995 [ Links ]
37. Salvi M. y col. Increased serum concentrations of interleukin-6 (IL-6) and soluble IL-6 receptor in patients with Graves' disease. J Clin Endocrinol Metab 81:2976-9, 1996 [ Links ]
38. Zantut-Wittmann DE. y col. Antithyroid drugs inhibit in vivo HLA-DR expression in thyroid follicular cells in Graves' disease. Thyroid 11:575-80, 2001 [ Links ]
39. Mitsiades N. y col. Fas ligand expression in thyroid follicular cells from patients with thionamide-treated Graves' disease. Thyroid 10:527-32, 2000 [ Links ]
40. Volpe R. Evidence that the immunosuppressive effects of antithyroid drugs are mediated through actions on the thyroid cell, modulating thyrocyte-immunocyte signaling: a review. Thyroid 4:217-23, 1994 [ Links ]
41. Volpe R. Immunomodulatory effects of antithyroid drugs. Thyroid 4:507-8, 1994 [ Links ]
42. Abraham P. y col. A systematic review of drug therapy for Graves' hyperthyroidism. Eur J Endocrinol 153:489-98, 2005 [ Links ]
43. Prakash Abraham AA. y col. Antithyroid drug regimen for treating Graves' hyperthyroidism, in Cochrane Database of Systematic Reviews 2010, John Wiley & Sons, Ltd [ Links ]
44. Razvi S. y col. What is the evidence behind the evidence-base? The premature death of block-replace antithyroid drug regimens for Graves' disease. Eur J Endocrinol 154:783-786, 2006 [ Links ]
45. Laurberg P. y col. Sustained control of Graves' hyperthyroidism during long-term low-dose antithyroid drug therapy of patients with severe Graves' orbitopathy. Thyroid 21:951-6, 2011 [ Links ]
46. Elbers L, Mourits M y Wiersinga W. Outcome of very long-term treatment with antithyroid drugs in Graves' hyperthyroidism associated with Graves' orbitopathy. Thyroid 21:279-83, 2011 [ Links ]
47. Klein I, Becker DV, Levey GS. Treatment of hyperthyroid disease. Ann Intern Med 121:281-8, 1994 [ Links ]
48. Mazza E. y col. Long-term follow-up of patients with hyperthyroidism due to Graves' disease treated with methimazole. Comparison of usual treatment schedule with drug discontinuation vs continuous treatment with low methimazole doses: a retrospective study. J Endocrinol Invest 31:866-72, 2008 [ Links ]
49. Kimball LE. y col. Does smoking increase relapse rates in Graves' disease? J Endocrinol Invest 25:152-7, 2002 [ Links ]
50. Allahabadia A. y col. Age and gender predict the outcome of treatment for Graves' hyperthyroidism. J Clin Endocrinol Metab 85:1038-42, 2000 [ Links ]
51. Orunesu E. y col. Use of an artificial neural network to predict Graves' disease outcome within 2 years of drug withdrawal. Eur J Clin Invest 34:210-7, 2004 [ Links ]
52. Bolanos F. y col. Remission of Graves' hyperthyroidism treated with methimazole. Rev Invest Clin 54: 307-10, 2002 [ Links ]
53. Orgiazzi J, Madec AM. Reduction of the risk of relapse after withdrawal of medical therapy for Graves' disease. Thyroid 12:849-53, 2002 [ Links ]
54. Glinoer D, de Nayer P, Bex M. Effects of l-thyroxine administration, TSH-receptor antibodies and smoking on the risk of recurrence in Graves' hyperthyroidism treated with antithyroid drugs: a double-blind prospective randomized study. Eur J Endocrinol 144:475-83, 2001 [ Links ]
55. Takasu N. y col. Remission of Graves' hyperthyroidism predicted by smooth decreases of thyroid-stimulating antibody and thyrotropin-binding inhibitor immunoglobulin during antithyroid drug treatment. Thyroid 10:891-6, 2000 [ Links ]
56. Laurberg P. y col. Goitre size and outcome of medical treatment of Graves' disease. Acta Endocrinol (Copenh) 111:39-43, 1986 [ Links ]
57. Allannic H. y col. Antithyroid drugs and Graves' disease: a prospective randomized evaluation of the efficacy of treatment duration. J Clin Endocrinol Metab 70:675-9, 1990 [ Links ]
58. Maugendre D. y col. Antithyroid drugs and Graves' disease-prospective randomized assessment of long-term treatment. Clin Endocrinol (Oxf) 50:127-32, 1999 [ Links ]
59. Azizi F. y col. Effect of long-term continuous methimazole treatment of hyperthyroidism: comparison with radioiodine. Eur J Endocrinol 152:695-701, 2005 [ Links ]
60. Konishi T. y col. Drug discontinuation after treatment with minimum maintenance dose of an antithyroid drug in Graves' disease: a retrospective study on effects of treatment duration with minimum maintenance dose on lasting remission. Endocr J 58:95-100, 2011 [ Links ]
61. Leger J. y col. Positive impact of long-term antithyroid drug treatment on the outcome of children with Graves' disease: national long-term cohort study. J Clin Endocrinol Metab 97:110-9, 2012 [ Links ]
62. Feldt-Rasmussen U, Schleusener H, Carayon P. Meta-analysis evaluation of the impact of thyrotropin receptor antibodies on long term remission after medical therapy of Graves' disease. J Clin Endocrinol Metab 78:98-102, 1994 [ Links ]
63. Cooper DS. The Side Effects of Antithyroid Drugs. The Endocrinologist 9:457-478, 1999 [ Links ]
64. Ducornet B, Duprey J. Side-effects of synthetic antithyroid drugs. Ann Med Interne (Paris) 139:410-31, 1998 [ Links ]
65. Cooper DS. Antithyroid drugs. N Engl J Med 352:905-17, 2005 [ Links ]
66. Tajiri J, Noguchi S. Antithyroid drug-induced agranulocytosis: special reference to normal white blood cell count agranulocytosis. Thyroid 14:459-62, 2004 [ Links ]
67. Sheng W. y col. Antithyroid-drug-induced agranulocytosis complicated by life-threatening infections. QJM 92:455-61, 1999 [ Links ]
68. Takata K. y col. Methimazole-induced agranulocytosis in patients with Graves' disease is more frequent with an initial dose of 30 mg daily than with 15 mg daily. Thyroid 19:559-63, 2009 [ Links ]
69. Watanabe N. y col. Antithyroid drug-induced hematopoietic damage: a retrospective cohort study of agranulocytosis and pancytopenia involving 50,385 patients with Graves' disease. J Clin Endocrinol Metab 97:E49-53, 2012 [ Links ]
70. Thomas D. y col. Antithyroid drug-induced aplastic anemia. Thyroid 18:1043-8, 2008 [ Links ]
71. Tsuboi K. y col. The relation of initial methimazole dose to the incidence of methimazole-induced agranulocytosis in patients with Graves' disease. Endocr J 54:39-43, 2007 [ Links ]
72. Williams KV y col. Fifty years of experience with propylthiouracil-associated hepatotoxicity: what have we learned? J Clin Endocrinol Metab 82:1727-33, 1997 [ Links ]
73. Gunton JE. y col. Clinical case seminar: Antithyroid drugs and antineutrophil cytoplasmic antibody positive vasculitis. A case report and review of the literature. J Clin Endocrinol Metab 84:13-6, 1999 [ Links ]
74. Nakamura H y col. Comparison of methimazole and propylthiouracil in patients with hyperthyroidism caused by Graves' disease. J Clin Endocrinol Metab 92:2157-62, 2007 [ Links ]
75. Dai W.X. y col. Retrospective analysis of 18 cases of antithyroid drug (ATD)-induced agranulocytosis. Endocr J 49:29-33, 2002 [ Links ]
76. Sun MT, Tsain CH, Shih K. Antithyroid drug-induced agranulocytosis. J Chin Med Assoc 72:438-41, 2009 [ Links ]
77. Hegedus L. Treatment of Graves' hyperthyroidism: evidence-based and emerging modalities. Endocrinol Metab Clin North Am 38:355-71, 2009 [ Links ]
78. Russo M.W. y col. Liver transplantation for acute liver failure from drug induced liver injury in the US. Liver Transpl 10:1018-23, 2004 [ Links ]
79. Food and Drug Administration (FDA). Propylthiouracil-induced liver failure 2009 http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm162701.htm, [cited 2011, 15 march] [ Links ]
80. Malozowski S, Chiesa A. Propylthiouracil-induced hepatotoxicity and death. Hopefully, never more. J Clin Endocrinol Metab 95:3161-3, 2010 [ Links ]
81. Casallo Blanco S. y col. Hepatitis aguda tóxica por metimazol y propiltiouracilo/ Methimazole. Gastroenterol Hepatol 30:3, 2007 [ Links ]
82. Arab DM. y col. Severe cholestatic jaundice in uncomplicated hyperthyroidism treated with methimazole. J Clin Endocrinol Metab 80:1083-5, 1995 [ Links ]
83. Ramos-Bonner L.S. y col. Methimazole-induced cholestatic jaundice in an elderly hyperthyroid patient. Am J Geriatr Pharmacother 5:236-40, 2007 [ Links ]
84. Majeed M, Babu A. Cholestasis secondary to hyperthyroidism made worse by methimazole. Am J Med Sci 332:51-3, 2006 [ Links ]
85. Zhang M. y col. Steroids for the treatment of methimazole-induced severe cholestatic jaundice in a 74-year-old woman with type 2 diabetes. Endocrine 37:241-3, 2010 [ Links ]
86. Gallelli L. y col. Hepatotoxicity induced by methimazole in a previously healthy patient. Curr Drug Saf 4:204-6, 2009 [ Links ]
87. Mikhail NE. Methimazole-induced cholestatic jaundice. South Med J 97:178-82, 2004 [ Links ]
88. Wada N. y col. Prevalence of serum anti-myeloperoxidase antineutrophil cytoplasmic antibodies (MPO-ANCA) in patients with Graves' disease treated with propylthiouracil and thiamazole. Endocr J 49:329-34, 2002 [ Links ]
89. Bajaj S. y col. Antithyroid arthritis syndrome. J Rheumatol, 25(6): p. 1235-9, 1998 [ Links ]
90. Chapman EM. History of the discovery and early use of radioactive iodine. JAMA 250:2042-4, 1983 [ Links ]
91. Wartofsky L. y col. Differences and similarities in the diagnosis and treatment of Graves' disease in Europe, Japan, and the US. Thyroid 1:129-35, 1991 [ Links ]
92. Chen DY. y col. Striving for euthyroidism in radioiodine therapy of Graves' disease: a 12-year prospective, randomized, open-label blinded end point study. Thyroid 21:647-54, 2011 [ Links ]
93. Harbert J.C y col. Nuclear Medicine Therapy. 3th edition, New York: Georg Thieme Verlag, Stuttgart, 1987 [ Links ]
94. Marinelli LD. y col. Dosage determination with radioactive isotopes; practical considerations in therapy and protection. Am J Roentgenol Radium Ther 59:260-81, 1948 [ Links ]
95. Reinhardt MJ. y col. Radioiodine therapy in Graves' disease based on tissue-absorbed dose calculations: effect of pre-treatment thyroid volumeon clinical outcome. Eur J Nucl Med Mol Imaging 29:1118-24, 2002 [ Links ]
96. Hamada N. y col. Persistent high TRAb values during pregnancy predict increased risk of neonatal hyperthyroidism following radioiodine therapy for refractory hyperthyroidism. Endocr J 58:55-8, 2011 [ Links ]
97. Vannucchi G. y col. Graves' orbitopathy activation after radioactive iodine therapy with and without steroid prophylaxis. J Clin Endocrinol Metab 94: 3381-6, 2009 [ Links ]
98. Bartalena L, Tanda M. Clinical practice. Graves' ophthalmopathy. N Engl J Med 360:994-1001, 2009 [ Links ]
99. Bartalena L. y col. Consensus statement of the European group on Graves' orbitopathy (EUGOGO) on management of Graves' orbitopathy. Thyroid 18: 333-46, 2008 [ Links ]
100. Wiersinga WM. Preventing Graves' ophthalmopathy. N Engl J Med 338:121-2, 1998 [ Links ]
101. DeGroot L. Radioiodine and the immune system. Thyroid 7:259-64, 1997 [ Links ]
102. Marcocci C, Pinchera A. Graves' orbitopathy: a multidisciplinary approach. Questions and answers., ed. KG Wiersinga WM. Basel, Switzerland, 2010 [ Links ]
103. Cooper DS. Medical management of thyroid disease (2nd ed). New York: Informa Healthcare, 2008 [ Links ]
104. Gauna A, Novelli J.L, Sánchez A. Tratamiento del Hipertiroidismo, Fundac Dr. J.L Novelli, UNR editora, 2008 [ Links ]
105. Feliciano DV, Lyons J. Thyroidectomy is optimal treatment for Graves' disease. J Am Coll Surg 212: 714-20; discussion 720-1, 2011 [ Links ]
106. Nystrom E, Jansson SK, Torring O, Valdemarsson S. Thyroid Disease in Adults. Springer-Verlag, Berlin-Heidelberg, 2011 [ Links ]
107. Panzer C. y col. Rapid preoperative preparation for severe hyperthyroid Graves' disease. J Clin Endocrinol Metab 89:2142-4, 2004 [ Links ]
108. Erbil Y. y col. Effect of lugol solution on thyroid gland blood flow and microvessel density in the patients with Graves' disease. J Clin Endocrinol Metab 92:2182-9, 2007 [ Links ]
109. Erbil Y. y col. The effect of antithyroid drug treatment duration on thyroid gland microvessel density and intraoperative blood loss in patients with Graves' disease. Surgery 143:216-25, 2008 [ Links ]
110. Stalberg P. y col. Surgical treatment of Graves' disease: evidence-based approach. World J Surg 32:1269-77, 2008 [ Links ]
111. Werga-Kjellman P. y col. Surgical treatment of hyperthyroidism: a ten-year experience. Thyroid 11:187-92, 2001 [ Links ]
112. Kurihara H. Total thyroidectomy for the treatment of hyperthyroidism in patients with ophthalmopathy. Thyroid 12:265-7, 2002 [ Links ]
113. Boger MS, Perrier N. Advantages and disadvantages of surgical therapy and optimal extent of thyroidectomy for the treatment of hyperthyroidism. Surg Clin North Am 84:849-74, 2004 [ Links ]
114. Traisk F. y col. Thyroid-associated ophthalmopathy after treatment for Graves' hyperthyroidism with antithyroid drugs or iodine-131. J Clin Endocrinol Metab 94:3700-7, 2009 [ Links ]
115. Bartalena L. The dilemma of how to manage Graves' hyperthyroidism in patients with associated orbitopathy. J Clin Endocrinol Metab 96:592-9, 2011 [ Links ]
116. Marcocci C. y col. Treatment options for Graves' orbitopathy. Expert Opin Pharmacother 13:795-806, 2012 [ Links ]
117. Lowery AJ, Kerin MJ. Graves' ophthalmopathy: the case for thyroid surgery. Surgeon 7:290-6, 2009 [ Links ]
118. Lamata Hernández F. y col. Enfermedad de Graves-Basedow con nódulos tiroideos asociados (enfermedad de Graves-Basedow nodular). Consideraciones clínicas, diagnósticas y terapéuticas. Ann Med Int 20:6, 2003 [ Links ]
119. Kraimps J.L. y col. Multicentre study of thyroid nodules in patients with Graves' disease. Br J Surg 87:1111-3, 2000 [ Links ]
120. Gharib H. y col. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations. Endo Pract 16:468-75, 2010 [ Links ]
121. Anderson SR. y col. Can cytomorphology differentiate between benign nodules and tumors arising in Graves' disease? Diagn Cytopathol 31:64-7, 2004 [ Links ]
122. Bilezikian JP. y col. The influence of hyperthyroidism and hypothyroidism on alpha- and beta-adrenergic receptor systems and adrenergic responsiveness. Endocr Rev 4:378-88, 1983 [ Links ]
123. Solomon B y col. Current trends in the management of Graves' disease. J Clin Endocrinol Metab 70:1518-24, 1990 [ Links ]
124. Orgiazzi J. The treatment of Graves' disease: current views and controversies. Presse Med 40(12 Pt 1):1155-62, 2011 [ Links ]
125. Coulombe P. y col. Catecholamine metabolism in thyroid disease. II. Norepinephrine secretion rate in hyperthyroidism and hypothyroidism. J Clin Endocrinol Metab 44:1185-9, 1997 [ Links ]
126. Ratge D. y col. Altered plasma catecholamines and numbers of alpha- and beta-adrenergic receptors in platelets and leucocytes in hyperthyroid patients normalized under antithyroid treatment. Acta Endocrinol (Copenh) 110:75-82, 1985 [ Links ]
127. Cooper DS. y col. Hyperthyroxinemia in patients treated with high-dose propranolol. Am J Med 73:867-71, 1982 [ Links ]
128. Shayne P, Hart A. Thyrotoxic periodic paralysis terminated with intravenous propranolol. Ann Emerg Med 24:736-40, 1994 [ Links ]
129. Birkhahn RH. y col. Thyrotoxic periodic paralysis and intravenous propranolol in the emergency setting. J Emerg Med 18:199-202, 2000 [ Links ]
130. Tassone H. y col. The pitfalls of potassium replacement in thyrotoxic periodic paralysis: a case report and review of the literature. J Emerg Med 26:157-61, 2004 [ Links ]
131. Lin SH, Lin Y.F. Propranolol rapidly reverses paralysis, hypokalemia, and hypophosphatemia in thyrotoxic periodic paralysis. Am J Kidney Dis 37:620-3, 2001 [ Links ]
132. Yeung RT, Tse TF. Thyrotoxic periodic paralysis. Effect of propranolol. Am J Med 57:584-90, 1974 [ Links ]
133. Wartofsky L. y col. Inhibition by iodine of the release of thyroxine from the thyroid glands of patients with thyrotoxicosis. J Clin Invest 49:78-86, 1970. [ Links ]
134. Otake M. y col. Studies on the mechanism of inhibitory action of excess iodide on thyroid hormone secretion. Proc Soc Exp Biol Med. 144:538-43, 1973 [ Links ]
135. Vagenakis, AG, L.E. Braverman, Adverse effects of iodides on thyroid function. Med Clin North Am 59:1075-88, 1975 [ Links ]
136. Langley RW, Burch HB. Perioperative management of the thyrotoxic patient. Endocrinol Metab Clin North Am 32:519-34, 2003 [ Links ]
137. Baeza A. y col. Rapid preoperative preparation in hyperthyroidism. Clin Endocrinol (Oxf) 35:439-42, 1991. [ Links ]
138. Rhee CM. y col. Association between iodinated contrast media exposure and incident hyperthyroidism and hypothyroidism. Arch Intern Med 172:153-9, 2012 [ Links ]
139. Burch HB y col. Life-threatening thyrotoxicosis. Thyroid storm. Endocrinol Metab Clin North Am 22:263-77, 1993 [ Links ]
140. Williams DE. y col. Acute effects of corticosteroids on thyroid activity in Graves' disease. J Clin Endocrinol Metab 41:354-61, 1975 [ Links ]
141. Ibbeken C. y col. Renal side effects of long-term lithium therapy. Dtsch Med Wochenschr 137:143-8, 2012 [ Links ]
142. Sauer-Schulz A. y col. A rare differential diagnosis of primary hyperparathyreoidism - case 12/2011. Dtsch Med Wochenschr 136:2621, 2011. [ Links ]
143. Bowden CL. y col. Impact of lamotrigine and lithium on weight in obese and nonobese patients with bipolar I disorder. Am J Psychiatry 163:1199-201, 2006 [ Links ]
144. Atmaca M. y col. Weight gain and serum leptin levels in patients on lithium treatment. Neuropsychobiology 46:67-9, 2002 [ Links ]
145. McKnight RF y col. Lithium toxicity profile: a systematic review and meta-analysis. Lancet 379: 721-728, 2012. [ Links ]
146. Akin F. y col. The use of lithium carbonate in the preparation for definitive therapy in hyperthyroid patients. Med Princ Pract 17:167-70, 2008 [ Links ]
147. Martino E. y col. Treatment of amiodarone associated thyrotoxicosis by simultaneous administration of potassium perchlorate and methimazole. J Endocrinol Invest 9:201-7, 1986. [ Links ]
148. Erdogan MF. y col. A stepwise approach to the treatment of amiodarone-induced thyrotoxicosis. Thyroid 13:205-9, 2003 [ Links ]
149. Adali E. y col. The use of plasmapheresis for rapid hormonal control in severe hyperthyroidism caused by a partial molar pregnancy. Arch Gynecol Obstet 279:569-71, 2009 [ Links ]
150. Azezli y col. Hyperthyroidism in molar pregnancy: rapid preoperative preparation by plasmapheresis and complete improvement after evacuation. Transfus Apher Sci 36:87-9, 2007 [ Links ]
151. Samaras K. y col. Failure of plasmapheresis, corticosteroids and thionamides to ameliorate a case of protracted amiodarone-induced thyroiditis. Clin Endocrinol (Oxf) 45:365-8, 1996 [ Links ]
152. El Fassi D. y col. Treatment of Graves' disease with rituximab specifically reduces the production of thyroid stimulating autoantibodies. Clin Immunol 130:252-8, 2009 [ Links ]
153. Heemstra KA. y col. Rituximab in relapsing Graves' disease, a phase II study. Eur J Endocrinol 159:609-15, 2008 [ Links ]
154. Neumann S. y col. A new small-molecule antagonist inhibits Graves' disease antibody activation of the TSH receptor. J Clin Endocrinol Metab 96:548-54, 2011 [ Links ]














