Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Phyton (Buenos Aires)
versión On-line ISSN 1851-5657
Phyton (B. Aires) v.78 n.1 Vicente López ene./jun. 2009
ARTÍCULOS ORIGINALES
Efecto de la fertilización nitrogenada y fosforada en el contenido de ácido fítico y vigor de la semilla de avena de la variedad Saia en México
Effect of nitrogen and phosphorus fertilization on phytic acid concentration and vigor of oat seed (var. Saia) in Mexico
Rivera-Reyes1 JG, FA Peraza-Luna2, JC Serratos-Arévalo3, P Posos-Ponce4, SH Guzmán-Maldonado5, E Cortez-Baheza6, G Castañón-Nájera7, M Mendoza-Elos*
1 JG Rivera-Reyes. Instituto Tecnológico de Roque km 8 Carretera Celaya-J. Rosas Celaya, Guanajuato, México.
2 FA Peraza-Luna. Instituto Tecnológico de Tlajomulco de Zúñiga, Km 10 Carretera Tlajomulco-San Miguel Cuyutlan, Tlajomulco de Zuñiga, Jalisco, México.
3 JC Serratos-Arévalo. Instituto Tecnológico de Tlajomulco de Zúñiga, Km 10 Carretera Tlajomulco-San Miguel Cuyutlan, Tlajomulco de Zuñiga, Jalisco, México.
4 P Posos-Ponce. Centro Universitario de Ciencias Biológicas y Agropecuarias, Universidad de Guadalajara, Carretera a Nogales Km. 15.5, Las Adjuntas Nextipac, Zapópan, Jalisco, México.
5 SH Guzmán-Maldonado. Campo Expérimental Bajío INIFAP Km. 6.5 Carretera Celaya-San Miguel Allende, Celaya, Guanajuato, México.
6 E Cortez-Baheza. Instituto Tecnológico de Roque km 8 Carretera Celaya-J. Rosas Celaya, Guanajuato, México.
7 G Castañón-Nájera. Universidad Juárez Autónoma de Tabasco. División Académica de Ciencias Biológicas, Carretera Villahermosa-Cárdenas km. 0.5, entronque Bosques de Saloya, Villahermosa, Tabasco, México.
*Mariano Mendoza-Elos. Instituto Tecnológico de Roque km 8 Carretera Celaya-J. Rosas Celaya, Guanajuato, México.
Address Correspondence to: mmendoza66@hotmail.com
Recibido-Received 06.05.2008.
Aceptado-Accepted 22.12.2008.
Resumen. La avena es un cereal de importancia mundial. Se cultiva en ambientes con restricciones climáticas y en áreas de riego de las regiones templadas. El cultivo de avena produce altos rendimientos de forraje, alta calidad de grano, lo que hace que tenga amplia diversidad de usos en la alimentación. Sin embargo, el cultivo de avena en México carece de investigación sobre la calidad fisiológica de la semilla; esto implica grandes importaciones de la misma. La concentración de ácido fítico en la semilla juega un papel muy importante; de él depende el grado de viabilidad deésta y su capacidad para germinar, así como el vigor que mostrará la plántula. El objetivo del presente estudio fue determinar el efecto de la fertilización química sobre la concentración de ácido fítico y el vigor de la semilla en avena. El estudio se realizó en 2004-2005 en el Instituto Tecnológico de Roque (ITR) y en el Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP) en Celaya, Guanajuato. Se evaluaron dos factores a cuatro niveles cada uno, el factor A fue la fertilización nitrogenada (60, 100, 140 y 180 kg/ha), y factor B la fertilización fosfórica (40, 80, 120 y 160 kg/ha). Se midieron las concentraciones de ácido fítico, proteína y aminoácidos, y el vigor de la semilla. Los resultados indicaron efecto aditivo cúbico para el factor fertilización nitrogenada, y efecto cuadrático para el factor fertilización fosfórica, sobre la concentración de ácido fítico de la semilla. Las mismas tendencias fueron observadas en el vigor de la misma. Sin embargo, no se observaron diferencias estadísticas en el contenido de proteína para ninguno de los factores. Las concentraciones de los aminoácidos y ácido fítico no se asociaron significativamente.
Palabras clave: Nitrógeno; Fósforo; Calidad; Avena; Fitatos.
Abstract. Oats cereal is a worldwide significant crop. It is grown in restrictive climates and in rainy regions of temperate areas. Cultivation of oats produces high forage yields and grain quality, which gives it a wide variety of uses as animal feed and human food. However, the physiological quality of oat seeds in Mexico faces problems, which impact both their import and export. Phytic acid concentration in the oat seed plays a very important role since it affects seed viability, its germination capacity and potential seedling vigor. The objective of this study was to determine the effect of chemical fertilization on the phytic acid concentration and vigor of oat seeds. The study was conducted at the Technological Institute of Roque (ITR) and the National Research Institute for Forestry, Agricultural and Livestock in Celaya, Guanajuato in 2004 and 2005. Effects of two factors were evaluated at four levels each. Factor A was nitrogen fertilization (60, 100, 140, and 180 kg/ha). Factor B was phosphorus fertilization (40, 80, 120 and 160 kg/ha). Variables measured were phytic acid, protein and amino acid concentrations, and vigor of oat seeds. Results indicated a cubic effect from nitrogen fertilization, and a quadratic effect from phosphorus fertilization, on the phytic acid concentration of oat seeds. The same trends were observed in seed vigor. However, there were no statistical differences in protein concentration for any of the study factors. Amino acid and phytic acid concentrations were not significantly related.
Key words: Nitrogen; Phosphorus; Quality; Oat; Phytates.
INTRODUCCIÓN
La avena forrajera es un cultivo de alta demanda para consumo en la República Mexicana (López, 1994). Como es un cultivo que se adapta a diferentes ambientes, se cultiva en casi todo el país. Anualmente se siembran alrededor de 316.400 ha (Salmerón et al., 2007). En el estado de Guanajuato el área cultivada es de alrededor de 90.000 ha/año (INEGI, 2001) con rendimiento de grano entre 1 y 1,5 t/ha. La producción tiene una buena calidad, con un alto porcentaje de proteína (15%), en comparación con otros cereales. Además posee una excelente composición de aminoácidos, que convierte al grano de avena en alimento de alto valor nutritivo (INEGI, 2002).
Una de las principales limitaciones en el desarrollo forrajero de México es la insuficiente producción de semilla de buena calidad para la siembra. En el país existen variedades de avena con excelente calidad como plantas forrajeras. Sin embargo, falta generar información sobre su manejo agronómico y poscosecha. Un ejemplo lo constituye la variedad Saia, una Avena strigosa (diploide), de grano pequeño. Es escasa la información con relación a su reproducción y composición química. Además no se cuenta con semilla de calidad en el mercado, y la que se produce, tiene bajo porcentaje de germinación (latencia), con pobre vigor y baja uniformidad en la emergencia. Esto implica un mal establecimiento en la siembra, y por consiguiente, rendimientos bajos de semilla.
Las semillas de avena presentan latencia e inician su germinación en presencia de sustancias reguladoras del crecimiento (ácido giberélico), que desencadenan procesos fisiológicos relacionados con la germinación. Lo mismo puede ocurrir con sales minerales, compuestos nitrogenados y/o soluciones que modifiquen la permeabilidad de la membrana celular (Fernández y Staehelin, 1985).
El vigor de la semilla está relacionado con la germinación rápida y uniforme, o con el desarrollo de plántulas más vigorosas y competitivas. Esta característica se refleja en el rendimiento (AOSA, 1992; Delouche, 2002). Naylon y Murro (1992) indicaron que existe una interrelación entre vigor, nutrición, tamaño de la semilla, y rendimiento. Asímismo, Vela (1997) señaló que el nitrógeno y fósforo mejoran el vigor y la germinación de las semillas de avena.
Otras investigaciones se han enfocado en los tratamientos de presiembra para mejorar la emergencia desde la semilla a campo bajo condiciones de estrés hídrico. Estos estudios han mostrado beneficios considerables, ya que han permitido (1) acelerar la germinación, (2) mejorar la uniformidad de emergencia, (3) eliminar la dormancia de la semilla impuesta por el medio ambiente, y (4) acelerar los mecanismos fisiológicos (Mc Donald, 1999).
El ácido fítico o ácido mioinositol hexafosfórico (IP6) se encuentra como inositol fosfato, y representa la principal fuente de almacenamiento en las semillas (Dave et al., 1996). Este ácido es esencial en todas las semillas y constituye una reserva de fósforo que se libera durante la germinación; una forma de determinarlo es mediante espectroscopia de resonancia magnética (Rebollar y Mateos, 1999).
Los fitatos son sales de ácido fítico con distintos cationes. Su localización varía según el tipo de grano. En el trigo y centeno, entre el 80 y el 90% de los fitatos se localizan en la aleurona y pericarpio, mientras que en el maíz y sorgo se acumulan en el germen. En las leguminosas se acumulan en los cotiledones y en las oleaginosas se distribuyen en toda la semilla, asociándose a los cuerpos globulares ricos en proteína (Sauveur, 1993).
El ácido fítico se relaciona con la actividad enzimática. Éste puede inhibir la acción de ciertas enzimas como las α-amilasas, las proteasas (ej. tripsina y pepsina) y las lipasas, formando complejos mediante mecanismos aún desconocidos. Probablemente, los compuestos más afectados por esta inhibición enzimática sean las proteínas y en particular, ciertos aminoácidos (Deshpande y Cheryan, 1989). Durante la germinación de los granos de cereales, se produce un incremento significativo en la actividad de la fitasa (Centeno et al., 2001). Las nucleasas liberadas por la aleurona después de la imbibición, degradan el ADN y ARN del endosperma (Brown y Ho, 1996). Por los antecedentes expuestos se propone la hipótesis que la nutrición del cultivo influencia la acumulación de reservas, y éstas a su vez determinan el vigor de las semillas de avena.
El objetivo del presente trabajo fue determinar el efecto de la fertilización nitrogenada y fosfórica sobre las concentraciones de ácido fítico y proteína, y el vigor de las semillas de avena.
MATERIALES Y MÉTODOS
Se empleó semilla de la variedad de avena Saia, de la Empresa productora y comercializadora de semillas BIDASEM, de Guanajuato, México. En un estudio previo se realizó su análisis y se encontró una germinación baja e irregular. La siembra de la parcela experimental se estableció durante Otoño- Invierno de 2004-2005 en el Campo Experimental del Instituto Tecnológico de Roque (ITR), ubicado en el km 8 de la carretera Celaya- J. Rosas. El clima del sitio experimental es semicálido (García, 1998), con una temperatura media anual de 19°C. El suelo es Vertisol Pélico, de textura franco-arcillosa. Determinaciones previas en muestras de suelo tomadas a 0 a 30 cm de profundidad incluyeron: textura (24,04% de arena, 33,24% de arcilla y 42,72% de limo); densidad aparente: 1,2 g/cc; pH: 6,91; capacidad de campo: 42,0%; punto de marchitamiento permanente: 22%; nitrógeno inorgánico: 9,44 mg/kg; fósforo disponible Bray: 76,9 mg/kg y potasio disponible (Fotometría): 11,66 mg/kg (INEGI, 2002).
La siembra se realizó en surcos de 0,75 m a doble hilera con espaciamiento de 0,20 m entre hileras. Como fuente de nitrógeno (N) se utilizó urea (46,0% de N) y como fuente de fósforo (P) el superfosfato triple (46,0% de P2O5). Durante el desarrollo del experimento se suministraron cinco riegos espaciados entre 20 y 30 días cada uno. Se utilizó un diseño de tratamiento con dos factores. El factor A fue la fertilización nitrogenada (N) (60, 100, 140 y 180 kg/ha), y el Factor B la fertilización fosfórica (P) (40, 80, 120 y 160 kg/ha). El experimento se estableció en un diseño factorial 4x4 en bloques al azar con tres repeticiones. La unidad experimental fue de cuatro surcos de 5,0 m; como parcela útil se tomaron dos surcos. Una vez realizada la cosecha en el campo se procedió con la semilla (derivada de los tratamientos) a la cual se quería evaluar el vigor. Se sembraron en papel germinador tres repeticiones de 100 semillas cada una. Se incubaron en una estufa germinadora a 25°C. La prueba de vigor (V) se cuantificó a los cinco días de iniciada la prueba de germinación (Moreno, 1996).
Para realizar las determinaciones, las muestras se limpiaron con un soplador neumático y se secaron por medio de liofilización. Posteriormente, se molieron en un molino marca Wiley con tamiz de malla calibre 40 y se desgrasaron antes de iniciar la determinación del AF con el análisis respectivo. La metodología utilizada fue por el método simple propuesto por Wheeler y Ferrel (1971), que se resume a continuación.
Se utilizó una muestra molida estimada para obtener de 5 a 50 mg de fitato. Fue extraída en una solución de ácido tricloroacético (ATA). Una vez realizado el procedimiento de extracción se procedió a la lectura en un espectrofotómetro a 480 nm. Con cada muestra se realizó un blanco de reactivos para calcular el contenido de hierro a partir de un estándar.
El cálculo de fitato-P se realizó a partir de los resultados de hierro, asumiendo una tasa molecular de 4:6 hierro-fósforo, de acuerdo con reportes de Thompson y Erdman (1982) y Frolich y Nyman (1988).
Para la estimación de la proteína total las muestras se molieron y tamizaron con malla calibre 60, y posteriormente se determinó el nitrógeno total mediante el método Micro-Kjeldalh propuesto por Villegas y Mertz (1971). El factor utilizado para calcular el porcentaje de proteína fue de 6,25. La determinación de aminoácidos se realizó por el método de columnas (HPLC) propuesto por Henderson et al. (2005).
Las variables medidas en porcentaje, se transformaron a arco seno antes de realizar los análisis estadísticos (Steel y Torrie, 1988). El análisis de varianza se realizó con el programa MSTAT (Michigan State University), y de acuerdo a los resultados aditivos la tendencia de los factores N y P se realizó mediante polinomios ortogonales. Asimismo se realizaron análisis de regresión y correlación del AF con proteína, aminoácidos y vigor de la semilla de avena.
RESULTADOS
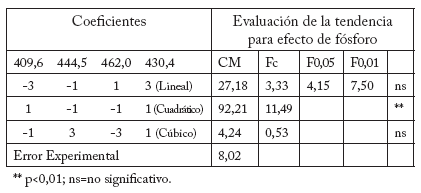
El factor A (Fertilización nitrogenada) fue significativo (p<0,05) en la concentración del AF y altamente significativo (p<0,01) para el vigor. La fertilización fosfórica (B) presentó un efecto altamente significativo para la concentración de AF y el vigor de la semilla. Sin embargo no se observaron efectos significativos de estos elementos en el contenido de proteína (Tabla 1) (Tabla 2).
Tabla 1. Cuadrados medios del análisis de varianza (ANOVA) del efecto del nitrógeno y fósforo en la concentración de proteína y ácido fítico, y vigor en la semilla de avena, Celaya, Guanajuato, México.
Table 1. Mean squares variation analysis (ANOVA) from the nitrogen and phosphorus effect on protein and phytic acid concentration, and vigor of Oat seeds, Celaya, Guanajuato, Mexico.

Tabla 2. Efecto de la fertilización nitrogenada sobre la concentración de proteína, ácido fítico y vigor de la semilla de avena, en Celaya, Guanajuato, México.
Table 2. Effect of nitrogen fertilization on protein and phytic acid concentrations, and vigor of oat seeds, Celaya, Guanajuato, Mexico.

Los resultados muestran que el nivel de 100 kg de N fue el tratamiento que presentó mayor cantidad de AF (38,05 mg/g), y vigor de la semilla (76,67) seguido de 140 y 180 kg; el tratamiento más bajo fue el de 60 kg (34,49 mg/g). La tendencia del efecto del nitrógeno mostrada mediante el análisis de polinomios ortogonales corresponde a la cúbica (Tabla 4). Para fósforo se encontró que la aplicación de 120 kg fue el tratamiento de mayor contenido de AF (38,51 mg/g), cercano al de 80 kg con 37,03 mg/g, y la más baja concentración del mismo ácido fue con el nivel de 40 kg de fósforo (34,11 mg/g). Este elemento presenta una tendencia cuadrática de acuerdo con el análisis realizado por polinomios ortogonales donde se observa que con niveles intermedios se obtiene la mayor concentración de fítico (Tablas 3 y 5).
Tabla 3. Efecto de la fertilización fosfórica sobre la concentración de proteína y ácido fítico y vigor de las semillas de avena, en Celaya, Guanajuato, México.
Table 3. Effect of phosphorus fertilization on protein and phytic acid concentrations, and vigor of oat seeds, Celaya, Guanajuato, Mexico.

Tabla 4. Efecto de la fertilización nitrogenada sobre la concentración de ácido fítico en las semillas de avena, Celaya, Guanajuato, México, usando Polinomios Ortogonales.
Table 4. Effect of nitrogen fertilization on phytic acid concentration in Oat seeds, Celaya, Guanajuato, Mexico, using Orthogonal Polynomials.
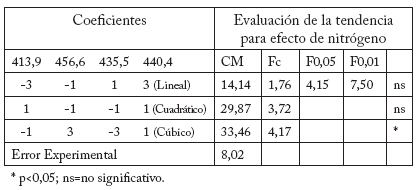
Tabla 5. Efecto de la fertilización fosfórica sobre la concentración de ácido fítico en las semillas de avena, Celaya, Guanajuato, México, usando Polinomios Ortogonales.
Table 5. Effect of phosphorus fertilization on phytic acid concentration in Oat seeds, Celaya, Guanajuato, Mexico, using Orthogonal Polynomials.
Se observó una relación lineal entre la concentración de AF y la concentración de proteína (Fig. 1). Asimismo al incrementarse el AF en un mg se incrementó el vigor de la semilla de avena en 0,919 % (Fig. 2).

Fig. 1. Relación de la concentración estimada (Y=6,22+0,172X) de proteína (Y) vs. la de ácido fítico (X) en las semillas de avena de la variedad Saia, Celaya, Guanajuato, México.
Fig. 1. Relationship of the estimated (Y=6,22+0,172X) protein vs. phytic acid concentrations in oats seeds in Celaya, Guanajuato, Mexico.

Fig. 2. Efecto del ácido fítico (mg/g) en por ciento de vigor de las semillas de avena, en Celaya, Guanajuato, México.
Fig. 2. Phytic acid effect (mg/g) on percent vigor of oat seeds in Celaya, Guanajuato, Mexico.
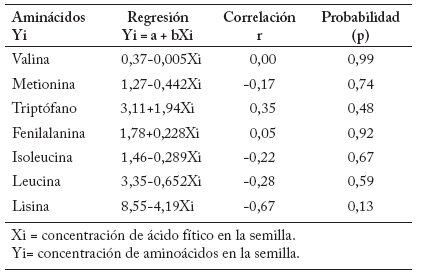
La relación de la concentración de AF con la de aminoácidos no fue significativa (Tabla 6).
Tabla 6. Relación de los aminoácidos (g/100g de proteína) con la concentración de ácido fítico (mg/g) en las semillas de avena, Celaya, Guanajuato, México.
Table 6. Relationship of amino acids (g/100g protein) to phytic acid (mg/g) concentration in Oat seeds, Celaya, Guanajuato, Mexico.
DISCUSIÓN
Los resultados de esta investigación mostraron que para que la semilla de avena acumule mayores concentraciones de AF, principal componente de reserva de fósforo, es necesaria una adecuada nutrición de los cultivos (Othón, 1996). La respuesta a la aplicación de nitrógeno en la producción de grano mostró una tendencia similar a la reportada para otros cereales por Amado y Ortiz (2001); Salazar et al. (1996) y Wuest y Cassman (1992). La fertilización nitrogenada es indispensable para el crecimiento del cultivo en suelos como el del ensayo con baja disponibilidad del elemento de acuerdo al análisis. Sin embargo, niveles excesivos de este nutrimento provocan acame del cultivo y reducción en la producción de semilla.
El incremento en la concentración de AF y en el vigor de la semilla por fertilización fosfórica fue comparable al encontrado en cebada por Vela (1997). A las dosis más altas ensayadas el vigor de la semilla tendió a descender; lo anterior puede relacionarse con la alta disponibilidad de fósforo mostrada en el análisis de suelo. Es importante estudiar cual es el nivel de nutrición adecuado para tener la mejor respuesta en rendimiento y calidad de la semilla.
La asociación entre el AF y la calidad de la semilla ha sido estudiada por diferentes autores. Sauveur (1993) afirma que el inositol fosfato y sus intermediarios intervienen en diversos procesos vitales en el interior de la célula. Por su parte Hoseney (1991) lo relaciona con los ácidos nucleicos que son parte del ácido fítico, y que son degradados del endosperma de la semilla una vez que éste inicia el proceso de germinación. Sin embargo, Carnovale et al. (1987) describen que cuando existen altas cantidades de AF y ausencia de fitasas la digestibilidad de los productos disminuye. Esto es debido a la interacción con complejos insolubles como proteínas, almidón y aminoácidos como lisina, arginina e histidina, que forman estructuras complejas que reducen la solubilidad, digestibilidad y funcionalidad.
El grado de interacción entre AF y proteínas es dependiente de la carga neta de la proteína, de su conformación y de la interacción con minerales a un pH dado (Thompson, 1993 Citado por Martínez et al., 2002). A bajo pH, menor al del punto isoeléctrico de las proteínas, éstas se encuentran cargadas positivamente y el AF negativamente. Bajo estas condiciones, se produce una fuerte interacción electrostática entre grupos amino terminal de las proteínas, y ésteres fosfato aniónicos del AF, formándose un complejo binario. Numerosos investigadores han encontrado una reducción del AF durante la germinación en las semillas de leguminosas, aparentemente como resultado de un elevado aumento de la actividad fitásica (Centeno et al., 2001). Esto concuerda con los resultados de la presente investigación en donde se incrementó la concentración de AF y a la vez el porcentaje de vigor de la semilla. Esto demuestra que al iniciarse el proceso de germinación a nivel celular, los depósitos de AF tienden a desintegrarse y a liberar determinados cationes, como Mg. Estos cationes son utilizados para la síntesis de ácidos nucleicos y transportados a las zonas de crecimiento haciendo disponibles otros minerales, acelerando el desarrollo de la nueva planta.
CONCLUSIONES
El mejor tratamiento para el cultivo de la variedad de avena Saia fue el de 100 kg/ha de nitrógeno y 120 kg/ha de fósforo. La concentración de ácido fítico se incrementó en 3,56 mg al aumentar de 60 a 100 kg de N/ha, y en 4,40 mg al incrementarse de 40 a 120 kg de fósforo.
Los aumentos en la concentración de ácido fítico por efecto de la fertilización nitrogenada y fosfórica se reflejaron en el vigor de la semilla de avena.
REFERENCIAS
1. Amado, A.J.P. y P. Ortiz F. (2001). Consecuencias de la fertilización nitrogenada y fosfórica sobre la producción de avena irrigada con agua residual. Terra 19:175-182. [ Links ]
2. AOSA (1992). Vigor Testing handbook. Association Official Seed Analists. Contribution No.32 to the handbook of seed testing. USA. 6: 1-126. [ Links ]
3. Brown, P.H.D. y T.H. Ho (1996). Barley aleurone layers secret a nuclease in response to gibberelic acid. Purification and partial characterization of the associated ribonuclease, deoxiribonucleasa, and 3-nucleotidase activities. Plant Physiology 82:168-177. [ Links ]
4. Carnovale, E., E. Lugaro y G. Lombarda-Boccia (1987). Phytic acid in faba bean and pea: Effect on protein availability. Cereal Chemistry 65:114-117. [ Links ]
5. Centeno, C., A. Viveros., A. Brenes., R. Canales, A. Lozano y C. De la Cuadra (2001). Effect of several germination conditions on total P, Phytate P, Phytase and acid phosphatase activities and inositol phosphate stress in rye and barley. Journal of Agricultural and Food Chemistry 49: 3208-3215. [ Links ]
6. Dave, B.O., E. O. Kenaschuk y G. Mazza (1996). Phytic acid content of flaxseed as influenced by cultivar, growing season, and location. Journal Agricultural Chemistry 44: 2663-2667. [ Links ]
7. Delouche, J.C. (2002). Germinación, Deterioro y Vigor de semillas. Seed News. Mississippi State University. E U. A. Seednews@seednews, 2002 (Fecha de consulta 14 Agosto 2006). [ Links ]
8. Deshpande, S.S. y M. Cheryan (1989). Effects of phytic acid, divalent cations, and their interactions on a--amylase activity. Journal Food Science 49: 516-519 [ Links ]
9. Fernández, D.E. y L. A. Staehelin (1985). Structural organization of ultrarapidly frozen barley aleurone cells actively involved in protein secretion. Planta 165: 455-468. [ Links ]
10. Frolich, W. y M. Nyman (1988). Minerals, Phytate and dietary fiber in different fractions of oat-grains. Journal Cereal Science 7: 73-82. [ Links ]
11. García, E. (1998). Modificaciones al sistema de clasificación climática de Köppen para adaptarlos a las condiciones de la República Mexicana. UNAM. México. 246 p. [ Links ]
12. Henderson, J.W., R. D. Ricker., B. A. Bidlingmeye y C. Woodward (2005). Rapid, Accurate, Sensitive, and Reproducible HPLC Analysis of Amino Acids. "Technical support" User Contributed Software. Agilent Technologies. [ Links ]
13. Hoseney, C. (1991). Principios de Ciencia y Tecnología de los Cereales Ed. ACRIBIA, S.A Zaragoza, España. 321p. [ Links ]
14. INEGI (2001). Instituto Nacional de Estadística Geografía e Informática. Anuario Estadístico del Estado de Guanajuato, SARH. México. 673 p. [ Links ]
15. INEGI (2002). Instituto Nacional de Estadística Geografía e Informática. "Cultivos anuales de México. Vll Censo Agropecuario". Aguascalientes, México. pp. 53-58 [ Links ]
16. López, D.U. (1994). Análisis y perspectivas del mejoramiento genético de los forrajes. Xl Congreso Latinoamericano de Genética y XV Congreso de Fitogenética. Monterrey, N.L. 25-30 de Septiembre. [ Links ]
17. Martínez, D.B., M.V. Ibáñez G y F. Rincón L (2002). Ácido fítico: Aspectos nutricionales e implicaciones analíticas. ALAN 52: 219-231. [ Links ]
18. Mc Donald, M.B. (1999). Seed deterioration: Physiology, repair and assessment. Seed Science Technology 27: 77-23. [ Links ]
19. Moreno, C.P. (1996). Análisis físico y biológico de semillas agrícolas UNACH., México, 601p. [ Links ]
20. Naylon, R.E. y L. Murro (1992). Interrelationships of parent plant nutrition, seed size viability and vigor in wheat and triticale. Seed Science Technology 20: 421-425. [ Links ]
21. Othón, S.R.S. (1996). Química, Almacenamiento e Industrialización de los Cereales. A.G.T. Editor, S.A. México, 521p. [ Links ]
22. Rebollar, P.G. y G. Mateos G (1999). El fósforo en nutrición animal. Necesidades, valoración de materias primas y mejora de la disponibilidad. Avances en nutrición y alimentación animal. XV Curso de especialización FEDNA pp 21-64. [ Links ]
23. Salazar, G.M., O. Moreno R., R. Salazar G y L. Carrillo M (1996). Wheat production as affected by seeding rate x fertilization interaction. Cereal Research 24: 231-237. [ Links ]
24. Salmerón, Z.J.J., V. Hernández M., B. Cabañas C., C. Lara M., R. Velasco N y H. E. Villaseñor M (2007). "Aracero" Variedad de avena resistente a las royas del tallo y de la corona para áreas de riego en México. Revista Fitotecnia Mexicana 30: 105-107. [ Links ]
25. Sauveur, B. (1993). Les phytases fongiques dans alimentation des volatiles. INRA Production Animale 6: 265-267. [ Links ]
26. Steel, R.G.D. y J.H. Torrie (1988). Bioestadística: Principios y procedimientos. Ed. McGraw-Hill, 622p. [ Links ]
27. Thompson, D.B. y J.W.J. Erdman (1982). Structural model for ferric phytate: Implications for phytic acid analysis. Cereal Chemistry 59: 525-528. [ Links ]
28. Vela, L.B. (1997). Rendimiento y calidad de semilla de cebada (Hordeum vulgare L.) en respuesta a densidad de siembra y fertilización. Tesis de Maestría. Instituto Tecnológico Agropecuario 33. Roque, Celaya, Gto., Mex, 86p. [ Links ]
29. Villegas, E. y E. T. Mertz (1971). Chemical Screening Methods for Maize Protein Quality at CIMMYT, México. Research Bulletin 20:14p. [ Links ]
30. Wheeler, E. y R. E. Ferrel (1971). A method for phytic acid determination in wheat and wheat fractions. Cereal Chemistry 48: 312-320. [ Links ]
31. Wuest, S.B. y K. G. Cassman (1992). Fertilizer Nitrogen Use Efficiency of Irrigated Wheat:ll. Partitioning Efficiency of Preplant versus Late Season Application. Agronomy Journal 84: 689-694. [ Links ]














