Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencia y Tecnología
versión On-line ISSN 1851-7587
Rev. cienc. tecnol. no.19 Posadas ene. 2013
INGENIERÍA, TECNOLOGÍA E INFORMÁTICA
Actividad antioxidante y contenido de compuestos fenólicos y flavonoides en mieles de tréboles, eucalipto y alfalfa
Antioxidant activity and content of phenolic and flavonoids compounds in clovers, eucalyptus and lucerne honeys
María C. Ciappini, Fernando S. Stoppani, Roxana Martinet, María B. Alvarez
1 CIDTA - Universidad Tenológica Nacional - Fac. Reg. Rosario. E. Zeballos 1341 - S2000BUN Rosario - Argentina. TE 54 341 4484909. E-mail: mcciappini@frro.utn.edu.ar
. María Cristina Ciappini1
Magíster en Tecnología de los Alimentos. Ingeniera Química. Doctorando de UBA. Investigador Cat. II (Prog. Incentivos). Directora del proyecto: "Composición fenólica de mieles monoflorales de distinto origen y evaluación de su capacidad antioxidante". Profesor adjunto en la FRRo, Universidad Tecnológica Nacional. Directora del Área de Posgrado y Educación Continua, UTN FRRo. Autora de numerosos artículos y presentaciones en Congresos. mcciappini@frro.utn.edu.ar
. Roxana Martinet1
Ingeniera Química. Jefe de Trabajos Prácticos con semidedicación en el Centro de Investigaciones en Tecnología de los Alimentos y docente en Química de los Alimentos en la FRRo, Universidad Tecnológica Nacional. Integrante del proyecto consolidado con incentivos "Composición fenólica de mieles monoflorales de distinto origen y evaluación de su capacidad antioxidante".
. Fernando Stoppani1
Magíster en Tecnología de los Alimentos. Ingeniero Químico. Auxiliar de Primera en el Centro de Investigaciones en Tecnología de Alimentos y docente en Ingeniería de las Reacciones en la FRRo, Universidad Tecnológica Nacional. Coordinador en la Maestría en Tecnología de Alimentos en la misma institución. Integrante del proyecto consolidado con incentivos "Composición fenólica de mieles monoflorales de distinto origen y evaluación de su capacidad antioxidante".
. María Belén Alvarez1
Ingeniera Química. Adscripta en el Centro de Investigaciones en Tecnología de Alimentos de la FRRo, Universidad Tecnológica Nacional. Integrante del proyecto consolidado con incentivos "Composición fenólica de mieles monoflorales de distinto origen y evaluación de su capacidad antioxidante". Beca BINID 2012.
Resumen
Los productos apícolas son particularmente ricos en compuestos polifenólicos, a los que se les atribuyen propiedades antioxidantes. El objetivo de este trabajo fue evaluar la capacidad antioxidante de mieles monoflorales y el contenido de compuestos fenólicos y flavonoides, para establecer las posibles correlaciones entre estos parámetros. Se analizaron 81 muestras de miel de "tréboles", "eucalipto" y "alfalfa". El contenido de fenoles total se cuantificó por el método de Folin Ciocalteau y el contenido de flavonoides se determinó espectrofotométricamente. La capacidad antioxidante se midió a través de ensayos in vitro de captura de radicales 1,1-difenil picril hidracilo y oxhidrilo, capacidad antioxidante Trolox equivalente y capacidad de reducción del ión férrico. Fue significativamente mayor para la miel de "eucalipto". El contenido de compuestos fenólicos fue significativamente inferior (p=0,05) para las mieles de "tréboles" que para las de "eucalipto" y "alfalfa". Un Análisis por Componentes Principales explicó el 73% de las diferencias encontradas en la actividad antirradicalaria, en función del origen floral de las mieles analizadas. El contenido de fenoles se correlacionó con la actividad capturadora de radicales, lo que indica la influencia de estos compuestos en la actividad antioxidante de la miel.
Palabras clave: Capacidad antioxidante; Radicales libres; Miel.
Abstract
Bee products are particularly rich in polyphenolic compounds, which are attributed antioxidant properties. The objectives of this study were to evaluate the antioxidant capacity of unifloral honeys, by radical scavenging methods and to determine the content of phenolic and flavonoids compounds. Eighty-one samples of clover, eucalyptus and lucerne honey were assayed. Free phenolic content was quantified by the Folin Ciocalteau method and flavonoids were determined spectrophotometrically. The antioxidant capacity was measured using scavenging assays of 1,1-diphenyl-2-picrylhydrazyl and hydroxyl radicals Trolox equivalent antioxidative capacity and ferric reducing antioxidant capacity. The content of phenolic compounds and the ability to free radicals scavenging were significantly lower (p=0.05) for clover honey than those for eucalyptus and lucerne honeys. Principal Components Analysis explained 73% of the differences found in the antiradical activity, through the botanical origin of honeys assayed. The phenol content was correlated with the free radical scavenging, which indicates the influence of these compounds in the antioxidant activity of honey.
Key words: Antioxidant activity; Free radicals scavenging; Honey.
Introducción
La capacidad antioxidante de los alimentos ha despertado gran interés en los últimos tiempos. Ya se comercializan extractos con capacidad antioxidante, como ingredientes alimentarios, y algunos alimentos se expenden indicando esta propiedad, como atributo de fundamental interés para contribuir a la conservación de la salud o a la prolongación de la vida útil de los productos (1).
Se conoce como actividad antioxidante total o capacidad antioxidante total a la medición analítica de concentraciones de radicales de diferente naturaleza, en un sistema oxidativo controlado. En los alimentos de origen vegetal, se atribuye esta capacidad a la presencia de compuestos fenólicos, especialmente a los flavonoides. Existe consenso en que la actividad antioxidante de los flavonoides resulta de una combinación de las propiedades quelantes del hierro y capturadoras de radicales libres. Otros autores se refieren además a la inhibición de oxidasas (lipoxigenasa, ciclooxigenasa, mieloperoxidasa, NADPH oxidasa y xantina oxidasa), evitando la generación in vivo de especies reactivas del oxígeno (ROS), así como de hidroperóxidos orgánicos. Por otra parte, se ha podido establecer que también inhiben enzimas involucradas indirectamente en los procesos oxidativos, como la fosfolipasa A2, al mismo tiempo que estimulan otras, con reconocidas propiedades antioxidantes (catalasa y superóxido dismutasa). De esta forma, los flavonoides interfieren en la formación y en las reacciones de propagación de los radicales libres (2).
Los estudios coinciden en que los flavonoides con sustituyentes dihidroxílicos en posiciones 3`y 4` en el anillo B, se muestran más activos como antioxidantes y que este efecto es potenciado por la presencia de un doble enlace entre los carbonos 2 y 3, un grupo oxhidrilo libre en la posición 3 y un grupo carbonilo en la posición 4, como sucede en la quercetina. Asimismo, se evidencia que las agliconas de los flavonoides se muestran más potentes en sus acciones antilipoperoxidantes, que sus correspondientes glicósidos (3).
Los productos apícolas son particularmente ricos en estos compuestos bioactivos. En trabajos previos, se determinaron las concentraciones de algunos de los compuestos flavonoides presentes en la miel, mediante análisis por cromatografía líquida (4). Sin embargo, la sola cuantificación de estos compuestos no es suficiente para conocer su efecto antioxidante. En la miel, también se encuentran presentes una variedad de compuestos nitrogenados (alcaloides, derivados de la clorofila, aminoácidos y aminas) carotenoides y vitamina C, que son ampliamente conocidos por su actividad antioxidante (5).
Se han desarrollado diversos ensayos in vitro para la determinación de la capacidad antioxidante. Se clasifican en ensayos que involucran reacciones de transferencia de hidrógeno (HAT), ensayos que involucran reacciones de transferencia de electrones (ET) y ensayos que miden la capacidad capturadora de ROS (6). Los HAT aplican un esquema de reacción competitiva en la cual el antioxidante y el sustrato compiten por un radical peroxilo, generado térmicamente por la descomposición de un azo compuesto. Los ET se basan en la medida de la capacidad de un compuesto en reducir un oxidante, que cambia de color cuando se reduce (7).
Otros ensayos intentan medir la capacidad de captura de un oxidante de importancia biológica, tal como oxígeno singlete, súperoxido, peroxinitrito y radical oxhidrilo. El ensayo de captura de oxhidrilos (OH), especie extremadamente reactiva y de corta vida, que puede hidroxilar DNA, proteínas y lípidos, es el de uso más frecuente.
Recientemente se han desarrollado métodos biológicamente más relevantes que los populares ensayos químicos de actividades antioxidantes, porque tienen en cuenta algunos aspectos de metabolismo, ingesta y ubicación del compuesto antioxidante en las células. Hacen uso de células cancerosas o glóbulos rojos, con un precursor de tinción agregado en el interior del citosol de la célula, que sólo se convierte en un medio de contraste si está dañado por el estrés oxidativo. Sin embargo, estos métodos han sido cuestionados por no haberse encontrado correlaciones entre sus resultados y la actividad biológica in vivo (1).
En este trabajo se han seleccionado algunos ensayos in vitro para la determinación de la capacidad antioxidante en mieles de distinto origen floral, en correlación con la presencia de compuestos fenólicos y flavonoides, para estimar en la miel esta característica de importancia nutricional, que también contribuye a la caracterización de este producto.
Materiales y métodos
Se analizaron 81 muestras de miel, de las cuales 48 fueron tipificadas como mieles de "tréboles", 28 de "eucalipto" (Eucalyptus spp.) y 5 de "alfalfa" (Medicago sativa L.), de acuerdo a los resultados del análisis palinológico (8) y a la clasificación de mieles monoflorales propuesta en la Res. SAGPyA Nº 274/95 (9). En todas ellas, se determinaron previamente propiedades fisicoquímicas, que aseguraron su aptitud comercial.
Las mieles fueron recolectadas directamente en apiarios de la región fitogeográfica pampeana argentina, que se caracteriza por ser una pradera de gramíneas, alterada por el pastoreo y el desarrollo de diversos cultivos (Triticum aestivum L., Zea mays L., Glycine max (L.) Merr., Oryza sativa L.) y cosechas de forrajes (Lotus sp., Medicago sativa L, Trifolium repens L., Trifolium pratense L. y Melilotus albus Medik.). Como la región pampeana está dedicada principalmente a la agricultura y ganadería, la vegetación nativa ha sido reemplazada por cultivos y malezas acompañantes, creando un importante recurso para la producción de miel en la región (10).
La determinación de compuestos fenólicos totales se realizó utilizando el reactivo de Folin Ciocalteau. El procedimiento (11) consistió en pesar 4 ± 0,01 g de miel, que se llevaron a 25 mL con agua; a 1 mL de esta solución se le adicionaron 10 mL de agua destilada y 1 mL de solución de Folin-Ciocalteau, agitando suavemente y dejando reposar durante dos minutos. Posteriormente se agregaron 2 mL de solución de carbonato de sodio al 10% y se completó a volumen con agua (25 mL). Luego de reposar 2 horas a temperatura ambiente, se leyó la absorbancia de la solución a 725 nm. Los resultados se expresaron como equivalentes de ácido gálico (AGE) en 100 g de miel, de acuerdo a la curva de calibración obtenida con el estándar (Absorbancia = 0,0237 x [µg AGE/mL] - 0,005; R² = 0,9986).
El contenido de flavonoides se determinó espectrofotométricamente mediante la reacción de estos con tricloruro de aluminio (12). Se pesó 2,5 ± 0,01 g de miel, se solubilizó con agua destilada, se le adicionó 0,5 mL de AlCl3 al 5% y se llevó a 25 mL con agua destilada. Luego de reposar durante 30 minutos en ausencia de luz, se leyó la absorbancia de la solución a 425 nm. Los resultados se expresaron en mg QE /100 g de miel, de acuerdo a la curva de calibración (Absorbancia = 0,065 x [µQE/mL] + 0,006; R² = 0,9969).
La capacidad antioxidante se determinó mediante la captura del radical 1,1-diphenil-2-picril hidracilo (DPPH) (13). Para su determinación en miel, se pesaron aproximadamente 0,700 g de muestra, que se disolvieron en 50 mL de agua. Se mezclaron 2 mL de esta solución con 2 mL de una solución etanólica 0,1 M de DPPH, extemporánea que se preparaba en el momento de ser usada. Se conservó esta mezcla durante 60 minutos al abrigo de la luz, para luego leer la absorbancia a 515 nm. Los resultados se expresaron en mg de Trolox equivalente (TE) en 100 g de miel, de acuerdo a la curva de calibración (Absorbancia = 0,0238 x [µM TE] + 0.003; R2=0,9989).
La capacidad antioxidante Trolox equivalente (TEAC) (14), se determinó empleando el radical 2-2-azobis- 3-ethylbenzothiazoline-6-sulphonate (ABTS). Se pusieron en contacto 0,1 mL de una solución acuosa de miel al 10% y 4 mL de la solución de catión ABTS, que se obtuvo a partir de una solución de ABTS 7 mM y persulfato de potasio 2,45 mM. Se dejó la mezcla en reposo en la oscuridad durante 24 horas y se leyó la absorbancia a 734 nm, habiendo ajustado la lectura del equipo en 0,7 con la solución de ABTS. La capacidad antioxidante se expresó en mg de Trolox equivalente (TE) en 100 g de miel, de acuerdo a la curva de calibración (Absorbancia = -0,0028 x [mM TE] + 0,673; R2= 0,9807).
Para la determinación del poder reductor (FRAC) (15), se mezclaron 2 mL de una solución acuosa de miel de 0,03 g/mL, 2 mL de solución buffer de fosfato de sodio 0,2 M (pH = 6,6) y 2 mL de ferricianuro de potasio al 1%. La mezcla homogeneizada, se incubó a 50ºC durante 20 minutos, transcurridos los cuales se le adicionaron 2 mL de ácido tricloroacético. A 5 mL de esa mezcla, perfectamente homogeneizada, se le adicionaron 5 mL de agua bidestilada y 1 mL de cloruro férrico al 1%. Se leyó la absorbancia a 700 nm. La capacidad reductora se expresó en mg de ácido ascórbico equivalente (AAE) en 100 g de miel, de acuerdo a los valores correspondientes a la curva de calibración (Absorbancia = 0,0148 x [mg AAE/mL] + 0,2385; R2= 0,9928).
Para la determinación de captura del radical OH (16), se mezclaron 0,1 mL de solución de desoxiribosa (C5H10O4) 28 mM y 200 µl de una solución de miel al 2%. Se le agregaron 0,5 mL de buffer fosfato 40 mM pH 7,4; 0,1 mL de cloruro férrico 1 mM; 0,1 mL de EDTA 1,04 mM: 0,1 mL de H2O2 1 mM y 0,1 mL de ácido L-Ascórbico 1 mM. Luego de incubar a 37ºC durante una hora en baño termostatizado, se le adicionaron 0,5 mL de ácido tiobarbitúrico al 1% P/V en NaOH 0,05 M y 0,5 mL de ácido tricloroacético al 2,8% (v/v). Se dejó reaccionar durante 10 minutos a 100ºC y se midió la absorbancia a 530 nm. Los resultados se expresaron como miligramos de quercetina equivalente (QE) en 100 g de miel (Absorbancia = -117 x [mg QE/mL] + 0,554; R2= 0,9934).
Para todos los ensayos, se empleó un espectrofotómetro Varian Cary 50 (Las Vegas, NV, EE.UU.) y cubetas de cuarzo de paso 10 mm. Se aplicó estadística descriptiva y multivariada para el análisis estadístico de los datos, mediante el uso del software Stat Plus. Los diagramas de caja y bigotes no se realizaron para los resultados correspondientes a las mieles de "alfalfa", por ser solamente cinco las muestras de este origen botánico.
Resultados y discusión
El contenido de fenoles totales para todas las mieles analizadas estuvo comprendido entre 40,30 y 193,03 mg AGE/100 g de miel, con un promedio de 93,75 ± 37,06 AGE/100 g. Meda y col. (17) encontraron valores entre 32,59 y 114,75 mg AGE/ 100 g, con un promedio de 74,38 ± 20,54 mg AGE para mieles multiflorales y mieles de mielada y Vit y col. (18), entre 47,40 y 265,49 mg AGE/ 100 g, para mieles checas. Otros autores encontraron valores más bajos, pero comprendidos en los intervalos mencionados (19), (20), (21) a excepción de Muñoz y col. (22), que informan valores entre 0 y 8,82 mg AGE/ 100 g, para mieles chilenas.
Entre los alimentos a los que se les atribuye capacidad antioxidante, se pueden mencionar al té verde, al vino tinto y al chocolate. Entre ellos, el chocolate contiene valores mucho más elevados de compuestos fenólicos totales (611 mg AGE por porción), mientras que el té negro contiene 124 mg AGE, el té verde, 165 mg AGE y el vino tinto, 340 mg AGE (23). Para alcanzar estos aportes, deberían ingerirse cantidades de miel próximas a los 100 g, superando ampliamente el valor de una porción (30 g) (24).
El contenido de flavonoides para todas las mieles analizadas estuvo comprendido entre 1,42 y 7,48 mg QE/100 g de miel, con un promedio de 3,52 ± 1,19 mg QE/100 g. Meda y col. (17) encontraron valores promedio iguales a 2,57 ± 2,09 mg QE/100 g para mieles multiflorales y mieles de mielada; Vit y col. (18) entre 1,90 y 15,74 mg QE/100 g para mieles checas. Otros autores informaron rangos de menor amplitud, comprendidos entre los valores informados (19), (22), (25), (26), (27).
La Figura 1 muestra que el 75% de las mieles de "eucalipto" tuvieron a lo sumo un nivel de fenoles totales de 142,7 mg AGE/100 g y de flavonoides de 5,0 mg QE/100 g. Entre las mieles de "tréboles", hay dos muestras con niveles superiores a 150 mg AGE/100 g de fenoles totales y una con un contenido de flavonoides igual a 7,5 mg QE/100 g; mientras que el 75%, tiene un nivel de fenoles de 100,4 mg AGE/100 g o menor y de 3,9 mg QE/100 g de flavonoides o menor.

Figura 1: Diagrama de caja y bigotes correspondientes al contenido de a) fenoles totales y b) flavonoides para mieles de "eucalipto" y"tréboles"
El contenido de compuestos fenólicos fue significativamente inferior (p=0,05) para las mieles de "tréboles" (ẋ =82,73 ± 28,04 mg AGE/100 g de miel), con respecto a las mieles de "eucalipto" (ẋ =109,37 ± 41,44 mg AGE/100 g de miel) y a las mieles de "alfalfa" (ẋ =112,03 ± 52,22 mg AGE/100 g de miel). El mismo comportamiento se observó para el contenido de flavonoides, que arrojó los siguientes valores promedio: 3,28 ± 1,13 mg QE/100 g de miel de "tréboles", 3,95 ± 1,29 mg QE/100 g de miel de "eucalipto" y 3,63 ± 0,74 mg QE/100 para mieles de "alfalfa".
Los valores de DDPH (ẋ=42,55 ± 33,19 mg TE/100 g) encontrados coinciden con los informados por González Lorente y col. (20) y superan a los informados por Vela y col. (28). Los antecedentes publicados para TEAC, indican contenidos que oscilan entre 122,06 y 294,5 mg TE/100 g (19) y entre 43,55 y 290 mg TE/100 g (18), en concordancia con lo encontrado en este trabajo (ẋ=102,02 ± 44,69 mg TE/100 g). Para el radical OH, se encontraron valores entre 0,52 y 2,03 mg QE/100g (ẋ=1,34 ± 0,33), coincidentes con lo informado por Rodríguez y col. (29). Los valores obtenidos para FRAC estuvieron entre 2,50 y 98,10 mg AAE/100 g.
El análisis de resultados para "eucalipto" y "tréboles", se muestra en la Figura 2, donde se aprecia que la capacidad antioxidante de las mieles de "tréboles" es inferior a la manifestada por las mieles de "eucalipto". A partir de la matriz que contiene la información de las variables: compuestos fenólicos totales (fenoles), flavonoides totales (flavonoides), FRAC, TEAC y capacidad de captura de los radicales DPPH y OH, las cuales identifican la capacidad de captura de radicales libres y el contenido de compuestos fenólicos, en relación a la capacidad antioxidante de las mieles en estudio, se realizó un Análisis por Componentes Principales (ACP), previa estandarización de los datos. Los valores propios correspondientes a las tres primeras componentes principales (CP) fueron: l1 = 2,34; l2 = 1,19; l3 = 0,78, las cuales explicaron, conjuntamente, el 73% de la variación total de los datos, criterio aceptable para representar con sólo tres nuevas variables latentes la información original. Los coeficientes de las tres primeras CP se muestran en la Tabla 1.
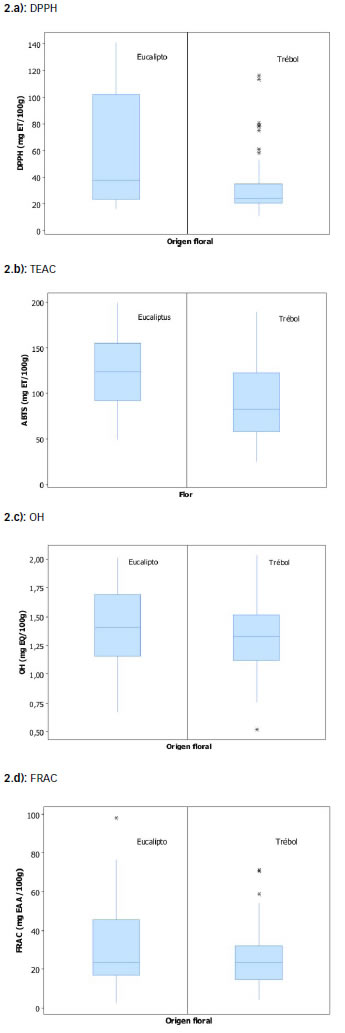
Figura 2: Diagrama de caja y bigotes correspondientes a la capacidad antioxidante de mieles de "eucalipto" y "tréboles", expresadas como a) DPPH, b) TEAC, c) OH y d) FRAC.
Tabla 1: Coeficientes de los tres primeros componentes principales en el ACP sobre los valores de compuestos fenólicos, flavonoides y capacidad de captura de radicales.

En la Figura 3 se indica la distribución de las muestras de miel analizadas en el primer plano factorial. Las mieles de "eucalipto" se orientaron en el mismo sentido que los vectores representativos de fenoles, flavonoides, DPPH y TEAC. Las mieles de "alfalfa" y las de "tréboles", en cambio, no ocuparon el primer cuadrante del plano factorial. El vector representativo de OH se orientó hacia el segundo cuadrante del plano factorial y no contribuyó a discriminar este conjunto de mieles. La capacidad de captura del radical OH no mostró correlación con los demás parámetros determinados para establecer la capacidad antioxidante. Esto podría indicar que el mecanismo de la reacción de captura de OH es diferente a las reacciones de transferencia de electrones o que este parámetro no depende del contenido de compuestos fenólicos y flavonoides, como sí ocurre con DPPH y TEAC.

Figura 3: Distribución de las muestras de mieles de "tréboles","eucalipto" y "alfalfa" en el primer plano factorial, según compuestos fenólicos, flavonoides y capacidad de captura de radicales libres.
La relación observada entre el contenido de compuestos fenólicos y la captura de radicales DPPH y ABTS, indica que resulta innecesario llevar a cabo todas estas determinaciones. En cambio, sería suficiente la determinación de compuestos fenólicos, considerando además la ventaja de que la solución de Folin Ciocalteau es estable y se puede adquirir comercialmente, disminuyendo posibles errores analíticos.
Investigadores de la Universidad de Wisconsin propusieron el Índice de Capacidad Antioxidante Relativa (RACI), integrando los métodos de determinación in vivo combinados con TEAC, capacidad de absorbancia del radical oxígeno (ORAC), Índice antioxidante de fenol (PAOXI) y capacidad reductora del ión férrico (FRAC) (30).
Conclusiones
Todas las muestras de miel presentaron capacidad antioxidante distinta de cero, siendo significativamente mayor la manifestada por la miel de "eucalipto". Sin embargo, de acuerdo al contenido de compuestos fenólicos, ninguna representaría una fuente significativa de antioxidantes en la dieta, en relación a la porción de ingesta diaria.
Resulta necesario aunar criterios respecto a los ensayos para la determinación de capacidad antioxidante in vitro y adoptar uno o varios métodos combinados, como estándar. Una alternativa de interés sería evaluar la capacidad antioxidante determinando compuestos fenólicos totales, captura del radical OH u otra ROS y monitorear la etapa inicial de la peroxidación lipídica, con la decoloración del beta caroteno; como alternativa que combina las tres modalidades de los ensayos propuestos para la determinación de la capacidad antioxidante in vitro.
1. Blasa, M.; Candiaracci, M.; Accorsi, A.; Piacentini, M. y Piatti, E., Honey flavovoids as protection agents against oxidative damage to human red blood cells, Food Chemistry 104: p. 1635-1640. 2007. [ Links ]
2. Martínez Florez, S.; González Gallego, J.; Culebras, J.M. y Tuñon, M.J., Los flavonoides: propiedades y sus acciones antioxidantes, Nutr. Hosp. XVII (6): p. 271-278. 2000. [ Links ]
3. Tomás Barberán, F.A.; Martos, I.; Ferreres, F.; Radovic, B.S. y Anklam, E., HPLC flavonoid profiles as markers for the botanical origin of European unifloral honeys, Journal of the Science of Food and Agriculture 81: p. 485-496. 2001. [ Links ]
4. Ciappini, M.C. y Stoppani, F., Composición fenólica de mieles de eucalipto, trébol y alfalfa, en: Avances en Análisis Fisicoquímicos y Sensoriales, Wunderlin y Borneo Editores, Córdoba, Argentina, p. 408-418. 2009. [ Links ]
5. Pérez, R.A.; Iglesias, M.T.; Pueyo, E.; González, M. y de Lorenzo, C., Amino acid composition and antioxidant capacity of Spanish honeys, J. Agric. Food. Chem. 42: p. 360- 365. 2007. [ Links ]
6. Xianli Wu; Beecher, G.; Holden, J.; Haytowitz, D.; Gebhartdt, S. y Prior, P., Lipophilic and Hidrophilic Antioxidant Capacities of common foods in the United States, J. Agric. Food Chem. 52: p. 4026-4037. 2004. [ Links ]
7. Gómez Caravaca, A.; Gómez Romero, M.; Marraez Román, D.; Segura Carretero, A. y Fernández Gutiérrez, A., Advances in the analysis of phenolic compounds in products derived from bees, Journal of Pharmaceutical and Biomedical Analysis 41: p. 1220-1234. 2006. [ Links ]
8. Louveaux, J.; Maurizio, A. y Vorwohl, G., Methods of Melissopalynology, Bee World 59: 139-157. 1978. [ Links ]
9. SAGP yA. Secretaría de Agricultura, Ganadería, Pesca y Alimentación. Resolución 274/95. Tipificación por origen botánico (Modificación de la Res. SAGPyA 1051/94). Disponible en http://www.alimentosargentinos.gov.ar/0-3/apicola, consultado: 12/12/10. [ Links ]
10. Fagúndez, G.A. y Caccavari, M.A., Pollen analysis of honeys from the central zone of the Argentine province of Entre Rios, Grana 45: p. 305-320. 2006. [ Links ]
11. Singleton, V.L.; Orthofer, R. y Lamuela-Raventos, R.M., Analysis of total phenol and other oxidation substrates and antioxidants by means of Folin-Ciocalteau reagent, Methods in Enzymology 299: p. 152-178. 1999. [ Links ]
12. Woisky, R. y Salatino, A., Analysis of propolis: some parameters and procedures for chemical quality control, J. Apic. Res. 37: p. 99-105. 1998. [ Links ]
13. Brand-Williams, W.; Cuvelier, M.E. y Berset, C., Use of free radical method to evaluate antioxidant activity, Lebensmitt. Wissenschaft and Technologie 28: p. 25-30. 1995. [ Links ]
14. Arnao, M.B.; Cano, A. y Acosta, M., The hydrophilic and lipophilic contribution to total antioxidant activity, Food Chemistry 73: p. 239-244. 2001. [ Links ]
15. Benzie, I.F.F. y Strain, J.J., The ferric reducing ability of plasma (FRAP) as a measure of antioxidant power: the FRAP assay, Analytical Biochemistry 239: p. 70-76. 1996. [ Links ]
16. Halliwell, B.; Gutteridge, J. y Aruoma, O., The desoxyrribosa method: a simple test tube assay for determination of rate constants for reactions of hydroxyl radicals, Anal. Biochem. 165: p. 215-219. 1987. [ Links ]
17. Meda, A.; Lamien, C.; Romito, M.; Millongo, J. y Nacoulma, O., Determination of the total phenolic, flavonoid and proline contents in Burkina Fasan Honey, as well as their radical scavening activity, Food Chemistry 91: p. 571-577. 2005. [ Links ]
18. Vit, P.; Gutiérrez, M.G.; Titera, D.; Vendar, M. y Rodríguez Malaver, A.J., Mieles checas categorizadas según su capacidad antioxidante, Acta Bioquím. Clin. Latinoam. 42 (2): p. 237-244. 2008. [ Links ]
19. Álvarez Suárez, A.; Tulipán, J.; Romandini, S.; Bompadre, S.; Vidal, A. y Battino, M., Determinación de la capacidad antioxidante total en mieles de abeja por el método FIA ABTS. Proceedings Congreso de Apicultura, La Habana, Cuba, p. 33. 2009. [ Links ]
20. Gonzalez Lorente, M.; De Lorenzo, C. y Perez Martin, R.A. Sensory attributes and antioxidant capacity of spanish honeys, Journal of Sensory Studies 23: p. 293-302. 2008. [ Links ]
21. Otilia, B.; Socaciu, C.; Marghitas, L. y Dezmirean, D., Correlation between total phenols, flavonoids, colour intensity and botanical origin of some honeys from Transylvania Region, Prospects of the Agriculture of the 3rd millennium Science, Rumania. 2005. [ Links ]
22. Muñoz, O. y Copaja, S., Contenido de flavonoides y compuestos fenolicos de mieles chilenas e indice antioxidante, Quim Nova 30: p. 848-851. 2007. [ Links ]
23. Won Lee, K.; Jun Kim, Y.; Joo Lee, H.; Yong Lee, C., Cocoa has more phenolic phytochemicals and higher antioxidant capacity than teas and red wine, J. Agricul. Food Chem. 41: p. 792-795. 2003. [ Links ]
24. Bogdanov, S.; Jurendic, T.; Sieber, R.; Gallman, P., Honey for Nutrition and Health: a Review, American Journal of the College of Nutrition 27: p. 677-689. 2008. [ Links ]
25. Baltrusaityt, V.; Venskutonia, P.R. y Ceksteryt, V., Radical scavenging activity of different floral origin honey and beebread phenolic extracts, Food Chemistry 101: p. 502-514. 2007. [ Links ]
26. Martos, I.; Cossetini, M.; Ferreres, F. y Tomas Barberan, F.A., J. Agric Food Chem. 45: p. 2824-2829. 1997. [ Links ]
27. Yao, L.; Jiang, Y.; Singanusong, R.; Darcy, B.; Datta, N.; Caffin, N. y Raymond, K., Flavonoids in Australian Maleluca, Guioa, Lophostemosn, Banskia and Helianthus honeys and their potencial for floral authentication, Food Research International 37 (2): p. 166-174. 2004. [ Links ]
28. Vela, L.; de Lorenzo, C. y Perez, R.A., Antioxidant capacity of Spanish honeys and its correlation with some physicochemical parameters and poliphenolic content, J. Sci. Food Agric. 87: p. 1069-1075. 2007. [ Links ]
29. Rodríguez, A.; Pérez, E. y Vit, P., Capacidad antioxidante de mieles venezolanas de los géneros Apis, Melipona y Tetragonisca, evaluados por tres métodos, INHRR, 38(2): p. 30-34. 2007. [ Links ]
30. Honzel, D.; Carter, S.G.; Redman, K.A.; Schauss, A.G.; Endres, J.R. y Jensen, G.S., Comparison of chemical and cell-based antioxidant methods for evaluation of foods and natural products: generating multifaceted data by parallel testing using erythrocytes and polymorphonuclear cells, J. Agric. Food. Chem 56: p. 8319-8325. 2008. [ Links ]
Recibido: 22/06/2012
Aprobado: 23/12/2012














