Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.38 n.3 Ciudad Autónoma de Buenos Aires jul./sep. 2006
Detección de Mycoplasma suis en casos clínicos de síndrome del desmedro multisistémico posdestete en porcinos
N. B. Pereyra1,3*, J. E. Sarradell2, F. D. Cane3, S. E. Francois1, C. L. Pidone1, E. R. Comba1, F. Rodríguez4, A. A. Guglielmone5
1Cátedra de Microbiología, 2Cátedra de Patología General, Anatomía y Fisiología Patológicas, Facultad de Ciencias Veterinarias, Universidad Nacional de Rosario - Bv. O. Lagos y Ruta Nac. 33 (2170) Casilda, Argentina; 3Instituto de Porcinotecnia, Ministerio de la Producción de la Pcia. de Santa Fe - Ruta Prov. 93 Km 99, (2643) Chañar Ladeado, Argentina; 4Departamento de Morfología, Facultad de Veterinaria, Universidad de Las Palmas de Gran Canaria, Las Palmas, España; 5Estación Experimental Agropecuaria Rafaela, Instituto Nacional de Tecnología Agropecuaria - CC 22 (2300) Rafaela, Argentina.
*Correspondencia. E-mail:npereyra@futurnet.com.ar
RESUMEN
Mycoplasma suis es un parásito obligado de los eritrocitos del cerdo. Produce anemia aguda o crónica y afecta a distintas categorías de animales. El síndrome del desmedro multisistémico posdestete (PMWS) se considera causado por el circovirus porcino tipo 2 (PCV-2), aunque muchos aspectos de la patogenia del síndrome permanecen sin aclarar. Se manifiesta a través de retraso del crecimiento, anemia e ictericia en cerdos de 5 a 12 semanas de edad, en los que se produce una inmunosupresión que deriva en coinfecciones bacterianas. Se estudiaron tres granjas porcinas con sintomatología asociada a la presencia de estos dos agentes etiológicos. Se observaron formas compatibles con M. suis en extendidos de sangre y en lesiones histopatológicas indicativas de PMWS, en cortes de tejidos. Esta es la primera comunicación acerca de la asociación clínica entre las dos entidades mencionadas.
Palabras clave: Mycoplasma suis, PMWS, PCV-2, Eperythrozoon suis, coinfección
ABSTRACT
Detection of Mycoplasma suis in clinical cases with postweaning multisystemic wasting syndrome in swine. Mycoplasma suis is a swine erythrocyte obligatory parasite. Its presence may result in chronic or acute anaemia in different pig categories. It is considered that the postweaning multisystemic wasting syndrome (PMWS) is caused by porcine circovirus type 2, but some aspects of the pathogenesis remain unknown. PMWS signs are impaired weight gain, anaemia and jaundice in 5 to 12 week-old pigs that suffer from immunosuppression and bacterial co-infections. The pigs with signs of these diseases on three porcine farms were studied. Compatible M. suis forms in blood smears and typical PMWS lesions in tissue cuts were seen. This is the first communication of the clinical association between these two entities.
Key words: Mycoplasma suis, PMWS, PCV-2, Eperythrozoon suis, co-infection
Mycoplasma suis, antes Eperythrozoon suis, es una bacteria pequeña y pleomófica, parásito obligado de los eritrocitos porcinos, imposible de cultivar en medios artificiales. Actualmente integra un grupo dentro de los micoplasmas conocido como hemoplasmas, los que poseen características patogénicas antes no consideradas entre los mollicutes (2, 3, 4).
La eperitrozoonosis porcina se caracteriza por producir anemia aguda o crónica y se manifiesta por 4 síndromes: 1- fallas reproductivas en cerdas; 2- debilidad en lechones recién nacidos, con mayor incidencia de problemas respiratorios y digestivos; 3- inadecuada conversión alimenticia en recría y terminación; 4- disnea y muerte en recría y terminación (1). Esta patología fue reconocida en la Argentina en 1985 (8) pero los casos clínicos comunicados son escasos, a pesar de que se determinó que el 65% de 285 cerdos estudiados por PCR estaban infectados (7). Este dato hace sospechar que M. suis es un microorganismo endémico en la población porcina del país. La aparición de la clínica en animales infectados depende, como en otras infecciones por hemoplasmas, de la edad, de la existencia de enfermedades concurrentes y del grado de inmunosupresión o esplenectomía (1, 2, 3).
El síndrome del desmedro multisistémico posdestete (PMWS o postweaning multisystemic wasting syndrome) se considera causado por el circovirus porcino tipo 2 (PCV-2), aunque ciertos aspectos de la patogenia permanecen sin aclarar. El PMWS se caracteriza por el adelgazamiento progresivo, la palidez, la ictericia y el aumento en el tamaño de los linfonódulos, en animales de 5 a 12 semanas de edad (14). Los enfermos se inmunosuprimen y ciertos microorganismos presentes en la granja, normalmente no patógenos, pasan a ser importantes (5, 6, 9, 10, 13). Los hallazgos histopatológicos en linfonódulos, bazo, tonsilas, placas de Peyer, riñones, pulmón, hígado e intestinos son característicos, con presencia de células tipo histiocitario, que muchas veces presentan múltiples cuerpos de inclusión citoplasmáticos, células gigantes multinucleadas y depleción linfocitaria (12, 14).
En la Argentina, el PMWS fue diagnosticado en 2002 (11). Hoy se considera al PCV-2 como un patógeno emergente en nuestro medio (12), aunque no existe información suficiente referida a la extensión y a las características de la presentación del síndrome. El objetivo de este estudio es describir casos clínicos en donde el M. suis y el PMWS se manifiestan en forma conjunta.
Estudio de los casos: se obtuvieron datos clínicos y epizootiológicos de tres granjas porcinas: G1 (engorde de 800 animales alojados en pistas superpobladas), G2 y G3 (criaderos al aire libre, de 150 madres y ciclo completo). Anatomopatología: se necropsiaron 2 animales provenientes de G1, 6 de G2 y 3 de G3. Hematología: se sangraron animales de las tres granjas antes del sacrificio para realizar microhematocritos y frotis que se colorearon con May Grünwald-Giemsa y se observaron con objetivo de inmersión. Bacteriología: se cultivó material de pulmón, hígado, bazo, riñón, SNC y líquidos cavitarios en agar sangre ovina al 10% (con factor V, en el caso de pulmón) y en Mac Conkey, a 37 °C, en aerobiosis, por 24 a 48 horas, utilizando pruebas convencionales para la identificación. Histopatología: muestras de linfonódulos, tonsilas, placas de Peyer, pulmón, corazón, bazo, hígado, riñón e intestino se fijaron en formol tamponado al 10% por 24 a 48 horas y se obtuvieron cortes de 4 a 5 ?m que se colorearon con hematoxilina-eosina.
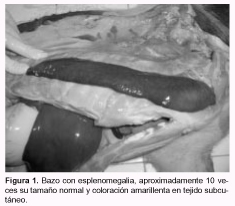
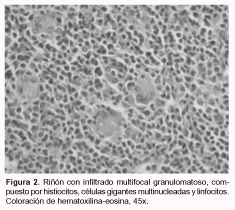
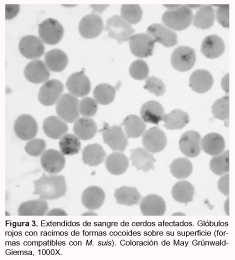
En las 3 granjas se observaron animales de 20 a 25 kg de peso con enflaquecimiento, disnea, debilidad y coloración amarillenta en la piel. En la mayoría, el curso fue agudo pero en todas las granjas se observaron también casos sobreagudos. En promedio para G1, G2 y G3, la morbilidad fue del 4%, la mortalidad del 3% y la letalidad del 70%. Anatomopatología: se destacó en todos los animales la coloración amarillento-verdosa de la conjuntiva ocular, de la piel, de los grandes vasos (aorta y arteria pulmonar) y del tejido subcutáneo; también se observó esplenomegalia (aproximadamente 10 veces el tamaño normal) (Figura 1); hígado pardo-amarillento; riñones con manchas blanquecinas diseminadas por la superficie, de 2 a 10 mm, con el borde difuso y en algunos casos sobreelevadas en su centro; aumento del tamaño de linfonódulos superficiales y profundos; sangre pálida y acuosa; hidrotórax, hidropericardio y ascitis leves a moderadas; estómago sin contenido; ausencia de colapso pulmonar con aumento difuso y generalizado de la coloración del parénquima, que al corte rezumaba líquido seroso a serosanguinolento, y presencia de abundante espuma blanquecina en las vías aéreas. En los cerdos de G1 se observó un área hepatizada y con fibrina en dorsal del lóbulo pulmonar diafragmático (unilateral en ambos animales), y en 2 de los animales de G3, áreas de consolidación grisácea en lóbulos apicales, adherencias pleurales y abscesos pulmonares diseminados. Hematología: los valores de hematocrito fueron inferiores a lo normal (20 a 28%) en los animales con sintomatología. Se observaron cuerpos cocoides de aproximadamente 0,3 µm de diámetro y, en menor cantidad, formas anillares de aproximadamente 0,8 µm, agrupadas en cadenas simples o en acúmulos de muchos elementos sobre la superficie de los eritrocitos (Figura 3). No se observaron reticulocitos u otras formas inmaduras de eritrocitos. Bacteriología: se aisló Actinobacillus pleuropneumoniae en G1 y Salmonella spp. a partir de las lesiones pulmonares en G3. El aislamiento fue negativo en G2. Histopatología: en los linfonódulos se observó una severa depleción linfocitaria en las áreas interfoliculares, y en los centros foliculares se observaron restos de células en vías de necrosis o cariorrexis, infiltrados de células de tipo histiocitario y células gigantes multinucleadas. En pulmón se detectó neumonía broncointersticial de grados variables, con infiltrado linfohistiocitario peribronquial extensivo a los septos interalveolares circundantes y llenado alveolar con presencia de macrófagos alveolares. En bazo se vio congestión y depleción linfocítaria. En la región cortical del riñón se observó un moderado infiltrado granulomatoso de tipo intersticial multifocal, compuesto por linfocitos, células tipo histiocitario y células gigantes multinucleadas (Figura 2).
Las formas observadas en los extendidos de sangre se consideraron prueba de la presencia de M. suis (2, 3), y las lesiones histopatológicas como correspondientes a un cuadro de PMWS (12, 14).
El diagnóstico de una infección por M. suis se basa en la observación directa de extendidos de sangre coloreados, aunque los resultados falsos negativos son comunes por esta técnica. Ello se debe a que las parasitemias son transitorias en las formas agudas, y en las crónicas las bacterias son muy escasas (2, 3). El diagnóstico definitivo requiere de la inoculación de sangre sospechosa en cerdos esplenectomizados, para reproducir la enfermedad (1), o de la técnica de PCR (2), aunque en ambos casos un resultado positivo no distingue entre animales portadores y enfermos, ya que el germen estaría ampliamente distribuido en la población (7). Así, la observación de formas compatibles en extendidos de sangre sigue siendo el diagnóstico de rutina. Probablemente a causa de estas dificultades, la enfermedad permanezca subdiagnosticada.
En los casos estudiados, las lesiones histopatológicas de linfonódulos, bazo, riñón, pulmón e hígado se consideraron características del PMWS (12, 14). No obstante, sería importante realizar la confirmación definitiva por inmunohistoquímica o hibridización in situ.
Se acepta que existe asociación entre las infecciones por hemoplasmas y las enfermedades virales, neoplásicas e inmunomediadas. En el gato, el hemoplasma Mycoplasma haemofelis actúa sinérgicamente con retrovirus como el de la inmunodeficiencia felina y el de la leucemia felina, en este último caso favoreciendo la transformación neoplásica de células hematopoyéticas; además, la coinfección entre el virus de la leucemia felina y el hemoplasma Candidatus Mycoplasma haemominutum conducen a una anemia más severa (2, 3). En cerdos, se ha observado una mayor frecuencia de casos de M. suis en criaderos con peste porcina clásica, con síndrome respiratorio y reproductivo, con influenza y con pseudorrabia (1, 2). En los casos estudiados no se encontraron eritrocitos inmaduros en los frotis, tal como se describe en las anemias hemolíticas producidas por M. suis, lo que podría ser consecuencia de la presencia concomitante de una anemia arregenerativa.
Este estudio comunica por primera vez la coexistencia de M. suis y PMWS en casos de campo. Considerando que ambos agentes son ubicuos, que los factores desencadenantes de la clínica serían comunes para ambos y que los animales afectados con PMWS se encuentran inmunosuprimidos (1, 2 10, 15), M. suis y el PMWS pueden manifestarse al mismo tiempo en una granja; inclusive existiría la posibilidad de que esta asociación produzca cuadros clínicos más severos. Es importante, entonces, confirmar la presencia de M. suis en casos de PMWS e incluir en la antibioticoterapia que se instaura para paliar las infecciones secundarias, drogas efectivas contra este agente.
BIBLIOGRAFÍA
1. Heinritzi K. Eperitrozoonosis. En: Straw BE, D'Allaire S, Mengeling WL, Taylor DJ, editores. Enfermedades del Cerdo. Buenos Aires, Intermédica, 2000, p. 363-7. [ Links ]
2. Messick J. Hemotrophic mycoplasmas (hemoplasmas): a review and new insights into pathogenic potencial. Vet Clin Pathol 2004; 33: 2-13. [ Links ]
3. Neimark H, Johansson K-E, Rikihisa Y, Tully JG. Proposal to transfer some members of the genera Haemobartonella and Eperythrozoon to the genus Mycoplasma with descriptions of "Candidatus Mycoplasma haemofelis", "Candidatus Mycoplasma haemomuris", "Candidatus Mycoplasma haemosuis" and "Candidatus Mycoplasma wenyonii". Int J Syst Evol Microbiol 2001; 51: 891-9. [ Links ]
4. Neimark H, Johansson K, Rikihisa Y, Tully J. Revision of haemotrophic Mycoplasma species names. Int J Syst Evol Microbiol 2002; 52: 683. [ Links ]
5. Núñez A, McNeilly F, Perea A, Sánchez-Cordon PJ, Huerta B, Allan G, et al. Co-infection by Cryptosporidium parvum and porcine circovirus type 2 in weaned pigs. J Vet Med B Infect Dis Vet Public Health 2003; 50: 255-8. [ Links ]
6. Pallares F, Halbur P, Opriessnig T, Sorden S, Villar D, Janke B, et al. Porcine circovirus type 2 (PCV-2) coinfections in US field cases of postweaning multisystemic wasting syndrome (PMWS). J Vet Diagn Invest 2002; 14: 515-9. [ Links ]
7. Pereyra N, Messick J, Cane F, Pereda A, Blum M, Guglielmone A. Prevalencia de la infección por el hemoplasma Mycoplasma suis en Argentina. Decimonoveno Congreso Panamericano de Ciencias Veterinarias, 2004, Resumen 510, Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
8. Pereyra N, Cane F, Guglielmone A. Epizootiología, patología y patogenia de la infección por Mycoplasma suis (antes Eperytrozoon suis). Segundo Cursillo de Actualización sobre Enfermedades Emergentes del Cerdo, 2004, p. 69-76, La Plata, Argentina. [ Links ]
9. Rodríguez-Arrioja G, Segalés J, Rosell C, Quintana J, Ayllon S, Camprodon A, et al. Aujeszky's disease virus infection concurrent with postweaning multisystemic wasting syn-drome in pigs. Vet Rec 1999; 144: 152-3. [ Links ]
10. Rose N, Larour G, Le Diguerher G, Eveno E, Jolly J, Blanchard P, et al. Risk factors for porcine post-weaning multisystemic wasting syndrome (PMWS) in 149 French farrow-to-finish herds. Prev Vet Med 2003; 61: 209-25. [ Links ]
11. Sarradell J, Pérez A, Andrada M, Rodríguez F, Fernández A, Segalés J. PMWS in Argentina. Vet Rec 2002; 150: 323. [ Links ]
12. Sarradell J, Pérez A, Comba E, Pereyra N, Anthony L, Andrada M, et al. Hallazgos patológicos en cerdos afectados con el Síndrome del Desmedro Multisistémico Postdestete de la República Argentina. Rev Argent Microbiol 2004; 36: 118-24. [ Links ]
13. Segalés J, Collell M, Jensen H, Blanco J, Domingo M. Pulmonary aspergillosis in a postweaning multisystemic wasting syndrome (PMWS) affected pigs. Pig J 2003; 52: 41-7. [ Links ]
14. Segalés J, Domingo M. Postweaning multisystemic wasting syndrome (PMWS) in pigs. A review. Vet Q 2002; 24: 109-24. [ Links ]
15. Segalés J, Domingo M, Chianini F, Majo N, Domínguez J, Darwich L, et al. Immunosuppression in postweaning multisystemic wasting syndrome affected pigs. Vet Microbiol 2004; 98: 151-8. [ Links ]
Recibido: 13/6/05
Aceptado: 4/9/06














