Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ameghiniana
versión On-line ISSN 1851-8044
Ameghiniana v.42 n.4 Buenos Aires sept./dic. 2005
Asociaciones de ostrácodos modernos del estuario de Bahía Blanca, Buenos Aires, Argentina
Dina Elsa Martínez 1
1 Universidad Nacional del Sur. Departamento de Geología. San Juan 670, 8000 Bahía Blanca. dinamart@criba.edu.ar
Resumen. Se analizan las asociaciones de ostrácodos obtenidas de sedimentos superficiales del canal Tres Brazas del estuario de Bahía Blanca. La distribución de las biocenosis y tanatocenosis autóctonas permitió determinar distintos hábitats. Las especies desarrolladas en las planicies de marea son Loxocythere variasculpta , Neocytherideis ruidis , Cyprideis salebrosa hartmanni , Leptocythere darwini ?, Cytherura dimorphica , Frenguellicythere argentinensis y Paracytherois sp. n. En áreas submareales se reconocen Callistocythere litoralensis , Hemicytherura escobasensis , Cytheretta punctata , Cornucoquimba lutziana , Semicytherura rugosoreticulata y Hemicytherura chuiensis . La composición faunística y las variaciones cuantitativas de los ostrácodos pueden relacionarse con la topografía, sedimentología, vegetación y variaciones de salinidad en las planicies de marea mientras que, en las áreas submareales, la energía constituye el factor más importante. La distribución cuantitativa de los ostrácodos alóctonos muestra las abundancias relativas más altas en los depósitos de canal, reflejando la hidrodinámica ambiental. El flanco erosivo del canal está caracterizado por una paleotanatocenosis originada en depósitos de planicies de marea más antiguos.
Abstract.Modern ostracod assemblages from the Bahía Blanca estuary, Buenos Aires, Argentina . This paper deals with the ostracod assemblages recovered from superficial sediments of the Tres Brazas Channel of Bahía Blanca Estuary. The distribution of biocoenosis and autochthonous thanatocoenosis allowed to recognize different habitats. The species developed in tidal flats are Loxocythere variasculpta , Neocytherideis ruidis , Cyprideis salebrosa hartmanni , Leptocythere darwini ?, Cytherura dimorphica , Frenguellicythere argentinensis and Paracytherois sp. n. In subtidal areas Callistocythere litoralensis , Hemicyherura escobasensis , Cytheretta punctata , Cornucoquimba lutziana , Semicytherura rugosoreticulata and Hemicytherura chuiensis were recognized. The faunal composition and quantitative variations of the ostracods can be correlated with the topography, sedimentology, vegetation and variations of salinity in the tidal flats, whereas the energy is the most important factor in subtidal areas. The quantitative distribution of allochthonous ostracods shows highest relative abundances in sediments from the channel, reflecting the environmental hydrodynamic. The erosive flank of the channel is characterized by paleothanatocoenosis originated in ancient tidal flat deposits.
Key words. Modern ostracods; Environmental factors; Bahía Blanca estuary; Buenos Aires; Argentina.
Palabras clave. Ostrácodos modernos; Factores ambientales; Estuario de Bahía Blanca; Buenos Aires; Argentina.
Introducción
Los ostrácodos son microcrustáceos con caparazón calcáreo, fundamentalmente bentónicos. Poseen un amplio espectro ecológico ya que habitan en ambientes de agua dulce, salobres, marinos e hipersalinos. Son organismos muy sensibles a los cambios ambientales y, por otra parte, los requerimientos ecológicos de las especies no se alteran significativamente a través del tiempo (van Harten, 1988). Estas características facilitan la aplicación de una metodología actualista, que toma como base el conocimiento de las poblaciones modernas para las reconstrucciones paleoambientales.
Whatley y Moguilevsky (1975), Whatley et al. ( 1987, 1988, 1995, 1997 y 1998) estudiaron la ostracofauna marina reciente de varias localidades del litoral y de la plataforma argentina y consideraron, además del análisis sistemático, algunos aspectos ecológicos y, asimismo, biogeográficos a gran escala.
En el presente trabajo se realizó un estudio cualicuantitativo de las asociaciones de ostrácodos modernos provenientes de sedimentos superficiales del estuario de Bahía Blanca. El área de estudio comprende a un canal tributario de tercer orden del canal Tres Brazas (38º 54' LS y 62º 25' LO), denominado Tierra Firme (figura 1). Este área fue seleccionada por ser morfológicamente representativa de los sectores internos del estuario y por estar minimizados los efectos contaminantes de las tareas de dragado, realizadas en el sector externo del estuario. Cusminsky et al. (1995) realizaron un análisis sedimentológico y estudiaron los foraminíferos, diatomeas y palinoformos provenientes de las muestras de superficie tratadas en este estudio.

Figura 1. Canal Tres Brazas. Mapa de ubicación / Tres Brazas Channel. Location map.
Este trabajo forma parte de un estudio más amplio que comprende, además, a los sedimentos holocenos de distintos sitios del estuario de Bahía Blanca (Bertels y Martínez, 1990, 1997; Gómez et al. , 1992, 2000; Guerstein et al. , 1992 y Martínez, 2002).
El objetivo de este estudio es la caracterización ostracodológica de las muestras de depositación actual para facilitar la interpretación del origen de los sedimentos portadores de ostrácodos fósiles. Para determinar la distribución de los ostrácodos modernos en los distintos ambientes del área de estudio, se analiza la estructura de las poblaciones, como asimismo, la composición taxonómica, diversidad y abundancia de las biocenosis y tanatocenosis. Además, se evalúan las modificaciones post mortem de las tanatocenosis y se reconoce una paleoasociación en el área.
Este trabajo representa el primer aporte al conocimiento de la ostracofauna moderna del estuario de Bahía Blanca y constituye una primera contribución para Argentina al estudio de la distribución local de la ostracofauna relacionada con algunos factores ambientales en un ambiente marino marginal dominado por mareas. La información provista en este estudio constituye una herramienta particularmente útil para la interpretación paleoambiental de depósitos del Cuaternario, a partir de las asociaciones de ostrácodos.
Características generales del área
El estuario de Bahía Blanca es un estuario mesomareal formado por una densa red de canales de diversas dimensiones y orientados en dirección NO-SE. Estos canales tienen cauces sinusoidales separados por islas y extensas llanuras de marea compuestas, en general, por sedimentos limoarcillosos. Las islas presentan las comunidades vegetales típicas de la estepa halófila (Verettoni, 1961; Verettoni y Aramayo, 1976). Las planicies de marea, en las áreas topográficamente más altas están cubiertas por una densa vegetación de Spartina , mientras que las áreas más bajas no presentan cobertura vegetal.
Los vientos característicos de la región provienen del noroeste y norte y en menor medida del sur y suroeste. Los primeros, de mayor frecuencia e intensidad, fluyen paralelos a los canales mayores afectando la circulación y la mezcla vertical de las aguas. Las olas oceánicas, salvo situaciones de fuertes sudestadas, no penetran en la parte interior del estuario y sólo tienen influencia en las costas y bancos de la zona exterior (Piccolo et al. , 1987).
El canal principal está ubicado en el extremo norte del estuario y su longitud es de algo más de 60 km; posee una configuración en embudo, presentando un ancho máximo en su cabecera de 200 m y de 3 a 4 km en su desembocadura; su profundidad media es de 10 m. El aporte de agua dulce lo proporciona principalmente el río Sauce Chico y el arroyo Napostá Grande. Ambos afluentes descargan en la cabecera del estuario una media anual de 1,9 y 0,8 m3/s, respectivamente (Piccolo et al. , 1987).
El canal Tres Brazas es uno de los canales más largos que desemboca en el canal principal. El mismo no presenta descarga de agua dulce y su circulación es totalmente mareal dominante. Se caracteriza por ser altamente sinuoso y por poseer numerosos canales tributarios que drenan las planicies de marea; entre ellos está Tierra Firme que se une al canal Tres Brazas, aproximadamente a 2,5 km de su desembocadura (Ginsberg y Perillo, 1990).
Las variaciones longitudinales de temperatura a lo largo del canal principal presentan una distribución homogénea, siendo aún menores los gradientes batimétricos de temperatura, salvo en los sectores asociados a la desembocadura de arroyos (Piccolo et al. , 1987). Las temperaturas oscilan entre 6,8ºC-9,5ºC en invierno y entre los 21,5ºC-25,7ºC durante el verano, con un patrón de ascenso y descenso suave (Marcovecchio et al. , 2000).
Las salinidades son verticalmente homogéneas, excepto en los sectores asociados a la desembocadura de arroyos, donde las aguas presentan una estratificación marcada (Piccolo et al. , 1987). La distribución longitudinal de la salinidad en el canal principal presenta un patrón homogéneo, salvo en las cabeceras del estuario donde se registran concentraciones de salinidades más bajas. Durante el período 1990-2000 se realizaron registros estacionales de salinidad, a lo largo de dicho canal, que oscilaron entre 32 y 37, mientras que en la desembocadura del río Sauce Chico, variaron entre 23-25. Estos datos son coincidentes con los valores obtenidos entre 1979-1981 (Marcovecchio et al. , 2000). Cerca de la desembocadura del canal Tres Brazas las salinidades varían entre 36 y 33 (Marcovecchio et al. , 1997 y 2000).
Montessarchio y Lizasoain (1981) y Picollo et al. (1987) registraron las diferencias de salinidades entre bajamar y pleamar en varias estaciones del sector interno del canal principal durante 1979 y 1980; estos valores no superan el 3 , excepto en la desembocadura del río Sauce Chico donde la variación de salinidad alcanzan el 7. En el canal Tierra Firme durante 1980 (primavera), Montessarchio y Lizasoain (1981) determinaron una diferencia de salinidad entre bajamar y pleamar de 1 (33,60y 32,60 ).
Materiales y métodos
El presente estudio está basado en muestras colectadas el 16 de abril de 1991, en la porción meandriforme del interior del canal tributario Tierra Firme, a lo largo de una transecta perpendicular a dicho canal (figura 2). Este muestreo se realizó durante la bajamar para facilitar la toma de muestras en las planicies de marea. El límite entre el flanco de acreción y de erosión se determinó a partir del estudio batimétrico y sedimentológico (Cusmnisky et al. , 1995). Previo al muestreo, se realizó un perfil batimétrico transversal al canal con una sonda ecográfica Raytheon de 719B, que permitió diferenciar el flanco erosivo, con presencia de escarpas funcionales sobre la barranca de la isla y el flanco acrecional constituido por planicies bajas de marea.

Figura 2. Perfil transversal del canal (Cusminsky et al. , 1995). Ubicación de las muestras y distribución granulométrica de los sedimentos/ Transversal profile of the channel (Cusminsky et al. , 1995). Location of the samples and distribution of grain-size sediments.
Para este estudio se analizaron ocho muestras. Las muestras M1, M2 y MV se obtuvieron manualmente tomando, aproximadamente, 1,5 cm de sedimento superficiales de la planicie de marea. Se recogieron un número de submuestras igual a 10, las que fueron colocadas dentro de una única bolsa de plástico y mezcladas antes de su procesamiento (Mehringer, 1967). Las muestras del canal (Sn1 a Sn5) se obtuvieron mediante un muestreador a mandíbulas Dietz-Lafond y se tomaron los primeros centímetros superiores de sedimento de cada muestra. La muestra MV fue tomada fuera de la transecta, en un sector más interno del canal donde, por la inversión en la curvatura del mismo, el flanco erosivo pasa a ser de acreción con formación de planicie de marea alta sin vegetación y con una fauna de cangrejos muy abundante (figura 1).
Cada una de las muestras obtenidas fue dividida en dos porciones: una parte fue tratada con rosa de Bengala diluida en alcohol etílico para teñir las partes blandas de los ostrácodos vivos y de la fauna acompañante en el momento de la colecta. La otra porción se tomó como referencia para calcular la densidad faunística, es decir el número absoluto de individuos por gramo de sedimento bruto. Para calcular dicho parámetro, previo al secado con estufa a una temperatura de 40ºC, se pesó 50 gramos de sedimento bruto de cada muestra. Este sedimento, una vez seco, fue desagregado con H2 O2 de 130 volúmenes diluida en cuatro partes de H 2 O. Ambas porciones de las muestras fueron lavadas mediante un tamiz con una abertura de malla de 62 µm. Para calcular los valores de frecuencias relativas de las especies, densidad faunística, diversidad e índice de diversidad se consideró a la suma de individuos o especies de ambas porciones.
Se efectuó el recuento, por un lado, de especimenes vivos con las partes blandas teñidas y por el otro, el de individuos muertos con sus valvas y caparazones vacíos teñidos o no. De esta manera se diferenció a las biocenosis o conjunto de especies con individuos vivos de la tanatocenosis o conjunto de poblaciones muertas. Para reconocer las tanatocenosis autóctonas y alóctonas en los distintos ambientes involucrados en este estudio, se calcula la proporción de valvas adultas versus el total de valvas juveniles (Brouwers, 1988).
Con el fin de determinar el grado de estabilidad ambiental, se calculó el índice de diversidad de Shannon-Wiener, basado en la información contenida por un individuo en una población infinita dada por la fórmula:
s
H(S)= -Σ pi. ln pi
i=l
Siendo S es el número de especies en cada muestra y pi la proporcióin de individuos de la especie i, es decir, p=ni/N , donde ni es el número de individuos de la especie i y N es la abundancia total de las especies (Murray, 1973). A partir del estudio de la diversidad de los foraminíferos en ambientes marinos se determina que los índices mayores a 2,5 se relacionan con ambientes marinos normales, mientras que los valores menores indican ambientes marinos más inestables o restringidos, en los cuales los taxones son escasos o bien existen especies dominantes (Buzas y Gibson, 1969; Gibson y Buzas, 1973).
La sistemática utilizada a nivel genérico es la propuesta en Moore y Pitrat (1961), en tanto que para las determinaciones específicas se utilizó literatura especializada, como también para aquellos géneros nuevos propuestos a partir de 1961. La mayoría de las especies identificadas fueron previamente registradas como fósiles en afloramientos del área de estudio y fueron descriptas detalladamente en Bertels y Martínez (1997) y Bertels-Psotka y Martínez (1999).
Lista de especies identificadas
Ilyocypris gibba (Ramdhor, 1808)
Loxocythere variasculpta Whatley et al ., 1997
Cytheretta punctata Sanguinetti, 1979
Grekoffiana australis (Rossi de García, 1969)
Cyprideis salebrosa hartmanni Ramírez, 1967
Cyprideis riograndensis Pinto y Ornellas, 1965
Neocytherideis ruidis Whatley et al ., 1998
Copytus rara Mc Kenzie, 1967
Cushmanidea ? echevarriae Bertels y Martínez, 1997
Minicythere argentinensis Bertels y Martínez, 1997
Papillosacythere parallela Whatley et al ., 1987
Cytherura dimorphica Bertels y Martínez, 1997
Hemicytherura chuiensis Kotzian (en Bertels et al ., 1982)
Hemicytherura lapillata Whatley et al ., 1988
Hemicytherura escobasensis Bertels-Psotka y Laprida, 1998
Oculocytheropteron macropunctatum Whatley et al ., 1988
Semicytherura rugosoreticulata Whatley et al ., 1988
Loxoreticulatum dictyotos Whatley et al ., 1988.
Frenguellicythere argentinensis Bertels-Psotka y Martínez, 1999
Caudites ohmerti Coimbra y Ornellas, 1987
Patagonacythere tenuireticulata (Kotzian) (en Bertels et al ., 1982)
Cornucoquimba lutziana Zabert, 1978
Ambostracon ( Ambostracon ) bertelsae (Sanguinetti) (en Whatley et al. , 1998)
Leptocythere darwini ? Whatley et al., 1998
Callistocythere litoralensis (Rossi de García, 1966)
Callistocythere dispersocostata Hartmann, 1962
Callistocythere rioplatensis Whatley et al ., 1998
Limnocythere sp.
Loxoconcha paranensis Rossi de García, 1966
Paracytherois sp. n. (en Bertels y Martínez, 1997)
Pellucistoma elongata Whatley et al ., 1998
Munseyella undulata Whatley et al ., 1997
Munseyella fuegoensis Echevarría, 1987
Keijia patagonica Whatley et al ., 1997
Quadracythere gloriaensis Bertels-Psotka y Laprida, 1998
Xestoleberis sp.
Semixestoleberis debueni Hartmann, 1962
Análisis de la estructura de las poblaciones
Los ostrácodos, como todos los crustáceos, tienen crecimiento discontinuo y generan, a través de su ontogenia, ocho mudas hasta alcanzar la madurez. Por consiguiente, las tanatocenosis de estos organismos están constituidas por valvas adultas y juveniles de diferentes tamaños, formas y pesos que pueden ser removidas selectivamente, antes de ser enterradas (Whatley, 1988).
El hallazgo de poblaciones completas, es decir, con una proporción de adultos/juveniles igual a 1:8 (0,12), solamente ocurre en ambientes con condiciones energéticas adecuadas. Si se considera la dinámica del ambiente estudiado, las tanatocenosis están sujetas a desplazamientos; sin embargo, la presencia de poblaciones con valvas adultas y determinada proporción de valvas juveniles permite establecer que, si bien pudieron haber sido removidas en algún grado, no han sido desplazadas de sus hábitats originales. Este tipo de poblaciones denominadas paraautóctonas (Kidwel et al. , 1986), son consideradas en este trabajo poblaciones autóctonas.
El análisis de la proporción de valvas adultas y valvas juveniles (VA/VJ) de cada una de las especies permitió reconocer las tanatocenosis autóctonas registradas en los distintos hábitats.
En las muestras de las planicies de mareas, la mayoría de las especies presentaron proporciones de VA/ VJ comprendidas entre 1/6 (0,16) y 1/3 (0,33) que reflejan condiciones ambientales de baja energía (Brouwers, 1988). Estas poblaciones están constituidas por sus formas adultas y la mayoría de los estados juveniles o mudas que indican un desplazamiento mínimo (poblaciones del tipo A, Whatley, 1988). Entre ellas, están Loxocythere variasculpta , Neocytherideis ruidis , Cyprideis salebrosa hartmanni , Papillosacythere paralella , Leptocythere darwini ? y Minicythere argentinensis . Otras especies con poblaciones menos desarrolladas, como Cytherura dimorphica , Paracytherois sp. n., Frenguellicythere argentinensis , Copytus rara , Semixestoleberis debueni , Hemicytherura escobasensis y Callistocythere litoralensis , presentan un número menor de valvas juveniles con valores que variaron entre 2/3 (0,66) y 7/3 (2,33). Estas especies, salvo H. escobasensis y C. litoralensis , se hallan casi exclusivamente en los sedimentos de llanura de marea; solamente se registraron una valva de Paracytherois sp. n. y otra de Frenguellicythere argentinensis en los sedimentos submareales. Esto indica que, si las valvas fueron transportadas en suspensión hacia el canal durante la bajamar (Cuadrado et al. , 2000), no se han conservado por destrucción y/o pérdida. Por otra parte, si se tiene en cuenta, tanto la fragilidad como el buen estado de conservación de las valvas de dichas especies, no es factible que hayan sido desplazadas por las corrientes de flujo, desde el canal hacia las planicies, debido a que estas corrientes se caracterizan por transportar material de fondo, especialmente arenoso (Cuadrado et al. , 2000).
Dentro de las poblaciones con baja proporciones de juveniles se hallan especies vivientes, entre ellas, Cytherura dimorphica , Callistocythere litoralensis y Hemicytherura escobasensis (cuadro 1). Es probable que los ejemplares vivos de estas especies y, en general, de las biocenosis halladas en este trabajo, posean filamentos de fijación al sustrato que evitan sus desplazamientos (Whatley, 1988). Por otra parte, la fragilidad y/o el tamaño pequeño de sus caparazones, implican una mayor posibilidad de destrucción o pérdida de los ejemplares juveniles por transporte, como asimismo, la pérdida de valvas muy pequeñas (< 62 µm) durante el lavado de las muestras con tamiz. Por estas razones, las especies con baja proporción de juveniles son consideradas autóctonas de la planicie de marea.
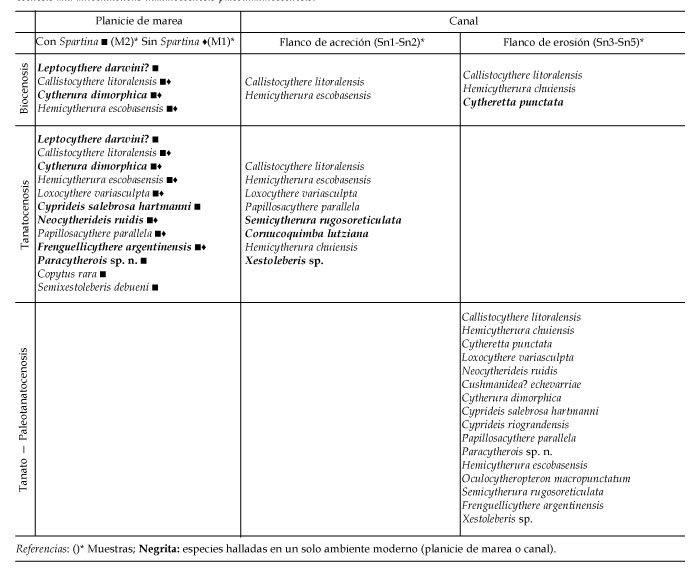
Cuadro 1. Distribución ambiental de las biocenosis y tanatocenosis-paleotanatocenosis autóctonas/ Environmental distribution of the biocoenosis and autochthonous thanatocoenosis-paleothanatocoenosis.
En las muestras submareales del flanco de acreción las especies registran proporciones de VA/VJ que varían entre 1/3 (0,33) a 2/1(2). Dentro de este rango, predominan los valores > 0,5 que indican un desplazamiento y/o pérdida de valvas juveniles por la hidrodinámica del ambiente (Brouwers, 1988). Por ejemplo, Loxocythere variasculpta con valores bajos de VA/VJ en las planicies de marea, presenta una disminución notable de valvas juveniles en estos sedimentos submareales. La estructura de estas poblaciones se relaciona con asociaciones de vida en un hábitat de cierta energía (poblaciones tipo B, según Whatley, 1988) y, consecuentemente, son consideradas autóctonas. Otros taxa, como Callistocythere litoralensis , con ejemplares vivos en las planicies de marea y en los sedimentos del canal, registran poblaciones con muy bajo número de juveniles en la mayoría de las muestras de ambos ambientes. Esto evidencia que la estructura poblacional post mortem de los ostrácodos está determinada no sólo por factores ambientales, sino también por el tamaño y la morfología de los caparazones (Kontrovitz, 1975).
En el flanco de erosión se hallaron especies con un alto número de adultos >1/2-2/1 (>0,5-2) que reflejan las condiciones energéticas ambientales, como así también, poblaciones con una alta proporción de juveniles 1/8-1/2 (0,12-0,5). Entre estas últimas, se encuentran Loxocythere variasculpta , Neocytherideis ruidis y Cyprideis salebrosa hartmanni , con proporciones de VA/VJ, equivalentes a las registradas en la planicie de marea. Por consiguiente, en este flanco se consideraron a las poblaciones autóctonas según los criterios expuestos para las tanatocenosis de las planicies de marea y del flanco de acreción.
Brouwers (1988) analiza la estructura de las poblaciones del golfo de Alaska y propone un rango empírico que varía entre 1/5 y 1/3 (0,20 y 0,33), para relacionar a las tanatocenosis con una asociación de vida. Teniendo en cuenta que el área de estudio comprende a un ambiente más restringido, con baja influencia del mar abierto (Piccolo et al. , 1987; Cuadrado et al. , 2000) y considerando, además, las observaciones mencionadas arriba, es probable que el rango de VA/VJ más amplio 1/8 y 7/3 (0,12-2,33), registrado en este estudio, incluya a las tanatocenosis autóctonas. Por consiguiente, tentativamente, las especies con valvas adultas y juveniles registradas en los distintos ambientes son consideradas autóctonas. Por otra parte, se reconocieron como especies alóctonas o desplazadas aquellas que sólo presentan valvas adultas o juveniles.
Distribución cualitativa de las asociaciones de ostrácodos autóctonos
Se analizó la composición de las biocenosis y tanatocenosis, considerando las condiciones hidrológicas, sedimentológicas (figura 2) y la presencia o no de vegetación, en los distintos hábitats o subambientes del área estudiada (cuadro 1).
Todos los taxones de ostrácodos de las biocenosis y tanatocenosis autóctonas analizadas en este estudio, pertenecen a la superfamilia Cytheroidea, que son típicamente bentónicos; viven sobre el sedimento del fondo o bien dentro de los primeros milímetros de sedimento, salvo Paracytherois sp. n. (Paradoxostomatidae), que habita sobre las plantas (Moore y Pitrat, 1961; Van Morkhoven, 1963; Carbonel, 1988). Si se considera que se han tomado, como mínimo, 1,5 cm de sedimento superficial, dentro de las tanatocenosis se incluyen valvas que por procesos tafonómicos representan un time-averaging de generaciones (Kidwel y Bosence, 1991). Es probable, entonces, que las tanatocenosis autóctonas halladas en cada una de las muestras, estén constituidas por una mezcla de poblaciones no contemporáneas que provienen de un mismo hábitat. Si bien no se tienen datos de la velocidad de sedimentación en el área, posiblemente las diferentes especies que integran las tanatocenosis autóctonas en este estudio, reflejen, al menos, cambios estacionales de salinidad, temperatura, oxígeno, etcétera. Por consiguiente, se considera que estas asociaciones de ostrácodos, por el efecto time-averaging , presentan un enriquecimiento en la composición faunística, que se relaciona con cortas fluctuaciones ambientales y/o esporádicos cambios no determinables (Staff et al. , 1986); mientras que las biocenosis analizadas en este estudio constituyen una generación de ostrácodos y, consecuentemente, no reflejan variaciones ambientales.
Finalmente, es necesario destacar que en todas las muestras tratadas con rosa de Bengala, las poblaciones de las biocenosis presentaron, además de los ejemplares vivos, valvas juveniles y adultas vacías; estas últimas pertenecen a generaciones previas. Por consiguiente, las especies de las biocenosis en los distintos hábitats, también integran a las tanatocenosis (cuadro 1).
Planicie de marea alta con vegetación fanerógama (muestra M2)
Esta zona se caracteriza por las condiciones ambientales de energía baja y fluctuantes por acción de las mareas que originan periódicas emersiones e inmersiones. El sustrato es fangoso con alto contenido de limo (45%) y bajo de arena (aproximadamente 25%). En este ambiente, cubierto por Spartina sp., se registra una cantidad abundante de detritos orgánicos teñidos con rosa de Bengala. La comunidad macrofaunística asociada a los ostrácodos se halla integrada por crustáceos isópodos teñidos, junto a restos de caparazones de bivalvos juveniles y gastrópodos piramidéllidos.
Biocenosis. Se hallaron ejemplares vivos de Leptocythere darwini ?, Cytherura dimorphica , Callistocythere litoralensis y Hemicytherura escobasensis . Cytherura y Leptocythere son taxones marinos litorales, con especies típicas de ambientes poco profundos y salobres (Van Morkhoven, 1963; Garbett y Maddocks, 1979). Las especies Callistocythere litoralensis y Hemicytherura escobasensis viven en aguas mixo-euhalinas (18-30) y euhalinas (30-40) respectivamente de la bahía de Sepetiba, Brasil (Dias-Brito et al. , 1988).
Tanatocenosis. Además de las especies mencionadas dentro de la biocenosis, la tanatocenosis está constituida por especies que solamente presentaron ejemplares muertos. Entre ellas están: Loxocythere variasculpta , Cyprideis salebrosa hartmanni , Neocytherideis ruidis , Semixestoleberis debueni , Paracytherois sp. n., Copytus rara , Frenguellicythere argentinensis , Minicythere argentinensis y Papillosacythere parallela .
Loxocythere variasculpta vive en cuerpos de agua pequeños con Spartina y en fangos mareales de poca profundidad, con abundante detrito algal en la bahía San Blas (provincia de Buenos Aires) (Whatley et al. , 1998). Cyprideis salebrosa hartmanni se halla en agua dulce a mixohalina (0-29), en sedimentos ricos en detritos y vegetación litoral (Ornellas y Würdig, 1983; Ramírez, 1967; Dias-Brito et al. , 1988). Es probable que las especies mencionadas se relacionen con la vegetación y se nutran de detritos vegetales, al igual que Semixestoleberis debueni . Esta especie fue registrada en aguas hipohalinas de la desembocadura del río Deseado, provincia de Santa Cruz, Argentina (Hartmann, 1962).
Papillosacythere parallela fue registrada en el litoral y plataforma de Argentina en un rango de profundidad que varía entre 4 y 53 m (Whatley et al. , 1987).
Planicie de marea baja (muestra M1)
No presenta cobertura vegetal y se ubica en la parte más baja de la planicie, a la altura del nivel medio del mar. El contenido de limo disminuye siendo su proporción similar al de las arcillas (37%). Las condiciones sedimentológicas e hidrológicas son similares a las de la planicie de marea alta vegetada, aunque el tiempo de emersión es menor. La macrofauna se presentó sin cambio con respecto al ambiente anterior, aunque en estos sedimentos se registró una disminución de restos orgánicos teñidos con rosa de Bengala.
Biocenosis. En este ambiente la asociación de ostrácodos presentó una disminución evidente de poblaciones con ejemplares vivos; se hallaron: Callistocythere litoralensis y Hemicytherura escobasensis .
Tanatocenosis. La tanatocenosis, al igual que la biocenosis, disminuye en número de especies; registrándose ejemplares muertos de Callistocythere litoralensis , Hemicytherura escobasensis , Neocytherideis ruidis , Loxocythere variasculpta , Paracytherois sp. n. y Cytherura dimorphica .
Planicie de marea alta sin vegetación (muestra MV Cangrejal)
Se caracteriza por el alto contenido de limos (aproximadamente 75% y por la presencia de una fauna de cangrejos ( Chasmagnatus granulata Dana) muy abundante. No se hallaron ostrácodos y se destaca la presencia del foraminífero Ammonia becarii (Linnaeus) con su citoplasma teñido. Los restos de isópodos y gastrópodos registrados en esta área son muy escasos.
Flanco de acreción (muestras Sn1 y Sn2)
Las muestras fueron tomadas a 2,5 y 4 metros de profundidad debajo del nivel medio del mar, respectivamente. El sustrato en esta zona submareal tiene un alto contenido de arena (45 a 50%) y los valores de limo y arcilla varían entre 26-29% y 22-27%, respectivamente. La comunidad asociada a los ostrácodos está formada por crustáceos isópodos teñidos con rosa de Bengala, junto a restos de conchillas de gastrópodos y exoesqueletos calcáreos de briozoos. Los detritos orgánicos son muy escasos o bien no se registran.
Biocenosis. Las especies que constituyen las biocenosis son Callistocythere litoralensis y Hemicytherura escobasensis .
Tanatocenosis. Dentro de las tanatocenosis, junto a Callistocythere litoralensis y Hemicytherura escobasensis , se destaca la presencia de especies autóctonas que no fueron registradas en las muestras de las planicies de marea. Entre ellas se hallan Hemicytherura chuiensis , Semicytherura rugosoreticulata , Cornucoquimba lutziana y Xestoleberis sp.
Semicytherura rugosoreticulata se encuentra en ambientes estuáricos, litorales (principalmente con algas) y de plataforma argentina (Whatley et al. , 1988). Cornucoquimba lutziana vive en áreas euhalinas (30-40) abiertas de la Bahía de Sepetiba, Brasil (Dias-Brito et al. , 1988).
Flanco de erosión (muestras Sn3, Sn4 y Sn5)
Las muestras Sn3, Sn4 y Sn5 fueron obtenidas de los sedimentos superficiales ubicados a 6, 4 y 2 metros, respectivamente, debajo del nivel medio del mar. En este flanco las muestras Sn4 y Sn5 presentan características granulométricas similares a las muestras submareales del flanco de acreción. Los sedimentos de la parte más profunda del canal (Sn3) presentan un marcado incremento de las fracciones de limo y arcilla en relación con una baja proporción de arena. Esta litología no se halla en equilibrio con las condiciones energéticas imperantes en este sector del canal. Cusminsky et al. (1995) reconocen, en este ambiente, sedimentos más antiguos que están siendo expuestos por la acción erosiva.
La comunidad asociada a los ostrácodos consiste en restos muy fragmentarios y escasos de moluscos. Se diferencian, entre ellos, gastrópodos piramidéllidos y una valva coloreada del bivalvo Tagelus plebeius (Sn5). Además, se registran restos fragmentarios de exoesqueletos de briozoos teñidos (Sn4) y un ejemplar del crustáceo isópodo (Sn5).
Biocenosis. En las muestras Sn3 y Sn5 se hallaron ejemplares vivos; se destaca la continuidad de Callistocythere litoralensis (Sn3 y Sn5) y la aparición de Cytheretta punctata (Sn5). En este ambiente se registran ejemplares vivos de Hemicytherura chuiensis (Sn3), previamente mencionada, dentro de las tanatocenosis del flanco de acreción. Cytheretta punctata vive en las costas brasileñas (Pinto et al. , 1978) y en la Argentina, en el estuario del río de La Plata y en la plataforma continental entre 3,5 m y 14,6 m de profundidad (Whatley et al. , 1998).
Tanato-paleotanatocenosis. En el fondo del canal (Sn3) se registró un cambio notorio en la composición faunística, que coincide con el incremento de las fracciones de limo y arcilla. Además de las especies mencionadas dentro de las biocenosis, las tanatocenosis están constituidas por poblaciones autóctonas de Neocytherideis ruidis , Cytherura dimorphica , Paracytherois n. sp. y Frenguellicythere argentinensis . Estas especies se hallan solamente en las asociaciones autóctonas de la planicie de marea (M2 y M1). En las muestras Sn4 y/o Sn5, también se registraron dichas especies, salvo F . argentinensis . En estas muestras submareales, donde la salinidad es euhalina (ver Características generales del área), se destaca la presencia de taxones típicamente eurihalinos tales como Cyprideis salebrosa hartmanni y C. riograndensis . Esta última especie se encuentra en la laguna marginal de Tramandai (Brasil) con salinidades que varían entre 6,10 y 29,11 (Pinto y Ornellas, 1965). Por estas consideraciones se infiere que dichas especies provienen de depósitos intertidales más antiguos, originados en condiciones ambientales diferentes a los actuales y por ello constituyen una paleotanatocenosis. Según Staff et al. (1986), la composición taxonómica de las tanatocenosis constituye un atributo básico en las reconstrucciones de las paleocomunidades, dado que sufren, en menor grado, los efectos tafonómicos y de time averaging . Si se tiene en cuenta, además de la composición taxonómica de las paleotanatocenosis de estos depósitos submareales, la estructura de las poblaciones de Loxocythere variasculpta , Neocytherideis ruidis y Cyprideis salebrosa hartmanni con una alta proporción de valvas juveniles, como se indicó en el ítem anterior, se puede asumir que, al menos, los procesos iniciales de formación de las paleotanatocenosis y de las tanatocenosis time-averaging de la llanura de marea actual, fueron similares. Asimismo, es probable que dichas paleotanatocenosis no hayan sufrido alteraciones tafonómicas adicionales muy marcadas (Staff et al. , 1986).
Distribución cuantitativa de las asociaciones modernas de ostrácodos autóctonos
Para el estudio de las abundancias de los ostrácodos autóctonos modernos se consideraron a las biocenosis y a las tanatocenosis autóctonas en conjunto, dado que ambas asociaciones representan a los ostrácodos que habitan los distintos ambientes analizados (cuadro 2). La incidencia de las biocenosis en la distribución cuantitativa de la ostracofauna autóctona no es significativa, debido a que el porcentaje de individuos vivos a lo largo de los distintos niveles no supera el 2% (figura 3). Esto indica que las variaciones de las abundancias absolutas y relativas de las especies están determinadas por las tanatocenosis.

Cuadro 2. Distribución y abundancia relativa de especies autóctonas (biocenosis y tanatocenosis-paleotanatocenosis)/ Distribution of autochthonous species (biocoenosis and tanatocoenosis-paleotanatocoenosis).
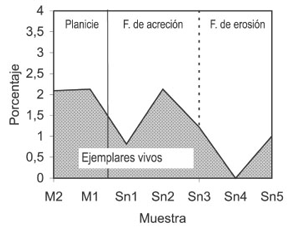
Figura 3. Distribución y abundancia relativa de especímenes vivos/ Distribution and relative abundance of living specimens.
En cuanto a la diversidad, el número total de especies registradas en este estudio representa a la diversidad de las tanatocenosis, dado que todas las especies que integran las biocenosis de los distintos ambientes, registraron ejemplares muertos, tal como se indicó previamente (cuadro 1).
En el flanco de erosión, se mezclan las valvas vacías actuales y las de las asociaciones más antiguas. Por lo tanto, si bien algunos taxones pueden reconocerse ecológicamente dentro de las paleotanatocenosis, no es posible determinar el total de especies y/o especímenes pertenecientes a dichas asociaciones. Sin embargo, en este ambiente, las variaciones cuantitativas de las especies autóctonas registran cambios significativos en la distribución de las frecuencias relativas (figura 4), como así también, en los parámetros de densidad (figura 5.A), diversidad específica (figura 5 B) e índice de diversidad (figura 5.C). Los valores obtenidos en la muestra Sn3 y, en general, en las muestras Sn4 y Sn5, no se elacionan con los parámetros hallados en los sedimentos actuales submareales y por otra parte, son equivalentes a los registrados en la planicie de marea actual. Como se vio previamente, las paleotanatocenosis de este ambiente presentan similitud con las tanatocenosis autóctonas time averaging de las planicies de marea actual, tanto en la composición taxonómica, como en la estructura de las poblaciones. Es probable, entonces, que las variaciones cuantitativas de ambas tanatocenosis puedan ser comparables. Esto implicaría una preservación de las paleotanatocenosis por rápidos eventos de sedimentación, factibles en los ambientes de planicies de marea (Staff et al. , 1986; Fürsich y Aberhan, 1990). Estas consideraciones permiten inferir que en el flanco de erosión se exponen estratos más antiguos, portadores de una paleotanatocenosis que se relaciona con la asociación de ostrácodos modernos de la llanura de marea.

Figura 4. Distribución y frecuencia relativa de las especies de ostrácodos (biocenosis y tanatocenosis-paleotanatocenosis autóctonas) más abundantes (> 5%) a lo largo de los distintos hábitats/ Distribution and relative frequence of species of ostracods (biocoenosis and autochthonous thanatocoenosis-paleothanatocoenosis) most abundant throughout the different habitats (> 5%).

Figura 5. Análisis cuantitativo de los ostrácodos. A, Densidad faunística (= número total de individuos en 100 gr de sedimento bruto); B, Diversidad específica total; C, Índice de diversidad (función de información de Shannon-Wiener)/ Quantitative analisys of ostracods. A, Faunal density (= total number of individuals per 100 gm of raw sediment); B, Total Specific diversity; C, Diversity Index (Shannon-Wiener information function).
Finalmente, se puede deducir que la hidrodinámica del flanco erosivo no permite un desarrollo significativo de los ostrácodos vivientes y/o una buena conservación de las tanatocenosis actuales. En consecuencia, las tendencias cuantitativas de las asociaciones analizadas, representan los variaciones de la ostracofauna más antigua. Por lo tanto, para el análisis cuantitativo de la fauna moderna, se consideraron solamente los depósitos de planicie de marea y del flanco de acreción.
Abundancias relativas de las especies
Las especies registradas tanto en las planicies como en los sedimentos submareales del flanco de acreción (figura 4), son Loxocythere variasculpta , Callistocythere litoralensis, Hemicytherura escobasensis y Papillosacythere parallela . Loxocythere variasculpta es abundante en todas las muestras aunque sus poblaciones se hallan más desarrolladas en los sedimentos de planicie de marea con frecuencias que superan el 23%. Callistocythere litoralensis y Hemicytherura escobasensis registran abundancias relativas marcadamente más altas en el flanco de acreción. Las poblaciones de Papillosacythere parallela son levemente más abundantes en la planicie de marea con vegetación.
Dentro de las especies autóctonas registradas solamente en los sedimentos de las planicies de marea, se destaca Neocytherideis ruidis con frecuencias que oscilan entre 13% y 26%; son comunes los taxones eurihalinos, tales como Cyprideis salebrosa hartmanni , Cytherura dimorphica y Leptocythere darwini ?, como así también, Paracytherois sp. n., y Frenguellicythere argentinensis .
En los depósitos submareales del flanco de acreción, como se mencionó anteriormente, se destaca la abundancia de Callistocythere litoralensis y Hemicytherura escobasensis con frecuencias que alcanzan el 43% y 25% respectivamente. Otras especies euhalinas son comunes y exclusivas de este ambiente tales como Cornucoquimba lutziana , Hemicytherura chuiensis , Semicytherura rugosoreticulata y Xestoleberis sp.
En los sistemas marinos marginales e inestables, algunas especies pueden hallarse en varios ambientes pero solamente en un tipo de hábitat su abundancia puede elevarse significativamente (Cronin, 1979). Las tanatocenosis no reflejan con exactitud las abundancias de las poblaciones vivientes debido a procesos de preservación diferencial (Staff et al. , 1986). Dado que, en este estudio, las abundancias relativas están determinadas por las tanatocenosis, no se puede identificar las especies dominantes en los distintos ambientes analizados. Si bien no es posible evaluar el grado de alteración de las abundancias de las especies que integran las tanatocenosis, las variaciones en la distribución de las frecuencias relativas de las asociaciones de ostrácodos autóctonos de las planicies de marea y del flanco de acreción del canal, permiten la caracterización de ambos ambientes y facilitan, como se vio previamente, el reconocimiento de depósitos más antiguos en el flanco de erosión.
Densidad faunística, diversidad específica e índice de diversidad de poblaciones autóctonas
Los valores de densidad de los ostrácodos autóctonos registrados en las planicies de marea y en el flanco de acreción varían entre 191 y 64 ostrácodos en 100 gr de sedimento bruto (figura 5.A). El valor más alto corresponde a la planicie de marea alta con vegetación (muestra M2) y disminuye marcadamente en la parte más baja y sin vegetación (muestra M1). Finalmente, en los sedimentos submareales (muestras Sn1 y Sn2) las densidades son relativamente bajas.
Como se indicó previamente, la abundancia de las poblaciones en los distintos ambientes está determinada por las tanatocenosis. Por consiguiente, las densidades pueden presentar modificaciones post mortem (transporte, destrucción, etc.) relacionadas con la energía del ambiente (Staff et al. , 1986). Es factible, entonces, que las abundancias absolutas del total de ostrácodos vivientes a lo largo de un tiempo, equivalente al período de acumulación de las tanatocenosis, hayan sido menos modificadas en las planicies de marea que en los sedimentos submareales. Por consiguiente, se puede asumir que las densidades registradas en las planicies de marea, especialmente la vegetada, se relacionan con el desarrollo de las poblaciones vivientes.
Los valores de diversidad de las biocenosis fluctúan entre 1 y 4 (figura 4), mientras que la diversidad de las tanatocenosis (o diversidad total) oscila entre 4 y 13 especies (figura 5.B), debido al enriquecimiento específico por el efecto time-averaging (Staff y Powell, 1988).
Los índices de diversidad, que representan la diversidad específica y la abundancia de las tanatocenosis, varían entre 1,25 y 2,28 (figura 5.C). En general, los valores de diversidad e índices de diversidad son bajos y pueden relacionarse con la inestabilidad del medio.
La distribución de la diversidad de las tanatocenosis y de los índices de diversidad en los distintos ambientes analizados, es semejante. En la planicie de marea alta y vegetada (M2), donde la inestabilidad ambiental es importante por las periódicas emersiones, se registran los valores de diversidad e índice de diversidad más altos; por otra parte, en las muestras submareales, con condiciones de salinidad más estable, se obtuvieron los valores más bajos. Esto indicaría que más especies pudieron habitar un ambiente más inestable, sucesivamente, durante el tiempo de acumulación de la tanatocenosis (Staff et al. , 1986).
Por otra parte, la distribución de la diversidad de las biocenosis y de las tanatocenosis es similar; se registra el mayor número de especies vivas en las planicies de marea vegetada (M2), y el más bajo, en el canal (Sn1) (figura 4). Por consiguiente, es posible que las variaciones de diversidad de las tanatocenosis y de los índices de diversidad, reflejen las tendencias de diversidad de los ostrácodos vivientes en los distintos ambientes del área de estudio. Asimismo, es probable que en la planicie de marea vegetada, no sólo habite un número mayor de especies no contemporáneas, sino que, además, convivan más especies.
Distribución de los ostrácodos alóctonos
El estudio cuantitativo de la fauna desplazada ayuda a la interpretación de la dinámica del medio (Carbonel, 1980). El aporte del total de fauna alóctona registrada en los distintos hábitats es importante (figuras 5.A y B) y se relaciona con las condiciones hidrodinámica de un ambiente marino litoral.
Se analizó la distribución de los taxones límnicos y marinos alóctonos en todas las muestras analizadas. Por un lado (figura 6.A), se consideraron las frecuencias acumulativas de las especies límnicas Ilyocypris gibba , Cypridopsis vidua y Limnocythere sp. que pudieron ser transportadas desde ambientes continentales. Por otra parte (figura 6.B), se estudiaron las variaciones cuantitativas de taxones euhalinos alóctonos, probablemente, desplazados desde sectores más externos del estuario. Entre éstos, se consideraron Loxoreticulatum dictyotos , Caudites ohmerti , Ambostracon ( Ambostracon ) bertelsae , Patagonacythere tenuireticulata , Keijia patagonica , Quadracythere gloriaensis y Munseyella spp.

Figura 6. Distribución de los ostrácodos alóctonos. A, Especies límnicas; B, Especies euhalinas/ Distribution of allocthonous ostracods. A, Limnic species; B, Euhaline species.
Las variaciones cuantitativas de ambos grupos de ostrácodos, límnicos y marinos, son coincidentes a lo largo de los distintos hábitats. En las muestras submareales del flanco de acreción se destaca un marcado aumento de las abundancias relativas de las poblaciones que refleja las condiciones energéticas del medio. En el flanco de erosión, si bien existe una mezcla de especies actuales y de otras que provienen de sedimentos más antiguos, la disminución de las abundancias de las especies alóctonas en la muestras Sn3 y Sn4 puede relacionarse con la exposición de sedimentos de planicie de mareas más antiguas, por la acción erosiva.
Distribución de los ostrácodos modernos y discusiones ambientales
A partir del estudio cuali-cuantitativo de las asociaciones de ostrácodos modernos, se analizó la incidencia de algunos factores ambientales en las variaciones faunísticas, tales como la inestabilidad en la salinidad, la hidrodinámica, el tipo de sedimento y, particularmente, la importancia de la topografía y vegetación en las planicies de marea (cuadro 3).

Cuadro 3. Relaciones entre las variaciones faunísticas y los factores ambientales/ Relationships between the faunal variations and environmental factors.
Engel y Swain (1967) consideran que el control ecológico más importante en la distribución de los ostrácodos de la costa del golfo de Texas se relaciona con la adaptación a las variaciones en la salinidad. Keyser (1977), quien estudió la ecología de los ostrácodos de la costa oeste de la Florida, concluye que la salinidad y el sustrato son los factores más importantes en la distribución de las especies. Asimismo, considera que otros factores como la temperatura, la fuerza de las corrientes, la profundidad, el pH y la turbidez son de escasa importancia o bien no muestran influencia en la fauna de ostrácodos en las áreas litorales.
Según Cronin (1979), la distribución local de las especies de ostrácodos en un ambiente marino marginal está controlada principalmente por la salinidad, sustrato y vegetación, mientras que la distribución a gran escala de especies marinas que habitan la plataforma continental, está controlada por la temperatura del agua.
Si bien la salinidad es un factor limitante en la distribución de las especies de ostrácodos, las variaciones de salinidad constituyen un factor determinante (Carbonel, com. personal, 2004). En el área de estudio, la composición de las asociaciones registradas en los distintos hábitats refleja las condiciones de estabilidad ambiental. En las planicies de marea, donde las variaciones de salinidad son marcadas por las periódicas emersiones e inmersiones, las biocenosis y tanatocenosis autóctonas están constituidas por taxones eurihalinos tales como Cytherura , Leptocythere y Cyprideis salebrosa hartmanni . Mientras que en las muestras submareales, donde la salinidad es euhalina y más estable, se registró una mayor proporción de taxones euhalinos y posiblemente estenohalinos. Entre ellas están las especies con ejemplares vivos, como Cytheretta punctata y Hemicytherura chuiensis ; por otra parte, dentro de las tanatocenosis autóctonas, se hallan Cornucoquimba lutziana y Semicytherura rugosoreticulata .
La densidad faunística se relaciona, fundamentalmente, con las condiciones tróficas del medio (Carbonel, 1988). Como se vio previamente, todos los taxones registrados en este estudio son bentónicos. Es probable, entonces, que la nutrición de las especies autóctonas, excepto el taxón fital Paracytherois que se nutre y vive sobre las plantas (algas o fanerógamas), dependa de las condiciones tróficas de la película superficial constituida por el contacto del agua y el sedimento en sus primeros milímetros (Carbonel, 1980; 1982). Este autor considera la influencia de un conjunto de factores topográficos, sedimentológicos e hidrológicos en el desarrollo de la fauna de ostrácodos actuales de planicies de marea de la costa atlántica de Francia. En las planicies de mareas altas y vegetadas, debido al largo tiempo de emersión, predomina la evaporación que provoca el ascenso capilar de los elementos nutritivos hacia la película superficial. Este ascenso de los nutrientes es favorecido por la estructura heterogénea del sedimento fino, con una proporción adecuada de arena. La vegetación, por su parte, impide la desecación, retiene las partículas alimenticias transportadas por las corrientes y aporta el oxígeno necesario para la degradación de la materia orgánica. En la parte más baja y sin vegetación de la planicie de marea, el poco tiempo de exposición aérea frena la ascensión capilar de los elementos nutritivos y la ausencia de vegetación obstaculiza la retención del material nutritivo. Estas consideraciones explicarían las variaciones de densidad faunística registradas en el área de estudio; un mayor desarrollo de las poblaciones de ostrácodos en la planicie de marea vegetada, con abundante detrito orgánico teñido con rosa de Bengala y una disminución de la densidad faunística en el sector más bajo y sin vegetación. Por otra parte, la ausencia de ostrácodos en las planicies de marea alta y sin vegetación (muestra MV, cangrejal) se debe, fundamentalmente, a la ausencia de vegetación que provoca la desecación de la película superficial y al alto contenido de limo (aproximadamente 75%) que impide el ascenso capilar de los nutrientes hacia la película superficial de agua, durante la fase de inmersión. Finalmente, las densidades faunísticas, relativamente bajas en las muestras submareales, como asimismo el escaso registro de materia orgánica teñida con rosa de Bengala, se relacionan con la hidrodinámica y la posibilidad de depositación de elementos nutritivos, transportados en suspensión. Carbonel (1980, 1982) señala que en los canales, las condiciones son desfavorables para la degradación y asimilación de la materia orgánica, debido a que la materia transportada provoca ladisminución del pH. Por consiguiente, si bien los valores de densidad de las tanatocenosis autóctonas pueden estar modificados por procesos post mortem , las tendencias en las variaciones de las densidades registradas en los distintos ambientes pueden reflejar las condiciones tróficas que afectan a las poblaciones vivientes en los distintos hábitats.
Según Carbonel (1980, 1988), el número de especies disminuye en relación con la inestabilidad en la salinidad. En el área de estudio, la diversidad de las biocenosis y tanatocenosis, como asimismo los índices de diversidad de las tanatocenosis registraron valores bajos y sus variaciones fueron equivalentes en los distintos ambientes. En la planicie de marea alta con vegetación, donde la eurihalinidad es importante, se hallaron los valores más altos. Probablemente, la vegetación contribuye con un mayor número de nichos ecológicos y permite que más especies convivan. Por otra parte, en el canal, donde las condiciones de salinidad son más estables que en las planicies de marea, los valores de dichos parámetros faunísticos son relativamente más bajos. Si se considera la relación entre la energía y las condiciones tróficas de este hábitat, mencionadas previamente, es probable que la hidrodinámica del medio influya también en la diversidad, tanto de las tanatocenosis como de las especies vivientes.
A partir de las consideraciones tratadas en este apartado, se puede asumir que, aunque las tanatocenosis autóctonas presenten modificaciones por efectos de time-averaging y otros procesos post mortem , las variaciones en la composición taxonómica, densidad, diversidad e índice de diversidad, en los distintos hábitats, pueden relacionarse con atributos de las especies vivientes.
Finalmente, las variaciones de las abundancias relativas de las especies alóctonas, límnicas y marinas, reflejan las condiciones hidrodinámicas de los distintos ambientes del área estudiada. Los bajos porcentajes de abundancia de las especies límnicas indican un escaso aporte de aguas continentales en el área y confirman, a su vez, las condiciones de salinidad estable en el canal.
Conclusiones
En la planicie de marea se registraron, dentro de las biocenosis, Cytherura dimorphica , Leptocythere darwini ?, Callistocythere litoralensis y Hemicytherura escobasensis . Las especies de las tanatocenosis autóctonas que se destacan por su abundancia y/o por hallárselas solamente en este ambiente son Loxocythere variasculpta , Cyprideis salebrosa hartmanni , Neocytherideis ruidis , C. y Cytherura dimorphica , Leptocythere darwini ?, Frenguellicythere argentinensis , Paracytherois n. sp., Semixestoleberis debueni , Minicythere argentinensis y Copytus rara . El predominio de poblaciones con una alta proporción de valvas juveniles se relaciona con las condiciones de baja energía del medio, mientras que la presencia de los taxones eurihalinos como Cyprideis , Leptocythere y Cytherura reflejan condiciones de salinidad inestables.
Las variaciones cuantitativas de los ostrácodos autóctonos modernos permiten diferenciar tres tipos de hábitats en la planicie de marea.
En la planicie de marea alta y vegetada los valores relativamente altos de densidad faunística pueden reflejar condiciones tróficas favorables para la proliferación de la fauna de ostrácodos, dado que la vegetación, el sustrato y las exposiciones aéreas permiten una disponibilidad mayor de sustancias nutritivas. Por otra parte, los valores relativamente más altos de diversidad de las biocenosis y tanatocenosis, como asimismo de los índices de diversidad de Shannon-Wiener de las asociaciones, se relacionan con la disponibilidad de un mayor número de nichos ecológicos.
En la planicie de marea baja no vegetada la disminución de la diversidad de taxones vivos y muertos, así como la densidad faunística, pueden reflejar una mayor inestabilidad ambiental y un menor aporte de alimentos por la ausencia de vegetación.
En la planicie de marea alta no vegetada (cangrejal) la ausencia de fauna de ostrácodos se relaciona con las condiciones tróficas no favorables debido a las prolongadas emersiones, a la falta de vegetación y al sedimento predominantemente fino.
En los sedimentos submareales del flanco de acreción se hallan ejemplares vivos de Callistocythere litoralensis , Hemicytherura escobasensis y Cytheretta punctata . Dentro de las tanatocenosis, las especies que se destacan por su abundancia y/o por su registro exclusivo en el área son Callistocythere litoralensis , Hemicytherura escobasensis , Semicytherura rugosoreticulata , Cornucoquimba lutziana y Hemicytherura chuiensis . El predominio de taxones euhalinos y la escasa presencia de especies límnicas alóctonas reflejan la salinidad más estable del canal. Por otra parte, las altas proporciones de valvas adultas de las poblaciones, como asimismo el aumento de especies alóctonas límnicas y euhalinas indican la hidrodinámica del medio. Este factor ambiental, a su vez, puede condicionar los valores relativamente bajos de densidad faunística, diversidad e índice de diversidad de las asociaciones de ostrácodos modernos.
En el flanco de erosión caracterizado, fundamentalmente, por el incremento de la dinámica sedimentaria, las biocenosis están integradas por Callistocythere litoralensis , Hemicytherura escobasensis y Cytheretta punctata . Contrariamente, las tanatocenosis autóctonas y la estructura de las poblaciones, se relacionan con las asociaciones de ostrácodos de la planicie de marea actual; por esto, se concluye que estos sedimentos son más antiguos y fueron depositados en un ambiente de menor energía.
Agradecimientos
A A. Bertels-Psotka, por su invalorable dirección de mi tesis doctoral, por su constante apoyo y estímulo. A M. Quattrocchio, R. Guerstein y E. Farinati, por la lectura crítica del manuscrito y por sus valiosas sugerencias. A P. Carbonel y a L. Ferrero, como así también al revisor anónimo por las observaciones que enriquecieron y mejoraron sustancialmente este trabajo. Fue financiado por el CONICET y el proyecto FONCYT (Pic 07-09659).
Bibliografía
Bertels, A., Kotzian, S. y Madeira-Falcetta, M. 1982. Micropaleontología (foraminíferos y ostrácodos) del Cuaternario de Palmares do sul (Formación Chui, Brasil). Ameghiniana 19: 125-156. [ Links ]
Bertels-Psotka, A. y Laprida, C. 1998. Ostrácodos (Arthropoda, Crustacea) del Miembro Cerro de la Gloria, Formación Las Escobas (Holoceno), provincia de Buenos Aires, República Argentina. Revista Española de Micropaleontología 30: 103-127. [ Links ]
Bertels, A. y Martínez, D.E. 1990. Quaternary ostracodes of continental and transitional littoral-shallow marine environments. Courier Forschchungs Institut Senckenberg 123: 141-160. [ Links ]
Bertels, A. y Martínez, D.E. 1997. Ostrácodos holocenos de la desembocadura del arroyo Napostá Grande, sur de la provincia de Buenos Aires, Argentina. Revista Española de Micropaleontología 29: 20-69. [ Links ]
Bertels-Psotka, A. y Martínez, D.E. 1999. Frenguellicythere argentinensis , n. gen. and n. sp. from Holocene deposits of estuary of Bahía Blanca, Buenos Aires, Argentina. Micropaleontology 45: 394-398. [ Links ]
Brouwers, E. 1988. Sediment transport detected from the analysis of ostracod population structure: an example from the Alaskan continental shelf. En: P. de Deckker, J.P. Colin y J-P. Peypouquet (eds.), Ostracoda in the Earth Sciences , Elsevier pp. 231-245. [ Links ]
Buzas, M.A. y Gibson, T.G. 1969. Species diversity: benthonic Foraminifera in western North Atlantic. Science 163: 72-75. [ Links ]
Carbonel, P. 1980. [ Les ostracodes et leur intêret dans la definition des ecosystemes estuariens et de plateforme continentale. Essais d'application à des domaines anciens . Thése de doctorat d'état ès sciencies. Université de Bordeaux 350 pp. Inédito]. [ Links ]
Carbonel, P. 1982. Ostracodes, traceurs des variations hydrologiques dans les systemes de transition eaux douces-eaux salées. Mémoire Société Géologique de France 144: 117-128. [ Links ]
Carbonel, P. 1988. Ostracods and the transition between fresh and saline waters. En: P. de Deckker, J.P. Colin y J-P. Peypouquet (eds.), Ostracoda in the Earth Sciences , Elsevier pp. 157-173. [ Links ]
Coimbra, J.C. y Ornellas, L.P. 1987. The Subfamily Orionininae Puri, 1973 (Ostracoda, Hemicytheridae) in Brazilian Continental Shelf, Part II. Sistematic of Genus Caudites Coryell and Fields, 1937. Pesquisas 19: 55-80. [ Links ]
Cronin, T. 1979. Late Pleistocene marginal marine ostracodes from the Southeastern Atlantic Coastal plain and their paleoenvironmental implications. Géographie Physique Quaternaire 33: 121-173. [ Links ]
Cuadrado, D., Ginsberg, S. y Gómez, E. 2000. Características físicas de un canal de marea interior en el estuario de Bahía Blanca (Buenos Aires). 3º Jornadas Nacionales de Geografía Física . Universidad Católica de Santa Fe, Actas: 113-120. [ Links ]
Cusminsky, G., Gómez, E., Grill, S., Guerstein, R. G. y Tumini, L. 1995. Estudio sedimentológico y micropaleontológico de sedimentos superficiales del estuario de Bahía Blanca, provincia de Buenos Aires. Primeros resultados. 6º Congreso Argentino de Paleontología y Bioestratigrafía (Trelew), Actas : 107-115. [ Links ]
Dias-Brito, D., Moura, J.A. y Würdig, N. 1988. Relationship between ecological models based on ostracods and foraminifers from Sepetiba Bay (Rio de Janeiro, Brazil). En: T. Hanai, N. Ikeya y K. Ishizaki (eds.), Evolutionary Biology on Ostracoda. Proceedings Ninth International Symposium on Ostracoda (Tokyo), pp. 467-484. [ Links ]
Echevarría, A. 1987. Ostrácodos de la Formación Carmen Silva, Miembro superior (Mioceno Inferior) Isla Grande de Tierra del Fuego, Argentina. Parte II. Ameghiniana 24: 309-318. [ Links ]
Engels, P. y Swain, F. 1967. Environmental relationships of Recent Ostracoda in Mesquite, Aransas and Copano Bays, Texas Gulf Coast. Gulf Coast Association of Geological Societies Transactions 17: 408-417. [ Links ]
Fürsich, F.T. y Aberhan, M. 1990. Significance of time-averaging for palaeocommunity analysis. Lethaia 23: 143-152 [ Links ]
Garbett, E. y Maddocks, R. 1979. Zoogeography of Holocene Cytheracean ostracodes in Bay of Texas. Journal of Paleontology 53: 841-919. [ Links ]
Gibson, T.G. y Buzas, M.A. 1973. Species Diversity: Patterns in Modern and Miocene Foraminifera of the Eastern Margin of North America. Geological Society of America Bulletin 84: 217-238. [ Links ]
Ginsberg, S. y Perillo, G. 1990. Deep-scour holes at tidal channel junctions, Bahía Blanca Estuary, Argentina. Marine Ecology 160: 171-182. [ Links ]
Gómez E.A., Martínez, D.E., Cuminsky, G.C., Suárez, M.I., Vilanova, R.F. y Guerstein, G.R. 1992. Estudio del testigo PS2, Cuaternario del estuario de Bahía Blanca, provincia de Buenos Aires. Parte I: Sedimentología y micropaleontología. 3º Jornadas Geológicas Bonaerenses (La Plata), Actas : 38-46. [ Links ]
Gómez E., Martínez, D., Cuminsky, G., Borel, G. y Guerstein, G. 2000. Submerged tidal flats at the Bahía Blanca Estuary, Argentina. 17 Latein Amerika-Kolloquim . Oktober (Sttugart). Profil, Band 18. [ Links ]
Guerstein, G. R., Vilanova, R. F., Suárez, M. I., Cuminsky, G. C., Martínez, D. E. y Gómez E. A. 1992. Estudio del testigo PS2, Cuaternario del estuario de Bahía Blanca, provincia de Buenos Aires. Parte II: evaluación paleoambiental. Terceras Jornadas Geológicas Bonaerenses (La Plata), Actas : 47-52. [ Links ]
Hartmann, G. 1962. Zur kenntnis des Eulitorals der chilenischen Pazifikkuste und der argentinischen Küsste Südpatagoniens unter besonderer Berücksichtigung der Polychaeten und Ostracoden. Teil 3. Ostracoden des Eulitorals. Mitteilungen aus dem Hamburgischen Zoologischen Museum und Institut, Hamburg 60: 169-270. [ Links ]
Keyser, D.1977. Ecology and zoogeography of recent brackishwater Ostracoda (Crustacea) from South-West Florida. En: H. Loffler y D. Danielopol (eds.), Aspects of Ecology and Zoogeography of Recent and Fossil Ostracods . 6th International Symposium on Ostracods, Saafelden (Salzburg). Junk Publishers, The Hague, pp. 207-222. [ Links ]
Kidwell, S. y Bosence, W. J. 1991. Taphonomy and Time averaging of Marine Shelly Faunas. En: P.A. Allison y D.E.G. Briggs (eds.), Taphonomy: Releasing the Data Locked in Fossil Record . New York, 9: 116-188. [ Links ]
Kidwell, S.M., Fürsich, F.T. y Aignet, T.M. 1986. Conceptual fromework for the analysis and calssification of fossil concentrations. Palaios 1: 228-238. [ Links ]
Kontrovitz, M. 1975. A study of the differential transportation of ostracodes. Journal of Paleontology 49: 937-941. [ Links ]
Mc Kenzie, K.G. 1967. Recent Ostracoda from Port Phillip Bay, Victoria. Proceedings Royal Society Victoria 80: 61-106. [ Links ]
Marcovecchio, J., Asteasuan, R., Rusansky, C., Ferrer, L., Andrade S. y Asteasuan, A. 1997. Estudio de la calidad del agua en la ría de Bahía Blanca. Instituto Argentino de Oceanografía. Informe final 90 pp. [ Links ]
Marcovecchio, J. Asteasuan, R., Ferrer, L., Andrade, S., Asteasuan, A., Contardi, E. y Freije, R. 2000. Estudio de la calidad del agua en la ría de Bahía Blanca ( 2º etapa). Instituto Argentino de Oceanografía. Informe final 53 pp. [ Links ]
Martínez, D.E. 2002. [ Microfauna (Ostracoda, Crustacea) del Cuaternario de las cercanías de Bahía Blanca, República Argentina . Tesis doctoral. Universidad Nacional del Sur, Bahía Blanca 378 pp. Inédito]. [ Links ]
Mehringer, P.J. Jr. 1967. Pollen Analysis of the Tule Springs area, Nevada State. Museum Archeological Paper 13: 130-200. [ Links ]
Montessarchio, L. y Lizasoain, W. 1981. Dinámica sedimentaria en la denominada ría de Bahía Blanca. Segundo informe. Contribución Científica del Instituto Argentino de Oceanografía. Bahía Blanca 58, 202 pp. [ Links ]
Moore, R. y Pitrat, C.W. 1961 (ed.). Treatise on Invertebrate Palaeontology. Part Q. Arthropoda 3. Crustacea, Ostracoda . Geological Society of America and University of Kansas Press, Lawrence 442 pp. [ Links ]
Murray, J.W. 1973. Distribution and ecology of living benthic foraminiferids . Heinemann Educational Books. London 274 pp. [ Links ]
Ornellas, L.P. de y Würdig, N. 1983. Cyprideis salebrosa hatmanni. Ramírez, F. 1967. A new subspecies from Brazil and Argentina. Pesquisas 15: 94-112. [ Links ] [ Links ]
Piccolo, M.C., Perillo G. y Arango, J.M. 1987. Hidrografía del estuario de Bahía Blanca, Argentina. Revista Geofísica 26: 75-89. [ Links ]
Pinto, I.D. y Ornellas, L.P. de. 1965. A new brackishwater ostracode Cyprideis riograndensis , Pinto et Ornellas, sp. nov. From Southern Brazil and its ontogenetic carapace development. Escola de Geologia Porto Alegre, Publicação Especial 8: 1-79. [ Links ]
Pinto, I.D., Ornellas, L.P. de, Purper, S.B. y Sanguinetti, Y.T. 1978. Recent Ostracodes along 7.408 km of the Brazilian Coast (33º 45'S to 4º 25'N). Pesquisas 9: 109-120. [ Links ]
Ramdohr, F.A. 1808. Über die Gattung Cypris Müller und drei zu derselben gehörige neue Arten. Magazin Gessellschaft Naturforsch, Freunde 2: 83-93. [ Links ]
Ramírez, F. 1967. Ostrácodos de lagunas de la provincia de Buenos Aires. Revista del Museo La Plata (nueva serie) Secc. Zoología 10: 5-54. [ Links ]
Rossi de García, E. 1966. Contribución al conocimiento de los ostrácodos de la Argentina. Formación Entre Ríos de Victoria, provincia de Entre Ríos. Revista de la Asociación Geológica Argentina 21: 194-208. [ Links ]
Rossi de García, E. 1969. Amendement a la sub-familie Cytherettinae Triebel 1952 (Familia Cytherettidae (Triebel) Howe 1961. Proceeding Third African Micropaleontology Colloquium , Ibadan, Nigeria, pp. 217-221. [ Links ]
Sanguinetti, Y. 1979. Miocene ostracodes of the Pelotas Basin, State of Rio Grande do Sul, Brasil. Pesquisas 12: 119-187. [ Links ]
Staff, G.M. y Powell, E.N. 1988. The paleoecological significance of diversity: the effect of time averaging and differencial preservation on macroinvertebrate species richness in death assemblages. Palaeogeography, Palaeoclimatology, Palaeoecology 63: 73-89. [ Links ]
Staff, G.M., Stanton, Jr. R.J., Powell, E.N. y Cummins, H. 1986. Time-averaging, taphonomic and their impact on paleocommunity reconstruction: Death assemblages in Texas bays. Geological Society of America Bulletin 97: 428-443. [ Links ]
Van Harten, D. 1988. Chronoecology, a non taxonomic application of ostracods. En: P. de Deckker, J.P. Colin y J-P. Peypouquet (eds.), Ostracoda in the Earth Sciences , Elsevier, pp. 47-54 [ Links ]
Van Morkhoven, F.P.C.M. 1963. Post Paleozoic Ostracoda. Their morphology, taxanomic and economic use. Volumen II; generic descriptions, Elsevier, Amsterdam, 478 pp. [ Links ]
Verettoni, H.N. 1961. Las asociaciones halófilas del partido de Bahía Blanca . Comisión ejecutiva 150º Aniversario de la Revolución de Mayo, Bahía Blanca, 105 pp. [ Links ]
Verettoni, H. y Aramayo, E. 1976. Las comunidades vegetales de la región de Bahía Blanca. Harris, Bahía Blanca 175 pp. [ Links ]
Whatley, R.C. 1988. Population structure of ostracods: some general principles for the recognition of palaeoenvironments. En: P. de Deckker, J.P. Colin y J-P. Peypouquet (eds.), Ostracoda in the Earth Sciences , Elsevier, pp. 245-256. [ Links ]
Whatley, R.C y Moguilevsky, A. 1975. The family Leptocytheridae in Argentina waters. En: F.N. Swain (ed.), Biology and Paleobiology of Ostracoda. Bulletin of American Paleontology 65: 502-517. [ Links ]
Whatley, R.C., Chadwick, J., Coxill, D. y Toy, N. 1987. New genera and species of Cytheracean Ostracoda from the SW Atlantic. Journal of Micropaleontology 6: 1-12. [ Links ]
Whatley, R.C., Chadwick, J., Coxill, D. y Toy, N. 1988. The ostracod family Cytheruridae from the Antartic and South West Atlantic. Revista Española de Micropaleontología 20: 171-203. [ Links ]
Whatley, R.C.; Toy, N.; Moguilevsky, A. y Coxill, D. 1995 Ostracoda from the South West Atlantic. Part I. The Falkland islands. Revista Española de Micropaleontología 27: 17-38. [ Links ]
Whatley, R.C., Moguilevsky, A., Chadwick, J., Toy, N. y Feijó Ramos M.I. 1997. Ostracoda from the South West Atlantic. Part II. The littoral fauna from between Tierra del Fuego and the Río de La Plata. Revista Española de Micropaleontología 29: 5-83. [ Links ]
Whatley, R.C., Moguilevsky, A., Chadwick, J., Toy, N. y Feijó Ramos, M.I. 1998. Ostracoda from the South West Atlantic. Part III. The Argentinian, Uruguayan and Southern Brazilian Continental Shelf. Revista Española de Micropaleontología 30: 89-116. [ Links ]
Zabert, L. 1978. Micropaleontología de la Formación Paraná (Mioceno Superior) en el subsuelo de la provincia de Santa Fe, República Argentina. FACENA 2: 101-165. [ Links ]
Recibido: 30 de octubre de 2003.
Aceptado: 17 de diciembre de 2004.














