Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ameghiniana
On-line version ISSN 1851-8044
Ameghiniana vol.45 no.4 Buenos Aires Dec. 2008
ARTICULOS ORIGINALES
Nuevo cangrejo violinista (género Uca, Ocypodidae) en el Plio-Pleistoceno del litoral pacífico de Honduras
Patricio Domínguez Alonso1
1Departamento de Paleontología y UEI de Paleontología. Facultad de Ciencias Geológicas e Instituto de Geología Económica. Universidad Complutense de Madrid-CSIC. C/ José Antonio Novais, 2. 28040 Madrid, España. patricio@geo.ucm.es
Resumen. Se describen los primeros cangrejos fósiles encontrados en Honduras; se trata de representantes del género Uca Leach, 1814 (Brachyura, Ocypodidae) procedentes del Plio-Pleistoceno del golfo de Fonseca en la costa pacífica de Honduras en la localidad de Cedeño, Departamento de Choluteca. Se conocen cerca de cien especies actuales de Uca, si bien el registro fósil de este género es muy incompleto ya que hasta la fecha tan sólo se conocían cinco fósiles descritos con información diagnóstica muy escasa. En este trabajo se describe Uca (Uca) marinae sp. nov. basada en un total de catorce individuos. Se trata de una especie de quela mayor plana emparentada con las actuales Uca ornata (Smith, 1870), U. maraconai (Latreille, 1802-1803) y U. insignis (Milne Edwards, 1852). El análisis filogenético confirma esas relaciones y establece la posición filogenética de la nueva especie y de U. antiqua (Mioceno, norte de Brasil) como el plesion más distal y basal respectivamente de U. ornata. El análisis filogenético tiene implicaciones biogeográficas, etológicas y de ocupación de biotopos pues muestra que los ancestros del grupo de especies Uca ornata, U. maraconai y U. insignis y las extinguidas U. marinae y U. antiqua debieron tener una distribución panamericana en un momento anterior al Mioceno inferior y que debió haber un evento de vicarianza reciente, seguramente tras el cierre del istmo de Panamá durante el Plio-Pleistoceno, entre U. insignis y U. maracoani y otro de edad indeterminada en el grupo basal de U. ornata.
Abstract. A new fiddler crab (genus Uca, Ocypodidae,) from the Plio-Pleistocene from the pacific coast of Honduras. The first fossils crabs from Honduras assigned to Uca Leach, 1814 (Brachyura, Ocypodidae) taken at Cedeño (Choluteca region) on the Pacific slope around the Gulf of Fonseca are described. Although Uca are common estuarine crustaceans with ~100 extant species across the globe, their fossil record is extremely scarce with only five described taxa. Moreover, these descriptions are based on very fragmentary fossils with poor diagnostic features. On the basis of fourteen silicified specimens, Uca (Uca) marinae sp. nov. is described here. With a large, flattened major cheliped, the new species is most likely related to the extant species Uca ornata, U. maracoani and U. insignis. Farther analysis indicates that the phylogenetic positions of both the new species as well as U. antiqua (Miocene, Northern Brazil) are relatively close to U. ornata. Biogeographic, ethologic, and ecologic interpretations imply that the last common ancestor for the extant forms, Uca ornata, U. maraconai and U. insignis, and the extinct congeners, U. marinae and U. antique, had a Pan-American distribution prior to the early Miocene and experienced at least two vicariance events. The most recent probably occurred after the closing of the trans-Panamanian seaway during the Plio-Pleistocene separating U. insignis and U. maracoani. During an earlier era, another event created a lineage stemming from an ancestor of U. ornata.
Palabras clave. Uca; Decapoda; Plioceno; Pleistoceno; Golfo de Fonseca; Honduras; América Central.
Key words. Uca; Decapoda; Pliocene; Pleistocene; Gulf of Fonseca; Honduras; Central America.
Introducción
Los cangrejos violinistas (Familia Ocypodidae, género Uca) se caracterizan por su marcado dimorfismo sexual y por la fuerte asimetría de los machos. Las hembras tienen dos pinzas (quelas) similares entre sí, de tamaño pequeño y frecuentemente curvadas con las que recolectan alimento. Por el contrario, los machos muestran en sus pinzas uno de los casos más llamativos de desarrollo asimétrico (figura 1): una de las pinzas es similar en tamaño, forma y función a las que poseen las hembras, mientras que la otra puede llegar a representar hasta la mitad de la masa corporal del animal. Esta quela es inútil para la recolecta de alimento y se ha convertido en un elemento de interacción social en comportamientos agonistas o de cortejo (Crane, 1975; Miller, 1969, 1973; Valiela et al., 1974; Yamaguchi, 2000). Además, tienen una compleja comunicación sonora que se realiza mediante golpeteos contra el sustrato o mediante frotación de estructuras estridulantes, singularmente las patas ambulatorias posteriores contra el caparazón, por lo que es posible inferir algunas de las pautas de comunicación de las especies extinguidas (Salmon, 1965; Burkenroad, 1947; Salmon y Atsaides, 1968; Hyatt, 1977).
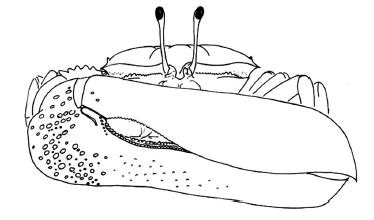
Figura 1. Reconstrucción de un macho de Uca marinae sp. nov. en vista frontal, mostrando el gran impacto visual del quelípedo mayor en comportamientos agonistas / reconstruction of a male Uca marinae sp. nov., frontal view, showing the great visual impact of the major chelipede in agonistic behaviours.
En la actualidad, los cangrejos violinistas se distribuyen en las zonas costeras tropicales y subtropicales de todo el mundo y casi siempre confinados a estuarios y manglares, donde el pacido de Uca ejerce un fuerte impacto en los ciclos de circulación de la materia orgánica epibentónica (Reinsel, 1995, 2004). A lo largo de los diferentes tramos de costa se pueden encontrar varias especies, si bien localmente tan sólo se encuentran de una a tres especies y siempre habitando biotopos diferentes, siendo posible determinar el habitat de una especie a partir de su morfología. (Crane, 1975; Thurman, 1977; Barnwell y Thurman, 1984; Levinton et al., 1996).
Se conocen en torno a un centenar de especies actuales de Uca de las que dos tercios proceden de las costas americanas del Pacífico y más de la mitad se concentran entre el Golfo de Fonseca (El Salvador, Honduras y Nicaragua) y la Bahía de Málaga (Colombia) (Crane, 1975; Levinton et al., 1996). Hasta la fecha, el fósil mas antiguo conocido procede del Mioceno inferior y este se trata de una especie relativamente avanzada por lo que el origen del género debería ser muy anterior, quizás vinculado con la aparición de los manglares de tipo moderno durante el Eoceno. Sin embargo, a pesar de esta antigüedad, tan sólo se conocen diez fósiles que se atribuyen a cinco especies, siendo la mitad muy fragmentarios como ápices de patas o quelas y de atribución dudosa.
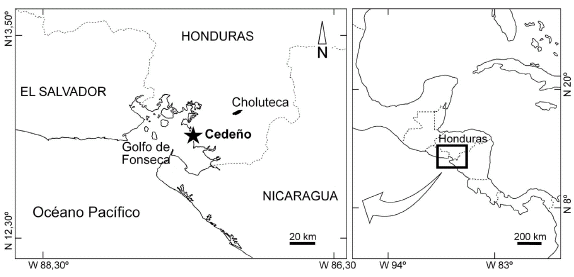
Figura 2. Golfo de Fonseca indicando la situación de Cedeño, la localidad de procedencia de los fósiles estudiados / map of the gulf of Fonseca and the village of Cedeño from where the fossils were collected.
El objetivo de este trabajo es describir una nueva especie, Uca (Uca) marinae sp. nov., basada en catorce ejemplares silicificados con una excelente calidad de detalles anatómicos. Además se propondrá hipótesis filogenética y biogeográfica para los cangrejos violinistas americanos de frente estrecha y gran talla [subgénero Uca (Uca)].
Contexto geológico y consideraciones tafonómicas
El Golfo de Fonseca se sitúa entre El Salvador, Honduras y Nicaragua. En esta región, la placa de Cocos subduce bajo el bloque de Chortis desarrollando el arco volcánico centroamericano. Durante el Mioceno medio, en la fosa hondureña se acumularon potentes series de ignimbritas de la Formación Padre Miguel que forman relieves topográficos de fuertes pendientes que cierran por el norte y noreste al golfo de Fonseca con cuencas que descargan en el Golfo de Fonseca rellenándolas con aluvial Plio-Pleistoceno rico en sílice (Álvarez-Gómez et al., 2007; Domínguez y Coca, 1998).
En la actualidad, las costas del Golfo de Fonseca están ocupadas por grandes extensiones de manglar, un ecosistema intermareal altamente dinámico con períodos de emersión seguidos de otros de inmersión con aguas de salinidad también muy variable y con una gran producción de biomasa que se incorpora al sedimento de una manera muy compleja. La presencia de U. marinae sugiere que este bosque ya estaba bien establecido en el Plio-Pleistoceno. Lima da Costa et al. (2004) encuentran que, para manglares maduros del Norte de Brasil, los valores de pH y de Eh son muy bajos en los primeros metros de superficie y suben en profundidad, donde suelen pasar a básicos y reductores, algo que parece común en muchos manglares. Sin embargo, el volcanismo local del Golfo de Fonseca podría controlar las condiciones geoquímicas acidificando las aguas intersticiales en los niveles profundos y medios de sedimento. Estas condiciones locales de bajo pH y Eh serían favorables para la preservación de la fase orgánica de la cutícula (lipoproteínas, quitina y proteínas) y la disolución de la fase mineral (principalmente calcita). En una primera fase de silicificación se podría producir el depósito de sílice en la matriz orgánica y en una fase posterior sustituir a esta última (Fernández López, com. pers., 2007).
Paleontología sistemática
Orden DECAPODA Latreille, 1802
Familia OCYPODIDAE Rafinesque, 1815
Género Uca Leach, 1814
Subgénero Uca (Uca) Leach (sensu Bott, 1954)
Especie tipo. Ocypode maracoani Latreille, 1802.
Diagnosis. Un subgénero de Uca de tamaño grande o mediano. Frente extremadamente estrecha con el extremo algo ensanchado; pedúnculos oculares notablemente estrechos y largos. Ojo en el lado más ancho del pedúnculo y en ocasiones con un estilo, único en el género. Cresta inferior de las cejas ausente. Sin elevaciones en la superficie de las órbitas. Quelípedo mayor con una cresta oblicua que en ocasiones se continúa hacia arriba hacia la cavidad carpal; sin cresta ornamentada en el borde superior de la cavidad carpal, que continua hacia la base del dactylus; ni el pollex ni el dactylus poseen un surco de gran tamaño; el pollex presenta una carena ventral (basada en Crane, 1975).
Diagnosis. A narrow-fronted species of the subgenus Uca (Uca) Leach (sensu Bott, 1954) of large to medium size. Suborbital margin with large crenellation, but indistinct near the antero-lateral angle. The antero-lateral angle of carapace acute. A large tubercle on the posterior part of the dorso-lateral margin, males without a file of small tubercles. Pollex and dactyllus of the major cheliped strikingly deep and compressed. External surface of the manus and basis of the pollex with tubercles, pollex conspicuously pitted and surface of the dactylus smooth. Merus with a serrated crest of large teeth. Horseshoe-shaped gonopore with a central tubercle.
Distribución. Mioceno-Actual. Costas americanas tropicales del Pacífico y del Atlántico y subtropicales del Pacífico Norte.
Especies incluidas y su distribución. Uca intermedia Prahl y Toro, 1985; Pacífico oriental - Panamá (ciudad de Panamá) hasta Colombia (Bahía de Buenaventura); Uca heteropleura (Smith, 1870) Pacífico oriental -desde El Salvador hasta el norte de Perú; Uca stylifera (Milne Edwards, 1852) Pacífico oriental -desde El Salvador hasta el norte de Perú; Uca molinifera (Rathbun, 1914) (= Uca (Uca) princeps molinifera) norte del golfo de California; Uca maracoani (Latreille, 1802-1803) Atlántico occidental- Venezuela y Brasil, Santo Domingo; Uca insignis (Milne Edwards, 1852) (=Uca (Uca) maracoani insignis) Pacífico oriental -desde El Salvador hasta el norte de Perú; Uca major (Herbst, 1782) Atlántico occidental - desde Panamá hasta la Guayana Francesa, Antillas occidentales, México (desde Veracruz a Tabasco); Uca princeps (Smith, 1870) Pacífico oriental -desde México a Perú; Uca ornata (Smith, 1870) Pacífico oriental -desde El Salvador hasta el norte de Perú; Uca antiqua (Brito, 1972) (=Uca (Uca) maracoani antiqua) Mioceno inferior, Brasil Estado de Pará; Uca (Uca) oldrodydi Rathbun, 1926 Plioceno, sur de California, EE.UU.
Uca (Uca) marinae sp. nov. Figuras 3 y 4
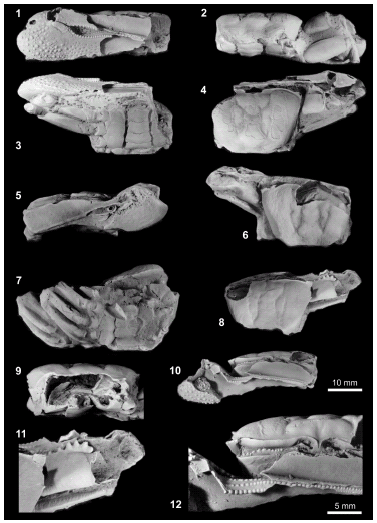
Figura 3. Machos de / males of Uca (Uca) marinae sp. nov. 1, Holotipo, FU001, vista frontal mostrando el quelípedo mayor / holotype, frontal view showing the major chelipede 2, Holotipo / holotype, FU001, vista inferior mostrando el quelípedo mayor, el segundo y tercer pereiópodos derechos y el abdomen / lower view showing the second and third right ambulatory pereiopodes and the abdomen. 3, Holotipo / holotype, FU001, vista posterior mostrando merus y carpus de la quela mayor y la cara posterior del tercer pereiópodo derecho / posterior view showing the merus and carpus of the major chelipede and the posterior face of third right pereiopode. 4, Holotipo / holotype, FU01, vista dorsal / dorsal view. 5, FU011, vista frontal, el quelípedo con el extremo del dactylus muy ensanchado / in frontal view,shows the chelipede with a wide distal part of the dactylus. 6, FU0011, vista dorsal / dorsal view. 7, FU008 (detrás) y FU009 (delante) en vista ventral, sobre el abdomen de FU009 se aprecia el dactylus del primer pereiópodo ambulatorio derecho / two specimens: FU008 (behind) and FU009 (in front), both of them in ventral view, on the abdomen of FU009 is the dactylus of the first right ambulatory pereiopode. 8, FU010 en vista posterior, se observa parte del endoesqueleto / posterior view, showing part of the endoskeleton 9, FU010 en vista dorsal / dorsal view. 10, FU010 en vista frontal / frontal view. 11, FU010 en vista dorsal, detalle de las serraciones del merus mayor / in dorsal view, detail of the serrations of the major merus. 12, FU010 en vista dorsal, detalle de la región orbital derecha con el pedúnculo ocular en su interior y detalle de las filas de tubérculos de la superficie oclusal del pollex mayor / frontal view, detail of the right orbital region with a in situ retracted right eyestalk and detail of the three rows of tubercles on the oclusal surface of the major pollex. Escala gráfica de 10mm para todas las figuras excepto para las figuras 11 y 12 que usan la de 5mm / scale bar = 10mm for all the figures except figures 11 and 12 where scale bar=5mm.
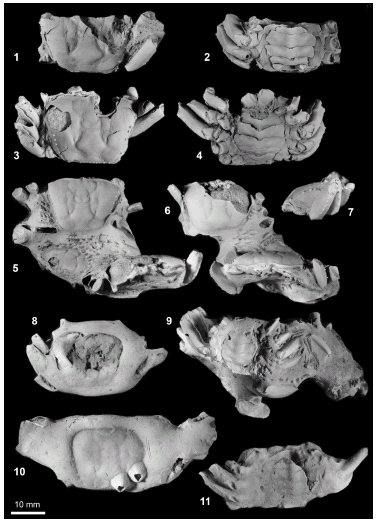
Figura 4. Hembras de / females of Uca (Uca) marinae sp. nov. 1,. FU006 en vista dorsal / in dorsal view. 2, FU006 en vista ventral mostrando el gran desarrollo discoidal del abdomen / in ventral view showing the large disc-shaped abdomen. 3, FU007 en vista dorsal / in dorsal view. 4, FU006 en vista ventral mostrando las regiones coxales de los pereiópodos / ventral view of the specimen FU006 showing the coxal region of the pereipodes. 5, Muestra con 4 individuos: FU002 (arriba, en vista dorsal), FU003 (en el medio a la izquierda), FU004 (en el medio a la derecha) y FU005 (abajo, en vista frontal) / hand sample with 4 individuals: FU002 (at the top, in dorsal view), FU003 (middle left), FU004 (middle right) y FU005 (bottom, in frontal view). 6, Muestra con 4 individuos: FU005 (arriba, en vista dorsal), FU002 (en el centro en vista frontal) y FU003 (por detrás de FU002 visible por encima y por debajo de él) / the same hand sample: FU005 (top, in dorsal view), FU002 (centre, in frontal view) and FU003 (behind of FU002). 7, FU006, vista lateral mostrando los meri del primer y segundo pereiópodos derechos / lateral view showing the merus of the first and second right pereiopodes. 8, nódulo silíceo con el ejemplar FU012, posiblemente una hembra, este ejemplar muestra parte del endoesqueleto / siliceous nodule containing FU012, probably a female; this specimen shows parts of the endoskeleton. 9, Muestra con 4 individuos, muestra cara inferior del ejemplar FU003; en el centro, abajo vista lateral de FU004 con tubérculos en la línea postero-lateral / hand sample with four individuals: lower face of FU003 and, behind of it; FU004 in lateral view showing the tubercles of the postero-lateral line. 10, Nódulo silíceo conteniendo a FU013, los cirrípedos son actuales / siliceous nodule containing FU013. The cirripedes are Recent. 11, FU011 con el abdomen que fue posteriormente eliminado para mostrar la forma de los gonoporos / the abdomen was removed to show the gonopores.
Derivación del nombre. Epíteto específico dedicado a la Prof. Mirna Marín, Departamento de Biología de la Universidad Nacional Autónoma de Honduras, Tegucigalpa, Honduras.
Diagnosis. Una especie del subgénero Uca (Uca) Leach (sensu Bott, 1954) de tamaño mediano a grande y de frente estrecha. Margen suborbital con crenulación de gran tamaño a lo largo de todo su recorrido, pero indistinta cerca del ángulo antero-lateral. Ángulo antero-lateral agudo. Gran tubérculo en la porción posterior del margen dorso-lateral, machos sin fila de pequeños tubérculos. Quelípedo mayor con pollex y dactylus de gran desarrollo, aplanados. Ornamentación de la cara externa del manus y base del pollex con tubérculos, pollex con fosetas y dactylus lisa. Merus con una cresta aserrada con grandes dientes; patas ambulatorias robustas con los márgenes ventrales con espinas romas. Gonoporo en forma de herradura con un tubérculo central.
Tipos. El ejemplar macho IHAN-FU001 es designado como holotipo (lámina 1, figuras 1-5). 13 ejemplares en numeración consecutiva de IAHN-FU002 a FU014 como paratipos.
Localidad y estrato tipo. Cedeño, Municipio de Marcovia, Departamento de Choluteca, Honduras. En materiales aluviales de facies de manglar de edad pliocena-pleistocena.
Material estudiado. El material estudiado procede en su totalidad de las colecciones de paleontología del Instituto Hondureño de Antropología e Historia (IHAH), por lo que los datos de localidad y estrato tipo son los que recoge la documentación e informes del IHAH. El material está constituido por dos lotes diferentes. El primer lote lo forman dos muestras antiguamente expuestas en la Sala de Paleontología del Museo de Antropología e Historia del IHAH, la menor de ellas posee un único ejemplar (FU001, holotipo) y la mayor contiene cuatro ejemplares (FU002-FU004); este material procede de la localidad de Cedeño, Municipio de Marcovia, Departamento de Choluteca, Honduras. El segundo lote corresponde a una donación anterior a 1995 realizada por Dª Corina de Bográn; se compone de ocho piezas de tamaños similares, una de ellas con dos ejemplares (FU008-FU009) y el resto con un único ejemplar (FU005-FU007, FU010-FU014). Los ejemplares FU001, FU008-FU011 son machos. Los ejemplares FU002-FU007, FU013 y FU014 son hembras. El ejemplar FU012 parece tratarse de una hembra.
Descripción
Caparazón, descripción general. Los ejemplares estudiados tienen un rango de tamaños desde moderado (longitud del caparazón entre 15 y 19 mm) hasta muy grande (longitud del caparazón entre 25 y 29 mm según la escala de Crane, 1975, p. 449). En vista dorsal, el caparazón tiene un contorno trapezoidal y en vista lateral es moderadamente convexo. Presenta las regiones bien marcadas por áreas deprimidas, resultando especialmente bien marcada la separación entre las regiones cardiaca y branquial, así como la totalidad del contorno de la región protogástrica. El límite entre las regiones hepática y branquial no es discernible externamente y apenas resultan diferenciados los límites transversales de las regiones frontal, mesogástrica, urogástrica, cardiaca e intestinal. La región orbital está restringida a la zona próxima a la región frontal y a la cresta o borde anterior del caparazón llegando hasta el ángulo anterolateral. En las regiones hepático-branquiales y pterigostomial se aprecian, en la mayoría de los ejemplares, tanto en los machos como en las hembras, unas estrías en forma de venas ramificadas. En la región hepático-branquial estas estrías son transversales, paralelas entre si en buena parte de su recorrido; una de estas "venas" destaca sobre las demás y recorre el caparazón en sentido longitudinal dividiendo las regiones hepático-branquiales en dos mitades adaxiales. En los ejemplares de menor tamaño no se han apreciado estilos (los juveniles de varias especies poseen ojos con un estilo en el ápice).
Machos
Caparazón. La superficie del caparazón es lisa o ligeramente granulosa. Las regiones branquiales y pterigostomiales pueden presentar venaciones poco marcadas o carecer de ellas. Las regiones pterigostomial y lateral son convexas. El surco frontal es muy estrecho, de lados paralelos y distalmente no divergen. El margen suborbital presenta unas crenulaciones orbitales grandes a lo largo de todo su recorrido, si bien cerca del ángulo antero-lateral resultan ser de un tamaño algo menor aunque sin llegar a presentar las diferencias observadas en Uca princeps, o en el grupo U. major. El margen suborbital, hacia la mitad de su longitud, sufre una inflexión hacia atrás muy acentuada. El ángulo antero-lateral no se conserva íntegro en ningún ejemplar estudiado, no obstante, en apariencia era moderadamente agudo. El margen antero-lateral es corto, granulado, pero sin dentículos; el área situada inmediatamente por debajo de él es lisa y no presenta tubérculos. El margen vertical lateral puede no presentarse, pero cuando lo hace tiene la parte inferior bien marcada aunque la superior apenas se insinúa. La parte anterior del margen dorso-lateral se encuentra poco marcada o ausente, la parte posterior puede presentar un tubérculo grande y redondeado en el ángulo formado con el margen posterior cerca de la escotadura del quinto pereiópodo, pero en los machos no se ha observado una fila de pequeños gránulos como ocurre en las hembras. En los machos tampoco se han observado fosetas indicadoras de pilosidad en esta área.
Quelípedo mayor. El pollex y el dactylus son muy comprimidos, fuertemente arqueados en sentido transversal y alongados, llegando a presentar una longitud igual o superior a tres veces la longitud del manus. La base del pollex está ornamentada con tubérculos con cierta ordenación en líneas radiales, las regiones media y distal presenta fosetas someras con un patrón de distribución similar al que presentan los tubérculos en el manus. La cara externa proximal del dactylus en lisa, sin tubérculos ni fosetas. Tanto el pollex como el dactylus son más estrechos en sentido dorsoventral cerca del manus que distalmente, llegando a formar un diastema de corta longitud. El merus presenta una cresta aserrada en el borde superior anterior a lo largo de toda su longitud con al menos ocho dientes, un patrón que es muy diferente de la que presenta Uca ornata, proximalmente estas espinas forman una serie de dientes aislados. La cara inferior del merus presenta una serie irregular de espinas. El carpus en su extremo superior-anterior presenta algunas espinas aisladas.
Patas ambulatorias. Los pereiópodos ambulatorios son robustos tanto en los machos como en las hembras, si bien en estas últimas las estructuras son más fuertes y numerosas. El ischium es robusto y no presenta espinas distales. El margen ventral posterior del merus se encuentra ornamentado con una fila de espinas romas, menos desarrolladas que en las hembras. Un ejemplar (IHAH-FU009) conserva el dactylus de la primera pata ambulatoria derecha, es robusto y aparentemente carece de uña.
Abdomen. Presenta las características propias del subgénero con cinco terguitos y telson, los terguitos medios libres, sin fusionarse. En los machos, los márgenes son subparalelos, ligeramente cóncavos y ocupa aproximadamente un tercio del esterno del cefalotórax.
Gonópodos. En el ejemplar FU010 pueden observarse parcialmente el extremo distal de los gonópodos. Son delgados, de sección subrectangular y sus ápices convergen.
Hembras
Caparazón. La superficie del caparazón es ligeramente rugosa, con tubérculos moderadamente grandes distribuidos irregularmente a lo largo de los márgenes dorso-lateral, posterior y vertical lateral. En cualquier caso, el margen dorso-lateral está marcado por una fila de pequeños gránulos. El ángulo antero-lateral es muy agudo y dirigido hacia el frente. El margen lateral puede tener, o no, tubérculos pequeños y redondeados. El margen vertical-lateral siempre está bien marcado y presenta tubérculos. El margen posterior presenta igualmente una fila de tubérculos redondeados. En el área posterior del caparazón, a juzgar por las fosetas que se encuentran en esta área, debió existir una pilosidad poco densa que se extendía hasta el margen dorsal de la cuarta pata ambulatoria.
Patas ambulatorias. Las hembras poseen merus fuertes, su margen ventral posterior presenta una fila de espinas romas bien desarrolladas.
Gonoporos. Se han podido observar en el ejemplar FU014 una vez que se ha levantado el abdomen. El gonoporo resulta ser similar al que presentan las hembras de Uca (Uca) maracoani y U. insignis; en él se encuentra un pequeño tubérculo o elevación rodeada por tres de sus lados por el gonoporo que tiene forma de herradura.
Abdomen. En las hembras el abdomen es de contorno subcircular, muy ancho, alcanzando casi las coxas de las patas ambulatorias y ocultando prácticamente la totalidad de la región esternal del cefalotórax.
Relaciones y diferencias
Uca marinae sp. nov. se diferencia claramente de U. heteropleura (Smith, 1870), U. major (Herbst,1782) y U. stylifera (Milne Edwards, 1852) por el tamaño, y por la forma de la quela mayor de los machos. Los machos de U. princeps (Smith, 1870) se diferencian de los de Uca marinae por no tener marcado el margendorsolateral y si lo está, nunca tiene tubérculos, tan sólo gránulos; no tienen venaciones en las regiones branquio-hepática y pterigostomial. Las hembras de U. maracoani (Latreille, 1802) nunca tienen tubérculos moderadamente grandes distribuidos irregularmente a lo largo del margen posterior como U. marinae sino sólo en el margen dorso-lateral y vertical lateral. U. marinae como U. ornata y U. princeps nunca tiene tubérculos en los márgenes dorsolaterales. Para otros caracteres, véase apéndices 1 y 2.
Fósiles descritos de cangrejos violinistas
Es notorio que a pesar del elevado número de especies de Uca (o incluso de Ocypodidae), de su amplia distribución geográfica y de que una especie filogenéticamente derivada como es Uca antiqua ya existiera en el Mioceno Inferior, hasta la fecha tan sólo se conocieran diez fósiles correspondientes a cinco grupos (especies e incertae sedis) basados en restos muy fragmentarios e incluso carentes de caracteres diagnósticos. Los fósiles conocidos hasta ahora son:
1- Uca (Minuca?) hamlini Rathbun, 1926 basada en un quelípedo mayor procedente del Plioceno de Los Ángeles, California.2- Un dactylus de una pata ambulatoria atribuido por Rathbun (1918) a Uca (Minuca) macrodactylus (Milne-Edwards y Lucas, 1843). Sin embargo, Crane (1975) pone de manifiesto que las diferencias intragenéricas de los dactili ambulatorios no se conocen lo suficientemente bien como para poder atribuir este fósil a una especie concreta.
3- Uca (Uca) oldrodydi Rathbun, 1926 del Plioceno de Deadman, Los Ángeles, California. basdada en un único ejemplar macho carente de quelípedos actualmente depositado en Smithsonian Institution, (USNM 1371025). En opinión tanto de Rathbun (1926) como de Crane (1975), Uca (Uca) oldrodydi es similar a Uca (Uca) princeps monilifera.
4- Demarest (1817) describió Goneplax nitida, basándose en un cuarto ejemplar fósil; posteriormente lo asignó a Gelasima (Desmarest, 1822) y finalmente a Gelasimus (Desmarest, 1825), un sinónimo de Uca. Este ejemplar hoy desaparecido, podría ser atribuido según Crane (1975) a cualquiera de los subgéneros Uca (Thalassuca), Uca (Deltuca) o Uca (Uca).
5- Brito (1972) describe seis ejemplares, todos ellos machos, procedentes de la Formación Pirabas (Mioceno inferior), del estado de Pará, Brasil, como U. (Uca) maracoani antiqua, una nueva subespecie de una especie actual brasileña y señala como diferencias la altura del dactylus respecto al propodus del quelípedo mayor.
Además de estos fósiles corporales, Curran y Martin (2003) describen para el Pleistoceno de Bahamas icnofósiles atribuidos a galerías excavadas en ambientes intertidales por Uca.
Por último, es relevante otro ejemplar fósil procedente del Plioceno de Jamaica asignado a Macrophtalmus (Rathbun, 1919), un género que en la actualidad se distribuye en el área indopacífica, y que junto a los anteriores representarían todos los fósiles descritos hasta la fecha para la Família Ocypodidae.
Filogenia del subgénero Uca (Uca)
En el análisis filogenético se han incluido las especies U. intermedia, U. heteropleura, U. stylifera, U. major, U. princeps, U. maracoani, U. insignis, U. ornata, U. antiqua† y U. marinae† sp. nov. Para enraizar el árbol obtenido se ha elegido U. tangeri como grupo externo. No se han incluido en el análisis las especies U. monilifera y U. oldroydi†, si bien en la hipótesis filogenética propuesta se situarán según los criterios de Rathbun, 1926 y Crane, 1975. En opinión de estos autores Uca (Uca) oldrodydi es similar a Uca (Uca) monilifera. Por otra parte, U. monilifera fue descrita originalmente como una subespecie de U. princeps de la que representaría las poblaciones más septentrionales (Rathbun, 1914; Crane, 1975; Rosenberg, 2001).
La serie de transformación de caracteres está basada en estudios y recopilaciones previos, fundamentalmente Rosenberg (2001) que a su vez está basada inicialmente en otras fuentes y modificada según sus propias observaciones. Se realiza un análisis inicial con caracteres exclusivamente morfológicos, que se amplía posteriormente con caracteres etológicos codificados según Crane (1975). Los estados de los caracteres se han tomado de la bibliografía existente, fundamentalmente del texto y figuras de Brito (1973) para U. antiqua, del material examinado de la nueva especie y de ejemplares actuales de U. tangeri recolectados por el autor en las costas de Huelva (España). Las series de transformación de los caracteres aparecen listados en el Apéndice 1.
Se ha preparado una matriz de 86 caracteres filogenéticamente informativos y 11 especies (véase Apéndice 2) y se ha analizado con PAUP* 4.0b (Swofford, 1999). Se han considerado todos los caracteres como desordenados y de igual peso. Se ha realizado una búsqueda exhaustiva. Tras realizar una búsqueda se han obtenido 3 árboles más parsimoniosos de longitud 142 (índice de consistencia (CI) = 0,61; índice de retención (IR) = 0,74; índice reescalado de retención (RC) = 0,46; siendo la longitud mínima posible de 88 y la máxima posible de 300). De los 3 árboles más parsimoniosos por el método del repesaje sucesivo (Farris, 1969) reescalando los pesos según el RC se obtuvo un único árbol que coincide con el árbol consenso 50% majority rule. Este árbol coincide con los trazos contínuos del árbol de la figura 4. Se realizó un análisis de bootstrap (5.000 pseudoréplicas), los valores se indican en los internodos de la figura 5.
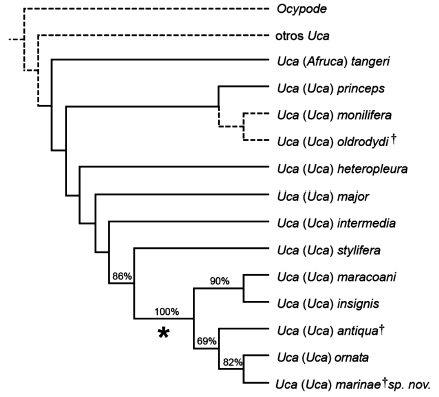
Figura 5. Hipótesis filogenética propuesta para el subgénero Uca (Uca) Leach (sensu Bott, 1954) basado en el consenso 50% majority rule del análisis realizado (líneas contínuas). Mediante líneas punteadas se indica la posible posición de Uca (Uca) monilifera y Uca (Uca) oldrodydi. Uca (Afruca) tangeri ha sido considerada grupo externo. En los internodos se indican los valores relevantes de Bootstrap. Con un asterisco (*) se indica el clado U. maracoani. Con el símbolo † se señalan las especies extinguidas / phylogenetic hypothesis for the subgenus Uca (Uca) Leach (sensu Bott, 1954). In dashed lines is noted the suggested position of Uca (Uca) monilifera, and Uca (Uca) oldrodydi†. Uca (Afruca) tangeri is the external group. In some internodes are the relevant Bootstrap values. The clade U. maracoani is noted with noted with an asterisk. The symbol † indicates the extinct species. In regular lines is the 50% majority rule of the three most parsimonious trees.
U. marinae se agrupa con U. ornata con un índice de soporte bootstrap del 84% y estos dos son a su vez con U. antiqua con un índice de soporte bootstrap relativamente bajo (66%). Por su parte, el clado (U. insignis, U. maraconai) con un alto soporte (92%) es el grupo hermano del clado ((U. ornata, U. marinae) U. antiqua). El clado (((U. ornata, U. marinae) U. antiqua), (U. insignis, U. maraconai)), que comprende los Uca de grandes pinzas mayores aplanadas, tiene un soporte máximo (100%). En lo sucesivo nos referiremos a este clado como "clado U. maraconai".
Observando los tres árboles más parsimoniosos obtenidos en el análisis, se evidencian cambios de posición de dos de los taxones, U. antiqua y U. insignis, que no son congruentes en todos los árboles y fueron eliminados en análisis subsecuentes. Al eliminar U. insignis se obtenía un único árbol de L = 130 (CI = 0,66; IR = 0,77; RC = 0,51). Sin embargo, al eliminar U. antiqua se obtenían dos árboles de L = 141 (CI = 0,62; IR = 0,73; RC = 0,4). Por último, al eliminar U. antiqua y U. intermedia se obtenía un único árbol de L = 129 con CI = 0,67; IR = 0,76; RC = 0,51, unos valores que no mejoran significativamente los obtenidos en el análisis general. En el caso de U. antiqua, los cambios de posición pueden explicarse como una consecuencia de que se tan sólo se ha podido codificar el 37% de los caracteres considerados (32 de 86). En el caso de U. insignis por simple homoplasia (incluyendo convergencia). Por otra parte, la inclusión de U. insignis induce una redistribución de los cambios de estado de caracteres en la topología manifestada como una incertidumbre en la posición de U. antiqua.
Consideraciones sobre el grupo externo Uca (Afruca) Crane, 1975
El subgénero monoespecífico Uca (Afruca) fue propuesto por Crane (1975) para Uca tangeri (Eydoux, 1835) que es la única especie que se encuentra en las costas del Atlántico oriental. Estudios tanto morfológicos (Crane, 1975; Rosenberg, 2001) como moleculares (Levinton et al., 1996; Sturmbauer et al., 1996) evidencian que el subgénero Uca Leach (sensu Bott, 1954) y Afruca (Crane, 1975) son grupos hermanos, si bien Rosenberg (2001) encuentra poca justificación en mantener a Uca tangeri separada del resto de las especies de Uca (Uca) en un subgénero independiente. En cualquier caso, tanto si Uca tangeri es considerada el único representante del subgénero Afruca Crane, 1975, como si se incluye dentro del subgénero Uca Leach (sensu Bott, 1954), se puede considerar como la especie hermana del resto de los representantes americanos de Uca (Uca) y como tal la consideraremos en nuestro análisis filogenético.
A diferencia de Crane (1975) que consideraba el origen del género Uca en las Indias orientales y que por lo tanto el subgénero Uca era muy derivado, los resultados de Rosenberg (2001), Levington et al. (1996) y Sturmbauer et al. (1996) sugieren una separación temprana del género Uca en dos clados, uno formado por los Uca de afro-americanos de gran tamaño (subgéneros Uca y Afruca) y otro correspondiente al resto de las especies que se distribuirían en el Indo-Pacífico y costas americanas del Atlántico. Por otro lado, Rosenberg (2001) también sugiere la separación temprana de los Uca (Uca) americanos (todos ellos con frente estrecha), de los africanos (con frente ancha) en lo que, en definitiva, era la propuesta original de Crane 1975 al proponer el subgénero Afruca para las formas africanas.
Resultados y discusión
Uno de los resultados más relevantes del análisis filogenético es el gran soporte obtenido para el clado U. maracoani que debió tener una distribución panamericana en un momento anterior al Mioceno inferior.
Uca insignis fue considerada durante un tiempo como una subespecie de U. maracoani, la primera habitando las costas pacíficas y la segunda las atlánticas. Crane (1975) resalta la similitud externa entre las hembras de U. insignis y las de U. ornata (ambas especies del Pacífico), aunque la forma general de los gonoporos de U. insignis coinciden con los de U. maracoani (las genitalias de los artrópodos actúan como un eficaz sistema de aislamiento entre especies similares mediante un sistema llave-cerradura por lo que su estudio es uno de los métodos taxonómicos más eficaces en la determinación de especies). La gran similitud entre U. insignis y U. maracoani induce a pensar en un evento de vicarianza reciente tras el cierre del istmo de Panamá (aproximadamente hace unos 5 Ma, Lear et al., 2003). Asimismo, la separación del linaje del último ancestro común de U. insignis y U. maracoani del de U. ornata tuvo que suceder en un momento anterior al Mioceno inferior ya que ésta es la edad atribuida a U. antiqua que es el plesion más basal de U. ornata. Además, la edad de U. antiqua hace que la edad atribuida a U. marinae (coincidente grosso modo con el cierre del istmo de Panamá) sea poco relevante en este contexto. Beinlich y von Hagen (2006) sugieren que la gran dispersión de Uca pudo ocurrir en el Eoceno ya que estos cangrejos están actualmente asociados con los manglares de Rhizopora, Avicenia y Sonneratia que, según la evidencia palinológica recopilada por Specht (1981), aparecieron en Australia durante el Eoceno.
Por otra parte, el gonoporo de las hembras de U. marinae, en forma de herradura rodeando un tubérculo central es del mismo tipo que el de U. maracoani y U. insignis, lo que nos indica que la modificación del gonoporo en U. ornata podría indicar un caso de especiación simpátrida (sensu lato) con, al menos, aislamiento mecánico entre U. marinae y los ancestros de U. ornata.
Respecto al aislamiento etológico, cabe decir que las pautas de salutación de los machos actuales del U. ornata, U. insignis y U. maracoani coinciden en los componentes de salutación números 4, 8, 9, 11 y 12 y en los de combate números 1 y 2 de Crane (1975), si bien el de U. insignis no es conocido en detalle.
En los machos actuales del clado U. maracoani, la salutación a alta intensidad es completamente circular, con el quelípedo levantado sobre el cuerpo con pollex y dactylus abiertos y orientados hacia arriba describiendo círculos horizontales repetidos en el aire.
Este movimiento va acompañado de oscilaciones de la quela menor y de levantamiento del cuerpo por extensión de las patas ambulatorias, con movimientos oscilatorios que podrían estar relacionados con el mantenimiento del equilibrio (Crane, 1975). Respecto a los combates rituales, las especies actuales del clado U. maracoani comparten el componente 1 de Crane (1975) donde los machos frotan las caras externas del manus mayor (esta zona tiene tuberculación) y el componente 2 que es agonístico agresivo, donde el manus es elevado mientras el ápice de pollex y dactylus son orientados hacia el sustrato, el cuerpo se inclina acentuando la inclinación de la quela para finalmente abrirla a partir de este momento las quelas se traban y los dactili de las patas ambulatorias primera y segunda se enganchan al contrario para hacerle perder equilibrio y posiblemente también para estridular. Se trata éste de un comportamiento que poseen todas las especies de quelas mayores aplanadas y que diferencia al clado U. maracoani del resto de especies de Uca (Uca) y que, salvo modificaciones de conducta apomórficas, seguramente sería compartido por U. marinae y U. antiqua. Sin embargo, las diferencias dentro del clado U. maracoani son importantes en la salutación a baja intensidad por lo que estas deberían ser consideradas derivadas.
Por otra parte, todas las especies del clado U. maracoani ocupan biotopos similares. Estas especies siempre ocupan ambientes relativamente resguardados como llanuras fangoso-arenosas en canales y sus desembocaduras frecuentemente cerca de la vegetación e incluso con sombra así como en llanuras abiertas arenoso-fangosas de lagoon (Crane, 1975). Estos ambientes son congruentes con la granulometría del sedimento de la matriz rocosa de los fósiles de U. marinae sp. nov. El resto de las especies del subgénero Uca ocupan ambientes menos restringidos y arenosos de bahía, en llanuras fangoso-arenosas de desembocaduras de canales y en áreas emergibles del lagoon.
Observaciones. Crane (1975) mantiene la superespecie Uca (Uca) [Major] para agrupar a las especies Uca (Uca) [Major] major (Herbst, 1782) y Uca (Uca) [Major] heteropleura (Smith, 1870). Nuestro análisis sitúa a la superespecie "Major" en una posición parafilética que no debería mantenerse.
Por otra parte, Crane (1975) considera que Uca (Uca) stylifera (Milne-Edwards, 1852) es una especie muy cercana a Uca (Uca) heteropleura (Smith, 1870) (Crane, 1975, p.140), tan próxima que durante cierto tiempo las consideró sinónimos (Crane, 1975, p. 134). Tras analizar el comportamiento de salutación, esta autora concluye que se trata de especies diferentes y cercanas a Uca (Celuca) beebei y Uca (Celuca) stenodactylus que son pertenecientes a otro subgénero.
Conclusiones
Se describe, Uca marinae sp. nov., una nueva especie de cangrejo violinista del subgénero Uca procedente del Plio-Pleistoceno de las costas pacíficas de Honduras. Se trata de una especie de quela mayor plana emparentada con las actuales Uca ornata, U. maraconai y U. insignis. El análisis filogenético realizado confirma esas relaciones y sitúa además a U. antiqua del Mioceno del norte de Brasil como el plesion más basal de U. ornata y a U. marinae como el plesion más distal. El análisis filogenético tiene implicaciones biogeográficas, etológicas y de ocupación de biotopos para U. marinae y para U. antiqua pues muestra que los ancestros del grupo de especies Uca ornata, U. maraconai y U. insignis y las extinguidas U. marinae y U. antiqua debieron tener una distribución panamericana en un momento anterior al Mioceno inferior y que debió haber un evento de vicarianza reciente, seguramente tras el cierre del istmo de Panamá durante el Plio- Pleistoceno, entre U. insignis y U. maracoani y otro de edad indeterminada en el grupo basal de U. ornata.
Apéndice 1. Series de transformación de caracteres / character transformation series.
1. Región epibranquial sin (0) o con (1) setas.
2. Isquion menor sin (0) o con (1) tubérculo en el margen ventral anterior.
3. El espacio entre pollex y dactylus cuando están cerrados mide la mitad de la anchura del dactylus (0), entre la mitad y la anchura del dactylus (1) o es mayor que la anchura del dactylus.
4. quelípedo menor sin (0) o con (1) serraciones en el borde oclusal.
5. Margen antero-dorsal del merus mayor sin (0) o con (1) tubérculos.
6. Margen antero-dorsal del merus mayor sin diente distal (0) o con él (1).
7. Margen antero-dorsal del merus mayor sin (0) o con (1) un gran reborde convexo.
8. Margen dorsal del merus mayor sin (0) o con (1) pilosidad.
9. Margen antero-dorsal proximal del carpus mayor con un diente grande (1) o sin él (0).
10. Margen dorsal del carpus mayor con pilosidad (1) o sin ella (0).
11. Abertura oclusal del quelípedo mayor con pilosidad (1) o sin ella (0).
12. Margen dorsal externo del manus mayor es liso (0) o rugoso (1).
13. Cara externa del manus mayor con un surco por fuera de la cúspide del dactylus (1) o sin surco (0).
14. Superficie inferior de la cara externa del manus mayor con tubérculos (0) o grandes (1).
15. la cresta oblicua de la palma del quelípedo mayor acaba en la cavidad carpal (0) o en el margen inferior (1).
16. La palma del quelípedo mayor tiene un borde tuberculado que discurre a lo largo de la cresta oblicua y dactylus (1) o sin él (0).
17. Cresta media de tubérculos de la superficie oclusal del pollex mayor con un gran diente medio (1) o sin él (0).
18. Cresta media de tubérculos de la superficie oclusal del pollex mayor con un gran diente subdistal (1) o sin él (0).
19. Cresta media de tubérculos de la superficie oclusal del dactylus mayor con un gran diente medio (1) o sin él (0).
20. Cresta media de tubérculos de la superficie oclusal del dactylus mayor con un gran diente subdistal (1) o sin él (0).
21. Cresta interna de tubérculos de la superficie oclusal del dactylus mayor con un gran tubérculo adicional en el borde interno del dactylus (1) o sin él (0).
22. Fila interna de tubérculos del dactylus mayor próximalmente ausente (0) o presente (1).
23. Fila externa de tubérculos del dactylus mayor distalmente ausente (0) o presente (1).
24. Fila de tubérculos interna del pollex mayor se extiende hasta la base del dactylus (0) o la sobrepasa (1).
25. La longitud del dactylus mayor es menor o igual que la longitud del manus (0), entre una o dos veces mayor que el manus (1) o más del doble (2).
26. Surco medio externo del pollex mayor con pilosidad (1) o sin ella (0).
27. Pollex mayor de la menor anchura que el dactylus (1) o de la misma anchura o mayor que el dactylus (0).
28. Pollex y dactylus mayores con finas espinas puntiagudas orientadas hacia dentro (1) o sin ellas (0).
29. Cara externa del pollex mayor sin (0) o con (1) tuberculación.
30. Cara externa del dactylus mayor sin (0) o con (1) tuberculación.
31. Cara externa del pollex mayor sin (0) o con (1) fosetas.
32. Merus de la primera pata ambulatoria es fino (0) o ensanchado (1).
33. Pilosidad presente (0) o ausente (1) en el manus de la primera pata ambulatoria.
34. Pilosidad presente (0) o ausente (1) en el carpus de la primera pata ambulatoria.
35. Pilosidad presente (0) o ausente (1) en el merus de la primera pata ambulatoria.
36. Pilosidad presente (0) o ausente (1) en el manus de la segunda pata ambulatoria.
37. Pilosidad presente (0) o ausente (1) en el carpus de la segunda pata ambulatoria.
38. Pilosidad presente (0) o ausente (1) en el merus de la segunda pata ambulatoria.
39. Pilosidad presente (0) o ausente (1) en el manus de la tercera pata ambulatoria.
40. Pilosidad presente (0) o ausente (1) en el carpus de la tercera pata ambulatoria.
41. Pilosidad presente (0) o ausente (1) en el merus de la tercera pata ambulatoria.
42. Pilosidad presente (0) o ausente (1) en el carpus de la cuarta pata ambulatoria.
43. Pilosidad presente (0) o ausente (1) en el merus de la cuarta pata ambulatoria.
44. Un gran diente presente (1) o ausente (0) en el margen posteroventral del merus de la primera pata ambulatoria.
45. Un gran diente presente (1) o ausente (0) en el margen posteroventral del merus de la segunda pata ambulatoria.
46. Un gran diente presente (1) o ausente (0) en el margen posteroventral del merus de la tercera pata ambulatoria.
47. Serración en el margen postero-ventral del merus de la primera pata ambulatoria ausente (0) o presente (1).
48. Serración en el margen dorsal del merus de la primera pata ambulatoria ausente (0) o presente (1).
49. Serración distal en el margen antero-ventral del merus de la segunda pata ambulatoria ausente (0) o presente (1).
50. Serración proximal en el margen antero-ventral del merus de la segunda pata ambulatoria ausente (0) o presente (1).
51. Serración en el margen postero-ventral del merus de la segunda pata ambulatoria ausente (0) o presente (1).
52. Serración en el margen dorsal del merus de la segunda pata ambulatoria ausente (0) o presente (1).
53. Serración distal en el margen antero-ventral del merus de la tercera pata ambulatoria ausente (0) o presente (1).
54. Serración proximal en el margen antero-ventral del merus de la tercera pata ambulatoria ausente (0) o presente (1).
55. Serración en el margen postero-ventral del merus de la tercera pata ambulatoria ausente (0) o presente (1).
56. Serración en el margen dorsal del merus de la segunda pata tercera ausente (0) o presente (1).
57. Serración distal en el margen antero-ventral del merus de la cuarta pata ambulatoria ausente (0) o presente (1).
58. Serración proximal en el margen antero-ventral del merus de la cuarta pata ambulatoria ausente (0) o presente (1).
59. Serración en el margen postero-ventral del merus de la cuarta pata ambulatoria ausente (0) o presente (1).
60. Serración en el margen dorsal del merus de la cuarta pata ambulatoria ausente (0) o presente (1).
61. Las cejas son más estrechas (0) o iguales o más gruesas (1) que el pedúnculo ocular.
62. Crenulaciones suborbitales fusionadas o ausentes del margen orbital (0) o discurren a lo largo de toda la longitud del margen (1).
63. El margen vertical lateral del caparazón se extiende subdorsalmente (0) o se sitúa en la superficie dorsal (1).
64. El caparazón es ligeramente redondeado (0), plano (1), o fuertemente convexo (2).
65. Márgenes antero-laterales del caparazón convergentes (0), paralelos (1), o divergentes (2).
66. Forma de los márgenes antero-laterales del caparazón aguda (0) o cuadrada (1).
67. Las puntas de los ángulos anterolateral apuntan hacia la frente (0), están en ángulo (1), o hacia los lado (2).
68. Los márgenes dorso-laterales del caparazón están formados por una hilera de tubérculos microscópicos (0) o contienen tubérculos grandes y bien espaciados (1).
69. El caparazón es liso (0) o rugoso (1). 70. Gran tubérculo presente (1) o ausente (0) en el extremo posterior del los márgenes dorso-laterales.
71. Gonópodo con torsión (1) o sin ella o muy ligera (0).
72. "Pulgar" del gonópodo presente (1) o ausente (0).
73. Reborde anterior del gonópodo es pequeño (0) o grande (1).
74. Reborde anterior del gonópodo termina en el poro (0) o por encima del poro (1).
75. Reborde posterior del gonópodo acaba en el poro (0) o por encima del poro (1).
76. Extremo del gonópodo es redondeado (0) o se proyecta como un tubo (1).
77. El proceso interno del gonópodo es una espina afilada (0), o es túmido y carnoso (1), o es una plataforma triangular plana (2).
78. Gonópodo sin (0) o con (1) una gran proyección aplanada bajo la base del tubo.
79. Pollex y dactylus muy comprimidos (1), caso contrario (0).
80. Diastema corta (0) o larga (1).
81. Salutación: componente nº 3 (1), sin este componente (0).
82. Salutación: componente nº 5 (1), sin este componente (0).
83. Salutación: componente nº 8 (1), sin este componente (0).
84. Salutación: componente nº 10 (1), sin este componente (0).
85. Salutación: componente nº 11 (1), sin este componente (0).
86. Salutación: componente nº 12 (1), sin este componente (0)
Caracteres basados en Bairagi y Misra, 1988 (carácter 66); Collins et al., 1984 (caracteres 12 y 62); Crane, 1975(caracteres 5, 7, 31, 61, 79-86); George and Jones, 1982 (carácter 4); Jones and Morton, 1994 (carácter 6); Rosenberg, 2001 (caracteres 1-3, 8-11, 13-30, 32-60, 63-65, 67, 70-78); Thurman, 1979 (carácter 69) y von Hagen and Jones, 1989 (caracteres 4 y 68).
Apendice 2. Análisis filogenético: tabla de caracteres / phylogenetic analysys: matrix of characters.

Agradecimientos
Deseo agradecer a C. Thurman, de la University of Northern Iowa; a S.R. Fernández López de la Universidad Complutense de Madrid; a D. Roccatagliata y a B. Aguirre-Urreta, ambos de la Universidad de Buenos Aires por la lectura crítica del manuscrito y sus aportaciones al mismo. También deseo agradecer a O.M. Joya; C.J. Fajardo, P.R. Gómez y L.O. González del Instituto Hondureño de Antropología e Historia las atenciones prestadas durante mi estancia en dicho instituto. Este trabajo es una contribución al Grupo de Trabajo UCM 910161 "Registro geológico de periodos críticos: factores paleoclimáticos y paleoambientales" liderado por N. López Martínez, Universidad Complutense de Madrid.
Bibliografía
1. Álvarez-Gómez, J.A., Meijer, P. Th., Martínez-Díaz, J.J. y Capote, R. 2007. On the active tectonics of northern Central America and Middle America Trench: Constraints from finite element modelling. Workshop to Integrate Subduction Factory and Seismogenic Zone Studies in Central America. Heredia, Costa Rica. World Wide Web: http://www.nsf-margins.org/CostaRica2007 (9 Junio 2006). [ Links ]
2. Bairagi, N. y Misra. A. 1988. On the taxonomic status of Gelasimus acutus Stimpson (Decapoda: Ocypodidae) present in the national collection of the Zoological Survey of India, Calcutta. Journal of the Bombay Natural History Society 85: 449-451. [ Links ]
3. Barnwell, F. H. y Thurman, C. L. 1984. Taxonomy and biogeography of fiddler crabs (Ocypodidae: genus Uca) of the Atlantic and Gulf coasts of eastern North America. Zoological Journal of the Linnean Society 81: 23-87. [ Links ]
4. Beinlich, B. y von Hagen, H. O. 2006. Materials for a more stable subdivision of the genus Uca Leach. Zoologische mededeelingen 80: 9-32 [ Links ]
5. Bott, R. 1954. Dekapoden (Crustacea) aus El Salvador. 1. Winkerkrabben (Uca). Senckenbergiana biologica 35: 155-180. [ Links ]
6. Brito, I.M. 1972. Contribuição ao conhecimento dos crustáceos decápodos da formação Pirabas. II-O gênero Uca (Brachyura-Ocypodidae). Anais da Academia Brasileira de Ciências 44: 95-98. [ Links ]
7. Burkenroad, M.D. 1947. Production of sound by the fiddler crab, Uca pugilator Bosc, with remarks on its nocturnal mating behaviour. Ecology 28: 458-462. [ Links ]
8. Collins, M.J., Jones, D.A. y Clayton. D.A. 1984. Redescription of Uca sindensis (Alcock, 1900) (Brachyura: Ocypodidae) with notes on the ecology of a population from Kuwait. Journal of Crustacean Biology 4: 318-328. [ Links ]
9. Crane, J. 1975. Fiddler crabs of the world. Ocypodidae: Genus Uca. 736 pp. Princeton, N. J.: Princenton University Press [ Links ]
10. Curran, H.A. y Martin, A.J. 2003. Complex decapod burrows and ecological relationships in modern and Pleistocene intertidal carbonate environments, San Salvador Island, Bahamas. Palaeogeography, Palaeoclimatology, Palaeoecology 192: 229-245 [ Links ]
11. Desmarest, A.G. 1817. Crustacés fossiles. En: Dictionnaire d'histoire naturelle. 8. Edited by J.B. Biot. pp. 495-519. [ Links ]
12. Domínguez, P. y Coca, M.M. 1998. Nidos de avispas minadoras en el Mioceno de Tegucigalpa (Honduras, América Central): Coloquios de Paleontología 49: 93-114 [ Links ]
13. Eydoux, F. 1835. Nouvelle espèce de Gélasime. Magasin de Zoologie 5: 4 pp. [ Links ]
14. Farris, J.S. 1969. A successive approximations approach to character weighting. Systematic Zoology 18: 374-385. [ Links ]
15. George, R.W. y Jones. D.S. 1982. A revision of the fiddler crabs of Australia (Ocypodinae: Uca). Record of the Western Australian Museum Supplement 14: 1-99. [ Links ]
16. Hagen, H.O. 1975. Klassifikation und Phylogenetische Einordnung der Lautäusserungen von Ocypodiden und Grapsiden (Crustacea, Brachyura). Zeitschrift für Zoologische Systematik und Evolutionsforsch 13: 300-316 [ Links ]
17. Herbst J.F.W. 1782-1804. Versuch einer Naturgeschichte der Krabben und Krebse, nest einer systematischen. Beschreibung ihrer verschiedenen Arten, Vol. 1-3. Berlin & Stralsund. 515 pp. [ Links ]
18. Hyatt, G.W. 1977. Quantitative analysis of size-dependent variation in the fiddler crab wave display (Uca pugilator, Brachyura, Ocypodidae). Marine Behaviour and Physiology 5: 19-36. [ Links ]
19. Jones, D.S. y Morton, B. 1994. The fiddler crabs (Ocypodidae: Uca) of Hong Kong. Asian Marine Biology 11: 9-40. [ Links ]
20. Latreille, P.A. 1802-1803. Histoire naturelle, générale et particulière des crustacés et des insectes: ouvrage faisant suite aux oeuvres de Leclerc de Buffon, et partie du cours complet d'histoire naturelle rédigé par C. S. Sonnini. Volume VI Paris. [ Links ]
21. Leach, W.E. 1814. Crustaceology. Pp. 383-437 in The Edinburgh Encyclopedia, Volume VII. David Brewster. [ Links ]
22. Lear, C.H., Rosenthal, Y. y Wright J.D. 2003. The closing of a seaway: ocean water masses and global climate change. Earth and Planetary Science Letters 210: 425-436. [ Links ]
23. Levinton, J.S., Sturmbauer, C. y Christy, J.H. 1996. Molecular data and biogeography: Resolution of a controversy over evolutionary history of a pan-tropical group of invertebrates. Journal of Experimental Marine Biology and Ecology 203: 117-131. [ Links ]
24. Lima da Costa, M., Behling, H., Berrêdo, J.F., Silva do Carmo, M. y Moreida de Siqueira. 2004. Mineralogical, geochemical and palynological studies of Late Holocene mangrove sediments from northeastern Pará State, Brazil. Revista Brasileira de Geociências 34: 479-488. [ Links ]
25. Miller, D.C. 1969. Ontogeny of asymmetry in fiddler crabs. American Zoologist 9: 1142. [ Links ]
26. Miller, D.C. 1973. Growth in Uca, 1. Ontogeny of asymmetry in Uca pugilator (Bosc) (Decapoda, Ocypodidae). Crustaceana 24: 119-131. [ Links ]
27. Milne Edwards, H. 1852. Observations sur les affinités zoologiques et la classification naturelle des crustacés. Annales des Sciences Naturelles. Zoologie, Série 3, 18: 109-166. [ Links ]
28. Prahl, H.V. y Toro, N. 1985. Uca (Uca) intermedia (Crustacea: Brachyura: Ocypodidae) A new fiddler crab of the Pacific coast of Columbia. Zoologischer Anzeiger 215: 274-278. [ Links ]
29. Rafinesque-Schmaltz, C.S. 1815. Analyse de la nature ou tableau de l'univers et de corps organisés. Palermo. 224 pp. [ Links ]
30. Rathbun, M.J. 1914. New genera and species of American Brachyrhynchous crabs. Proceedings of the United States National Museum 47: 117-129. [ Links ]
31. Rathbun, M.J. 1918. Contributions to the geology and paleontology of the canal zone, Panama, and geologically related areas in central America and the West Indies. Decapod crustaceans from the Panama region. United States National Museum Bulletin 103: 123-184. [ Links ]
32. Rathbun, M.J. 1919. A new name for a Dromiid crab. Proceedings Biological Society Washington 32: 197 [ Links ]
33. Rathbun, M.J. 1926. The fossil stalk-eyed Crustacea of the Pacific slope of North America. United States National Museum Bulletin 138: 1-155. [ Links ]
34. Reinsel, K.A. 1995. Impact of fiddler crab foraging on a benthic sandflat community: Effects over 9 months. American Zoologist 35: 139A. [ Links ]
35. Reinsel, K.A. 2004. Impact of fiddler crab foraging and tidal inundation on an intertidal sandflat: Season-dependent effects in one tidal cycle. Journal of Experimental Marine Biology and Ecology 313: 1-17. [ Links ]
36. Rosenberg, M.S. 2001. The systematics and taxonomy of fiddler crabs: A phylogeny of the genus Uca. Journal of Crustacean Biology 21: 839-869. [ Links ]
37. Salmon, M. 1965. Waving display and sound production in the courtship behavior of Uca pugilator, with comparisons to U. minax and U. pugnax. Zoologica NY 50: 123-150. [ Links ]
38. Salmon, M. y Atsaides, S.P. 1968. Visual and acoustical signalling during courtship by fiddler crabs (genus Uca). American Zoologist 8: 623-639. [ Links ]
39. Smith, S.I. 1870. Notes on American Crustacea. No. 1. Ocypodoidea. Transactions of the Connecticut Academy of Arts and Science 2: 113-176 [ Links ]
40. Specht, R.L. 1981. Biogeography of halophytic angiosperms (saltmarsh, mangrove and sea-grass). En: A. Keast (ed.), Ecological biogeography of Australia. Vol. 1 Dr. W. Junk Publishers. The Hague, 575-589 pp. [ Links ]
41. Sturmbauer, C., Levinton, J.S. y Christy, J.H. 1996. Molecular phylogeny analysis of fiddler crabs: Test of the hypothesis of increasing behavioral complexity in evolution. Proceedings of the National Academy of Sciences USA 93: 10855-10857. [ Links ]
42. Swofford, D.L. 1999. PAUP* *Phylogenetic Analysis Using Parsimony (and Other Methods), 4.0d. Sinauer Associates, Inc.: Sunderland. [ Links ]
43. Thurman, C.L. 1977. Taxonomy and zoogeography of fiddler crabs from the Atlantic and Gulf coasts of North America. American Zoologist 17: 950. [ Links ]
44. Valiela, I., Babiec, D.F., Atherton, W., Seitzinger, S. y Krebs, C.T.. 1974. Some consequences of sexual dimorphism: Feeding in male and female Fiddler Crabs, Uca pugnax (Smith). Biological Bulletin 147: 652-660. [ Links ]
45. von Hagen, H.-O. y Jones, D.S. 1989. The fiddler crabs (Ocypodidae: Uca) of Darwin, Northern Territory, Australia. Beagle, Records of the Northern Territory Museum of Arts and Sciences 6: 55-68. [ Links ]
46. Yamaguchi, T. 2000. Sexual differences in feeding by the fiddler crab, Uca lactea (De Haan). Crustacean Research 29: 121-132. [ Links ]
Recibido: 16 de julio de 2007.
Aceptado: 30 de julio de 2008.














