Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ameghiniana
versión On-line ISSN 1851-8044
Ameghiniana vol.46 no.4 Buenos Aires oct./dic. 2009
ARTÍCULOSORIGINALES
Foraminíferos y ostrácodos del Pleistoceno tardío (Mar Chiquita, provincia de Buenos Aires, Argentina)
Laura Ferrero1
1Centro de Geología de Costas y del Cuaternario, Universidad Nacional de Mar del Plata, CC. 722 Correo Central, 7600 Mar del Plata, Argentina. marmart@mdp.edu.ar
Resumen. Sobre la base del estudio de foraminíferos y ostrácodos, se describe la evolución de ambientes marino- costeros al sudeste de la provincia de Buenos Aires afectados por las variaciones del nivel del mar durante el Pleistoceno tardío. Fueron estudiadas dos perforaciones realizadas al sur de la laguna Mar Chiquita. En las secciones inferiores de las perforaciones (A y B) se registran ambientes marinos marginales que pueden ser asignados a la Formación Canal 5 correlacionable con el último máximo interglacial (subestadio isotópico 5e). En los niveles fértiles inferiores de la perforadión A y en toda la sección B las asociaciones de foraminíferos, dominadas por Ammonia beccarii (Linné), permiten inferir ambientes marinos litorales a lagunas costeras. Las asociaciones de ostrácodos indican ambientes de depositación costeros, litorales a de plataforma interna cercanos a estuarios o lagunas costeras, con niveles relativamente altos de energía que han provocado mezcla de material por transporte y retrabajo. Estos ambientes pueden ser asociados al ascenso del nivel del mar durante la última transgresión pleistocena y asignados a la Facies Los Médanos de la Formación Canal 5. Hacia arriba (en la Perforación A), estos ambientes gradan a otros con mayor influencia continental, lagunares, oligo-mesohalinos, de baja energía, evidenciados por el aumento de las proporciones de taxones mixohalinos (Cyprideis) y dulceacuícolas-oligohalinos, por el buen estado de preservación de los ejemplares y la coexistencia de adultos y juveniles de los taxones de ostrácodos, así como por asociaciones de foraminíferos con baja diversidad dominadas por Ammonia beccarii. Estos ambientes pueden ser asignados a la Facies Santa Ana de la misma Formación. Sobreyacen sedimentos continentales no microfosilíferos.
Abstract. Late Pleistocene Foraminifera and Ostracoda (Mar Chiquita, Buenos Aires Province, Argentina). The evolution of Late Pleistocene marginal marine environments in the southeast of Buenos Aires province are described based upon the associations of foraminifera and ostracoda. Two drilling performed in the southern coastal plain of Mar Chiquita coastal lagoon were studied. The lowest sections of the drillings (A and B) indicate marginal marine environments that could be assigned to Canal 5 Formation and correlated to Last Interglacial Maximum, (marine oxygen isotope substage 5e). Along the whole studied section of drilling B and the lowest levels of drilling A, foraminiferal associations are dominated by Ammonia beccarii (Linné) and could be interpreted as characterizing littoral marine environments or coastal lagoons. Ostracoda associations suggest littoral marine environments close to an estuary or a coastal lagoon, with relatively high energetic conditions shown by reworked and mixed material. These environments represent the transgressive/ highstand phase of the Late Pleistocene transgression and could be assigned to Los Médanos Facies of Canal 5 Formation. Upward (Drilling A) increasing percentages of mixohaline (Cyprideis) and non-marine taxa, along with a good preservation of valves, tests and the presence of juvenile and adults of ostracoda and lower diversity associations of foraminifera dominated by Ammonia becarii, suggest the evolution towards lagoonal, low energy environments. These levels represent the regressive phase corresponding to Santa Ana Facies of Canal 5 Formation and are covered by non-microfossiliferous continental muds.
Key words. Foraminifera; Ostracoda; Late Pleistocene; Marine transgression; Paleoenvironments.
Palabras clave. Foraminifera; Ostracoda; Pleistoceno tardío; Transgresión marina; Paleoambientes.
Introducción
El área costera de la provincia de Buenos Aires ha sido afectada durante el Cuaternario tardío por las variaciones del nivel del mar. Entre los registros de las transgresiones marinas cuaternarias distribuidos a lo largo de la franja litoral de la provincia, los depósitos holocenos son los más estudiados y los que presentan menores controversias desde el punto de vista estratigráfico (Schnack et al., 2005). Sobre los depósitos de las transgresiones marinas pleistocenas, en cambio, existe una larga lista de términos y asignación de edades. Según Schnack et al. (2005) los mayores desacuerdos corresponden al número de transgresiones pleistocenas que dejaron evidencias en la franja costera pampeana. Violante y Parker (1992) reconocieron registro de tres ciclos marinos que afectaron la región costera al norte de la laguna Mar Chiquita, correspondiendo uno al Pleistoceno medio, otro al Pleistoceno tardío y el tercero al Holoceno.
La ingresión ocurrida durante el Holoceno medio es la mejor representada en secuencias aflorantes y la más extensamente estudiada desde distintas disciplinas. En cambio, la ingresión ocurrida durante el Pleistoceno tardío, localmente conocida como "transgresión Belgranense" presenta registros más escasos y discontinuos entre los sedimentos aflorantes y ha sido menos estudiada. Ameghino (1889) fue quien acuñó el término "Belgranense" para los depósitos de origen marino aflorantes en las Barrancas de Belgrano, Buenos Aires, asignándole una edad Pleistocena media. Frenguelli (1928) utilizó esta denominación reasignándole una edad Pleistocena tardía. Posteriormente, en la provincia de Buenos Aires fueron definidas unidades litoestratigráficas como la Formación Pascua (Fidalgo et al., 1973a) en el Canal 15, aguas arriba y aguas abajo del Puente de Pascua, la Formación Canal 5 (Violante y Parker, 1992), en el Canal homónimo al norte de la laguna Mar Chiquita, la Formación Pilar (Fucks y De Francesco, 2003) en la localidad homónima, que posteriormente fueron correlacionadas con el "Belgranense" y asignadas al último interglacial (Isla et al., 2000, Cavallotto et al., 2005). Las edades C14 adjudicadas a todos estos depósitos en base a moluscos se encuentran cercanas al límite de resolución del método, por lo que pueden ser consideradas como edades mínimas.
Violante (2003) describió depósitos en la franja litoral de la provincia de Buenos Aires, tanto en la planicie costera entre Samborombón y la laguna Mar Chiquita como en plataforma interna adyacente, que debido a su posición estratigráfica consideró correspondientes a la transgresión marina del Pleistoceno tardío, reconociendo facies transgresivas, correspondientes al máximo transgresivo, y regresivas. La facies de nivel alto del mar pueden ser asignadas al último Interglacial (subestadio isotópico 5e) (ca 120.000 años). Esto es congruente con los resultados de varias dataciones radiocarbónicas realizadas en localidades asignadas a la Formación Canal 5 que están más allá de los límites del método y por el análisis de racemización de aminoácidos en conchillas de dos secuencias en los alrededores de Mar Chiquita (Violante y Parker, 1992). En la zona de Claromecó, aproximadamente a 270 km al sudoeste de la zona de estudio, una datación U/Th realizada sobre conchillas de gasterópodos contenidas en facies de playa de una unidad estratigráficamente equivalente arrojó una edad de 93500 ± 3500 años AP (Isla et al., 2000). Las conchillas datadas habrían sufrido un enriquecimiento de uranio luego de la muerte de los organismos por lo que los autores sugirieron una edad mayor a la informada estimando, entonces, que corresponderían al Interglacial Sangamon (subestadio isotópico 5e). Violante (2003) consideró que a pesar de que más dataciones y determinaciones isotópicas son necesarias para confirmar definitivamente la edad de estos depósitos, la información a la que se ha arribado a partir del conocimiento actual es altamente confiable.
El registro de microfósiles calcáreos en sedimentos asignables a la transgresión Belgranense es muy escaso. Esto es debido principalmente a dos problemas: los depósitos aflorantes son restringidos y dispersos y además, están representados por sedimentos muy cementados que han provocado la destrucción o recristalización de los fósiles haciendo dificultoso su estudio. A lo largo de la costa noreste de la provincia de Buenos Aires, Aguirre (1993), Aguirre y Whatley (1995) y Fucks et al. (2005) han estudiado los moluscos en depósitos marinos asignables al Pleistoceno tardío, pero no han podido realizar un estudio micropaleontológico detallado debido al alto grado de cementación de estos depósitos. Erra et al. (2008) han informado el registro de alrededor de noventa taxones de microfósiles (foraminíferos y ostrácodos), con variado estado de preservación, en la secuencia tipo de la Formación Pascua.
En el subsuelo del parque Mar Chiquita, al sur de la laguna costera del mismo nombre, fueron estudiadas dos perforaciones realizadas previamente por Obras Sanitarias de la provincia de Buenos Aires, en las que se registran sedimentos correspondientes a una ingresión marina que pueden ser asignados a la Formación Canal 5 (Violante y Parker, 1992) y correlacionados con el "Belgranense" (figura 1). El objetivo de este trabajo es lograr por primera vez en la región, una interpretación de la evolución de los ambientes pleistocenos representados en estas secuencias y su relación con las variaciones del nivel del mar, sobre la base del estudio cualitativo y cuantitativo de microfósiles calcáreos (foraminíferos y ostrácodos).

Figura 1. Mapa de ubicación de la perforaciones A y B (modificado de Schnack et al. 1982) /location map of drillings A and B (modified from Schnack et al. 1982).
Área de estudio y marco geológico
El área que circunda a la laguna Mar Chiquita se caracteriza por presentar un relieve relativamente llano y uniforme, de suave pendiente regional hacia el sudeste donde la laguna Mar Chiquita constituye el rasgo negativo más importante. La laguna está rodeada por una llanura marginal que se encuentra confinada al este por un cordón costero (medanoso) y al oeste por otro cordón formado por sedimentos preholocenos (Violante, 1992). La desembocadura de esta laguna en el mar en el primer punto de contacto de la red de drenaje con el océano desde el Cabo San Antonio. Numerosos arroyos que tienen sus cabeceras en las Sierras de Tandil y Balcarce desembocan en la laguna en forma directa o a través de canalizaciones.
Afloran en el área, principalmente, depósitos pleistocenos continentales y holocenos transicionales y marinos (Fasano et al., 1982). En particular, sedimentos marinos pleistocenos asignados a la Formación Canal 5, afloran al norte y oeste de la laguna Mar Chiquita, en cauces de canales y arroyos y en canteras (Violante y Parker, 1992).
Violante y Parker (1992) reconocen dos facies para la Formación Canal 5: la Facies Los Médanos, formada principalmente por arenas medianas, finas y muy finas, con conchilla y rodados de tosca, que aflora en las inmediaciones de la Ruta Provincial Nº11 y que corresponde a una ambiente de playas de baja energía asociadas a una barrera litoral y, la Facies Santa Ana, formada por arenas limosas a limoarcillosas y limos arenosos a arenoarcillosos, que aflora al oeste de de la Ruta Provincial Nº11 y representa llanuras mareales y lagunas en facies regresivas. Fasano (1991) reconoce para la Formación Canal 5 dos miembros: el Miembro Arena Limosa y el Miembro Arena. El primero, formado por arenas finas a muy finas, hasta medianas, limosas, con coloraciones castaño amarillento a grisáceo y castaño rojizo, con rodados de tosca, aflora a ambos lados de la Ruta 11, desde el norte y hasta el Arroyo Dulce y se hunde hacia el este continuando en el subsuelo. En el subsuelo se han registrado espesores de entre 5 y cerca de 20 m. Las edades C14 están cercanas al límite del método y la que surgen a partir del análisis de aminoácidos indican una edad igual o mayor al Interglacial Sangamon. Fasano (1991) correlaciona a este Miembro con el "Belgranense" (Frenguelli, 1950, 1957), con la Formación Pascua (Fidalgo et al., 1973a) y con la Facies Los Médanos de la Formación Canal 5 (Violante y Parker, 1992). Considera que representa principalmente facies de playa con cierta energía, mientras que los depósitos de menor granulometría podrían representar facies mareales a lagunares. Al Miembro Arena, compuesto por arenas finas con estratificación entrecruzada y que aflora a ambos lados de la ruta 11 desde el norte de la laguna Nahuel Rucá y hacia al norte con un espesor máximo de 3,5 m, le asigna un origen eólico litoral (barrera litoral) y lo correlaciona con la facies eólica del "Belgranense" de Frenguelli.
En el subsuelo correspondiente a la planicie costera al sur de la laguna Mar Chiquita, área donde fueron realizadas las perforaciones bajo estudio, se registran depósitos marinos asignados al Miembro Arena Limosa (sensu Fasano, 1991) de la Formación Canal 5 (Violante y Parker, 1992) formando una cuña que, desde la costa y hacia el continente se intercala con los limos y limos arenosos asignados por Fasano (1991) a los Miembros Inferior y Superior de la Formación Santa Clara (Schnack et al., 1982) de origen continental. El Miembro Inferior de la Formación Santa Clara, de una edad Pleistoceno medio-superior, es correlacionable con la parte inferior de la Formación Pampiano (Fidalgo et al., 1973b) y la Formación Laguna Limpia (Violante y Parker, 1992). Estos sedimentos afloran en la localidad de Santa Clara donde constituyen la plataforma de abrasión para luego hundirse en dirección noreste (Fasano, 1991). Mientras que el Miembro Superior de la misma formación, constituido por sedimentos de origen eólico, se correlaciona con el "Bonaerense" de Frenguelli (1950, 1957), con la parte superior de la Formación Pampiano (Fidalgo et al., 1973b) y parcialmente con la Formación Atlántida (Violante y Parker, 1992). Sobreyacen sedimentos asignados la Formación Mar Chiquita (Schnack et al., 1982) correspondientes a la transgresión marina holocena.
Descripción de las secuencias sedimentarias estudiadas
Se estudiaron dos perforaciones realizadas con perforadora rotativa mecánica por Obras Sanitarias de la provincia de Buenos Aires en 1982 en la localidad de Mar Chiquita (figura 1).
La Perforación A (37º45'01''S, 57º25'40''O) fue realizada en terrenos con una cota de 4 m sobre el nivel del mar, se perforaron 19 metros y fueron extraídas 17 muestras a intervalos de aproximadamente un metro correspondientes a los 18 metros superiores de la perforación. La Perforación B (37º44'30''S, 57º26'08''O) se realizó a una cota de 2 m sobre el nivel del mar, se perforaron 20 metros y se extrajeron 17 muestras a intervalos de 1 metro, correspondientes a los 17 metros superiores de la perforación.
Las secciones inferiores y superiores de ambas perforaciones contuvieron microfósiles, mientras que las secciones medias, de aproximadamente 8 metros de espesor en la Perforación A y 6,5 metros en la Perforación B, resultaron estériles. En este trabajo se presentan resultados de las secciones fértiles inferiores de ambas perforaciones (Perforación A: entre -15 y -7 m; Perforación B: entre -14,5 y -8 m). Es importante aclarar que por el tipo de perforación las profundidades de muestreo no son exactas sino sólo aproximadas y que si bien se presenta la descripción litológica de las secuencias completas y fueron analizadas todas las muestras extraídas, sólo se presentan para este trabajo los resultados sobre los microfósiles contenidos en sedimentos asignados al Pleistoceno tardío. Si bien el intervalo de muestreo es amplio, la escasez de información micropaleontológica sobre sedimentos correspondientes a las ingresiones marinas pleistocenas en la provincia de Buenos Aires justifica este trabajo. Los sedimentos microfosilíferos de las secciones superiores fueron excluidos porque el intervalo entre muestras resulta demasiado amplio para el Holoceno.
Las descripciones litológicas, así como la estratigrafía y la correlación entre las perforaciones se basan en el trabajo de Fasano (1991) (figura 2).

Figura 2. Columnas sedimentológicas y correlación estratigráfica de las perforaciones estudiadas indicando la ubicación de las muestras (basado en Fasano, 1991) / sedimentological columns and stratigraphic correlation of the studied drillings indicating the location of the samples (based on from Fasano, 1991).
Perforación A. La secuencia comienza, en los 3 metros inferiores (-15 a -12 m), con areniscas y conchilla cementadas que gradan a arena mediana con abundante conchilla y restos de briozoos (-12 a -10 m). Hacia arriba (-10 a -8 m), continúan limos arenosos con conchilla, que se interrumpen con una capa de aproximadamente 1 m de una arcilla limosa plástica verde. La secuencia prosigue con unos 8 m de limos arenosos y arcillosos castaños con presencia de tosca (-8 a 0 m). Siguen (0 a +2 m), arenas finas con moluscos, con Mactra isabelleana d'Orbigny; Nucula puelcha d'Orbigny; Ostrea equestris Say, Corbula patagonica d'Orbigny y Brachidontes rodriguezi (d'Orbigny) entre los bivalvos más abundantes y Olivella cf. puelcha (Duclos), Heleobia australis (d'Orbigny) entre los gasterópodos, tubos de poliquetos asignables a Hydroides sp. y briozoos. La secuencia culmina (+2 a +4 m) con arena arcillosa negra donde se observa el desarrollo de un suelo sobre el que se depositó arena mediana con restos de conchilla (figura 2).
Perforación B. La secuencia comienza (-18 a -14,5 m) con aproximadamente 3,5 m de limos castaños entoscados, continúa (-14,5 a -12 m) con arena limosa con conchilla. Hacia arriba (-12 a -10 m) aumenta la cantidad de conchilla que se presenta cementada en sedimentos de grava muy fina y arena. La secuencia prosigue (-10 a -8 m) con arena fina con algo de conchilla. Sobreyacen (-8 a -2 m) sedimentos limosos castaños, los cuatro metros inferiores entoscados y los dos superiores con arena subordinada. Hacia arriba (-2 a -1 m), se registra aproximadamente 1 m de limo arcilloso con restos de conchillas, sobre la que apoyan (-1 a +1 m) limos arenosos con restos de conchillas. La secuencia culmina (+1 a +2 m) con arena fina limosa gris, con conchilla, Heleobia australis y Nucula sp. y restos de briozoos (figura 2).
Métodos
Se procesaron entre 50 y 100 g de sedimento seco lavándolo a través de tamiz de 63 mm. El secado del residuo se realizó en estufa a aproximadamente 70°C. Se extrajeron los microfósiles bajo lupa binocular, tratando de alcanzar al menos 300 foraminíferos e igual número de valvas de ostrácodos, aunque en varios casos no fue posible. En el caso de los ostrácodos, fueron extraídos tanto los juveniles como los adultos.
Se calcularon las abundancias de cada uno de los grupos bajo estudio en 50 g de sedimento seco y las frecuencias relativas de las distintas especies en cada muestra.
Para realizar el análisis cuantitativo de las asociaciones fósiles de ostrácodos, se contaron las valvas adultas, izquierda o derecha, según cuales fueran las más abundantes y los caparazones. Para el análisis de agrupamiento se incluyeron tanto los ostrácodos adultos como los juveniles contabilizando cada valva juvenil como 0,2 de la de un adulto. Se realizó esta transformación de los datos con el objetivo de disminuir la sobrestimación de las especies en las que los juveniles son más fuertes y por ende más propensos a preservarse y está basada en el conocimiento de que si bien la relación teórica entre adultos y juveniles es 1:8, en la práctica los valores hallados para biocenosis es cercana a 1:6 (Brouwers, 1988).
Para realizar las determinaciones sistemáticas de ostrácodos y foraminíferos se utilizó lupa binocular, microscopio óptico y en algunos casos, microscopio electrónico de barrido.
Tanto los foraminíferos como los ostrácodos fueron determinados, en los casos en que fue posible, a nivel de especie utilizando bibliografía específica. Para la determinación de las especies de foraminíferos se utilizó la clasificación de Loeblich y Tappan (1988) y para los ostrácodos, la seguida en Moore, R.C. Ed. (1961), modificada y completada, principalmente con los trabajos de Sanguinetti et al. (1991) y Whatley et al. (1995; 1996; 1997; 1998). Para ambos grupos se recurrió también a las descripciones originales recopiladas en Ellis y Messina (1940-suppl.; 1954-suppl.). Las especies ilustradas se encuentran depositadas en la colección del Centro de Geología de Costas y del Cuaternario (CGC-F y CGC-O) de la Universidad Nacional de Mar del Plata, bajo los números que se indican en las referencias de las láminas.
Se observaron rasgos tafonómicos tales como recristalización, signos de abrasión o fragmentación y, en el caso de los ostrácodos, se calculó la relación A:J en cada uno de los niveles estudiados, así como para cada taxón en particular. También se tuvo en consideración la presencia y proporción de ejemplares articulados.
Para el análisis de la diversidad tanto de foraminíferos como de ostrácodos se consideraron la riqueza específica y el índice de Shannon-Wiener para cada nivel muestreado.
Para la interpretación paleoambiental se tuvieron en cuenta las características ecológicas de las especies determinadas, asumiendo que la autoecología de los taxones no ha cambiado durante el período considerado, así como las asociaciones características de distintos ambientes. Los ostrácodos se agruparon según su tolerancia a las variaciones de salinidad en dulceacuícolas- oligohalinos, mixohalinos, marinos eurihalinos y marinos euhalinos. Entre los primeros se incluyeron a las especies dulceacuícolas que pueden habitar ambientes oligohalinos (0,5-5‰) y excepcionalmente mesohalinos (=mixohalinos: 5-18‰), entre los mixohalinos se incluyen las especies eurihalinas que típicamente soportan variaciones de salinidad habitando frecuentemente ambientes de mezcla; entre los marinos eurihalinos a aquellos taxones que habitan ambientes marinos pero pueden registrarse en ambientes marginales entre mesohalinos y polihalinos (18-30‰) y, entre los marinos euhalinos aquéllos que han sido registrados sólo en ambientes marinos de salinidad normal, que en el Atlántico Sudoccidental es de alrededor del 35‰.
Los diagramas de frecuencias relativas de especies y de grupos se realizaron con los programa Tilia 1.12 (Grimm, 1991) y TGView 1.3.11 (Grimm, 2001).
Se utilizaron técnicas multivariadas como el análisis de agrupamiento usando el coeficiente de Momento Producto de Pearson, cuyos valores oscilan entre 1 (máxima similitud) y -1. Se aplicó la técnica Q, que parte de una matriz de similitud entre muestras. Para el procesamiento de los datos se utilizó el programa Past 1.72 (Hammer et al., 2001). Se utilizó una matriz conjunta de foraminíferos y ostrácodos de los niveles fértiles estudiados en ambas perforaciones.
Resultados
Fueron registradas 65 especies de foraminíferos y 64 de ostrácodos. En general, los foraminíferos fueron más abundantes que los ostrácodos especialmente en la Perforación B (figura 3). La lista completa de los taxones determinados se presenta en un Apéndice.

Figura 3. Abundancia absoluta y diversidad de foraminíferos y ostrácodos (riqueza específica e índice de Shannon-Wiener=H'(s)) / absolute abundance and diversity of foraminifera and ostracoda (species richness and Shannon-Wiener diversity index=H'(s)).
Foraminíferos
Entre los foraminíferos, dominan los de pared hialina mientras que los aglutinados están ausentes (figuras 4.2 y 5.2).

Figura 4. Perforación A: 1, Columna estratigráfica con la ubicación de los niveles fosilíferos pleistocenos; 2, Foraminíferos: Diagrama de distribución y frecuencia relativa (taxones con porcentaje >/= 1%); proporciones según el tipo de pared; 3, Ostrácodos: Diagrama de distribución y frecuencia relativa (taxones con porcentaje >/= 3%), proporción de adultos/juveniles (VD+VI+2C) y frecuencias de grupos de ostrácodos que habitan distintos ambientes según la salinidad. / Drilling A: 1, Stratigraphic column with the location of Pleistocene fossiliferous levels; 2, Foraminifera: distribution and relative frequencies diagram (taxa with >/= 1%) and percentages of foraminifera according with the type of wall; 3, Ostracoda: distribution and relative frequencies diagram (taxa with >/= 3%), proportion of adults/juvenile (RV+LV+2C) and groups of ostracoda frequencies according with salinity tolerances.

Figura 5. Perforación B: 1, Columna estratigráfica con la ubicación de los niveles fosilíferos pleistocenos; 2, Foraminíferos: Diagrama de distribución y frecuencia relativa (taxones con porcentaje >/= 1%); proporciones según el tipo de pared; 3, Ostrácodos: Diagrama de distribución y frecuencia relativa (taxones con porcentaje >/= 1%), proporción de adultos/juveniles (VD+VI+2C) y frecuencias de grupos de ostrácodos que habitan distintos ambientes según la salinidad. / drilling B: 1, Stratigraphic column with the location of Pleistocene fossiliferous levels; 2, Foraminifera: distribution and relative frequencies diagram (taxa with >/= 1%) and percentages of foraminifera according with the type of wall; 3, Ostracoda: distribution and relative frequencies diagram (taxa with >/= 1%), proportion of adults/juvenile (RV+LV+2C) and groups of ostracoda frequencies according with salinity tolerances.
Los taxones más abundantes son Ammonia beccarii (Linné) s.l., dominante en todos los niveles, seguida por Buccella peruviana f. campsi (Boltovskoy), Elphidium discoidale (d'Orbigny) y Quinqueloculina patagonica d'Orbigny (figuras 4.2 y 5.2).
Rasgos tafonómicos. En los distintos niveles estudiados se observa cierta mezcla de material, con variado estado de preservación y altas proporciones de material recristalizado. Sin embargo parte del material se encuentra inalterado (5-20%), otros presentan diferencias en la coloración (10-30%).
Diversidad. La riqueza específica presenta valores máximos de 33 en la perforación A y 24 en la perforación B, mientras el índice de Shannon-Wiener (H') presenta, en general, valores inferiores a 2 en ambas perforaciones (figura 3).
Ostrácodos
Tanto en la perforación B como en los niveles inferiores de la perforación A (M. 17-14) no existen especies dominantes (figuras 4.3 y 5.3). Entre los taxones mejor representados se encuentran varias especies de Cytheruridae (Hemicytherura lapillata Whatley et al., distintas especies de Oculocytheropteron), Ambostracon bertelsae (Sanguinetti et al.) y Callistocythere litoralensis (Rossi de García). En cambio, en los niveles superiores de la perforación A (M. 13-12), las especies que presentan mayores frecuencias relativas son Limnocythere staplini Gutentag y Benson, Cyprideis salebrosa hartmanni Ramírez, Candona sp. 1 y Heterocypris cf. H. incongruens (Ramdohr).
Rasgos tafonómicos. Las asociaciones de ostrácodos presentan variado estado de preservación, escasez de ejemplares juveniles (entre el 40 y 60% en la perforación A y el 20% en la perforación B), además se reconocen elementos alóctonos (figuras 4.3 y 5.3). Varias especies están representadas sólo por juveniles, algunos de origen continental y otros marinos. En los niveles superiores de la perforación A las poblaciones de las especies más abundantes están bastante completas.
Diversidad. La riqueza específica oscila entre 7 y 19 considerando sólo los adultos, y entre 8 y 30 cuando se consideran también los taxones que se encuentran representados solamente por juveniles. En los niveles basales de la perforación A los valores de H' son relativamente altos (2,5-3), disminuyendo hacia arriba, mientras que en los niveles de la Perforación B en los que el índice pudo ser calculado oscilan entre 2 y 2,5 (figura 3).
Análisis de agrupamiento
En el dendrograma obtenido a partir de las matrices conjuntas de ostrácodos y foraminíferos de ambas perforaciones se forman claramente dos grupos. El Grupo "a", unido a una similitud mayor a 0,8, reúne a todos los niveles fértiles de la Perforación B (M. 17-12) y a los niveles inferiores de la Perforación A (M.17-14) y el Grupo "b", unido a valor de similitud de aproximadamente 0,75, constituido por los niveles 13 y 12 de la perforación A. Esta agrupación responde fundamentalmente a las asociaciones de ostrácodos, pues entre los foraminíferos las asociaciones dominantes son similares en todos los niveles estudiados y sólo es de resaltar cierta disminución en la diversidad en las muestras 13 y 12 de la perforación A (la muestra 11 no fue incluida en el análisis por presentar una muy baja abundancia) (figura 6).
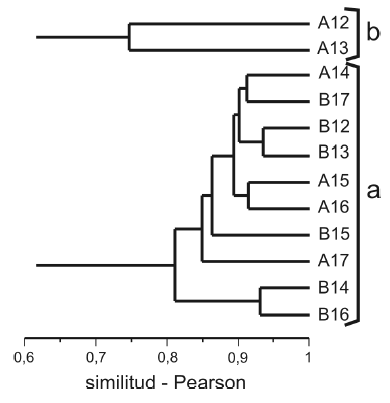
Figura 6. Dendrograma de los niveles estudiados en las perforaciones A y B /cluster analysis of drillings A and B studied levels.
Consideraciones tafonómicas y paleoecológicas
Foraminíferos
Los Textulariina están bien representados en ambientes actuales tanto en la plataforma continental como en ambientes costeros salobres. En la plataforma continental adyacente a la provincia de Buenos Aires viven numerosas especies aglutinadas y, en particular, en la laguna Mar Chiquita varias especies han sido registradas viviendo (Lena y L'Hoste, 1975; Boltovskoy et al., 1980; Scott et al., 1990). Su ausencia en las secuencias estudiadas está probablemente relacionada con problemas tafonómicos. La propensión a la desintegración de ciertos taxones arenáceos ha sido reconocida por diferentes autores (e.g., Denne y Sen Gupta, 1989; Jorissen y Wittling, 1999). Se ha sugerido que la degradación microbiana de los cementos orgánicos constituye un importante mecanismo de pérdida de aglutinados (Goldstein y Watkins, 1999; Berkeley et al., 2007). Su ausencia o escasa representación ha sido registrada en numerosas secuencias holocenas en la franja costera de la provincia de Buenos Aires (Laprida y Bertels-Psotka, 2003; Gómez et al., 2005; Ferrero, 2006; Laprida et al., 2007).
Entre los foraminíferos hialinos se observa la dominancia de Ammonia beccarii s.l. en todos los niveles estudiados. Es un taxón muy variable y un importante número de investigadores han discutido problemas taxonómicos con esta especie. Schnitker (1974); Wang y Lutze (1986) y Walton y Sloan (1990) concuerdan en la existencia de una única especie Ammonia beccarii (Linné) y distintas formas, variedades o ecofenotipos. Walton y Sloan (1990) reconocen tres formas básicas para Ammonia beccarii (Linné): forma beccarii, forma parkinsoniana y forma tepida. Si bien últimamente se han realizados estudios moleculares que sugieren la separación de varias de las formas atribuidas a Ammonia beccarii en distintas especies (Pawlowski et al., 1995; Hayward et al., 2004), criterio seguido por varios autores; la situación es todavía confusa. Entre los ejemplares aquí estudiados, sólo algunos se pueden incluir sin dudas en forma parkinsoniana o en forma tepida, presentando la mayoría caracteres intermedios entre una y otra. Esta misma situación es registrada por Laprida (1998) para la Formación Destacamento Río Salado.
Ammonia beccarii es una especie euribionte y oportunista con amplia distribución y típicamente abundante en la plataforma continental interna, estuarios y marismas saladas a lo largo de distintas localidades de casi todo el mundo, y está caracterizada por su capacidad de sobrevivir en un amplio rango de temperaturas y salinidades y por su variabilidad morfológica (Schnitker, 1974; Poag, 1978; Walton y Sloan, 1990). A. beccarii f. parkinsoniana ha sido registrada en ambientes con grandes variaciones de salinidad o de salinidad muy baja (valores menores al 1‰); por ejemplo en el río Quequén Grande (Boltovskoy y Boltovskoy, 1968), la laguna Mar Chiquita (Lena y L'Hoste, 1975), el río de la Plata (Boltovskoy y Lena, 1974) y la laguna Los Patos al sur del Brasil (Closs y Madeira, 1968). A. beccarii f. tepida también es común en estuarios o lagunas salobres del Atlántico sudoccidental (Eichler et al., 1995; Debenay et al., 1998). Ammonia beccarii fue registrada abundantemente en las tanatocenosis del Canal Tres Brazas en el estuario de Bahía Blanca y fue hallada viviendo en un ambiente de planicie de marea alta, sin vegetación sometido a emersiones prolongadas y a variaciones en la salinidad (Cusminsky et al., 2006).
Las especies que siguen en orden de importancia son: Buccella peruviana f. campsi, Quinqueloculina patagonica y Elphidium discoidale.
Buccella peruviana, s.l. es indudablemente la especie más común y constante de la provincia zoogeográfica Argentina. Los ecotipos de esta especie están ampliamente distribuidos en las aguas poco profundas de esta provincia y también son conocidas a lo largo de las costas de Chile y Perú (Boltovskoy, 1976). Si bien es una especie característica de la plataforma continental, Buccella peruviana f. campsi y Buccella peruviana f. frigida han sido registradas en ambientes de aguas salobres con variaciones de salinidad, en el río de la Plata (Boltovskoy, 1957; Boltovskoy y Lena, 1974), en Laguna Los Patos (Brasil) y Arroyo Chuy (Uruguay) (Boltovskoy et al., 1980).
Quinqueloculina es un género epifaunal que habita ambientes tanto marinos como hiperhalinos y en un rango amplio de temperatura (Murray, 1991). Q. patagonica ha sido registrada a lo largo de la plataforma continental argentina (Boltovkoy et al., 1980) y, en ambientes salobres como el río Quequén Grande, aunque a salinidades altas de entre el 30 y 33‰ (Wright, 1968), ejemplares sin protoplasma fueron citados para la albufera Mar Chiquita (Lena y L'Hoste, 1975).
Elphidium discoidale es la especie de Elphidium que domina en la Subprovincia Norpatagónica (desde 32- 33ºS a 41ºS) (Boltovskoy, 1976). Elphidium es un género que presenta varias especies eurihalinas entre las que se puede incluir a Elphidium discoidale que, siendo una especie típica de la plataforma continental interna, ha sido registrada también en aguas salobres de numerosas lagunas y estuarios en el sur de Brasil y Uruguay y, en la Argentina, en áreas del río de la Plata caracterizadas por grandes variaciones de salinidad, (con mínimas menores al 1‰) y en Mar Chiquita (1,8-34,4‰) (Boltovskoy, 1957; 1963; Closs y Madeira, 1962; Closs y Madeira, 1968; Lena y L'Hoste, 1975; Boltovskoy et al., 1980).
La riqueza específica es superior a 20 en varios de los niveles estudiados, valores compatibles con ambientes de plataforma (Bandy y Arnal, 1960). Sin embargo, los valores de diversidad calculados según la función de información de Shannon-Wiener son relativamente bajos (inferiores o cercanos a 2) en ambas perforaciones. Según Murray (1991), en líneas generales, valores de H´ mayores a 2,1 indican ambientes marinos normales mientras que valores de H' inferiores a 0,6 indican aguas salobres. Los valores relativamente bajos de este índice se deben a la dominancia de Ammonia beccarii.
Con respecto a los hábitos de vida, en las secciones estudiadas de ambas perforaciones dominan los organismos infaunales y que viven libres en el sedimento y el modo de alimentación predominante es el herbívoro-detritívoro. En el caso de Ammonia, considerado aquí entre los infaunales y que contribuye con sus altas frecuencias a la dominancia de este modo de vida, no existe criterio uniforme entre diferentes autores. Murray (1991) lo incluye entre los organismos infaunales, mientras que por ejemplo Duleba et al. (1999) lo consideran epifaunal. Ammonia beccarii, según las observaciones de Moodley (1990) presenta el pico máximo de su distribución en la superficie del sedimento aunque también se distribuye en números importantes en capas más profundas (hasta 25 cm).
De acuerdo con las proporciones según el tipo de pared (figuras 4 y 5) y siguiendo la caracterización de Murray (1973; 1991), es posible inferir como paleoambientes probables lagunas desde hipo a hiperhalinas o en algunos niveles ambientes de plataforma. Sin embargo, debido a la composición específica, la proporción relativamente baja de miliólidos, la dominancia de Ammonia beccarii y los valores relativamente bajos de diversidad y teniendo en consideración que la ausencia de aglutinados probablemente responda a causas tafonómicas, es más probable inferir ambientes marginales de salinidad variable pero probablemente hipohalinos. De todos modos es importante recalcar que, según el estado de preservación observado, es posible inferir que ha habido aportes a la asociación por transporte y retrabajo. Sin embargo, no se observa diferencias de preservación entre los taxones, al menos entre los más abundantes, que permitan reconocer taxones alóctonos.
Ostrácodos
De las 64 especies de ostrácodos registradas en las secciones estudiadas, más del 80% corresponden a ambiente marino. La mayoría se encuentran distribuidas en la actualidad en la provincia zoogeográfica Bonaerense, sólo Minicythere heini Ornellas, Hemicytherura auriculata Ramos et al. y Oculocytheropteron delicatum Ramos et al., registradas para la provincia Brasilera, se encuentran más al sur y, Paradoxostoma cf. P. dolichoforma Whatley et al. y Australicythere cf. A. frequens (Skogsberg), registradas para la provincia Antártica, más al norte de su zona de distribución. H. auriculata y O. delicatum han sido descriptas recientemente y sólo han sido registradas en la localidad tipo al norte de Río de Janeiro (Brasil) (Ramos et al., 1999); es probable que la segunda tenga una distribución más amplia y no haya sido registrada aún o haya sido confundida, en otros estudios de la región, con alguna de las especies del género con más amplia distribución.
La mayoría de los niveles fértiles estudiados, corresponden al grupo "a" obtenido en el análisis de agrupamiento (Perforación A: M.17-14; Perforación B: M.17-12) y pueden ser asignados a la Facies Los Médanos de Violante y Parker (1992) y al Miembro Arena Limosa (facies de playa) de Fasano (1991) de la Formación Canal 5. Estos niveles presentan material con variado estado de preservación, escasez de ejemplares juveniles y se reconocen elementos alóctonos. Según los esquemas de clasificación planteado por Johnson (1960, en Kidwell, 1993) y Kidwell (1993) este tipo de asociaciones podrían considerarse condensadas temporalmente ("time-averaged") dentro de un hábitat de cierta energía que justificaría la inclusión de algunos taxones exóticos, provenientes de ambientes cercanos.
En la perforación A (M.17-14), la abundancia de ostrácodos es baja y entre el 50 y 70% de las asociaciones están conformadas por ejemplares de ostrácodos juveniles. Taxones tales como Heterocypris cf. incongruens, Cyprideis multidentata Hartmann, Cyprideis salebrosa hartmanni, Quadracythere gloriaensis Bertels-Psotka y Laprida y Papillosacythere parallela Whatley et al. están representados sólo por valvas juveniles (M.17-15). Este tipo de estructura poblacional, con ausencia de adultos se puede asociar a la asociación de tipo C, caracterizada por Whatley (1983, 1988) como asociación de muerte de baja energía, explicando la presencia sólo de mudas por acumulación por transporte. Entre estos taxones, unos son de origen continental y otros marinos, lo que permite inferir aporte por transporte desde ambas fuentes. Otras especies, representadas tanto por ejemplares adultos como por juveniles, muestran diferentes estados de preservación, por lo que se puede inferir mezcla de material (e.g., Ambostracon bertelsae en M17 con parte de los ejemplares juveniles retrabajados o transportados). El resto de las especies de las que se registran sólo ejemplares juveniles, están representadas sólo por la presencia de una o dos valvas. En estos niveles (Perforación A: M17-14) no existen especies dominantes, los Cytheruridae son los mejor representados, y llegan a formar el 60% de la asociación (M.17), las otras familias presentes en porcentajes importantes son los Paradoxostomatidae y Cytherideididae. La familia Cytheruridae es una de las más diversas y abundantes en ambientes marinos y salobres y numerosas especies han sido descriptas para ambientes costeros de Brasil y Argentina (e.g., Whatley et al., 1988; Ramos et al., 1999); los Cytherideididae incluyen tanto taxones marinos litorales y de plataforma, como otros típicamente mixohalinos y entre los Paradoxomatidae la mayoría son litorales y fitales. Las asociaciones están formadas fundamentalmente por taxones marinos, entre éstos predominan los marinos eurihalinos, como por ejemplo distintas especies de Oculocytheropteron, Hemicytherura lapillata y Ambostracon bertelsae. Estas especies están representadas por ejemplares adultos y juveniles, aunque en un número insuficiente para realizar el análisis de su estructura poblacional y, si bien están incluidas entre los taxones marinos euhalinos, han sido halladas viviendo en muy pocas localidades, generalmente litorales, a veces con aportes de agua dulce, y no se conocen claramente los rangos de salinidad en los que pueden vivir.
Los niveles fértiles de la perforación B también presentan abundancias bajas, aunque en estos niveles los adultos constituyen entre el 65 y 90% de los ejemplares, con una relación A:J entre 1:0,15 y 1:0,54, valores compatibles con la remoción selectiva de juveniles (Brouwers, 1988). Unas pocas especies están representadas sólo por ejemplares juveniles que podrían ser considerados alóctonos. La familia Cytheruridae es dominante, constituyendo entre el 50 y el 80% de las asociaciones, seguida por Cytherideidae, Hemicytheridae y Leptocytheridae y, en algunos niveles, por Paradoxostomidae. Los Hemicytheridae son fundamentalmente marinos y entre los Leptocytheridae existen especies marinas y otras que son frecuentes habitantes de ambientes salobres.
En ambas perforaciones (Perforación A: M17-14; Perforación B: M17-12) dominan los taxones marinos y en particular los marinos euhalinos, definidos como los que viven en un rango de salinidad restringido entre el 30 y 40‰, con abundancia de especies típicas de ambientes litorales, aunque también se encuentran representados en proporciones importantes los taxones marinos eurihalinos, que suelen aparecer viviendo en ambientes salobres tales como especies de los géneros Leptocythere, Callistocythere o Paracytherois (figuras 4.3 y 5.3). Estos niveles presentan una diversidad relativamente alta, los valores del índice de Shannon-Wiener en las muestras en las que pudo ser calculado, son cercanos o superiores a 2,5. Valores de H' de entre 1,75 y 3,9 han sido registrados para asociaciones totales (vivos más valvas y caparazones) en muestras superficiales en ambientes de plataforma continental de entre 15 y 85 m de profundidad (Hazel, 1975). De acuerdo a las evidencias provistas por las asociaciones de ostrácodos se pueden reconocer ambientes de depositación costeros, litorales a de plataforma interna. En la perforación A, hacia arriba (M.15-14), aumenta el carácter estuárico evidenciado por la presencia de especies mixohalinas típicas de ambientes salobres tales como Cyprideis multidentata y C. salebrosa hartmanni y bajas proporciones de especies dulceacuícolas-oligohalinas, probablemente alóctonas, transportadas desde un ambiente cercano, como Heterocypris cf. H. incongruens, Potamocypris sp.2 o Ilyocypris gibba (Ramdohr).
Los niveles 13 y 12 de la perforación A, reunidos en el Grupo "b" del análisis de agrupamiento, pueden ser asignados a la Facies Santa Ana de Violante y Parker (1992) y a facies lagunares del Miembro Arena Limosa descripto por Fasano (1991). En estos niveles se reconocen asociaciones en donde predominan especies dulceacuícolas y de ambientes salobres que no están presentes en la perforación B (figura 4.3). Entre las primeras se registran Heterocypris cf. H. incongruens, Potamocypris sp. 2, Candona sp.1, Ilyocypris gibba, Limnocythere sp. aff. L. itasca Cole con poblaciones más o menos bien representadas y proporciones importantes de Limnocythere staplini con poblaciones casi completas. La ocurrencia del género Limnocythere está relacionada generalmente con valores altos de alcalinidad. Limnocythere staplini es una especie continental que puede habitar aguas con alto contenido en solutos y es sensible a la relación CO3H-/ Ca2+ prefiriendo las aguas enriquecidas en iones de calcio y sulfato (Forester, 1983, 1986, en Palacios-Fest et al., 1994; Curry, 1999). Esta especie, muy abundante en depósitos holocenos, ha sido registrada por Laprida (2006) como Limnocythere sp. aff. L. staplini en lagunas permanentes y ambientes lóticos de aguas oligohalinas a hipohalinas y fuertemente alcalinas y, como Limnocythere sp., en una laguna permanente de aguas mesohalinas, fuertemente alcalina y poco oxigenada. Limnocythere itasca Cole no ha sido hallada viviendo en Argentina, habita lagos o más raramente cursos de agua de baja energía y su rango geográfico conocido es en el hemisferio norte, desde el sur del bosque boreal hasta México (Brouwers, 1990). Entre las especies más frecuentes en ambientes de mezcla, Cyprideis salebrosa hartmanni que también presenta adultos y juveniles, es una especie eurihalina ampliamente distribuida en ambientes salobres en Brasil y Argentina. En la laguna mixohalina de Armazém (Rio Grande do Sul) fue registrada a salinidades de entre 0‰ y 29‰, con amplias variaciones de salinidad y en ambientes de baja profundidad (Ornellas y Würdig, 1983), además ha sido observada en la laguna Mar Chiquita así como en los estuarios del río Quequén Grande y del Quequén Salado (o.p.). Ramírez (1967) y Laprida (2006) la registraron tanto en ambientes lóticos como lénticos caracterizados por aguas alta alcalinidad, hipohalinos a oligohalinos. La asociación está compuesta también, en menor proporción, por especies marinas con distintas tolerancias a las variaciones de salinidad como Parakrithella hanai Hartmann, Hemicytherura lapillata, Oculocytheropteron reticulopunctatum Whatley et al. y Neocytherideis ruidis Whatley et al.
En estos niveles (M.13 y M.12) de la perforación A, la riqueza específica es relativamente baja y el índice de Shannon-Wiener toma valores (H'(s)≅1,7) inferiores a los promedio para ambiente marino normal. Esto puede asociarse a que en la transición del agua dulce a marina se observa una disminución de la diversidad en la zona de mezcla y en el ambiente marino la diversidad se recupera (Carbonel, 1988). Las evidencias provistas por los ostrácodos estarían indicando ambientes salobres oligo-mesohalinos con energía relativamente baja, inferido a partir del buen estado de preservación de los ejemplares así como de la coexistencia de adultos y juveniles en la mayoría de estos taxones. Por otra parte, la presencia, aunque escasa, de especies más típicamente litorales indica conexión marina cercana. Este tipo de asociaciones podrían considerarse condensadas temporalmente ("time-averaged") dentro de un hábitat de baja energía (Johnson, 1960 en Kidwell, 1993 y Kidwell, 1993).
Discusión
Las perforaciones realizadas al sur de la albufera Mar Chiquita proveen registro, en sus secciones fértiles inferiores, de una ingresión marina pleistocena asignada por Fasano (1991) al Miembro Arena Limosa de la Formación Canal 5. A esta formación definida por Violante y Parker (1992) se le asigna una edad de Pleistoceno superior y se la correlaciona con el "Belgranense" (Frenguelli, 1950; 1957). Varios autores coinciden en correlacionar la transgresión Belgranense con el interglacial Sangamoniano (Violante y Parker, 1992; Isla et al., 2000). Estos depósitos se encuentran intercalados entre limos y limos arenosos carentes de microfósiles correspondientes a la Formación Santa Clara (Schnack et al., 1982).
A diferencia de lo que ocurre generalmente en la provincia de Buenos Aires, las asociaciones registradas en los niveles asignados al Pleistoceno de las perforaciones A y B proveen un registro bastante diverso de microfósiles calcáreos con una preservación relativamente buena. Otro registro más o menos detallado de microfósiles calcáreos en sedimentos correlacionables con el Belgranense es el provisto por Erra et al. (2008) quienes ha descripto asociaciones de foraminíferos y ostrácodos de una secuencia asignada a la Formación Pascua en su localidad tipo (Puente de Pascua) que es considerada como límite más interno de la ingresión pleistocena en toda el área de la Cuenca del Salado. Si bien las asociaciones presentan menor riqueza específica que las registradas en este trabajo, existe una muy alta coincidencia entre taxones de una y otra localidad. Entre los foraminíferos, las especies más frecuentes son Buccella peruviana campsi, Ammonia beccarii y Discorbis williamsoni y Elphidium discoidale y no se registran taxones aglutinados. Entre los ostrácodos, también escasos, la mayor parte de los taxones corresponden a ambientes marinos litorales. Sobre la base de la malacofauna y los microfósiles se interpretan ambientes marginales marinos con variaciones en la salinidad.
Las asociaciones de foraminíferos son muy similares a lo largo de las secciones estudiadas. La dominancia de Ammonia beccarii y valores de diversidad relativamente bajos permiten inferir ambientes marinos litorales a lagunas costeras, probablemente sometidos a variaciones de salinidad. Una leve disminución de la diversidad (H') y de las proporciones de miliólidos y de Buccella peruviana f. campsi en los niveles superiores de la perforación A, permitiría reconocer una evolución probablemente a ambientes más inestables y a una disminución de la salinidad promedio. Esto estaría corroborado por una disminución del tamaño en los ejemplares de Ammonia beccarii (Laprida y Bertels-Psotka, 2003).
De acuerdo a las asociaciones de ostrácodos de los niveles correspondientes al grupo "a", obtenido mediante el análisis de agrupamiento, es posible reconocer ambientes de depositación costeros, litorales a de plataforma interna cercanos a estuarios o lagunas costeras, con niveles relativamente altos de energía que han provocado mezcla de material por transporte y retrabajo. Estos ambientes pueden ser vinculados al ascenso del nivel del mar durante la última transgresión pleistocena y ser asignados a la Formación Canal 5, en particular a la Facies Los Médanos a la que Violante y Parker (1992) le asignan un ambiente de depositación de playas de baja energía asociados a una barrera litoral y a las facies de playa del Miembro Arena Limosa que Fasano (1991) define para la Formación Canal 5 (figura 7). La línea de costa para ese momento se encontraba inmediatamente al oeste de la ruta 11 (Fasano, 1991), a algo más de 1 km al noroeste de la perforación B.

Figura 7. Esquema estratigráfico, ubicación de las perforaciones, correlación de facies e interpretación paleoambiental (basado en Fasano, 1991) / stratigraphic diagram, drillings location, facies correlation and paleoenvironmental interpretation (based on Fasano, 1991).
Hacia arriba (Perforación A) estos ambientes gradan a ambientes con influencia continental evidenciada por la presencia de taxones mixohalinos del género Cyprideis y otros dulceacuícolas, probablemente transportados. En la Perforación A, la sección estudiada culmina con ambientes lagunares, de baja energía, entre oligo y mesohalinos, evidenciados valores relativamente bajo de diversidad, por el aumento de las proporciones de taxones mixohalinos y dulceacuícolas-oligohalinos, por el buen estado de conservación de los ejemplares y la coexistencia de adultos y juveniles en la mayoría de estos taxones, así como por asociaciones de foraminíferos con baja diversidad y dominancia de Ammonia beccarii. Estos niveles representarían la fase regresiva de la ingresión pleistocena y podrían ser asociados a la Facies Santa Ana de Violante y Parker (1992) o la facies de laguna costera descripta por Fasano (1991) que no se registra en la perforación B (figura. 7). Por lo tanto, inmediatamente al sur de la laguna Mar Chiquita, y en una posición intermedia entre ambas perforaciones (que distan en aproximadamente 900 m) se encuentra el límite de los depósitos correspondientes a estas facies lagunares.
Conclusiones
Entre los niveles pleistocenos estudiados en ambas perforaciones y asignados al Belgranense, se registraron asociaciones bastante diversas de microfósiles calcáreos con un estado de preservación relativamente bueno.
Si bien las asociaciones de foraminíferos no hicieron posible el reconocimiento claro de ambientes diferentes a lo largo de los niveles pleistocenos, los ostrácodos, particularmente en el caso de la perforación A, permitieron distinguir en este caso distintos ambientes con diferentes niveles de energía.
De acuerdo a las evidencias provistas por foraminíferos y ostrácodos se pudieron reconocer ambientes marinos litorales de energía relativamente alta que gradan a ambientes transicionales y finalmente claramente salobres de menor energía, probablemente de lagunas costeras con fuerte influencia continental. Estos niveles fueron asignados a la Formación Canal 5, la sección inferior a la facies transgresiva (Facies Los Médanos) y los ambientes salobres a la facies regresiva (Facies Santa Ana) de la transgresión Belgranense. En esta localidad los sedimentos correspondientes a la Formación Canal 5, fueron sepultados por sedimentos limosos de la Formación Santa Clara sobre los que yacen sedimentos correspondientes a la transgresión Holocena (Formación Mar Chiquita).
Apéndice
Especies registradas en este estudio:
Foraminíferos
Cornuspira planorbis Schultze, 1854
Quinqueloculina bosciana d'Orbigny, 1839
Quinqueloculina lamarckiana d'Orbigny, 1839
Quinqueloculina milletti (Wiesner, 1912) (figura 8.2)
Quinqueloculina patagonica d'Orbigny, 1839 (figura 8.3)
Quinqueloculina seminulum (Linné, 1767) (figura 8.4)
Quinqueloculina sp. B
Quinqueloculina spp.
Miliolinella subrotunda (Montagu, 1803)
Pyrgo nasuta Cushman, 1935
Pyrgo patagonica (d'Orbigny, 1839)
Pyrgo ringens (Lamarck, 1804)
Tubinellinae? gen. et sp. indet. (figura 8.1)
Lenticulina rotulata (Lamarck, 1804)
Amphicoryna scalaris (Batsch, 1791)
Lagena laevis (Montagu) f. tenuis (Bornemann, 1855)
Lagena striata (d'Orbigny, 1839)
Lagena striaticollis (d'Orbigny, 1839)
Polimorphininae gen. et sp. indet.
Sigmomorphina pauperata (Terquem, 1878)
Oolina caudigera (Wiesner, 1931)
Oolina melo d'Orbigny, 1839
Fissurina quadricostulata (Reuss, 1870)
Fissurina spp.
Bolivina compacta Sidebottom, 1905 (figura 8.5)
Bolivina cuomoi Boltovskoy, 1954
Bolivina danvillensis Howe y Wallace, 1932
Bolivina cf. B. lomitensis Galloway y Wissler, 1927 (figura 8.6)
Bolivina pseudoplicata Heron-Allen y Earland, 1930 (figura 8.7)
Bolivina striatula Cushman, 1922
Bolivina aff. B. thalmanni Renz (figura 8.8)
Bolivina tortuosa Brady, 1881
Cassidulina crassa d'Orbigny, 1839
Globocassidulina subglobosa (Brady, 1881)
Bulimina gibba Fornasini, 1900
Bulimina patagonica d'Orbigny f. typica
Bulimina patagonica d'Orbigny f. glabra Cushman y Wickenden, 1929
Bulimina spp.
Buliminella elegantissima (d'Orbigny, 1839)
Angulogerina angulosa angulosa (Williamson, 1858)
Angulogerina angulosa occidentalis (Cushman, 1923)
Valvulineria sp. (figura 8.10)
Discorbis peruvianus (d'Orbigny, 1839)
Discorbis valvulatus (d'Orbigny, 1826)
Discorbis williamsoni Chapman y Parr, 1932, s.l.
Discorbis spp.
Neoconorbina terquemi (Rzehak, 1888)
Discorbinella bertheloti (d'Orbigny, 1839)
Cibicides ex. gr. aknerianus (d'Orbigny, 1846) sensu Boltovskoy, 1980 (figura 8.9)
Cibicides lobatulus (Walker y Jacob, 1798)
Cibicides variabilis (d'Orbigny, 1826)
Cibicides spp.
Nonion depressulus (Walker y Jacob, 1798)
Nonion pauperatus (Balkwill y Wright, 1885)
Astrononion echolsi Kennett, 1967 (figura 8.11)
Hanzawaia boueana (d'Orbigny, 1846)
Buccella peruviana (d'Orbigny) f. campsi (Boltovskoy, 1954) (figura 8.13)
Buccella peruviana (d'Orbigny) f. frigida (Cushman, 1921) (figura 8.12)
Ammonia beccarii parkinsoniana (d'Orbigny, 1839)
Ammonia beccarii tepida (Cushman, 1926) (figura 8.20-21)
Elphidium advenum depressulum Cushman, 1933 (figura 8.14)
Elphidium articulatum (d'Orbigny, 1839)
Elphidium discoidale (d'Orbigny, 1839) (figura 8.15)
Elphidium excavatum (Terquem, 1876) (figura 8.16)
Elphidium cf. E. lessonii (d'Orbigny, 1826)
Elphidium margaritaceum Cushman, 1930 (figura 8.17)
Cribrorotalia meridionalis (Cushman y Kellet, 1929) (figura 8.18-19)
Ostrácodos
Heterocypris cf. H. incongruens (Ramdohr, 1808) (figura 9.1)
Potamocypris sp.2
Candona sp.1 (figura 9.2)
Candonopsis brasiliensis Sars, 1901
Iliocypris gibba (Ramdohr, 1808) (figura 9.3)
Argilloecia parameridionalis Whatley, Moguilevsky, Chadwick, Toy y Ramos, 1998
Argilloecia sp.
Loxocythere variasculpta Whatley, Moguilevsky, Toy, Chadwick y Ramos, 1997
Cytheretta punctata Sanguinetti, 1979
Protocytheretta australis (Rossi de García, 1969)
Cyprideis multidentata Hartmann, 1955 (figura 9.4)
Cyprideis salebrosa hartmanni Ramírez, 1967 (figura 9.5)
Perissocytheridea sp.1 (figura 9.6)
Parakrithella hanai Hartmann, 1962
Neocytherideis ruidis Whatley, Moguilevsky, Chadwick, Toy, y Ramos, 1998
Neocytherideis sp.
Copytus malumiani Echevarría, 1987
Cushmanidea echevarriae Bertels y Martínez, 1997 (figura 9.7)
Minicythere argentinensis Bertels y Martínez, 1997
Minicythere heini Ornellas, 1974 (figura 9.8)
Papillosacythere paralella Whatley, Chadwick, Coxill y Toy, 1987 (figura 9.9)
Cytherura dimorphica Bertels y Martínez, 1997
Frenguellicythere argentinensis Bertels-Psotka y Martínez, 1999 (figura 9.10)
Hemicytherura? sp.
Hemicytherura auriculata Ramos, Coimbra, Whatley y Moguilevsky, 1999 (figura 9.11)
Hemicytherura lapillata Whatley, Chadwick, Coxill y Toy, 1988 (figura 9.12)
Hemicytherura sp.
Hemingwayella pumilio (Brady, 1880)
Oculocytheropteron delicatum Ramos, Coimbra, Whatley y Moguilevsky, 1999 (figura 9.13)
Oculocytheropteron escobasensis (Bertels-Psotka y Laprida, 1998) (figura 9.14)
Oculocytheropteron macropunctatum Whatley, Chadwick, Coxill y Toy,1988
Oculocytheropteron micropunctatum Whatley, Chadwick, Coxill y Toy,1988 (figura 9.15)
Oculocytheropteron reticulopunctatum Whatley, Chadwick, Coxill y Toy,1988 (figura 9.16)
Semicytherura clavata (Brady, 1880)
Semicytherura closteria Whatley, Chadwick, Coxill y Toy,1988
Semicytherura rugosoreticulata Whatley, Chadwick, Coxill y Toy, 1988 (figura 9.17)
Semicytherura sp. (figura 9.18)
Ambostracon bertelsae (Sanguinetti, Ornellas y Coimbra, 1991) (figura 10.1)
Ambostracon tenuireticulatum Kotzian, 1982
Australicythere cf. A. frequens (Skogsberg, 1928)
Brasilicythere sp.
Muellerina sp.
Caudites ohmerti Coimbra y Ornellas, 1987
Cornucoquimba lutziana Zabert, 1978
Leptocythere sp.
Callistocythere litoralensis (Rossi de García, 1966) (figura 10.2)
Callistocythere rioplatensis Whatley, Moguilevsky, Chadwick, Toy y Ramos, 1998 (figura 10.3)
Limnocythere sp. aff. L. itasca Cole, 1949 (figura 10.4)
Limnocythere solum (Whatley y Cholich, 1974)
Limnocythere staplini Gutentag y Benson, 1962 (figura 10.5-6)
Limnocythere sp. 1 (figura 10.7)
Loxoconcha sp.
Paradoxostomatidae gen et sp. indet. (figura 10.8-9)
Paradoxostoma cf. P. dolichoforma Whatley, Moguilevsky, Toy, Chadwick y Ramos, 1997
Paracytherois sp. 1
Paracytherois sp. 2 (figura 10.10)
Sclerochilus sp. 1
Pellucistoma elongata Whatley, Moguilevsky, Toy, Chadwick y Ramos, 1997
Keijia falklandi (Brady, 1880) = Cythere falklandi Brady
Munseyella josti Kotzian, 1982
Munseyella undulata Whatley, Moguilevsky, Toy, Chadwick y Ramos, 1997
Munseyella sp. 1
Quadracythere gloriaensis Bertels-Psotka y Laprida, 1998
Cytherella sp. 2

Figura 8. Foraminiferida. VL: vista lateral/LV: lateral view; VE: vista espiral/SV: spiral view; VU: vista umbilical/UV: umbilical view. 1, Tubinellinae? gen. et sp. indet., VL/LV, CGC-F-83; 2, Quinqueloculina milletti (Wiesner), VL/LV, CGC-F-290; 3, Quinqueloculina patagonica d'Orbigny, VL/LV, CGC-F-291; 4, Quinqueloculina seminulum (Linné), VL/LV, CGC-F-293; 5, Bolivina compacta Sidebottom, VL/LV, CGC-F-23; 6, Bolivina cf. B. lomitensis Galloway y Wissler, VL/LV, CGC-F-38; 7, Bolivina pseudoplicata Heron-Allen y Earland, VL/LV, CGC-F-22; 8, Bolivina aff. B. thalmanni Renz, VL/LV, CGC-F-295; 9. Cibicides ex. gr. aknerianus (d'Orbigny), VU/UV, CGC-F- 297; 10, Valvulineria sp., VU/UV, CGC-F-3; 11, Astrononion cf. A. antarcticum Parr, VL/LV, CGC-F-19; 12, Buccella peruviana (d'Orbigny) f. frigida Cushman, VU/UV, CGC-F-299; 13, Buccella peruviana (d'Orbigny) f. campsi (Boltovskoy), VU/UV, CGC-F-301; 14, Elphidium advenum depressulum Cushman, VL/LV, CGC-F-18; 15, Elphidium discoidale (d'Orbigny), VL/LV, CGC-F-303; 16, Elphidium excavatum (Terquem), VL/LV, CGC-F-305; 17, Elphidium margaritaceum Cushman, VL/LV, CGC-F-307; 18, Cribrorotalia meridionalis Cushman y Kellet, VU/UV, CGC-F-11; 19. Cribrorotalia meridionalis Cushman y Kellet, VE/SV, CGC-F-309; 20, Ammonia beccarii tepida (Cushman), VE/SV, CGC-F-311; 21, Ammonia beccarii tepida (Cushman), VU/UV, CGC-F-312. Escala gráfica = 100µ / scale bar= 100µ.

Figura 9. Ostracoda. C: caparazón/C: caparace; VD: valva derecha/RV: right valve; VI: valva izquierda/LV: left valve; m: macho/m: male; h: hembra/f: female. 1, Heterocypris cf. incongruens (Ramdohr), VD /RV, CGC-O-50; 2, Candona sp. 1, VD/RV, CGC-O-51/3; 3, Ilyocypris gibba (Ramdohr), VI/LV, CGC-O-5/1; 4, Cyprideis multidentata Hartmann, VD, m/VD, m, CGC-O-52; 5, Cyprideis salebrosa hartmanni Ramírez, VI, h/LV, f, CGC-O-53/1; 6, Perissocytheridea sp.1, VD, juvenil/RV, juvenile, CGC-O-54; 7, Cushmanidea echevarriae Bertels y Martínez, VD/RV, CGC-O-55/2; 8, Minicythere heinii Ornellas, VI/LV, CGC-O-27; 9, Papillosacythere parallela Whatley, Chadwick, Coxill y Toy, VI, m/LV,m, CGC-O-56; 10, Frenguellicythere argentinensis Bertels-Psotka y Martínez, VD, h/RV, f, CGC-O-57/1; 11, Hemicytherura auriculata Ramos, Coimbra, Whatley y Moguilevsky, VD/RV, CGC-O-58; 12, Hemicytherura lapillata Whatley, Chadwick, Coxill y Toy, VD, h/RV, f, CGC-O-59, 13, Oculocytheropteron delicatum Ramos, Coimbra, Whatley y Moguilevsky, VD, h/RV, f, CGC-O-60; 14, Oculocytheropteron escobasensis (Bertels-Psotka y Laprida), VD, m/RV, m, CGC-O-61; 15, Oculocytheropteron micropunctatum Whatley, Chadwick, Coxill y Toy, VD, m/RV, m, CGC-O-62; 16, Oculocytheropteron reticulopunctatum Whatley, Chadwick, Coxill y Toy, VI, m/LV,m, CGC-O-63; 17, Semicytherura rugosoreticulata Whatley, Chadwick, Coxill y Toy, VD, m/RV, m, CGC-O-64; 18, Semicytherura sp., VD/RV, CGC-O-65. Escala gráfica = 100µ / scale bar= 100µ.

Figura 10. Ostracoda. C: caparazón / C: caparace; VD: valva derecha / RV: right valve; VI: valva izquierda / LV: left valve; m: macho / m: male; h: hembra / f: female.1, Ambostracon bertelsae (Sanguinetti, Ornellas y Coimbra), VI/LV, CGC-O-66/1; 2, Callistocythere rioplatensis Whatley, Moguilevsky, Chadwick, Toy y Ramos, C/C, CGC-O-67; 3, Callistocythere litoralensis (Rossi de García), C/C, CGC-O- 68, 4, Limnocythere sp. aff. L. itasca Cole, VI/LV, CGC-O-70; 5, Limnocythere staplini Gutentag y Benson, VD, h/RV, f, CGC-O-71/2; 6, Limnocythere staplini Gutentag y Benson, VD, m/RV, m, CGC-O-71/3; 7, Limnocythere sp. 1, VI/LV, CGC-O-38, 8, Paradoxostomatidae gen. et sp. indet., VI/LV, CGC-O-73; 9, Paradoxostomatidae gen. et sp. indet., VD, vista interna / RV internal view, CGC-O-74; Paracytherois sp. 2, VI/LV, CGC-O-75. Escala gráfica = 100µ / scale bar= 100µ.
Agradecimientos
Este trabajo se realizó con subsidios de la Universidad Nacional de Mar del Plata EXA 290/04 y EXA 369/07. Deseo expresar mi agradecimiento a J. Fasano quien proveyó las muestras estudiadas en este trabajo. A Susana Serra por el tratamiento de las muestras. Finalmente, deseo recordar con cariño y agradecimiento a A. Bertels quien fue mi directora de Tesis y me asesoró en las primeras etapas de este trabajo. Finalmente, agradezco a los revisores de este trabajo, R.A. Violante y un revisor anónimo y a C. Laprida que contribuyeron con sus correcciones y sugerencias a mejorar la versión original.
Bibliografía
1. Aguirre, M.L. 1993. Caracterización faunística de1 Cuaternario marino en el Noreste Bonaerense. Revista de la Asociación Geológica Argentina 47: 31-54. [ Links ]
2. Aguirre, M.L. y Whatley, R.C. 1995. Late Quaternary marginal marine deposits and palaeoenvironments from northeastern Buenos Aires Province, Argentina: a review. Quaternary Science Reviews 14: 223-254. [ Links ]
3. Ameghino, F. 1889. Contribución al conocimiento de los mamíferos fósiles de la República Argentina. Actas de la Academia Nacional de Ciencias (Córdoba) 6: 1-1027. [ Links ]
4. Bandy, O.L. y Arnal, R.E. 1960. Concepts of foraminiferal paleoecology. Bulletin of the American Association of Petroleum Geologists 44: 1921-1932. [ Links ]
5. Berkeley, A., Perry, C.T., Smithers, S.G., Horton, B.P. y Taylor, K.G. 2007. A review of the ecological and taphonomic controls on foraminiferal assemblage development in intertidal environments. Earth-Science Reviews 83: 205-230. [ Links ]
6. Boltovskoy, E. 1957. Los foraminíferos del estuario del Río de la Plata y su zona de influencia. Revista del Instituto Nacional de Investigación de las Ciencias Naturales, Geología 6: 1-77. [ Links ]
7. Boltovskoy, E. 1963. Foraminíferos y sus relaciones con el medio. Revista del Museo Argentino de Ciencias Naturales, Hidrobiología 1: 21-107. [ Links ]
8. Boltovskoy, E. 1976. Distribution of Recent Foraminifera of the South American region. En: R.H. Hedley y C.G. Adams (eds.), Academic Press, Londres, Foraminifera 2, pp. 171-236. [ Links ]
9. Boltovskoy, E. y Boltovskoy, A. 1968. Foraminíferos y Tecamebas de la parte inferior del río Quequén Grande (Prov. de Buenos Aires). Revista del Museo Argentino de Ciencias Naturales, Hidrobiología 2: 127-164. [ Links ]
10. Boltovskoy, E. y Lena, H. 1974. Foraminíferos del Río de la Plata. Servicio de Hidrografía Naval (H.661): 1-22. [ Links ]
11. Boltovskoy, E., Giussani, G., Watanabe, S. y Wright, R. 1980. Atlas of Benthic Shelf Foraminifera of the Southwest Atlantic. Dr. Junk bv. Publishers, The Hague-Boston-London, 147 pp. [ Links ]
12. Brouwers, E.M. 1988. Sediment transport detected from the analysis of ostracod population structure: an example from the Alaskan continental shelf. En: P. De Deckker, J.P. Colin y J.P. Peypouquet (eds.), Ostracoda in the Earth Sciences, Elsevier, Amsterdam, pp. 231-244. [ Links ]
13. Brouwers, E.M. 1990. Systematic paleontology of Quaternary ostracode assemblages from the Gulf of Alaska, Part 1: Families Cytherellidae, Bairdiidae, Cytheridae, Leptocytheridae, Limnocytheridae, Eucytheridae, Krithidae, Cushmanideidae. U.S. Geological Survey Professional Paper 1510: 43 pp. [ Links ]
14. Carbonel, P. 1988. Ostracods and the transition between fresh and saline waters. En: P. De Deckker, J.P. Colin y J.P. Peypouquet (eds.), Ostracoda in the Earth Sciences, Elsevier, Amsterdam, pp. 157-173. [ Links ]
15. Cavallotto, J.L., Violante, R.A. y Colombo, F. 2005. Evolución y cambios ambientales de la llanura costera de la cabecera del Río de la Plata. Revista de la Asociación Geológica Argentina 60: 353-367. [ Links ]
16. Closs, D. y Madeira, M.L. 1962. Tecamebas e foraminíferos do Arroio Chuí (Santa Vitória Do Palmar, Rio Grande Do Sul, Brasil. Iheringia, Zoologia 19: 3-43. [ Links ]
17. Closs, D. y Madeira, M.L. 1968. Seasonal variations of brackish foraminifera in the Patos Lagoon, southern Brazil. Escola de Geologia, UFRGS, Porto Alegre, Publ. Esp. 15: 1-51. [ Links ]
18. Curry, B.B. 1999. An environmental tolerance index for ostracodes as indicators of physical and chemical factors in acquatic habitats. Palaeogeography, Palaeoclimatology, Palaeoecology 148: 51-63. [ Links ]
19. Cusminsky, G.C., Martínez, D y Bernasconi, E. 2006. Foraminíferos y ostrácodos de sedimentos recientes del estuario de Bahía Blanca, Argentina. Revista Española de Micropaleontología 38:: 395-410. [ Links ]
20. Debenay, J.-P., Bénéteau, E., Zhang, J., Stouff, V., Geslin, E., Redois, F. y Fernandez-Gonzalez, M. 1998. Ammonia beccarii and Ammonia tepida (Foraminifera): morphofunctional arguments for their distinction. Marine Micropaleontology 34: 235-244. [ Links ]
21. Denne, R.A. y Sen Gupta, B.K. 1989. Effects of taphonomy and habitat on the record of benthic foraminifera in modern sediments. Palaios 4: 414-423. [ Links ]
22. Duleba, W., Debenay, J.-P., Eichler, B.B. y De Mahiques, M.M. 1999. Holocene environmental and water circulation changes: foraminifer morphogroups evidence in Flamengo Bay (SP, Brazil). Journal of Coastal Research 15: 554-571. [ Links ]
23. Eichler, B.B., Debenay, J.-P., Bonetti, C. y Duleba, W. 1995. Répartition des foraminifères benthiques dans la zone sudouest du système estuarien-lagunaire d'Iguape-Cananéia (Brésil). Boletim do Instituto Oceanográfico 43: 1-17. [ Links ]
24. Ellis, B. y Messina, A. 1940-suppl. Catalogue of Foraminifera: Micropaleontology Project, Inc., New York. World Wide Web: http://www.micropress.org/e-m.html. [ Links ]
25. Ellis, B. y Messina, A. 1954-suppl. Catalogue of Ostracoda: Micropaleontology Project, Inc., New York. World Wide Web: http://www.micropress.org/e-m.html. [ Links ]
26. Erra, G., Ferrero, L., Fucks, E., Aguirre, M. y Schnack, E. 2008. Evidencias paleoambientales del Pleistoceno marino tardío de la Formación Pascua basadas en moluscos y microfósiles. 4º Congress of the Regional Committee on Neogene Atlantic Stratigraphy (RCANS) (Buenos Aires), Resúmenes: 21. [ Links ]
27. Fasano, J.L. 1991. Geología y geomorfología, Región III: Faro Querandí-Mar de Cobo, Provincia de Buenos Aires. Informe final. Evaluación del Recurso Hídrico Subterráneo de la Región Costera Atlántica de la provincia de Buenos Aires, convenio de cooperación horizontal. CFI-UNMdP, 118 pp. Inédito. [ Links ]
28. Fasano, J.L., Hernández, M.A., Isla, F.I. y Schnack, E.J., 1982. Aspectos evolutivos y ambientales de la laguna Mar Chiquita (provincia de Buenos Aires, Argentina). Oceanologica Acta 4 suppl.: 285-292. [ Links ]
29. Ferrero, L. 2006. Micropaleontología y paleoecología del Cuaternario del sudeste de la provincia de Buenos Aires. Tesis de Doctorado, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Mar del Plata, 373 pp. Inédito. [ Links ]
30. Fidalgo, F., Colado, U.R. y De Francesco, F.O. 1973a. Sobre ingresiones marinas cuaternarias en los partidos de Castelli, Chascomús y Magdalena (Provincia de Buenos Aires). 5º Congreso Geológico Argentino (Carlos Paz), Actas 3: 227-240. [ Links ]
31. Fidalgo, F., De Francesco, F.O. y Colado, U.R. 1973b. Geología superficial de la Hojas Castelli, J.M. Cobo y Monasterio (Provincia de Buenos Aires). 5º Congreso Geológico Argentino (Carlos Paz), Actas 4: 27-39. [ Links ]
32. Frenguelli, J. 1928. Observaciones geológicas de la región costanera sur de la provincia de Buenos Aires. Anales de la Facultad de Ciencias de la Educación (Universidad Nacional del Litoral), Sección Historia y Geografía 2: 1-145. [ Links ]
33. Frenguelli, J. 1950. Rasgos generales de la morfología y la geología de la provincia de Buenos Aires. LEMIT (La Plata), Serie 2, 33: 72 pp. [ Links ]
34. Frenguelli, J. 1957. Neozoico. En: Geografía de la República Argentina, Sociedad Argentina de Estudios Geográficos, GAEA 2: 1-115. [ Links ]
35. Fucks, E., y De Francesco, F. 2003. Ingresiones marinas al norte de la ciudad de Buenos Aires, su ordenamiento estratigráfico. 2° Congreso Argentino de Cuaternario y Geomorfología (Tucumán), Actas: 101-110. [ Links ]
36. Fucks, E., Aguirre, M. y Deschamps, C.M. 2005. Late Quaternary continental and marine sediments of northeastern Buenos Aires province (Argentina): Fossil content and paleoenvironmental interpretation. Journal of South America Earth Sciences 20: 45-56. [ Links ]
37. Goldstein, S.T. y Watkins, G.D. 1999. Taphonomy of salt marsh foraminifera: an example from coastal Georgia. Palaeogeography, Palaeoclimatology, Palaeoecology 149: 103-114. [ Links ]
38. Gómez, E.A., Martínez, D.E., Borel, C.M., Guerstein, G.R. y Cusminsky, G.C. 2005. Submarine evidence of Holocene sealevel fluctuations in the Bahía Blanca estuary, Argentina. Journal of South America Earth Sciences 20: 139-155. [ Links ]
39. Grimm, E.C. 1991. Tilia Software. Illinois State Museum. Research and Collection Center. Springfield, Illinois. [ Links ]
40. Grimm, E.C. 2001. TGView. Illinois State Museum. Research and Collection Center. Springfield, Illinois. [ Links ]
41. Hammer, O., Harper, D.A.T. y Ryan, P.D. 2001. PAST: Palaeontological Statistics software package for education and data analysis. Palaeontologia Electronica 4, 9 pp. [ Links ]
42. Hayward, B.W., Holzmann, M., Grenfell, H.R., Pawlowski, J. y Triggs, C.M. 2004. Morphological distinction of molecular types in Ammonia - towards a taxonomic revision of the world's most commonly misidentified foraminifera. Marine Micropaleontology 50: 237-271. [ Links ]
43. Hazel, J.E. 1975. Patterns of marine ostracode diversity in the Cape Hatteras, North Carolina, Area. Journal of Paleontology 49: 731-744. [ Links ]
44. Isla, F.I., Rutter, N.W., Schnack, E.J. y Zárate, M.A. 2000. La transgresión belgranense en Buenos Aires. Una revisión a cien años de su definición. Revista Cuaternario y Ciencias Ambientales, Publicación Especial 4: 3-14. [ Links ]
45. Jorissen, F.J. y Wittling, I. 1999. Ecological evidence from live-dead comparisons of benthic foraminiferal faunas off Cape Blanc (Northwest Africa). Palaeogeography, Palaeoclimatology, Palaeoecology 149: 151-170. [ Links ]
46. Kidwell, S.M. 1993. Patterns of time averaging in the shallow marine fossil record. En: S.M. Kidwell y A.K. Beherensmeyer (eds.), Taphonomic approaches to time resolution in fossil assemblages. Paleontological Society, Short Courses in Paleontology 6: 275-300. [ Links ]
47. Laprida, C. 1998. Micropaleontological assemblages (Foraminiferida and Ostracoda) from Late Quaternary marginal marine environments (Destacamento Río Salado Formation), Salado Basin, Argentina. Revue Paléobiologie 17: 461-478. [ Links ]
48. Laprida, C. 2006. Ostrácodos recientes de la llanura pampeana, Buenos Aires, Argentina: ecología e implicancias paleolimnológicas. Ameghiniana 43: 181-204. [ Links ]
49. Laprida, C. y Bertels-Psotka, A. 2003. Benthic foraminifers and paleoecology of a Holocene shelly concentration, Salado Basin, Argentina. Geobios 36: 559-572. [ Links ]
50. Laprida, C., García Chapori, N., Violante, R.A. y Compagnucci, R.H. 2007. Mid-Holocene evolution and paleoenvironments of the shoreface-offshore transition, north-eastern Argentina: New evidence based on benthic microfauna. Marine Geology 240: 43-56. [ Links ]
51. Lena, H. y L'Hoste, S. 1975. Foraminíferos de aguas salobres (Mar Chiquita, Argentina). Revista Española de Micropaleontología 7: 539-548. [ Links ]
52. Loeblich, A.R. y Tappan, H. 1988. Foraminiferal genera and their classification, Van Nostrand Reinhold Company, New York, 1: 970 pp., 2: 212 pp., 847 lám. [ Links ]
53. Moodley, L. 1990. Southern North Sea seafloor and subsurface distribution of living benthic foraminifera. Netherlands Journal of Sea Research 27: 57-71. [ Links ]
54. Moore, R.C. (ed.) 1961. Treatise on Invertebrate Paleontology - Part Q, Arthropoda 3, Crustacea, Ostracoda. Geological Society of America and University of Kansas Press, 442 pp. [ Links ]
55. Murray, J.W. 1973. Distribution and ecology of living benthic Foraminiferids. Heinemann Educationals Books, London, 274 pp. [ Links ]
56. Murray, J.W. 1991. Ecology and paleoecology of benthic Foraminifera. Longman Scientific y Technical, New York, 397 pp. [ Links ]
57. Ornellas, L.P. y Würdig, N. 1983. Cyprideis salebrosa hartmanni Ramírez, 1967, a new subespecies from Brasil and Argentina. Pesquisas 15: 94-112. [ Links ]
58. Palacios-Fest, M.R., Cohen, A.S. y Anadón, P. 1994. Use of ostracodes as paleoenvironmental tools in the interpretation of ancient lacustrine records. Revista Española de Paleontología 9: 145-164. [ Links ]
59. Pawlowski, J., Bolivar, I., Fahrni, J. y Zaninetti, L. 1995. DNA analysis of "Ammonia beccarii" morphotypes: one or more species? Marine Micropaleontology 26: 171-178. [ Links ]
60. Poag, C.W. 1978. Paired foraminiferal ecophenotypes in Gulf Coast estuaries: ecological and paleoecological implications. Transactions of Gulf Coast Association of Geological Societies 28: 395-421. [ Links ]
61. Ramírez, F.C. 1967. Ostrácodos de lagunas de la provincia de Buenos Aires. Revista del Museo de La Plata (nueva serie), Zoología 10: 5-54. [ Links ]
62. Ramos, M.I.F., Coimbra, J.C., Whatley, R.C. y Moguilevsky, A. 1999. Taxonomy and ecology of the Family Cytheruridae (Ostracoda) in Recent sediments from the northern Rio de Janeiro Coast, Brazil. Journal of Micropalaeontology 18: 1-16. [ Links ]
63. Sanguinetti, I., Ornellas, L. P. y Coimbra, J.C. 1991. Post Miocene ostracodes from Pelotas Basin, Southern Brazil. Taxonomy . Part I. Pesquisas 18: 138-155. [ Links ]
64. Schnack, E.J., Fasano, J.L. e Isla, F.I. 1982. The evolution of Mar Chiquita lagoon coast, Buenos Aires Province, Argentina. En: D.J. Colquhoun (ed.), Holocene sea level fluctuations: maqnitude and causes, pp. 143-155. [ Links ]
65. Schnack, E.J., Isla, F.I., De Francesco, F.O. y Fucks, E.E. 2005. Estratigrafía del Cuaternario marino tardío en la provincia de Buenos Aires. En: R.E. de Barrio, R.O. Etcheverry, M.F. Caballé y E. Llambías (eds.), Geología y Recursos Minerales de la Provincia de Buenos Aires. Relatorio del 16º Congreso Geológico Argentino (La Plata), pp. 159-182. [ Links ]
66. Schnitker, D. 1974. Ecotypic variation in Ammonia beccarii (Linné). Journal of Foraminiferal Research 4: 216-223. [ Links ]
67. Scott, D.B., Schnack, E.J., Ferrero, L., Espinosa, M. y Barbosa, C.F. 1990. Recent marsh foraminifera from the east coast of South America: Comparison to the Northern Hemisphere. En: C. Hemleben, M.A. Kaminski, W. Kuhnt y D.B. Scott (eds.), Paleoecology, Biostratigraphy, Paleoceanography and Taxonomy of Agglutinated Foraminifera, Kluwer Academic Publishers, pp. 717-737. [ Links ]
68. Violante, R.A. 1992. Ambientes sedimentarios asociados a un sistema de barrera litoral del Holoceno en la llanura costera al sur de Villa Gessell, provincia de Buenos Aires. Revista de la Asociación Geológica Argentina 47: 201-214. [ Links ]
69. Violante, R.A. 2003. Geomorphology and coastal evolution during the Last Interglacial Maximum Sea-Level Highstand in the Atlantic Littoral of the Pampean Region, Argentina. Quaternary coastal morphology and sea level changes, Final Conference Project IGCP 437, Coastal Environmental Change During Sea-Level Highstands: A Global Synthesis with implications for management of future coastal change (Puglia), pp. 243-246. [ Links ]
70. Violante, R.A. y Parker, G. 1992. Estratigrafía y rasgos evolutivos del Pleistoceno medio a superior-Holoceno en la llanura costera de la región de Faro Querandí (provincia de Buenos Aires). Revista de la Asociación Geológica Argentina 47: 215-227. [ Links ]
71. Walton, W.R. y Sloan, B.J. 1990. The genus Ammonia Brunnich, 1772: Its geographic distribution and morphologic variability. Journal of Foraminiferal Research 20: 128-156. [ Links ]
72. Wang, P. y Lutze, G.F. 1986. Inflated later chambers: Ontogenetic changes of some Recent hyaline benthic foraminifera. Journal of Foraminiferal Research 16: 48-62. [ Links ]
73. Weiler, N.E. González, M.A. y Guida, N.G. 1987. Niveles marinos del Pleistoceno tardío en Cañada de Arregui, Partido de Magdalena, provincia de Buenos Aires. Revista de la Asociación Geológica Argentina 42: 92-98. [ Links ]
74. Whatley, R.C. 1983. The application of Ostracoda to palaeoenvironmental analysis. En: R.F. Maddocks (ed.), Applications of Ostracoda, University of Houston, pp. 51-77. [ Links ]
75. Whatley, R.C. 1988. Population structure of ostracods: some general principles for the recognition of palaeoenvironments. En: P. De Deckker, J.P. Colin y J.P. Peypouquet (eds.), Ostracoda in the Earth Sciences, Elsevier, Amsterdam, pp. 245-256. [ Links ]
76. Whatley, R.C., Chadwick, J., Coxill, D. y Toy, N. 1988. The ostracod family Cytheruridae from the Antarctic and Southwest Atlantic. Revista Española de Micropaleontología 20: 171-203. [ Links ]
77. Whatley, R.C., Toy, N., Moguilevsky, A. y Coxill, D. 1995. Ostracoda from the South West Atlantic. Part I. The Falkland Islands. Revista Española de Micropaleontología 27: 17-38. [ Links ]
78. Whatley, R.C., Stauton, M., Kaesler, R.L. y Moguilevsky, A. 1996. The taxonomy of Recent marine Ostracoda from the southern Strait of Magellan. Revista Española de Micropaleontología 28: 51-76. [ Links ]
79. Whatley, R.C., Moguilevsky, A., Toy, N., Chadwick, J.M. y Ramos, M.I.F. 1997. Ostracoda from the South west Atlantic. Part II. The littoral fauna from between Tierra del Fuego and the Río de la Plata. Revista Española de Micropaleontología 29: 5-83. [ Links ]
80. Whatley, R.C., Moguilevsky, A., Chadwick, J.M., Toy, N. y Ramos, M.I.F. 1998. Ostracoda from the South west Atlantic. Part III. The Argentinian, Uruguayan and Southern Brazilian Continental Shelf. Revista Española de Micropaleontología 30: 89- 116. [ Links ]
81. Wright, R. 1968. Miliolidae (Foraminíferos) recientes del Río Quequén Grande. Revista del Museo Argentino de Ciencias Naturales, Hidrobiología 2: 225-256. [ Links ]
Recibido: 28 de noviembre de 2008.
Aceptado: 24 de julio de 2009.














