Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Darwiniana, nueva serie
versión impresa ISSN 0011-6793versión On-line ISSN 1850-1699
Darwiniana v.42 n.1-4 San Isidro ene./dic. 2004
Revisión del género Danaea (Marattiaceae - Pteridophyta)
Cristina H. Rolleri 1
Laboratorio de Estudios de Anatomía Vegetal Evolutiva y Sistemática, Facultad de Ciencias Naturales y Museo deLa Plata, 64 entre Victoria y diagonal 113, B1904 DZB, La Plata, Argentina. E-mail: tinar@uolsinectis.com.ar
1 Profesora Titular, Facultad de Ciencias Naturales y Museo de La Plata; Investigadora I, Universidad Nacional de La Plata; Investigador Independiente, CONICET.
RESUMEN: Rolleri, C. H. 2004. Revisión del género Danaea (Marattiaceae-Pteridophyta). Darwiniana 42(1-4): 217-301.
Esta es una revisión de Danaea, el único género neotropical de Marattiaceae. Se estudiaron numerosas colecciones y se efectuó un análisis detallado de los caracteres de la morfología externa e interna del esporófito. También se incluye una actualización de la taxonomía de las especies, una clave para determinarlas, comentarios acerca de sus afinidades, distribución geográfica, rango altitudinal, citología y ecología. Se reconocen diecisiete especies: D. alata, D. carillensis, D. crispa, D. elliptica, D. humilis, D. imbricata, D. jenmanii, D. mazeana, D. moritziana, D. nodosa, D. oblanceolata, D. plicata, D. simplicifolia, D. tenera, D. trichomanoides, D. ulei y D. wendlandii. Danaea comparte con los otros cuatro géneros de Marattiaceae (Angiopteris, Archangiopteris, Christensenia y Marattia) los rizomas desnudos, carnosos, policiclostélicos, amiláceos, con tejidos de sostén colenquimáticos; el almidón de granos simples excéntricos; las estípulas geminadas amiláceas; la presencia de pulvínulos; los tipos de modelos epidérmicos; los estomas maratiáceos; la presencia de protuberancias intercelulares pécticas (PIP) del mesofilo de las frondas y el sistema secretor de mucílago. Sin embargo, los rizomas rastreros o erectos; el número de pulvínulos en el estípite; las láminas dimórficas simples o 1-pinnadas; los márgenes enteros, ondulados o crespos; el indumento glandular (tricomas y protoscamas mucilaginíferos); la textura y patrones de venación de las pinnas; las combinaciones de los modelos epidérmicos de epifilos e hipofilos; los estomas maratiáceos típicos y/o porociclocíticos; las PIP predominantemente filamentosas y la morfología del exoporio en las esporas monoletes equinadas, son rasgos típicos de Danaea cuya variación permite delimitar las especies. La división de la lámina, el indumento, el contorno de la lámina y las pinnas, el número de pares, margen, textura y venación de las pinnas, la presencia o ausencia de pinnas terminales o yemas, el color de las venas y de los hipofilos son buenos caracteres exomorfológios para determinar las especies, tanto en material fresco como herborizado, y sobre la base de los mismos se ha elaborado la clave de las especies, incluyendo además otros, como los tipos de rizomas, que pueden constituir un rasgo adicional útil para determinar las especies en el campo.
Palabras clave: Marattiaceae; Danaea; Taxonomía; Morfología.
ABSTRACT: Rolleri, C. H. 2004. Revision of the genus Danaea (Marattiaceae-Pteridophyta).
Darwiniana 42(1-4): 217-301.
This is a revision of Danaea, the only neotropical genus of the Marattiaceae. Several collections were analized, and both external and internal detailed morphology of the sporophyte was studied. Taxonomy of the species, a key to identify them, comments on their affinities, geographical distribution, altitudinal range, cytology and ecology are also given. Seventeen species of the genus are recognized: D. alata, D. carillensis, D. crispa, D. elliptica, D. humilis, D. imbricata, D. jenmanii, D. mazeana, D. moritziana, D. nodosa, D. oblanceolata, D. plicata, D. simplicifolia, D. tenera, D. trichomanoides, D. ulei and D. wendlandii. Danaea shares several characters with the other four marattiaceous genera (Angiopteris, Archangiopteris, Christensenia and Marattia ), as naked, carnose polycyclostelic amylaceous rhizomes with internal collenchymatous tissues, excentric simple starch grains, geminate stipules, pulvinules, types of epidermal patterns of the laminae, marattiaceous stomata, presence of intercellular pectic protuberances in the mesophyll cells (IPP), and mucilage secreting system. However, postrate and erect rhizomes; number of pulvinules in the stipes; simple or 1-pinnate, dimorphic laminae; pinna outline; entire, undulate or crispate pinna margins; glandular indument (both mucilaginiferous trichomes and protoscales); lamina texture; venation patterns; epidermal patterns of the epiphylls and hypophylls which vary at the specific level; both normal and porocyclocytic marattiaceous stomata; mostly filamentose IPP, and the morphology of the exopore in echinate spores are considered good diagnostic characters related to Danaea. Division of the lamina, indument, lamina and pinna outline, number of pinnae, type of pinna margin, lamina texture, venation patterns, presence or absence of terminal pinnae or gemae, and color of veins and the hypophylls are good morphological characteres to identify the species both in fresh and dry specimens, and they were used to prepare the key to identify the species, along with other traits such as rhizome types, which can be additionally useful to complete plant identifications in the field.
Key words: Marattiaceae; Danaea; Taxonomy; Morphology.
Original recibido el 13 de junio de 2003;
aceptado el 10 de septiembre de 2004.
INTRODUCCIÓN
En este trabajo se analiza la morfología y la taxonomía de Danaea Sm., el único género exclusivamente neotropical de la familia Marattiaceae (Rolleri et al., 2001a, 2003), cuyas especies crecen en las selvas tropicales y subtropicales, desde México hasta Brasil y Paraguay. Las especies de Danaea tienen esporófitos pequeños, con rizomas rastreros carnosos y frondas con láminas hialinas a herbáceas, o esporófitos medianos a grandes, casi con el aspecto de pequeños helechos arborescentes, con rizomas postrados, ascendentes o erectos y frondas con láminas firmes, hasta subcoriáceas. Es el único género de Marattiaceae con dimorfismo foliar: las frondas fértiles tienen láminas contraídas o reducidas y llevan sinangios inmersos en el tejido foliar, dehiscentes a través de numerosos poros. Producen gran cantidad de esporas monoletes con ornamentación esteliforme de tipo equinado (Lellinger &Taylor, 1997), con espinas cortas o largas, similares a las presentes en otros géneros de Marattiaceae, como Christensenia Maxon (Rolleri et al., 1996) y Marattia Sw. (Rolleri et al., 2000; Lavalle, 2002, 2003).
El género fue establecido en 1793 por J. E. Smith en honor del botánico italiano J. P. M. Dana y originalmente se basó en una planta coleccionada en La Martinica. Varios autores describieron o estudiaron especies de Danaea desde la publicación del género, entre ellos Desvaux (1811), Raddi (1819), Presl (1845), Fée (1866), Baker & Hooker (1874) y Christ (1905, 1907, 1909). Hasta la fecha, la única revisión existente es la de Underwood (1902), pero en esa obra se omitieron numerosas especies y los rasgos diagnósticos seleccionados fueron insuficientes para delimitarlas. El género fue tratado también en floras regionales por Liebmann (1849), Sturm (1859), Underwood (1909), Stolze (1976), Proctor (1977, 1989), Lellinger (1989), Tryon & Stolze (1989), Pérez García (1993), Camus & Pérez García (1995) y Tuomisto & Moran (2001). Otros autores, como Brebner (1896, 1902), Campbell (1911), West (1915, 1917), Bower (1926), Hill & Camus (1986), Tuomisto & Groot (1995); Rolleri & Lavalle (1997) y Rolleri et al. (1987, 1991, 1994, 1996, 1998, 1999, 2000, 2001b-d) analizaron diferentes aspectos de la morfología externa e interna del esporófito.
El número de especies descritas hasta el momento asciende a 59 y la única subdivisión del género, propuesta por Presl (1845) nunca se utilizó. Pichi Sermolli (1977) lo consideró un género aislado, poco afín con otros de Marattiaceae y lo segregó en una familia aparte, Danaeaceae Agardh. Rolleri et al. (2001b, 2003) propusieron una sola familia, Marattiaceae, con 5 géneros (Angiopteris Hoffm., Archangiopteris H. Christ & Giesenh., Christensenia Maxon, Danaea y Marattia Sw) y consideraron rasgos de familia los rizomas carnosos, desnudos, amiláceos, policiclostélicos; las estípulas geminadas amiláceas; el almidón de granos simples en los tejidos parenquimáticos de rizomas, estípulas y estípites; el colénquima en rizomas, raíces y estípites; el esclerénquima en raquis, costas y cóstulas; la presencia de pulvínulos en el estípite y/o en la base de las costas; el indumento formado por protoscamas y tricomas; los modelos epidérmicos; el estoma maratiáceo; las protuberancias intercelulares pécticas de las paredes de las células del mesofilo (en adelante PIP); el sistema secretor de mucílago distribuido por toda la planta y los tipos de macroornamentación de las esporas triletes y monoletes.
Aquí se analizaron en detalle varios rasgos del esporófito, como la anatomía del rizoma y estípite, las estípulas, el indumento adulto y su ontogenia, los patrones de venación, los modelos epidérmicos de la lámina, los estomas adultos y su ontogenia, las protuberancias intercelulares pécticas y la mor fología de las esporas. Sobre esa base, se reconocen 17 especies de Danaea, a saber: D. alata, D. carillensis, D. crispa, D. elliptica, D. humilis, D. imbricata, D. jenmanii, D. mazeana, D. moritziana, D. nodosa, D. oblanceolata, D. plicata, D. simplicifolia, D. tenera, D. trichomanoides, D. ulei y D. wendlandii.
Los esporófitos con frondas dimórficas 1- pinnadas, el número de pulvínulos en el estípite, el indumento glandular mucilaginífero, los tipos de tricomas y protoscamas, los márgenes de las pinnas enteros, repandos o crespos, la presencia de vena marginal, los estomas maratiáceos ciclocíticos y porociclocíticos, las PIP predominantemente filamentosas y las esporas monoletes equinadas son rasgos genéricos en Danaea, mientras que los patrones de venación y el color de las venas, los modelos epidérmicos de epifilos e hipofilos, los estomas maratiáceos porociclocíticos o con poros normales, la variación morfológica de los tricomas, protoscamas, PIP y exosporios equinados son rasgos taxonómicos de variación específica. Algunos de los caracteres de Danaea también se encuentran en el género paleotropical Christensenia, como los hipofilos amarillentos, los modelos epidérmicos sinuosos frecuentes, el indumento de naturaleza glandular (aunque en ese género está formado predominantemente por tricomas, morfológicamente diferentes de los de Danaea y las protoscamas están ausentes, Rolleri, 1993) y los exosporios equinados (Rolleri et al., 1996).
Los tipos de venación hallados en las especies de Danaea son caracteres específicos. Todo el material examinado ha sido estudiado en detalle en lo referente al patrón de venación, de modo que los tipos ilustrados para cada especie representan un carácter confiable de fácil observación. Los modelos epidérmicos resaltan como un rasgo diagnóstico útil para contrastar otros de apreciación más sencilla, ya que son específicos. Adicionalmente, el conocimiento de sus etapas de maduración permite reconocer fases de desarrollo e incluso plántulas. El conjunto de rasgos externos que se utiliza en la clave se ha seleccionado por su fácil acceso pero es resultado de la comparación con todos los caracteres arriba mencionados, incluyendo los modelos epidérmicos y ha sido puesto a prueba en material fresco y herborizado. Las esporas representan un carácter interesante en las determinaciones. Si bien la ornamentación es equinada en todas las especies, el tipo de perisporio, la morfología de las espinas y el grado de fusión de éstas son rasgos diagnósticos complementarios útiles en muchos casos. Su tamaño parece relacionarse con la ploidía (Barrington et al., 1986). Este dato, así como la proporción de esporas aspecto normal o anómalo en las poblaciones de algunas especies sugieren relaciones interespecíficas que se aclararían con estudios citológicos adicionales, que aún faltan en el género.
Tuomisto & Moran (2001) utilizaron la posición del rizoma como un rasgo específico, algo que aquí no se ha considerado de la misma forma. En las especies de Danaea se encuentran rizomas postrados, ascendentes y erectos, y del estudio de estas condiciones y la comparación con otros caracteres han surgido dudas sobre el hecho de que esa variación esté vinculada con una especie en particular, ya que las distintas posiciones del rizoma no se correlacionan bien con el conjunto de caracteres específicos estudiados aquí. Los ejemplares herborizados con rizomas son muy infrecuentes: el estudio de cerca de 1000 ejemplares de herbario mostró que los rizomas herborizados representan apenas un 10 % de los mismos. Por esa razón, se ha incluido este carácter de manera complementaria en las claves (no así en las descripciones), ya que las especies de Danaea aquí reconocidas pueden ser determinadas utilizando caracteres foliares.
Aquí se presentan una nueva descripción del género, una actualización de la taxonomía de las especies basada en la consulta de tipos nomenclaturales y material adicional, datos sobre su distribución geográfica, ecología y comentarios acerca de sus afinidades.
MATERIALES Y MÉTODOS
Se han consultado los herbarios cuyas siglas se citan a continuación, de acuerdo con Holmgren et al. (1990): A, AAU, BM, CTES, G, GH, HRCB, K, LP, MO, NY, PRC, R, RB, S, U, UAMIZ, UC, US, W.
Rizoma, estípulas y estípites. Pequeños trozos de estos órganos se ablandaron con éter monobutílico del etilenglicol 10 % acuoso. Se hicieron cortes a mano alzada y se montaron en gelatinaglicerina. Las protoscamas de los estípites se estudiaron montadas transitoriamente en glicerina y agua.
Patrones de venación y modelos epidérmicos de las láminas. Se estudiaron en pinnas aclaradas con hidróxido de sodio 2,5 % acuoso durante 20 minutos; se blanquearon con hipoclorito de sodio comercial 1:1 acuoso, se colorearon con Safranina - Fast Green 2 % en éter monometílico del etilenglicol (cellosolve), según Gurr (1966) y se montaron en "Canadax Biopur", un medio de montaje artificial estéril.
Protuberancias intercelulares pécticas de las células del mesofilo. Se estudiaron en fragmentos de pinnas y las PIP se fotografiaron mediante un microscopio electrónico de barrido (MEB). La comparación de material sin procesar y fijado en punto crítico indica que las PIP de Marattiaceae se conservan bien en material herborizado, aún antiguo y no requieren fijación especial. Los fragmentos se cubrieron con oro bajo vacío, se metalizaron en un JEOL JFC-1100 (fine coat ion sputter) y se fotografiaron con un microscopio JEOL JSMT100, en el Servicio de Microscopía de Barrido de la Facultad de Ciencias Naturales y Museo de La Plata.
Ontogenia de tricomas, protoscamas y estomas. El desarrollo de tricomas y protoscamas y la ontogenia de los estomas se estudiaron en ápices de pinnas juveniles en despliegue o tenuerales (Lellinger, 2002) de plántulas y circinos de algunas especies, coloreados con carmín acético.
Esporas. Se tomaron muestras de esporas de especímenes de todas las localidades de cada taxón. Las esporas se sacaron de cada sinangio con una aguja histológica o un pincel fino y se colocaron sobre cinta adhesiva de doble faz (para evitar la contaminación se eligieron plantas que no habían sido fijadas en la hoja de herbario mediante pegamento). Sin otro tratamiento, las esporas se cubrieron con oro bajo vacío, en un metalizador Jeol JSM 1100 (fine coat ion sputter). Las fotografías se tomaron con un microcopio electrónico Jeol JFC T100.
Pruebas químicas de identificación. Se efectuaron una serie de pruebas químicas (Johansen, 1940) para detectar o probar la presencia de taninos en células aisladas, cristales en células del mesofilo, almidón en tejidos parenquimáticos, lignina y pectinas en tejidos de sostén, para analizar los contenidos de los tricomas glandulares y para constatar la normalidad de las esporas. Los taninos son comunes como trazas en las paredes de los tricomas y protoscamas viejos; también aparecen en células aisladas o en pequeños grupos que se distribuyen por toda la planta, especialmente en los ejes; se ponen en evidencia con cloruro férrico 10 % acuoso. Los cristales de oxalato de calcio están presentes como un residuo metabólico corriente en rizomas y estípites y pueden ser abundantes en las células del mesofilo y de la epidermis de algunas especies; se detectan mediante la prueba del sulfato férrico. El almidón se pone en evidencia con solución de Lugol (ioduro de postasio iodurado). No se encontró una prueba satisfactoria para mucílagos, posiblemente porque se trata de un grupo químicamente variado de sustancias. En Danaea el mucílago está distribuido por toda la planta y rezuma de los rizomas ablandados tan pronto como son cortados, en forma de una sustancia gelatinosa translúcida que retiene por cierto tiempo la forma de los pasajes que la conducen. Una solución muy diluida de eosina indicó contenidos proteicos en mucílagos de casi todas las especies.
La venación, las variaciones morfológicas del indumento adulto, los modelos epidérmicos y los estomas adultos se analizaron en pinnas de todos los ejemplares citados, pero las ilustraciones corresponden a modelos adultos de pinnas medias. Las ilustraciones se efectuaron con un microscopio Wild M20 equipado con cámara de dibujo y escaneando los preparados (venación).
Para constatar la viabilidad de las esporas se utilizaron las coloraciones del pardo de Bismarck y carmín acético. Los porcentajes de esporas abortadas se calcularon en muestras sucesivas provenientes de distintos sinangios; las de D. jenmanii, a causa de sus variadas anomalías, no se midieron (Tabla 2). Se analizaron la mayoría de los especímenes estudiados, con excepción de los que presentaban sinangios muy maduros con poros muy abiertos.
Tabla 1.- Dimensiones y densidades estomáticas en especies de Danaea.

Tabla 2.- Dimensiones y caracteres de las esporas de las especies de Danaea (*)

A menos que se diga explícitamente "no visto", todos los especímenes citados fueron vistos, analizados y medidos. Las medidas expresadas en la tabla de estomas corresponden al promedio de 50 recuentos por cada ejemplar estudiado. Las medidas expresadas en la tabla de esporas se tomaron incluyendo la ornamentación y corresponden al promedio de 25 muestras con un mínimo de 100 esporas provenientes de sinangios elegidos al azar en diferentes ejemplares.
La mayor parte de los términos pteridológicos ya se han utilizado en trabajos previos sobre Marattiaceae (Rolleri, 1993, 2002; Lavalle, 2002; Mengascini, 2002) y todos ellos se encuentran en Lellinger (2002). De acuerdo con esto, se prefieren, entre otros, los términos fronda, pínnula, pinnúlula, costa, cóstula, pulvínulo, venuloide (en lugar de hoja, pinnas de segundo o tercer orden, raquis de segundo o tercer orden, nudo y vena recurrente), entre otros. El término protoscama es exclusivo de Marattiaceae (Lellinger, 2002); los términos utilizados para epidermis y estomas están en todos los trabajos previos de la autora, y los relativos a las esporas son de Lellinger & Taylor (1997).
RESULTADOS Y DISCUSIÓN
Rizomas y raíces (Fig. 1)

Fig. 1.- Raíz, rizomas y estípulas en Danaea. A: D. wendlandi, sección transversal de rizoma (similar en D. crispa ). B: D. crispa, esquema de media estípula. C: D. moritziana, sección de rizoma. D: D. carillensis, sección de rizoma. E: D. alata, sección de rizoma. F: D. elliptica, sección de raíz. Abreviaturas: c, corteza externa; ci, corteza interna; co, colénquima; e, endodermis; ep, epidermis; est, estípula; l, lámina pluriestratificada de la estípula; m, margen uniestratificado de la estípula; me, meristela del ciclo externo; me i, meristela del ciclo interno; mu, canal de mucílago; mx, metaxilema; fl, floema; prx, protoxilema; mx e, metaxilema esclerosado; prx, protoxilema; r, raíz; líneas rectas o punteadas en B, canales de mucílago.
Los rizomas son desnudos pero están cubiertos por estípulas pareadas que abrazan la base de los estípites. Éstos nacen adaxialmente en rizomas postrados, próximos o distantes, pero pueden estar muy próximos y más agrupados en un polo, en rizomas erectos. Las raíces son abaxiales en la mayoría de los rizomas, mientras que son abaxiales y laterales en los que tienen posición erecta.
Los rizomas son dorsiventrales, cortamente o largamente rastreros y pueden ser algo ascendentes en la mayoría de las especies, mientras que unas pocas desarrollan formas con rizomas suberectos o erectos, lo que confiere a las plantas el aspecto de un pequeño helecho arborescente. Danaea elliptica produce casi siempre rizomas erectos robustos, erguidos y gruesos, mientras que este tipo de rizomas es más bien ocasional en D. nodosa. Danaea moritziana forma rizomas rastreros a suberectos, cortos o largos, que pueden ser apoyantes o totalmente erguidos en plantas bien desarrolladas de ciertas localidades que se comportan entonces como hemiepífitos ocasionales. Las tres especies mencionadas tienen los esporófitos más grandes y robustos del género, en tanto que las demás especies, con esporófitos medianos o pequeños, casi siempre desarrollan rizomas rastreros. Danaea humilis presenta a veces rizomas cortos, delgados y carnosos, suberectos, pero es más frecuente la condición postrada. Danaea alata, D. carillensis, D. crispa, D. imbricata, D. jenmanii, D. mazeana, D. oblanceolata, D. plicata, D. simplicifolia, D. tenera, D. trichomanoides, D. ulei y D. wendlandii tienen rizomas postrados, cortamente o largamente rastreros, carnosos y más bien delgados, aunque en D. alata, D.mazeana, D. moritziana y D. ulei pueden formarse rizomas gruesos, duros y casi leñosos.
El rizoma carece de tejidos internos esclerosados. Presenta una epidermis cutinizada y engrosada; una corteza diferenciada en dos zonas: una externa, formada por colénquima, una interna, formada por parénquima, más laxa y con espacios intercelulares grandes y un área central mucho más laxa que contiene la estela (Fig. 1 C, E y F). La corteza en general está atravesada por numerosos conductos de mucílago, presenta células taníferas aisladas o en pequeños grupos y contiene abundante almidón (Rolleri et al., 2001c-d).
La estela es una dictiostela policíclica (Ogura, 1972), con meristelas dispuestas en 3 ó más ciclos. Si bien la estela de Danaea parece ser la más simple de Marattiaceae, es compleja en sección transversal, porque está atravesada casi horizontalmente por las trazas de las raíces que se originan en el ciclo interno y por los frecuentes haces comisurales de posición central que se extienden entre los ciclos de meristelas, llamados también "conexiones comisurales" por Bower (1926) o "haces vasculares de conexión", por Chang (1975). Se origina por fragmentación de una protostela y el proceso progresa hasta que se forma una dictiostela bicíclica con grandes lagunas parenquimáticas. Los haces comisurales están dispersos y es frecuente la presencia de uno (o más) de ellos en el centro de la estela, con forma de C. Los rizomas más gruesos de Danaea presentan dictiostelas 3- cíclicas, con 2-3 meristelas centrales y 15-20 meristelas en un ciclo externo, según el grosor del rizoma. Los rizomas largamente rastreros y delgados de D. carillensis (Fig. 1 D), D. crispa, D. humilis y D. wendlandii (Fig. 1 A) tienen 8-10 meristelas en el ciclo externo, mientras que los rizomas más gruesos de D. alata, D. elliptica, D. moritziana y D. nodosa tienen 15 ó más meristelas en el ciclo externo. El número de meristelas del ciclo interno puede variar, pero es común hallar 3- 4 meristelas centrales de distintos tamaños (Fig. 1 C-E).
El almidón de reserva es muy abundante en los rizomas. Está formado por granos lenticulares, ovoides, cilíndricos, claviformes, con forma de bala o de bumerán, con hilio casi concéntrico en los lenticulares y excéntrico en los otros tipos, sin estrías visibles. Los granos lenticulares y los granos con forma de bumerán son planos o casi planos, un tipo hasta ahora registrado solamente para Marattia laevis Sm. (Lavalle, 2002) y para el género Christensenia (Rolleri et al., 2001c), no así los otros tipos mencionados, más frecuentes en la familia, que nunca son aplanados. Los contornos son circulares o casi circulares (D. crispa, D. humilis, D. imbricata y D. oblanceolata), elípticos (D. moritziana, D. nodosa), elípticos muy angostos (D. trichomanoides) o bien triangulares (D. ulei). El conjunto del tamaño, contorno y forma parece ser un rasgo específico como en otros géneros de Marattiaceae (Rolleri et al., 2001c). Es un carácter útil y de fácil acceso, aunque representa un inconveniente el hecho de que el herborizado suele ser incompleto y los rizomas faltan en la mayoría de las colecciones.
El sistema secretor de mucílago alcanza su desarrollo máximo en el rizoma, y se encuentran numerosos canales atravesando toda la corteza y próximos a los tejidos conductores. Producen un mucílago amarillento o transparente que se torna rojizo, colorado o púrpura en las partes más expuestas, posiblemente debido a oxidación o a cambios en alguno de los componentes. Hay células con taninos dispersas por los tejidos parenquimáticos, aunque parecen ser más abundantes en la zona cortical más externa.
Las raíces nacen continuamente en el ápice del rizoma. Se originan en el periciclo de las meristelas más internas y atraviesan la corteza durante su desarrollo (Fig. 1 C-E). La posición dorsiventral de la raíces se mantiene aún en rizomas erguidos, de los cuales nacen manojos abaxiales y laterales de raíces cordeliformes gruesas, lo que podría sugerir que el hábito completamente erguido es una condición adquirida en Danaea. Tienen epidermis gruesa y papilosa, corteza dividida en dos zonas: una externa, subepidérmica, con colénquima en 3-6 capas y una interna más laxa, parenquimática. En las raíces de posición aérea hay una o más capas de células con paredes engrosadas y contorno hexagonal en sección transversal, como una exodermis. La zona colenquimática puede variar en espesor y tiene hasta 10 -12 capas en las raíces subaéreas más gruesas. Una endodermis delgada y poco obvia (Fig. 1 F) separa la corteza de la estela, que consiste de una actinostela poliarca con 12-15 (18- 20) terminales protoxilemáticas. El metaxilema se esclerosa en las raíces más viejas o gruesas, donde posiblemente tiene función mecánica más que conductora. Hill & Camus (1986) sugieren que en la médula de las raíces se forma esclerénquima, y consideran su presencia como un rasgo avanzado en Danaea. La condición actinostélica (protostélica) de las raíces indicaría, más bien, que el esclerosamiento se produce en el metaxilema y posiblemente esté vinculado con el hábito subaéreo adquirido por las raíces en rizomas suberectos o erectos.
La posición del rizoma es variable en Marattiaceae: en Angiopteris y Marattia los rizomas son erectos y gruesos y no se encuentran rizomas postrados. En Christensenia los rizomas son postrados y este hábito tambien es predominante en Archangiopteris, con rizomas erguidos registrados sólo en A. itoi W. C. Shieh (Mengascini & Rolleri, 2001; Mengascini, 2002). En Danaea se encuentran los dos tipos y la posición erecta del rizoma aparece tanto en especies con esporófitos grandes, como D. elliptica, D. moritziana y D. nodosa como en otras con esporófitos de menor tamaño, como D. humilis. En D. moritziana y D. nodosa predomina igualmente el tipo de rizoma postrado, pero ciertos ejemplares de ambas especies desarrollan rizomas erectos, una condición que parece generalizada en D. elliptica. Las formas con rizomas erectos coinciden en otros caracteres del esporófito con las que presentan rizomas postrado y por eso no se ha considerado la dirección de crecimiento del rizoma como un rasgo específico. Como en el caso del almidón, su utilidad en las claves se ve restringido por la herborización incompleta, ya que falta el rizoma en la mayoría de los ejemplares de herbario, los cuales suelen consistir predominantemente de frondas o partes de ellas.
Estípulas (Fig. 1)
Las estípulas son estructuras exógenas, persistentes, que nacen pareadas del rizoma cubriendo la base de los estípites, en todos los géneros de Marattiaceae (Rolleri et al., 2001a, 2003). Son es tructuras prolíferas y permiten la propagación vegetativa de las plantas, una condición utilizada en invernaderos y criaderos para producir clones con destino ornamental (Jones, 1997). En Danaea, además, las estípulas pueden desarrollar yemas en condiciones experimentales (Sharpe & Jernstedt, 1991). En Angiopteris y Marattia las estípulas son grandes, mientras que son más pequeñas y con la porción distal tempranamente papirácea en Archangiopteris, Christensenia y Danaea. Siempre están profusamente recorridas por numerosos pasajes secretores de mucílago de longitud variable. Bierhorst (1971) consideró las estípulas como parte de la base de la fronda. Hill & Camus (1986) las interpretaron como una especie de trofopodio, es decir, una porción basal ensanchada del estípite que serviría como órgano de almacenamiento y las describieron como vascularizadas para todos los géneros.
Las estípulas permanecen carnosas durante mucho tiempo y además de ser órganos prolíferos, son almacenadoras de almidón. Tienen los mismos tejidos que el rizoma: epidermis uniestratificada cutinizada y a veces papilosa, una corteza externa colenquimática de poco espesor (2-3 capas celulares) y una corteza interna parenquimática que acumula almidón abundante (Rolleri et al., 2001c). En Danaea carecen de vascularización en la mayor parte del cuerpo y su conexión con la estela del rizoma podría ser profunda, aunque en origen es difícil distinguirla de la estela de los estípites, a diferencia de las estípulas de Marattia cuya vascularización se extiende claramente hasta las porciones distales papiráceas (Lavalle, 2002).
Estípites (Fig. 2)

Fig. 2.- Secciones transversales de estípites en Danaea. A: D. wendlandi. B: D. crispa (similar en D. simplicifolia). C: D. carillensis. D: D. humilis. E: D. oblanceolata. F: D. alata. G: D. elliptica (similar en D. nodosa ). H: D. moritziana. Abreviaturas: a, ala; c, corteza externa; ci, corteza interna; co, colénquima; ep, epidermis; m, meristela; mu, canal de mucílago.
Cada rizoma lleva varios estípites, distanciados o próximos. Son convexos o tienen surcos suaves en el lado adaxial y surcos profundos en el abaxial. Los estípites de D. alata y D. jenmanii son adaxialmente convexos y tienen 3 surcos abaxiales (Fig. 2 F); los de D. carillensis (Fig. 2 C), D. humilis (Fig. 2 D) y D. oblanceolata (Fig. 2 E) son adaxialmente curvos o canaliculados y profundamente canaliculados en el lado abaxial; los de D. crispa (Fig. 2 B), D. wendlandii (Fig. 2 A) y D. simplicifolia (Fig. 2 B) son convexos o apenas canaliculados en el lado adaxial, tienen dos surcos laterales marcados y son abaxialmente carenados. Los estípites de D. elliptica (Fig. 2 G), D. mazeana, D. moritziana (Fig. 2 H), D. nodosa y D. ulei son profundamente canaliculados, con 2 surcos laterales, 2 adaxiales y 3 o más abaxiales. Además de surcos, en los estípites de D. crispa y de D. simplicifolia (Fig. 2 B) se encuentran estrías y papilas.
Los estípites tienen los mismos tejidos que el rizoma: una epidermis subpapilosa o papilosa, gruesa y cutinizada, una corteza diferenciada en una zona subepidérmica de 5-10 capas de espesor formada por colénquima y una zona interna de mayor grosor constituida por parénquima laxo, con espacios intercelulares grandes, cuyas células almacenan almidón. El almidón es más abundante en los estípites carnosos, jóvenes o adultos, de casi todas las especies, pero es muy escaso en los estípites adultos de D. elliptica, D. nodosa, D. simplicifolia y D. ulei .
El sistema secretor de mucílago, característico de todos los géneros de Marattiaceae, está muy diversificado en los estípites, con los pasajes de mayor diámetro en posición central, y numerosos pasajes de diámetro menor situados cerca de las meristelas.
En la porción distal del estípite, cerca del raquis, se encuentra una delgada zona de esclerénquima (en lugar de colénquima, como en los rizomas), que se continúa en las costas y se interrumpe sólo en los pulvínulos. El esclerénquima es raro en Marattiaceae y en todos los géneros tiene una localización similar: es subepidérmico y se encuentra en la porción distal del estípite, en raquis y costas (Rolleri et al., 2001a, 2003; Rolleri, 2002; Lavalle, 2002).
En la base del estípite se encuentran una o más meristelas. La meristela en forma de C que sale del rizoma se divide rápidamente en varias más pequeñas y separadas. La estela formada tiene 8-12 meristelas distribuidas en forma circular o elíptica, aunque es común la presencia de una meristela de posición medular, lo que sugiere que las comisuras vasculares se encuentran también en los estípites.
Los pulvínulos del estípite son llamados con frecuencia "nudos", aunque en la mayoría de los casos no llevan pinnas. En ellos, los tejidos parenquimáticos son más compactos, con espacios intercelulares muy pequeños y el colénquima desarrolla más capas que en las áreas entre nudos. Las meristelas están fragmentadas en unidades más pequeñas y frecuentemente se distribuyen en círculo y no dorsiventralmente. Los pulvínulos han sido interpretados como una adaptación a la abscisión de las frondas en estaciones secas (Hayata, 1928; Holttum, 1978), o como zonas relacionadas con el movimiento de orientación lumínica de las láminas (Chang, 1975; Rolleri, 2001; Rolleri et al., 2003). La anatomía interna suculenta de los mismos es sugerente al respecto y en estípites o costas con esclerénquima, éste se interrumpe en los pulvínulos, lo que apoya la idea de una adaptación en relación con el movimiento.
Todos los géneros de Marattiaceae, sin excepción, presentan pulvínulos o zonas pulvinadas, ya sea en la base del estípite, a lo largo del mismo o en la base de las costas. Danaea es el género que tiene más pulvínulos en los estípites (hasta 3-4), aunque pueden faltar o ser menos obvios en los estípites suculentos de especies con pequeños esporófitos umbrófilos. El número de pulvínulos no es un carácter diagnóstico específico seguro: hay 1-2 en D. imbricata, D. elliptica, D. oblanceolata (en esta especie hay estípites con y sin pulvínulos en la misma planta), D. plicata, D. simplicifolia y D. wendlandii; 1-3 en D. alata, D. carillensis, D. jenmanii, D. mazeana, D. moritziana (en esta especie ocasionalmente hay 4) y D. tenera; y generalmente 2-3 en D. crispa y D. humilis. Faltan en D. nodosa, D. trichomanoides y D. ulei, aunque en juveniles de D. nodosa a veces se presenta un pulvínulo poco conspicuo que desaparecería con el desarrollo ulterior. Archangiopteris y Christensenia presentan al menos 1 pulvínulo en el estípite, mientras que las plantas adultas de Angiopteris y Marattia tienen pulvínulos en la base de los estípites pero no a lo largo de ellos, aunque sí se han observado en plantas juveniles de algunas especies de Angiopteris (Rolleri, 2002). En Angiopteris y Marattia, la base ensanchada del estípite también funciona como un pulvínulo y facilita la inclinación de las frondas, que se curvan tocando distalmente el sustrato; en Angiopteris tienen pulvínulos tanto las plantas con frondas persistentes como las caducifrondas, de manera que las funciones de abscisión y movimiento no son excluyentes. Las áreas pulvinadas basales del estípite en ambos géneros son marcadamente amiláceas y se utilizan como fuente de almidón comestible en el paleotrópico. En Archangiopteris, Christensenia y Danaea las bases de los estípites no son tan suculentas y tal vez carezcan de la capacidad de movimiento descrito, pero en ellas sí tiene lugar el proceso de abscisión de frondas viejas o secas.
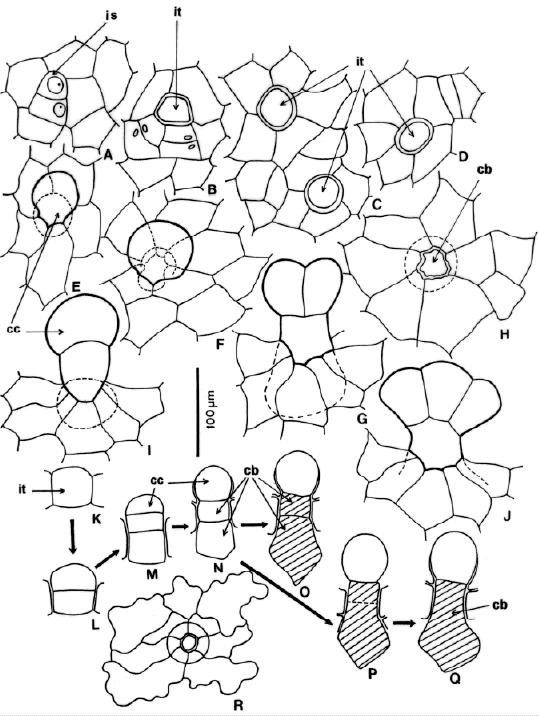
Fig. 3.- Desarrollo del indumento en Danaea. A: área con iniciales estomáticas. B-D: área con iniciales de tricomas. E-J: tricomas jóvenes en desarrollo. H: célula basal y marca de un tricoma caduco en epidermis juvenil. K-Q: desarrollo de un tricoma en corte tranversal de la lámina: K: inicial del tricoma, L-O: divisiones subsiguientes en el tricoma, P: lisis de la pared común en la base 2-celular de un tricoma, Q: tricoma con una sola célula basal. R: célula basal y marca de un tricoma caduco en epidermis adulta. Abreviaturas: cb, célula basal; cc, primera célula del cuerpo, capitada, de un tricoma joven; is, inicial estomática; it, inicial un tricoma.

Fig. 4.- Tricomas en Danaea. A: tricomas 3-celulares en D. carillensis, D. crispa, D. humilis y D. alata. B: tricomas 4-celulares en D. humilis. C: tricomas 5-celulares en D. tenera (similares en D. alata; D. crispa, D. elliptica; D. simplicifolia y D. oblanceolata). D-F: tricomas 4-5- celulares en D. moritziana (similares en D. jenmanii y D. mazeana). G-I: tricomas 5-celulares en D. humilis. J-K: tricomas 6-8-celulares en D. elliptica. L-O: tricomas pluricelulares en D. elliptica. P: tricomas próximos a los sinangios en D. alata (similares en las demás especies).

Fig. 5.- Protoscamas campanuladas en Danaea. A-E: D. crispa. F-H: D. tenera (similares en D. trichomanoides). IO: D. wendlandii. Las líneas de guiones y células grises representan el área mucilaginífera persistente.

Fig. 6.- Protoscamas campanuladas y laminares en Danaea. A-E: Protoscamas campanuladas medianas a grandes en D. alata (similares en D. jenmanii y D. oblanceolata). F-K: Protoscamas en D. moritziana (similares en D. mazeana). L-O: Protoscamas en D. carillensis. Las líneas de guiones y células grises representan el área mucilaginífera persistente; en negro se indica la pared engrosada de la célula basal secretora; en G y H, se indican las células mucilaginíferas marginales.

Fig. 7.- Protoscamas campanuladas y laminares en Danaea. A-F: protoscamas campanuladas a laminares en D. humilis. G-N: protoscamas laminares en D. simplicifolia. O-T: protoscamas laminares irregulares a estrelladas en D. nodosa (similares en D. ulei). U-Z: protoscamas estrelladas a fimbriadas en D. elliptica. Las líneas de guiones y las células grises señalan el área mucilaginífera persistente; en negro se indica la pared engrosada de la célula basal secretora; en G-M y U-Y se indican células mucilaginíferas marginales.
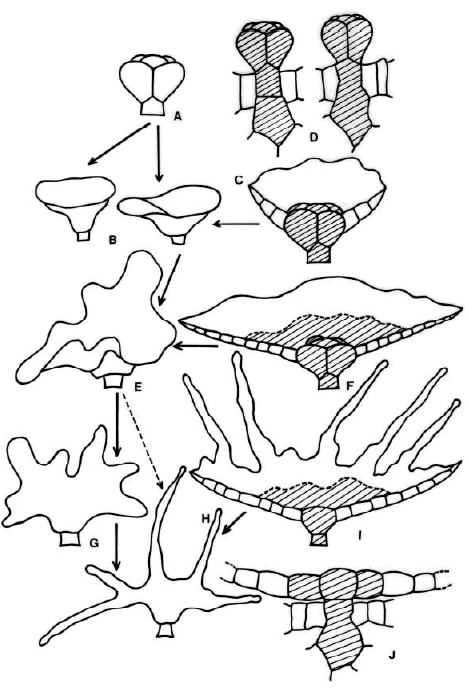
Fig. 8.- Representación esquemática de las relaciones sugeridas entre los tipos de indumento en Danaea. A: tipo más simple de tricoma glandular de todas las especies de Danaea. B-I: tipos más simples a más elaborados de protoscamas laminares, con área central glandular masiva o aplanada. B-C: pequeñas protoscamas campanuladas típicas de D. crispa, D. tenera, D. trichomanoides y D. wendlandii. E-F: protoscamas aplanadas típicas de D. alata, D. jenmanii, D. mazeana, D. nodosa y D. ulei. G-I: protoscamas estrelladas, lobuladas y fimbriadas típicas de D. elliptica y D. simplicifolia. D, J: células basales mucilaginíferas de tricomas y protoscamas. Los tricomas intermedios entre los más simples y las protoscamas campanuladas pequeñas no se han ilustrado. En rayado, células mucilaginíferas persistentes.
Los estípites, raquis y láminas de Danaea tienen indumento. La densidad del mismo varía, pero las plantas nunca son glabras. Aunque el indumento se percibe a simple vista, se requiere aumento para apreciar su variación. Se encuentran dos tipos morfológicos básicos: tricomas y protoscamas, así como formas intermedias entre ambos (Fig. 4 LM). Tanto tricomas como protoscamas son estructuras cortamente pediceladas con 1-2 células basales secretoras de mucílago que se insertan profundamente en la epidermis.
En las frondas en despliegue o tenuerales se encuentran todas las etapas de desarrollo del indumento, desde las células protodérmicas iniciales hasta los tipos adultos de tricomas y protoscamas y en ellas se observa muy bien la variedad que presenta el género. La mayoría de estas fases de desarrollo del indumento persisten en plantas adultas y se conservan en material herborizado. Las bases de los tricomas y protoscamas permanecen insertas en la epidermis aún en el caso de tricomas caedizos y son visibles con poco aumento (Figs. 3 R, 12 F).

Fig. 9.- Patrones de venación en Danaea. A: D. alata. B: D. trichomanoides. C: D. oblanceolata. D: D. carillensis. E: D. humilis. F: D. tenera. G: D. plicata. H: D. nodosa. I: D. moritziana. J: D. imbricata. K: D. elliptica (similar en D. simplicifolia y D. ulei). L: D. crispa y D. wendlandii.
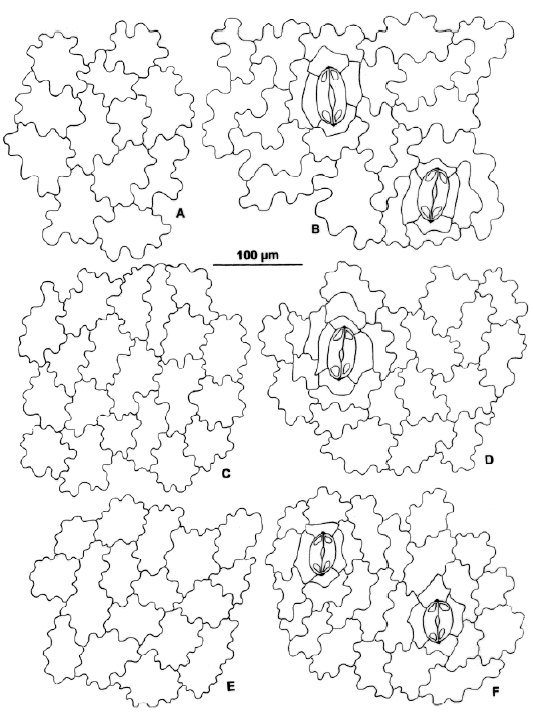
Fig. 10.- Modelos epidérmicos en especies de Danaea. A-B: D. trichomanoides. C-D: D. carillensis. E-F: D. plicata. Izquierda, epifilos; derecha, hipofilos.

Fig. 11.- Modelos epidérmicos en especies de Danaea. A-B: D. nodosa. C-D: D. ulei. E-F: D. elliptica.; G-H: D. simplicifolia. Izquierda, epifilos; derecha, hipofilos.

Fig. 12.- Modelos epidérmicos en especies de Danaea. A-B: D. moritziana. C-D: D. jenmani. E-F: D. mazeana. GH: D. alata. Izquierda, epifilos, derecha, hipofilos; gris, bases de tricomas.

Fig. 13.- Modelos epidérmicos en especies de Danaea. A-B: D. humilis. C-D: D. oblanceolata. E-F: D. imbricata. Izquierda, epifilos; derecha, hipofilos.

Fig. 14.- Modelos epidérmicos en especies de Danaea. A-B: D. wendlandi. C-D: D. tenera. E-F: D. crispa. Izquierda, epifilos; derecha, hipofilos.

Fig. 15.- Estomas adultos en especies de Danaea. A: D. carillensis. B: D. humilis. C: D. moritziana. D: D. oblanceolata (también D. trichomanoides y D. wendlandi). E: D. alata. F: D. elliptica y D. simplicifolia. G: D. mazeana. Abreviaturas: ap, área polar deprimida; al, área lateral deprimida; co, célula oclusiva; est, estría del poro; p, poro; po, pared epidérmica de la oclusiva; pt, pieza polar "en T".

Fig. 16.- Ontogenia de los estomas en especies de Danaea. A-C: áreas meristemáticas con divisiones recientes en las células protodérmicas, iniciales estomáticas y anexas mesógenas. D-F: áreas juveniles con células anexas en desarrollo e iniciales estomáticas que dan origen a células madres de oclusivas. G: células madres de oclusivas producidas por división de iniciales estomáticas y divisiones recientes en células anexas laterales. H-M, estoma juvenil y divisiones recientes en células periestomáticas. I y M: estomas tetracíticos y estaurocíticos formados en la misma área epidérmica. N-Q: síntesis del desarrollo que origina un estoma ciclocítico mesoperígeno de Danaea. Abreviaturas: al, anexa lateral; ap, anexa polar; ca, célula anexa; cmo, célula madre de las oclusivas; co, célula oclusiva; me, inicial del estoma; pr, célula protodérmica.

Fig. 17.- Protuberancias intercelulares pécticas de las células del mesofilo de especies de Danaea. A-C: D. elliptica. D-G: D. simplicifolia. H-J: D. nodosa (similar en D. ulei). Escala: 50 µm en A-B, D-F; 0,5 µm en C, G y J.

Fig. 18.- Protuberancias intercelulares pécticas de las células del mesofilo en especies de Danaea. A-F: D. alata. GL: D. moritziana. Escala: 50 µm en A, D, G, J; 0,5 µm en B-C, E-F, H-I, K-L.

Fig. 19.- Protuberancias intercelulares pécticas de las células del mesofilo en especies de Danaea. A-C: D. carillensis. D-F: D. humilis. G-I: D. trichomanoides. J-L: D. wendlandi. Escala: 50 µm en A, D, G, J; 0,5 µm en B-C, E-F, H-I, K-L.

Fig. 20.- Protuberancias intercelulares pécticas de las células del mesofilo en especies de Danaea A-C: D. oblanceolata. D-F: D. jenmani. G-I: D. plicata. K-M: D. mazeana. N-P: D. imbricata. Escala: 50 µm en A, D, G, J-K, N; 0,5 µm en B-C, E-F, H-I, L-M, O-P.

Fig. 21.- Esporas de Danaea. A-C: D. alata de Martinica, Stehlé 5857 (US). D-F: D. humilis de Colombia, Haught 1890 (US). G-I: D. oblanceolata de Colombia, Lellinger & de la Sota 577 (LP). J-L: D. imbricata de Ecuador, Baker et al. 5619 (NY). Escala: 10 µm en A-B, D-E, G-H, J-K; 3 µm en C, F, I, L.

Fig. 22.-Esporas de Danaea mazeana y D. moritziana. A-C: D. moritziana de Guatemala, von Tuerkheim 998 US). DF: D. moritziana de Colombia, van der Werff & van Hardelveld 6757 (US). G-I: D. moritziana de México, Mickel 962 (US). J-L: D. moritziana de Panamá, Lellinger 1970 (US). M-O: D. mazeana de Guadalupe, Dusén 4317-19 (US). Escala: 10 µm en A, B, D, E, G, H, J, K, M, N; 3 µm en C, F, I, L, O.

Fig. 23. Esporas de Danaea elliptica. A-C: D. elliptica de Peru, Allard 23885 (US). D-F: de Grenada, Murray & Elliot 8 (US). G-I: de Guayana Francesa, Leprieur 254 (US). J-L: de Cuba, Wright 1816 (US). M-O: de Jamaica, Maxon 2926a (US). Escala: 10 µm en A-B, D-E, G-H, J-K, M; 3 µm en C, F, I, L, N-O.

Fig. 24.- Esporas de Danaea elliptica y D. simplicifolia. A-F: D. elliptica de Trinidad, Hombersley 348 (US). G-O: D.simplicifolia. G-L: D.simplicifolia de Guayana Francesa, Cremers et al. 10128 (US). M-O: D. simplicifolia de Trinidad, Fendler 28 (US). Escala: 10 µm en A-I, M-N; 3 µm en J-L y O.

Fig. 25.- Esporas de Danaea. A-C: D. plicata de Costa Rica, Gómez et al. 22927 (US). D-F: D. crispa de Costa Rica, Herrera 1240 (US). G-J: D. carillensis de Costa Rica, Herrera 1239 (US). K-M: D. trichomanoides de Ecuador, Neill & Palacios 9629 (MO). N-P: D. wendlandi de Costa Rica, Herrera 1260 (US). Escala: 10 µm en A-B, D-E, G-H, KL, N-O; 3 µm en C, F, I-J, M, P.

Fig. 26.- Esporas de Danaea nodosa y D. ulei. A-C: D. nodosa de Paraguay, Rojas 10289 (UC). D-F: D. nodosa de Brasil, Brade 10370 (R). G-I: D. nodosa de Colombia, Hutchinson & Idrobo 3076 (US). H-L: D. nodosa de Colombia, Smith 992 (US). M-P: D. ulei de Trinidad, Fendler 129 (US). Escala: 10 µm en A-B, D-E, G-H, J-K, N; 22 µm en M; 3 µm en C, F, I, L, O, P.
Ontogenia (Fig. 3). Algunas células protodérmicas se dividen para formar iniciales de tricomas que se distribuyen más o menos regularmente entre las células epidérmicas en diferenciación (Fig. 3 BD). Difieren de las iniciales de estomas (Fig. 3 A) porque son más bien globosas y sobresalientes (Fig. 3 B-D) y presentan con frecuencia un citoplasma muy brillante y granular, posiblemente debido a sus funciones glandulares.
Las iniciales de los tricomas se dividen en forma paralela al plano de la epidermis y dan origen a dos células superpuestas (Fig. 3 K-L) que contienen citoplasma denso con abundantes gránulos de color amarillo claro o casi ámbar. La célula más externa del par formado se divide nuevamente en el mismo plano. El tricoma joven está formado ahora por 3 células mucilaginíferas: una célula distal globosa, una intermedia y una basal, ambas cilíndricas y cortas y más o menos hundidas en la epidermis (Fig. 3 M-N). Durante las etapas juveniles de tricomas y protoscamas, las células intermedia y basal pueden unirse en una sola por lisis de la pared común (Fig. 3 O-Q). La célula distal globosa se divide pronto y da origen a las formas paucicelulares, más simples, de tricomas superficiales, muy comunes en la lámina de todas las especies (Fig. 3 E-G, J). Con excepción de las células intermedia y basal, todas las células del cuerpo del tricoma parecen tener capacidad para dividirse.
Tricomas (Fig. 4). Los tricomas representan el tipo más simple de indumento en Danaea y no desarrollan cuerpos aplanados como las protoscamas. En general están formados por un cuerpo globoso o estrellado, con 3-10 (12) células de paredes muy delgadas. Los más pequeños tienen un cuerpo 3-celular (Fig. 4 A) y son muy comunes y abundantes en pinnas tenuerales. La mayoría crece rápidamente hasta alcanzar 4-5 células (Fig. 4 B-I) y representa el indumento más típico de las láminas de las especies de Danaea. Los tricomas más grandes pueden alcanzar unas 7-8 (10) células, ocasionalmente más (Fig. 4 J - K), pueden ser asimétricos, muy ramificados y representan formas transicionales entre los tricomas estrellados más típicos (Fig. 4 L - O) y las protoscamas más simples que predominan sobre los ejes de la mayoría de las especies de Danaea y que son infrecuentes como indumento de las láminas.
Todas las células de los tricomas son mucilaginíferas y actúan como glándulas durante el desarrollo de los mismos, pero en los tricomas más grandes la función de secreción parece restringirse a una zona central, cercana a la inserción, de un tamaño variable (unas pocas células). Cuando el tricoma cae, la célula basal persiste en la epidermis y se puede distinguir como una célula de contorno casi circular, brillante, algo hundida por debajo de varias células epidérmicas localmente separadas (Fig. 12 F). Estas glándulas residuales son particularmente abundantes en la epidermis de D. alata, D. jenmanii, D. mazeana y D. moritziana.
Protoscamas (Figs. 5-7). Las protoscamas, a diferencia de los tricomas, desarrollan una lámina, paucicelular a pluricelular. Las células de la zona de inserción son mucilaginíferas, mientras que las células del cuerpo o las marginales tienen paredes muy delgadas y pueden carecer de propiedades glandulares (o haberlas perdido en el curso del desarrollo).
El tricoma típico nunca desarrolla un cuerpo aplanado y la protoscama sí, aunque muchas protoscamas tienen un centro mucilaginífero no aplanado de tipo "tricomatoso". Esta distinción morfológica que se hace aquí es necesaria para la descripción del indumento, ya que hay muchas formas intermedias entre tricomas y protoscamas típicos y muchos tricomas estrellados grandes podrían ser tomados por protoscamas pequeñas.
En las láminas se pueden encontrar protoscamas pequeñas, con cuerpos planos aproximadamente estrellados o irregulares que irradian desde un centro glandular (Figs. 6 K, 7 F, N, T, Z), pero en general las formas planas predominan sobre venas secundarias, costas y otros ejes, donde los tricomas son más raros ya que se forman como una etapa de las protoscamas.
Desarrollo y relación entre los tipos de indumento (Fig. 8). Los tricomas glandulares se interpretan aquí como el tipo básico de indumento en Danaea y como el generador de otros tipos. Las protoscamas se desarrollan a partir de tricomas y éstos son, a la vez, un tipo de indumento superficial y una fase del indumento aplanado de los ejes. Todas las células del cuerpo de un tricoma glandular son capaces de dividirse, y así, los tricomas globosos (Fig. 8 A) serían el origen de escamas campanuladas (Fig. 8 B-C) y directamente o indirectamente, de protoscamas planas, con cuerpos enteros a ondulados (Fig. 8 E-F) o irregulares a fimbriados (Fig. 8 G-I). Las protoscamas más grandes tienen un centro plano, no globoso que permanece siempre mucilaginífero (Fig. 8 I), aunque tal vez cese toda la actividad glandular en protoscamas viejas. Tanto tricomas como protoscamas retienen el mismo tipo de base (Fig. 8 D, J), lo que también apoya la idea de que todas las formas se desarrollan a partir de un tipo básico y que la evolución morfológica hacia tricomas o hacia protoscamas es más bien un rasgo adaptativo del indumento glandular según se trate de láminas o de ejes. Mientras en las láminas es muy rara la presencia de protoscamas, en los ejes es posible encontrarlas mezcladas con tricomas, lo que confirmaría también la interpretación de los tricomas como fases de las protoscamas en los ejes.
Distribución de los tipos de indumento (Figs. 5- 7). El estudio de los tipos de indumento indica que se trata de un rasgo genérico, pero hay algunas diferencias entre las especies que pueden destacarse. En las láminas de D. alata, D. carillensis, D. crispa, D. humilis, D. imbricata, D. jenmanii, D. mazeana, D. moritziana, D. oblanceolata, D. plicata, D. tenera, D. trichomanoides y D. wendlandii se encuentra una mezcla de tricomas típicos con formas intermedias entre tricomas y pequeñas protoscamas, mientras que D. elliptica, D. nodosa, D. simplicifolia y D. ulei tienen tricomas, escasas formas intermedias y abundantes protoscamas estrelladas o irregulares, generalmente grandes.
Las protoscamas son campanuladas, con un cuerpo acampanado plano que irradia de un centro tricomatoso paucicelular, en D. crispa (Fig. 5 AE), D. oblanceolata (Fig. 5 F-H), D. tenera, D. imbricata y D. wendlandii (Fig. 5 J-O). Estas protoscamas pueden tener células mucilaginíferas marginales activas (Fig. 5 P) y siempre se presenta muy definida el área central mucilaginífera.
Las protoscamas son escuamiformes planas, con cuerpo paucicelular lanceado, estrellado o irregular que irradia de un centro mucilaginífero definido con células de paredes más bien engrosadas y también plano, con o sin células glandulares marginales, en D. carillensis (Fig. 6 L-O), D. humilis (Fig. 7 A-F), y D. plicata, y se mezclan con tipos campanulados en D. imbricata.
Las protoscamas son irregularmente campanuladas o estrelladas, grandes, con un cuerpo aproximadamente radial y plano, un centro glandular activo paucicelular plano, siempre uniestratificado, y gran cantidad de células marginales mucilaginíferas, en D. alata (Fig. 6 A-E), D. jenmanii, D. mazeana y D. moritziana (Fig. y F-K).
Las protoscamas son estrelladas a irregulares, pluricelulares, grandes, con cuerpo fimbriado provisto de numerosos brazos uniseriados que culminan en una glándula unicelular, en D. elliptica (Fig. 7 U-Z), similares pero en general con márgenes irregulares no fimbriadas, en D. simplicifolia (Fig. 7 G-N), y con márgenes erosos irregulares, en D. nodosa (Fig. 7 O-T) y D. ulei.
Lámina
Las láminas son simples en 2 especies y 1- pinnadas en las restantes. Son completamente dimórficas en la mayoría de las especies, aunque a veces pueden ser parcialmente dimórficas o eventualmente casi monomórficas, aunque esta condición es poco común. Ocasionalmente se presentan láminas 2-pinnadas, aunque en estos casos las pínnulas son vestigiales o aflébicas y las láminas no tienen una arquitectura bipinnada típica. Los desvíos de la división o del dimorfismo típicos (láminas con aflebias o láminas fértiles no reducidas) solamente se hallaron en ejemplares de D. elliptica.
Contorno. Los contornos de las láminas varían de una especie a otra, pero son similares los de las pinnas estériles y fértiles. Las láminas simples son lanceoladas, con ápices agudos, bases cuneadas y márgenes enteros en D. carillensis (Fig. 34 D) y elípticas, con ápices acuminados, bases anchamente cuneadas y márgenes repandos a ondulados, a veces algo cartilaginosos, en D. simplicifolia (Fig. 28 L-M).
En las especies 1-pinnadas, las láminas son lanceoladas en D. trichomanoides (Fig. 33 D-F) y D. tenera (Fig. 32 H); lanceoladas anchas en D. crispa (Fig. 34 A); oblongas en D. humilis (Fig. 33 A-C), D. imbricata (Fig. 32 J) y D. wendlandii (Fig. 32 I); oblongas a oblanceoladas en D. mazeana (Fig. 29 F) y D. moritziana (Figs. 29 A-E y 31 K-R); oblongas a oblongo-elípticas en D. alata (Fig. 27 A), D. nodosa (Fig. 30 A-C y 31 AJ) y D. ulei (Fig. 32 A-G); lanceoladas, elípticas u oblanceoladas en D. jenmanii (Fig. 29 G-H); lanceadas anchas en D. plicata (Fig. 34 B) y finalmente, elípticas a elípticas anchas en D. elliptica (Fig. 28 A-B) y D. oblanceolata (Fig. 32 C).

Fig. 27.- Danaea alata. A-C: D. alata de Grenada, Sherring 223 (US). A: planta adulta; derecha, fronda estéril; izquierda, fronda fértil. B: pinna estéril. C: detalle de la venación. D-H: sucesión foliar en planta juvenil. I-J: D. alata de Dominica, Lellinger 482 (US). I: fronda adulta estéril. J: fronda adulta fértil.

Fig. 28.- Danaea elliptica y D. simplicifolia . A-K: D. elliptica. A-B: D. elliptica de Grenada, Murray & Elliot 8 (US). A: dos frondas estériles (sólo contorno) y una fértil (sombreada). B: dos frondas fértiles (negro lleno). C-I: D. elliptica de Surinam, Stahel & Gonggrijp 589 (U), sucesión foliar. K: plántula y venación en pinna juvenil. L-M: D. simplicifolia, de Trinidad, Cremers et al. 10128 (US). L: fronda estéril. M: dos frondas fértiles.

Fig. 29.- Danaea jenmanii, D. mazeana y D. moritziana. A-E: D. moritziana. A: D. moritziana de Guatemala, von Tuerkheim 998 (US), fronda estéril (izquierda) y fértil (derecha). B-C: venación de una pinna adulta y detalle del margen, respectivamente, en A. D: D. moritziana de Bolivia, Buchtien 3352 (US), planta juvenil. E: venación de una pinna juvenil en D. F: D. mazeana de Guadalupe, Dusén 4465 (US), fronda estéril (izquierda) y fértil (derecha). G-I: D. jenmanii, de Jamaica, Maxon & Killip 735 (US), tres frondas estériles. J: venación en G.

Fig. 30.- Danaea nodosa. A: D. nodosa de Colombia, Hutchison & Idrobo 3076 (US), dos frondas, estéril (derecha) y fértil (izquierda), y detalle de venación en pinna adulta. B: contorno de una fronda fértil. C: D. nodosa de Colombia, Lellinger & de la Sota 508 (US). D: sucesión foliar. E: D. nodosa de Jamaica, Maxon 9336 (US), plántula y venación de una pinna juvenil.

Fig. 31.- Pinnas de Danaea nodosa y D. moritziana. A-J: D. nodosa; K-R: D. moritziana.
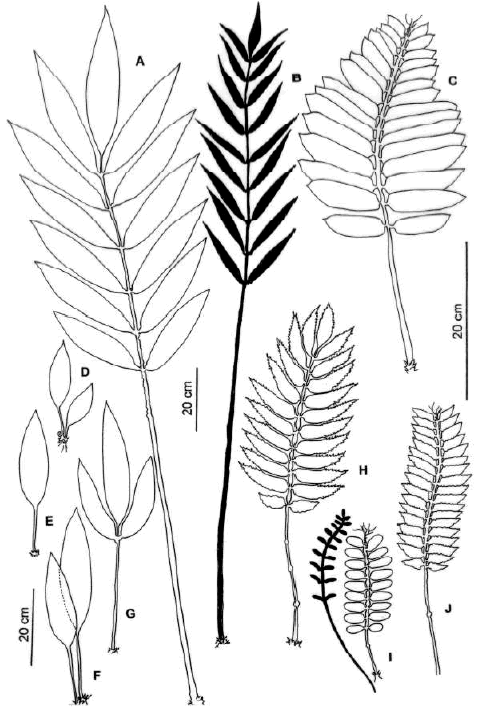
Fig. 32.- Frondas de Danaea. A-B: D. ulei de Trinidad, Fendler 129 (US). A: fronda adulta estéril. B: fronda fértil. DG: sucesión foliar en D. ulei. C: D. oblanceolata de Colombia, Lellinger & de la Sota 577 (LP), fronda estéril. H: D. tenera de Colombia, Haught 5392 (US), fronda estéril. I: D. wendlandii de Costa Rica, Herrera 1260 (US), frondas estéril (sólo contorno) y fértil (negro lleno). J: D. imbricata de Ecuador, Baker et al. 5619 (NY), fronda estéril.

Fig. 33.- Frondas de Danaea. A-C: D. humilis de Colombia, Haught 1890 (US). A: planta adulta. B: dos pinnas laterales. C: detalle de venación. D-F: D. trichomanoides de Ecuador, Neill & Palacios 9629 (MO). D: planta adulta. E: pinna lateral. F: detalle de venación.

Fig. 34.- Frondas de Danaea. A: D. crispa de Costa Rica, Brade & Brade 328 (US), dos frondas estériles (derecha) y una fértil (izquierda). B-C: D. plicata de Costa Rica, Gómez et al. 22927 (US). B: dos frondas estériles (derecha) y una fértil (izquierda). C: detalle de venación. D: D. carillensis de Costa Rica, Hammel et al. 16672 (US), una fronda fértil (derecha) y tres frondas estériles (sólo contorno).
Color. El color es generalmente uniforme en láminas adultas. Los hipofilos son siempre algo más claros que los epifilos, pero son concolores en la mayoría de las especies. Danaea alata tiene hipofilos amarillos, sulfúreos o blancuzcos; D. jenmanii tiene hipofilos glaucos, muy pálidos y D. moritziana puede presentar a veces láminas parcialmente variegadas o veteadas. Los hipofilos amarillos, blancuzcos o sulfúreos también aparecen en pinnas tenuerales o juveniles de D. elliptica y D. nodosa (en este caso algo iridiscentes). El color no es un rasgo de variación específica o infraespecífica constante y no se correlaciona con otros rasgos vegetativos excepto en D. nodosa, cuyas pinnas con hipofilos más claros tienen mayor proporción de venas simples, epidermis en fases juveniles de su desarrollo y estomas parcialmente inmaduros. Las variaciones de color no son exclusivas de Danaea entre las Marattiaceae, y también se han observado ejemplares variegados o con hipofilos muy claros en especies del género Angiopteris (Rolleri, 2002).
Textura y consistencia. Las láminas tienen textura y consistencia variables. Son membranáceas y translúcidas en D. crispa, D. tenera y D. trichomanoides; casi membranáceas y opacas en D. imbricata y D. wendlandii; delicadas, herbáceas o algo esponjosas y opacas en D. alata, D. carillensis, D. humilis y D. jenmanii; herbáceas y más bien brillantes en D. mazeana y D. moritziana; subcoriáceas a coriáceas en D.elliptica, D. nodosa, D. simplicifolia y D. ulei.
Pinnas. Las pinnas son cortamente pecioluladas sobre el raquis. Se insertan imbricadas en D. imbricata; próximas en D. humilis, D. oblanceolata y D. wendlandii; algo separadas en D. crispa, D. plicata, D. tenera y D. trichomanoides; distantes 4-7(-8)cm en D. alata, D. elliptica, D. jenmanii, D. mazeana, D. moritziana, D. nodosa y D. ulei. El número de pinnas laterales es variable: D. humilis tiene 25-28 pares; D. crispa, D. imbricata y D. oblanceolata tienen 15-18; D. tenera y D. trichomanoides tienen 12-15; D. alata, D. mazeana, D. moritziana y D. nodosa tienen 10-12(-18); D. wendlandii y D. jenmanii tienen 8-10 y finalmente, D. ulei presenta 5-7(-10) pares de pinnas.
En D. alata (Fig. 27 A) y D. tenera (Fig. 32 H) las pinnas son más o menos oblongas, con bases asimétricas subcordadas y ápices agudos o atenuados en un mucrón plano, aserrado e incurvado; en D. humilis (Fig. 33 A-B) son oblongo-falcadas, de lados paralelos, con bases redondeadas y ápices incurvados serrulados; en D. oblanceolata (Fig. 32 C) son oblanceoladas a subespatuladas, con bases más o menos redondeadas y ápices obtusos mucronulados y en D. wendlandii (Fig. 32 I) son lanceoladas, subfalcadas, con bases casi cordadas y ápices obtuso-redondeados y ondulados. Finalmente, las pinnas de D. imbricata (Fig. 32 J), D. crispa (Fig. 34 A), D. plicata (Fig. 34 B) y D. trichomanoides (Fig. 33 C) son más bien oblongas, subfalcadas, con bases redondeado-truncadas y ápices obtusos crespos, ondulados o repandos.
Danaea elliptica tiene pinnas elípticas anchas, con base cuneada y ápice acuminado a cuspidado (Fig. 28 A-K). Hay 5-7(-10) pares de pinnas en láminas adultas, pero las plantas juveniles tienen láminas simples, ternadas o con 2 pares de pinnas laterales y una pinna terminal grande, mientras que en plantas no adultas, de 50-70 cm de altura se pueden encontrar hasta 5 pares de pinnas (Fig. 28 C-J). En esta especie todas las fases de desarrollo producen frondas fértiles y esporas normales, de manera que existe un continuum de formas con un número diferente de pares de pinnas, todas precozmente fértiles. En algunos ejemplares de Brasil se observaron láminas fértiles con pinnas latifoliadas elípticas, no reducidas, sin otras diferencias morfológicas con las plantas que producen láminas fértiles contraídas. Ciertos rasgos vegetativos como el patrón de venación, la epidermis y el tipo de estoma se definen tempranamente, permitiendo reconocer todas estas fases.
Danaea moritziana presenta pinnas angostas, lanceoladas a oblongo-falcadas, más o menos asimétricas (Fig. 31 K-L, P-R) o, más raramente, elípticas u oblongas, poco asimétricas (Fig. 31 MO). En juveniles el contorno es elíptico, más bien asimétrico y moderadamente falcado (Fig. 31 K) y estas plantas son casi iguales a una juvenil de D. alata, excepto por la venación simple típica de esta última. Las pinnas tienen siempre bases redondeadas, marcadamente asimétricas y ápices atenuados, notoriamente incurvados, proyectados en una porción aserrada dirigida acroscópicamente, con dentículos curvos. En D. moritziana también hay fases de desarrollo, todas precozmente fértiles, pero el número de pares de pínnulas de cada fase es similar al adulto. El contorno lanceolado falcado, poco asimétrico (Fig. 31 R) también se presenta en D. mazeana, mientras que el elíptico, algo más ancho (Fig. 31 N) es característico de D. jenmanii.
Danaea nodosa tiene pinnas de contorno oblongo (Figs. 30 A, 31 A, F, H-I), oblanceoladas a subespatuladas (Fig. 31 B-C), más o menos elípticas (Fig. 31 E) o elíptico-oblanceoladas (Fig. 31 J). Las bases son siempre redondeado-cuneadas a cuneadas y los ápices redondeado-cuspidados, con un mucrón flexible o algo rígido, finamente serrulado, de longitud variable y raramente curvo (Fig. 31 A-J). Las pinnas pueden ser moderadamente angostas a más bien anchas. Los contornos elíptico-oblanceolados se presentan en las pinnas más latifoliadas de la especie, generalmente juveniles, y son los menos frecuentes (Fig. 31 J), mientras que los oblanceolados típicos (Fig. 31 D) son los que caracterizan a las formas adultas.
Los márgenes de las pinnas son enteros, algo repandos o más raramente, crespos. Son repandos, hialinos y hasta cartilaginosos, en D. elliptica, hialinos pero no cartilaginosos en D. mazeana, D. moritziana y D. nodosa; hialinos, algo cartilaginosos e irregulares en D. ulei; ondulados a subcrespos en plantas jóvenes o en desarrollo de D. oblanceolata y en plantas adultas de D. imbricata, D. plicata y D. trichomanoides, y crespos en D. crispa. En las restantes especies, y en las plantas adultas de D. oblanceolata, los márgenes son enteros. En plantas jóvenes de D. jenmanii se presentan márgenes más irregulares (a veces aserrados o serrulados) pero este rasgo es inconstante.
En Marattiaceae, el tipo de margen es un rasgo genérico: en Angiopteris los márgenes son crenados o aserrados y son raros los enteros (Rolleri, 2001); en Archangiopteris (Mengascini & Rolleri, 2001; Mengascini, 2002), Christensenia (Rolleri, 1993) y Danaea son enteros, repandos o más raramente, crespos y no hay crenados ni aserrados; mientras que en Marattia son aserrados o raramente, lobulados, en las especies neotropicales (Lavalle, 2002; 2003) y aserrados o aserrado-crenados, raramente enteros, en las paleotropicales (Rolleri et al., 2001 b).
Yemas. El ápice de la lámina puede ser una pinna o una yema. Las láminas son imparipinnadas, con una pinna terminal generalmente más larga y de mayor tamaño que las laterales o paripinnadas y terminadas en una yema prolífera. Ambas condiciones pueden presentarse en la misma planta. Hay especies que nunca desarrollan yemas, especies que nunca desarrollan pinnas terminales, especies que forman ambas indistintamente y finalmente, especies cuyas pinnas terminales juveniles se atrofian y son reemplazadas por yemas en la etapa adulta.
En D. alata, D. elliptica y D. ulei nunca se presentan yemas y éstas son extremadamente raras en D. moritziana y D. nodosa. Las láminas de estas especies tienen pinnas terminales bien desarrolladas, iguales o más grandes que las laterales (particularmente D.ulei, cuyas pinnas terminales pueden ser 2-3 veces más grandes que las laterales en adultos y hasta 4-5 veces más grandes en juveniles). En D. jenmanii y D. wendlandii las plantas juveniles pueden tener pinnas terminales o yemas, indistintamente, pero son muy raras las plantas adultas sin yemas y en D. jenmanii, además, se desarrollan yemas en reemplazo de alguna o de ambas pinnas del último par. En D. humilis y D. plicata hay láminas paripinnadas e imparipinnadas en la misma planta (aunque en la primera son más comunes las frondas imparipinnadas) y las pinnas terminales de D. plicata son 3-5 veces más largas que las laterales. En D. crispa, D. imbricata, D. oblanceolata, D. tenera y D. trichomanoides las láminas siempre son paripinnadas, con yemas terminales.
En las plantas con yemas de algunas especies se ha encontrado un porcentaje notablemente alto de esporas anómalas. Esto sucede en D. imbricata, D. moritziana y D. oblanceolata, con 40-50 % de esporas deformadas o vacías. En D. tenera y D. jenmanii predominan las plantas con frondas paripinnadas y la proporción de esporas anómalas alcanza el 90-100 %. En D. oblanceolata además, la proporción podría variar con la edad de la plantas, ya que los ejemplares más jóvenes (de acuerdo con los rasgos de la epidermis de las frondas) son precozmente fértiles y producen 70-80 % de esporas normales, mientras que la proporción de anómalas llega al 40-50 % en los adultos. En D. plicata se forman esporas anormales o colapsadas (70-80 %) y esporas gigantes (1-2 %) tanto en plantas con pinnas terminales como en plantas con yemas. Camus & Pérez García (1995) sugirieron que esta especie podría ser un híbrido entre D. carillensis y D. crispa, algo que no parece improbable a juzgar por los rasgos intermedios del esporófito. Aunque la correlación entre presencia de yemas terminales y esporas anómalas no es estricta, es posible suponer que la reproducción vegetativa mediante las yemas podría tener alguna relación con una disminución de la calidad de las esporas.
Las yemas pueden inducirse experimentalmente en las estípulas (Sharpe & Jernstedt, 1991). La aparición de yemas en el hábitat natural es una opción de reproducción vegetativa extendida en el género, pero tal vez haya factores ambientales, no investigados, que la estimulen en determinadas condiciones y en ciertas especies más que en otras. En D. moritziana las yemas son muy raras y se encontraron exclusivamente en plantas disminuidas, de menor tamaño o con pinnas contraídas, cuyas células epidérmicas tienen paredes algo más engrosadas que el común para la especie. Se pudo constatar que estas plantas fueron coleccionadas en localidades con residuos metálicos en el suelo (exceso de aluminio), pero la asociación podría ser casual y no se han encontrado referencias bibliográficas que vinculen el deterioro de los nutrientes en el suelo con la malformación de esporas o la producción de yemas.
La presencia de yemas no se vincula claramente con otros rasgos, excepto por el hecho de que las plantas con esporófitos más grandes no presentan yemas o sólo las desarrollan excepcionalmente. Las plantas con yemas o sin ellas, de una misma especie, no difieren entre sí más que por la presencia o ausencia de las mismas y las eventuales anomalías en las esporas. Sin embargo, las yemas puede resultar un carácter útil en la determinación de las especies, en combinación con otros. La capacidad de formar yemas prolíferas no es exclusiva de Danaea en Marattiaceae y también se ha observado en especies de Angiopteris (Rolleri, 2001; 2002).
Venación (Fig. 9)
Los patrones de venación de las especies de Danaea nunca han sido estudiados en conjunto. Underwood (1902) fue el único autor que usó la venación como un carácter diagnóstico específico, pero en su revisión del género hizo más énfasis en la distancia entre venas que en el patrón en sí y no estudió todas las especies.
Las venas son libres y se curvan ligeramente hacia el ápice en el margen. En algunos casos se tocan entre sí dando origen a una vena marginal o comisural que está ausente en las pinnas membranáceas o translúcidas de D. imbricata, D. plicata, D. tenera, D. trichomanoides y D. wendlandii. Las venas son simples, geminadas (pareadas en origen) o bifurcadas a distancias variables de la costa. Son horizontales y en ángulo recto con la costa u oblicuas, muy próximas o separadas. Pueden ser finas, rectas y del color de la lámina, o algo gruesas, onduladas o tortuosas y de color castaño-negruzco.
En Danaea hay varios patrones de venación y algunas especies pueden reconocerse casi exclusivamente por uno de ellos. Los tipos hallados son los siguientes:
Venas simples solamente, paralelas, no muy próximas, tortuosas y más oscuras que el tejido de la lámina (a veces casi negras), en D. alata (Figs. 9 A, 27 C).
Venas simples predominantes y ocasionales bifurcadas lejos de la costa, entre el margen y el área medial, más bien separadas, tortuosas y más oscuras que el tejido de la lámina (a veces casi negras), en D. trichomanoides (Figs. 9 B, 33 F).
Venas simples predominantes y ocasionales geminadas: algo distantes y oblicuas en D. oblanceolata (Fig. 9 C) y D. humilis (Figs. 9 E, 33 C) y muy próximas y en ángulo recto con la costa en D. carillensis (Fig. 9 D). En algunos ejemplares de D. humilis hay venas bifurcadas ocasionales en lugar de geminadas (Fig. 33 C).
Venas geminadas y simples, muy próximas, casi horizontales y paralelas, en plantas adultas (Figs. 9 H, 31 A) y juveniles (Fig. 31 E) de D. nodosa; más oblicuas y separadas en D. plicata (Figs. 9 F, 34 C) y D. tenera (Fig. 9 G).
Venas bifurcadas predominantes y simples escasas, separadas, tortuosas y oscuras, con bifurcaciones supramediales o intramarginales, en D. imbricata (Fig. 9 J); separadas, finas y apenas diferentes del color de la lámina en D. wendlandii (Fig. 9 L); más próximas, rectas, algo oscuras, con bifurcaciones cerca o muy cerca de la costa, en plantas adultas de D. moritziana (Figs. 9 I, 28 B) pero con algunas venas geminadas o bifurcadas lejos de la costa en juveniles (Fig. 28 E); más separadas y oblicuas, oscuras y algo tortuosas, bifurcadas a distancias muy irregulares de la costa y con mayor proporción de venas simples, en D. jenmanii y D. mazeana (Fig. 28 J).
Venas exclusivamente bifurcadas a distancias regulares de la costa (muy raro o ausente otro tipo, eventualmente esporádicas venas simples), separadas, gruesas y algo onduladas, oscuras, en D. crispa.
Venas simples, geminadas y bifurcadas regularmente cerca de la costa, algo separadas y divergentes, en plantas adultas y juveniles de D. elliptica (Figs. 9 K, 30 K), D. simplicifolia y D. ulei (en esta subespecie con patrón algo variable en la proporción de los tipos de venas).
La combinación del patrón de venación, la distancia entre venas, el color y delineado de las mismas y la textura de la lámina permiten reconocer las especies y ese conjunto de rasgos es diagnóstico en el nivel específico en plantas adultas, pero el patrón juvenil puede variar. Una excepción parecen ser las plántulas de D. alata y D. elliptica, cuyos patrones juveniles son iguales a los adultos, aunque las venas de estos últimos están más próximas entre sí. Las plantas en desarrollo de D. nodosa tienen más venas simples que las adultas, mientras que las plantas en desarrollo de D. moritziana pueden tener venas geminadas, generalmente ausentes en adultos. No se ha podido generalizar la determinación de las especies por medio de los patrones juveniles propuesta por Tuomisto & Groot (1995).
Modelos epidérmicos (Figs. 10-14)
En Danaea se encuentran modelos epidérmicos poligonales (formados por células de paredes rectas) y sinuosos, éstos últimos más frecuentes. Las sinuosidades pueden ser distantes (2-3 en la longitud total de la célula) o frecuentes (5-6 en la longitud total de la célula y las paredes uniformemente delgadas o localmente engrosadas en curvas o ángulos. Los modelos epidérmicos de las pinnas varían en el nivel específico. En los modelos sinuosos son diagnósticos el tipo de onda (amplitud y profundidad), la relación largo/ancho de las células (l/a) y la presencia o ausencia de engrosamientos localizados. La relación l/a es 1:1 en epifilos (células isodiamétricas), excepto en D. elliptica, D. simplicifolia y algunos ejemplares de D. moritziana. En esos epifilos y en los hipofilos en general, las células son más largas que anchas y la relación l/a va desde 2 (3):1 a 5-6:1 y las variaciones observadas son las siguientes:
Epifilos e hipofilos con modelo similar, poligonales o sinuosos
Epifilos e hipofilos con modelos poligonales, células de paredes rectas, relación l/a 1:1 en epifilos y 2-1:1 en hipofilos, en D. crispa (Fig. 14 E-F) y D. tenera (Fig. 14 C-D).
Epifilos e hipofilos con modelos sinuosos; sinuosidades frecuentes e irregulares en amplitud y profundidad, paredes muy delgadas y relación l/a 1:1, en D. trichomanoides (Fig. 10 A-B).
Epifilos e hipofilos con modelos sinuosos; sinuosidades muy frecuentes (6-7 o más en la longitud total de las células), regulares y someras, paredes muy delgadas y radio celular 1:1 en epifilos y 2:1 en hipofilos, en D. plicata (Fig. 10 EF) y D. carillensis (Fig. 10 C-D).
Epifilos e hipofilos con modelos sinuosos; sinuosidades muy frecuentes (6-7 o más en la longitud total de las células), algo irregulares y someras, células de paredes muy delgadas; relación l/a 1:1 en epifilos y hasta 6:1 en hipofilos, en D. nodosa (Fig. 11 A-B).
Epifilos e hipofilos con modelos sinuosos; sinuosidades distantes, amplias y profundas, curvas y angulosas, con engrosamientos locales en curvas y ángulos y relación l/a 2-1:1 en epifilos e hipofilos, en D. elliptica (Fig. 11 E-F) y con relación l/a 2-3:1 en epifilos y hasta 5-6:1 en hipofilos en D. simplicifolia (en esta especie, células más grandes, Fig. 11 G-H).
Epifilos e hipofilos con modelos diferentes, siempre sinuosos
Sinuosidades muy frecuentes (7-9 ó más en la longitud total de las células), muy someras y uniformes, y relación l/a 1:1en epifilos; sinuosidades distantes, amplias y profundas, curvas y angulosas, con engrosamientos localizados en curvas y ángulos y relación l/a 4-5:1 en hipofilos, en D. alata (Fig. 12 G-H).
Sinuosidades frecuentes, poco profundas pero no someras y algo irregulares, paredes delgadas y relación l/a 1:1 en epifilos; sinuosidades más distantes, curvas y profundas, relación l/a 4-5:1 en hipofilos, en D. jenmanii Fig. 12 C-D) y en D. moritziana (Fig. 12 A-B), en la primera con células hasta 2 veces más grandes.
Sinuosidades más bien frecuentes, poco profundas pero no someras, regulares o algo irregulares, paredes delgadas y relación l/a 2-1:1 en epifilos; sinuosidades más bien distantes, curvas o algo angulosas, con engrosamientos diferenciales leves en curvas o ángulos y relación l/a 4-5:1 en hipofilos, en D.mazeana (Fig. 12 E-F).
Sinuosidades frecuentes, poco profundas y algo irregulares, paredes muy delgadas, con engrosamientos localizados en las curvas y relación l/a 2-1:1 en epifilos, como en D. nodosa; sinuosidades como en hipofilos pero sin engrosamientos localizados y relación l/a hasta 6-7:1 en hipofilos, como en D. elliptica, en D. ulei (Fig. 11 C-D).
Sinuosidades someras pero uniformes, paredes celulares engrosadas uniformemente y relación l/a 1:1 en epifilos; sinuosidades angulosas, paredes muy delgadas, y radio celular 4-5:1 en hipofilos, en D. humilis (Fig. 13 A-B).
Sinuosidades extremadamente frecuentes, someras y uniformes, paredes celulares muy delgadas y relación l/a 1:1 en epifilos; sinuosidades angulosas poco profundas, paredes igualmente delgadas, y relación l/a 4-5:1 en hipofilos, en D. oblanceolata (Fig. 13 C-D).
Sinuosidades frecuentes, someras y uniformes, paredes celulares muy delgadas y relación l/a 1:1 en epifilos; sinuosidades angulosas con engrosamientos casi puntiformes en los ángulos, paredes muy delgadas y relación l/a 4-5:1 en hipofilos, en D. wendlandii (Fig. 14 A-B).
Sinuosidades muy frecuentes, someras y uniformes, paredes celulares muy delgadas y relación l/a 1:1 en epifilos; sinuosidades distantes, amplias, más bien profundas e irregulares, paredes delgadas y relación l/a 1-2:1 en hipofilos (como en D. trichomanoides), en D. imbricata (Fig. 13 E-F).
En algunas especies de Danaea la epidermis madura rápidamente y el modelo maduro se reconoce en las plántulas (D. alata, D. elliptica). En otras especies la epidermis madura progresivamente y el modelo maduro está presente en fases intermedias entre plántulas y plantas adultas de la especie (D. oblanceolata, D. nodosa). El conocimiento de los modelos maduros y sus etapas resulta útil en el caso de Danaea, un género en el que las fases de algunas especies podrían tomarse por especies diferentes. Las epidermis de D. carillensis (Fig. 10 C-D) y D. plicata (Fig. 12 E-F) son muy similares, D. plicata tiene paredes epidérmicas extremadamente delgadas. La epidermis de D. ulei (Fig. 11CD) parece intermedia entre la de D. nodosa y la de D.elliptica.
Los modelos poligonales y sinuosos son frecuentes en todos los géneros de Marattiaceae: los poligonales son comunes en especies de Angiopteris (Rolleri, 2001, 2002) y también aparecen en especies de Archangiopteris (Mengascini & Rolleri, 2001; Mengascini, 2002), Christensenia (Rolleri, 1993) y paleotropicales de Marattia (Rolleri et al., 2001a). También se encuentran como la etapa juvenil de los modelos sinuosos (Lavalle, 2002), que son más frecuentes en la familia que los poligonales (Rolleri et al., 2003). Las sinuosidades distantes, amplias y profundas, de pared uniforme son comunes en Angiopteris, Archangiopteris y Marattia, y las frecuentes, someras y poco amplias son típicas de Danaea y Christensenia y ocasionales en Marattia (especies paleotropicales, Rolleri et al., 2001a). Los modelos sinuosos presentan paredes uniformes o localmente engrosadas en especies de Archangiopteris (Mengascini & Rolleri, 2001; Mengascini, 2002), Christensenia (Rolleri, 1993), Danaea y paleotropicales de Marattia (Rolleri et al., 2001a-b), pero este tipo de espesamientos están ausentes en muchas especies de Angiopteris (Rolleri, 2001; 2002) y en las neotropicales de Marattia (Lavalle, 2002).
Estomas
Estomas adultos (Fig. 15, Tabla 1). Rolleri (1993) y Rolleri et al. (1994) llamaron porociclocítico al estoma de Christensenia, con células oclusivas semilunares y poros hiperdesarrollados. Posteriormente, Rolleri & Lavalle (1997) llamaron maratiáceo al estoma difundido en 4 de los cinco géneros de la familia, incluyendo Danaea. Los estomas maratiáceos tienen contorno elíptico u oblongo y las células oclusivas están sobrelevadas respecto de las epidérmicas adyacentes. La membrana cuticular pectinada de las paredes externas de las oclusivas se reduce o desaparece en los polos dando origen a áreas deprimidas en las que solamente se desarrolla pared celulósica (Rolleri & Lavalle, 1997). Las paredes epidérmicas y las de contacto de las oclusivas pueden estar engrosadas y la longitud de las paredes de contacto entre éstas es variable, dependiendo de la extensión del poro. En los polos del estoma se encuentran piezas cutinizadas en forma de cuña de "T" (Fig. 15). Tanto los estomas maratiáceos como los porociclocíticos tienen anexas dispuestas en 1 ó 2 ciclos, en disposiciones tetracíticas, estaurocíticas, actinocíticas o ciclocíticas típicas (Wilkinson, 1979; Rolleri et al., 1991) y son más bien infrecuentes los tipos anisocíticos, es decir, con células vecinas en lugar de anexas.
En Danaea hay estomas maratiáceos y porociclocíticos. Los estomas porociclocíticos se encuentran en D. alata y D. mazeana. Tienen contorno elíptico muy ancho a circular, un diámetro de casi 100 µm (pueden ser vistos con microscopio estereoscópico), poros de 35-65 µm, áreas polares deprimidas muy pequeñas o inexistentes, pared epidérmica de las oclusivas y piezas polares engrosadas. Se inician como estomas comunes con poros pequeños y como se han encontrado con diferentes grados de apertura, es posible suponer que se trata de estructuras normalmente funcionales en todos los casos. Las oclusivas están sobrelevadas respecto de la epidermis, pero no así el conjunto de anexas, como ocurre en los estomas de Christensenia (Rolleri, 1993; Rolleri et. al., 1994). En las restantes especies los estomas son de tipo maratiáceo, con poros externos elípticos e internos circulares, áreas polares deprimidas amplias, paredes epidérmicas de las oclusivas y piezas polares cutinizadas. Las células anexas se disponen en 1 ó 2 ciclos, en disposiciones tetracíticas, estaurocíticas, actinocíticas o ciclocíticas típicas. Como en otros géneros de Marattiaceae, son raras las disposiciones anisocíticas que predominan, en cambio, en los estomas porociclocíticos de D. alata.
En D. elliptica y D. simplicifolia los estomas tienen contorno oblongo y hay áreas deprimidas polares y laterales, mientras que en las demás especies las áreas deprimidas son solamente polares. En los estomas de D. carillensis, D. humilis, D. oblanceolata, D. trichomanoides y D. wendlandii no hay engrosamientos de pared epidérmica de las oclusivas pero sí pequeñas piezas polares en "T" o cuneiformes. En los estomas de D. imbricata y D. tenera faltan los engrosamientos de pared epidérmica y pueden estar ausentes también las pequeñas piezas polares cuneiformes: los estomas adultos de estas dos especies se parecen a los juveniles de otras porque no tiene paredes engrosadas ni se forman piezas polares; adicionalmente, están muy dispersos (no más de 4-6 estomas por cada hemilámina). El tamaño y la densidad son variables y una especie, D. crispa, carece de estomas (Tabla 1).
En los estomas maratiáceos las áreas deprimidas y sin capas cuticulares de la pared podrían indicar una adaptación a un mecanismo de apertura y cierre de las células oclusivas análogo al que tiene lugar en los estomas de gramíneas. Las áreas deprimidas de posición lateral ayudarían a este mecanismo en los estomas más largos, como los de D. elliptica y D. simplicifolia. En estas dos especies se han encontrado con frecuencia estomas plegados por las áreas no engrosadas y con sus poros muy abiertos. Aunque tales pliegues se deben a deshidratación durante el procesamiento del material, sugieren la forma en que podrían producirse naturalmente. Los estomas porociclocíticos podrían comportarse a la vez como hidatodos y favorecer tanto el intercambio gaseoso como la gutación, ya que los poros permitirían la salida de agua líquida. La bibliografía sobre estomas de pteridófitos es comparativamente más escasa que la que existe sobre el tema para otros grupos de plantas vasculares, aunque sí hay datos recientes para todos los géneros de Marattiaceae con registros que indican que las dimensiones de los estomas van desde 43 x 32 µm hasta 60 x 28 µm en Angiopteris, desde 51 x 29 µm hasta 62 x 30 µm en Archangiopteris, desde 50 x 20 µm hasta 80 x 40 µm en Danaea y desde 43 x 26 µm hasta 59 x 28 µm en Marattia (Rolleri, 1993; Rolleri et al., 1991; Lavalle, 2002; Mengascini, 2002; Rolleri, 2002). Wilkinson (1979) considera «grande» un estoma angiospérmico cuyo diámetro mayor alcanza 40 µm, pero no hay un registro similar para pteridófitos. Los estomas de Marattiaceae resultan 2-5 veces más grandes que los de otras plantas vasculares. En cuanto a las densidades, Angiopteris presenta las más altas de la familia (cerca de 120-150 estomas / mm2), Archangiopteris varía entre 35-65 estomas / mm2 y la densidad más baja se encuentra en Christensenia, con 4-8 estomas / mm2. Danaea es el único género con especies sin estomas. La baja densidad o la ausencia de estomas y la reducción del mesofilo son rasgos típicos de Danaea y únicos en Marattiaceae. Estos rasgos han sido relacionados por Wilkinson (1979), en angiospermas, con el hábito hidrofítico o acuático. Las especies de Danaea con estomas vestigiales o ausentes son plantas pequeñas, delicadas, umbrófilas, que crecen en selvas prístinas con precipitación muy abundante y casi 100 % de humedad atmosférica, en condiciones muy cercanas a las de un hidrófito.
Ontogenia de los estomas (Fig. 16). El estoma, como aquí se lo considera, está formado por el poro y las 2 células oclusivas. Las células que rodean las oclusivas son anexas o vecinas, es decir, difieren por su morfología de las epidérmicas adyacentes o bien no se distinguen morfológicamente de éstas (Rolleri et al., 1987).
Los estomas de Danaea son mesoperígenos (Pant, 1965; Fryns-Claessens & Van Cotthem, 1973). En este tipo de desarrollo, una o más anexas o vecinas se originan de la misma célula inicial que da origen a las oclusivas (Fig. 16, N-Q).
Las células protodérmicas de Danaea son poligonales e isodiamétricas (Fig. 16, A-N), y algunas se dividen para dar origen a iniciales estomáticas. Los estomas se inician por una división desigual de una célula protodérmica, cuyas células hijas difieren entre sí en el tamaño y la respuesta a los colorantes. La célula hija de mayor tamaño se agranda rápidamente y se desarrolla como una célula epidérmica o una anexa; la más pequeña, de contorno cuadrangular o casi circular, se colorea intensamente con carmín acético y es la inicial estomática (Fig. 16 A-C).
La inicial estomática se divide por un plano perpendicular a la primera división y origina dos células aproximadamente iguales: una de ellas es una anexa mesógena, que en general queda situada lateralmente respecto de la inicial (Fig. 16 D-G, P) y la otra es la célula madre de las oclusivas, que se divide nuevamente en un plano paralelo al anterior, produciendo dos células iguales (Fig. 16 G, Q), que son las dos oclusivas. Tanto en la anexa mesógena como en las perígenas periestomáticas pueden tener lugar nuevas divisiones (Fig. 16 GM), y así se foman uno o dos anillos de anexas que se disponen de manera tetracítica (Fig. 16 H-K, M), estaurocítica (Fig. 16 I, L, M) o ciclocítica (a veces la anexa mesógena se divide nuevamente antes de que lo haga la célula madre de las oclusivas). La ausencia de divisiones en algunos planos origina disposiciones actinocíticas, menos comunes.
Los estomas mesoperígenos fueron registrados por Probst (1971) y por Fryns-Claessens & van Cotthem (1973) para Angiopteris, Marattia y Danaea y por Rolleri et al. (1987, 1994) para Christensenia y Marattia. Fryns-Claessens & van Cotthem (1973) sugieren que los estomas de Danaea se originarían por divisiones paralelas u oblicuas y no perpendiculares a la precedente, en las iniciales estomáticas, pero esos autores no lo ilustran.
Los estudios ontogenéticos sugieren que los estomas tetracíticos, estaurocíticos y los ciclocíticos más complejos de Danaea se forman de manera similar, simplemente como variaciones en el patrón mesoperígeno, generalmente a partir de una célula madre de las oclusivas que se forma a continuación de 1-2 anexas mesógenas. Las células anexas son mesógenas y perígenas: las primeras son hermanas de las oclusivas y las otras provienen de divisiones de protodérmicas periestomáticas, dando origen a las disposiciones adultas arriba mencionadas. La observación de los tipos adultos no permite saber cuál célula es mesógena y cuál es perígena en origen, de modo que la terminología mixta para los estomas (Fryn-Clessens & van Cotthem, 1973) resulta innecesariamente confusa.
Protuberancias intercelulares pécticas (Figs. 17- 20)
Las protuberancias intercelulares pécticas de las células del mesofilo (PIP) fueron analizadas con MEB por Rolleri et al. (1999) para Angiopteris y comparadas con las presentes en algunas especies de los otros géneros de Marattiaceae. En ese trabajo, las autoras describieron 3 tipos morfológicos de PIP para Marattiaceae: verrugas, conexiones y filamentos pécticos y consideraron que la presencia de PIP es un carácter de familia mientras que el predominio de uno u otro tipo es un rasgo genérico.
Para Danaea se mencionaron los filamentos y las conexiones pécticas como tipos predominantes (Rolleri et al., 1999), pero este estudio indica que también se encuentran verrugas. Éstas aparecen como protuberancias bulbosas y esféricas, a veces de tamaños diferentes, que se distribuyen con escasa densidad en las células del mesofilo de D. elliptica (Fig. 17 A-C), D. nodosa (Fig. 17 H-I), D. simplicifolia (Fig. 17 D-G) y D. ulei (Fig. 17 I). Las PIP de estos 4 taxa son muy similares en morfología y distribución; la densidad es muy variable y pueden aparecer como verrugas aisladas (Fig. 17 D) o como grupos de verrugas más o menos localizados, a veces muy distantes unos de otros (Fig. 17 H-I).
Los filamentos largos, cilíndricos, enmarañados y las conexiones son más comunes que las verrugas. Se encuentran en D. alata, donde son particularmente densos y delgados, y pueden apreciarse incluso a través de los grandes poros estomáticos (Fig. 18 A-F), D. carillensis (Fig. 19 A-C), D. humilis (Fig. 19 D-F), D. imbricata (Fig. 20 N-P), D. oblanceolata (Fig. 20 A-C), D. plicata (Fig. 20 G-I), D. trichomanoides (Fig. 19 G-I) y D. wendlandii (Fig. 19 J-L). Danaea moritziana (Fig. 18 G-L) tiene filamentos cortos y largos, capitados y anillados, conexiones y verrugas bulbosas pediceladas; también hay abundantes verrugas intercaladas entre los filamentos delgados en D. jenmanii (Fig. 20 D-F) y una mezcla de verrugas, filamentos cortos anillados y conexiones en D. mazeana (Fig. 20 K-M). Danaea crispa y D. tenera carecen de PIP.
En Danaea los tipos de PIP reúnen grupos de especies que también tienen otros rasgos en común: las verrugas están presentes en D. elliptica, D. nodosa, D. simplicifolia y D. ulei, todas con esporófitos grandes, rizomas gruesos ascendentes a erectos y pinnas coriáceas, mientras que los filamentos se encuentran en especies con esporófitos pequeños a medianos y pinnas herbáceas o esponjosas. Danaea moritziana tiene verrugas grandes y capitadas, conexiones gruesas y filamentos, una combinación que también se encuentra en D. jenmanii y D. mazeana, dos especies muy afines con aquélla.
Los filamentos aparecen en otros géneros de Marattiaceae: cortos en Archangiopteris (Mengascini & Rolleri, 2001; Mengascini, 2002) y Christensenia (Rolleri, 1993), largos, delgados y muy similares a los de Danaea, en especies neotropicales y paleotropicales de Marattia (Rolleri et al., 1999; Lavalle, 2002), mientras que en Angiopteris predominan las verrugas, conexiones largas y gruesas y, más raramente, filamentos cortos mezclados con ambas (Rolleri et al., 1999; Rolleri, 2002).
Las esporas de las Marattiaceae son pequeñas y miden desde 11-18 µm en Marattia (Rolleri et al., 1998; Rolleri & Lavalle, 2001; Lavalle, 2002), 18- 32 µm en Danaea, hasta 45-50 µm en Christensenia (Rolleri, 1993), con medidas intermedias de 30-35 µm en Angiopteris (Rolleri et al., 1998; Rolleri, 2002) y Archangiopteris (Mengascini, 2002). La apertura es un rasgo genérico en Marattiaceae (Rolleri & Lavalle, 2001). La macroornamentación es buliforme, esteliforme o, más raramente, muriforme y los tres tipos se presentan en esporas triletes y monoletes (Rolleri & Lavalle, 2001). Angiopteris tiene esporas triletes pustuladas (Rolleri, 2002) con micro-ornamentación escasa o inconstante; Archangiopteris, esporas triletes equinadas y crestadas, con o sin micro-ornamentación (Mengascini, 2002); Christensenia, esporas monoletes equinadas (Rolleri et al., 1996) y finalmente, Marattia, tiene esporas monoletes y casi todos los tipos de ornamentación conocidos para la familia: buliforme, en especies del paleotrópico (Rolleri & Lavalle, 2001), o bien buliforme, muriforme y esteliforme, en especies del neotrópico (Lavalle, 2002).
Las esporas de Danaea son monoletes, bilaterales, más o menos elípticas en vista ecuatorial y elípticas o circulares en vista polar. Los tamaños corrientes están en el rango de los 16-25 µm, pero ocasionalmente aparecen esporas más grandes (Tabla 2).
La ornamentación es esteliforme. Los perisporios son delgados y lisos en la mayoría de las especies, pero tienen micro-ornamentación granular irregular y heterogénea en D. elliptica (Figs. 23 A-O, 24 A-F) y D. simplicifolia (Fig. 24 G-O).
Los exosporios son equinados con espinas cónicas o irregulares, cortas o largas, discretas o basalmente connatas formando aréolas y con micro-ornamentación granular fina o gruesa en los ápices.
Danaea alata (Fig. 21 A- C), D. humilis (Fig. 21 D-F), D. imbricata (Fig. 21 J-L), D. oblanceolata (Fig. 21 G-I) y D. tenera tienen exosporios con espinas discretas y distantes, cónicas, agudas y de largo variable: largas y afiladas en D. oblanceolata (Fig. 21 I), cortas e irregulares en D. imbricata (Fig. 21 L), cortas y típicamente cónicas en las demás. Danaea alata, D. humilis y las plantas juveniles o en desarrollo de D. oblanceolata presentan ca. 80-90 % de esporas normales, mientras que en D. imbricata y plantas adultas de D. oblanceolata el porcentaje de esporas normales es del 50 %. Hay pocos ejemplares fértiles de D. tenera y casi todos presentan esporas escasas y deformes.
En D. elliptica (Figs. 23 A-O, 24 A-F) y D. simplicifolia (Fig. 24 G-O) los exosporios tienen espinas discretas, más bien distantes, irregulares, cónicas, romas, bífidas, espatuladas, etc. Las esporas de estas dos especies son difíciles de distinguir, aunque las de D. simplicifolia generalmente son algo más pequeñas. Se analizaron ejemplares de todas las localidades del área de ambas especies y se encontró un 80-90 % de esporas de aspecto normal, sin variaciones de tamaño ni deformaciones.
En D. moritziana los exosporios tienen espinas cónicas agudas algo próximas, con micro-ornamentación granular gruesa en todo el cuerpo, que forman aréolas irregulares poco definidas (Fig. 22 A-L). Danaea mazeana tiene esporas similares pero de un tamaño casi 2 veces más grande y espinas irregulares con micro-ornamentación granular fina (Fig. 22 M-O), colapsadas o deformadas en algunas localidades. Finalmente, en D. jenmanii se encontraron ejemplares con esporas aletes con el esporodermo liso o informe, sin espinas; ejemplares con esporas monoletes con perisporio equinado irregular, deformadas o colapsadas y sólo escasos ejemplares (con pinnas terminales) mostraron una baja proporción del esporas de aspecto normal (40 %) aunque con irregularidades de tamaño.
En D. nodosa los exoporios tiene espinas cónicas discretas y distantes entre sí, cubiertas por micro-ornamentación granular fina (Fig. 26 A-L). Las esporas son normales en especímenes de toda el área, en un porcentaje de hasta el 70-80 % y sus dimensiones están en los valores de otros tetraploides del género. En una población de D. ulei, de Trinidad las esporas son 2 veces más grandes que el tamaño común en el género (Fig. 26 M-P), mientras que en otros ejemplares, procedentes de Ecuador y Perú se registraron diversas aberraciones, como esporas retorcidas, colapsadas y deformadas, díadas incompletamente divididas o diversidad de tamaños.
Danaea carillensis (Fig. 25 G-J) y D. crispa (Fig. 25 D-F) tienen esporas muy similares, generalmente pequeñas y con las espinas lisas o con micro-ornamentación muy escasa, basalmente fusionadas formando aréolas bien definidas. Muy similares a éstas son las esporas de D. plicata, aunque las espinas tiene menor longitud (Fig. 25 A-C) y en las muestras se encontró hasta un 80 % de esporas retorcidas o colapsadas, diversidad de tamaños y esporas gigantes o dobles.
Finalmente, las esporas de D. trichomanoides (Fig. 25 K-M) y D. wendlandii (Fig. 25 N-P) son prácticamente indistinguibles entre sí: los exosporios tienen espinas largas que son connatas en la base y se fusionan lateralmente y basalmente formando aréolas profundas; sus ápices son agudos, triangulares o cónicos, con abundante micro-ornamentación granular. La proporción de esporas normales en las muestras de ambas especies es del 90 %.
DISTRIBUCIÓN GEOGRÁFICA Y HÁBITAT
Las plantas de Danaea forman colonias numerosas debido a los rizomas reptantes y a la presencia de yemas prolíferas que se producen en el ápice de las láminas estériles y que permiten la reproducción vegetativa. Viven en selvas lluviosas tropicales y subtropicales bajas y en selvas de neblina, pedemontanas y montanas hasta los 2500 m s. m. Crecen en áreas selváticas densas, a la sombra o media sombra, en suelos húmedos y con humedad atmosférica alta, a la orilla o muy cerca de corrientes de agua o bien en suelos parcialmente inundados. Raramente se encuentran en selvas alteradas, aunque algunas especies parecen más tolerantes y pueden vivir en áreas más pertubadas; así, D. moritziana crece en barrancos y cañadones cerca de caminos y también en suelos hipermineralizados debido a actividades humanas, aunque esas plantas suelen presentar un alto porcentaje de esporas anormales y láminas más coriáceas que lo habitual.
La distribución geográfica refleja su restricción a las áreas selváticas más o menos prístinas y las especies se encuentran en México, América Central, las montañas costaneras de Sudamérica, desde Venezuela hasta Bolivia, las Guayanas, el Brasil, Paraguay y las Antillas Menores y Mayores. Sólo 3 especies tienen una distribución amplia: D. elliptica, D. moritziana y D. nodosa, mientras que el resto de las especies tiene áreas más restringidas o son endémicas.
CITOLOGÍA
Unas pocas especies de Danaea han sido estudiadas citológicamente. Walker (1966) reportó un 2n= 160 para plantas de D. jenmanii de Jamaica, D. elliptica de Trinidad y D. simplicifolia de Surinam. Ese autor (Walker, 1966) también registró un triploide para Jamaica, que atribuyó a un híbrido entre D. jenmanii y D. jamaicensis (aquí incluida en la sinonimia de D. moritziana ). La mayoría de los ejemplares revisados de D. jenmanii tienen esporas anormales (deformes, colapsadas, vacías, con ornamentación anómala, etc), aunque ocasionalmente aparecen algunas de apariencia normal, siempre más grandes que lo corriente en el género.
Para D. elliptica existen dos recuentos cromosómicos: el ya mencionado de Walker (1966), para un ejemplar de Trinidad, de 2n= 160, que coincide con uno más reciente, de Benko-Iseppon & Rodrigues da Fonseca (2000), para Brasil, también de 2n= 160. Es una especie con una proporción alta y constante de esporas bien formadas, aparentemente normales, en ejemplares de todas las localidades (Fig. 23 y 24), algunas de las cuales se han encuentrado germinando sobre las pinnas (Fig. 24, A-F). Danaea elliptica tiene fases de desarrollo representadas por individuos con un número variable de pares de pinnas, todos o casi todos precozmente fértiles, algo que puede contribuir a ciertas dificultades para la determinación, pero no parece tratarse de un complejo de especies, como sugieren Tuomisto & Moran (2001), aunque esos autores no efectuaron estudios citológicos. Las esporas de D. simplicifolia son muy similares y casi indistinguibles de las de D. elliptica.
Un recuento reciente para D. nodosa, de Brasil (Benko-Iseppon & Rodrígues da Fonseca, 2000) también indicó un 2n= 160, es decir, un tetraploide sobre la base x= 40, generalizado en Marattiaceae, aunque Sorsa (1971) reportó un triploide para ejemplares de D. nodosa de Puerto Rico. Es probable que D. nodosa y D. elliptica o D. nodosa y D. ulei se crucen en algunas localidades. Estos cruzamientos explicarían la morfología intermedia de ciertos ejemplares de Puerto Rico, Colombia, Perú y Ecuador, representados por plantas de casi 3 m de altura, con estípites sin nudos, pinnas latifoliadas elípticas, epidermis con modelos sinuosos intermedios entre los típicos de esas especies, pero con esporas deformes o colapsadas. Por el momento, no hay trabajos citológicos ni resultados de observaciones de campo en relación con estas hipótesis.
Otras dos especies de interés en cuanto a su citología por la presencia de esporas anómalas son D. plicata y D. tenera. La primera fue considerada por Camus & Pérez García (1995) como un posible híbrido entre D. carillensis y D. crispa, y aquí se han encontrado anomalías de tamaño y forma en esporas de todos los ejemplares, además de esporas gigantes. En D. tenera se encontraron 90-100 % de esporas anormales pero existen muy pocas colecciones y los ejemplares son casi siempre estériles.
TRATAMIENTO TAXONÓMICO
DANAEA Sm., Mém. Acad. Roy. Sci. Turin 5: 420. 1793, nom. cons. TIPO: Acrostichum nodosum L. [=Danaea nodosa (L.) Sm.].
Danaea sect. Arthrodanaea C. Presl, Suppl. Tent. Pterid. 37 (postpr. 297). 1845. TIPO: Danaea leprieurii Kunze [=Danaea elliptica Sm. in Rees].
Danaea sect. Holodanaea C. Presl, Suppl. Tent. Pterid. 37 (postpr. 297). 1845. TIPO: Danaea alata Sm.
Heterodanaea C. Presl, Suppl. Tent. Pterid. 38 (postpr. 298). 1845. TIPO: Danaea stenophylla Kunze [=Heterodanaea stenophylla (Kunze) C. Presl].
Plantas terrestres o hemiepífitos oportunistas, coloniales, de 15-20 y hasta 200-300 cm de altura. Rizomas postrados, largamente o cortamente rastreros, suberectos o parcialmente erectos y en ese caso, con una porción siempre rastrera y otra distal erguida, desnudos, con estípulas carnosas que abrazan la base de los estípites, 2-3-ciclostélicos, amiláceos; con raíces abaxiales y a veces también laterales, cordeliformes, gruesas, ocasionalmente subaéreas, con cortezas parenquimáticas reservantes y actinostelas poliarcas. Estípulas pareadas exógenas, carnosas, marginalmente papiráceas, castañas, amiláceas, capaces de reproducir vegetativamente las plantas, conectadas o no con la estela del rizoma pero con las porciones visibles sin vascularización. Frondas dimórficas, las estériles y las fértiles de contorno similar pero las fértiles moderadamente contraídas a reducidas y en general carnosas; las estériles escasas o numerosas, a veces en disposición espiralada cuando los rizomas se yerguen, y ocasionalmente arrosetadas en esporófitos muy pequeños. Estípites de las frondas estériles carnosos y flexibles en algunas especies, rígidos o endurecidos con la edad en otras, con surcos someros o profundos que se prolongan en las costas; con epidermis papilosa, colénquima subepidérmico y corteza parenquimática reservante con almidón abundante o escaso, biciclostélicos o dictiostélicos; con 0 - 3 (4) pulvínulos ensanchados y carnosos que facilitan el movimiento (a veces poco evidentes en estípites carnosos de plantas con esporófitos pequeños), con tejidos internos similares a los del estípite pero con colénquima más abundante, cortezas compactas y estelas más fragmentadas, con las meristelas en disposición circular. Pinnas cortamente pecioluladas, 1-3 y hasta 25-28 pares, insertas en el raquis muy próximas y hasta imbricadas o distanciadas 4-7 (8) cm; elípticas, elípticas anchas, oblongo-elípticas, lanceoladas, oblongo-lanceoladas, oblongo-espatuladas o falcadas; con base asimétrica cuneada, redondeada o subcordada; ápices acuminados, agudos, cuspidados u obtusos, aserrados, subaserrados, repandos o crespos, márgenes enteros, repandos, ondulados o crespos; textura translúcida, membranácea, esponjosa, herbácea firme y hasta coriácea; costas dorsiventrales con surcos leves o profundos, oscuras o rojizas. Indumento glandular más bien abundante, parcialmente caduco en plantas adultas, pero siempre denso en juveniles, tricomas paucicelulares globosos o estrellados, protoscamas campanuladas, escuamiformes, estrelladas o irregulares y formas intermedias entre ambos, todos mucilaginíferos, peltados y con bases mucilaginíferas que permanecen insertas en la epidermis cuando el indumento cae. Venas libres, curvas en el margen formando una vena marginal gruesa, tortuosa y continua, ausente en pinnas translúcidas o delicadas; exclusivamente simples (una especie), predominantemente simples (con pocas geminadas o bifurcadas), o bien combinaciones de geminadas y bifurcadas cerca o lejos de la costa o de ambos tipos con venas simples. Modelos epidérmicos poligonales y sinuosos con ondas profundas o someras, curvas o angulosas, a veces con engrosamientos localizados. Estomas maratiáceos típicos o porociclocíticos, muy esparcidos a ausentes en láminas translúcidas. Mesofilos presentes o ausentes. Protuberancias intercelulares pécticas de las células del mesofilo predominantemente filamentosas, conexiones y filamentos largos, delgados y enmarañados; verrugas menos comunes, siempre dispersas o aisladas. Sinangios lineares inmersos en el tejido de la lámina fértil, con cada esporangio fusionado dehiscente por medio de un poro apical. Esporas elipsoidales o esféricas, de 16-30 µm en vista polar, monoletes; perisporio liso o granular; exosporio con ornamentación esteliforme, estelas espiniscentes (espinas) largas o cortas, cónicas o irregulares, discretas o basalmente fusionadas, con micro-ornamentación granular en los ápices.
Clave de las especies de Danaea
1. Láminas simples ........................................................................................................................................ 2
1. Láminas 1-pinnadas ................................................................................................................................... 3
2 (1). Láminas lanceoladas, herbáceas; venas simples predominantes, escasas geminadas, horizontales;
tricomas no ramificados y protoscamas campanuladas pequeñas; 1-3 pulvínulos en el estípite .............................. 2. D. carillensis
2. Láminas elípticas, subcoriáceas; venas bifurcadas, geminadas y simples, oblicuas; tricomas estrellados
y protoscamas estrelladas o irregulares grandes; 1-2 pulvínulos en el estípite ................................................................................................................... 13. D. simplicifolia.
3 (1). Estípites sin pulvínulos ............................................................................................................................... 4
3. Estípites con 1-4 pulvínulos ........................................................................................................................ 6
4 (3). Frondas de 15-20 cm; láminas lanceoladas paripinnadas; yemas siempre presentes; 12-15 pares de pinnas laterales, membranáceas, con márgenes ondulados subcrespos; venas simples predominantes, escasas bifurcadas en al área intramarginal castañas a negruzcas, separadas; tricomas y protoscamas campanuladas pequeñas; rizomas siempre postrados y muy delgados ....................... 15. D. trichomanoides
4. Frondas desde 120 hasta 300 cm de altura; láminas oblongas a oblongo-elípticas o elípticas, imparipinnadas; yemas ausentes o muy raras; venas simples combinadas con geminadas o con geminadas y bifurcadas, próximas; protoscamas estrelladas a irregulares grandes, tricomas raros; rizomas postrados hasta erectos, muy gruesos .................................................................................. 5
5 (4). Pinnas 10-12 (18) pares, oblongo-lanceoladas anchas o angostas, a veces casi espatuladas, las terminales de igual tamaño o más pequeñas que las laterales, con ápice redondeado y mucrón aserrado flexible; venas geminadas y simples, horizontales; rizomas postrados, ascendentes y hasta erectos ................... 10. D. nodosa
5. Pinnas 5-7 (10) pares, elípticas o elíptico-lanceoladas anchas, las terminales 2-3 (4) veces más largas que las laterales, con ápice atenuado acuminado no mucronado; venas simples, geminadas y bifurcadas cerca de la costa, oblicuas en origen, luego horizontales; rizomas siempre postrados .................. 16. D. ulei
6 (3). Láminas imparipinnadas, pinnas terminales bien desarrolladas (láminas con yemas raras, sólo en especies con frondas predominantemente paripinnadas) ........................................................................ 7
6. Láminas paripinnadas con yemas en lugar de pinnas terminales (láminas con pinnas terminales raras, sólo en especies con frondas predominantemente paripinnadas) .............................................................. 11
7 (6). Plantas de 30-40 cm de altura; láminas oblongas, ocasionales láminas con yemas en la misma planta, 25- 28 pares de pinnas; venas simples predominantes y geminadas o bifurcadas ocasionales; tricomas poco ramificados y protoscamas planas, pequeños ..................................................... 5. D. humilis
7. Plantas más grandes, de 60-150 cm de altura, láminas siempre imparipinnadas con un número variable de pinnas laterales, pero siempre menos de 25-28 .............. 8
8 (7). Venas simples exclusivamente, negruzcas, muy oscuras, algo gruesas y tortuosas; hipofilos más claros, amarillentos o amarillos; láminas oblongas a oblongo-elípticas; rizomas siempre postrados ..................................................................................................................................................... 1. D. alata
8. Venas simples y otras, geminadas y/o bifurcadas cerca o lejos de la costa, en proporciones variables, castañas o del color de la lámina, delgadas, no tortuosas; hipofilos generalmente concolores .................... 9
9 (8). Venas bifurcadas a distancias regulares de la costa y simples, geminadas raras o en juveniles, castañas o más oscuras que la lámina; láminas oblongas, 10-12 (18) pares de pinnas laterales lanceoladas a oblongo-falcadas, angostas; rizomas postrados, ascendentes o erectos .......... 9. D. moritziana
9. Venas bifurcadas a distancias irregulares de la costa, geminadas y simples, del color de la lámina o más oscuras; rizomas postrados o erectos ................................. 10
10 (9). Pinnas lanceolado-falcadas, 10-12 (18) pares, con ápices atenuados irrregularmente aserrados e incurvados; venas más oscuras que la lámina; tricomas abundantes, estrellados y protoscamas campanuladas grandes; rizomas postrados .............................................................................. 8. D. mazeana
10. Pinnas elípticas a elípticas anchas, 2-7(8) pares, con ápices agudos a veces algo retorcidos, nunca aserrados ni incurvados; venas del color de la lámina; tricomas escasos, irregulares, protoscamas estrelladas o irregulares grandes; rizomas erectos ...................................................... 4. D. elliptica
11 (6). Láminas con 2-3(4) pares de pinnas, paripinnadas o imparipinnadas y con una pinna terminal 3-4 veces más larga que las laterales; pinnas oblongas u oblanceoladas con ápices muy crespos; venas geminadas y simples; plantas siempre pequeñas (raramente más de 30-40 cm) ........................ 12. D. plicata
11. Láminas con más pares de pinnas, ca 8-22, nunca menos, siempre paripinnadas; plantas pequeñas o grandes (hasta 60-70 cm) .................................... 12
12 (11). Pinnas crespas, casi translúcidas, brillantes, con márgenes y ápices ondulados a muy crespos; venas
bifurcadas predominantes, onduladas, algo más oscuras que la lámina; tricomas pequeños caducos, bases persistentes en la epidermis ......................... 3. D. crispa
12. Pinnas no crespas, membranáceas, esponjosas o herbáceas, a veces opacas; venas del color de la lámina o más oscuras ........................................ 13
13(12). Pinnas muy imbricadas y superpuestas, 15-18 pares, membranáceas, con ápices obtusos aserrados o aserrado-crenados; venas bifurcadas y simples, más oscuras que la lámina ........................... 6. D. imbricata
13. Pinnas distanciadas o próximas pero no imbricadas .................................................................................. 14
14 (13). Pinnas próximas pero no imbricadas ......................................................................................................... 15
14. Pinnas distanciadas, nunca imbricadas ...................................................................................................... 16
15 (14). Venas simples predominantes y escasas geminadas, más oscuras que la lámina; 15-18 pares de pinnas oblanceoladas u oblongo-espatuladas, membranáceas a herbáceas, más bien brillantes, con ápices obtusos cortamente mucronados (a veces algo agudos y subaserrados en juveniles), bases algo contraídas .................... 11. D. oblanceolata
15. Venas bifurcadas predominantes y escasas simples, del color de la lámina; 8-12 pares de pinnas oblongo-falcadas, esponjosas, opacas, con ápices redondeados ondulados en juveniles y adultos, bases redondeado-cordadas ................................................................................................ 17. D. wendlandi
16(14). Pinnas discolores, con hipofilos glaucos, esponjosas a herbáceas, oblongas o elípticas, anchas, 8-10 pares, con ápices obtusos aserrados irregulares y márgenes irregularmente subaserrados o repandos; venas simples, bifurcadas a distancias variables de la costa y geminadas; tricomas estrellados y protoscamas campanuladas grandes, persistentes ..................................................................... 7. D. jenmani
16. Pinnas concolores, hipofilos no glaucos, translúcidas, lanceolado- falcadas, 10-12 (14) pares, con ápices atenuados anchos, aserrados e incurvados y márgenes enteros; venas geminadas predominan tes, algunas simples; tricomas pequeños abundantes generalmente caducos ............................. 14. D. tenera
1. Danaea alata Sm., Mém. Acad. Roy. Sci. Turin 5: 420. 1793. TIPO: Lámina 109 en Plumier, "Traité...". 1705. Basado en un espécimen coleccionado por Plumier en La Martinica. Fig. 27 A-J.
Danaea fendleri Underw., Bull. Torrey Bot. Club 29: 673. 1902. TIPO: Trinidad. Fendler 147 (Holótipo, NY; isótipos K, Y, no vistos; isótipo, US!).
Danaea stenophylla Kunze, Farnkr. 1(1-3): 55, t. 28. 1840. TIPO. Guadeloupe. L'Herminier 213 (Holótipo, LZ, destruido; isótipo, B, no visto; isótipo, K!). Syn. nov.
Plantas hasta 120-130 cm de altura. Rizomas postrados, largamente o cortamente rastreros, a veces ascendentes, gruesos, con estípulas amiláceas carnosas y raíces abaxiales cordeliformes gruesas. Estípites numerosos, moderadamente próximos, adaxialmente convexos y abaxialmente 2-canaliculados, a veces también lateralmente canaliculados; decrecientemente alados; con 1-3 pulvínulos que a veces llevan pinnas aflébicas o reducidas, cubiertos por abundantes protoscamas grandes, persistentes, peltadas, campanuladas o irregularmente estrelladas, más o menos aplanadas pero con un centro paucicelular y células marginales mucilaginíferas; tejidos internos moderadamente amiláceos. Lámina oblongo-elíptica, herbácea a esponjosa, opaca; raquis conspicuamente alado, ala proximalmente reducida o revoluta; pinna terminal siempre presente y a menudo más larga que las laterales; yemas prolíferas ausentes. Pinnas estériles 12-15 pares, de 10-12 (15) cm de largo por 1-2 (3,5) cm de ancho, lanceolado-oblongas, asimétricas, algo falcadas, con bases asimétricas redondeadas a subcordadas, ápices agudos aserrados incurvados y márgenes enteros a repandos; hipofilos blanco-amarillentos, muy claros o de color amarillo sulfúreo, más raramente, verdes muy claros. Pinnas fértiles 10-20 pares, muy reducidas, cortamente pecioluladas, angostamente falcadas, con márgenes hialinos y ápices ligulados, mucronados u obtusos. Venas simples solamente, horizontales, oscuras y tortuosas. Indumento denso, superficial y sobre los ejes; tricomas y protoscamas mucilaginíferos parcialmente caducos en plantas adultas. Modelos epidérmicos sinuosos; epifilos con sinuosidades muy frecuentes, de pared uniforme, someras; hipofilos con sinuosidades irregulares muy profundas, curvas o angulosas, localmente engrosadas; estomas porociclocíticos. PIP filamentosas delgadas y enmarañadas, muy densas, visibles con escaso aumento a través de los poros estomáticos. Esporas elipsoidales de 22 x 17 µm, con periporio liso y exosporio equinado con espinas conicas agudas discretas con los ápices cubiertos por micro-ornamentación finamente granular.
Distribución geográfica y ecología: Antillas (Dominica, Grenada, Martinica, San Vicente), Costa Rica, Trinidad y Venezuela. En selvas lluviosas densas, bajas o montanas, en suelos húmedos y casi inundados o muy cerca de corrientes de agua. Crece desde el nivel del mar hasta los 1200 m.
Material examinado
COSTA RICA. Limón. Las Brisas de Pascuarito, Siquirres, Gómez et al. 23409 (MO); Camino por Las Brisas, Pascuarito, Siquirres, Río Danto, Gómez & Herrera 23622 (MO).
DOMINICA. St. George. Morne Micotrin, Lellinger 480 & 482 (US). St. Patrick. Morne Plat Pays, Hodge 1682 (US). Morne Anglais, Hodge 1A (US).
GRENADA. sin. loc., Sherring 223 (US).
MARTINICA. Pitons du Corbet. Stehlé 534 & 5857 (US).Trace des Jésuits, du Poste Forrestier de Deux Choux à la Vallée de Lorrain, Stehlé 3447 (US).
SAN VICENTE. Upper Valley of Richmond River, Morton 6183 (US). Valley of North York, Cumberland River, Morton 5569 (US).
TRINIDAD. Blanchisseuse Road, near 10-1/2 mile post, Broadway 6276 (MO). Andrews Trace, Hombersley 160 (US). Morne Bleu, Britton 2251 (US). Trinidad Botanic Gardens, Prestoe 1177 (US). Mount Tocuche, Britton et al. 1354 (US). Sin. loc., Bailey & Bailey T13 (US). Sin loc., Fendler 147 (US).
VENEZUELA. Miranda. Depto. Páez: Fila La Tigra, Oda. San Juan, 18 km SO de Cúpira, Ortega & González 375 (MO). Sucre. Península de Paria, Cerro Patao, N de Puerto de Hierro, NW de Güiria, Steyermark & Agostini 91176 (US). Cerro de Humo, cabeceras de uno de los afluentes del Río Santa Isabel, arriba de Sipara, W de Santa Isabel, alrededor de 14 km al N del Pueblo de Río Grande de Arriba, arriba de Boca de Cumana y Puerto Siparo, NO de Irapa, Steyermark 94899 (GH, US). Cagigal, near border with Depto. Arismendi, Peninsula de Paria, head water tributaries of the Río Cumaná, below trail between El Paugil and El Brasil, Steyermark et al. 121449 (MO).
Observaciones: es la única especie de Danaea con hipofilos de color amarillo sulfúreo o muy claro en plantas adultas (el color también puede ser verde muy claro, pero el amarillento persiste en material de herbario y no se lo ha podido relacionar con contenidos celulares u otra causa), con venas exclusivamente simples, tortuosas y de color castaño oscuro o casi negro e hipofilos con abundante indumento de tricomas y pequeñas protoscamas campanuladas, todos mucilaginíferos. Las plantas jóvenes de D. alata y D. moritziana y las adultas de D. humilis son externamente muy semejantes, pero la venación simple es un rasgo característico de la primera. Los modelos epidérmicos son típicos de la especie y los estomas son porociclocíticos, muy similares a los de D. mazeana y sólo presentes en Marattiaceae en estas dos especies y en el género Christensenia (Rolleri, 1993; Rolleri et. al., 2003). Las esporas de D. alata, D. humilis y D. oblanceolata son casi indistinguibles entre sí, pero las de D. alata son más grandes y podrían corresponder a un tetraploide. Las colecciones consultadas incluyen plantas grandes y bien desarrolladas; lo mismo puede decirse del tipo de D. stenophylla, un ejemplar bien desarrollado de D. alata. Las venas simples representan un carácter constante y único en el género.
2. Danaea carillensis H. Christ, Bull. Soc. Bot. Genève II, 1: 234. 1909. TIPO. Costa Rica. Carrillo, Pcia. San José, 400 m, Wercklé 365 (holótipo, P, no visto; foto del tipo, P!). Fig. 34 D.
Plantas pequeñas, de 20-30 cm de altura. Rizomas largamente rastreros, a veces ascendentes, carnosos, con estípulas amiláceas persistentes, suculentas, distalmente papiráceas. Numerosos estípites próximos, adaxialmente y abaxialmente surcados, más cortos que la lámina en las frondas estériles y más largos que la lámina en las frondas fértiles, carnosos, castaños a negros, oscuramente alados, con alas reducidas o revolutas, con 2-3 pulvínulos; con tejidos internos parenquimáticos moderadamente amiláceos, con indumento de protoscamas campanuladas, pequeñas, más bien densas, peltadas, con cuerpo plano que irradia de un centro mucilaginífero de aspecto tricomatoso y con numerosas glándulas mucilaginíferas marginales. Lámina estéril simple, de 20-25 (28) cm de largo por 3-4 (5) cm de ancho, lanceolada, herbácea a herbácea firme, con base cuneada, ápice agudo y márgenes enteros o algo repandos. Lámina fértil simple, de 16-20 (23) cm de largo por 1,5-2,5 (3) cm de ancho, lanceolada, algo carnosa, con base cuneada, ápice cuspidado y márgenes repandos membranáceos. Venas predominantemente simples y ocasionales geminadas, en ángulo recto con la costa, curvas en el margen formando una vena marginal, a menudo más oscura que el tejido foliar. Indumento formado por tricomas y pequeñas protoscamas superficiales, más abundante sobre venas o cerca de la costa. Modelos epidérmicos sinuosos similares en epifilo e hipofilo, sinuosidades frecuentes y uniformes; estomas maratiáceos. PIP filamentosas. Esporas casi esféricas, de 17 x 17 µm, con perisporio liso y exosporio con espinas triangulares algo planas, fusionadas basalmente formando aréolas muy definidas.
Distribución geográfica y ecología: endémica de Costa Rica. Crece en selvas húmedas y lluviosas, a 400-1150 m s. m.
Material examinado
COSTA RICA. Alajuela. Upala: Bijagua, El Pilón, cabeceras del Río Celeste, Herrera 1239 (US). Limón. Carrillo: Reserva Cordillera Volcánica Central, along small stream ca. 2 km E of lower Park Station, Finca González, San José-Guapiles Highway, Hammel et al. 16672 (US). San José. Carrillo: Brade & Brade 303 (US).
Observaciones: todos los ejemplares tienen una proporción constante del 80-90 % de esporas normales y bien formadas. Camus & Pérez García (1995) mencionan a D. carillensis como uno de los posibles parentales de D. plicata, que vive en la misma área y desarrolla frondas con pocos pares de pinnas laterales, paripinnadas y con yemas o imparipinnadas y con una pinna terminal comparativamente muy larga.
3. Danaea crispa Endres et Rchb. f., Bot. Zeit. (Berlin) 30: 489. 1872. TIPO: Costa Rica. Endres s.n. (holótipo, W no visto; foto del tipo, W!). Fig. 34 B-C.
Plantas pequeñas, delicadas, de 30-35 cm de altura. Rizomas largamente rastreros, carnosos, cubiertos por pequeñas estípulas persistentes amiláceas. Numerosos estípites más o menos próximos, adaxialmente convexos, abaxialmente carenados y con 2 surcos laterales, carnosos, papilosos y finamente estriados, oscuramente alados o exalados, con 2-3 pulvínulos sin pinnas o con pequeñas pinnas aflébicas o vestigiales, con indumento abundante de tricomas y protoscamas pequeñas, peltadas, con cuerpo campanulado paucicelular, un centro tricomatoso mucilaginífero y glándulas mucilaginíferas marginales; tejidos internos parenquimáticos con escaso almidón. Lámina estéril anchamente lanceolada, paripinnada, abruptamente terminada en una yema prolífera, membranácea a translúcida. Pinnas laterales 18-22 pares (los pares basales aflébicos o vestigiales), de 4,5-5,6 (6) cm de largo por 0,3-0,5 (0,8) cm de ancho, muy crespas, oblongas, con base asimétrica cuneada, ápice obtuso y márgenes plegados, ondulados o crespos. Lámina fértil contraída, no crespa, con menos pinnas, más cortas, que la estéril. Venas predominantemente bifurcadas, a distancias similares de la costa, con las ramas de la bifurcación frecuentemente onduladas. Indumento formado por tricomas, protoscamas pequeñas campanuladas y formas intermedias. Modelos epidérmicos poligonales en epifilos e hipofilos; estomas, mesofilo y PIP ausentes. Esporas de 22 x 17 µm, con periporio liso y exosporio con espinas largas triangulares o cónicas, fusionadas basalmente formando aréolas definidas.
Distribución geográfica y ecología: Costa Rica y Panamá. En selvas primarias o secundarias muy húmedas. Crece desde el nivel del mar y hasta cerca de los 500 m de altura.
Material examinado
COSTA RICA. Alajuela. Upala: Bijagua, El Pilón, Cabeceras del Río Celeste, Herrera 1240 (US). Guanacaste. Along the Río Corobici about 4 km NW of Canas, Taylor 17840 (US). San José. Carrillo: Brade & Brade 328, Pittier 1171 (US). Universidad of San Ramón´s Biological Field Station, ca. 20 km N of cloud forest, Moran 4145 (AAU, UC).
PANAMA. Coclé. Vicinity of El Copé at Parque Nacional El Copé, 5-6 N of El Copé, along trail which lends into the lowlands from Old River saw works area, Croat & Zhu 76747 (AAU).
Observaciones: todos los ejemplares revisados tienen 80-90 % de esporas normales y bien forma das. Camus y Pérez García (1995) sugieren que D. crispa y D. carillensis serían los parentales de D. plicata, una especie que presenta esporas anómalas, gigantes o dobles y cuyos rasgos morfológicos pueden interpretarse como intermedios entre las dos especies mecionadas.
4. Danaea elliptica Sm. in Rees, Cycl. 11: Danaea No. 2. 1808. LECTÓTIPO: Jamaica. locality unknown, Sloane (BM-Hb. J. E. Smith cat. no. 1645.7 ex LINN!). (elegido por D. B. Lellinger, Amer. Fern J. 90 (3): 100-103. 2000. Fig. 28 A-K.
Danaea geniculata Raddi, Syn. Fil. Bras. 5. 1819. TIPO: Brasil. Mandiocca. Est. Río de Janeiro, Raddi s.n. (FI!; foto del isótipo PRC!). Syn. nov.
Danaea trifoliata Rchb. f. ex Kunze, Analecta Pteridogr. 4, t. 2. 1837. TIPO: "Habitat in Surinamo," Weigelt (B, no visto; foto del isótipo B!). Syn.nov.
Danaea leprieurii Kunze, Farnkr. 1(6): 137, t. 60. 1843. TIPO: Guayana Francesa. Leprieur in 1840 (holótipo, LZ destruido; isótipo B, no visto; foto del isótipo, US!). Syn.nov.
Danaea augusti Karsten in Kunze, Linnaea 20: 2. 1847. TIPO: Venezuela. Pto. Cabello, Edo. Carabobo, Karsten s.n. (holótipo, B; isótipo C, no vistos; foto del tipo, US!). Syn.nov.
Danaea media Liebm., Kongel. Danske Vidensk. Selsk. Skr., Naturvidensk. Math. Afd. V, 1: 306 (repr. 154). 1849. TIPO: México. Edo. Veracruz. Barranca de Isapa, Hacienda de Jovo, Liebmann s.n. Pl. Mex. 2185 = Fl. Mex. 653, 654, 849, 850 (C no visto, fotos 5578, 5625 US!). Syn.nov. Danaea oligosora E. Fourn. ex Baker, Ann. Bot. (London) 5: 499. 1891. TIPO: Guadeloupe. Fournier (K? no visto, probable isótipo US! ). Syn.nov.
Danaea polymorpha Leprieur ex Baker, Ann. Bot. (London) 5: 499. 1891. Síntipo: Guadeloupe, Mazé (K no visto) y Grenada, Sherring s. n. (K no visto; isosíntipo US!). Syn. nov.
Danaea elliptica var. repens Jenman, Bull. Bot. Dept., Jamaica N.S., 5 (9): 208. 1898. Tipo no establecido. Sinonimizado por Proctor (Ferns Jam. 14. 1985).
Danaea elliptica var. crispula Rosenst., Repert. Spec. Nov. Regni Veg. 6: 310. 1909. TIPO: Perú. Río Mayo near Tarapoto, Depto. San Martín, Spruce 4770 (holótipo, S; isótipo, L no vistos; isótipo US!). Syn.nov.
Danaea bipinnata Tuomisto, Fl. Ecuador 66: 31. 2001. TIPO: Ecuador. Napo.Yasuni National Park, oil road km 41, Tuomisto et al. 10634 (holótipo, QCA; isótipos, NY, QCNE, TUR, no vistos; isótipo AAU!). Syn.nov.
Plantas grandes, de 120-150 cm de altura. Rizomas postrados cortamente rastreros, ascendentes, suberectos o erectos, con raíces cordeliformes gruesas, abaxiales y laterales y estípulas carnosas amiláceas. Estípites numerosos, más bien próximos, abaxialmente y adaxialmente bifurcados y con 1-2 surcos laterales profundos, con 1-2 (3) pulvínulos; tejidos parenquimáticos internos con escaso almidón. Protoscamas peltadas estrelladas a irregulares, con cuerpo pluricelular estrellado o fimbriado, prolongado en brazos unicelulares que rematan en células mucilaginíferas. Lámina estéril anchamente elíptica, en plántulas casi rómbica, siempre imparipinnada, concolor o más clara en el hipofilo en plantas juveniles y más oscura en adultas; yemas prolíferas siempre ausentes. Pinna terminal elíptica ancha, generalmente más grande que las laterales. Pinnas laterales 1-10 pares, insertas distantes 2-3 cm en plantas juveniles y hasta 6-8 cm en adultas, sobre raquis oscuramente alados, de 10-12 (16 cm de largo por 2-3,5 (5) cm de ancho, elípticas, con base redondeado-subcuneada, ápice cuspidado o acuminado, a veces algo aserrado y márgenes hialinos a cartilaginosos, enteros, repandos o algo ondulados. Lámina fértil reducida, con 5-8 (10) pares de pinnas de 5-8 (11) cm de largo por 1-2 (3 ) cm de ancho, más o menos suculentas. Venas simples, geminadas y bifurcadas más bien cerca de la costa, curvadas en el margen formando una vena comisural delgada o gruesa. Indumento cerca de las venas y sobre éstas y costa, superficial escaso, tricomas y protoscamas mucilaginíferas peltadas, estrelladas a irregulares. Modelos epidérmicos sinuosos similares en epifilo e hipofilo, sinuosidades profundas e irregulares, localmente engrosadas; estomas maratiáceos grandes, elípticos u oblongos, con áreas deprimidas polares y laterales y poros normales. PIP verrucosas. Esporas elipsoidales de 25 x 20 ìm, equinadas, con periporio granular y exosporio con espinas largas y cortas, conicas, espatuladas, bífidas o irregulares, discretas y distantes.
Distribución geográfica y ecología: México, América Central, Antillas (Jamaica, Cuba, Dominica, Grenada, Guadalupe, Haití, Puerto Rico, República Dominicana, Santa Lucía, San Vicente) y Sudamérica (Trinidad, Venezuela, Colombia, Ecuador, Perú, Bolivia, Guayanas y Brasil). En selvas bajas, en galería, montanas y pedemontanas, en suelos húmedos o inundados, cerca de corrientes de agua. Crece desde el nivel del mar hasta 2000-2500 m de altura.
Material adicional examinado
BELIZE. Middlesex. Sin loc. Schipp 355 (US).
BOLIVIA. La Paz. Mapiri Region: San Carlos, Buchtien 30, 2132 (ambos US).
BRASIL. Amazonas. Rio Negro: "in vicinibus Barra," Spruce s.n. (US). General Rondón-Rio Negro : Campos Salles, Estrada do Rio Branco, Luetzelburg 22061 (R). Municipio de Maraá: Río Japurá, Plowman et al. 12209 (NY). Amapa: Upper Jari River, Granville et al. 12449, 12451 (ambos US). Mato Grosso. Santuario de Jamaca: Chapada dos Guimaraes, Salino 342 (GH). Pará. Alto Tapajoz: Rio Curuní, tall rainforest, ca 5 km SE de Missao Cururú, Anderson 10593 (LP, NY). Rio de Janeiro. Serra do Itatiaga:Taquaral, Brade 10222 (R). Corcovado: Telliers 260 (NY). Saõ Paulo. Morro das Pedras: Iguape, Brade s.n. in 1925 (UUS). Sin loc., Brade 8430 (NY). Tietes, Gerdes 132 (NY). Sta. Catarina. Joinville, Mueller [Rosenst. Fil. Exs. Austrobras.] 51 (R, U, US); Antonio Carlos, Biguassú, Reitz 255 (US); Itahahy, Mueller 21356, 21357 (ambos R).
COLOMBIA. Amazonas.Río Popeyacá, near mouth, Evans Schultes & Cabrera 15583 (NY). Meta. Raudal de La Macarena, Angostura #1, Pinto & Bischler 340 (UAMIZ).
COSTA RICA. Cartago. Pejivalle, Lankester 828 (US).
CUBA. Oriente. Loma del Gato and vicinity, Hioram & Clement 6407 (US). Northern spur of the Sierra Maestra, W of the Río Yao, Morton & Acuña 3421 (US). Loma de San Juan, Clement 1023 (US). Las Villas: Soledad and vicinity, Buenos Aires, Jack s.n. (GH). Mountains along the Río Toa, near Arroyo Blanco, Schultes et al. 401 (GH). sin. loc., Wright 1816 (US).
DOMINICA. St. David. Dleau Gommier, Central Forest Reserve, Lellinger 472 (LP, US). St. John. Along trail up Morne Diablotins from Syndicate Estate, Lellinger 595 (US).
ECUADOR. Morona-Santiago. Mutinza: Easterna foothills of Cordillera Cutucó, trail to Tunatza, Øllgaaard & Navarrete 1461 (AAU); Misión Bomboiza, Holm-Nielsen et al. 4280 (AAU); Cordillera Cutucú, road Méndez-Morona, van der Werff & Palacios 10341 (AAU, MO). La Misión Salesiana, 5 km del río Bomboiza, ca. carretera Zamora-Gualaquiza, Baker et al. 6273 (NY). Pastaza. Chapetón on Rio Bobonaza, trail E of village to Rio Aulapi, Øllgaard & Navarrete 1318 (AAU).
GRENADA. Grand Etang, Beard 1234 (US). Sin loc., Murray & Elliot 8 (US);
GUADALUPE. Bois des Baines-Jaunes et Rivière Noire, Dusén 4316 (US). Madeleine, Questel 2801 (US).
GUATEMALA. Alta Verapaz. Cubilquitz, von Tuerckheim 520 (US), II 491 (PRC, US). Huehuetenango. Between Ixcán and the Río Ixcán, Sierra de Los Cuchumatanes, Steyermark 42999 (US).
GUAYANA FRANCESA. Trois Sautí, Haut-Oyapock, Oldeman 949 (U). Montagne de l'Inini, Cremers et al. 2182, 2053 (ambos U). Gobaya Soula, Bassin du Maroni, 7 km E de Gobaya Soula, Cremers et al. 10151 (U). Sin loc., Leprieur 254, 268 (ambos US) y Leprieur s.n. (GH).
GUYANA. Cuyuni-Mazaruni. Pakaraima Mtns., NW side of Mt. Ayuanganna, Hoffman 3286 (US). Upper Takutu-Upper Essequibo: Mt. Marudi, Henkel 2866 (US). Demerara. Potaro river, Jenman s/n (NY). Roraima. Mt. Roraima, Waruma trail, Persaud 76 (NY).
HAITI. Massif du Nord, Vic of Plaisance, Marmelade trail, Leonard 9310 (US). Anse-à-Foleur, top of M. Colombeau, Ekman 4363 (US).
HONDURAS. Cortés. Mountains on N side of Lake Yojoa, Morton 7631 (US).
JAMAICA. Portland. Crownlands, 4 miles W of Troy, Maxon 2926a (US). Catalina, near Chepstow, Moore s.n. in 1904 (US).
MEXICO. Chiapas. Finca S. Cristobal, Purpus 7247 (US). Oaxaca.Ixtlán: 15 km S of bridge at Valle nacional, trail from Puerto Eligio E toward Soyalapán, Mickel & Pardue 6511 (UAMIZ).
NICARAGUA. Zelaya. Bluefields, Danneberger s.n. in 1922 (US).
PANAMÁ. Darién. Vicinity of Cana on trail to Boca de Cupe, Burch 681 (US). San José Island. Pearl Archipelago, Johnston 263 (US). Veraguas. Isla Coiba, Sendera Yuma, Araúz 177 (US).
PERU. Junín. Pichis trail, Sta. Rosa, Killip & Smith 26149 (NY). E of Quimir Bridge, N La Merced, Killip & Smith 23885 (US). Loreto. Maynas, Departamento Fernado Lores, Panguana, McDaniel & Rimachi 31197 (NY). San Martín.Tingo María, Allard 20599 (US); "in montibus secus flumen Mayo, prope Tarapoto," Spruce 4770 (US).
PUERTO RICO. Aibonito. "in sylva ad Cuyón," Sintenis 2700 (US). Sierra de Naguabo, Schafer 3797 (GH). Las Marías. Barrio Espino, 1.1 km NW of intersection of roads 124 & 431, Proctor 40860 (US). Río Grande. Sierra de Luquillo, Caribbean National Forest, Quebrada Sonadora above crossing of road 186, Proctor 40183 (US). San Juan. Río Piedras, Hioram [Ros. Fil. Portoric. Exs.] 17, 120 (ambos US). Maricas, Hess 363 (US).
REPUBLICA DOMINICANA. Seibo. Forest along road between Miches and El Seibo, at crest of the Cordillera Oriental, 30 km from El Seibo, Gastony et al. 650 (US). Sto. Domingo. Monte Cristi: Cordillera Central, Monción, Lagunas de Cenobí, Ekman 12772 (US). Cordillera La Cumbre, Ekman.11567 (US). Vega. Vicinity of Piedra Blanca, near Goodrich rubber Grove, Allard 18962 (US).
STA. LUCIA. Savanne Edmund District SE of Pitón Troumassée, Proctor 21592 (US); Upper Cul-de-Sac Valley, Campistron Ridge, Box 438 (US).
SAN VICENTE. Cumberland Mountain, Morton 5897 (US).
SURINAM. Brownsberg, Stahel & Gonggrijp 589(U). Bosch Hendrik top, Gonggrijp & Stahel 5730 (U).Brokopongo, Nature Reserve, Brownsberg, Bank ofMazaroni falls, Tjom-Lim-San & van der Wiel 209a (U).Lely Mts., SW plateaus, Lindeman et al. 468a, 413(ambos U). "In montibus, qui dicuntur Nassau,"Lindeman 2459 (U).
TRINIDAD. Botanic Gardens Herbarium, sin. coll. 1174 (US). Sin loc., Hombersley 127, 352, 353, 355, 356, 357, 358, 360, 396, 398, 400 (all US). Sin loc., Fendler 28 (US).
Observaciones: D. elliptica es una de las especies más características del género. El número de pares pinnas en frondas adultas, el contorno de éstas, las pinnas terminales elípticas más grandes que las laterales y el patrón de venación se correlacionan con los modelos epidérmicos con engrosamientos en las sinuosidades, las PIP verrucosas y las esporas con perisporio granular. Sus formas juveniles y adultas están conectadas por un continuum de formas intermedias que difieren fenotípicamente entre sí en caracteres como el número de pares de pinnas, la ondulación del margen de éstas (debido al desarrollo variable de una vena comisural) y a veces, en el color de los hipofilos. Estas diferencias han conducido, a veces, a que se interpretaran estas fases como especies diferentes, como es el caso de D. trifoliata, con 1 par de pinnas laterales, o de D. augusti y D. lepreurii, con 2-3 pares de pinnas laterales. Las colecciones de D. augusti y D. trifoliata son escasas (todas US) pero permitieron comparar los caracteres mencionados con ejemplares típicos de D. elliptica. Igualmente, se estudiaron comparativamente colecciones AAU y UC, de D. lepreurii, determinadas por Tuomisto & Moran (2000) y otras colecciones (U, US), todo lo que indujo a incluir esos tres nombres en la sinonimia de D. elliptica, sobre la base de la coincidencia en los caracteres arriba mencionados, tanto externos como internos. Las plantas jóvenes de D. ulei también tienen un par de pinnas laterales como las de D. elliptica, pero ambas difieren en el desarrollo de las pinnas terminales (3-4 veces más grandes en D. ulei), los pulvínulos del estípite (ausentes en D. ulei) y las esporas (dos veces más grandes, con espinas cónicas largas con el ápice retorcido y perisporio liso en D. ulei). La única especie con este tipo perisporio, además de D. elliptica, es D. simplicifolia, que presenta siempre lámina simple entera.
Del estudio del isótipo AAU de D. bipinnata, así como de los ejemplares de herbario citados por su autora (Tuomisto, en Tuomisto & Moran, 2000), resaltan numerosos caracteres comunes con D. elliptica, como el contorno de la lámina, el número de pares de pinnas laterales, el contorno de éstas, la venación, el tipo y distribución del indumento, los modelos epidérmicos y las esporas con perisporio granular. La lámina de D. bipinnata es irregularmente bipinnada y presenta pequeñas "pínnulas" incompletas en la base de pinnas situadas en posición normal. Las divisiones extras de la lámina parecen ser un fenómeno típico de Marattiaceae (Stidd, 1974; Rolleri et al., 2003) y también se encuentran en otros géneros de la familia (Asama, 1960; Stidd, 1974). Asama (1960) las analizó para Angiopteris y las relacionó con fluctuaciones de temperatura, mientras que Stidd (1974) las atribuyó a una plasticidad de las frondas inherente a la familia. No existen estudios experimentales respecto de Danaea y en el caso de D. bipinnata, no hay indicaciones de la extensión de las poblaciones analizadas ni observaciones de campo conclusivas en relación con la presencia de una arquitectura bipinnada típica. Las divisiones supernumerarias son pequeñas y aflébicas, por lo que podría tratarse de un fenómeno teratológico operando en una población reducida o local y no de pínnulas normales. Los rasgos morfológicos que se han utilizado aquí para distinguir las especies sugieren más bien que es una forma desviada de D. elliptica y se ha considerado que la presencia de pínnulas aflébicas es un carácter insuficiente para considerarla una especie distinta de aquélla. Hasta que el fenómeno pruebe ser un rasgo específico constante, se ha preferido un tratamiento más conservador de estos ejemplares.
Tuomisto & Moran (2001) también sugirieron que D. elliptica representaría un complejo de especies, aunque no aportaron evidencias citológicas a favor de esta afirmación y los recuentos citológicos conocidos (Walker, 1966; Benko-Iseppon & Rodrigues da Fonseca, 2000) no parecen apoyar esta propuesta. Danaea elliptica es afín con D. simplicifolia, con la cual coincide en el patrón de venación, el tipo de modelo epidérmico, el tipo de estoma, las PIP verrucosas y las esporas (únicas en el género con perisporio granular).
5. Danaea humilis T. Moore, Index Fil. 286. 1861. LECTÓTIPO: Perú. Tarapoto, Depto. San Martín, Spruce 4769 (US). (elegido por D. B. Lellinger, Proc. Biol. Soc. Wash. 89: 710. 1987. (isolectótipos, BM, GH, L, P, no vistos; isolectótipos K!, US!). Fig. 33 A-C.
Plantas pequeñas a medianas, de 35-45 cm de altura, que crecen en colonias densas. Rizomas postrados, largamente o cortamente rastreros, a veces ascendentes a suberectos, carnosos, con raíces abundantes abaxiales y laterales, con estípulas amiláceas persistentes, suculentas, con márgenes papiráceos. Estípites flexibles y delgados, carnosos pero firmes, escasos (5-8) o numerosos (15- 20), próximos o separados, de color negruzco cubiertos por abundantes tricomas y protoscamas pequeñas, peltadas, irregularmente estrelladas a lanceadas, planas, con células mucilaginíferas marginales, con 2-3 pulvínulos y con abundante almidón de reserva en los tejidos internos. Lámina estéril oblonga, rematada en una pinna o una yema (ambas condiciones presentes en la misma planta), delicadamente herbácea a esponjosa, con abundante indumento abaxial. Pinnas laterales 20-27 pares, opuestas, casi imbricadas sobre el raquis angostamente alado, de 2-4 (6) cm de largo por 0,3-0,8 (1,3) cm de ancho, cortamente pecioluladas, asimétricas, marcadamente falcadas, con márgenes paralelos enteros, bases asimétricas y ápices incurvados finamente serrulados. Lámina fértil angostamente oblanceolada, más larga que la estéril, con estípites carnosos con abundante indumento; pinnas fértiles menos numerosas que las estériles, de 1,5-3 (4) cm de largo por 0,2-0,3 (0,5) cm de ancho, opuestas, próximas, cortamente pecioluladas, oblongas, con bases cordadas o redondeadas y ápices obtusos. Venas simples abundantes y escasas geminadas o a veces, bifurcadas cerca de la costa; vena marginal presente y delgada o ausente. Indumento abundante formado por tricomas, protoscamas y formas intermedias. Modelos epidérmicos sinuosos, sinuosidades muy frecuentes y someras en epifilos, irregulares, profundas y angulosas en hipofilos; estomas maratiáceos. PIP filamentosas abundantes, densas y enmarañadas. Esporas pequeñas, casi esféricas, de 18 x 16 µm, con perisporio liso y exosporio con espinas cortas, cónicas o romas, discretas y con micro-ornamentación granular en los ápices.
Distribución geográfica y ecología: Colombia, Ecuador y Perú. En selvas bajas o montanas y en galería, a la sombra; en suelos muy húmedos o casi inundados, calcáreos o rocosos, casi siempre en sitios ribereños y cerca de corrientes de agua. Crece desde el nivel del mar hasta casi los 1500 m de altura.
Material examinado
ECUADOR. Esmeraldas. Pueblo San Miguel, Holm - Nielssen et al. 24377 (GH). Napo. Cantón Tena: Jatun Sacha Biological Station, 8 km E of Misahualli, A. & L. Fay 2795 (MO). Zamora-Chinchipe. Miazi. Junction of Río Chumbiriatza to Río Nanagaritza, Øllgaard et al. 99372 (AAU).Cordillera del Cóndor: Chinanpitza, trail leading to Destacamento Mayaycu Alto, Øllgaard & Navarrete 98411 (AAU). Estación Experimental El Padmi, Zamora-Gualaquiza Road km 60, just south of El Pangui, Pedersen et al. 104335 (AAU). Road Zamora- Romerillo, km ca. 24, Øllgaard 99774 (AAU). Road Zamora Romerillo, 1-1,5 km N of Romerillo, Øllgaard & Navarrete 105868 (AAU).
COLOMBIA. Cauca. San Juan de Micay Valley, Haught 5391 (US). Santander. Vicinity of Barranca Bermeja: Magdalena Valley, between the Sogamoso and Carare Rivers, Haught 1890 (US). Camp 84 on Pipeline, Foster & Foster 1715 (GH).
Observaciones: se ha podido estudiar el síntipo de D. humilis y se ha visto que incluye, además del material seleccionado como lectótipo por Lellinger (1987), un espécimen de D. oblanceolata (Colombia. Chocó, Cape Corrientes, Seemann 996 (K!) y uno de D. wendlandii (Panamá. Chagres, Canal Zone, Fendler 389 (K!, US!). Las tres especies difieren en los caracteres de la lámina: en D. humilis es oblonga, imparipinnada o paripinnada en la misma planta, tiene 27-28 pares de pinnas laterales falcadas, con márgenes paralelos enteros y ápices incurvados finamente serrulados; en D. oblanceolata es anchamente lanceolada a elíptica, siempre paripinnada, tiene 10-12 (18) pares de pinnas laterales oblanceoladas, con márgenes repandos, ápices agudos subaserrados, obtusos serrulados o cuspidados y con costas rojizas o anaranjadas en plantas jóvenes y oscuras en adultos; finalmente, en D. wendlandii la lámina es lanceada, tiene 8-12 pares de pinnas laterales oblongo- falcadas, con márgenes enteros a repandos y ápices obtusos o redondeados. Las esporas de D. humilis son muy similares a las de D. alata y D. oblanceolata, ambas con espinas discretas, distantes, mientras que en D. wendlandii las espinas son más largas y están fusionadas basalmente formando aréolas profundas.
6. Danaea imbricata Tuomisto & R. Moran, Fl. Ecuador 66: 44. 2001. TIPO: Ecuador. Pastaza. Forest on the banks of Río Pastaza S of MadreTierra Øllgaard 99600 (holótipo, QCA, no visto; isótipos, MO, NY, TUR, U, no vistos; isótipos, AAU! UC!). Fig. 32 J.
Plantas pequeñas, de 30-35 cm de altura. Rizomas cortamente rastreros, carnosos y delgados, con estípulas amiláceas. Estípites distanciados, escasos, carnosos, con 1-2 pulvínulos, alados, con alas ensanchándose algo hacia el raquis, también alado. Protoscamas pequeñas, peltadas, campanuladas a irregulares, mucilaginíferas. Lámina estéril oblonga a angostamente lanceolada, de 10-13 (21) cm de largo por 2-3 (5,5) cm de ancho; generalmente paripinnada y rematada en una yema prolífera; membranácea a esponjosa, más bien opaca. Pinnas laterales 15-23 pares, de 2-3,5 (4) cm de largo por 1-1,4 (2,2) cm de ancho, los pares basales y distales siempre más cortos, muy imbricadas y superpuestas, asimétricas y oblongas a oblongofalcadas, con bases redondeada anchas, márgenes enteros a ondulados y ápices obtusos crenados o subaserrados. Lámina fértil oblonga angosta, con 15-25 pares de pinnas contraídas, cortamente pecioluladas, suculentas, con márgenes enteros y ápices redondeados. Venas bifurcadas predominantes y simples escasas, con las bifurcaciones lejos de la costa, a veces en el área medial o cerca del margen, tortuosas, en general más oscuras que el tejido foliar. Indumento abundante: tricomas, protoscamas y formas intermedias entre ambos tipos. Epidermis con modelos sinuosos, sinuosidades muy frecuentes y someras en epifilos, sinuosidades más profundas, regulares, en hipofilos; estomas maratiáceos vestigiales muy esparcidos o ausentes. PIP filamentosas abundantes, densas y enmarañadas. Esporas pequeñas, casi esféricas, de 19 x 17 µm, con perisporio casi liso y exosporio equinado con espinas cortas, irregulares: cónicas, romas u otras, discretas y con microornamentación granular gruesa en los ápices.
Distribución geográfica y ecología: se conoce solamente para Ecuador. En selvas lluviosas, en suelos húmedos, arcillosos o rocosos. Crece desde los 400 hasta 1500 m s. m.
Material adicional examinado
ECUADOR. Morona-Santiago. Along new road Méndez-Morona, km 55-62, van der Werff & Gudiño 11375 (NY, UC). Napo. Road from Tena to Baeza, km. 28 from Cotundo, Davis 491 (GH). Archidona, Parque Nacional Sumaco, Napo-Galera, Cordillera de las Galeras, Bloque 19, línea 30, Freire & Cerda 539 (NY, UC). Napo-Pastaza.Trail Puyo to Canelos, Mexía 6863 (NY, UC). Pastaza. Hacienda San Antonio del Barón von Humboldt, 2 km al NE de Mera, Baker et al. 5619 (NY). Road N of Mera, toward Río Anzu, km 6,7, Ollgaard & Navarrete 105538 (AAU). Shell-Mera rainforest, 2 km N of Shell-Mera, Holm-Nielsen & Jeppesen 433 (GH).
Observaciones: las plantas de D. imbricata son delicadas como las de D. trichomanoides, pero alcanzan mayor tamaño. Las láminas estériles de ambas especies son paripinnadas en plantas adultas, pero en D. trichomanoides son lanceoladas, de hasta 15 cm de largo, membranáceas a esponjosas, abaxialmente muy claras a glaucas, tienen hasta 16 pares de pinnas laterales distantes sobre raquis alados con indumento denso, mientras que en D. imbricata son oblongas a angostamente lanceoladas, translúcidas, concolores, y tienen hasta 23 pares de pinnas laterales muy imbricadas y superpuestas. Ambas especies difieren también en el número de pulvínulos (ausentes en D. trichomanoides y 1-2 en D. imbricata), la venación (simples en D. trichomanoides y bifurcadas en D. imbricata) y en la ornamentación de las esporas (fusionadas en aréolas en D. trichomanoides y discretas en D. imbricata y). Los modelos epidérmicos de las pinnas son muy similares en ambas, aunque en D. imbricata los estomas son escasos y vestigiales.
7. Danaea jenmanii Underw., Bull. Torrey Bot. Club 29: 677. 1902. TIPO: Jamaica, Jenman 66 (K!). Fig. 29 G-H.
Danaea wrightii Underw., Bull. Torrey Bot. Club 29: 676. 1902. TIPO: CUBA.La Guinea. Wright 1066 (YU no visto, isótipo K!, US!).
Plantas de 35-55 (65) cm de altura. Rizomas cortamente o largamente rastreros, carnosos, rígidos en plantas adultas, amiláceos, con estípulas crasas reservantes de almidón y con raíces abaxiales y laterales gruesas. Numerosos estípites próximos, castaños o negruzcos, abaxialmente y adaxialmente canaliculados y con surcos laterales marcados; con 1-3 pulvínulos; con tejidos internos parenquimáticos laxos con almidón abundante. Protoscamas densas, pequeñas a grandes, peltadas, campanuladas o irregularmente estrelladas, con cuerpos planos radiales o excéntricos que irradian desde un centro mucilaginífero paucicelular y abundantes glándulas marginales de mucílago. Lámina estéril oblonga, generalmente paripinnada en plantas adultas e imparipinnada en plántulas; herbácea a esponjosa; pinna terminal y una o ambas del par apical reemplazadas por yemas en plantas adultas o juveniles, pero a veces presente en juveniles y hasta 3 veces más grande que las laterales. Pinnas laterales 8-10 pares, más o menos próximas, de 8-10 (13) cm de largo por 1,5-2- (2,5) cm de ancho, oblongo- elípticas, con bases redondeadas, ápices subobtusos mucronados, márgenes enteros o repandos en adultos e irregularmente serrulados en juveniles y plántulas; hipofilos glaucos, amarillos o sulfúreos, muy claros. Lámina fértil angostamente oblonga; pinnas laterales oblongas, crasas, reducidas a la porción sinangial y con ápices obtusos. Venas bifurcadas divididas irregularmente cerca o lejos de la costa y simples abundantes, todas oscuras y tortuosas, algo gruesas. Indumento denso, escasamente caduco; tricomas pequeños y protoscamas peltadas campanuladas sobre venas y costa, cerca de las venas y sobre lámina. Modelos epidérmicos ampliamente sinuosos, sin engrosamientos en las ondulaciones, y estomas maratiáceos típicos. PIP filamentosas densas, delgadas y enmarañadas y algunas verrugas. Esporas variables; en plantas adultas con yemas prolíferas, esporas aletes, pequeñas (15 x 14 µm), con esporodermo sin ornamentación, o bien equinadas, deformes y colapsadas, más grandes; en plantas sin yemas prolíferas, 10-20 % de esporas esporas equinadas de aspecto normal, grandes (30 x 28 µm), con espinas cónicas o irregulares discretas.
Distribución geográfica y ecología: Cuba, Haití, Jamaica, Puerto Rico, República Dominicana. En selvas lluviosas densas, en suelos húmedos y casi inundados. Crece desde el nivel del mar hasta los 700-1000 m.
Material examinado
CUBA. Oriente. "in Cuba orientalis prope," Wright 1066 (US). Sierra Maestra. Loma del Gato and vicinity, Hioram & Clement 6406 (US). Ascent from Finca Reunión to the top of Loma del Gato, Ekman 6984 (US). Loma del Gato and vicinity, León et al. 10511 (US). Along the Río Buey, N slope of the Sierra Maestra, Morton & Acuña 3688 (US). La Gran Piedra, Ekman 1673 (US). Santiago de Cuba. Loma de San Juan, Clement 676, 971, 997 & 998 (todos US).
HAITI. Port-de-Paix. Masif du Nord, Haut Piton, Ekman 3707 (US).
JAMAICA. St. Catharine. Rose Hill, Port Royal, Sherring s.n. (US 1411214). Blue Mountains, Catherine's Peak, Pappenfuss s.n. (US 2256892), Webster & Goldberg 143 (US). Rainforest toward summit of Catherine's Peak, Goldberg & Webster 1676 (US). Portland. Trail from Morces Gap to Vinegar Hill, Maxon & Killip 735 (US). On slopes above Tweedside, Maxon 965 (US). St. Thomas. Eastern ridge of Stone Hole Bump, Maxon 9476 (US). St. Andrew. N Hardwar Gap, Maxon 1111 (US). Between Morces Gap and Vinegar Hill, Underwood 1362 & 1364 (ambos US). Trail from Morces gap to Vinegar Hill, Maxon & Killip 737 (US). Sin loc., Hinchley Hart 197, 302 (ambos US).
PUERTO RICO. Adjuntas. Cordillera Central, Monte Guilarte State Forest, upper slopes of Monte Guilarte, Proctor 40116 (US). Jayuya. Cordillera Central, Toro Negro State Forest, Río Saliente headwaters ravine, Proctor 40373 (US).
REPUBLICA DOMINICANA. Agua. Cordillera central, San Juan, Arroyo Mancle, Ekman 13428 (US). Cordillera Septentrional, Carlos Díaz, Ligier 12716 (US).
Observaciones: D. jenmanii presenta rasgos de D. alata y D. moritiziana: tiene hipofilos amarillos sulfúreos o glaucos, muy claros y venas tortuosas castaño-negruzcas, como D. alata, mientras que el patrón de venación, el modelo epidérmico, los estomas y las PIP son muy similares a los de D. moritziana. Las plantas jóvenes pueden presentar una larga pinna terminal que está reemplazada por una yema en los ejemplares adultos y ocasionalmente se encuentran yemas reemplazando ambas pinnas del último par. Los ejemplares con yemas tienen 90-100 % de esporas abortadas, informes o con exosporios lisos o aberrantes, sin espinas. En unos pocos ejemplares, con pinnas terminales típicas, se observaron esporas anómalas mezcladas con otras de aspecto normal, muy similares a las de D. alata pero hasta 2 veces más grandes. Walker (1966) encontró un 2n = 160 en plantas de D. jenmanii de Jamaica y Proctor (1985) señala que esta especie se cruzaría con D. jamaicensis (D. moritziana) en Jamaica. Por el momento se ha considerado conveniente conservarla en el rango específico, pero es una entidad de citología poco clara. Parte del material analizado podría corresponder a un híbrido, ya que las esporas malformadas y gigantes indicarían un intertaxa estéril. El recuento de Walker (1966) no está reñido con esta interpretación, ya que ese autor indica que se obtuvo en mitosis y podría tratarse de un híbrido poliploide. El tamaño de las esporas se puede relacionar con la ploidía (Barrington et al., 1986) y podría indicar que, al menos uno de los parentales de estos híbridos podría ser D. moritziana, cuyos tamaños esporales sugieren un diploide. El otro parental podría ser D. alata o D. mazeana.
8. Danaea mazeana Underw., Bull. Torrey Bot. Club 29: 276. 1902. LECTÓTIPO: Guadalupe. Mazé 11. [aquí designado, K!; otros síntipos son: Guadalupe, Mazé 143, 485 (K)]; isolectótipo, B, no visto; isolectótipo K! foto US!). Fig. 29 F.
Plantas de 70-90 (140) cm de altura. Rizomas largamente rastreros, ascendentes o suberectos, muy rígidos en plantas adultas, amiláceos, con estípulas crasas reservantes de almidón y raíces abaxiales y laterales gruesas. Numerosos estípites próximos, de color castaño o negruzco, abaxialmente y adaxialmente canaliculados y con surcos laterales más bien profundos, con 2 (3) pulvínulos y tejidos internos parenquimáticos laxos con almidón abundante. Protoscamas densas, pequeñas a grandes, peltadas, irregularmente campanuladas o estrelladas, con cuerpos planos radiales o excéntricos desde un centro mucilaginífero paucicelular y con abundantes glándulas marginales de mucílago. Lámina estéril oblanceolada siempre imparipinnada, con una pinna terminal más grande que las laterales; herbácea firme. Yemas prolíferas siempre ausentes. Pinnas laterales 10-16 pares, distantes entre sí 2-3 cm en plantas juveniles y hasta 4-8 en adultas; de 8,5-12 (19,5) cm de largo por 1,5-2,5 (3) cm de ancho; lanceolado-oblongas a algo falcadas, con bases cuneadas levemente asimétricas, ápices largamente atenuados, incurvados y aserrados, y márgenes enteros. Lámina fértil angostamente oblanceolada o elíptica, imparipinnada, con pinnas laterales asimétricas angostamente lanceoladas, reducidas a la porción sinangial y crasas, con o sin un ápice estéril ligulado. Venas bifurcadas a distancias irregulares de la costa y abundantes simples, más bien oscuras, tortuosas pero finas y distanciadas, nunca próximas. Indumento denso en plantas jóvenes y más bien caduco en adultas dejando abundantes glándulas mucilaginíferas en la epidermis; tricomas pequeños y protoscamas peltadas irregularmente campanuladas, cerca y sobre venas y costa, menos en lámina y estípite. Modelos epidérmicos sinuosos, sinuosidades frecuentes, curvas, uniformes y poco profundas en epifilos, sinuosidades distantes, subangulosas, con engrosamientos localizados y profundas, en hipofilos; estomas porociclocíticos. PIP filamentosas delgadas, conexiones largas y verrugas pécticas. Esporas de 29 x 22 ìm con perisporio liso y espinas conicas discretas irregulares, con micro-ornamentación granular en los ápices.
Distribución geográfica y ecología: Guadalupe, Haití, Jamaica, Martinica, República Dominicana y Venezuela. En selvas lluviosas densas, a la sombra, cerca de corrientes de agua. Crece desde el nivel del mar hasta los 1000 m de altura.
Material examinado
GUADALUPE. Baines Jaunes. Bois superieurs des Baines Jaunes, Dusén 4465 (US). Baines Jaunes, Questel 3198 (US). Dugommier. Ravine Chaude, Stehlé 1223 (US). Ravine Malanga, Stehlé 1811 (US). Hauteurs du Matouba, Ravine Flore, Sofaya, Ste. Rose, Dusén 4317-19 (US). Basse Terre, along trail between Plateau de Papye & Ravine Chaude, above Matouba, Proctor 20145 (US).
HAITI. L'Ouest. Vicinity of Dominican Republic- Haiti border, E of St. Pierre, Gastony et al. 514 (US). Port-de-Paix. Massif du Nord, Haut-Piton towards Morne Chavaly, Ekman 4883 (US). Port-au-Prince. Massif de La Selle, Crête-à-Pignants, Morne Malanga, Ekman 5449 (US). Massif de la Hotte, western group, Torbec, ridge above La Mare-Proux, Ekman 5292 (US). Massif de Cahors, Riv. de l'Artibonide, Perodin, ridge above Ingrand, Ekman 3448 (US). Guimbi Galata, Mornes des Commissaires, Holdridge 2248 (US). Massif de Cahors, Belladire, Morne Lagoune-Ibere, Ekman 5599 (US).
JAMAICA. Portland. Morces Gap, Watt 38 (US).
MARTINICA. Massif du Nord, Le Borgne, Morne Chapelet, Ekman 4839 (US). Sin loc. Dusén 1690 (US).
REPUBLICA DOMINICANA. Agua. Cordillera central, San Juan, Arroyo Mancle, Ekman 13428 (US).
VENEZUELA. Mérida. Slopes near summit of Cerro San Isidro, above La Carbonera, Steyermark 56012 (US).
Observaciones: Danaea mazeana es fenotípicamente muy similar a D. moritziana con la que coincide en caracteres como el tamaño del esporófito adulto, los rizomas postrados gruesos y robustos, las láminas imparipinnadas, las pinnas terminales más grandes que las laterales, con bases ensanchadas, el patrón de venación (aunque en D. mazeana las venas se bifurcan más erráticamente, a distancias irregulares de la costa y las venas simples son más abundantes) y el modelo epidérmico de los epifilos. También tiene rasgos en común con D. alata, como el modelo epidérmico de los hipofilos y los estomas porociclocíticos, únicos en el género junto con D. alata. Nunca presenta yemas. La proporción de esporas anómalas puede llegar al 50-60 % y las esporas de aspecto normal son muy similares a las de D. alata pero casi dos veces más grandes. Danaea mazeana podría ser un poliploide derivado de D. moritziana, pero su citología no se conoce.
9. Danaea moritziana C. Presl, Suppl. Tent. Pterid. 35. 1845. TIPO: Venezuela. Colonia Tovar, Edo. Aragua, Moritz 257 (holótipo, PR, no visto; isótipo L, no visto, fragm. del holótipo, US! foto del isótipo, L!; foto del holótipo, PR!). Fig. 29 A-E y fig. 31 K-R.
Danaea cuspidata Liebm., Kongel. Danske Vidensk. Selsk. Skr., Naturvidensk. Math. Afd. V, 1: 307 (repr. 155). 1849. TIPO: México. Oaxaca. Chinantla, between Lobani and Petlapa, 2550 ft. elev., Liebmann Pl. Mex. 2184, Fl. Mex. 255, 656 (C, no vistos; fragmento US!). Syn. nov.
Danaea jamaicensis Underw., Bull. Torrey Bot. Club 29:75. 1902. TIPO: Jamaica. Morces Gap, Clute 105 (Herb. Clute, no visto, posiblemente destruido; isótipo, US!). Syn. nov. Danaea moritziana var. brasiliensis Rosenst., Hedwigia 46: 162. 1907. SÍNTIPOS: Brasil. Sta Catarina. Joinville, Schmalz s.n. (isosíntipo, B, no visto) e Itapoçú, Hansch s.n. (isosíntipo, B, no visto; isosíntipo R!). Syn. nov.
Danaea muelleriana Rosenst., Hedwigia 46: 162. 1907. SÍNTIPOS: Brasil. Sta. Catarina. Joinville, Mueller 48 (B no visto) y Peirabeiraba, Schmalz 122 (isosíntipo, B, no visto; isosíntipo, UC!). Syn. nov.
Danaea excurrens Rosenst., Hedwigia 46: 163. 1907. Síntipos: Brasil. Sta. Catarina. Joinville, Schmalz 122 (2) (isosíntipo, B, no visto; isosíntipo, S!) e Itapoçú, Hansch 11 (isosíntipo, B, no visto; isosíntipo S!). Syn. nov.
Danaea paraguariensis H. Christ in Hassler, Bull. Herb. Boissier II, 7: 927. 1907. SÍNTIPOS: Paraguay, sin. loc., Hassler 104, 111 (isosíntipos G!). Syn. nov.
Danaea pterorachis H. Christ, Bull. Soc. Bot. Genève II, 1: 235. 1909. TIPO: Costa Rica. Sin. loc., Wercklé s.n. in 1903 (P, no visto; foto del tipo P!). Syn. nov.
Danaea urbanii Maxon, J. Wash. Acad. Sci. 14:195. 1924. TIPO: República Dominicana. Barahona. Fuertes 942 (holótipo, US!). Syn. nov.
Danaea muenchii H. Christ in Rosenst., Repert. Spec. Nov. Regni Veg. 22:23. 1925. TIPO: México Chiapas. San Pablo, Muench 159 (P?, no visto; isótipo DS, no visto; isótipo US!). Syn. nov.
Danaea acuminata Tuomisto & R. C. Moran, Fl. Ecuador 66: 27. 2001. TIPO: Ecuador. Napo. Yasuní National Park, oil road km 35, Tuomisto et al. 10507 (holótipo, QCA, no visto; isótipos F, K, MO, NY, QCNE, TUR, U, US no vistos, isótipos AAU! y UC!). Syn. nov.
Danaea falcata Tuomisto, Fl. Ecuador 66: 40. 2001. TIPO: Ecuador. Napo.Yasuní National Park, oil road km 38, Tuomisto et al. 10832 (holótipo, QCA, no visto; isótipos K, NY, QCNE, TUR, U, no vistos; isótipos AAU! y UC!). Syn. nov.
Plantas medianas a grandes, de 100-120 cm de altura. Rizomas cortamente o largamente rastreros, ascendentes, suberectos o casi erectos, a veces apoyantes sobre otras plantas, casi como hemiepífitos ocasionales, carnosos a rígidos en plantas adultas, amiláceos, con estípulas crasas reservantes de almidón y raíces abaxiales y laterales gruesas, a veces subaéreas. Numerosos estípites próximos, abaxialmente y adaxialmente canaliculados, con surcos laterales más bien profundos, con 2-3 pulvínulos y con tejidos internos parenquimáticos laxos con almidón abundante. Protoscamas más bien densas, pequeñas a grandes, peltadas, irregularmente campanuladas a estrelladas, con cuerpos planos radiales o excéntricos que irradian desde un centro mucilaginífero paucicelular, con abundantes glándulas marginales de mucílago. Lámina estéril oblanceolada, con una pinna terminal más grande que las laterales y con la base más ensanchada, muy rara vez reemplazada por una yema; herbácea firme a algo coriácea. Pinnas laterales 10- 15 pares, distantes entre sí 2-3 cm en plantas juveniles y 6-8 cm en adultas; de 8-12 (19) cm de largo por 1,2-2 (2,5) cm de ancho; asimétricas, lanceolado - oblongas, falcadas, con bases cuneadas generalmente asimétricas, ápices atenuados incurvados aserrados y márgenes enteros. Lámina fértil angostamente oblanceolada a elíptica, imparipinnada, con pinnas laterales angostamente lanceoladas a subfalcadas, reducidas a la porción sinangial y crasas, a veces con un ápice estéril ligulado más o menos largo. Venas bifurcadas regularmente cerca de la costa y simples, más simples y ocasionales geminadas en juveniles, finas, del color del tejido foliar o más oscuras y a veces algo tortuosas. Indumento denso en plantas jóvenes y parcialmente caduco en adultas, con las bases mucilaginíferas permaneciendo largo tiempo en la epidermis; tricomas pequeños y protoscamas peltadas irregularmente campanuladas en general sobre venas y costa o cerca de ambas y menos en lámina y estípite. Modelos epidérmicos sinuosos frecuentes con ondas regulares poco porfundas en epifilos y sinuosos distantes con ondas irregulares y muy profundas en hipofilos, en ambos paredes delgadas y uniformes; estomas maratiáceos. PIP filamentosas gruesas, conexiones y verrugas pécticas capitadas aisladas. Esporas de 18 x 12 ìm con perisporio liso y espinas conicas irregulares, con micro-ornamentación granular en los ápices y formando aréolas poco profundas.
Distribución geográfica y ecología: Danaea moritziana tiene una distribución geográfica extensa: vive en las Antillas Mayores y Menores (Cuba, Jamaica, Puerto Rico, República Dominicana), México, Centroamérica y Sudamérica (Trinidad, Venezuela, las Guayanas, Colombia, Ecuador, Perú, Bolivia, Brasil y Paraguay). Crece en selvas lluviosas bajas o montanas, a la sombra, en suelos húmedos y casi siempre cerca de corrientes de agua; también sobre barro y hojas o troncos podridos; es colonial, terrestre o puede crecer como hemiepífito o semiarborescente debido al desarrollo local de rizomas robustos suberectos. Desde el nivel del mar hasta los 2550 m de altura.
Material examinado
BOLIVIA. Cochabamba. Road to San Onofre, 3.3 km N of road to Villa Tunari at point 97.5 km from Cochabamba, Foster 79139 (MO). Polo-Polo bei Coroico. Nord Yungas, Buchtien 3352 (GH, US). Sud Yungas, La Paz-Chulumani road, 15.1 km W of Chulumani, 9.3 km from Huancaré, Fay & Fay 2518 (US). La Paz. Mapiri, San Carlos, Buchtien 69 (MO); San Antonio bei Mapiri, Buchtien 1088 (US). Hacienda Simaco, sobre el camino a Tipuani, Buchtien 5159 (NY, US).
BRASIL. Rio de Janeiro. Serra do Itatiaga, Taquaral, Brade 10219 (R). sin. loc., Damazio 998 (R). Río Grande do Sul. São Paulo, Wacket 20908 (NY). Serra do Mar, Wacket 107 (NY). Taranapiaçaba, Brade 8393 (NY). Fazenda Santo Amari, Spannagel 314b (UC, US).
COLOMBIA. Antioquia. Medellín, Santa Elena, Stanislas 1713 (US).Tranvía del Oriente, 22 km N of Medellín, Archer 1686 (US). Las Orquídeas, Vereda Calles, Parque Nacional Natural Las Orquídeas, Quebrada Honda, Pipoly et al. s. n.(MO). Vicinity Planta Providencia, 28 km SW of Zaragoza, valley of the Río Anorí in areas surrounding the confluence of Quebrada La Tirana and Río Anorí, ca. 3 km up river from Planta Providencia, Alverson et al. 383 (MO, NY). Río Guapá, hills 6 km E of Guapá, 53 km S of Turbo, Haught 4663 (US). Cauca. Baja Calima, Concesión Pulpapel, Buenaventura, Monsalve 1275, 1451 (ambos MO). SW slopes of Cerro Munchique, 40 km W of Popayán, Tryon & Tryon 6005 (GH). La Gallera, Micay Valley, Cordillera Occidental, Killip 7682 (GH, US). Chocó. Municipio de Río Sucio. Parque Nacional Natural Los Catios, alrededores del Campamento de Tilupo, Forero et al. 1726 (MO). Hills above junction of the Río Capá and the Río Mumbí, upriver from Lloró, Juncosa 1481 (GH, MO). Mojarras del Tadó, 8.5 km east of Istmina, Lellinger & de la Sota 386, 421 (ambos LP, US). NW side of Alto del Buey, trail along ridge from the confluence of the forks of Río Mutatá above the Río Dos Bocas to the top of Alto del Buey, Lellinger & de la Sota 247 (LP, US). Slopes and ridges of Loma del Cuchillo, ca. 15 km WSW of Chigorodó, Lellinger & de la Sota 640 (LP, US). 0.3 km E of the Ciudad Bolívar-Quibdo Road, across the suspension bridge at. ca. Km 141, Lellinger & de la Sota 881 (LP, US). Chocó-Valle. At and on both sides of the principal ridge of the Serranía de Los Paraguas, along the trail from El Cairo to Río Blanco, ca. 8 km SW of El Cairo, Lellinger & de la Sota 817 (LP, US). Huila. Cordillera Oriental, Camp La brisa, 25 km ESE of Baraya, Little 8870 (US). Magdalena. Santa Marta, Smith 1129 (NY). Meta. Central Mountains, Pico Renjifo, Philipson et al. 2151 (US). Reserva Nacional La Macarena, Pico Renjifo, Idrobo 2499 (US). Sierra de La Macarena, Central Mountains, N ridge, Philipson & Idrobo 1960 (US). Villavicencio, hill back of Tres Esquinas, Schiefer 767 (GH, MO, US). Nariño. Quebrada Mongón at Camp Mongón of Cia. Minera de Nariño, Río Telembí above Barbacoas, Ewan 16878 (GH, US). Norte de Santander. Pica-Pica Valley above Tapatá (N of Toledo), Killip & Smith 20221 (GH, US). Bellavista: on Pipeline, Foster & Foster 1675 (GH); Km. 16 between Puerto Wilches and Puerto Santos, Killip & Smith 14861 (GH). Santander: Ridge 5 km NE of Coromoro, 17 km ENE of Charala, Ewan 15662 (GH, US). Valle. N shore of Buenaventura Bay, Killip & García 33344 (US)
COSTA RICA. Puntarenas. Osa Península, 1 km S of Tropical Science Center Field Station and ca. 17 km S of Rincón de Osa, Lellinger 692 (US). Along road between Cahacarita and Rincón de Osa, ca. 6 km W of InterAmercan Highway at Chacarita, Croat & Grayum 59710 (MO). Alajuela. Viento Fresco, Standley & Torres 47774 (US); NW of Zarcero, ca. 2 km W of Zapote, on dirt road to Santa Elena, Lellinger 1368 (US). Heredia. Vara Blanca, between Poás and Barba Volcanoes, Maxon & Harvey 8313 (US). Along the Río Vueltas (upper Río Patria), at end of Rte. 113, 9 km N of Ángeles, Stolze 1621 (US). Braulio Carrillo. Braulio Carrillo National Park, Hennipman et al. 6784 (US). Parque Nacional Braulio Carrillo, Estación Carrillo, Quebrada Sandijuela, Gómez et al. 22921 (MO). San José: along Río Zurquí, upstream from highway N of tunnel, Smith et al. 1667 (MO). Tablazo, Valerio 306 (US). El Gallito, Valerio III.57 (US). Cartago. Estrella, Cooper 6059B (US). Cerro de La Carpintera, Standley 35594 (US). El Muñeco, S of Navarro, Standley 33642 (US). SE of Orosi, ca. 2.2 km SSE of Purisil, above Finca La Concordia, at the head of the valley, Lellinger 1481, 1520 (ambos US). La Carpintera, Torres 153 (US). In ravine at Cervantes, Scamman 6992 (US); Santa Clara de Cartago, Maxon & Harvey 8151 (US).
CUBA. Oriente. Slopes of La Bayamesa, crest of the Sierra Maestra near Aserradero San Antonio de Las Cumbres, Morton 9303, 9257 (ambos US). Crest of the Sierra Maestra, between Pico Turquino and La Bayamesa, Morton & Acuña 3673 (US). Sierra Maestra, W slope of Loma Joaquim, Ekman 14467 (US). La Bayamesa, on the ridge between Río Oro and Río Yao, Ekman 7047 (US). N slope of Pico de La Bayamesa, Schultes et al. 563 (GH). El Pinolón, side of Bayamesa, Schultes et al. 695 (GH).
ECUADOR. Carchí. Mira Cantón: Norte del Carmen, camino a Chical, Palacios et al. 9739 (MO). Esmeraldas. Road Lita-Alto tambo, km 175 entrance to reserva Ecológica Cotacachi-Cayapa, Øllgaard y Navarrete 105415 (AAU). San Miguel, upstream from Puerto Cayapos, Holm-Nielsen et al. 25342 (AAU). Río Bolborde a small tributary to Río San Miguel in the upper part of Cayapé River system, Kvist et al. 48282 (AAU). Imbabura. Vicinity of the Río Verde, ca. 5 km SW from the Village of Mani, Río Cachaco, Sperling & Bleiweis 5035 (GH). Morona-Santiago. Mutintza, SE of Makuna, trail to Río Kiritín, ca. 3 km SW of village, Øllgaard & Navarrete 1985 (AAU). Napo. Parque Nacional Yasuní, km 36,6 on the oil road starting at Pompeya, Transect 9, Moran et al. 6195 (AAU). Just outside of Parque Nacional Yasuní, ca. Km 21 on Maxus oil Camp Road Transect 11, Moran et al. 6209 (AAU). Payamino, reserva Florística El Chuncho, Cerón & Manny 2294 (MO, UC). Pichincha. NE of Vicente Maldonado, Reserva de ENDESA, Laegaard 52463 (AAU); Santa Rosa, 18 km S de Nanegalito, Navarrete 799 (AAU). Road El paraíso-Saguangal, 11 km from El Paraíso, Øllgaard et al. 37644 (AAU). Sucumbios. Cerro Lumbaqui (Umahuallacta), just E of Lumbaqui, Øllgaard & Navarrete 1816 (AAU). Trail Chuscuyacu- Río Candué, Øllgaard 99683 (AAU). Zamora - Chinchipe. Cordillera del Cóndor, Chinanpuntza trail to destacamento Mayayco Alto, Øllgaard 98389 (AAU). Road Zamora -Gualaquiza, 10 km of Los encuentros, Øllgaard 99810 (AAU). Road between Loja and Zamora, ca. Km 16-18, Luteyin et al. 6582 (AAU).
GUATEMALA. Alta Verapaz: "in walde in Pansamala," von Tuerkheim 998 (K, US). Huehuetenango. Vic. of Maxbal, ca. 17 mi N of Barillas, Sierra de Los Cuchumatanes, Steyermark 48786 (US).
GUAYANA FRANCESA. Cayenne. Montagne de L'Inini, zone centrale, forêt sur pente, face E, Cremers 9089 (MO). Piste de Bélizon vers Montagne Tortue, pk. 31,2 (Bassin de la Comté), Billiet et al. 6318 (MO).
JAMAICA. Portland. Hardwar Gap, along trail to falls, Crosby et al. 530 (GH). Hardwar Gap, Proctor 4419 (MO). SE slope of Caledonia Peak, Proctor 22530 (MO). Sin. loc., Sherring s.n. (US 1421987, 1421988). St. Andrew. Blue Mountains, Big Gulch, Morces Gap Trail, Seifriz s.n. (US). Catherines Peak, 27 Jun 1932, Pappenfuss s.n. (US).
MEXICO. Chiapas: Tonehuitz, Muench 159 (US). Oaxaca.Ixtlán-Tuxtepec road, 35-39 km S of Valle Nacional, Mickel 1552 (UAMIZ, US). Distr. Villa Alta: Valley of the Yelagago River ca. 20 min. NE of Villa Alta, Mickel 962 (US). Entre Puerto Eligio y Comaltepec, Km. 154 entre Tuxtepec y Oaxaca, Martínez Calderón 399 (US).
PANAMÁ. Chiriquí. Between Alto Las Palmas and the top of Cerro de La Horqueta, Maxon 5518 (US). Vicinoty of El Boquete, Cornman 1082, 1207 (ambos US). Fortuna Dam Site, along trail following the continental divide, van der Werff & van Hardelveld 6757 (US). San Blas. El Llano-Carti Road, 17.5 km from International Highway, De Nevers & Herrera 4003 (US). Darién. Cerro Sapo, ca. 5 km south of Garachiné, Hammel et al. 14863 (MO). Ca. 6 km S from the gold mining camp at Cana up the fila leading W to the Alturas de Nique, Lellinger 1970 (US). Panamá-San Blas. Trail from end of road past Los Altos de Pacora, region of Cerro Jefe, on Cerro Brewster, Hammel & Nevers 13550 (MO).
PARAGUAY. Cordillera de Cerro León, Balansa s.n. (CTES).
PERÚ. Amazonas. Bagua. Ca. 25 km (by trail) E of La Peca, Barbour 2969 (MO). Bagua. Ca. 40-43 km of Chiriaco, Barbour 4520 (NY). Cuzco. La Convención. Above Camp 2, ca. 10 km walking distance NE from Hacienda Louisiana and the Apurimac River, Dudley 10412 (GH). Paucatambo. Bosque de Las Nubes, Río La Unión, León et al. 2892 (US). Huánuco. Tingo María. Tryon & Tryon 5278 (GH, US). Junín. Chanchamayo Valley, Schunke 156 (US). Pasco. Oxapampa. Palcazu Valley, Río Caczu, above confluence with Río Bocaza, near guardpost on road in construction to Puerto Bermudez, Foster & Smith 9421 (MO). Gran pajonal, vic. of Chequitavo, Smith 5294 (MO). Rioja. Venceremos. Pedro Ruiz-Moyobamba Road, km. 390, Smith et al. 4691 (MO). San Martín. Tingo María, Allard 20908 (GH). Mariscal Cáceres Province, Dist. Tocache Nuevo, vicinity around Tocache, Schunke 8615 (MO, UC). La Divisoria, about 25 km NE of Tingo María on the road to Pucallpa, Moran 3698 (MO). La Divisoria, between Tingo María and Aguaytia, Cordillera Azul, Gentry et al. 41466 (MO). E of Tingo María, Allard 20908, 21368, 21557 (todos US). Tarapoto. Fundo de la Biodiversidad de la Universidad San Martín de Tarapoto, km 20, Guipúzcoa 858 (AAU).
PUERTO RICO. Adjuntas. Cordillera Central, Barrio Portugués. ca. 0.9 km due SW of Alto de La Bandera, Proctor 42131 (US). Cordillera Central, Toro Negro State Forest, Road 143, Km. 15.2-15.4, Proctor 41273 (US). Jayuya. Toro Negro State Forest, summit area of Monte Jayuya, Proctor 40144 (US). Naguabo. Along stream bed from Pico del Este to the Río Prieto waterfall, Nevling & Evans 144 (GH). Ponce. Barrio Anón, along headwaters of the Río Inabón above high falls, Proctor 40068 (US). Utuado. Mt. Morales, near Utuado, Britton & Marble 1072 (US).
REPÚBLICA DOMINICANA. Carlos Díaz. Cordillera Septentrional, Ligier 12716 (US). Monte Cristi. Cordillera Central, Lagunas del Cenobí, Ekman 12859 (US).
VENEZUELA. Amazonas. Cerro de la Neblina, Río Yatua, Maguire et al. 36865 (US). Bolívar. Bolívar: Vicinity of km 134 bordering headwaters of the Río Cuyuni, NE of Luepa, Steyermark & Nilsson 493 (US). Entre Las Parchitas, Tierra Fría y Ojo del Agua, Ortega & Smith 2508 (AAU). Distrito Federal. Depto. Vargas. Serranía de La Costa, 2-6 km NW of La Victoria- Colonia Tovar highway, along the road to Costa de La Maya, ca. 8-12 km W of Colonia Tovar, Davidse & Miller 28137 (MO). Aragua. Prope Colonia Tovar, Fendler s.n. (GH, MO). Guanare. Portuguesa. ESE of Paraíso de Chabasquén, road to Córdoba, ca. 20-25 km from Chabaquén, Smith 956 (MO). 15 km al E de Chabasquera, 67 km al NNO de Guanare, Steyermark et al. 126684 (AAU, GH, MO). Jiménez. Parque Nacional Cayambí, 10-14 km by road SE of Sanare, ridges of Fila Potreritos, between Alto del Viento and El Volcán, Davidse & González 21262 (US). Mérida. Near Mérida, Gabaldoni s.n. (US 1059319). Dto. Andrés Bello, La Carbonera, ca. 13 miles NNW of Jají along Highway 4 property of the Universidad de Los Andes, Smith et al. 1463 (MO). Quebrada de Los Salichales, tributary of Río Canaguá, Steyermark 56435 (US). Between Mucuchachí and Canaguá, along the canyon of the Río Canaguá, Steyermark 56351 (GH, MO, US). Morán. Lara. Carretera desde Humacaro Alto hacia Guaito, van der Werff & Rivero 7903 (US). Yacambí, Torres et al. 133 (MO). 8.7 km SE of Sanare, in Parque Nacional Yacambí (3.4 miles beyond park entrance), Smith et al. 1246 (MO). Sucre. La Divisoria de La Concepción, van der Werff et al. 7901 (MO). Los Paramitos, 20 km por aire al SO de Biscucuy, Ortega et al. 1834 (MO). Sierra de Aroa, 15- 20 km NW of Cocorote, on road to Aroa, from 1 km SE of Los Cruceros to El Refugio, ca. 11 km W of San Felipe air distance, Liesner & González 10096 (MO). Táchira. Distrito Junín: southern slopes of Cerro San Isidro, directly N of El Reposo, above Hacienda Bella Vista, Quebrada Agua Caliente and tributaries, Davidse & González 22084 (US).
Observaciones: Danaea moritziana es una especie geográficamente extendida. Es característica por sus frondas imparipinnadas con láminas oblanceolada, con una pinna terminal siempre más grande que las laterales y con la base más ensanchada. Tiene hasta 15 pares de pinnas laterales muy distanciadas entre sí, un rasgo notablemente constante y obvio (en frondas jóvenes la distancia es menor pero el carácter es igualmente apreciable), oblongo-lanceoladas, falcadas. Los ápices de las pinnas no representan un rasgo diagnóstico estable en todas las especies del género, pero en el caso D. moritziana son muy característicos, atenuados, largos, incurvados y aserrados, tanto en plantas juveniles como adultas (Fig. 31 K-R) y los márgenes son enteros. Las venas son más bien próximas, finas, del color del tejido foliar o algo más oscuras, se bifurcan regularmente cerca de la costa y se mezclan con simples (más frecuentes en plantas jóvenes). Los modelos epidérmicos son sinuosos frecuentes con ondas regulares poco profundas en epifilos y sinuosos distantes con ondas irregulares y muy profundas en hipofilos, en ambos con paredes delgadas y uniformes y los estomas son maratiáceos. Los tipos de D. jamaicensis y D. urbanii coinciden con D. mortiziana en todos los rasgos mencionados y en tamaño de la esporas. La división de la lámina, los caracteres externos de las pinnas, la venación, los rasgos de la morfología interna de las frondas y las esporas han sugerido, igualmente, la inclusión de D. acuminata y D. falcata en D. moritziana. En el caso de D. acuminata, el grado de desarrollo observado en la epidermis y los estomas indicaría que se trata de plantas no completamente maduras. En el caso de D. falcata, los ejemplares no se diferencian de algunos determinados como D. cuspidata, cuyo tipo se ha estudiado aquí, y que ocasionalmente pueden tener venas algo más próximas que lo común en D. moritziana pero coinciden en los demás rasgos estudiados. Esporádicamente aparecen plantas de D. moritziana con frondas paripinnadas y yemas prolíferas en las que se observa asimismo un incremento en la proporción de esporas anormales (colapsadas o retorcidas), pero la presencia de pinnas terminales grandes y basalmente ensanchadas es la condición más común. Parece ser una de las especie más tolerantes del género y se encuentra en suelos pobres en nutrientes o altamente mineralizados por acción humana (cerca de plantas de fabricación de papel, con Al abundante), y en esos casos, desarrolla láminas más coriáceas y venas más próximas. El tamaño de las esporas es constante en poblaciones de toda el área de distribución y sugiere un diploide. Danaea mazeana es fenotípicamente muy similar a D. moritziana, pero su venación es algo variable, los estomas son porociclocíticos, tiene esporas casi del doble del tamaño de aquélla y un área más restringida.
10. Danaea nodosa (L.) Sm., Mém. Roy. Acad. Turin 5: 420. 1793. Acrostichum nodosum L., Sp. Pl. 1070. 1793. LECTÓTIPO: Pl. 108, "Traité" de Plumier (1705), basado en una planta coleccionada por Plumier cerca de Portaux Paix, Haití y La Martinica, elegido por Underwood (Bull. Torrey Bot. Club 29: 671. 1902).
Danaea longifolia Desv., Ges. Naturf. Fr. Berl. Mag. 5: 307. 1811. TIPO: "In Antillis" sin coll. (holótipo, P, no visto; foto del tipo US!), sinonimizado por Weatherby (Contr. Gray Herb. 94: 23. 1936).
Danaea angustifolia C. Presl, Suppl. Tent. Pterid. 35 (postpr. 295). 1845. TIPO: Antilles, Bertero s.n. (holótipo, P, no visto; foto del tipo US!, isótipo, PRC!). Syn. nov. (Figs. 30, 31 F-I).
Danaea sellowiana C. Presl, Suppl. Tent. Pterid. 37 (postpr. 297). 1845. TIPO: Brasil. "Habitat in Brasil," Sellow (Holótipo, PRC, isótipo, R, no vistos; foto del isótipo PRC!). Syn. nov.
Danaea elata Liebm., Kongel Danske. Vidensk. Selsk. Skr., Naturvidensk. Afd. V, 1:306 (repr. 154). 1849. TIPO: México. Edo. Veracruz. Barranca de Isapa, Hacienda de Jovo, Liebmann Pl. Mex. 2199, Fl. Mex. 848 (C no visto), sinonimizado por A. R. Smith (Fl. Chiapas 2: 89. 1981).
Danaea cordata Fée, Cryp. Vasc. Brésil 1: 216, t. 71, f. 5. 1869. LECTÓTIPO (designado aquí): Brasil. Río de Janeiro. Corcovado, Glaziou 451 (US!, isolectótipo, P, no visto). El otro elemento del síntipo es: Brasil. Río de Janeiro. Corcovado, Glaziou 1686 (P, C, no vistos; fotos US!). Syn. nov.
Danaea nigrescens Jenm., Gard. Chron. 24: 413. 1898. TIPO: Guyana. Jenman 53 (holótipo desconocido, isótipo US 1120090!). Syn. nov.
Danaea grandifolia Underw., North Amer. Fl. 16(1): 18. 1909. TIPO: Colombia. Magdalena. Valparaiso, Sta. Marta, Smith 992 (holótipo NY!, isótipos BM, F, MO no vistos; isótipos GH! US!). Syn. nov.
Danaea bicolor Tuomisto & R.C. Moran, Fl. Ecuador 66: 29. 2001. TIPO: Ecuador. Sucumbios. Trail at Río Ushaué N of Coop. Flor del Valle, 2,5 km W of bridge over Río Aguarico at Lumbaqui, Øllgaard 99719 (holótipo, QCA, no visto; isótipo AAU!). Syn. nov.
Danaea erecta Tuomisto & R.C. Moran, Fl. Ecuador 66: 37. 2001. TIPO: Ecuador. Pichincha. Maquipucuna Biological Field Station, ca. 5 km E of Nanegalito, Moran 5950 (holótipo, QCA, no visto; isótipos, QCNE, TUR, no vistos; isótipos AAU! NY! UC!). Syn. nov.
Danaea latipinna Tuomisto & R.C. Moran, Fl. Ecuador 66: 46. 2001. TIPO: Ecuador. Pinchincha. Reserva Forestal Puerto Quito (ENDESA), km 113 of Quito-Puerto Quito Road, 8 km E of Puerto Pedro Vicente Maldonado, Moran et al. 6023 (holótipo, QCA, no visto; isótipos, AAU! UC!). Syn. nov.
Danaea longicaudata Tuomisto, Fl. Ecuador 66: 50. 2001. TIPO: Ecuador. Pichincha. Reserva Forestal Puerto Quito (ENDESA), km 113 of Quito-Puerto Quito road, 8 km E of San Pedro Vicente Maldonado, Moran et al. 6025 (Holótipo, QCA, isótipos, QCNE, TUR, NY no vistos; isótipo AAU!). Syn. nov.
Plantas terrestres grandes, de hasta 2 m de altura. Rizomas postrados largamente o cortamente rastreros, ascendentes y hasta erectos, fuertes, gruesos, con raíces cordeliformes abaxiales y laterales, a veces subaéreas, y estípulas carnosas amiláceas. Estípites numerosos, más bien próximos, abaxialmente y adaxialmente bisurcados, con 1-2 surcos profundos laterales, rígidos y gruesos, sin pulvínulos en estado adulto, pero a veces con 1 pulvínulo algo indiferenciado en etapas juveniles y tejidos parenquimáticos internos con escaso almidón. Protoscamas peltadas irregulares, con cuerpo pluricelular prolongado en brazos unicelulares que rematan en células cilíndricas con escaso mucílago o sin él en plantas adultas. Lámina estéril anchamente oblonga u oblanceolada, siempre imparipinnada, concolor, más clara en el hipofilo, a veces de color amarillo brillante en juveniles y más oscura en adultos; yemas prolíferas ausentes o muy raras. Pinna terminal oblonga ancha, oblanceolada, elíptico-lanceolada o lanceolada, de igual tamaño que las laterales o más comúnmente, más pequeña. Pinnas laterales 6-8 pares, insertas en un raquis oscuramente alado, distantes hasta 7- 8 cm en plantas adultas, de 15-18 (35 cm de largo por 3,5 -6,5 (7,2) cm de ancho, oblongas, oblanceoladas o espatuladas en plantas adultas, pero algo variables en contorno y ancho en el curso del desarrollo, con base más o menos redondeado-cuneada, ápice redondeado con un mucrón aserrado flexible, no incurvado, de longitud variable y márgenes repandos u ondulados. Lámina fértil oblonga, más reducida, con 12-14 (18) pares de pinnas elípticas de 5-8 (11) cm de largo por 1-2 (2,5) cm de ancho, más o menos carnosas. Venas simples y geminadas, horizontales, en ángulo recto con la costa, muy próximas y paralelas, apenas curvadas en el margen formando una vena comisural no muy gruesa. Indumento cerca de las venas, sobre éstas y sobre la costa, el superficial algo escaso en plantas adultas; tricomas estrellados y protoscamas mucilaginíferas estrelladas irregulares, grandes. Modelos epidérmicos sinuosos, sinuosidades muy frecuentes y algo someras en epifilo e hipofilo, sin engrosamientos localizados; estomas maratiáceos grandes, elípticos u oblongos. PIP verrucosas muy escasas o esparcidas. Esporas elipsoidales de 25 x 20 ìm, equinadas, con periporio liso y exosporio con espinas conicas largas y más bien agudas, discretas y distantes, con los extremos cubiertos por micro-ornamentación granular.
Distribución geográfica y ecología: México, América Central, Antillas (Jamaica, Cuba, Puerto Rico, Haití, República Dominicana, Guadalupe, Grenada, Dominica) y Sudamérica (Trinidad, Venezuela, Colombia, Ecuador, Perú, Bolivia, Guayanas, Brasil, Paraguay). En selvas bajas, en galería, montanas y pedemontanas, en suelos húmedos a inundados, cerca de corrientes de agua, desde el nivel del mar hasta 2000-2500 m de altura.
Material examinado
BELIZE. Middlesex. Schipp 422 (US). Stann Creek District, Hummingbird Highway, Gentle 8379 (US).
BOLIVIA. Beni. Ballivian. Colegio Técnico Agropecuario de Río Colorado, Fay & Fay 2118 (US). La Paz. Franz Tamayo, 42 km al W y 1 km al N de Rurrenabaque, Helme 236 (AAU).
BRASIL. Mato Grosso. Mun. Alta Floresta: ca. 50 km from Alta Floresta, Windisch 4759 (AAU, US). Minas Gerais. Viçosa Agricultural College lands, Corrigo Ribeiro, Mexia 4900 (US). Rio de Janeiro. Trapicheira, Brade 10370 (R). Santa Catarina. Joinville, Schmalz s.n. (MO). Braço Joaquim, Luis Alves, Itajaí, Reitz & Klein 2859 (US). São Paulo. Morro das Pedras, Brade 8212 (US).
COLOMBIA. Amazonas. Vaupés, Río Apaporis, entre gel Río Pacoa y el Río Kananarí, Soratama, Schultes & Cabrera 13698, 13716 (ambos US). Antioquia. Dos Bocas, on the Río Nechi near Pato, Ewan 15823 (US). Cauca. Bitaco road, 1 km N of junction with main road to Dagua (and Buenaventura), Hutchison & Idrobo 3076 (US). Chocó. Near Punta San Francisco Solano, ca. 10 km NE of Puerto Mutis, Lellinger & de la Sota 88 (US). Trail above water supply inpoundment W of Puerto Mutis (Bahía Solano), Lellinger & de la Sota 10, 14 (ambos US). Mojarras del Tadó, 8.5 km E of Itsmina, Lellinger & de la Sota 395, 416 (ambos US). Slopes and ridges of Loma del Cuchillo, ca. 15 km WSW of Chigorodó, Lellinger & de la Sota 632 (US). Río San Juan, 3.5 km SW of Andagoya, just NE of the mouth of the Río Suruco, Lellinger & de la Sota 508 (US). Trail to Miniquía, E of Puerto Mutis, Bahía Solano, Lellinger & de la Sota 22 (US). Quibdo Road, 0.3 km E of Ciudad Bolívar, across the suspension bridge at ca. km 114, Lellinger & de la Sota 893 (US). Upper Río Truando, 2 km SSW of the confluence of the Río Nercua, near the Madurex Camp, Lellinger & de la Sota 578 (US). Río El Salto, tributary of the Río Suruco, 9 km W of Andagoya, Lellinger & de la Sota 477 (US). Cabita Bay, Cape Corrientes, Taylor 1243, 1252 (ambos US). Magdalena. Cincinnati, Lower slopes of Mt. San Lorenzo, near Santa Marta, Seifriz 27 (US). Nariño. Río San Juan, near junction of the Río San Juan drainage, Río Perlasbi, Ewan 16049 (US). Pambana, between the Río Pimbi and the Río Cuembí, on the Río Telembí, Ewan 16839 (US). Santander. Vicinity of Puerto Berrío, between Carare and Magdalena Rivers, Haught 1841 (US). Valle. Calima, on the Río Calima, Cordillera Occidental, Killip 11236 (US). Cordillera Occidental, La Cumbre, Killip 11578 (US).
COSTA RICA. Alajuela. NW of Volcán Arenal, ca. 2 km NE of Tabaco, Lellinger & White 1644 (US). Near Artezalea and Methodist Rural Center, ca. 8 km NE of Villa Quesada, Molina et al. 17252 (US). Bois de Santiago, prés San Ramón, Tonduz 17584 (US). Cartago. 16 km SE of San Isidro del General, ca. 1 km off Highway 2, along Río Pacuare, Funk et al. 3041 (US). Virgen del Socorro-Río Sarapiquí-Cariblanco, Chacón & Herrera 1199 (AAU). Isla de Coco. Near Wafer Bay, Dressler 4478 (US), Stewart 225 (US). Limón. Hacienda Parismina, Banana Co., Jiménez 1048 (US). Heredia. Puerto Viejo, a son confluent avec le Sarapiquí, Biolley 6923 (US). Upstream from Puerto Viejo, ca. 4 km at Finca La Selva, Mickel 4390, 3504 (ambos US). Puntarenas: Sabanillas del Limoncito, Coto Brus, Gomez 22035 (UC, US). San José. Vicinity of El General, Skutch 2180 (US).
CUBA. Oriente. Pinar del Río: mountains near El Guama, Palmer & Riley 191 (US). Las Villas: Trinidad Mtns., Buenos Aires, Morton 10369 (US). Arroyo Trinitario, Río Negro, Britton & Britton 5185, 5803 (ambos US). Santa Ana, Maxon 4188 (US). Jateras, Monte Verde, Maxon 4332 (US). Northern Spur of Sierra Maestra, W of Río Yao, Morton & Acuña 3480 (US). Near Baracoa, at the top of the Yunque, Ekman 3928 (US).
DOMINICA. Laudat, Eggers 963 (US).
ECUADOR. Chimborazo. Cordillera Occidental, ad radices montis Chimborazo, Rimbach [Rosenst. Fil. Ecuad. Exs.] 45 (US). Mountains in Sacramento area, Wiggins 11076 (US). Esmeraldas. Road Lita-Urbina, km 38.8, Øllgaard et al. 98685 y 98693 (ambos AAU). Road Lita-Altotambo, km 17.5, entrance to Reserva Ecológica Cotacachi-Cayapa, Øllgaard & Navarrete 10416 y 10420 (ambos AAU). Road Lita-Altotambo, km 16.5, Øllgaard & Navarrete 10461 (AAU). Guayas. West Cordillera, region of the Upper Guayas River, Rimbach 15 (US). Morona-Santiago. Pachicutza, at Escuela Cardenal Dopfner, km 140 on road Loja- Gualaquiza, Holm-Nielsen et al. 4503 (AAU). Matinza, foothills of Cordillera Cutucú just east of villlage, Øllgaard & Navarrete 1510 (AAU). Gualaquiza, along road east from Sevilla, 5 km S of Gualaquiza, along Bomboiza river, Fay & Fay 4199 (AAU, MO). Trail along Río Inimikis, ca. 3 km NE of Village of Inimikis (San Luis) toward foothills of Cordillera Cutucú, Øllgaard & Navarrete 1417 (AAU). Napo. Reserva Biológica Jatún Sacha, Río Napo, 8 km E de Misahualli, Cerón 1097 (UC). Cascada San Rafael, Moran et al. 6283 (AAU). Valley of Rio Oyacachi, ca. 10 km along road W of El Chaco, ridge SE of rio San Juan Grande, Øllgaard & Navarrete 1685 (AAU). Parque Nacional Yasuní, estación Científica Yasuní, por el río Tiputini, Moran et al. 6064 (AAU). Jatún Sacha Biological Station, 8 km east of Misahualli, Fay & Fay 2751 (AAU, MO). Pastaza. Montalvo, on he río Bobonaza, Øllgaard et al. 35383 (AAU). Río Capihuari, tributary of Río Pastaza, Øllgaard et al. 35124 (AAU). Bolívar: Carretera Guaranda-Caluma, 45 km desde Sanata Fe, Navarrete 739 (AAU). Pichincha. 20 km W of Sto. Domingo de Los Colorados, Cazalet & Pennington 5275 (US). Loma Bombolí, just NW of St. Domingo de Los Colorados, Øllgaard & Larrea 98851 (AAU). Reserva Ecológica Mindo-Nambillo, Navarrete 422 (AAU). Road Pacto-La Delicia-La Esperanza, Øllgaard et al. 2221 (AAU). Reserva Forestal Puerto Quito, ENDESA, ca. 8 km E of San Pedro Vicente Maldonado, Moran et al. 6024 (AAU). NE of Vicente Maldonado, Reserva ENDESA, Laegaard 54858 y 51677 (ambos AAU). Reserva Forestal ENDESA, along Río Silanche NE of Vicente Maldonado, Øllgaard et al. 2268 (AAU). Zamora- Chinchipe. Zamora, within 3 km of Zamora, Fay & Fay 4367 (AAU).
GRENADA. Sin loc., Sherring s.n. (US 830714).
GUADALUPE. Morne Gommier, Dusén 4318 (US). Bois Superieurs de la Grand Anse, Dusén 1687 (US). Baines Jaunes, Questel 3200 (US).
GUATEMALA. Alta Verapaz. Cubilquitz, von Tuerckheim 8336 (US). Vic. of Cacao, between Panzós and Senahú, Barber 169 (US). Izabal. Río Perdonalis SW of Izabal, Johnson 1252 (US).
GUAYANA FRANCESA. Region de l'Inini. Mont Atachi Bacca, extremité N camp II, Cremers et al. 10360 (US).
HONDURAS. Santa Bárbara. San Pedro Sula, Thieme 5661 (US). Atlántida. Lancetilla Valley, near Tela, Standley 53145 (US). Lancetilla Valley, Tela área, Steeves & Ray 379 (US).
JAMAICA. St. Catharine. Vicinity of Hollymount, Mt. Diablo, Maxon 2255 (US). St. Mary: Near Castleton, on the road to Annetto Bay near junction of Ugly River with Wag Water, Maxon 794 (US). Portland. Spur of the John Crow Mountains opposite Mill bank, Maxon 9336, 9348 (ambos US). St. Thomas. Mansfield, near Bath, Maxon 1811 (US). Near Cuna-Cuna Pass, Maxon 1761 (US). sin. loc., Hart 25 (US). Trelawny. Cock-pit country, ca. 8 miles N of Quick Step, above Aberdeen P. O., Proctor 4128 (US).
HAITI. Morne Chavary, vic. of S. Louis du Nord, Leonard & Leonard 14584 (US). Massif des Cahos, Gr. Las Caobas, Morne Dos-Bois-Rouge, Ekman 5551 (US).
MEXICO. Oaxaca. Usmapampas, road from Sarabia off Highway 185 to Esmeraldas, along lumber road south 16 km, Hammel & Merello 15596 (US). Ixtlán: 29 km S of Valle Nacional, 80 km N of Ixtlán de Juárez, E of Campamento Vista Hermosa along path down to Río Soyalapán, Hallberg 1287 (US). Ixtlán: 29 km S of Valle Nacional, 80 km N of Ixtlán de Juárez, trail E of route 175 at Campamento Vista Hermosa toward Ladú, 1 hour bike down to Río de La Trucha, Mickel 6408 (US). Chiapas. sin. loc., Purpus 6760 (US).
NICARAGUA. Sangsangta. Segovia Distr., Schramm 14 (US).
PANAMA. Canal Zone. Barro Colorado Island, Gatun Lake, Maxon et al. 6866, Standley 31405 (ambos US); Cerro de La Plata, nr S. Félix, E Chiriqui, Pittier 5166 (US). Juan Díaz, Killip 2515 (US); Pipeline Road, Agua Salud, Kennedy & Andrews 1889 (US). Chiriqui. Bocas del Toro. Laguna de Chiriqui and vicinity, Hart 6a (US). Los Santos: West Coast, Bahía Honda, Taylor 1363 (US). Colón. Vicinity of Porto Bello, Maxon 5750 (US). San Blás. Cordillera frente a Isla Narganá, quebrada afluente del Río Diablo, Galdanes 1534 (US).
PARAGUAY. Estancia Golondrina, Reserva Privada Ypeli, Zardini & Hellman 48901 (MO).
PERU. Junín. Puerto Bermudez, Killip & Smith 26511 (US). Pampayacu, Kanehira 127 (US). Loreto. Varadero de Mazán, from the Río Amazonas to the Río Napo, Croat 19432 (US). Maynas, Cerro Paleta, Flores A-360 (AAU). Caserío Roca Eterna, Río Amazonas, Flores et al. 195 y 214 (AAU).ç
PUERTO RICO. Corozal. Forested gully above Corozal, Britton et al. 8349 (US). Mayagüez. Mayagüez, Hess 198 (AAU, US). San Narciso, Britton 7304 (US). Naguabo. Sierra de Naguabo, vicinity of La Florida, Shafer 3797 (US). Ponce. Arroyo Los Corchos, between Adjuntas and Jajuya, Britton et al. 5241 (US). San Juan. Near Pueblo Viejo, Britton 8091 (US). Yabucoa. Cerro Gordo, Kuhn 2596 (US).
REPUBLICA DOMINICANA. Barahona. Vicinity of Paradis, Abbott 1652, 1661 (ambos US). Monte Cristi. Sabaneta, Las Cidras, Valeur 526 (US). Samaná. Península de Samaná, Sánchez, Ekman 15926 (US). Santiago. Cordillera Central, Monción; SW spur of Monte Gallo, Ekman 12900 (US). Seibo. Los Haitises, La Mina, El Jovero, Miches, Jiménez 5802 (US). Monte Bonito, Parque Nacional Los Haitises, Zanoni et al. 35427 (US). Vega. Vicinity of Piedra Blanca, deep ravine along the Maimon River, 1.5 mi above Piedra Blanca, Allard 13956 (US).
SAN VICENTE. Cumberland Mountain, Morton 5896 (US). Valley of north fork of the Cumberland River, Morton 5476 (US).
SURINAM. Brownsberg, B. W. 3338 (US). Boschreserve, B. W. 6262 (US).
TRINIDAD. Maracas, before Falls, Hombersley 240 (US).
VENEZUELA. Mérida. 15 km from El Vigía, Vareschi & Pannier 1670 (US).
Observaciones: El contorno de las pinnas, el mucrón central del ápice y la venación son muy característicos y permiten reconocer incluso las fases de desarrollo, a veces algo diferentes entre sí pero que coinciden en los rasgos mencionados y en los modelos epidérmicos. En algunas plantas juveniles puede aparecer un pulvínulo poco diferenciado en el estípite, que probablemente se atrofia durante el desarrollo (como sucede ocasionalmente en esporófitos de otras Marattiaceae, como Angiopteris, Rolleri, 2001). Las esporas son normales en una proporción considerable (70 %) y no se observaron aberraciones o anomalías.
En algunos ejemplares jóvenes procedentes de Ecuador las pinnas son muy delicadas, esponjosas y pueden presentar hipofilos de color amarillo claro. Todos los ejemplares de estas características se estudiaron anatómicamente y tanto el modelo epidérmico como los estomas son inmaduros. Es posible que la maduración histológica sea relativamente lenta en relación con el tamaño que alcanza el esporófito y ambos procesos discrónicos, un fenómeno que Lavalle (2002) analizó en Marattia laevis Sm. y que aparece con cierta frecuencia en Marattiaceae (Rolleri, 2002), un grupo en el que la maduración de la epidermis puede prolongarse hasta que el esporófito ha alcanzado un desarrollo apreciable (a veces con una altura de un metro o algo más) y las estructuras esporógenas pueden estar formadas antes de la maduración histológica completa. A expensas de esta condición neoténica (plantas juveniles precozmente fértiles), lo que podrían ser fases de desarrollo de un mismo individuo pueden interpretarse como especies diferentes. La epidermis es un rasgo diagnóstico importante en el reconocimiento de estas fases. Todos los ejemplares de este tipo, procedentes de Ecuador, fueron asignados a D. bicolor por Tuomisto & Moran (2001), pero aquí se han mantenido incluidos en D. nodosa por los rasgos exomorfológicos y anatómicos mencionados. El tipo de D. erecta es idéntico al isolectótipo Glaziou 451 (US) de D. cordata (aquí listada en la sinonimia de D. nodosa), pero en el tipo de D. cordata faltan los rizomas. El material tipo de D. cordata y D. erecta fueron estudiados detalladamente y comparados con material de D. nodosa de toda el área y con los ejemplares AAU citados por Tuomisto & Moran (2001). Las pinnas son característicamente oblanceoladas, a veces levemente espatuladas, más bien angostadas hacia la base, que es redondedocuneada y tienen un ápice redondeado y ancho que se proyecta en un mucrón aserrado no incurvado (Fig. 31 D). Estos caracteres y otros, como el contorno de la lámina, el número de pares de pinnas, el desarrollo de la pinna terminal (menor que las laterales), la ausencia de pulvínulos en el estípite, el patrón de venación, los modelos epidérmicos ilustrados y las esporas, se han considerado aquí rasgos adultos de D. nodosa y están presentes en todo el material mencionado. Es posible que en algunas localidades (Ecuador) existan formas caracterizadas por diferentes direcciones de crecimiento del rizoma, pero esas variantes no han sido vinculadas claramente con otros caracteres y por eso se ha preferido mantener a todas bajo el nombre de D. nodosa. Aunque es un carácter biológico destacable, el tipo de rizoma no se ha interpretado como un carácter específico y se ha incluido en la clave de las especies de manera complementaria. Danaea latipinna está representada por plantas pequeñas con rizomas postrados delgados y pinnas delicadas oblanceoladas anchas (Fig. 31 J). Los caracteres epidérmicos coinciden con los descritos para D. nodosa, pero las frondas son histológicamente inmaduras, por lo que se consideró que podría tratarse de una fase de esa especie. Los ejemplares son estériles o presentan escasas esporas, también iguales a las de D. nodosa, pero más pequeñas y adheridas a las paredes sinangiales (lo que podría indicar, asimismo, falta de desarrollo). Danaea longicaudata está representada por ejemplares de tamaño mediano, sin pulvínulos, con pinnas oblongas u oblanceoladas angostas con ápice redondeado rematado en un mucrón aserrado largo, casi todos estériles, pero con la epidermis y los estomas maduros, cuyos caracteres se corresponden con los de D. nodosa. El material tipo de D. grandifolia pudo estudiarse con todo detalle; el holótipo y los isótipos son ejemplares bien desarrollados de D. nodosa; las esporas del isótipo US son normales y están en los rangos de tamaño de la especie.
11. Danaea oblanceolata Stolze, Amer. Fern J. 77: 33. 1987. TIPO: PERU: Depto. Pasco (as Junín). Cahuapanas, on the Río Pichis, Killip & Smith 26777 (holótipo, US!; fragm. F, no visto). Fig. 32 C.
Plantas terrestres medianas, de hasta 50-70 cm de altura, que crecen en colonias densas. Rizomas cortamente o largamente rastreros, carnosos, amiláceos, con abundantes raíces abaxiales y estípulas pareadas crasas y reservantes. Estípites 5- 6 o más en plantas jóvenes, 2-3 o menos en adultas, flexibles y crasos, distalmente alados, casi tan largos como la lámina y con 1-2 pulvínulos; adaxialmente convexos y abaxialmente apenas canaliculados, densamente cubiertos por indumento; tejidos internos parenquimáticos amiláceos. Tricomas mucilaginíferos y proscamas peltadas pequeñas, campanuladas a estrelladas, con un centro tricomatoso mucilaginífero paucicelular. Lámina estéril lanceada o anchamente lanceolada, paripinnada, con la pinna terminal reemplazada siempre por una yema prolífera, membranácea a translúcida en plantas jóvenes, más firme en adultas. 10-12 (18) pares de pinnas laterales de 7-10 (11,5) cm de largo por 2-2,3 (3,1) cm de ancho, oblanceoladas, con bases asimétricas angostas, ápices agudos subaserrados u obtusos serrulados o cuspidados y márgenes repandos, con costas rojizas o anaranjadas en plantas jóvenes y oscuras en adultos, insertas moderadamente próximas en raquis alados cubiertos por indumento denso. Lámina fértil más larga que la estéril, oblonga, con número similar o mayor de pares de pinnas laterales crasas. Indumento abundante; tricomas, protoscamas campanuladas y formas intermedias entre ambos. Venas simples predominantes y algunas geminadas (muy escasas). Modelos epidérmicos sinuosos, sinuosidades muy frecuentes y muy someras en epifilos, curvas y angulosas en hipofilos, con células de paredes muy delgadas; estomas maratiáceos. PIP filamentosas muy delgadas y enmarañadas, abundantes. Esporas con exosporio equinado, con espinas cónicas agudas, discretas.
Distribución geográfica y ecología: Colombia, Ecuador y Perú. Selvas lluviosas bajas y montanas, prístinas o perturbadas. En suelos arenosos y cerca de corrientes de agua; desde el nivel del mar hasta 1000 m de altura.
Material examinado
COLOMBIA. Antioquia. Río Guapá, 6 km E of Guapá, 53 km S of Turbo, Haught 4662 (NY, US). En selvas entre Río Guapá y León, Ruiz Landa et al. 18362 (US). Chocó. Ca. campamento Dos Bocas, Quebrada Murduquera en dirección O por el camino a Jurubidá, Barbosa 6712 (MO). Slopes and ridges of Loma del Cuchillo, ca. 15 km WSW of Chigorodó, Lellinger & de la Sota 651 (LP, US). Bahía Solano, near ciudad Mutis, Killip & García 33625 (US). Trail to Miniquía E of Puerto Mutis (Bahía Solano), Lellinger & de la Sota 29 (LP, US). Río Mutatá, ca. 3 km above its junction with the Río El Valle, NW of Alto del Buey, Lellinger & de la Sota 183 (US). Upper Río Truando, 2 km SSW of the confluence of the Río Nercua near the Madurex Camp, Lellinger & de la Sota 577 (LP, US). Río Catripe, Haught 5452 (NY, US). Hydro Camp 8, helipad in premontane forest, peak over Curundu, Duke 13321 (US). Río Nuqui, Haught 5471 (US). Río San Juan, 3.5 km SW of Andagoya, just NE of the mouth of the Río Suruco, Lellinger & de la Sota 497 (LP, US). Cabita Bay, Cape Corrientes, Taylor 996, 1822 (ambos K), 1269 (US); Port Utria, Taylor 1294 (US).
ECUADOR. Pastaza. Chapetón on Río Bobonaza, N of the river, Øllgaard & Navarrete 1384 (AAU). Chapetón on Río Bobonaza, trail E of Village to Río Aulapi, Øllgaard & Navarrete 1353 (AAU). Napo. Upper Río Tiputini, ca. 2 canoe hours from bridge on Coca-Auca oil field road, Øllgaard & Blasco 99071 y 99039 (los dos AAU). Parque Nacional Yasuní, km 36,6 on the oil road starting at Pompeya, Moran et al. 6196 (AAU). Añangu, Parque Nacional Yasuní, Øllgaard et al. 38927 (AAU). Parque Nacional Yasuní, Estación Científica Yasuní, por el Río Tiputini, Moran et al. 6035 (AAU).Cantón Tena, Jatún Sacha Biological Station, Fay & Fay 2795 (MO). Esmeraldas. Pueblo San Miguel, Holm-Nielsen et al. 25377 (AAU). Lita, San Lorenzo, Moran & Rorhbach 5288 (MO).
PERU. Pasco.Oxapampa, Palzcazu Valley, Iscozacín, Foster 9466 (MO).
Observaciones: las plantas grandes como el ejemplar tipo son poco comunes en las colecciones, en las cuales esta especie está representada más bien por plantas jóvenes cuyas pinnas tienen ápices ondulados y serrulados, obtusos o más raramente, agudos y costas rojizas, que en ejemplares adultos son oscuras o concolores, y con modelos epidérmicos más o menos inmaduros (poligonales en el epifilo y subpoligonales a subsinuosos en el hipofilo; estomas en diferentes etapas de desarrollo). Un ejemplar juvenil con estas características forma parte del síntipo de D. humilis (Colombia, Seeman 996 K!). Los patrones de venación de juveniles y adultos son iguales, con venas casi exclusivamente simples y ocasionales geminadas. Las esporas son casi indistinguibles de las de D. alata y D. humilis y los ejemplares jóvenes tienen porcentajes más altos de esporas normales que los adultas (90-100% versus 60-70 %).
12. Danaea plicata H. Christ, Repert. Spec. Nov. Regni Veg. 8: 19. 1910. TIPO: Costa Rica. Carrillo, Pcia. San José, 400 m, Brade & Brade 327 (holótipo, S, no visto; foto del holótipo US!). Fig. 34 B-C.
Plantas terrestres pequeñas, de hasta 30-35 cm de altura. Rizomas cortamente rastreros, delgados, carnosos, con estípulas pareadas crasas y amiláceas. Estípites escasos, generalmente 2-3, flexibles y crasos, distalmente alados, con 1-2 pulvínulos. Lámina estéril elíptica ancha a casi rómbica, de 12-20 cm de largo por 6-7 cm de ancho, paripinnada o imparipinnada, con la pinna terminal reemplazada por una yema prolífera o con una pinna terminal extremadamente larga, hasta 2 veces el largo total de la lámina, membranácea a translúcida. Pinnas laterales 2-3 (5) pares, de 3-4 (5) cm de largo por 1-1,3 (1,5) cm de ancho, oblongas, con bases asimétricas anchas, ápices obtusos aserrados o subcrespos y márgenes repandos ondulados, insertas próximas pero no imbricadas en raquis alados cubiertos por indumento denso. Lámina fértil lanceolado-oblonga, más larga que la estéril y con más pares de pinnas laterales, éstas en general crasas. Indumento denso, mucilaginífero, caduco; tricomas y protoscamas campanuladas peltadas muy pequeñas y formas intermedias entre ambos. Venas geminadas predominantes y simples, algo separadas. Modelo epidérmico sinuoso frecuente en epifilo e hipofilo, con sinuosidades poco profundas pero no someras; estomas maratiáceos normales. PIP filamentosas muy delgadas y enmarañadas. Esporas equinadas con espinas cortas cónicas formando aréolas, malformadas y colapsadas hasta cerca del 80 % y esporas dobles o gigantes.
Distribución geográfica y ecología: Costa Rica. Selvas prístinas húmedas y lluviosas. Umbrófila y colonial, en comunidades pequeñas. Crece hasta los 400-700 m s.m.
Material examinado
COSTA RICA. Alajuela. San Ramón: Road to Los Angeles Norte ca. 30 km N of San Ramón, McAlpin 1291, 1288 (ambos US). San José. Parque Nacional Braulio Carrillo, Estación Carrillo, Quebrada Sandijuela, Gómez et al. 22927 (US).
Observaciones: Camus & Pérez García (1995) mencionaron la existencia de anormalidades en las esporas de D. plicata y sugirieron que se trataría de un taxón híbrido entre D. carillensis y D. crispa. Las láminas imparipinnadas con pinnas terminales extremadamente largas o paripinnadas (rematadas en yemas) en la mima planta, la textura, el margen crespo y los modelos epidérmicos son rasgos que pueden considerarse intermedios entre esas especies. Las esporas analizadas aquí muestran anomalías y diferencias de tamaño y es la única especie en la que se encontraron esporas dobles, todo lo cual apoya fuertemente la idea de un origen híbrido. Las colecciones son extremadamente escasas.
13. Danaea simplicifolia Rudge, Pl. Guian. 1: 24, t. 36. 1805. TIPO: No establecido, posiblemente Guayana Francesa, sin loc., Martin (BM no visto, foto del tipo US!). Fig. 28 L-M.
Plantas pequeñas a medianas, de ca. 50-60 cm de altura. Rizomas postrados largamente o cortamente rastreros, con raíces cordeliformes abaxiales y estípulas carnosas amiláceas. Estípites 6-8 o más, próximos, adaxialmente convexos, lateralmente canaliculados y abaxialmente carenados, papilosos, con abundantes estrías paralelas y poco profundas que se prolongan en la costa, con 1-2 pulvínulos siempre sin pinnas y con tejidos internos compactos carentes de almidón. Protoscamas abundantes, peltadas, pluricelulares, estrelladas o irregulares, con cuerpo aplanado y márgenes ondulados a erosos. Lámina estéril anchamente elíptica, subcoriácea a coriácea, de 18-20 (26) cm de largo por 6-8 (12) cm de ancho, con base cuneada, ápice agudo o acuminado y márgenes enteros a repandos. Lámina fértil reducida, elíptica, de 12-15 (29) cm de largo por 3-5 (6) cm de ancho, herbácea a carnosa. Venas simples, geminadas y bifurcadas más bien cerca de la costa, curvadas en el margen formando una vena comisural generalmente gruesa. Indumento cerca de las venas, sobre éstas y costa, superficial algo escaso en adultos, formado por tricomas y protoscamas peltadas a irregulares con margen eroso a casi fimbriado, mucilaginíferas. Modelos epidérmicos sinuosos similares en epifilo e hipofilo, sinuosidades curvas o angulosas, localmente engrosadas; estomas maratiáceos grandes con poros normales y áreas deprimidas polares y laterales. PIP verrucosas aisladas y esparcidas o en grupos localizados. Esporas elipsoidales de 22 x 18 ìm, equinadas, con periporio granular y exosporio con espinas largas y cortas, conicas, romas, espatuladas, bífidas o irregulares, discretas y distantes.
Iconografía. Rudge Pl. Guian. 1: 24, t. 36.1805. Una planta de tamaño natural con frondas estériles y fértiles, las venas claramente simples, geminadas y bifurcadas cerca de la costa.
Distribución geográfica y ecología: Trinidad, S de Venezuela y Guayanas; también citada por Smith (1995) para Brasil. En selvas primarias prístinas. Desde el nivel del mar hasta 400-850 m.
Material adicional examinado GUYANA. Demerara. Essequibo Is, West Demerara: White Creek 3-5 km downstream from mining camp, Henkel 1950 (US). Potaro Road, sin coll. 46 (US). Moraballi Creek, Essequibo River, Forestry Dept. B. G. 5311 (US). Kangaruma-Potaro landing, Gleason 184 (US). Potaro-Siparuni, from camp on Elizabeth Creek ca. 1 km along road to NE and along creek, McDowell 3585 (US). Kaieteur Falls, Appun s.n. in 1872 (US). Kaieteur Falls National Park, trail to Turkeit, Hahn et al. 4711 (US). Cuyuni-Mazaruni: Omai, off Ridge Road, near Gilt Creek, Gillespie 1519 (US).
GUAYANA FRANCESA. Savane Roche de Virginie, Bassin de l'Approuague, Cremers & Petronelli 11760 (U). D. Z. de Saut Aïmara, Bassin du Sinnamary, Hoff 6986 (U). Savane Roche du Quatorze Juillet, Bassin du Bas-Oyapock, Cremers 12262 (U). Gobaya Soula, Bassin du Maroni, Cremers et al. 10128 (U). "In sylvis montosis Kaw," Leprieur s.n. in 1831 (U). Sin. loc., Leprieur 976 (U). Sin loc., Mélinon 978, 979 (ambos U).
SURINAM. Brownscreek, Second Fall, B. W. 590 (US).
TRINIDAD. Aripo Road toward Heights of Aripo, via Arima, Broadway 5415 (US). Aripo Road, Hombersley 69 (US).
VENEZUELA. Amazonas. Río Negro. Neblina base camp on the Río Bario (Río Mawarinuma), Beitel 85239 (US).
Observaciones: Walker (1966) mencionó un 2n= 160 para material de D. simplicifolia de Trinidad; es decir, se trataría de un tetraploide en relación con el número básico de 40, típico de Marattiaceae. Los modelos epidérmicos son muy similares a los de D. elliptica, con engrosamientos en las sinuosidades, pero las células tienen tamaño mayor, un carácter que sería típico de la especie y no influido por la poliploidía. Las esporas tienen aspecto normal en una proporción del 70-90 % y es difícil distiguirlas de las esporas de D. elliptica, también con perisporio granular, aunque tienen un tamaño algo menor.
14. Danaea tenera C. V. Morton, J. Wash. Acad. Sci. 41:276. 1951. TIPO: Colombia. Cauca. El Tambo, 100 m elev., von Sneidern 1578 (holótipo, US!; isótipo, S, no visto). Fig. 32 H.
Plantas terrestres medianas, de hasta 40-50 cm de altura. Rizomas cortamente rastreros, carnosos, con estípulas pareadas crasas y amiláceas. Estípites escasos, generalmente 2-3, flexibles y crasos, distalmente alados, tan largos como la lámina, con 1-3 pulvínulos. Lámina estéril oblonga o lanceolado- oblonga, de 14-25 cm de largo por 5-6 cm de ancho, siempre paripinnada y con la pinna terminal reemplazada por una yema prolífera, membranácea a translúcida. Pinnas laterales 14-18 pares, de 4-5 (6,5) cm de largo por 1,2-1,5 (2) cm de ancho, oblongo-falcadas, con bases asimétricas anchas, ápices acuminados incurvados y aserrados y márgenes repandos u ondulados, insertas próximas pero no imbricadas en raquis alados cubiertos por indumento denso. Lámina fértil rara, oblonga, más larga que la estéril y con menos pares de pinnas laterales, éstas en general crasas. Indumento denso, mucilaginífero, caduco; tricomas, protoscamas campanuladas y formas intermedias entre ambos. Venas geminadas predominantes y simples en menor proporción, algo separadas. Modelo epidérmico poligonal en epifilo e hipofilo; estomas vestigiales a ausentes. PIP filamentosas muy delgadas y enmarañadas. Esporas escasas, equinadas, generalmente anómalas.
Distribución geográfica y ecología: Colombia y Ecuador. Selvas lluviosas bajas. Umbrófilo, crece desde 100 hasta 1000 m s.m.
Material examinado
COLOMBIA. Cauca. San Juan de Michay, Haught 5392 (US).
ECUADOR. Carchi. San Marcos Valley, Barford et al. 48760 (AAU).
Observaciones: las plantas adultas de D. tenera son semejantes a plantas jóvenes de D. oblanceolata, aunque las frondas tienen textura más delicada y pinnas translúcidas con ápices incurvados y aserrados, nunca obtusos y predominan las venas geminadas sobre las simples. El modelo epidérmico poligonal es poco común en el género y sólo está presente, además, en D. crispa. El indumento está formado casi exclusivamente por tricomas mucilaginíferos cuyas células parecen mantenerse activas por largo tiempo. Los tricomas son parcialmente caducos y se encuentran muchas bases mucilaginíferas en la epidermis. Existen pocas colecciones, la mayoría de ellas con ejemplares estériles.
15. Danaea trichomanoides Spruce ex T. Moore, Index. Fil. 288. 1861. TIPO: Perú. San Martín. Tarapoto, Spruce 4710 (holótipo, K!). Fig. 33 D-F.
Plantas terrestres, pequeñas, de 15-25 cm de altura. Rizomas cortamente rastreros, carnosos, amiláceos, cubiertos por estípulas pareadas suculentas. Estípites 5-7, carnosos y flexibles, muy próximos y agrupados ormando una roseta; alados, con el ala ondulada o crespa de hasta 0,8 cm de ancho, densamente cubiertos por indumento mucilaginífero formado por tricomas globosos paucicelulares y protoscamas peltadas campanuladas pequeñas; sin pulvínulos. Lámina estéril lanceolada, de 8-15 cm de largo por 3-5 cm de ancho, ocasionalmente imparipinnada en plantas jóvenes pero siempre paripinnada en adultas y rematada en una yema prolífera; membranácea a delicadamente esponjosa, abaxialmente mucho más clara, casi glauca. Pinnas laterales 10-16 pares, de 1,5-2,5 (3) cm de largo por 0,5-0,8 (1) cm de ancho, oblongas, con bases redondeadas escasamente asimétricas, ápices obtusos a truncados y márgenes ondulados, más o menos distantes sobre los raquis alados, con alas onduladas cubiertas por indumento denso. Tricomas mucilaginíferos parcialmente caducos, protoscamas pequeñas, campanuladas y formas intermedias entre ambos. Venas predominantemente simples y esporádicas bifurcadas muy lejos de la costa, en el área supramedial o hasta intramarginal; vena marginal ausente. Modelos epidérmicos sinuosos subfrecuentes, sinuosidades uniformes y paredes muy delgadas, similares en epifilos e hipofilos; estomas maratiáceos dispersos con moderada densidad, más abundantes que en otras especies con pinnas membranáceas. PIP muy abundantes, filamentosas, delgadas y enmarañadas. Esporas elipsoidales grandes, de 24 x 20 mµ, equinadas; perisporios lisos; exosporios con espinas largas, cónicas o triangulares, casi planas, con ápices cubiertos por micro-ornamentación granular y bases anchas fusionadas lateralmente formando aréolas muy profundas.
Distribución geográfica y ecología: Ecuador y Perú (Tryon & Stolze, 1989). Selvas lluviosas densas. Umbrófila, crece en matas arrosetadas en suelos y laderas rocosas cerca de cascadas, con poca luz y mucha humedad o en suelos muy húmedos, sobre barro, en riberas o cerca de corrientes de agua, desde los 500-600 hasta casi 2000 m s.m.
Material examinado
ECUADOR. Morona-Santiago. Km 10 del camino Limón-San Antonio, Moran 587 (AAU). Zamora- Chinchipe. Nangaritza Canton, Río Nangaritza, Miazi, Neill & Palacios 9629 (AAU, MO). Río Nangaritza, Canyon S of Miazi, Øllgaard & Lozano 2593 (AAU).
Observaciones: Las esporas son abundantes y bien formadas en todos los ejemplares, y presentan las espinas más largas del género, basalmente fusionadas en aréolas profundas; son muy similares a las de D. wendlandii y no se distinguen bien unas de otras. Sin embargo las plantas de D. trichomanoides se reconocen fácilmente por su tamaño, el color más claro o glauco de los hipofilo y la venación predominantemente simple de las pinnas.
16. Danaea ulei H. Christ, Hedwigia 44 : 368. 1905. TIPO: Brasil. Amazonas, Río Juruá, Juruá Mirí, Puritisal, Ule 5758 (holótipo, L; foto del tipo, UC, no vistos; foto del tipo AAU! US!). Fig. 32 A-B.
Plantas terrestres muy grandes, de hasta 3 m de altura. Rizomas postrados o ascendentes, fuertes, con raíces cordeliformes gruesas abaxiales y laterales y estípulas carnosas amiláceas grandes. Estípites poco numerosos, próximos, rígidos, abaxialmente y adaxialmente bisurcados, con 2 surcos laterales profundos, sin pulvínulos y sin almidón de reserva. Protoscamas peltadas irregulares, con un cuerpo pluricelular prolongado en largos brazos unicelulares que rematan en células cilíndricas sin mucílago en plantas adultas. Lámina estéril elíptica u oblonga ancha, siempre imparipinnada, a veces más clara en el hipofilo y hasta plateado-amarillenta en juveniles; yemas prolíferas ausentes. Pinna terminal elíptica o lanceolado-elíptica, siempre mucho más grande que las laterales. Pinnas laterales 5-7 (10) pares, insertas en un raquis oscuramente alado, distantes hasta 8-10 cm en plantas adultas, de 16-2 (38) cm de largo por 5,5 -7,5 (8,2) cm de ancho, elípticas o lanceoladas, anchas, con base subcuneada a cuneada, ápice agudo o acuminado y márgenes repandos, ondulados o irregulares, hialinos. Lámina fértil elíptica, con 10- 12 (16) pares de pinnas elípticas o lanceoladas, de 7-9,5 (12,5) cm de largo por 2-3 (3,5) cm de ancho, más o menos suculentas, ocasionalmente no contraídas. Venas simples, geminadas y escasas bifurcadas cerca de la costa, curvas en origen, no muy próximas aunque este rasgo es variable; vena comisural presente o ausente. Indumento cerca de las venas, sobre éstas y sobre costa, el superficial algo escaso en aultos; tricomas y protoscamas grandes, estrellados e irregulares. Modelos epidérmicos sinuosos frecuentes o subfrecuentes similares en epifilos e hipofilos, pero con engrosamientos localizados leves en los epifilos; estomas maratiáceos grandes, elípticos, con áreas deprimidas polares y laterales. PIP verrucosas aisladas o en grupos dispersos, ausentes en vastas áreas. Esporas elipsoidales de 40 x 27 ìm, equinadas, con periporio liso y exosporio con espinas conicas largas, agudas, notoriamente ensanchadas en la bases y fusionadas, con los ápices cubiertos por microornamentación granular.
Distribución geográfica y ecología. Panamá hasta Perú y Brasil, Trinidad y posiblemente también en Puerto Rico y Jamaica, según G. Proctor (com. pers.). En selvas lluviosas bajas, pedemontanas y montanas, en suelos húmedos.
Material examinado
ECUADOR. Napo. At and near Laguna Grande de Cuyabeno, Laegaard 52521 (AAU). Añangu, rain forest on well drained hilly ground in the Parque Nacional Yasuní, Øllgaard et al. 39227 y 39226 (AAU). Lagunas del Cuyabeno, Brandybyge 42669 (AAU). Morona- Santiago. Trail Maikunoma-Mutinza eastern foothills of Cordillera Cutucú, Øllgaard & Navarrete 1489 (AAU). Pastaza. Río Bobonaza, river banks and rain forest on elevated ground between oil exploration camp Chichinota and destacamento cabo Pozo, Øllgaard et al. 34865 (AAU). Montalvo, on Río Bobonaza, along th trail to Chiriboga, Øllgaard et al. 35477 (AAU). Chapetón on Río Bobonaza, N of the river, Øllgaard & Navarrete 1489 (AAU). Pichincha. Reserva ENDESA, Corporación Forestal Juan Manuel Darini, turnoff at km 113 Quito to Puerto Quito road, ca. 6 km N of ENDESA houses, Hammer & Wilder 17252 (UC). NE of Vicente Maldonado, Reserva de ENDESA, Laegaard 52231, 52462 y 52445 (los 3 AAU). Sucumbios. Reserva Faunística Cuyabeno, one hectarea plot ca. 1 km N of Laguina Grande, Poulsen 78601 y 79022 (ambos AAU).
PANAMÁ. Darién. Between Punta Guayabo Grande and Punta Guayabo Chiquita, Pacific Coast near the Columbian border, Stern & Chambers 185 (US).
PERU. Loreto. Mishuyacu, near Iquitos, Klug 1463 (US). Balsapuerto (lower Río Huallaga Basin), Killip & Smith 28410 (US). San Antonio on the Río Itaya, Killip & Smith 29306 (US).
TRINIDAD. Sin loc., Fendler 129 (US). Dibe Valley, Britton et al. 1746 (US).
Observaciones: Danaea ulei tiene rasgos intermedios entre D. elliptica (el contorno de láminas y pinnas, el número de pares de pinnas en adultos, el patrón de venación los engrosamientos localizados en la epidermis) y D. nodosa (la ausencia de pulvínulos en el estípite, los rizomas predominantemente postrados y el modelo epidérmico). El ejemplar procedente de Trinidad [Fendler 129 (US)], tiene esporas grandes, bien formadas y de aspecto normal pero de tamaño doble en relación con las más grandes del género; los ejemplares de Perú [Killip & Smith 29306; Killip & Smith 28410 (US), Klug 1463 (US)] presentan esporas anómalas, deformes, colapsadas o en díadas irregulares incompletamente divididas. El material de Ecuador está estéril. Esta especie es muy llamativa y a primera vista podría confundirse con D. elliptica, pero su pinna terminal es hasta 4 veces más grande que las laterales, no tiene pulvínulos y no parece ser una planta precozmente fértil. Podría ser un poliploide de origen híbrido, a estar por el tamaño de sus esporas, pero no existen recuentos cromosómicos de referencia. También es posible que sea, junto con D. nodosa, uno de los parentales de los presuntos híbridos mencionados, ya que ambas son muy afines.
17. Danaea wendlandii Rchb. f., Bot. Zeit. (Berlin) 30: 490. 1872. TIPO: Costa Rica. Heredia. Piedregal, Wendland 744 (holótipo, W, no visto; foto US!). Fig. 32 I.
Plantas terrestres, delicadas, de hábito más o menos arrosetado, de 25-35 cm de altura. Rizomas cortamente rastreros, carnosos, abundantemente amiláceos, cubiertos por estípulas pareadas, también reservantes. Estípites numerosos, flexibles, carnosos, adaxialmente apenas canaliculados y abaxialmente carenados, tan largos como las láminas o más, alados, con alas de hasta 1,3-1,5 mm y con 1-2 pulvínulos, a veces poco evidentes. Protoscamas peltadas, pequeñas, campanuladas, con un cuerpo pequeño que irradia de un centro tricomatoso paucicelular permanentemente mucilaginífero. Lámina estéril lanceada, membranácea o delicadamente herbácea, opaca, de 10-15 (20) cm de largo por 4-5 (6,5) cm de ancho, concolor, siempre paripinnada y rematada en una yema prolífera (pinna terminal ocasional en plantas jóvenes). Pinnas laterales 8-12 pares, próximas o ligeramente imbricadas, de 2,5-4 (5,5) cm de largo por 0,6- 0,8 (1,2) cm de ancho, oblongo-falcadas, de lados paralelos, con bases asimétricas redondeadas a subcordadas, ápices obtusos o redondeados, algo serrulados y márgenes enteros a repandos. Lámina fértil lanceolada angosta, con 8-10 pinnas oblongas reducidas a la porción sinangial, crasas. Indumento moderadamente denso sobre lámina, alas, venas y costa; tricomas y protoscamas peltadas campanuladas y formas intermedias entre ambos. Venas bifurcadas cerca de la costa, predominantes y escasas simples. Modelos epidérmicos sinuosos, sinuosidades muy frecuentes y someras en epifilos y sinuosidades más distantes, subangulosas, amplias y profundas, con pequeños espesamientos puntiformes localizados en hipofilos; estomas maratiáceos muy dispersos. PIP filamentosas muy densas y finas. Esporas grandes, de 25 x 21 µm, con perisporio liso y exosporio equinado con espinas largas, cónicas o triangulares, fusionadas por sus bases ensanchadas formando aréolas profundas.
Distribución geográfica y ecología: Costa Rica, Nicaragua, Panamá, Colombia y Ecuador. En selvas prístinas, terrestre, umbrófila, colonial, en suelos muy húmedos. Crece hasta ca. 1200-1500 m s.m.
Material examinado
COSTA RICA. Alajuela. Upala, Bijagua, El Pilón, Cabeceras del Río Celeste, Herrera 1260 (AAU, CR, MO, US). Finca Hundriesser, Brade 400 (US). Limón. Parque Nacional Tortuguero, Estación Agua Fría, primera loma aproximadamente 6 km al SE, Cerros Azules, Robles 1580 (US). La Lola, a cacao finca near Río Madre de Dios, Scamman 6993 (US). Heredia. Near the Río Puerto Viejo, about 2 km upstream from the confluence with the Río Sarapiquí, formerly Finca La Selva of L. R. Holdridge, Burger & Stolze 5773 (US). Upstream from Puerto Viejo ca. 4 km at Finca La Selva, Lellinger 897 (US), Mickel 3526 (LP, US), Scamman 6104 (US).
PANAMA. Canal Zone. Chagres, Fendler 389 (K, parte del síntipo de D. humilis).
Observaciones: Tuomisto & Moran (2001) señalan que los especímenes de D. wendlandii procedentes de Ecuador tienen pinnas más numerosas, más separadas, más anchas y con ápices más obtusos y aserrados que los de otras localidades. Sin embargo, el ejemplar que esos autores ilustran para D. wendlandii sería uno juvenil de D. oblanceolata, que se reconoce claramente por el contorno de la lámina y de las pinnas, la disposición de éstas y el mayor número de pares laterales. A esos rasgos hay que agregar otros, también perceptibles en material de herbario, como la textura de las pinnas, el color de las venas y de las costas, y la venación. Danaea wendlandii y D. trichomanoides son las especies más pequeñas del género y se distinguen entre sí por los rasgos de la lámina: pinnas membranáceas concolores, con venas del color de la lámina, bifurcadas cerca de la costa, en D. wendlandii y pinnas esponjosas con hipofilos glaucos y venas oscuras casi exclusivamente simples, en D. trichomanoides. Las esporas de estas dos especies son muy similares y no se diferencian bien unas de otras. Danaea imbricata es una especie con algunos rasgos en común con ambas: el patrón de venación como D. wendlandii, los hipofilos glaucos, las venas oscuras y tortuosas y los modelos epidérmicos como D. trichomanoides. Las frondas estériles de D. wendlandii a veces son muy próximas, formando una roseta y luego se curvan tocando distalmente el suelo, mientras que las fértiles son semierectas.
NOMBRES DUDOSOS Y TAXONES EXCLUIDOS
Danaea dubia C. Presl, Suppl. Tent. Pterid. 36 (postpr. 296). 1845. TIPO: Brasil. "Habitat in Brasilia," Kulemkampf s.n. (PR, o PRC, no visto). No fue posible hallar material tipo ni otro en relación con este nombre. Por la descripción, posiblemente se trate de D. elliptica.
Danaea serrulata Baker, J. Bot. Brit. For. 19: 208. 1881. TIPO: Colombia. Antioquia. Kalbreyer 1352 (holótipo, K, no visto). No se ha pudo consultar el tipo de esta especie. Solamente se revisaron colecciones de US determinadas por C. V. Morton. Los ejemplares vistos se asemejan a las plantas más grandes de D. humilis y a individuos jóvenes de D. moritziana. Las frondas son semejantes a las de esta última, con un número coincidente de pares de pinnas laterales y similar modelo epidérmico, aunque las células tiene paredes más engrosadas. Las pinnas son coriáceas, están algo contraídas y las esporas están colapsadas. Algunos de estos ejemplares provienen de suelos mineralizados. Queda un margen de inseguridad respecto de la asignación del nombre.
AGRADECIMIENTOS
Parte de este trabajo se llevó a cabo gracias a una Beca de Profesor Visitante del Instituto Smithsonian de Washington, D. C. La autora agradece a los Curadores de los numerosos herbarios consultados por los préstamos de material y tipos; al Dr. David Lellinger, Curador del U. S. National Herbarium, de Washington, D. C., Estados Unidos de América, por la autorización para realizar estudios morfológicos con material de las colecciones US, por el apoyo recibido durante el transcurso de la investigación, por la lectura crítica del manuscrito original y por numerosas sugerencias útiles; a la Dra. Carmen Prada Moral, de la Facultad de Biología de la Universidad Complutense de Madrid, España, por su cuidadosa lectura del manucrito y numerosos comentarios constructivos y a la Licenciada Mónica Rodríguez por su ayuda en la preparación y diagramación de las ilustraciones.
BIBLIOGRAFÍA
1. Baker, J. & Hooker, W. J. 1874. Synopsis Filicum. Hardwicke, London. [ Links ]
2. Barrington, D. S., Paris, C. A. & Ranker, T. A. 1986. Systematics inferences from spore and stomate size in the ferns. Amer. Fern J. 76: 149-159. [ Links ]
3. Benko-Iseppon, A. M. & Rodrigues da Fonseca, E. 2000. Cytological notes on five species of the genera Danaea and Adiantum (Pteridophyta) from northern Brasil. Bol. Soc. Argent. Bot. 35: 269-273. [ Links ]
4. Bierhorst, D. W. 1971. Morphology of Vascular Plants. Macmillan, New York. [ Links ]
5. Bower, F. O. 1926. The Ferns (Filicales). University Press, Cambridge. [ Links ]
6. Brebner, G. 1896. On the prothallus of Danaea simplicifolia Rudge. Ann. Bot. 10: 109-121. [ Links ]
7. Brebner, G. 1896.1902. On the anatomy of Danaea and other Marattiaceae. Ann. Bot. 16: 517-552. [ Links ]
8. Campbell, D. H. 1911. The Eusporangiate: The comparative morphology of the Ophiglossaceae and the Marattiaceae. Carnegie Inst. Wash. Publ. 140: i-vi, 1-29. [ Links ]
9. Camus, J. & Pérez García, B. 1995. Marattiaceae, pp. 48-51, en Davidse, G., Sousa M., & Knapp, S. et al.(eds.), Flora Mesoamericana, vol.1. Universidad Nacional Autónoma de México, Mexico. [ Links ]
10. Chang, C.Y. 1975. Morphology of Archangiopteris C. Chr. et Giesenh. and its relationship with Angiopteris Hoffm. Acta Bot. Sin. 15: 261-276. [ Links ]
11. Christ, H. 1905. Filices Uleanae Amazonicae. Hedwigia 44:359-370 [ Links ]
12. Christ, H. 1907. Primitiae Filices Costaricensis. Bull. Soc. Bot. Genève II, 1(5): 216-236. [ Links ]
13. Christ, H. 1909. Primitiae Filices Costaricencis. Bull. Soc. Bot. Genève, II, 7(4): 257-274. [ Links ]
14. Desvaux, A. N. 1811. Observations sur quelques nouveaux genres de fougères et sur plusieurs espèces nouvelles de la même famille. Ges. Naturf. Fr. Berl. Mag. 5: 297-330. [ Links ]
15. Fée, A. L. A. 1866. Histoire des fougères et des Lycopodiaceés des Antilles, Mém. Foug. 11. Veuve Berger- Levrault, Strasbourg. [ Links ]
16. Fryns-Claessens, E. & van Cotthem, N. R. 1973. A new classification of ontogenetic types of stomata. Bot. Rev. 39: 71-138. [ Links ]
17. Gurr, L. 1966. The Rational Use of Dyes in Biology. Williamson and Wilkers, Baltimore (también publicado por Arrowsmith, Bristol, England and Leonard Hill, London, 1965). [ Links ]
18. Hayata, B. 1928. On the systematic importance of the stelar system in the Filicales, II. Bot. Mag.Tokyo 42: 301-311. [ Links ]
19. Hill, C. R. & Camus, J. M. 1986. Evolutionary cladistics of the marattialean ferns. Bull. British Mus. (Nat. Hist.) 14: 219-300. [ Links ]
20. Holmgren, P. K., Holmgren, N. H. & Barnett, L. 1990. Index Herbariorum, Part I: Herbaria of the World . New York Botanical Garden, Bronx, New York. [ Links ]
21. Holttum, R. E. 1978. The morphology and taxonomy of Angiopteris (Marattiaceae) with a description of a new species. Kew Bull. 32: 587-594. [ Links ]
22. Johansen, D. A. 1940. Plant Microtechnique. McGraw- Hill, New York. [ Links ]
23. Jones, D. L. 1997. The encyclopedia of ferns. Lothian Publishing Co., Pty Ltd., Melbourne. [ Links ]
24. Lavalle, M. C. 2002. Revisión de las especies neotropicales de Marattia Sw. (Marattiaceae). Tesis Doctoral (inéd.), Facultad de Ciencias Naturales y Museo de La Plata. [ Links ]
25. Lavalle, M. C.2003. Taxonomía de las especies neotropicales de Marattia (Marattiaceae). Darwiniana 41: 61-86. [ Links ]
26. Lellinger, D. B. 1989. The Ferns and Fern-allies of Costa Rica, Panamá, and the Chocó, 1. Pteridologia 2A: 1-364. [ Links ]
27. Lellinger, D. B. 2002. A Modern Multilingual Glossary of Taxonomic Pteridology. Pteridologia 2: 1- 263. [ Links ]
28. Lellinger, D. B. & Taylor, W. C. 1997. A classification of spore ornamentation in the Pteridophyta. pp. 33-42, en Johns, R.J. (ed.), Holttum Memorial Volume. Royal Botanic Gardens, Kew. [ Links ]
29. Liebmann, F. 1849. Mexicos Bregner. Kongel. Danske Vidensk. Selsk. Skr., Naturvidensk. Afd. V, 1:153- 322, 353-362 (repr. 1-174). [ Links ]
30. Mengascini, A. 2002. Caracteres diagnósticos en 5 especies de Archangiopteris C. Chr. & Giesenh. Rev. Museo La Plata, Botánica, 15 (115): 3 - 22 y pag. web. http://www.fcnym.unlp.edu.ar [ Links ]
31. Mengascini, A. & Rolleri, C. H. 2001. Caracteres diagnósticos en Archangiopteris C. Chr. & Giesenh. Bol. Sol. Argent. Bot. 36 (suplemento): 146-147. [ Links ]
32. Ogura, Y. 1972. Comparative Anatomy of the Vegetative Organs of the Pteridophyta, en: Zimmerman, W., Carlquist, S., Ozenda, P. & Wulff, H.D. (eds.), Encyclopedia of Plant Anatomy vol. 7. Berlin. [ Links ]
33. Pant, D. D. 1965. On the ontogeny of stomata and other homologous structures. Pl. Sci.1:1-24 [ Links ]
34. Pichi-Sermolli, R. E. G. 1977. Tentamen pteridophytorum in taxonomicum ordinen redigendi. Webbia 31: 313-512. [ Links ]
35. Pérez García, B. 1993. Pteridófitas, Familia Marattiaceae, Fl. México 6(1): 1-12. [ Links ]
36. Presl, C. B. 1845. Supplementum Tentaminis Pteridographiae. Amadeus Haase's Sons, Praga. [ Links ]
37. Probst, W. 1971. Vergleichende Morphologie und Entwicklungsgeschichte der Sfaltöffnungen bei Farnen. Dissertation, Universität Stuttgart. [ Links ]
38. Proctor, G. R. 1977. Flora of the Lesser Antilles, Leeward and Winward Islands, vol. 2, Pteridophyta. Arnold Arboretum, Harvard University, Jamaica Plain. [ Links ]
39. Proctor, G. R.1989. Ferns of Puerto Rico and the Virgin Islands. Mem. New York Bot. Gard. 53:1-389. [ Links ]
40. Raddi, J. 1819. Synopsis Filicum Brasiliensium. Opusc. Sci. 3: 279-297. [ Links ]
41. Rolleri, C. H. 1993. Revision of genus Christensenia. Amer. Fern J. 83: 3-19. [ Links ]
42. Rolleri, C. H.2001. Caracteres diagnósticos y taxonomía en el género Angiopteris Hoffm. (Marattiaceae), Resúmenes de las XXVIII Jornadas Argentinas de Botánica (La Pampa), Bol. Soc. Argent. Bot. 36, Supl. 2001: Bol. Soc. Argent. Bot. 36, Supl. 2001: 146. [ Links ]
43. Rolleri, C. H.2002. Caracteres diagnósticos y taxonomía en el género Angiopteris Hoffm. (Marattiaceae), I, Los caracteres. Rev. Mus. La Plata, Bot. 15 (115): 23-49 y pag. web, http://www.fcnym.unlp.edu.ar [ Links ]
44. Rolleri, C. H.2003. Caracteres diagnósticos y taxonomía en el género Angiopteris Hoffm.(Marattiaceae), II, Sinopsis de las especies. Rev. Mus. La Plata, Bot. 15 (115) y pág. web, http://www.fcnym.unlp.edu.ar [ Links ]
45. Rolleri, C. H, Deferrari, A. M. & Cicciarelli, M. 1987. Epidermis y estomatogénesis en Marattiaceae (Marattiales). Rev. Mus. La Plata, n. s., Bot. 14: 124-147. [ Links ]
46. Rolleri, C. H, Deferrari, A. M.& Lavalle, M. 1991. Epidermal morphology of the pinnae of Angiopteris, Danaea and Marattia. Amer. Fern J. 81: 44-62. [ Links ]
47. Rolleri, C. H, Deferrari, A. M.& Lavalle, M. 1994. Epidermis y estomas porociclocíticos en Christensenia cumingiana Maxon (Marattiaceae-Pteridophyta), Rev. Mus. La Plata, n. s., Bot. 14 (98): 207- 219. [ Links ]
48. Rolleri, C. H& Lavalle, M. 1997. Análisis con MEB y MO de caracteres epidérmicos en Marattiaceae. Rev. Mus. La Plata, n.s., Bot., 14 (108): 433-456. [ Links ]
49. Rolleri, C. H& Lavalle, M. 2001. Morfología de las esporas en ocho especies paleotropicales del género Marattia Sw. (Marattiaceae). Rev. Mus. La Plata, n.s., Bot. 114: 695-705. [ Links ]
50. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 1996. Spore morphology and systematics in the genus Christensenia. Amer. Fern J. 86: 80-88. [ Links ]
51. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 1998. Morfología de las esporas en Angiopteris Hoffm. y otras Marattiales. Physis (Buenos Aires), C 55 (128-129): 17-26. [ Links ]
52. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 1999. Protuberancias intercelulares pécticas en mesofilos de Angiopteris Hoffm. y otras Marattiales. Physis (Buenos Aires),C 57 (132-133): 1-11. [ Links ]
53. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 2000 (2001). Paráfisis en especies neotropicales y paleotropicales de Marattia Sw. Physis (Buenos Aires) C 58 (135- 136): 39-46. [ Links ]
54. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 2001a. Las especies de Marattia Sw. (Marattiaceae) en el paleotrópico. Candollea 56: 98-113. [ Links ]
55. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 2001b. Sistemática de los helechos maratiáceos. Resúmenes de las XXVIII Jornadas Argentinas de Botánica (La Pampa, Bol. Soc. Argent. Bot. 36, Supl. 2001: Bol. Soc. Argent. Bot., 36 Supl. 2001: 147-148. [ Links ]
56. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 2001c. Almidón de reserva en Marattiaceae. Resúmenes de las XXVIII Jornadas Argentinas de Botánica (La Pampa, Bol. Soc. Argent. Bot. 36, Supl. 2001: 148. [ Links ]
57. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 2001d (2003). Idioblastos de ópalo en helechos maratiáceos. Physis (Buenos Aires), C, 59 (136-137): 13-22. [ Links ]
58. Rolleri, C. H, Lavalle M. C., Mengascini, A. & Rodríguez, M. 2003. Sistemática de los helechos maratiáceos (Marattiaceae-Pteridophyta). Rev. Mus. La Plata, Bot. 15 (115), y pag. web http://www.fcnym.unlp.edu.ar [ Links ]
59. Sharpe, J. M. & Jernstedt, J. A. 1991. Stipular bud development in Danaea wendlandii (Marattiaceae). Amer. Fern J. 81: 119-127. [ Links ]
60. Smith, A.. 1995. Marattiaceae, pp. 206-209, en Berry, P., Holst, B. & Yatskyevich, K. (eds.). Flora of the Venezuelan Guayana vol. 2. Missouri Botanical Graden, St. Louis and Timber Press, Portland, Oregon. [ Links ]
61. Sorsa, V. 1971. Fern citology and the radiation field. pp. 39-50 en Odum, T. H. (ed.), A Tropical Rain Forest. Off. Tech. Inform., U. S. Atomic Energy Comm., U. S. Dept. Commerce, Springfield, Virginia. [ Links ]
62. Stidd, B. M. 1974. Evolutionary trends in the Marattiales. Ann. Missouri Bot. Gard. 61: 388-407. [ Links ]
63. Stolze, R. G. 1976. Ferns and Fern Allies of Guatemala, Part 1. Fieldiana, Bot. 39: 1-130. [ Links ]
64. Sturm, J. G. 1859. Marattiaceae. pp. 149-160, en Martius, C. F. P. (ed.), Flora Brasiliensis, 1 (2). [ Links ]
65. Tryon, A. F. & Lugardon, B.1990. Spores of the Pteridophyta. Springer, Berlin. [ Links ]
66. Tryon, R. M., Jr. & Stolze, R. G. 1989. Pteridophyta of Peru, Part I. Fieldiana, Bot., N.S. 20: 1-145. [ Links ]
67. Tryon, R. M., Jr.& Tryon, A. F. 1982. Ferns and Allied Plants with Special Reference to Tropical America. Springer, New York. [ Links ]
68. Tuomisto, H. & Groot, A. T. 1995. Identification of the juveniles of some ferns from western Amazonia. Amer. Fern J. 85: 1-28. [ Links ]
69. Tuomisto, H.& Moran, R. 2001. Marattiaeae, pp. 23-68, en Harling, G. & Andersson, L. (eds.), Fl. Ecuador 66:23-68. [ Links ]
70. Underwood, L. M. 1902. American Ferns, V. A review of the genus Danaea. Bull.Torrey Bot. Club 29: 669-679. [ Links ]
71. Underwood, L. M.1909. Marattiaceae. North American Fl. 16 (1): 17-23. Waltham, Massachussets [ Links ]
72. Walker, T. G. 1966. A cytological survey of the pteridophytes of Jamaica. Trans. Roy. Soc. Edinburgh 66: 169-237. [ Links ]
73. West, C. 1915. On the structure abd development of the secretory tissues of the Marattiaceae. Ann. Bot. 29: 409-422. [ Links ]
74. West, C.1917. A contribution to the study of the Marattiaceae. Ann. Bot. 31: 361-414. [ Links ]
75. Wilkinson, H. 1979. The plant cuticle (mainy leaf), pp. 65-145, en Metcalfe, C. R. & Chalk, L. (eds.), The anatomy of the Dicotyledons, Clarendon Press, Oxford. [ Links ]
INDICE DE COLECCIONES
Abbott 20599 (4), 20908 (9), 21368 (9), 21557 (9), 652 (10), 1661 (10); Allard 13956 (10); Alverson 383 (9); Anderson 10593 (4); Appun s.n. (13); Araúz 177 (4); Archer 1686 (9).
B. W. 6262 (10); 3338 (10), 590 (13); Bailey T 113 (1); Baker, 6273 (4), 619 (6); Barber 169 (10); Barbosa 6712 (11); Barbour 2969 (9), 4520 (9); Beitel 85239 (13); Billiet 6318 (9); Biolley 6923 (10); Blanes s.n. (9); Box 438 (4); Brade 303 (2), 328 (3), 10222 (4), 8430 (4), 10219 (9), 10370 (10), 400 (17), 8393 (9); Bradford 48760 (14); Brandybridge 42669 (16); Britton 1354 (1), 2251 (1), 1072 (9), 5185 (10), 5241 (10), 5807 (10), 8091 (10), 8349 (10), 1746 (16); Broadway 6276 (1), 5415 (13); Buchtien 1088 (9), 3352 (9), 5159 (9), 69 (9); Burch 681 (4); Burger 5773 (17).
Cer ón 1097 (10), 2294 (9); Chacón 1199 (10); Clement 676 (7), 971 (7), 997 (7), 998 (7); Cooper 6059b (9); Cornman 1082 (9), 1207 (9); Cremers 2053 (4), 2182 (4), 10151 (4), 9089 (9) 10360 (10), 10128 (13), 11760 (13), 12262 (13); Croat 76747 (3), 59710 (9),19432 (10); Crosby 530 (9).
Damazio 998 (9); Danneberger s.n. (4); Davidse 22084 (9), 28137 (9); Davis 491 (6); De Nevers 4003 (9); Dressler 4478 (10); Dudley 10412 (9); Duke 13321 (11); Dus én 4316 (4), 4465 (8), 4317-19 (8), 13428 (8), 1687 (10); 4318 (10).
Eggers 963 (10); Ekman 11567 (4), 4363 (4), 113428 (7), 6984 (7), 3707 (7), 1673 (7), 4839 (8), 5292 (8), 5449 (8), 5599 (8), 3448 (8), 4467 (9), 12859 (9), 12900 (10), 15926 (10), 3928 (10), 5551 (10); Ewan 16049 (10), 16839 (10), 16878 (9), 15823 (10).
Fay 2795 (5), 4199 (10), 4367 (10), 2118 (10), 2518 (9), 2751 (10), 2795 (11); Fendler s.n. (1), 28 (4), s. n. (9), 129 (16), 389 (17); Flores 195 (10), 214 (10); Forero 1726 (9); Forestry Dept. B. G. 5311 (13); Foster 1715 (5), 79139 (9), 9451 (9), 9466 (11); Freire 539 (6); Funk 3041 (10).
Gabaldoni s.n. (9); Galdanes 1534 (10); Gastony 4883 (8), 650 (4); Gentle 8379 (10); Gentry 41466 (9); Gerdes 132 (4); Gillespie 1519 (13); Gleason 184 (13); Goldberg 1676 (7); G ómez 23409 (1), 23622 (1), 22921 (9), 22035 (10), 22927 (12); Gonggrijp 5730 (4); Granville 12449 (4), 12451 (4); Guipúzcoa 858 (9).
Hahn 4711 (13); Hallberg 1287 (10); Hammel 16672 (2), 13550 (9), 14863 (9), 15596 (10); Hammer 17252 (16); Hart 25 (10), 6a (10); Haught 1841 (10), 1890 (5), 4662 (11), 5391 (5), 5392 (14), 5452 (11), 5471 (11); Helme 236 (10); Henkel 1950 (13); Hennipman 6784 (9); Herrera 1239 (2), 1240 (3), 1270 (17); Hess 198 (10), 363 (4); Hinchley Hart 197 (7), 1302 (7); Hioram 120 (4), 17 (4), 6406 (7), 6407 (4); Hodge 1682 (1), 1A (1); Hoff 6986 (13); Hoffman 3286 (4); Holm-Nielsen 4280 (4), 24377 (5), 439 (6), 25342 (9), 4503 (10), 25377 (11); Hombersley 160 (1), 127 (4), 352 (4), 353 (4), 355 (4), 356 (4), 357 (4), 358 (4), 360 (4), 396 (4), 398 (4), 400 (4), 169 (13); Hutchinson 3076 (10).
Idrobo 2499 (9).
Jack s.n. (4); Jenman s.n. (4); Jim énez 1048 (10), 5802 (10); Johnson 1252 (10); Johnston 262 (4); Juncosa 1481 (9).
Kanehira 127 (10); Kennedy 1889 (10); Killip 26149 (4), 23885 (4), 14861 (9), 20221 (9), 33344 (9), 7638 (9), 2515 (10), 11236 (10), 11578 (10), 33625 (11), 29306 (16), 28410 (16); Klug 463 (16); Kuhn 2596 (10); Kvist 48282 (9).
Laegaard 52463 (9), 51677 (16), 52231 (16), 52231 (16), 52445 (16), 52462 (16), 52521 (16), 54858 (16); Lankester 828 (4); Lellinger 480 (1), 482 (1), 595 (4), 472 (4), 1368 (9), 386 (9), 1481 (9), 1520 (9), 247 (9), 692 (9), 817 (9), 88 (10), 893 (10), 14 (10), 10 (10), 1644 (10), 22 (10), 508 (10), 578 (10), 632 (10), 395 (10), 416 (10), 477 (10), 499 (11), 577 (11), 29 (11), 640 (9), 651 (11), 897 (17); Le ón 10511 (7), 2891 (9); Leonard 9310 (4), 14584 (10); Leprieur 254 (4), 268 (4), s.n. (4); s. n. (13); Liesner 10096 (9); Ligier 12716 (7), 12716 (9); Lindeman 2459 (4), 413 (4), 468 (4); Little 8870 (9); Luetzelburg 22061 (4); Luteyin 6582 (9).
Maguire 36865 (9); Mart ínez 399 (9); Maxon 2926 (4), 1111 (7), 735 (7), 737 (7), 9476 (7), 965 (7), 5518 (9), 8151 (9), 8313 (9), 5750 (10), 1761 (10), 2255 (10), 6866 (10), 794 (10), 9336 (10), 9348 (10); McAlpin 1288 (12), 1291 (12); Mc Daniel 31197 (4); McDowell 3585 (13); Mélinon 979 (13), 978 (13); Mexía 4900 (10), 6863 (6); Mickel 6511 (4), 962 (9), 1552 (9), 3504 (10), 4390 (10), 3526 (17); Monsalve 1275 (9), 1451 (9); Moore s.n. (4); Moran 4145 (3), 3698 (9), 6195 (9), 6209 (9), 6064 (10), 6196 (11), 6035 (11), 5288 (11), 5587 (15); Morton 5569 (1), 6183 (1), 7631 (4), 3421 (4), 3421 (4), 5897 (4), 3688 (7), 9257 (9), 9303 (9), 3673 (9), 3480 (10), 10369 (10), 5476 (10), 5896 (10); Mueller 21356 (4), 21357 (4), s. n. (4); Muench 159 (9); Murray 8 (4).
Navarrete 422 (10), 739 (10); Neill 9629 (15); Nevling 144 (9).
Oldeman 949 (4); Øllgaard 1318 (4), 105868 (5), 99372 (5), 99774 (5), 98411 (5), 105538 (6), 105451(9), 1816 (9), 1985 (9), 99810 (9); 10416 (10), 10420 (10), 1353 (10), 35124 (10), 98685 (10), 98851 (10), 99039 (10), 99071 (10), 35383 (10), 1384 (10), 1417 (10), 4611(10), 1510 (10), 1685 (10), 2221 (10), 2268 (10), 37644 (9), 38927 (10), 2593 (15), 34865 (16), 1489 (16), 39226 (16), 39227 (16); Ortega 1834 (9), 2508 (9), 375 (1).
Palacios 9739 (9); Palmer 191 (10); Pappenfuss s.n. (7), s.n. (9); Persaud 76 (4); Philipson 1960 (9); Pinto 340 (4); Pipoly s.n. (9); Pittier 1171 (3), 5166 (10); Plowman 12209 (4); Poulsen 78601 (16), 79022 (16); Prestoe 1177 (1); Proctor 7247 (4), 21592 (4), 40860 (4), 40183 (4), 40373 (7), 40116 (7), 20145 (8), 22530 (9), 40068 (9), 40144 (9), 42131 (9), 42173 (9), 4419 (9), 4128 (10); Purpus 6760 (10).
Questel 2801 (4), 3198 (8), 3200 (10).
Reitz 2859 (10); Rimbach 15 (10), 45 (10); Robles 1580 (17); Ruiz Landa 18362 (11).
Salino 342 (4); Scamman 6992 (9), 6104 (17), 6993 (17); Schafer 3797 (4); Schiefer 767 (9); Schipp 355 (4), 422 (10); Schmalz s.n. (10); Schramm 14 (10); Schultes 563 (9), 695 (9), 156 (9), 15583 (4); Schunke 8615 (9); Seifriz 27 (10), s. n. (9); Shafer 3797 (10); Sherring 223 (1), s.n. (10), s.n. (7), s.n. (9); Sintenis 2700 (4); Skutch 2180 (10); Smith 1129 (9), 1246 (9), 1463 (9), 1667 (9), 4691 (9), 5294 (9), 956 (9); Spannagel 314b (9); Sperling 5035 (9); Spruce 4770 (4), s.n. (4); Stahel 589 (4); Standley 31405 (10), 33642 (9), 35594 (9), 47774 (9), 53145 (10); Stanislas 1713 (9); Steeves 379 (10); Stehl é 3447 (1), 534 (1), 5857 (1), 1223 (8), 1811 (8); Stern 185 (16); Stewart (10); Steyermark 91176 (1), 94899 (1), 121449 (1), 42999 (1), 56012 (8), 48786 (9), 493 (956351 (9), 126684 (9); Stolze 1621 (9).
Taylor 17840 (3), 1243 (10), 1252 (10), 1294 (11), 1822 (11), 996 (11); Telliers 260 (4); Thieme 5661 (10); Tjom-Lim-San 209a (4); Tonduz 17584 (10); Torres 133 (9), 153 (9); Tryon 5278 (9), 6005 (9).
Underwood 1362 (7), 1764 (7).
Valerio 306 (9), III.57 (9); Valeur 526 (10); van de Werff 7901 (9), 10341 (4), 6757 (9), 113 (6), 7903 (9); Vareschi 1670 (10); von Tuerckheim 520 (4), 998 (9), II.491 (4), 8336 (10).
Wacket 107 (9), 20908 (9); Watt 38 (8); Webster 143 (7), 143 (7); Wiggins 11076 (10); Wright 1816 (4), 1066 (7).
Zanoni 35427 (10); Zardini 48901 (10).














