Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Darwiniana, nueva serie
Print version ISSN 0011-6793On-line version ISSN 1850-1699
Darwiniana vol.43 no.1-4 San Isidro Jan./Dec. 2005
Análisis de las comunidades de microhongos de la hojarasca de Scutia buxifolia (Rhamnaceae) en el este de la provincia de Buenos Aires, Argentina
Natalia Allegrucci, María Cecilia Cazau, Marta Noemí Cabello & Angélica Margarita Arambarri
Instituto de Botánica Spegazzini, Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata. Avenida 53 n° 477, B1900AVJ, La Plata, Argentina. E-Mail: nataliaallegrucci@yahoo.com
RESUMEN: Allegrucci, N., Cazau M. C., Cabello, M. N. & Arambarri, A. M. 2005. Análisis de las comunidades de microhongos de la hojarasca de Scutia buxifolia (Rhamnaceae) en el este de la Provincia de Buenos Aires, Argentina. Darwiniana 43(1-4): 1-9.
La micobiota saprótrofa descomponedora de la hojarasca de bosques de Scutia buxifolia (Coronillo) fue analizada en dos áreas: disturbada y no disturbada, evaluando su estacionalidad. Se calculó la frecuencia relativa porcentual de cada especie, estos datos fueron utilizados para calcular el Indice de Diversidad de Shannon y Weaver, H; la Riqueza específica, S y la Equitatividad, E. Del análisis de la comunidad fúngica de Coronillo en ambas áreas, la composición específica no varía con relación al disturbio; sin embargo, se observan cambios en la riqueza específica y la frecuencia relativa de las especies. Un análisis de componentes principales mostró tendencias de estacionalidad: las especies se agruparon en verano-otoñales e invierno-primaverales de acuerdo a su abundancia a lo largo del año.
Palabras clave: Comunidad fúngica, Hojarasca, Scutia, Disturbio.
ABSTRACT: Allegrucci, N., Cazau M. C., Cabello, M. N. & Arambarri, A. M. 2005. Analysis of microfungal communities on Scutia buxifolia (Rhamnaceae) leaf litter from eastern Buenos Aires Province, Argentina. Darwiniana 43(1-4): 1-9.
Decomposer saprotrophic mycobiota of leaf litter from woods of Scutia buxifolia (Coronillo) was analyzed in both disturbed and non disturbed areas, evaluating their seasonal variations. The relative frecuency of each species was calculated, and this information was used to establish the Diversity Index (Shannon-Weaver), H; species richness, S; and evenness, E. From the analysis of the fungal community of Coronillo in both areas, we found the fungal community has not changed regarding disturbance, although its effects is reflected in the species richness and relative frecuency of the species. A principal component analysis showed seasonal tendencies: some species were found to be abundant in summer-autumn whereas others had higher abundance in winter-spring.
Keywords: Fungal communities, Leaf litter, Scutia, Distrurbance.
Original recibido el 10 de junio de 2005;
aceptado el 14 de septiembre de 2005.
INTRODUCCIÓN
La descomposición y la mineralización de los nutrientes de los restos orgánicos es de considera ble importancia para el funcionamiento de los ecosistemas, así como la composición específica de los organismos descomponedores debido a su influencia en la tasa de descomposición (Swift et al., 1979).
Los hongos juegan un papel importante en estos procesos y sus funciones incluyen la volatilización de C, H y O, la reducción en volumen de los materiales orgánicos, la fragmentación de las macromoléculas, el incremento de la homogeneidad del sustrato, favoreciendo la asimilación por parte de los microbios y organismos que se alimentan de detritos. La mineralización del N, P, K, S, y otros iones a partir de la materia orgánica e inorgánica acompaña comúnmente a la descomposición (Christensen, 1989). La productividad primaria y el funcionamiento a largo plazo de los ecosistemas depende de estas actividades (Doran & Parkin, 1994, 1996).
A pesar de toda la importancia que la micobiota tiene en los procesos arriba mencionados, es poca la atención que se le ha prestado al papel de los hongos en el funcionamiento de los ecosistemas, y en el mantenimiento de su diversidad (Hawksworth, 1991).
En la Argentina se han realizado estudios relacionados con la micobiota que interviene en la degradación de la hojarasca de diversas especies de Nothofagus (Arambarri, 1981; Gamundí et al., 1977; Godeas et al., 1985) y otras plantas que conforman estas comunidades (Pancotto et al., 2003). Estos estudios corresponden a bosques templados-fríos. Por otro lado, muchos trabajos han sido publicados sobre la ecología de los hongos de la hojarasca de bosques tropicales y la identificación de comunidades fúngicas específicas (véase Rambelli et al., 2004).
Los bosques nativos xéricos dominados por Scutia buxifolia Reiss (Fam. Rhamnaceae) "coronillo" y Celtis tala Gill ex Planch (Fam. Ulmaceae) "tala", constituyen una de las comunidades boscosas mejor conservada de la región pampeana ubicada en la provincia de Buenos Aires, Argentina (Cabrera, 1939; Goya et al., 1992). Estos bosques han sufrido un importante proceso degradativo desde los comienzos del siglo XX debido al incremento de áreas urbanas y agrícolas, así como también, al uso de madera como combustible (Parodi, 1940), a la extracción de conchilla, y al pastoreo constante de los animales que impiden el crecimiento de los rebrotes y que utilizan estas áreas como protección durante el invierno.
Cabello & Arambarri (2002) realizaron un estudio de la micobiota saprótrofa del suelo en estos bosques. Esta contribución analiza la micobiota saprótrofa descomponedora de la hojarasca en bosques de Scutia buxifolia disturbados y no disturbados por el método artificial de raleo, evaluando su estacionalidad.
MATERIALES Y MÉTODOS
Área de estudio
El área de estudio corresponde a un bosque xérico dominado por Scutia buxifolia y Celtis tala situado a 20 km, al SE de la localidad de Magdalena, provincia de Buenos Aires, Argentina. Los bosques se desarrollan sobre áreas de relieve positivo constituidas por depósitos calcáreos denominados cordones conchiles, constituidos por material de origen biológico, originados por trasgresiones y regresiones marinas en el Cuaternario. Estos depósitos forman cordones paralelos a la costa del Río de La Plata y alternan con áreas de relieve negativo (intercordones) cubiertas por pastizales anegables (Arturi, 1997). Los suelos de los cordones están bien drenados y aireados con un pH cercano a 9. El clima regional presenta una temperatura media anual de 15 °C y precipitaciones de 885 mm por año (Servicio Metereológico Nacional, 1986).
Se seleccionaron dos áreas de estudio dentro del bosque nativo de Scutia buxifolia: una zona control y una disturbada por el método artificial de raleo (Smith et al., 1997).
Se realizaron muestreos trimestrales en ambas áreas, durante el período de un año (Febrero, Mayo, Julio y Septiembre de 2003). Para la obtención de la micobiota asociada a la hojarasca se recolectaron hojas de coronillo enteras y se colocaron 100 hojas en cajas de Petri con papel de filtro, las cuales fueron humedecidas e incubadas a temperatura ambiente durante un mes (Pasqualetti et al., 1999; Arambarri, 1981). Se efectuaron observaciones semanales y se identificaron las especies presentes, las cuales fueron depositadas en el herbario del Instituto de Botánica Spegazzini (LPS). Algunas especies fueron aisladas y conservadas en el cepario del Instituto de Botánica Spegazzini (LPSC).
Las especies fueron identificadas de acuerdo con Ellis (1971, 1976), Kendrick (1980), Matsushima (1971, 1975) y Gams (1993). Aquellas que sólo están determinadas a nivel género están en estudio y podrían corresponder a especies nuevas.
Análisis de los datos
Con las especies taxonómicamente determinadas se calculó la frecuencia relativa porcentual de cada especie como el número de veces que aparece una especie / número total de presencias de todas las especies en la muestra X 100. Estos datos fueron utilizados para calcular el índice de Diversidad de Shannon y Weaver, H; riqueza específica, S y equitatividad, E; de acuerdo con Magurran (1988).
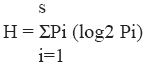
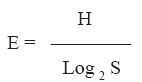
Para discriminar las comunidades fúngicas y establecer tendencias de estacionalidad se utilizó el Análisis de los Componentes Principales empleando el programa "Multi-Variate Statistical Package" (MVSP 3.1)
RESULTADOS
Se examinaron un total de 800 hojas y se registraron 49 especies de hongos imperfectos. La Tabla 1 muestra la lista de especies que constituyen la comunidad fúngica para ambas situaciones del bosque de coronillo. El mayor valor del índice corresponde al bosque disturbado, lo mismo se observa en la riqueza específica, registrándose un valor de 46 especies para el bosque disturbado y 34 para bosque no disturbado. No se encontraron diferencias en la equitatividad, la cual presentó un valor de 0.78.
Tabla 1.- Lista de las especies encontradas en ambas situaciones de el bosque de Coronillo. Las especies están ordenadas de acuerdo a su contribución al índice de Diversidad en forma decreciente. H, Indice de Diversidad; S, Riqueza específica; E, Equitatividad.
Los taxa identificados en el bosque no disturbado, ordenadas de acuerdo a su contribución al índice de diversidad fueron: Ciliochorella sp. (0.41), Chalara hughessi (0.36), Idriella tropicalis (0.35), Cladosporium cladosporioides (0.29), Solosympodiella rigidentata (0.29), Gyrothrix podosperma (0.27), Cylindrocladium sp. (0.25), Circinotrichum chathamiense (0.22), Dactylaria obtriangularia (0.21), Chalara sp. (0.19), Gyrothrix verticiclada (0.17), Circinotrichum maculiforme (0.16), Mirandina corticola (0.15) y Circinotrichum papakurae (0.12)
Las especies que aparecieron exclusivamente en este bosque son: Pyriculariopsis parasitica, Ramichloridium schulzeri y Tubercularia sp.
En el bosque disturbado las especies identificadas, ordenadas de acuerdo con su contribución al índice de diversidad fueron: Ciliochorella sp. (0.4), Idriella tropicalis (0.33), Cladosporium cladosporioides (0.33), Gyrothrix podosperma (0.29), Cylindrocladium sp. (0.27), Chalara hughessi (0.26), Dactylaria obtriangularia (0.23), Solosympodiella rigidentata (0.22), Circinotrichum chathamiense (0.21), Gyrothrix verticiclada (0.2), Mirandina corticola (0.19), Circinotrichum papakurae (0.18), Circinotrichum maculiforme (0.16) y Gyrothrix flagella (0.12).
El número de especies exclusivas de este bosque fue mayor al del bosque no disturbado, estos taxa fueron: Aspergillus sp., Beltrania rhombica, Cylindrocarpon orthosporum, Chaetopsina ramífera, Dictyosporium trirramosum, Epicoccum nigrum, Fusariella atrovirens, Myrothecium sp., Phaeotrichoconis sp., Sympodiella sp., Acrostalagmus luteo-albus y Volutella ciliata.
La frecuencia relativa de las especies varió en relación con el estado del bosque (Figuras 1 y 2) En el bosque no disturbado las especies presentaron mayores frecuencias que en el bosque disturbado durante todo el año. Las frecuencias relativas más altas en el bosque no disturbado se registraron en invierno, presentándose en esta misma estación los valores más bajos en el bosque disturbado (dato no mostrado).
Existen especies que se presentan a lo largo de todo el año y que representan por lo tanto los componentes básicos de la comunidad, tales como: Ciliochorella sp., Chalara hughessi, Idriella tropicalis, Cladosporium cladosporioides, Solosympodiella rigidentata, Gyrothrix podosperma, Cylindrocladium sp., Circinotrichum chatamiensis, Dactylaria obtriangularia, Chalara sp, Gyrothrix verticiclada, Circinotrichum maculiforme, Mirandina corticola, Circinotrichum papakurae , Idriella lunata y Gyrothrix flagella. La variación en sus frecuencias durante las diferentes estaciones del año determinó una tendencia de estacionalidad. La Figura 3 muestra el gráfico bidimensional de los componentes I-III del Análisis de los Componentes Principales. Los tres primeros componentes explicaron el 83,06 % de la variación total (Tabla 2), siendo el primer componente el que mejor discriminó los muestreos del bosque de coronillo en dos grupos estacionales: a) en el extremo negativo del eje las especies verano-otoñales, caracterizadas por Gyrothrix podosperma, Solosympodiella rigidentata, Beltraniella sp., y Circinotrichum chathamiense, presentaron abundancias más altas en estas estaciones (verano y otoño) y b) en el extremo positivo, las especies invierno-primaverales, caracterizadas por Idriella tropicalis, Dactylaria obtriangularia y Cladosporium cladosporioides.
Fig. 1.-Variación estacional de la frecuencia relativa de las especies fúngicas más frecuentes en el bosque no disturbado.
Fig. 2.- Variación estacional de la frecuencia relativa de las especies fúngicas más frecuentes en bosque disturbado.
Tabla 2.- Análisis de componentes principales. N. ALLEGRUCCI et al. Análisis de las comunidades de microhongos de la hojarasca de Scutia buxifolia
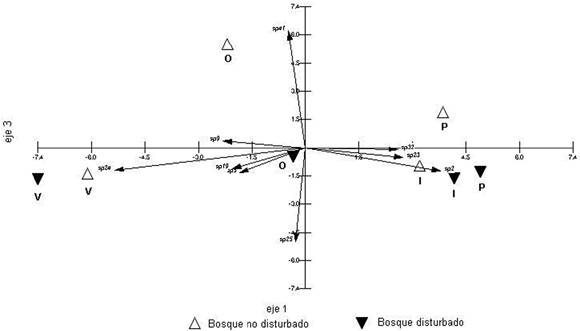
Fig. 3.-Análisis de componentes principales. Gráfico bidimensional con la proyección de las muestras en los componentes I-III. Abreviaturas: O, otoño; I, invierno; P, primavera; V, verano.
DISCUSIÓN
La comunidad de hongos imperfectos que crece en la hojarasca de coronillo está integrada por especies diferentes a las que caracterizan la micobiota del suelo de la misma área. Por lo tanto es mayor la riqueza de especies en el bosque disturbado, al contrario de lo que ocurre en las comunidades del suelo donde Cabello & Arambarri (2002) encontraron que esto ocurre en el área sin disturbio.
La composición específica encontrada en la hojarasca de los bosques de coronillo difiere de la descripta para la hojarasca de otras plantas (ver Gamundi et al., 1977; Yanna & Hyde, 2002; Rambelli et al., 2004; Arambarri et al., 1981; Pasqualetti et al., 1999).
Cilichorella sp. presentó los porcentajes de abundancia más altos en ambas situaciones del bosque; este género ha sido registrado como un habitante característico de varias clases de hojarascas de angiospermas de los trópicos y subtrópicos (Nag Raj, 1993). Otras especies de los géneros Idriella, Cylidrocladium, Chalara, Gyrothrix y Circinotrichum han sido también encontrados en otras hojarascas (Rambelli op cit). Cladosporium cladosporioides es una especie comúnmente presente durante el año; es un patógeno débil frecuente del filoplano y hojarascas de varias plantas de regiones templadas (Lee & Hyde, 2002).
La frecuencia de especies saprotróficas exhibió una variación estacional en el presente estudio. Las muestras se agruparon en verano-otoñales e invierno-primaverales, las especies que caracterizan ambos grupos se encuentran presentes durante todo el año, aumentando su abundancia en dichas estaciones. Alternaria alternata, Mirandina corticola, Idriella lunata, Circinotrichum maculiforme y C. papakurae fueron especies que mostraron frecuencias relativas bajas y exhibieron variaciones mínimas de la misma a lo largo del año. Estas especies podrían ser consideradas como poco sensibles a las variaciones estacionales.
Por otro lado, el pico de mayor frecuencia de especies en el bosque no disturbado fue en invierno, presentándose en esta misma estación los valores más bajos para el bosque disturbado. Este hecho se podría relacionar con los efectos producidos por el raleo, las modificaciones que el mismo produce en el ambiente físico tendrían un mayor impacto sobre la frecuencia de los microorganismos.
Del análisis de la comunidad fúngica de coronillo en ambas situaciones de bosque, surge que la misma no varía en relación con el disturbio. Sin embargo, estos efectos se reflejan en la riqueza específica y en la frecuencia relativa de las especies. Dependiendo de la escala del evento, los disturbios podrían incrementar la heterogeneidad del sistema por la creación de nuevos espacios en el hábitat para la colonización (Denslow, 1985). Aunque el efecto primario del disturbio es la creación de nuevos espacios, éste es generalmente asociado con un cambio en la disponibilidad de otros recursos tales como la luz y los nutrientes, o con un cambio en el ambiente físico: temperatura, radiación solar y humedad. Paine (1979) observó que un disturbio regular a pequeña escala tiende a promover la coexistencia de los organismos, a diferencia de uno a larga escala. Connell (1978) propuso la hipótesis del disturbio intermedio, la cual establece que la biodiversidad debería ser mayor cuando los niveles de disturbio en el espacio y el tiempo son intermedios en intensidad.
Los resultados obtenidos en el presente trabajo concuerdan con los encontrados por Denslow (1985) para comunidades vegetales. Este autor demuestra que la presencia de un disturbio puede operar alterando la heterogeneidad ambiental, produciendo cambios temporales en la heterogeneidad o modificando la abundancia relativa de las especies.
AGRADECIMIENTOS
Los autores agradecen a la Facultad de Ciencias Naturales y Museo por facilitar el traslado al lugar de muestreo, y el financiamiento parcial y a la Licenciada Ana Bucsinszky por su colaboración con el material de laboratorio. Esta investigación es parte de los proyectos N411 UNLP y CYTED, Red Iberoamericana sobre Diversidad, Ecología y uso de hongos microscopicos (REDEMIC). Para su realización se recibieron subsidios de CIC y ANPCyT No 13404 BID.
BIBLIOGRAFÍA
1. Arambarri, A. M. 1981. Micoflora de la hojarasca de Nothofagus oblicua y N. pumilio. I. Bol. Soc. Argent. Bot. 20: 19-30. [ Links ]
2. Arturi, M. 1997. Regeneración de Celtis tala en el Noreste de la Provincia de Buenos Aires. Tesis doctoral, Facultad de Ciencias Naturales y Museo. Universidad Nacional de La plata. [ Links ]
3. Cabello, M. & A. Arambarri. 2002. Diversity in soil fungi from undisturbed and disturbed Celtis tala and Scutia buxifolia forest in the eastern Buenos Aires province (Argentina). Microbiol. Res. 157: 115-125. [ Links ]
4. Cabrera, A. 1939. Las comunidades vegetales de las dunas costeras de la Provincia de Buenos Aires. DAGI 1, 3-43. [ Links ]
5. Connell, J. H. 1978. Diversity in tropical rain forest and coral reefs. Science 199: 1302. [ Links ]
6. Christensen, M. 1989. A view of fungal ecology. Mycología 81: 1-19. [ Links ]
7. Denslow, J. S. 1985. Disturbance-mediated coexistence of species, pp. 307-323, in S.T.A Pickett & P. S. White (eds.), The Ecology of Natural Disturbance and Patch Dynamics. Academic Press, New York. [ Links ]
8. Doran, J. W. & Parkin, T. B. 1994. Defining and assessing soil quality, pp. 3-21, in J.W. Doran (ed.), Defining Soil Quality for a Sustainable Environment. Soil Science of Society of America, Special Publication 35, Madison. [ Links ]
9. Doran, J. W. & Parkin, T. B. 1996. Quantitative indicators of soil quality: A minimum data set, pp. 25-37, in J. W. Doran & Jones A. J. (eds.), Methods for assessing soil quality. Soil Science of Society of America, Madison. [ Links ]
10. Gamundí, I. J., Arambarri, A. M. & Gianotti, A. 1977. Micoflora de la hojarasca de Nothofagus dombeyi. Darwiniana 21: 81-113. [ Links ]
11. Godeas, A. M., Arambarri, A. M., Gamundí, I.J. & Spinedi, H. A. 1985. Descomposición de la hojarasca en el bosque de Lenga (Nothofagus pumilio). Ciencia del Suelo 3: 68-77. [ Links ]
12. Goya, J. F., Placci, L .G., Arturi, M. F. & Brown A. D. 1992. Distribución y características estructurales de los Talares de la Reserva de Biosfera Parque Costero del Sur. Revista de la Facultad de Agronomía 68: 53-64. [ Links ]
13. Hawksworth, D. L. 1991. The fungal dimension of biodiversity: magnitude, significance, and conservation. Mycol. Res. 95: 641-655. [ Links ]
14. Lee, O. H. K. & Hyde, K. D. 2002. Phylloplane fungi in Hong Kong mangroves: evaluation of study methods. Mycología 94: 596-606. [ Links ]
15. Magurran, A. E. 1988. Ecological diversity and its measurement. Croom Helm, London. [ Links ]
16. Nag Raj, T.R. 1993. Coelomycetous anamorphs with appendage-bearing conidia. Mycologue Publications 331, Daleview PL. Waterloo, Ontario, Canada. [ Links ]
17. Paine, R. T. 1979. Disaster, catastrophe and local persistence of the sea palm, Postelsia palmaeformis. Science 205: 685. [ Links ]
18. Pancotto, V. A., Sala, O. E., Cabello, M. N., Lopez, N. I., Robson, T. M., Ballaré, C. L., Caldwell, M. M. & Scopel, A. L. 2003. Solar UV-B decreases decomposition in herbaceous plant litter in Tierra del Fuego, Argentina: potential role of an altered decomposer community. Global Change Biology 9: 1465-1474. [ Links ]
19. Parodi, L. 1940. Distribución geográfica de los talares de la provincia de Buenos Aires. Darwiniana 4: 33-56. [ Links ]
20. Pasqualetti, M., Mulas, B., Zucconi, L. & Rambellli, A. 1999. Succession of microfungal communitieson Myrtus communis leaf litter in Sardinian Mediterranean maquis ecosystem. Mycol. Res. 103: 724-728. [ Links ]
21. Rambelli, A, Mulas B. & Pasqualetti, M. 2004. Comparative studies on microfungi in tropical ecosystems in Ivory Coast forest litter: behaviour on different substrata. Mycol. Res. 108: 325-336. [ Links ]
22. Smith, D. M., Larson, B. C., Kelty & Ashton, M. J. P. M. S. 1997. The practice of Silviculture: Applied Forest Ecology. John Wiley and Sons, New York. [ Links ]
23. Swift, M. J., Heal, O. W. & Anderson, J. M. 1979. Decomposition in terrestrial Ecosystems. University of California Press, Berkeley. [ Links ]
24. Yanna, Ho, W. H. & Hyde, K. D. 2002. Fungal succession on fronds of Phoenix hanceana in Hong Kong, pp. 183-209, in K. D. Hyde & E. B. G. Jones (eds.), Fungal Succession, Fungal Diversity 10: 183-209. [ Links ]














