Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Darwiniana, nueva serie
versión impresa ISSN 0011-6793versión On-line ISSN 1850-1699
Darwiniana v.43 n.1-4 San Isidro ene./dic. 2005
El cariotipo de Pithecellobium dulce (mimosoideae-leguminosae)
Fernando Tapia-Pastrana & Sandra Luz Gómez-Acevedo
Laboratorio de Genecología, División de Estudios de Posgrado e Investigación, Facultad de Estudios Superiores Zaragoza, UNAM, Apartado Postal 9-020, 15000 México D.F. E-mail: pasfer@correo.unam.mx
RESUMEN: Tapia-Pastrana, F. & Gómez-Acevedo, S. L. 2005. El cariotipo de Pithecellobium dulce (Mimosoideae-Leguminosae). Darwiniana 43(1-4): 52-56. 2005.
Se realizó un estudio citogenético en células provenientes de meristemos radiculares de cinco individuos de Pithecellobium dulce (Leguminosae) provenientes de Cañón de Lobos, Morelos, México (18°51'20''N, 99°06'W, 1105 m s.m.) utilizando un método de extendido y secado al aire. Sobre un análisis de 456 células se confirmó un número cromosómico diploide 2n= 26 con baja frecuencia de células tetraploides (4,38%). Se obtuvo además, por primera vez, la fórmula cariotípica para una población de esta especie (14m+10sm+2st), la longitud cromosómica total diploide (42,13 µm), el intervalo cromosómico (1,32 - 2,07 µm) y el índice de asimetría (T.F.%= 39,14). Estos datos se compararon con el único registro cariotípico previo de una especie del género, P. candidum. La carencia de datos citogenéticos impide por el momento vislumbrar la participación de cambios citogenéticos en la evolución del género.
Palabras clave: Pithecellobium, México, Cariotipo, Extendido y secado al aire, Cromosomas subtelocéntricos.
ABSTRACT: Tapia-Pastrana, F. & Gómez-Acevedo, S. L. 2005. The karyotype of Pithecellobium dulce (Mimosoideae-Leguminosae). Darwiniana 43(1-4): 52-56. 2005.
Meristematic root cells from germinating seeds of five plants of Pithecellobium dulce (Leguminosae) from Cañon de Lobos, Morelos, Mexico (18° 51' 20'' N, 99° 06' W, 1105 m s.m.) were cytogenetically analyzed using a surface spreading and air-drying method for plant chromosomes. Cytological data from 456 nuclei showed a somatic chromosome number of 2n= 26 with a low frequency of tetraploid cells (4.38%). The mitotic karyotype established as 14m+10sm+2st is reported for the first time for a population of this species. Total diploid chromosomal length (42.13 µm), the interval of chromosomal length (1.32 - 2.07 µm) and the asymmetry index (T.F.%= 39.14) were also obtained. These data were compared with those of P. candidum, which is the only species of the same genus with an earlier cytogenetic analysis. The scarcity of detailed karyotypic analyses prevents at present time to discuss about the cytogenetic changes in the evolution of the genus.
Keywords: Pithecellobium, Mexico, Karyotype, Spreading and air-drying, Subtelocentric chromosomes.
Original recibido el 30 de julio de 2002;
aceptado el 8 de marzo de 2005.
INTRODUCCIÓN
Pithecellobium Martius (Mimosoideae – Leguminosae) es un género endémico neotropical ymonofilético que incluye árboles y arbustos mesófilos perennifolios y xerófilos deciduos con alturas menores de un metro hasta más de 10 y potencialmente entre 15-20 metros, la mayoría armados con estípulas ligniscentes en los nudos. El grupo comprende 18 especies de las tierras bajas de Norte y Suramérica, tres de las cuales se extienden desde el Norte de México subtropical, Bahamas y la Península de la Florida, y una de éstas (P. dulce) ha sido cultivada y naturalizada circuntropicalmente (Barneby & Grimes, 1997).
El género Pithecellobium difiere consistentemente de las demás especies de la tribu Ingeae por presentar el funículo modificado en un arilo esponjoso que cubre un tercio o la mitad de la semilla. En las vainas dehiscentes, las semillas se encuentran suspendidas sobre este funículo ariliforme rojo, rosa o blanco, el cual es atractivo a las aves y comestible para el hombre (Barneby & Grimes, 1997).
En particular, Pithecellobium dulce (Roxb.) Benth. es una especie perennifolia cuya distribución original comprende desde el este y oeste de México (sur de Baja California Sur, sur de Sonora y Tamaulipas), América Central hasta Colombia interandina y el oeste de Venezuela, encontrándose desde el nivel del mar hasta aproximadamente 1550 m s.m. Asimismo, esta especie ha sido ampliamente introducida en otras partes del mundo como el oeste de la India, Filipinas, Asia tropical, Florida subtropical, las islas hawaianas, Guyana y el este de Brasil (Barneby & Grimes, 1997).
En México se la conoce vulgarmente con los nombres de "Guamúchil", "Huamúchil", "Guamuti" (Barneby & Grimes, 1997) y es un árbol común en los climas cálidos de todo el país (Martínez, 1994). Pithecellobium dulce se caracteriza por presentar hojas tetrafoliadas; flores en cabezuela; vainas dehiscentes, lineares, curvadas o enrolladas y semillas reniformes negras cubiertas por un arilo carnoso (Barneby & Grimes, 1997). Es una especie de uso alimenticio, ornamental, maderable, de rápido crecimiento y adaptada a la temporada de sequía (Challenger, 1988).
Cariotípicamente Pithecellobium es un género poco conocido pues la literatura únicamente registra trabajos sobre números cromosómicos (Carvalheira et al., 1991; Jahan et al., 1994) y con excepción de P. candidum (Rico, 1992) hasta el momento no se localizan registros detallados sobre la morfología cromosómica de las especies del grupo.
El presente estudio citológico tiene como objetivo revelar características detalladas del cariotipo somático de Pithecellobium dulce y establecer la fórmula cariotípica y demás características cuantitativas para una población mexicana, como una contribución al conocimiento de la arquitectura cromosómica de esta especie de amplia distribución geográfica y ecológica, e importancia económica.
MATERIALES Y MÉTODOS
Se coleccionaron frutos de cinco individuos arbóreos de Pithecellobium dulce provenientes de Cañón de Lobos, Mpio. de Yautepec, Edo. de Morelos, México, 18°51'20''N, 99°06'W; 1105 m s.m. [15-IV-2003, Tapia y Gómez 35 (FEZA)]. Cuarenta semillas seleccionadas al azar de cada individuo fueron puestas a germinar a temperatura ambiente y en luz natural en cajas de Petri con algodón humedecido con agua destilada. Las raíces de 1-2 cm de largo fueron cortadas y pretratadas en 8-hidroxiquinoleína 0,002 M durante 5 horas a temperatura ambiente. Posteriormente fueron fijadas en solución Farmer (etanol-ácido acético, 3:1). Para la obtención de los cromosomas metafásicos se siguió un método de secado al aire (Tapia-Pastrana & Mercado-Ruaro, 2001), el cual se basa en la maceración enzimática (pectinasa 20% + celulasa 2%) de los meristemas radiculares durante 2 horas en estufa a 37 oC, seguido de la transferencia de las células liberadas y separadas por centrifugación a 1500 rpm a una solución fresca de KCl 0,075 M durante 20 minutos a 37 oC (lo cual produce un choque hipotónico). Posteriormente, se realizaron dos lavados con la misma solución de KCl y las células entonces fueron nuevamente fijadas en solución Farmer y lavadas dos veces más, usando cada vez solución Farmer fresca. Las laminillas fueron preparadas dejando caer dos gotas del paquete celular en dilución sobre portaobjetos y se dejaron secar al aire. La tinción de los cromosomas fue realizada con Giemsa al 10% y las preparaciones se hicieron permanentes empleando resina sintética. Los mejores campos fueron fotografiados en un microscopio óptico Carl Zeiss Axioscop usando película Kodak Technical Pan.
Se utilizó un vernier digital (Mitutoyo Digimatic Caliber CD-GBS) para establecer los tamaños cromosómicos sobre diez fotografías de placas metafásicas típicas con la misma magnificación y sólo se usaron cinco de éstas para la caracterización morfológica de los cromosomas y elaboración del cariotipo. Para la obtención de la fórmula cariotípica se aplicó el sistema propuesto por Levan et al. (1964). La proporción de la suma total de longitudes de brazos cortos respecto a la suma total de longitudes cromosómicas como indicador de asimetría de un cariotipo (T.F.%) se realizó según Sinha & Roy (1979).
RESULTADOS
Se revisaron un total de 456 células en metafase de las cuales 436 (95,61%) presentaron un número diploide 2n= 26 y sólo 20 (4,38%) exhibieron un 2n= 4x= 52. La fórmula cariotípica obtenida fue 14m + 10sm + 2st. Las constricciones secundarias y satélites fueron ubicados en los brazos cortos de un par de cromosomas submetacéntricos (Figs. 1A-B, 2 y Tabla 1). La longitud cromosómica total diploide para esta especie fue de 42,13 ± 3,13 µm, con un intervalo cromosómico de 1,32 ± 0,09 -2,07 ± 0,13 µm y una T.F.%= 39,14 (Tabla 2).
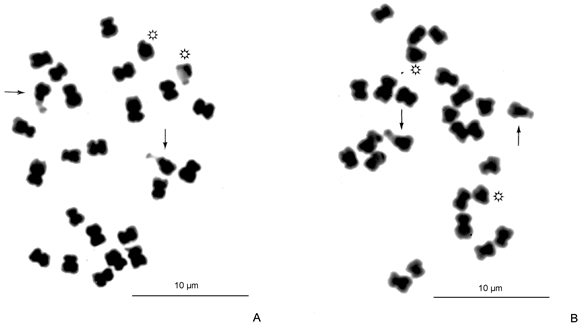
Fig. 1.- A-B: metafases mitóticas (2n = 26) de Pithecellobium dulce. Las flechas señalan a los cromosomas satelitados. Los asteriscos resaltan a los cromosomas subtelocéntricos.

Fig. 2.- Cariotipo de Pithecellobium dulce. Los cromosomas están alineados por el centrómero y en orden decreciente.
Tabla 1.- Medidas cromosómicas promedio en Pithecellobium dulce. NC, número de cromosoma; LCT, longitud cromosómica total en µm; LBL, longitud brazo largo en µm; LBC, longitud brazo corto en µm; r, proporción de brazos; N, nomenclatura en base a Levan et al. (1964); *, cromosoma con satélite.
Tabla 2.- Características del complemento cromosómico de Pithecellobium dulce. FC, fórmula cariotípica; LCTD, longitud cromosómica total diploide en µm; IC, intervalo cromosómico en µm; TF, índice de asimetría en base a Sinha & Roy (1979).

DISCUSIÓN
El número cromosómico diploide 2n= 26 obtenido aquí para una población de Pithecellobium dulce confirma recuentos cromosómicos previos en esta especie (Carvalheira et al., 1991; Jahan et al., 1994) y concuerda con el hallado en otras especies del género (Yeh et al., 1986).
Nuestros resultados revelan un complemento cromosómico con asimetría de bajo orden, característica atribuida principalmente a la presencia de un par st. Los cromosomas subtelocéntricos se consideran escasos en las Leguminosas y se asocian generalmente con géneros de la subfamilia Papilionoideae, considerada la más avanzada (Bairiganjan & Patnaik, 1989; Mercado-Ruaro & Delgado-Salinas, 1998; Souza & Benko-Iseppon, 2004); sin embargo, en años recientes han sido hallados también en especies de las subfamilias Caesalpinioideae (Zanin & Cangiano, 2001) y Mimosoideae (Tapia-Pastrana & Mercado-Ruaro, 2001; Gómez-Acevedo & Tapia-Pastrana, 2003) por lo que su participación en los cariotipos de éstas podría ser mayor a la considerada hasta ahora.
Por otra parte, en la bibliografía especializada sólo se encuentra el cariotipo de otra especie del género, la sudamericana P. candidum (14m + 12sm), con constriciones secundarias y satélites localizados en un par de cromosomas metacéntricos (Rico, 1992). No obstante que su fórmula cariotípica difiere nominalmente con la obtenida aquí para P. dulce (14m + 10sm + 2st), una revisión cuidadosa de ambos complementos permite apreciar una estrecha similitud. Los dos cariotipos incluyen 7 pares de cromosomas metacéntricos y la principal diferencia se encuentra en el par de cromosomas subtelocéntricos registrados en P. dulce y en el tipo de cromosomas que portan la constricción secundaria y el satélite. Se puede considerar que tales diferencias son más aparentes que reales y podrían explicarse si se considera la posibilidad que en P. candidum un par subtelocéntrico haya sido interpretado cualitativamente como submetacéntrico. En cuanto al cromosoma satelitado, se puede argumentar que en especies con cariotipos ligeramente asimétricos, la morfología cromosómica se establece con mayor precisión cuando se dispone de un número suficiente de metafases típicas y con un grado de contracción óptimo, como sucedió en la presente investigación. Con respecto a la talla cromosómica, el intervalo obtenido aquí (1,31 - 2,07 µm) es menor que el de la especie suramericana (1,6 - 2,45 µm), sin embargo éstos son proporcionalmente similares.
La carencia de información citogenética sobre especies del género Pithecellobium dificulta el estudio comparativo de los cariotipos y sus características cuantitativas, limita una discusión más profunda sobre la probable participación de cambios cromosómicos en la evolución del género, en sus procesos de especiación así como el establecimiento de algún tipo de especialización del genoma en relación con el hábitat. También indica la necesidad de realizar más estudios detallados sobre la morfología cromosómica en este grupo que contribuyan con su tratamiento taxonómico y a evidenciar patrones evolutivos en las leguminosas, mismos que pueden facilitarse con el empleo de métodos citogenéticos alternativos a la técnica clásica de aplastado como el utilizado aquí.
AGRADECIMIENTOS
Los autores agradecen al Dr. Alfonso Delgado Salinas (Instituto de Biología, UNAM) y a la Dra. Lourdes Rico Arce (Royal Botanic Gardens, Kew) por la revisión crítica del manuscrito y sus valiosos comentarios y a la Biól. Carmen Loyola quien fotografió el cariotipo.
BIBLIOGRAFÍA
1. Bairiganjan, G. C. & Patnaik, S. N. 1989. Chromosomal evolution in Fabaceae. Cytologia 54: 51-64. [ Links ]
2. Barneby, R. C. & Grimes, J. W. 1997. Silk tree, guanacaste, monkey's earring: A generic system for the synandrous Mimosaceae of the Americas. Part II. Pithecellobium, Cojoba, and Zygia. Mem. New York Bot. Gard. 74: 1-149. [ Links ]
3. Carvalheira, G. M. G., Guerra, M., Dos Santos, G. G., De Andrade, V. C. & De Farias, M. C. A. 1991. Citogenética de angiospermas colectadas en Pernambuco-IV. Acta Bot. Bras. 5: 37-51. [ Links ]
4. Challenger, A. 1988. Utilización y conservación de los ecosistemas terrestres de México. Pasado, presente y futuro. CONABIO, IBUNAM, Sierra Madre, México. [ Links ]
5. Gómez-Acevedo, S. L. & Tapia-Pastrana, F. 2003. Estudio genecológico en Prosopis laevigata, Acacia farnesiana y Acacia schaffneri (Leguminosae). Darwiniana 41: 47-54. [ Links ]
6. Jahan, B., Vahidy, A. A. & Ali, S. I. 1994. Chromosome numbers in some taxa of Fabaceae mostly native to Pakistan. Ann. Missouri Bot. Gard. 81: 792-799. [ Links ]
7. Levan, A., Fredga, K. & Sandberg, A. A. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52: 201-219. [ Links ]
8. Martínez, M. 1994. Plantas mexicanas. Fondo de Cultura Económica, México. [ Links ]
9. Mercado-Ruaro, P. & Delgado-Salinas, A. 1998. Karyotypic studies on species of Phaseolus (Fabaceae: Phaseolinae). Amer. J. Bot. 85: 1-9. [ Links ]
10. Rico, A. M. L. 1992. New chromosome counts in neotropical Albizia, Havardia and Pithecellobium, and a new combination for Albizia (Leguminosae-Mimosoideae-Ingeae). Bot. J. Linn. Soc. 108: 269-274. [ Links ]
11. Sinha, S. S. N. & Roy, H. 1979. Cytological studies in the genus Phaseolus I. Mitotic analysis in fourteen species. Cytologia 44: 191-199. [ Links ]
12. Souza, M. G. C. & Benko-Iseppon, A. M. 2004. Cytogenetics and chromosome banding patterns in Caesalpinioideae and Papilionoideae species of Pará, Amazonas, Brazil. Bot. J. Linn. Soc. 144: 181-191. [ Links ]
13. Tapia-Pastrana, F. & Mercado-Ruaro, P. 2001. A combination of the "squash" and "splash" techniques to obtain the karyotype and assess meiotic behavior of Prosopis laevigata L. (Fabaceae: Mimosoideae). Cytologia 66: 11-17. [ Links ]
14. Yeh, M. S., Yuasa, H. & Maekawa, F. 1986. Chromosome numbers in the Leguminosae. Sci. Rep. Res. Inst. Evol. Biol. 3: 57-71. [ Links ]
15. Zanín, L. A. & Cangiano, M. A. 2001. El cariotipo de Hoffmannseggia glauca (Fabaceae). Darwiniana 39: 11-13. [ Links ]














