Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Darwiniana, nueva serie
Print version ISSN 0011-6793On-line version ISSN 1850-1699
Darwiniana vol.44 no.1 San Isidro Jan./July 2006
Micromorfología de la epidermis de la lemma de Trisetum y géneros afines (Poaceae, Pooideae)
Víctor L. Finot1, Carlos M. Baeza2 & Oscar Matthei2
1 Departamento de Producción Animal, Facultad de Agronomía, Universidad de Concepción, Casilla 537, Chillán, Chile; vifinot@udec.cl (autor corresponsal).
2 Departamento de Botánica, Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción, Casilla 160-C, Concepción, Chile.
Resumen. Finot, V. L., C. M. Baeza & O. Matthei. 2006. Micromorfología de la epidermis de la lemma de Trisetum y géneros afines (Poaceae, Pooideae). Darwiniana 44(1): 32-57.
Las características micromorfológicas de la lemma de Trisetum y géneros relacionados de Pooideae (Poaceae) fueron investigadas utilizando microscopia electrónica de barrido, con el objeto de evaluar la circunscripción del género Trisetum y sus relaciones sistemáticas. Se estudiaron 76 especies, incluyendo 32 especies de Trisetum y especies seleccionadas de Amphibromus (1 sp.), Avena (2 spp.), Avenula (6 spp.), Deschampsia (6 spp.), Dielsiochloa (1 sp.), Graphephorum (2 spp.), Gymnachne (1 sp.), Helictotrichon (8 spp.), Koeleria (5 spp.), Leptophyllochloa (1 sp.), Peyritschia (4 spp.), Raimundochloa (1 sp.), Relchela (1 sp.), Rhombolytrum (1 sp.), Rostraria (1 sp.) y Sphenopholis (3 spp.). Los resultados muestran que la epidermis de la lemma varía muy poco en las especies de cada género pero es diferente en los distintos géneros estudiados y, por tanto, es un buen carácter para estudiar la circunscripción de los géneros así como las relaciones sistemáticas en Pooideae. Trisetum se caracteriza por poseer células largas rectangulares, células silíceas usualmente presentes, estomas ausentes y ganchos y aguijones presentes. Diferencias en la presencia de células silíceas, aguijones y varias otras características demuestran que Peyritschia es distinto de Trisetum. Las especies de Peyritschia generalmente carecen de células silíceas, macropelos y aguijones. Células silíceas y aguijones están usual-mente presentes en Trisetum y algunas especies poseen macropelos que cubren la lemma. Las especies examinadas de Sphenopholis tienen células epidérmicas más cortas que las especies de Trisetum y algunas especies de Sphenopholis tienen estomas en la porción apical de la lemma. Los resultados sugieren que Sphenopholis interrupta (=Trisetum interruptum) debe ser excluido de Trisetum y clasificado en el género Sphenopholis. Deschampsia es muy diferente de Trisetum en cuanto a las características epidérmicas de la lemma. Las especies estudiadas de Deschampsia tienen células epidérmicas muy largas, ausencia de células silíceas y usualmente carecen de aguijones y ganchos y poseen células largas con paredes anticlinales rectas. Los géneros Amphibromus, Avena, Avenula, Helictotrichon, Gymnachne, Rhombolytrum, Dielsiochloa, Leptophyllochloa y Raimundochloa muestras diversas combinaciones de características micromorfológicas que avalan su delimitación recíproca y de Trisetum. Por otra parte, Graphephorum, Rostraria y Koeleria son muy similares a Trisetum en las características epidérmicas de la lemma.
Palabras clave. Trisetum; Pooideae; Poaceae; Lemma; Micromorfología.
Abstract. Finot, V. L., C. M. Baeza & O. Matthei. 2006. Epidermis micromorphology of the lemma in Trisetum and related genera (Poaceae, Pooideae). Darwiniana 44(1): 32-57.
The micromorphological features of the lemma were investigated in Trisetum and related genera in Pooideae (Poaceae) using scanning electron microscopy to evaluate the circumscription of the genus Trisetum and its systematic relationships. Seventy six species were studied including 32 species of Trisetum and selected species of Amphibromus (1 sp.), Avena (2 spp.), Avenula (6 spp.), Deschampsia (6 spp.), Dielsiochloa (1 sp.), Graphephorum (2 spp.), Gymnachne (1 sp.), Helictotrichon (8 spp.), Koeleria (5 spp.), Leptophyllochloa (1 sp.), Peyritschia (4 spp.), Raimundochloa (1 sp.), Relchela (1 sp.), Rhombolytrum (1 sp.), Rostraria (1 sp.) and Sphenopholis (3 spp.). The results showed that the epidermis of the lemma varies very little within the studied genera, thus it is a good character for the generic circumscription and to study the generic relationships in Pooideae. Trisetum is characterized by rectangular long cells, silica cells usually present, stomata absent, and hooks and prickle hairs present. Differences in the presence of silica cells, prickle hairs and various other epidermal features showed that Peyritschia is distinct from Trisetum. Species of Peyritschia generally lack silica cells, macrohairs and prickle hairs. Silica cells and prickle hairs are usually present in Trisetum and some species have macrohairs covering the lemma. Species examined of Sphenopholis have epidermal cells shorter than species of Trisetum and some species of Sphenopholis have stomata in the apical portion of the lemma. The results suggest that Sphenopholis interrupta (= Trisetum interruptum) should be excluded from Trisetum and classified in the genus Sphenopholis. Deschampsia is very distinct from Trisetum in the epidermal characteristics of the lemma. Studied species of Deschampsia have very long epidermal cells, absence of silica cells, prickle hairs and hooks usually absent, and long cells with straight anticlinal walls. The genera Amphibromus, Avena, Avenula, Helictotrichon, Gymnachne, Rhombolytrum, Dielsiochloa, Leptophyllochloa, and Raimundochloa showed various combinations of micromorphological features supporting their generic distinction among them and from Trisetum. On the other hand, Graphephorum, Rostraria and Koeleria are very similar to Trisetum in the epidermal characters of the lemma.
Keywords. Trisetum; Pooideae; Poaceae; Lemma; Micromorphology.
Original recibido el 30 de marzo de 2005;
aceptado el 6 de septiembre de 2005
INTRODUCCIÓN
El género Trisetum (lat., "tri" = tres, "setum" = seta), fue erigido por Persoon (1805) con 11 especies. Actualmente comprende unas 70 a 80 especies de zonas templadas y frías de ambos hemisferios (Hitchcock, 1927b, 1951; Louis-Marie, 1928, 1929; Foster, 1958, 1966; Hultén, 1959; Nicora, 1978; Marticorena & Quezada, 1985; Clayton & Renvoize, 1986; Hernández-Torres & Koch, 1988b; Tovar, 1957, 1993; Watson & Dallwitz, 1992; Zuloaga & al., 1994; Edgar, 1998; Finot, 2003b; Finot & al., 2004, 2005a,b).
Trisetum pertenece a la subtribu Aveninae, que comprende unos 23 géneros y más de 360 especies (Clayton & Renvoize, 1986; Soreng & al., 2003). Dentro de la subtribu, las relaciones filogenéticas entre los géneros se resuelven en tres líneas evolutivas, representadas por los géneros Helictotrichon Besser ex Schult. & Schult. f., Deschampsia P. Beauv. y Trisetum, respectivamente (Clayton & Renvoize, 1986). Según estos autores, Trisetum representa el grupo ancestral del cual habrían derivado Koeleria Pers., Rostraria Trin., Graphephorum Desv., Peyritschia E. Fourn., Sphenopholis Scribn. y Dielsiochloa Pilg., además de los géneros Trisetaria Forssk. y Ventenata Koeler, no representados en América. Otros géneros afines, no incluidos en el diagrama de Clayton & Renvoize (1986), son Leptophylochloa C. E. Calderón ex Nicora y Raimundochloa A. M. Molina (Molina, 1986a,b, 1989, 1993). Recientemente, Soreng & al. (2003), restringen la subtribu Aveninae a las líneas Trisetum y Helictotrichon, excluyendo a Deschampsia, lo que concuerda con los resultados de los análisis filogenéticos de Catalán & al. (1997), basados en la secuencia del gen cloroplastidial ndhF. Redefinida de este modo, la subtribu Aveninae aparece como un grupo monofilético (Soreng & Davis, 2000), que comprende 16 géneros y poco más de 80 especies en América (Soreng & al., 2003). Trisetum es el género mejor representado, con 45 especies y 20 variedades (Finot & al. 2005b).
El género Trisetum se caracteriza por la presencia de una arista dorsal y dos setas apicales que se originan por la prolongación de los nervios intermedios de la lemma (Nicora, 1978). Sin embargo, tanto el grado de desarrollo de las setas apicales como el desarrollo y posición de la arista dorsal son caracteres muy variables, que no permiten una adecuada delimitación del género. Es así que algunos autores han tratado a Trisetum en un sentido muy amplio, incluyendo en él especies de los géneros Bromus L., Calamagrostis Adans, Dielsiochloa, Graphephorum, Helictotrichon, Koeleria, Leptophyllochloa, Peyritschia, Rostraria, Sphenopholis y Trisetaria, entre otros. Por otra parte, el género ha sido dividido en subgéneros, secciones y subsecciones para acomodar las diversas especies incluidas en él (Louis-Marie, 1928, 1929; Chrtek & Jirásek, 1963; Chrtek, 1965; Finot & al., 2004, 2005a,b). En consecuencia, se hace necesario abordar la búsqueda de nuevos caracteres que contribuyan a circunscribir el género Trisetum adecuadamente.
El problema de la circunscripción del género Trisetum fue detalladamente abordado por Koch (1979), quien analiza la utilidad de diversos caracteres morfológicos (forma de la lemma, ápice de la lemma, inserción de la arista, forma de la cariopsis, consistencia del endosperma, forma de las lodículas, ápice de la lígula, etc.), así como el número de cromosomas, para distinguir Trisetum de los géneros Deschampsia y Peyritschia. Según Koch (1979), la forma de las lodículas y la consistencia del endosperma constituyen los caracteres más confiables para distinguir los géneros Trisetum y Deschampsia. Como consecuencia de este estudio, Koch (1979) acepta a Trisetum y Peyritschia como géneros diferentes y transfiere una especie desde Deschampsia a Peyritschia, este último hasta entonces monotípico. Koch (1979) sugiere que Trisetum y Deschampsia no están cercanamente relacionados y que pueden ser claramente distinguidos sobre la base de 13 de los 25 caracteres analizados. Posteriormente, sin embargo, Hernández-Torres & Koch (1987, 1988a) proponen la fusión de los géneros Trisetum y Peyritschia, considerando su estrecha afinidad morfológica y anatómica.
Otros autores, como Clayton & Renvoize (1986), Watson & Dallwitz (1992), Soreng & al. (2003) y Finot & al. (2004), en cambio, reconocen a Peyritschia como un género independiente de Trisetum. Finot (2003a) transfiere Trisetum confertum Pilg., T. deyeuxioides (Kunth) Kunth y T. humile Louis-Marie al género Peyritschia, que queda así circunscrito a cinco especies de México, Centro y Sudamérica. Peyritschia se distingue de Trisetum por las glumas 1-nervias e isomorfas, la lemma con el ápice bilobado, la arista inserta cerca de la base o reducida a un mucrón subapical, la pálea encerrada por la lemma, las lodículas lineares y el androceo compuesto por dos estambres. Trisetum posee, en cambio, glumas desiguales, la inferior 1(-3)-nervia, la superior 3(-5)-nervia, la lemma con el ápice terminado en dos setas, la arista inserta en la mitad o tercio superior de la lemma, la pálea libre de la lemma, las lodículas bilobadas y el androceo compuesto de tres estambres.
Asimismo, Scribner (1906a) analiza los límites entre los géneros Trisetum y Graphephorum, concluyendo que los caracteres morfológicos, tradicionalmente utilizados, no avalan la distinción genérica. Louis-Marie (1928, 1929) concuerda con este punto de vista y trata a Graphephorum bajo Trisetum, con el rango de subsección. Graphephorum ha sido, no obstante, aceptado posteriormente con rango de género por diversos autores (Clayton & Renvoize, 1986; Watson & Dallwitz, 1992; Finot & Soreng, 2003; Finot & al., 2005a). Graphephorum reúne sólo dos especies, endémicas de Norteamérica. Se distingue de Trisetum por la lemma con el ápice entero, por los nervios intermedios no prolongados en setas apicales y por la arista ausente o reducida a un mucrón subapical. Aunque Graphephorum comparte estos caracteres con Koeleria, se distingue de éste por su panícula laxa, carácter que lo acerca a Trisetum sect. Trisetum.
Sphenopholis es un pequeño género de Norteamérica, con 4 a 5 especies afines a Trisetum (Scribner, 1906b; Erdman, 1965; Clayton & Renvoize, 1986; Tucker 1996). Se distingue de Trisetum por la lemma con ápice entero o brevemente bidentado (bidentado y 2-setulado en Trisetum), mútica o con una arista subapical poco desarrollada (aristada en el dorso en Trisetum), por las glumas notablemente dimorfas, la superior obovada, la inferior lanceolada (isomorfas o subisomorfas en Trisetum) y por la raquilla que se desarticula bajo las glumas (raquilla se desarticula sobre las glumas en Trisetum). Scribner (1906b), al fundar Sphenopholis y Erdman (1965), en su revisión taxonómica del género, transfieren a Sphenopholis varias especies desde Trisetum. No obstante, Erdman (1965) señala que una decisión en torno a la posición genérica de una de las especies, T. interruptum [= S. interrupta], con caracteres morfológicos intermedios entre Trisetum y Sphenopholis, debe ser diferida hasta disponer de mayores antecedentes, demostrando que los caracteres exomorfológicos son insuficientes, por sí solos, para comprender sus intrincadas relaciones sistemáticas.
Numerosos estudios han demostrado que los caracteres epidérmicos, tanto de la hoja como de las brácteas de la espiguilla (glumas, lemmas y páleas) son útiles para esclarecer las relaciones sistemáticas y evolutivas en Poaceae (Prat, 1932, 1936, 1948, 1961; Tateoka & al., 1959; Metcalfe, 1960; Baum, 1971; Kaufman & al., 1972; Clark & Gould, 1975; Ellis, 1979; Shaw & Smeins, 1979; Barkworth, 1981; Terrel & Wergin, 1981; Shaw & Webster, 1983; Terrel & al., 1983; Jacobs & Lapinpuro, 1986; Zuloaga & Soderstrom, 1985; Thomasson, 1986; Thompson & Estes; 1986; Amarasinghe & Watson, 1988; Peterson, 1989; Soderstrom & Zuloaga, 1989; Dávila & Clark, 1990; Kellog, 1990; Peterson & Annable, 1990; Webb, 1990; Valdés-Reyna & Hatch, 1991; Zuloaga & Judziewicz, 1991; Ball & al., 1993; Rojas, 1994; Snow, 1996; Zuloaga & Morrone, 1996; Morrone & al., 1998; Peñailillo, 1998; Zuloaga & al., 1998; Terrel & al., 2001; Giraldo-Cañas, 2002, 2004). Es evidente, sin embargo, que su valor sistemático depende del grupo estudiado y del rango considerado. Según Snow (1996), estos caracteres tienen especial valor entre los rangos de subfamilia y especie y es a nivel genérico donde han sido principalmente utilizados, aportando, en algunos casos, suficientes evidencias como para reinterpretar la sistemática de los géneros (Barkworth, 1990; Rojas, 1994; Morrone & al., 1998; Zuloaga & al., 1998; Vázquez & Barkworth, 2004). Dentro de la subfamilia Pooideae, la epidermis de la lemma ha sido estudiada, con propósitos taxonómicos, en un número relativamente bajo de géneros. Entre éstos podemos mencionar los géneros Briza, Catabrosa, Glyceria, Melica, Pleuropogon y Schizachne (Thomasson, 1986), Koeleria (Molina, 1993), Helictotrichon (Lange, 1995), Nasella (Barkworth, 1990; Thomasson, 1978; Barkworth & Torres, 2001) y Bromus (Acedo & Llamas, 2001).
En el presente trabajo se estudia la micromorfología de la epidermis abaxial de la lemma de 32 especies de Trisetum y especies seleccionadas de los géneros Amphibromus Nees (1 sp.), Avena L. (2 spp.), Avenula (Dumort.) Dumort. (6 spp.), Deschampsia (6 spp.), Dielsiochloa (1 sp.), Graphephorum (2 spp), Gymnachne Parodi (1 sp.), Helictotrichon (8 spp.), Koeleria (5 spp.), Leptophyllochloa (1 sp.), Peyritschia (4 spp.), Raimundochloa (1 sp.), Relchela Steud. (1 sp.), Rhombolytrum Link. (1 sp.), Rostraria (1 sp.) y Sphenopholis (2 spp.), con el objeto de proporcionar nuevos caracteres que permitan distinguir Trisetum de sus géneros afines y discutir sus relaciones sistemáticas.
MATERIALES Y MÉTODOS
Las lemmas se obtuvieron de material de los herbarios B, BA, BAA, BAF, CTES, CONC, CR, F, LP, M, MERL, P, PR, QCA, S, SI, SGO, US, USL y ZOELLNER. Las siglas utilizadas para citar los herbarios corresponden a las indicadas en Holmgren & al. (1990), excepto ZOELLNER que corresponde al herbario particular del Prof. Otto Zoellner, Quilpué, Chile. El material estudiado se entrega en el Anexo 1. Las lemmas fueron separadas de la espiguilla, secadas a punto crítico (O2 líquido, 31,1ºC, 80 atm), metalizadas con oro a 500 Aº de espesor en un metalizador Edwards S150 y montadas directamente para su observación en un microscopio electrónico de barrido Etec Autoscan U-1, en el Laboratorio de Microscopía Electrónica de la Universidad de Concepción. Se procuró trabajar siempre con el antecio inferior de la espiguilla. Las observaciones se realizaron en las zonas media, base y ápice, dado que algunas especies mostraron diferencias en la ornamentación a lo largo del antecio.
Las dimensiones se dan en micrones (µm); en las dimensiones de los ganchos y aguijones se incluye la barba o espina, cuando existe. En la terminología utilizada en las descripciones se sigue a Ellis (1979) y Thomasson (1986). La distinción entre aguijones («prickle hairs») y ganchos («hooks») se basa principalmente en el tamaño de estas estructuras. Se describe como aguijones, a las estructuras con bases ovales o elípticas, con barba o espina apical que puede ser mayor o menor que la base en vista lateral y que son de mayor tamaño que los ganchos. Se describe como ganchos a las estructuras de menor tamaño, con bases redondeadas y barba muy breve dirigida hacia el ápice de la lemma o sin barba evidente. Por otra parte, ganchos y aguijones pueden ser interpretados como estructuras homólogas y su distinción se considera arbitraria (Snow, 1996).
RESULTADOS
Micromorfología de la lemma

Fig. 1. Fotomicrografías MEB de la epidermis de la lemma en especies de Trisetum. A, Trisetum angustum (Steyermark 35525, isotipo US ex F). B, Trisetum pringlei (Steyermark 50224, US). C, Trisetum filifolium (Moore 3250, US). D, Trisetum caudulatum (Gunckel s.n., CONC). E, Trisetum irazuense (Robinson & Beltran 3041, US). F, Trisetum macbridei (Asplund 11793, US). G, Trisetum montanum (Holmgren & Tillet 9561, US). H-I, Trisetum sibiricum (Johnson RJ-130, US). Abreviaturas: ag, aguijones; cc, células cortas; cl, células largas; g, ganchos; pa, pared anticlinal.
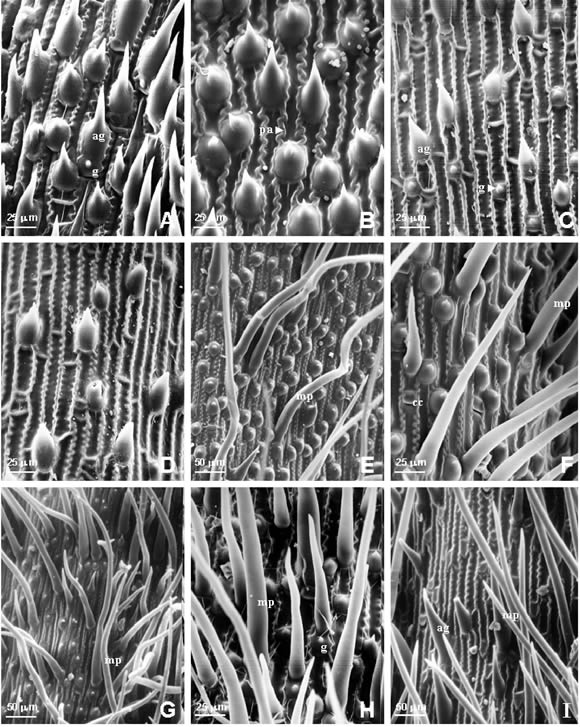
Fig. 2. Fotomicrografías MEB de la epidermis de la lemma en especies de Trisetum. A, Trisetum andinum (Sklenar & Kosteckova 80-12, QCA). B, Trisetum spicatum (Schwabe 69, CONC). C, Trisetum tonduzii (Torres s.n., US). D, Trisetum virletii (Koch 76337, US). E, Trisetum barbinode (Pfister s.n., CONC). F, Trisetum mattheii (Marticorena & al. 86, holotipo CONC). G, Trisetum nancaguense (Lammers, Baeza & Peñailillo 7894, holotipo, CONC). H, Trisetum rosei (Matuda & al. 29044, US). I, Trisetum durangense (Peterson & Brothers 16964, US). Abreviaturas: ag, aguijones; cc, células cortas; cl, células largas; g, ganchos; m, macropelo; pared anticlinal.

Fig. 3. Fotomicrografías (MEB) de la epidermis de la lemma en especies de Trisetum, Graphephorum, Leptophyllochloa, Peyritschia y Rostraria. A, Trisetum spellenbergii (Peterson & Annable 12509, US). B, Graphephorum melicoideum (Fernald & Wiegand 4591, US). C, Graphephorum wolfii (Bartholomew s.n., US). D, Peyritschia conferta (Stübel 152, CONC, fragm. tipo ex B). E, Peyritschia koelerioides (King & Soderstrom 5159, US). F, Peyritschia pringlei (Sohns 597, US). G, Peyritschia deyeuxioides (Peterson & Judziewicz 9300, QCA). H, Rostraria cristata (Matthei & Quezada 233, CONC). I, Leptophyllochloa micrathera (Gunckel 12938, CONC). Abreviaturas: ag, aguijones; cc, células cortas; g, ganchos.
Células largas de 35-150 x 7,5-15 µm, general-mente 5-10 veces más largas que anchas (T. angustum y T. pringlei presentaron células largas relativamente cortas en relación a las restantes especies, con una relación largo/ancho menor que 5x, Tabla 1), rectangulares, con paredes anticlinales longitudinales paralelas, moderadamente engrosadas, onduladas, las ondulaciones en forma de U o V; paredes periclinales planas (cóncavas en T. angustum, T. irazuense y T. pringlei); células silíceas de 10-15 µm de diámetro, de contorno redondeado a irregular, planas a ligeramente cóncavas raramente ausentes, en general escasas (en T. ambiguum, T. filifolium, T. foliosum y T. pringlei no se observó células silíceas); estomas ausentes; aguijones de 30-60 µm long, oval-lanceolados en vista paradermal, con la base algo abultada y la barba antrorsa, menor o poco mayor que la base, distribuidos principalmente en el dorso de la lemma, más escasos en los márgenes y zonas proximal y distal; ganchos de 10-25 µm long, con la base redondeada a elíptica, brevemente barbados en el ápice, la barba antrorsa, abundantes, uniformemente distribuidos en el dorso de la lemma; macropelos ausentes en la mayoría de las especies, presentes en T. barbinode, T. durangense, T. mattheii, T. nancaguense, T. oreophilum, T. preslei y T. rosei, principalmente en el dorso de la lemma, desde la base hasta cerca de la inserción de la arista en el tercio superior, escasos o ausentes en el ápice y márgenes; Trisetum pringlei difiere de las restantes especies por ser variable con respecto a la presencia de macropelos pudiendo estar presentes en algunos especimenes y ausentes en otros; en aquellos especimenes que presentaron macropelos, éstos son más cortos y menos densos que en las restantes especies del género; a veces presentes pero muy escasos en T. andinum; macropelos cortos, presentes en el callo en todas las especies.
Tabla 1. Características micromorfológicas de la epidermis de la lemma. Abreviaturas: -, ausente ; +, presente; (+), escaso; +++, abundante. N, Número de especimenes examinados. L/A, Radio largo/ancho aproximado de las células largas (1x, menos de 5 veces más largas que anchas; 2x, 5-10 veces más largas que anchas; 3x, más de 10 veces más largas que anchas); PA, Pared anticlinal de las células largas (o, onduladas; r, rectas; s, sinuosas; e, engrosadas; me, moderadamente engrosadas; ne, no engrosadas); PP, Pared periclinal de las células largas (co, cóncavas; cv, convexas; p, planas); CS, Células silíceas. EST, Estomas; AG, Aguijones; G, Ganchos; MP, Macropelos en el dorso de la lemma.
| Especie | N | L/A | PA | PP | CS | EST | AG | G | MP |
| Amphibromus | |||||||||
| 1. A. scabrivalvis | 1 | 2x | ne, o | p | (+) | - | + | + | - |
| Avena | |||||||||
| 2. A. barbata | 1 | 2x | e, o | p | +++ | - | - | + | +++ |
| 3. A. fatua | 1 | 2x | e, o | p | +++ | - | - | + | +++ |
| Avenula | |||||||||
| 4. A. bromoides | 1 | 2x | e, o | cv | +++ | - | + | + | + |
| 5. A hookeri | 2 | 3x | e, o | cv | +++ | + | + | + | - |
| 6. A. marginata | 1 | 3x | e, o | cv | +++ | - | - | + | - |
| 7. A. praeusta | 1 | 3x | e, o | cv | +++ | + | - | - | - |
| 8. A. pratensis | 1 | 3x | e, o | cv | +++ | + | + | + | - |
| 9. A. pubescens | 1 | 3x | e, o | cv | +++ | - | + | + | - |
| Deschampsia | |||||||||
| 10. D. antarctica | 1 | 3x | ne, s | p | - | - | - | - | - |
| 11. D. atropurpurea | 1 | 3x | me, r | cv | - | - | - | - | (+) |
| 12. D. berteroana | 1 | 3x | me, r | co | - | - | + | - | - |
| 13. D. brasiliensis | 1 | 2x | me, o | co | - | - | + | + | - |
| 14. D. cespitosa | 1 | 3x | me, s | co | - | - | - | - | - |
| 15. D. laxa | 1 | 3x | me, s | p | - | - | - | - | - |
| Dielsiochloa | |||||||||
| 16. D. floribunda | 1 | 3x | e, o | co | - | - | + | + | - |
| Graphephorum | |||||||||
| 17. G. melicoideum | 1 | 1-2x | me, o | p | + | - | + | + | - |
| 18. G. wolfii | 1 | 1-2x | me, o | p | + | - | + | + | - |
| Gymnachne | |||||||||
| 19. G. koelerioides | 2 | 1-2x | me, o | p | - | - | + | + | - |
| Helictotrichon | |||||||||
| 20. H. bulbosum | 3 | 1x | ne, o | p | - | - | + | + | - |
| 21. H. convolutum | 1 | 3x | e, o | cv | +++ | - | (+) | + | - |
| 22. H. decorum subsp. basalticum | 1 | 3x | e, o | cv | +++ | - | - | + | - |
| 23. H. desertorum | 1 | 3x | e, o | cv | +++ | - | + | + | - |
| 24. H. montanum | 1 | 3x | e, o | cv | +++ | - | + | + | - |
| 25. H. mortonianum | 1 | 3x | e, o | cv | +++ | - | + | + | - |
| 26. H. parlatorei | 1 | 3x | e, o | cv | +++ | - | + | + | - |
| 27. H. sarracenorum | 1 | 3x | e, o | cv | - | - | + | + | - |
| Koeleria | |||||||||
| 28. K. boliviensis | 1 | 1x | e, o | p | (+) | - | - | + | - |
| 29. K. macrantha | 1 | 2x | me, o | p | (+) | - | (+) | + | (+) |
| 30. K. fueguina | 1 | 2x | ne, o | cv | (+) | (+) | (+) | + | - |
| 31. K. kurtzii | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 32. K. permollis | 2 | 2x | me, o | p | (+)/ | - | + | + | - |
| Leptophyllochloa | |||||||||
| 33. L. micrathera | 5 | 2-3x | ne, o | p-cv | +++ | - | (+) | (+) | - |
| Peyritschia | |||||||||
| 34. P. conferta | 1 | 1-2x | me, o | p | - | - | - | + | - |
| 35. P. deyeuxioides | 1 | 2x | ne, o | p | (+) | (+) | (+) | + | - |
| 36. P. koelerioides | 1 | 2x | me, o | p | - | - | - | + | - |
| 37. P. pringlei | 1 | 2-3x | me, o | p | - | - | - | + | - |
| Raimundochloa | |||||||||
| 38. R. trachyantha | 1 | 1x | me, o | p | - | - | + | + | - |
| Relchela | |||||||||
| 39. R. panicoides | 1 | 2x | me, o | p-co | (+) | - | + | + | - |
| Rhombolytrum | |||||||||
| 40. R. rhomboideum | 1 | 1x | me, o | p | - | - | + | + | - |
| Rostraria | |||||||||
| 41. R. cristata | 2 | 1-2x | me, o | p | (+) | - | + | + | (+)/ |
| Sphenopholis | |||||||||
| 42a. S. interrupta var. interrupta | 1 | 1x | me, o | co | - | (+) | (+) | + | - |
| 42b. S. interrupta var. californica | 1 | 1x | me, o | co | (+) | (+)/ | (+) | + | - |
| 43. S. nitida | 1 | 1x | me, o | co | (+) | (+) | + | + | - |
| 44. S. obtusata | 2 | 1x | me, o | co | (+) | - | - | + | - |
| Trisetum | |||||||||
| 45. T. ambiguum | 1 | 2x | me, o | p | - | - | + | + | - |
| 46. T. andinum | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 47. T. angustum | 1 | 1x | me, o | co | (+) | - | + | + | - |
| 48a. T. barbinode var. barbinode | 3 | 2x | me, o | p | (+) | - | + | + | +++ |
| 48b. T. barbinode var. hirtiflorum | 1 | 2x | me, o | p | (+) | - | + | + | +++ |
| 49a. T. caudulatum var. caudulatum | 6 | 2x | me, o | p | (+) | - | + | + | - |
| 49b. T. caudulatum var. correae | 2 | 2x | me, o | p | (+) | - | + | + | - |
| 50a. T. cernuum var. canescens | 2 | 2x | me, o | p | (+) | - | + | + | - |
| 50b. T. cernuum var. cernuum | 4 | 2x | me, o | p | (+) | - | + | + | - |
| 51. T. curvisetum | 1 | 2x | me, o | p(+) | - | + | + | - | |
| 52. T. dianthemum | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 53. T. durangense | 1 | 2x | me, o | p | (+) | - | + | + | +++ |
| 54. T. filifolium | 1 | 2x | me, o | p | - | - | + | + | - |
| 55. T. flavescens | 2 | 2x | me, o | p | (+) | - | + | + | - |
| 56. T. foliosum | 1 | 2x | me, o | p | - | - | - | + | - |
| 57. T. irazuense | 3 | 2x | me, o | co | (+) | - | + | + | - |
| 58. T. ligulatum | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 59. T. longiglume | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 60. T. macbridei | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 61. T. mattheii | 1 | 2x | me, o | p | (+) | - | + | + | +++ |
| 62. T. montanum | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 63. T. nancaguense | 1 | 2x | me, o | p | (+) | - | + | + | +++ |
| 64a. T. oreophilum var. oreophilum | 2 | 2x | me, o | p | (+) | - | + | + | +++ |
| 64b. T. oreophilum var. johnstonii | 1 | 2x | me, o | p | (+) | - | + | + | +++ |
| 65. T. orthochaetum | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 66. T. phleoides | 3 | 2x | me, o | p | (+) | - | + | + | - |
| 67. T. pinetorum | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 68. T. preslei | 2 | 2x | me, o | p | (+) | - | (+) | + | +++ |
| 69. T. pringlei | 1 | 1x | me, o | co | - | - | + | + | (+)/ |
| 70. T. rosei | 1 | 2x | me, o | p | (+) | - | (+) | + | +++ |
| 71. T. sibiricum | 3 | 2x | me, o | p | (+) | - | + | (+) | - |
| 72. T. spellenbergii | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 73a. T. spicatum var. cumingii | 6 | 2x | me, o | p | (+) | - | + | + | - |
| 73b. T. spicatum var. spicatum | 3 | 2x | me, o | p | (+) | - | + | + | - |
| 74. T. tonduzii | 2 | 2x | me, o | p | (+) | - | + | + | - |
| 75. T. viride | 1 | 2x | me, o | p | (+) | - | + | + | - |
| 76. T. virletii | 2 | 2x | me, o | p | (+) | - | + | + | - |
Especies estudiadas. Trisetum ambiguum Rúgolo & Nicora, T. angustum Swallen, T. barbinode Trin. var. barbinode, T. barbinode var. hirtiflorum (Hack.) Louis-Marie, T. caudulatum Trin. var. caudulatum, T. caudulatum Trin. var. correae Nicora, T. cernuum Trin. var. canescens (Buckl.) Beal, T. cernuum Trin. var. cernuum, T. curvisetum Mordén & Valdés-Reyna, T. dianthemum (Louis-Marie) Finot, T. durangense Finot & P.M. Peterson, T. filifolium Scribn. ex Beal, T. flavescens (L.) P. Beauv., T. foliosum Swallen, T. irazuense (Kuntze) Hitchc., T. ligulatum Finot & Zuloaga, T. longiglume Hack., T. macbridei Hitchc., T. mattheii Finot, T. montanum Vasey, T. nancaguense Finot, T. oreophilum Louis-Marie var. oreophilum, T. oreophilum var. johnstonii Louis-Marie, T. orthochaetum Hitchc., T. phleoides (dUrv.) Kunth, T. pinetorum Swallen, T. preslei (Kunth) E. Desv., T. pringlei (Scribn.) Hitchc., T. rosei Scribn. & Merr., T. sibiricum Rupr., T. spellenbergii Soreng, Finot & P.M. Peterson, T. spicatum var. cumingii (Nees ex Steud.) Finot, T. spicatum (L.) K. Richt. var. spicatum, T. tonduzii Hitchc., T. viride (Kunth) Kunth, T. virletii E. Fourn.
GRAPHEPHORUM Desv. Fig. 3B-C.
Células largas de 37,5-110 x 7,5-10 µm, (3-) 5-10 veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales paralelas, moderadamente engrosadas, profundamente onduladas, las ondulaciones en forma de U o V; paredes periclinales planas; células silíceas de 12,5-20 x 7,5-10 µm, redondeadas a irregulares; estomas ausentes; aguijones de 40-72,5 µm long, agudos, con la base oval-elíptica en vista paradermal y barba antrorsa, menor que la base, distribuidos principalmente en el dorso de la lemma, escasos en los márgenes; ganchos de 15-30 µm, con la base redondeada y barba muy breve, distribuidos uniformemente en el dorso de la lemma; macropelos ausentes en el dorso de la lemma, presentes en el callus, cortos.
Especies estudiadas. Graphephorum melicoideum (Michx.) Desv., G. wolfii (Vasey) Vasey.
PEYRITSCHIA E. Fourn. Fig. 3D-G.
Células largas de 20-75 x 7,5-10 µm, (2-) 3-12 veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales paralelas, moderadamente engrosadas o no engrosadas (P. deyeuxioides), onduladas; ondulaciones en forma de U o V; paredes periclinales planas; células silíceas ausentes (P. conferta, P. koelerioides, P. pringlei) o escasas, restringidas a la zona distal (P. deyeuxioides), de 12,5 µm de diámetro, de contorno redondeado a irregular; estomas ausentes (P. conferta, P. koelerioides, P. pringlei) o presentes (P. deyeuxioides), restringidos a la zona distal, 25 µm long, con células subsidiarias con forma de domo; aguijones ausentes (P. conferta, P. koelerioides, P. pringlei) o presentes, aunque escasos (P. deyeuxioides), de 45 µm long, ovales en vista paradermal, con la barba aguda, menor que la base, restringidos a la zona distal; ganchos de 10-12,5 µm de diámetro, con barba ausente o muy breve, si presente aguda, antrorsa, menor que la base, situada en posición central, redondeados en vista paradermal, engrosados en la base, alternando con las células largas, abundantes; macropelos ausentes en el dorso de la lemma, presentes sólo en el callo, cortos (P. conferta, P. koelerioides, P. pringlei) o largos (P. deyeuxioides).
Especies estudiadas. Peyritschia conferta (Pilg.) Finot, P. deyeuxioides (Kunth) Finot, P. koelerioides (Peyr.) E. Fourn., P. pringlei (Scribn.) S.D. Koch.
ROSTRARIA Trin. Fig. 3H.
Células largas de 20-33 x 13-17 µm, 3-6 veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales paralelas, moderadamente engrosadas, profundamente onduladas, las ondulaciones en forma de V; paredes periclinales planas; células silíceas de 8-10 µm de diámetro, de contorno redondeado a irregular, escasas; estomas ausentes; aguijones de 20-100 µm long, oval a oval-lanceolados en vista paradermal, la barba menor o mayor que la base, aguda, esparcidos; ganchos de 13-15 µm de diámetro, con la base orbicular a oval y barba incipiente situada en posición central, distribuidos uniformemente en el dorso de la lemma; macropelos ausentes (Matthei & Quezada 233) o presentes, 100 µm long, esparcidos, distribuidos en la quilla y dorso de la lemma (Bustamante 27), ausentes en el callus.
Especie estudiada. Rostraria cristata (L.) Tzvelev.
LEPTOPHYLLOCHLOA C.E. Calderón ex Nicora, Fig. 3I.
Células epidérmicas largas de 50-95 x 7,5-8,5 µm, 6-11 veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales paralelas, no engrosadas, profundamente onduladas, las ondulaciones con forma de Ω; paredes periclinales planas a levemente convexas; células silíceas de 10-15 µm de diámetro, de contorno redondeado a irregular, cóncavas, abundantes; estomas ausentes; aguijones de 25 µm long, cónicos a oval-lanceolados en vista paradermal, agudos, escasos, a veces ausentes; ganchos de 8,75-12,5 µm long, con la base redondeada en vista paradermal, con barba incipiente, distribuidos en el dorso desde la base hasta la inserción de la arista, ausentes hacia los márgenes y ápice; macropelos ausentes en el dorso de la lemma, presentes sólo en el callus, muy cortos.
Especie estudiada. Leptophyllochloa micrathera (E. Desv.) C.E. Calderón ex Nicora.
KOELERIA Pers. Fig. 4A-C.
Células epidérmicas largas de 25-90 x 8-14 µm, (2-) 3-10 veces más largas que anchas, rectangulares, con paredes anticlinales verticales paralelas, onduladas, las ondulaciones en U o V, engrosadas (K. boliviensis) o moderadamente engrosadas (K. fueguina, K. kurtzii, K. macrantha, K. permollis); paredes periclinales planas (convexas en K. fueguina); células silíceas de contorno redondeado a irregular, escasas; estomas ausentes (observados sólo en la arista de K. fueguina); aguijones de 22-50 µm long, con la base oval y la barba menor que la base, agudos, escasos, a veces ausentes (K. boliviensis); ganchos de 15-25 µm, con la base redondeada y barba apical muy breve, de distribución y tamaño uniforme, escasos hacia los márgenes; macropelos ausentes en el dorso de la lemma (presentes pero muy escasos en K. macrantha), presentes en el callus, cortos y esparcidos.

Fig. 4. Fotomicrografías MEB de la epidermis de la lemma en especies de Gymnachne, Koeleria, Raimundochloa, Rhombolytrum y Sphenopholis. A, Koeleria boliviensis (Peterson & al. 12782, CONC). B, Koeleria fueguina (T.B.P.A. 3282, CONC). C, Koeleria permollis (Jörgensen 136, CONC). D, Sphenopholis interrupta var. californica (Orcutt 1437, US, tipo de Trisetum californicum Vasey). E, Sphenopholis interrupta var. interrupta (Hinckley & Hinckley 400, US). F, Sphenopholis nitida (Dean 12826, US). G, Raimundochloa trachyantha (Pisano & Bravo 393, CONC). H, Rhombolytrum rhomboideum (Garaventa s.n., CONC). I, Gymnachne koelerioides (Montero 4516, CONC). Abreviaturas: ag, aguijones; cl, células largas; g, ganchos.
Especies estudiadas. Koeleria boliviensis (Domin) A.M. Molina, K. macrantha (Ledeb.) Schult., K. fueguina C.E. Calderón ex Nicora, K. kurtzii Hack., K. permollis Nees ex Steud.
SPHENOPHOLIS Scribn. Fig. 4D-F.
Células epidérmicas largas de 10-52,5 x 7,5-20 µm, 1-5 veces más largas que anchas, cuadradas a rectangulares, a veces levemente más anchas que largas, con paredes anticlinales longitudinales paralelas, moderadamente engrosadas, onduladas; ondulaciones irregulares; paredes periclinales cóncavas; células silíceas de 6-12 µm de diámetro, de contorno circular a irregular, escasas, ausentes en S. interrupta var. interrupta (Tabla 1); estomas ausentes (S. obtusata) o presentes en la porción distal de la lemma (S. nitida, S. interrupta), 25 µm long, con células subsidiarias en forma de domo a rectangular; aguijones de 25-45 µm long, con la base elíptica a oval-elíptica, con barba apical muy breve, dirigida hacia el ápice de la lemma, mucho menor que la base en los aguijones dorsales, tan larga como la base en los aguijones de la zona distal, ausentes o escasos en el dorso, frecuentes en S. nitida principalmente en la zona distal; ganchos de (7,5-) 15-20 µm de diámetro, con la base redondeada y barba muy breve, situada en posición central, alternando con las células largas; macropelos ausentes en el dorso y en el callus.
Especies estudiadas. Sphenopholis interrupta (Buckl.) Scribn. var. interrupta, S. interrupta var. californica (Vasey) Scribn., S. nitida (Biehler) Scribn., S. obtusata (Michx.) Scribn.
RAIMUNDOCHLOA A.M. Molina. Fig. 4G.
Células epidérmicas largas de (12,5) 27,5-50 x 10-12,5 µm, (2-) 3-4 veces más largas que anchas, raramente tan largas como anchas, rectangulares, con paredes anticlinales longitudinales paralelas, profundamente onduladas, las ondulaciones en forma de U o V; paredes periclinales planas; células silíceas ausentes; estomas ausentes; aguijones de 55-85 µm long, con la base redondeada y dilatada, cónicos en vista lateral, agudos, esparcidos, distribuidos en toda la superficie, incluyendo la quilla y los márgenes de la lemma (presentes también en la porción distal de la pálea, no mostrado); ganchos de 10-12,5 µm de diámetro, con la base de contorno redondeado en vista paradermal, plana en el ápice en vista lateral, provista de barba central incipiente, alternando con las células largas; macropelos ausentes tanto en el dorso de la lemma como en el callus.
Especie estudiada. Raimundochloa trachyantha (Phil.) A.M. Molina.
GYMNACHNE Parodi. Fig. 4I.
Células largas de 21-50 x 7-11 µm, (2-) 3-5 (-10) veces más largas que anchas, rectangulares, con pare-des anticlinales longitudinales paralelas, moderadamente engrosadas, onduladas, las ondulaciones en forma de U o V; paredes periclinales planas; células silíceas ausentes; estomas ausentes; aguijones de 28-70 µm, ovales en vista paradermal, con barba igual o, más frecuentemente, menor que la base, aguda; ganchos de ca. 10 µm de diámetro, con la base redondeada y barba incipiente situada en posición central, alternando con las células largas; macropelos ausentes en el dorso, presentes sólo en el callus y márgenes inferiores, muy cortos y esparcidos.
Especie estudiada. Gymnachne koelerioides (Trin.) Parodi.
RHOMBOLYTRUM Link. Fig. 4H.
Células epidérmicas largas de 20-37,5 x 7.5 µm, 2,5-5 veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales moderadamente engrosadas, profundamente onduladas, las ondulaciones en U o V; paredes periclinales planas; células silíceas ausentes; estomas ausentes; aguijones de (27,5-) 50-87,5 µm, con la base dilatada, con barba aguda, menor, igual o mayor que la base, frecuentes; ganchos de 10-12,5 µm de diámetro, con la base de contorno redondeado, cónicos en vista lateral, con barba central pequeña, alternando con las células largas; macropelos ausentes en el dorso de la lemma, presentes sólo en el callus y márgenes inferiores, cortos.
Especie estudiada. Rhombolythrum rhomboideum Link.
HELICTOTRICHON Besser ex Schult. & Schult.f. Fig. 5A-D.

Fig. 5. Fotomicrografías (MEB) de la epidermis de la lemma en especies de Amphibromus, Avenula y Helictotrichon. A, Helictotrichon bulbosum (Baeza 1722a, CONC). B, Helictotrichon convolutum (Rechinger f. 17157, M). C, Helictotrichon montanum (Merxmueller & Zollitsch 25997, M). D, Helictotrichon mortonianum (Swallen 1403, US). E-F, Avenula bromoides (Podlech 9055, M). G, Avenula hookeri (Rollins 1024, US). H, Avenula praeusta (Lippert s.n., M). I, Amphibromus scabrivalvis (Bliss 2264, CONC). Abreviaturas: ag, aguijones; cc, células cortas; est, estoma; g, ganchos; m, macropelo.
Células epidérmicas largas de (27,5-) 62,5-125 x (5-) 12,5-15 µm, generalmente más de 10 veces más largas que anchas (2-6 veces más largas que anchas en H. bulbosum), rectangulares, con paredes anticlinales longitudinales paralelas, fuertemente engrosadas (delgadas en H. bulbosum), onduladas, las ondulaciones con forma de U o V; paredes anticlinales convexas (planas en H. bulbosum); células silíceas de ca. 15 µm de diámetro, de contorno redondeado a irregular, muy abundantes o ausentes (H. bulbosum, H. sarracenorum); estomas ausentes; aguijones de 15-65 µm long, agudos, con barba igual o mayor que la base, dirigidos hacia el ápice de la lemma, distribuidos en toda la superficie de la lemma en H. desertorum, H. parlatorei y H. montanum, restringidos a la porción distal en H. mortonianum y H. sarracenorum, ausentes en H. decorum subsp. basalticum; ganchos de 5-10 µm, con la base dilatada y barba apical muy breve o incipiente, distribuidos más o menos uniformemente en el dorso de la lemma; macropelos ausentes en el dorso, presentes en el callus en todas las especies.
Especies estudiadas. Helictotrichon bulbosum (Hitchc.) Parodi, H. convolutum (K. Presl) Henrard, H. decorum (Janka) Henrard, H. desertorum (Less.) Pilg. subsp. basalticum (Podpera) Holub, H. montanum (Vill.) Henrard, H. mortonianum (Scribn.) Henrard, H. parlatorei (Woods) Pilg., H. sarracenorum (Gand.) Holub.
AVENULA (Dumort.) Dumort. Fig. 5E-H.
Células epidérmicas largas de 35-175 x 12,5-20 µm, más de 10 veces más largas que anchas (5-10 veces más largas que anchas en A. bromoides), rectangulares, con paredes anticlinales longitudinales paralelas, fuertemente engrosadas, onduladas; paredes periclinales convexas; células silíceas de ca. 15 µm de diámetro, de contorno redondeado a irregular, muy abundantes, distribuidas homogéneamente en el dorso de la lemma; estomas presentes (A. hookeri, A. praeusta y A. pratensis) o ausentes (A. bromoides, A. marginata y A. pubescens), de 37,5-56 x 17,5-27,5 µm, con células subsidiarias en forma de domo; aguijones de 30-42,5 (-150) µm, raramente ausentes (A. praeusta, A. marginata, agudos en vista paradermal, con barba apical dirigida hacia el ápice de la lemma, usualmente menor que la base (A. bromoides, A. hookeri), más frecuentes hacia el ápice de la lemma; ganchos ovales o redondeados en vista paradermal, de 10-17,5 µm de diámetro, distribuidos en el dorso de la lemma, ausentes en A. praeusta; macropelos ausentes excepto en A. bromoides que presentó macropelos curvos de 125-150 µm long. en los márgenes de la lemma.
Especies estudiadas. Avenula bromoides (Gouan) H. Scholz, A. hookeri (Scribn.) Holub, A. marginata (Lowe) Holub, A. praeusta (Reichb.) Holub, A. pratensis (L.) Dumort., A. pubescens (Huds.) Dumort.
AMPHIBROMUS Nees. Fig. 5I.
Células largas de 37,5-100 x 10-12,5 µm, (3-) 5-10 (-11) veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales paralelas, no engrosadas, onduladas; ondulaciones en forma de V; paredes periclinales planas; células silíceas de ca. 15 µm de diámetro, de contorno redondeado a irregular, escasas; estomas ausentes; aguijones de 94,5-115 µm long, cónicos, agudos, tan largos o mayores que las células epidérmicas, frecuentes, esparcidos; ganchos de 17,5-22,5 de diámetro, redondeados en vista paradermal, con barba apiculada, pequeña, uniformemente distribuidos en el dorso de la lemma; macropelos ausentes en el dorso, presentes sólo en el callus.
Especie estudiada. Amphibromus scabrivalvis (Trin.) Swallen.
AVENA L. Fig. 6A-B.

Fig. 6. Fotomicrografías (MEB) de la epidermis de la lemma en especies de Avena, Relchela, Dielsiochloa y Deschampsia. A-B, Avena fatua (Ormeño s.n., CONC). C, Relchela panicoides (Junge s.n., CONC). D, Dielsiochloa floribunda (Landero & al. 603, CONC). E, Deschampsia brasiliensis (Chase 8304, US). F, Deschampsia antarctica (Ambrosetti & Méndez s.n., CONC). G-H, Deschampsia atropurpurea (Vogel 4, CONC). I, Deschampsia berteroana (Gunckel s.n., CONC). Abreviaturas: ag, aguijones; cc, células cortas; cl, células largas; g, ganchos; mpc, macropelo corto; mpl, macropelo largo.
Células epidérmicas largas de 75-90 x 13-20 µm, 4-6 veces más largas que anchas, rectangulares, con las paredes anticlinales longitudinales paralelas, engrosadas, onduladas; ondulaciones en U; paredes periclinales planas; células silíceas de 18-25 µm de diámetro, de contorno redondeado, abundantes; estomas ausentes; aguijones ausentes; ganchos de 17,5-25 µm, cónicos, con la base redondeada y el ápice agudo (A. fatua) u obtuso (A. barbata), uniformemente distribuidos en el dorso de la lemma; macropelos de dos tipos: largos, muy abundantes, mayores de 150 µm long, y macropelos cortos ca. 55-60 µm long, escasos y esparcidos en el dorso de la lemma; macropelos presentes también en el callus.
Especie estudiada. Avena barbata Pott ex Link, A. fatua L.
RELCHELA Steud. Fig. 6C.
Células epidérmicas largas de 55-100 x 10-12,5 µm, aproximadamente cinco veces más largas que anchas, rectangulares, con paredes anticlinales longitudinales paralelas, moderadamente engrosadas, profundamente onduladas, las ondulaciones en U; paredes periclinales planas a levemente cóncavas; células silíceas de ca. 20 µm de diámetro, redondeadas, planas, escasas; estomas ausentes; aguijones y ganchos presentes sólo en la porción distal de la lemma; porción proximal con ganchos de ca. 15 µm, de contorno redondeado, con la base oval-elíptica, con barba apical muy breve, escasos; aguijones de 43-58 µm, oval-lanceolados en vista paradermal, con barba de 11-16 µm long, mucho menor que la base, agudos, escasos; macropelos ausentes en el dorso, presentes sólo en el callus, cortos.
Especie estudiada. Relchela panicoides Steud.
DIELSIOCHLOA Pilg. Fig. 6D.
Células epidérmicas largas de 33-110 x 10-15 µm, más de 10 veces más largas que anchas, rectangulares, con las paredes anticlinales longitudinales paralelas, engrosadas, profundamente onduladas, las ondulaciones en forma de Ω o U; paredes periclinales cóncavas; células silíceas ausentes; estomas ausentes; aguijones de 40-70 µm long, agudos, con la base oval, con barba menor que 1/3 de la longitud de la base (ca. 10 µm long.), cónica, dirigida hacia el ápice de la lemma; ganchos de 20-35 µm long., apiculados, con base oval-elíptica y barba muy breve dirigida hacia el ápice de la lemma; macropelos ausentes tanto en el dorso de la lemma como en el callus.
Especie estudiada. Dielsiochloa floribunda (Pilg.) Pilg.
DESCHAMPSIA P. Beauv. Fig. 6E-I.
Células epidérmicas largas de (50-) 90-200 x 5-8 µm, generalmente más de 10 veces más largas que anchas, rectangulares a fusiformes, con paredes anticlinales longitudinales paralelas o convergiendo hacia los extremos (D. berteroana), moderadamente engrosadas o no engrosadas (D. antarctica), rectas (D. atropurpurea, D. berteroana), sinuosas (D. antarctica, D. cespitosa) o profundamente onduladas en U (D. brasiliensis. D. laxa); paredes periclinales planas (D. antarctica, D. laxa), convexas (D. atropurpurea, D. cespitosa) o cóncavas (D. berteroana, D. brasiliensis); células silíceas ausentes; estomas ausentes; aguijones y ganchos generalmente ausentes, presentes en D. brasiliensis (aguijones y ganchos, en toda la superficie) y en D. berteroana (aguijones en la zona distal, ganchos ausentes); Deschampsia brasiliensis presentó aguijones de ca. 50 µm long., de contorno oval-lanceolados en vista paradermal, agudos y ganchos no barbados a modo de asperezas incipientes, redondeados, de 5-7,5 µm de diámetro; Deschampsia berteroana presentó aguijones de 60-65 µm long, oval-lanceolados en vista paradermal, con barba tan larga o más larga que la base; macropelos ausentes en el dorso de la lemma, excepto en D. atropurpurea que mostró macropelos de 50-80 µm long, escasos y restringidos al ápice de la lemma; macropelos presentes en el callus en todas las especies.
Especies estudiadas. Deschampsia antarctica E. Desv., D. atropurpurea (Wahlenb.) Scheele, D. berteroana (Kunth) Trin., D. brasiliensis (Louis-Marie) Valencia, D. cespitosa (L) P. Beauv., D. laxa Phil.
Observaciones. Las características micromorfológicas más importantes de la epidermis de la lemma observadas en las especies investigadas se resumen en la Tabla 1.
Análisis comparado de los caracteres
Células largas
En Trisetum las células largas de la epidermis de la lemma poseen contorno rectangular, generalmente 5-10 veces más largas que anchas. Trisetum angustum y T. pringlei, en cambio, presentan células largas relativamente cortas en comparación con las restantes especies del género (menos de 5 veces más largas que anchas). En Sphenopholis la epidermis consta de células largas muy cortas, con una relación largo/ancho que varía de 1 a 5 veces más largas que anchas, notablemente menor que en Trisetum. Células largas relativamente cortas se observan también en Raimundochloa, Rhombolythrum y Gymnachne y también, a veces, en Peyritschia. Por su parte, las especies estudiadas de Deschampsia, Avenula y Helictotrichon (Fig. 6E-I), muestran células largas con una relación largo/ancho mayor que 10x, excepto H. bulbosum con células largas más cortas (menos de 5 veces más largas que anchas).
La mayor parte de los géneros y especies estudiadas presenta células largas con paredes anticlinales onduladas. No obstante, Deschampsia atropurpurea y D. berteroana poseen paredes anticlinales rectas, no onduladas (Fig. 6 E-I), en tanto D. laxa posee paredes anticlinales sinuosas. En todas las especies de Trisetum las células largas poseen paredes anticlinales onduladas, moderadamente engrosadas (Fig. 1-2, Tabla 1), como ocurre en la mayor parte de los géneros estudiados. Células largas con paredes anticlinales fuertemente engrosadas se observan en Helictotrichon, Avenula y Avena. En estos casos, el engrosamiento de la pared suele ocultar la forma de las ondulaciones.
La pared periclinal de las células largas en Trisetum es aproximadamente plana, esto es, no se observa paredes periclinales notablemente convexas o notablemente cóncavas, con la excepción de T. angustum, T. irazuense y T. pringlei que presentan paredes periclinales cóncavas. Paredes periclinales de las células largas notablemente cóncavas se encuentran también en Sphenopholis. En cambio, paredes notablemente convexas se presentan en Avenula y Helictotrichon (exceptuando H. bulbosum).
Células silíceas
La distinción entre células epidérmicas largas y cortas se basa en su tamaño relativo, sin embargo, no siempre resulta fácil distinguirlas basándose sólo en esta característica (Snow, 1996), pues muchas veces las células largas poseen dimensiones similares a las células cortas (Thomasson, 1978; Snow, 1996). Las células cortas incluyen dos tipos, células silíceas y células suberosas, que generalmente se presentan en pares sílico-suberosos. Las células suberosas son difíciles de distinguir con MEB, en tanto las células silíceas (cuerpos silíceos) se distinguen claramente (Kaufman & al., 1972) y son una de las estructuras epidérmicas más importantes desde un punto de vista taxonómico en la familia Poaceae (Snow, 1996). Entre las especies estudiadas las células silíceas se observan claramente, no así las células suberosas cuya existencia puede deducirse solamente por su posición adyacente a las células silíceas. En consecuencia, se describe únicamente las células silíceas.
En Trisetum, la presencia de células silíceas se observa en la mayor parte de las especies estudiadas, aunque siempre escasas (Fig. 1-2). No se observó la presencia de células silíceas en T. ambiguum, T. filifolium, T. pringlei y T. virletii, sin embargo, este resultado puede ser un artefacto derivado del bajo número de especimenes estudiados. Las células silíceas presentaron contorno redondeado o irregular, son planas a ligeramente cóncavas y se encuentran levemente levantadas en relación a las células epidérmicas largas. En la mayor parte de las especies las células silíceas miden 10-15 (-20) µm de diámetro. Células silíceas algo menores se encuentran en Rostraria (8-10 µm) y en Sphenopholis (6-12 µm), en tanto Avena presenta células silíceas de diámetro notablemente mayor (18-25 µm). Avena, Avenula y Helictotrichon (excepto H. bulbosum que no posee células silíceas), poseen células silíceas de contorno circular, muy abundantes y aisladas, que alternan con las células largas. La forma circular de las células silíceas observada en las especies estudiadas de Avena coincide con la observada por Kaufman & al. (1972) en A. sativa. También poseen células silíceas las especies de Sphenopholis, Koeleria, Leptophyllochloa, Relchela, Rostraria y Amphibromus. No se observa diferencias destacables en la morfología de las células siliceas entre estos géneros y las observadas en Trisetum. Por su parte, Avena, Avenula y Helictotrichon se distinguen claramente de Trisetum y de los restantes géneros estudiados por la forma y abundancia de las células silíceas. En Peyritschia (excepto P. deyeuxioides), Dielsiochloa, Raimundochloa, Rhombolytrum, Gymnachne y Deschampsia, no fueron observadas.
Macropelos
Los macropelos son típicamente unicelulares y generalmente pueden ser observados con un microscopio estereoscópico (Bonnett, 1972; Ellis, 1979). En Trisetum la lemma puede ser glabra o pilosa (Fig. 1-2, 3A). La presencia de macropelos unicelulares se observa en Trisetum barbinode, T. durangense, T. mattheii, T. nancaguense, T. pres-lei, T. oreophilum var. oreophilum y T. oreophilum var. johnstonii y T. rosei (Fig. 2E-I). Además, Finot & al. (2004) observan su presencia en T. barbatipaleum (Hultén ex Veldkamp) Finot, no incluida en este trabajo. En las especies estudiadas de Trisetum se observa la presencia de macropelos de dos tamaños, largos y cortos; cubren principalmente el dorso de la lemma, haciéndose más escasos hacia los márgenes y hacia el ápice. En Trisetum la presencia de macropelos es un carácter consistente a nivel de especie. Sin embargo, en T. pringlei se observa la presencia de macropelos cortos en algunos ejemplares, mientras en otros la lemma es completamente glabra. También presentan macropelos Avena barbata, A. fatua (Fig. 6A-B), Avenula bromoides (Fig. 5E-F) y Deschampsia atropurpurea (Fig. 6G-H). En las especies estudiadas de Avena, se observó dos tipos de macropelos, que se distinguen por su tamaño (largos, mayores de 150 µm y cortos 50-60 µm; Fig. 6, A-B). Los macropelos largos fueron observados por Kaufman & al. (1972) en Avena sativa, pero la presencia de los macropelos cortos no es mencionada. En Avenula bromoides los macropelos son cortos (menores de 150 µm) y curvos y están presentes sólo en los márgenes de la lemma (Fig. 5E). En Deschampsia atropurpurea los macropelos son cortos y están restringidos a la porción distal de la lemma. Como sostiene Ellis (1979), la distinción entre aguijones y macropelos no siempre es clara. En el caso de D. atropurpurea los describimos aquí como macropelos, aunque también podrían ser descritos como aguijones largamente barbados. Por otra parte, es un hecho aceptado que la longitud de los macropelos puede variar considerablemente en una misma epidermis. Ocasionalmente se observa también macropelos esparcidos en el dorso de la lemma de Rostraria cristata (Bustamante 27).
Ganchos y aguijones
Los ganchos y aguijones son tricomas que se distinguen sólo por su tamaño (Ellis, 1979), por ello, algunos autores se refieren a ellos simple-mente como asperezas (Aliscioni & Arriaga, 1998; Giraldo-Cañas, 2002). En Trisetum la presencia de ganchos y aguijones es ubicua (Fig. 1-2). Tanto los ganchos como los aguijones se disponen en toda la superficie de la lemma, excepto en T. sibiricum que posee tanto ganchos como aguijones distribuidos solamente sobre la quilla (Fig. 1 H). En algunas especies de Koeleria, en las especies estudiadas de Avena y en las especies estudiadas de Peyritschia, no se observó aguijones. En Leptophyllochloa micrathera se observa la presencia de aguijones sólo en algunos especimenes, pero siempre restringidos hacia el ápice de la lemma. En Peyritschia los ganchos se disponen alternando con las células largas mientras en Trisetum no se observó un patrón regular. En Deschampsia no se observa ganchos ni aguijones excepto en D. brasiliensis y D. berteroana. En esta última especie los aguijones están restringidos a la porción distal de la lemma (Fig. 6 G-I).
Estomas
En general, la presencia de estomas en la epidermis de la lemma es sólo ocasional (Snow, 1996). En Trisetum no se observa estomas en la epidermis de la lemma de ninguna de las especies estudiadas (Fig. 1-2). Sólo muestran estomas especies de Avenula (A. hookeri, A. praeusta y A. pratensis, Fig. 5G-H) y Sphenopholis (S. interrupta y S. nítida). En este último género los estomas, cuando presentes, están restringidos a la porción distal de la lemma (no mostrados). En los restantes géneros estudiados no se observa estomas en la epidermis de la lemma.
DISCUSIÓN Y CONCLUSIONES
Los resultados sugieren que la micromorfología epidérmica de la lemma es un carácter útil para circunscribir el género Trisetum. La epidermis de la lemma de Trisetum se caracteriza por estar compuesta por células largas con paredes anticlinales onduladas, moderadamente engrosadas, paredes periclinales planas o al menos no conspicuamente cóncavas (con la notable excepción de T. angus-tum, T. irazuense y T. pringlei), con células cortas típicamente presentes y escasas, ausencia de estomas y presencia de aguijones y ganchos en todas las especies. Aunque el número de especimenes examinados (1 a 6 especímenes por especie, Tabla 1) no permite establecer la variabilidad intraespecífica, este patrón epidérmico resultó muy homogéneo entre especies, lo que confirma el carácter congenérico de las especies estudiadas. Por otra parte, no es posible distinguir los subgéneros y secciones de Trisetum así como no es posible utilizar este carácter para distinguir las especies o grupos de especies.
Con excepción de la presencia de macropelos que cubren la superficie de la lemma en algunas especies, no se observó otras diferencias importantes entre las especies estudiadas del género Trisetum. La presencia de macropelos se observó tanto en especies del subgénero Trisetum (T. barbinode, T. mattheii, T. nancaguense, T. preslei, T. oreophilum var. oreophilum, T. oreophilum var johnstonii, T. rosei y ocasionalmente en T. pringlei), como en especies del subgénero Deschampsioideum (T. durangense). Si bien los resultados de este trabajo muestran que las características de la epidermis de la lemma tienen una limitada utilidad taxonómica a nivel específico en el género Trisetum, la presencia o ausencia de macropelos es un carácter consistente en la mayor parte de las especies y permite reconocer a T. rosei y T. oreophilum como especies distintas de T. spicatum.
En general, entre los géneros estudiados se observó diferencias en la forma de las células epidérmicas, ondulación de las paredes anticlinales, presencia de estomas, presencia de células silíceas y presencia y distribución de aguijones, ganchos y macropelos, que junto con los caracteres morfológicos tradicionalmente utilizados, permiten distinguir el género Trisetum de la mayor parte de sus géneros afines en forma más segura. Con la notable excepción de Graphephorum, que posee el mismo patrón epidérmico que el observado en Trisetum.
Así, los resultados permiten distinguir claramente los géneros Trisetum y Sphenopholis y confirman la ubicación de Trisetum interruptum en el género Sphenopholis, como fue inicialmente propuesto por Scribner (1906b) y, posteriormente, por Soreng (2003d): Sphenopholis interrupta (Buckl.) Scribn. subsp. interrupta; S. interrupta subsp. californica (Vasey) Scribn. Aunque esta especie presenta características exomorfológicas intermedias entre Sphenopholis y Trisetum, la epidermis de la lemma concuerda con la epidermis de las restantes especies de Sphenopholis y se correlaciona con otros caracteres, como la desarticulación de la raquilla y la forma de las glumas que caracterizan a Sphenopholis. Los resultados concuerdan también con la transferencia de las especies de Trisetum sect. Sphenophoidea Louis-Marie (T. pennsylvanicum P. Beauv., T. interruptum Buckl. y T. hallii Scribn.) al género Sphenopholis previamente propuesta por Scribner (1906b) y Erdman (1965).
Las características epidérmicas de la lemma permiten también reconocer a Peyritschia como un género diferente de Trisetum. Peyritschia se distingue de Trisetum por la ausencia de aguijones (presentes ocasionalmente en el ápice de la lemma de P. deyeuxioides, presentes en todas las especies de Trisetum), por la forma de los ganchos (de contorno circular, no barbados y generalmente rebordeados por un engrosamiento en Peyritschia (de contorno oval, barbados y no rebordeados en Trisetum) y la ausencia de macropelos en todas las especies (presentes en algunas especies en Trisetum). Estos caracteres, en conjunto con los caracteres exomorfológicos, son útiles para distinguir a Peyritschia de Trisetum y confirmar la posición sistemática de algunas especies. Peyritschia fue establecido por Fournier (1886), con una especie, P. koelerioides. Posteriormente, Koch (1979) transfiere una segunda especie, Deschampsia pringlei, a Peyritschia. Sin embargo, Hernández-Torres & Koch (1987, 1988a) consideran a Peyritschia un sinónimo de Trisetum y transfieren ambas especies al género Trisetum: Peyritschia koelerioides (= Trisetum altijugum) y Peyritschia pringlei (= Trisetum kochianum). Los resultados de este trabajo sustentan la revalidación de Peyritschia así como la transferencia de T. confertum, T. humile y T. deyeuxioides a Peyritschia, previamente propuestas (Finot, 2003a).
Dielsiochloa, género monotípico [D. floribunda (Pilg.) Pilg.], endémico de los Andes sudamericanos [Perú, Bolivia, Chile y Argentina] (Muñoz, 1972; Nicora, 1975; Zuloaga & al., 1994; Soreng, 2003a), se distingue de Trisetum por su raquilla tenaz y la presencia de antecios estériles (Pilger, 1943, 1944¸ Parodi, 1949a). La epidermis de la lemma de Dielsiochloa se distingue de la de Trisetum por las células largas con paredes anticlinales fuertemente engrosadas (moderadamente engrosadas en Trisetum) y paredes periclinales notablemente cóncavas, por la forma de los ganchos y aguijones y por la ausencia de células silíceas (presentes en Trisetum). Estos resultados concuerdan con la separación de esta especie en un género distinto de Trisetum, Dielsiochloa, ampliamente aceptado en la literatura agrostológica (Muñoz, 1972; Nicora, 1975; Clayton & Renvoize, 1986; Watson & Dallwitz, 1992; Soreng, 2003a). No obstante, las relaciones filogenéticas de Dielsiochloa con otros géneros de Aveninae no son aún bien comprendidas. Por una parte, se ha propuesto que Dielsiochloa es uno de los géneros más primitivos de la Subfamilia Pooideae (Nicora, 1975), en tanto Clayton & Renvoize (1986), consideran a Dielsiochloa derivado directamente de Trisetum.
La micromorfología de la lemma es también un buen carácter para separar los géneros Trisetum y Deschampsia, que se suma a los determinados por Koch (1979). Deschampsia presentó la estructura epidérmica más simplificada entre los géneros estudiados en el presente trabajo. Deschampsia berteroana (originalmente descrita como Trisetum berteroanum) fue transferida por Desvaux (1854) a Monandraira (Parodi, 1949b). Aunque la lemma ligeramente aquillada y el ápice de la lemma provisto de dos dientes largos (más dos dientes muy breves) recuerda la morfología del ápice de la lemma de Trisetum, los caracteres epidérmicos muestran mayor similitud con Deschampsia que con Trisetum, confirmando su posición en este género. Por otra parte, la epidermis de la lemma de D. brasiliensis la distingue tanto de Trisetum como de Deschampsia, lo que concuerda con su conflictiva posición sistemática. No cabe duda, que la epidermis de la lemma no permite decidir, en este caso, la clasificación genérica de esta especie y que se requiere de un mayor número de antecedentes antes de solucionar apropiadamente este problema.
Asimismo, los resultados del presente trabajo no permiten resolver la posición sistemática de Helictotrichon bulbosum (Hitchc.) Parodi. Esta es la única especie del género Helictotrichon presente en Sudamérica (Argentina, Chile) y se distingue de las restantes especies del género por su ovario glabro, razón por la cual ha sido excluido de Helictotrichon por algunos autores, quienes lo tratan bajo Trisetum [T. bulbosum Hitchc.] (Hitchcock, 1927a; Lange, 1995; Finot, 2003b; Soreng, 2003b). A su vez, diversos caracteres de la espiguilla (forma de la lemma, morfología del callus, forma de las lodículas) y del fruto (hilo), lo separan de Trisetum (Parodi, 1949a). La epidermis de la lemma no concuerda con la de las especies de Trisetum y Helictotrichon estudiadas. Helictotrichon bulbosum se distingue de Trisetum por sus células epidérmicas muy cortas, 2-6 veces más largas que anchas (5-10 veces más largas que anchas en Trisetum), por la ausencia de células cortas (presentes en Trisetum) y por la presencia de ganchos sin barba, a modo de asperezas incipientes (ganchos barbados en Trisetum). De Helictotrichon se distingue por las paredes anticlinales delgadas (engrosadas en Helictotrichon), células largas relativamente cortas, 2-6 veces más largas que anchas (más de 10 veces más largas que anchas en Helictotrichon) y ausencia de células cortas (presentes en Helictotrichon). Por su parte, Helictotrichon s.s. resultó relativamente homogéneo en relación con la epidermis de la lemma. En general, se caracteriza por la presencia de células silíceas, ausencia de estomas, aguijones restringidos a la porción distal de la lemma y ganchos no barbados (asperezas incipientes) en la porción proximal. En Norteamérica, la única especie presente es H. mortonianum, endémica de los Estados Unidos de América, donde habita en regiones montañosas de Utah, Colorado y Nuevo México (Hitchcock, 1951; Gervais, 1973). Por la micromorfología epidérmica de la lemma, esta especie se acerca a H. sarracenorum, de Europa. El género Avenula (=Avenastrum Jess., Avenochloa Holub) ha sido incluido por algunos autores como subgénero de Helictotrichon o como una sección de Trisetum (sect. Avenula) (Gervais, 1973). Por la presencia de abundantes células silíceas, células epidérmicas muy largas (más de 10 veces más largas que anchas), con paredes anticlinales muy engrosadas y por la ausencia de aguijones o éstos restringidos a la porción distal de la lemma mientras la porción proximal presenta sólo ganchos no barbados, a modo de asperezas incipientes se distingue de Trisetum y se acerca a Helictotrichon. De este último se distingue por la presencia de estomas en algunas de sus especies (A. hookeri, A. praeusta, A. pratensis). En general, la micromorfología de la lemma es un carácter que permite distinguir claramente los géneros Helictotrichon y Avenula de Trisetum. Grebenstein & al. (1998), a su vez, encontraron que Trisetum y Helictotrichon s.l. (incl. Avenula) se separan claramente en los análisis filogenéticos basados en las secuencias ITS 1 e ITS2 del ADN ribosomal nuclear.
Por otra parte, la separación de los géneros Trisetum y Koeleria es menos clara. Grebenstein & al. (1998) encontraron que Trisetum forma junto con Koeleria (y posiblemente otros géneros), un linaje monofilético sustentado por una deleción de 9 pb en ITS1. Este resultado concuerda con la estrecha similitud morfológica que presentan Trisetum y Koeleria, similitud que alcanza a la micromorfología epidérmica de la lemma. Es posible notar, sin embargo, que la estructura epidérmica de Koeleria muestra algún grado de simplificación con respecto a la de Trisetum. En Koeleria se observó ausencia de macropelos y escasa presencia de aguijones comparado con el género Trisetum. Según Clayton & Renvoize (1986), Koeleria parece derivar de Trisetum. En favor de esta hipótesis aparecen la estructura simplificada de la espiguilla, la reducción de la arista y la simplificación de la estructura epidérmica de la lemma. Sin embargo, una clara distinción entre estos géneros no puede hacerse en base a la epidermis de la lemma.
Una estructura epidérmica simplificada con respecto a la observada en Trisetum pudo observarse también en Leptophyllochloa. Este género monotípico, endémico de Chile y Argentina, fue fundado por Calderón ex Nicora (1978) sobre la base de Trisetum micratherum. La lemma con el ápice entero, obtuso y la arista recta y breve, lo diferencian de Trisetum. La forma de la panícula y de las lodículas lo separan de Koeleria (Nicora 1978).
El género Raimundochloa, fue creado por Molina (1986a,b), basado en Koeleria trachyantha Phil. Raimundochloa trachyantha presentó una morfología epidérmica muy distinta de la observada en las especies estudiadas de Koeleria. La abundancia de tricomas ofrece a la lemma de Raimundochloa una textura áspera, carácter destacado por Molina (1986a) entre las diferencias que lo separan de Koeleria, al que se suman varios otros detalles de la estructura floral. Las peculiares características de la epidermis de la lemma de esta especie, en conjunto con la estructura de la espiguilla, justifican la proposición de Molina (1986a,b) de otorgarle una posición sistemática particular. Por otra parte, R. trachyantha fue transferida a Rostraria por Soreng (2003c) (R. trachyantha (Phil.) Soreng, en Abstract, citada por error como R. trachyantha (Phil.) Tzvelev en Soreng 2003c: 604). Los caracteres epidérmicos de la lemma lo separan, no obstante, tanto de Koeleria como de Rostraria. Molina (1986a,b) relaciona a Raimundochloa con Gymnachne, Rostraria, Leptophyllochloa y Koeleria. Sobre la base de los caracteres epidérmicos de la lemma, su relación con Leptophyllochloa no puede ser sostenida. En cambio, una estructura epidérmica similar a la de Raimundochloa fue observada en Gymnachne y Rhombolytrum. Si bien estos resultados no permiten por sí solos fundamentar una relación directa entre Raimundochloa y Gymnachne o Rhombolytrum, concuerdan con la proposición de Molina (1986a,b) de separar esta especie de Koeleria. Asimismo, los resultados separan claramente a Raimundochloa de Trisetum.
Aunque la mayor parte de los autores concuerdan en que Relchela encuentra su correcta posición sistemática en Aveneae (Muñoz 1941, Clayton & Renvoize 1986, Watson & Dallwitz 1992, Zuloaga & al. 1994), sus relaciones taxonómicas con otros géneros de esta tribu no han sido bien establecidas. Clayton & Renvoize (1986) lo relacionan directamente con Helictotrichon, por su ovario piloso. Sin embargo, sobre la base de los resultados de este trabajo, no es posible establecer una similitud estructural en la epidermis de la lemma de Relchela con ninguna de la especies estudiadas de Helictotrichon. Por otra parte, una posible relación de Relchela con Peyritschia (Parodi 1949a) debe también descartarse a la luz de los microcaracteres epidérmicos de la lemma.
ANEXO 1
Especies, coleccionistas y localidad de origen de los especímenes estudiados, ordenados alfabéticamente
Amphibromus
A. scabrivalvis:CHILE. Petorca. Catapilco, Bliss 2264 (CONC).
Avena
A. barbata:CHILE. VIII Región, C. Joseph 5813 (CONC).
A. fatua:CHILE. VIII Región, Ormeño s.n. (CONC).
Avenula
A. bromoides: FRANCIA. Alpes Maritimes, Podlech 9055 (M). A. hookeri: USA. Fort Saskothewan, Turner s.n. (US); Rollins 1024 (US). A. marginata: ESPAÑA. Soria, Segura 19742 (M). A. praeusta: ITALIA, Südtirol, Lippert s.n. (M). A. pratensis:ALEMANIA. Bayern, Oberwinkler 18631 (M). A. pubescens: CHILE. XII Región, Magens 200 (CONC).
Deschampsia
D. antarctica: ARGENTINA. Santa Cruz, Ambrosetti & Méndez s.n. (CONC). D. atropurpurea: CHILE. XI Región, Vogel 4 (CONC). D. berteroana: CHILE. Región Metropolitana, Gunckel s.n. (CONC). D. brasiliensis: BRASIL. Itataia, Chase 8304 (US, holotipo). D. cespitosa: CHILE. Lago Sofía, Pisano & Henríquez 6815 (CONC). D. laxa: CHILE. X Región, Villagrán & Aguila 6240 (CONC).
Dielsiochloa
D. floribunda: CHILE. I Región, Landero & al. 603 (CONC).
Graphephorum
G. melicoldeum:CANADA. Newfoundland, Fernald & Wiegand 4591 (US). G. wolfii: USA. California, Bartholomew s.n. (US).
Gymnachne
G. koelerioides:CHILE. VIII Región, Matthei 569 (CONC); IX Región, Montero 4516 (CONC).
Helictotrichon
H. bulbosum:CHILE. VIII Región, Matthei 152 (CONC); Barros s.n. (CONC); Baeza 1722a (CONC). H. convolutum: GRECIA. Creta, Rechinger f. 17157 (M). H. decorum: RUMANIA. Transilvania, Wolf s.n. (M). H. desertorum subsp. basalticum: CHECHENIA. Südmähren, Angerer s.n (M). H. montanum: FRANCIA. Cantal, Merxmueller & Zollitsch 25997 (M). H. mortonianum: USA. Colorado, Swallen 1403 (US). H. parlatorei: ALEMANIA. Bayern, Dörr s.n. (M). H. sarracenorum: ESPAÑA. Granada, Merxmueller & Lippert s.n. (M).
Koeleria
K. boliviensis:BOLIVIA. Oruro, Peterson & al. 12782 (CONC). K. macrantha: ALEMANIA. Magdeburg, Schwing s.n. (CONC). K. fueguina: ARGENTINA. Santa Cruz, T.B.P.A. 3282 (CONC). K. kurtzii: CHILE. XII Región, Arroyo 8580 (CONC). K. permollis: ARGENTINA. Buenos Aires, Boelke & al. s.n. (CONC); Catamarca, Jörgensen 136 (CONC).
Leptophyllochloa
L. micrathera:CHILE. VIII Región, Neger 14742 (M); IX Región, Gunckel 12938 (CONC); Neger s.n. (M); Eyerdam 10252 (US); IX Región, Pfister s.n. (CONC).
P. conferta: ECUADOR. Imbabura, Stübel 152 (CONC, fragm. tipo ex B). P. deyeuxioides: ECUADOR. Bolívar, Peterson & Judziewicz 9300 (QCA). P. koelerioides: MEXICO. Michoacán, King & Soderstrom 5159 (US). P. pringlei: MEXICO. Tlaxcala, Sohns 597 (US).
Raimundochloa
R. trachyantha:CHILE. II Región, Pisano & Bravo 393 (CONC).
Relchela
R. panicoides:CHILE. X Región, Junge s.n. (CONC).
Rhombolytrum
R. rhomboideum:CHILE. V Región, Garaventa s.n. (CONC).
Rostraria
R. cristata:CHILE. IV Región, Bustamante 27 (CONC); Región Metropolitana, Matthei & Quezada 233 (CONC).
Sphenopholis
S. interruptavar. interrupta: USA. Texas, Hinckley & Hinckley 400 (US). S. interrupta var. californica: MEXICO. Northern Lower California, Orcutt 1437 (US, tipo de Trisetum californicum Vasey). S. nitida: USA. Indiana, Dean 12826 (US). S. obtusata: USA. Arizona, Palmer 577 (US); Wisconsin, Stout 18 (US).
Trisetum
T. ambiguum:ARGENTINA. Tierra del Fuego, Soriano 4847 (BAA, paratipo). T. andinum: ECUADOR. Cotopaxi, Sklenar & Kosteckova 80-12 (QCA). T. angustum: GUATEMALA. San Marcos, Steyermark 35525 (isotipo, US ex F). T. barbinode var. barbinode: CHILE. VIII Región, Philippi 229 (SGO); Garaventa 4681 (CONC). IX Región, Cañulaf s.n. (CONC); Pfister s.n. (CONC). T. barbinode var. hirtiflorum: CHILE. VIII Región, Pfister 6254 (CONC). T. caudulatum var. caudulatum: CHILE. Región Metropolitana, Gunckel s.n. (CONC); V Región, Bertero 998 (CONC fragm. tipo de T. variabile E. Desv. var. flavescens E. Desv.); V. Baeza s.n. 9-IX-1913 (CONC); VI Región, Montero 1354 (CONC); VII Región, Cauquenes, Dessauer 1875 (M); X Región, Gay s.n. (CONC fragm. tipo de T. variabile E. Desv. var. virescens E. Desv.). T. caudulatum var. correae: CHILE. V Región, Garaventa 2248 (CONC); IX Región, Pfister s.n. (CONC). T. cernuum var. canescens: USA. California, Duran 3333 (CONC); Montana, Chase 5208 (US). T. cernuum var. cernuum: CHILE. X Región, Godoy 119 (CONC); XI Región, Schlegel 8070 (CONC); XII Región, Schlegel 8122 (CONC). USA. Alaska, Norberg 211 (US). T. curvisetum: MEXICO. Nuevo León, Valdés & Capo UR1417 (US). T. dianthemum: CHILE. X Región, O. Philippi s.n. (SGO). T. durangense: MEXICO. Durango, Peterson & Brothers 16964 (CONC; US). T. filifolium: MEXICO. Hidalgo, Moore 3250 (US). T. flavescens: ALEMANIA. Magdeburg, Schwing s.n. (CONC). USA. Washington, Leckenby 19a (US). T. foliosum: COLOMBIA. La Guajira, Cuadros & Gentry 2676 (US). T. irazuense: COLOMBIA. Santander, Robinson & Beltrán 3041 (US). PANAMA. Chiriquí, Hitchcock 8221 (US). ECUADOR. Pichincha, Laegaard 101414 (QCA). T. ligula-tum: MÉXICO. Jalisco, Peterson & Blackburn 13778 (US). T. longiglume: Chile. Región Metropolitana, Vidal Gormaz 265 (SGO, tipo de Trisetum andicola). T. macbridei: PERU. Junín, Asplund 11793 (US). T. mattheii: Chile, I Región, Marticorena, Matthei & Quezada 86 (holotipo, CONC). T. montanum: USA. Idaho, Holmgren & Tillet 9561 (US). T. nancaguense: CHILE. VI Región, Lammers, Baeza & Peñailillo 7894 (holotipo, CONC). T. oreophilum var. oreophilum: COLOMBIA. Santander, Robinson & Beltran 3141; PERU. Junín, Hitchcock s.n. (US). T. oreophilum var. johnstonii: CHILE. III Región, Marticorena, Arroyo & Villagrán 83462b (CONC). T. orthochaetum: USA, Montana, Shelley & Ring 1230 (US). T. phleoides: CHILE. XII Región, Pisano 3090 (CONC); Magallanes, Magens 3301 (CONC); Pisano 5198 (CONC). T. pinetorum: GUATEMALA. Quezaltenango, Steyermark 34824 (US, isotipo). T. preslei: CHILE. V Región, Peñalosa & al. 91126 (CONC); Gay s.n. (tipo de T. lasiolepis, CONC fragm. ex P). T. pringlei: GUATEMALA. Huehuetenango, Steyermark 50224 (US). T. rosei: MEXICO. Volcán Iztaccihuatl, Matuda & al. 29044 (US). T. sibiricum: USA. Alaska, Hultén s.n. (S); Johnson RJ-130 (US). USA, Washington, Leckenby s.n. (US). T. spellenbergii: MÉXICO. Sonora, Peterson & Annable 12509 (US). T. spicatum var. cumingii: CHILE. XII Región, von Bohlen & Cavieres s.n. (CONC); Dollenz 1393 (CONC); Arroyo & al. 92112 (CONC); Arroyo 85213 (CONC); Henríquez & Pisano 177a (CONC). T. spica-tum var. spicatum: CHILE. XII Región, Arroyo & Squeo 860055a (CONC); Schwabe 69 (CONC). GUATEMALA. Huehuetenango, Beaman 3870 (US). T. tonduzii: COSTA RICA. Cartago, Torres s.n. (US); volcán Irazú, Semple 319 (US). T. viride: MÉXICO. Oaxaca, Liebman 597 (US, tipo de T. paniculatumFourn.); Sinaloa, Gentry 7196 (US). T. virletii: MEXICO. Amecameca, Koch 76337 (US).
AGRADECIMIENTOS
Trabajo financiado por el Proyecto DIUC 204.121.009-1.0. Los autores agradecen a los curadores de los herbarios BA, BAA, BAF, CONC, CR, F, P, PR, QCA, S, SI, SGO, US, USL y al Prof. Otto Zoellner, que permitieron el acceso o nos enviaron en préstamo sus colecciones. Al personal del Laboratorio de Microscopía Electrónica de la Universidad de Concepción, por su asistencia técnica. A los Prof. Clodomiro Marticorena, Fernando O. Zuloaga, Paul M. Peterson, Robert J. Soreng, Mariela González y Zulma Rúgolo de Agrasar, la discusión y lectura crítica del manuscrito. A Pedro Arias y Rossy Montero su valiosa ayuda técnica. Los autores agradecen también a los correctores anónimos que aportaron valiosas sugerencias para mejorar este trabajo.
BIBLIOGRAFÍA
1. Acedo, C. & F. Llamas. 2001. Variation of micromorphological characters of lemma and palea of genus Bromus (Poaceae). Ann. Bot. Fenn. 38: 1-14. [ Links ]
2. Aliscioni, S. & M. Arriaga. 1998. Estudio histofoliar comparado de las especies de los grupos Virgata y Quadrifaria del género Paspalum L. (Poaceae: Panicoideae: Paniceae). Candollea 53: 333-348. [ Links ]
3. Amarasinghe, V. & L. Watson. 1988. Comparative ultrastructure of microhairs in grasses. Bot. J. Linn. Soc. 98: 303-319. [ Links ]
4. Ball, T. B., J. D. Brotherson & J. S. Gardner. 1993. A typologic and morphometric study of variation in phytoliths from einkorn wheat (Triticum monococcum). Canad. J. Bot. 71: 1182-1192. [ Links ]
5. Barkworth, M. E. 1981. Foliar epidermis and taxonomy of North American Stipeae (Gramineae). Syst. Bot. 6: 136-152. [ Links ]
6. Barkworth, M. E. 1990. Nassella (Gramineae Stipeae): revised interpretation and nomenclatural changes. Taxon 39: 597-614. [ Links ]
7. Barkworth, M. E. & M. A. Torres. 2001. Distribution and diagnostic characters of Nassella (Poaceae: Stipeae). Taxon 50: 439-468. [ Links ]
8. Baum, B. R. 1971. Additional taxonomic studies on Avena fatuoids: some morphological attributes seen using the scanning electron microscope. Canad. J. Bot. 49: 647-649. [ Links ]
9. Bonnett, O. T. 1972. Silicified cells of grasses: a major source of plant opal in Illinois. Agric. Exp. Stat. Bull. 742: 1-39. [ Links ]
10. Catalán, P., E. A. Kellogg & R. G. Olmstead. 1997. Phylogeny of Poaceae subfamily Pooideae based on chloroplast ndhF gene sequences. Molec. Phylogen. Evol. 8: 150-166. [ Links ]
11. Chrtek, J. 1965. Bemerkungen zur Gliederung der Gattung Trisetum Pers. Bot. Not. 118: 210-224. [ Links ]
12. Chrtek, J. & V. Jirásek. 1963. On the taxonomy of genus Trisetum Pers. Webbia 17: 569-579. [ Links ]
13. Clark, L. G. & F. W. Gould, 1975. Some epidermal characteristics of paleas of Dichantelium, Panicum and Echinochloa. Amer. J. Bot. 62: 743-748. [ Links ]
14. Clayton, W. D. & S. A. Renvoize. 1986. Genera Graminum, Grasses of the World. Kew Bull. Addit. Ser. XIII, London. [ Links ]
15. Dávila, P. & L. G. Clark. 1990. Scanning electron microscopy survey of leaf epidermis of Sorghastrum (Poaceae: Andropogoneae). Amer. J. Bot. 77: 499-511. [ Links ]
16. Desvaux, E. 1854. Gramíneas, en C. Gay, Hist. Chile, Bot. 6: 233-551. E. Thunot Y.C., Paris. [ Links ]
17. Edgar, E. 1998. Trisetum Pers. (Gramineae: Aveneae) in New Zealand. New Zealand J. Bot. 36: 539-564. [ Links ]
18. Ellis, R. P. 1979. A procedure for standardizing comparative leaf anatomy in the Poaceae. II. The epidermis as seen in surface view. Bothalia 12: 641-671. [ Links ]
19. Erdman, K. S. 1965. Taxonomy of the genus Sphenopholis (Gramineae). Iowa State J. Sci. 39: 289-336. [ Links ]
20. Finot, V. L. 2003a. Peyritschia. Pp. 478, en R. J. Soreng, P.M. Peterson, G. Davidse, E. J. Judziewicz, F. O. Zuloaga, T. S. Filgueiras & O. Morrone (eds.), Catalogue of New World grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb. 48: 1-730. [ Links ]
21. Finot, V. L. 2003b. Trisetum. Pp. 659-676, en R.J. Soreng, P.M. Peterson, G. Davidse, E.J. Judziewicz, F.O. Zuloaga, T.S. Filgueiras & O. Morrone (eds.), Catalogue of New World grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb.48: 1-730. [ Links ]
22. Finot, V. L. & R. J. Soreng. 2003. Graphephorum. Pp. 380-381, en R.J. Soreng, P.M. Peterson, G.. Davidse, E. J. Judziewicz, F.O. Zuloaga, T.S. Filgueiras & O. Morrone (eds.), Catalogue of New World grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb. 48: 1-730. [ Links ]
23. Finot, V. L., P. M. Peterson, V. Soreng & F. O. Zuloaga. 2004. A Revision of Trisetum, Peyritschia, and Sphenopholis (Poaceae: Pooideae: Aveninae) in México and Central America. Ann. Missouri Bot. Gard. 91:1-30. [ Links ]
24. Finot, V. L., P. M. Peterson, R. J. Soreng & F. O. Zuloaga. 2005a. A Revision of Trisetum and Graphephorum (Poaceae: Pooideae, Aveninae) in North America North of México. Sida 21: 1419-1453. [ Links ]
25. Finot, V. L., P. M. Peterson, F. O. Zuloaga, R. J. Soreng & O. Matthei. 2005b. Revision of Trisetum (Poaceae: Pooideae: Aveninae) in South America. Ann. Missouri Bot. Gard. 92: 533-568. [ Links ]
26. Foster, R. C. 1958. A catalogue of the ferns and flowering plants of Bolivia. Contr. Gray Herb. 184: 1-223. [ Links ]
27. Foster, R. C. 1966. Studies in the flora of Bolivia. IV. Rhodora 68: 241-358. [ Links ]
28. Gervais, C. 1973. Contribution à létude cytologique et taxonomique des avoines vivaces. Mem. Soc. Helvétique Sci. Nat. 88: 1-166, 165 figs. [ Links ]
29. Giraldo-Cañas, D. 2002. Estudios micromorfológicos y anatómicos en el género neotropical Axonopus (Poaceae: Paniceae). II. Antecio superior. Caldasia 24: 293-316. [ Links ]
30. Giraldo-Cañas, D. 2004. Características micromorfológicas y anatómicas de la espiguilla y el antecio superior del género Digitaria (Poaceae: Panicoideae: Paniceae). Caldasia 26: 1-35. [ Links ]
31. Grebenstein, B., M. Röser, W. Sauer & V. Hemleben. 1998. Molecular phylogenetics relationships in Aveneae (Poaceae) species and other grasses as inferred from ITS1 and ITS2 rDNA sequences. Plant Syst. Evol. 213: 233-250. [ Links ]
32. Hernández-Torres, I. & S. D. Koch. 1987. The status of the genus Peyritschia (Gramineae: Pooideae). Phytologia 61: 453-455. [ Links ]
33. Hernández-Torres, I. & S. D. Koch. 1988a. Anatomía de la lámina foliar de Trisetum, Deschampsia y Peyritschia y sus implicaciones taxonómicas. Agrociencia 71: 61-69. [ Links ]
34. Hernández-Torres, I. & S. D. Koch. 1988b. Revisión taxonómica del género Trisetum (Gramineae: Pooideae) en México. Agrociencia 71: 71-102. [ Links ]
35. Hitchcock, A. S. 1927a. Trisetum bulbosum. J. Wash. Acad. Sci. 17: 217, f. 2. [ Links ]
36. Hitchcock, A. S. 1927b. The grasses of Ecuador, Perú and Bolivia. Contr. U.S. Natl. Herb. 24: 291-556. [ Links ]
37. Hitchcock, A. S. 1951. Manual of the grasses of the United States. 2nd Ed. United States Agriculture Department, Misc. Publ. 200. Washington, 1051 pp. [ Links ]
38. Holmgren, P. K., N. H. Holmgren & L. C. Barnett. 1990. Index herbariorum. Part I. The herbaria of the world, ed. 8. Regnum Veg. 120: 1-693. [ Links ]
39. Hultén, E. 1959. The Trisetum spicatum complex. Svensk Bot. Tidskr. 53: 203-228. [ Links ]
40. Jabobs, S. W .L. & L. Lapinpuro. 1986. The Australian species of Amphibromus (Poaceae). Telopea 2: 715-729. [ Links ]
41. Kaufman, P. B., J. D. Lacroix, J. J. Rosen, L. F. Allard & W. C. Bigelow. 1972. Scanning electron microscopy and electron micropobe analysis of silicification patterns in inflorescence bracts of Avena sativa. Amer. J. Bot. 59: 1018-1025. [ Links ]
42. Kellog, E. A. 1990. Ontogenetic studies in florets of Poa (Gramineae): allometry and heterochrony. Evolution 44: 1978-1989. [ Links ]
43. Koch, S. D. 1979. The relationships of three Mexican Aveneae and some new characters for distinguishing Deschampsia and Trisetum (Gramineae). Taxon 28: 225-235. [ Links ]
44. Lange, D. 1995. Untersuchungen zur Systematik und Taxonomie der Gattung Helictotrichon Besser ex J. A. Schultes et J.H. Schultes (Poaceae) in Südosteuropa und Vorderasien. Biblioth. Bot. Heft 144: 1-238. [ Links ]
45. Louis-Marie, P. 1928. The genus Trisetum in America. Rhodora 30: 209-223, 237-245. [ Links ]
46. Marticorena, C. & M. Quezada. 1985. Catálogo de la flora vascular de Chile. Gayana, Bot. 42: 1-147. [ Links ]
47. Metcalfe, C. R. 1960. Anatomy and Morphology of the Monocotyletdons I. Gramineae. Clarendon Press, Oxford. i-xlix, 1-730. [ Links ]
48. Molina, A. M. 1986a. Parodiochloa, un nuevo género de Gramineae para Chile y Perú. Parodiana 4: 473-489. [ Links ]
49. Molina, A. M. 1986b. Raimundochloa, nuevo nombre para Parodiochloa A. M. Molina non Hubbard. Parodiana 4: 401-402. [ Links ]
50. Molina, A. M. 1989. Nuevos sinónimos de Leptophyllochloa micrathera (Desvaux) Calderón ex Nicora. Parodiana 5: 341-345. [ Links ]
51. Molina, A. M. 1993. Las especies del género Koeleria (Gramineae: Poeae) de Sudamérica. Parodiana 8: 37-67. [ Links ]
52. Morrone, O., F. O. Zuloaga, M. E. Arriaga, R. Pozner & S. Alliscioni. 1998. Revisión sistemática y análisis cladístico del género Chaetium (Poaceae: Panicoideae: Paniceae). Ann. Missouri Bot. Gard. 85: 404-424. [ Links ]
53. Muñoz, C. 1941. Relchela panicoides Steudel, Gramineae endémica de Chile. J. Arnold Arbor. 22: 209-218, 1 lám. [ Links ]
54. Muñoz, M. 1972. Dielsiochloa floribunda (Pilger) Pilger en Chile. Not. Mens. Mus. Nac. Hist. Nat. 186: 3-5. [ Links ]
55. Nicora, E. G. 1975. Un género de gramíneas nuevo para la flora argentina: Dielsiochloa Pilger. Darwiniana 19: 400-403. [ Links ]
56. Nicora, E. G. 1978. Gramineae, en M.N. Correa, Flora Patagónica 3: 1-563. Col. Ci. INTA, Buenos Aires. [ Links ]
57. Nicora, E. G. & Rúgolo de Agrasar, Z.E. 1987. Los géneros de Gramíneas de América Austral. Ed. Hemisferio Sur, Buenos Aires. [ Links ]
58. Parodi, L. R. 1949a. Los géneros de Aveneae de la flora argentina. Revista Argent. Agron. 16: 205-223. [ Links ]
59. Parodi, L. R. 1949b. Las gramíneas sudamericanas del género Deschampsia. Darwiniana 8: 415-475. [ Links ]
60. Peñailillo, P. 1998. Delimitación de los géneros de la tribu Stipeae (Poaceae) nativos de América del Sur. Tesis para optar al grado de Doctor en Ciencias mencion Botánica, Universidad de Concepción, Concepción. [ Links ]
61. Peterson, P. M. 1989. Lemma micromorphology in the annual Muhlenbergia (Poaceae). Southw. Naturalist 34: 61-71. [ Links ]
62. Peterson, P. M. & C.R. Annable. 1990. A revision of Blepharoneuron (Poaceae: Eragrostideae). Syst. Bot. 15: 515-525. [ Links ]
63. Persoon, C. H. 1805. Synopsis plantarum, seu enchiridium botanicum, complectens enumerationem systematicam specierum huqusque cognitarum, vol. 1. Paris. [ Links ]
64. Pilger, R. 1943. Über einige Gramineen aus Südamerika. Bot. Jahrb. Syst. 73: 99-105. [ Links ]
65. Pilger, R. 1944. Sobre algunas gramíneas de América del Sur. Revista Argent. Agron. 1: 257-264. [ Links ]
66. Prat, H. 1932, Lepiderme des Graminées. Etude anatomique et systematique. Ann. Sci. Nat., Bot. 10. 14: 117-324. [ Links ]
67. Prat, H. 1936. La systématique des graminées. Ann. Sci. Nat., Bot. 10. 18: 165-258. [ Links ]
68. Prat, H. 1948. General features of the epidermis in Zea mays. Ann. Missouri Bot. Gard. 35: 341-351. [ Links ]
69. Prat, H. 1961. Emploi des caractères épidermiques dans la classification des graminées. Recent Adv. Bot. 1: 99-102. [ Links ]
70. Rojas, F. 1994. Revisión de las especies de la Tribu Stipeae (Poaceae) en Bolivia. Tesis para optar al grado de Magíster en Ciencias con mención en Botánica, Universidad de Concepción, Concepción. [ Links ]
71. Scribner, F. L. 1906a. Notes on Trisetum and Graphephorum. New England Bot. Club. 8: 81-90. [ Links ]
72. Scribner, F. L. 1906b. The genus Sphenopholis. Rhodora 8: 137-146. [ Links ]
73. Shaw, R. B. & F. E. Smeins. 1979. Epidermal characteristics of the callus in Eriochloa (Poaceae). Amer. J. Bot. 66: 907-913. [ Links ]
74. Shaw, R. B. & R. Webster. 1983. Characteristics of the upper anthecia of Ichnanthus (Poaceae: Paniceae). Bot. Gaz. 144: 363-370. [ Links ]
75. Snow, N. 1996. The phylogenetic utility of lemmatal micromorphology in Leptochloa s.l. and related genera in subtribe Eleusininae (Poaceae, Chloridoideae, Eragrostidae). Ann. Missouri Bot. Gard. 83: 504-529. [ Links ]
76. Soderstrom, T. R. & F. O. Zuloaga. 1989. A revision of the genus Olyra and the new segregate genus Parodiolyra (Poaceae: Bambusoideae: Olyreae). Smithsonian Contr. Bot. 69: 1-79. [ Links ]
77. Soreng, R. J. 2003a. Dielsiochloa. Pp. 270, en R. J. Soreng, P.M. Peterson, G. Davidse, E.J. Judziewicz, F.O. Zuloaga, T.S. Filgueiras & O. Morrone (eds.), Catalogue of NewWorld grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb.48: 1-730. [ Links ]
78. Soreng, R. J. 2003b. Helictotrichon. Pp. 382-383, en R.J. Soreng, P.M. Peterson, G. Davidse, E.J. Judziewicz, F.O. Zuloaga, T.S. Filgueiras & O. Morrone (eds.), Catalogue of New World grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb. 48: 1-730. [ Links ]
79. Soreng, R. J. 2003c. Rostraria. Pp. 604, en R.J. Soreng, P.M. Peterson, G.. Davidse, E.J. Judziewicz, F.O. Zuloaga, T.S. Filgueiras & O. Morrone (eds.), Catalogue of New World grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb. 48: 1-730. [ Links ]
80. Soreng, R. J. 2003d. Sphenopholis. Pp. 614-617, en R. J. Soreng, P.M. Peterson, G.. Davidse, E.J. Judziewicz, F.O. Zuloaga, T.S. Filgueiras & O. Morrone (eds.), Catalogue of New World grasses (Poaceae): IV. subfamily Pooideae. Contr. U.S. Natl. Herb. 48: 1-730. [ Links ]
81. Soreng, R. J. & J. Davis. 2000. Phylogenetic structure in Poaceae subfamily Pooideae as inferred from molecular and morphological characters: misclassification versus reticulation, en S.W.L. Jacobs & J. Everett, Grasses: Systematics and Evolution pp. 61-74. [ Links ]
82. Soreng, R. J., G. Davidse, P.M. Peterson, F. O. Zuloaga, E.J. Judziewicz & T. S. Filgueiras. 2003. Catalogue of New World Grasses (Poaceae). IV. Subfamily Pooideae. Contr. U.S. Natl. Herb.48: 1-730. [ Links ]
83. Tateoka, T., S. Inowe & K. Kawano. 1959. Notes on some grasses IX: Systematic significance of bicellular micro-hairs of leaf epidermis. Bot. Gaz. 121: 80-91. [ Links ]
84. Terrel, E. E., P. M. Peterson & W. P. Wergin. 2001. Epidermal features and spikelet morphology in Oryza and related genera (Poaceae: Oryzeae). Smithsonian Contr. Bot. 91: 1-50. [ Links ]
85. Terrel, E. E. & W. P. Wergin. 1981. Epidermal features and silica deposition in lemmas and awns of Zizania (Gramineae). Amer. J. Bot. 68: 697-707. [ Links ]
86. Terrel, E. E.,W. P. Wergin & S. A. Renvoize. 1983. Epidermal features of spikelets in Leersia (Poaceae). Bull. Torrey Bot. Club 110: 423-434. [ Links ]
87. Thomasson, J. R. 1977. Epidermal patterns of the lemma in some fossil and living grasses and their phylogenetic significance. Science 199: 975-977. [ Links ]
88. Thomasson, J. R. 1986. Lemma epidermal features in the North American species of Melica and selected species of Briza, Catabrosa, Glyceria, Neostaphia, Pleuropogon and Schizachne (Gramineae). Syst. Bot. 11:253-262. [ Links ]
89. Thompson, R.A. & Estes, J.R. 1986. Anthecial and foliar micromorphology and foliar anatomy of Brachiaria (Poaceae: Paniceae). Amer. J. Bot. 73: 398-408. [ Links ]
90. Tovar, O. 1957. Las gramíneas de Huancalevica. Primera parte. Mem. Mus. Hist. Nat. "Javier Prado" 6: 1-110. [ Links ]
91. Tovar, O. 1993. Las gramíneas (Poaceae) del Perú. Ruizia 13: 1-480. [ Links ]
92. Tucker, G. C. 1996. The genera of Pooideae (Gramineae) in the Southeastern United States. Harv. Pap. Bot. 9: 11-90. [ Links ]
93. Valdés-Reyna, J. & S. Hatch. 1991. Lemma micromorphology in the Eragrostideae (Poaceae). Sida 14: 531-549. [ Links ]
94. Vázquez, F. M. & M. E. Barkworth. 2004. Resurrection and emendation of Macrochloa (Gramineae: Stipeae). Bot. J. Linn. Soc. 144: 483-495. [ Links ]
95. Watson, L. & M. J. Dallwitz. 1992 (onwards). Grass Genera of the World. http:// biodiversity.uno.edu/delta/. Versión: (agosto 18, 1999). [ Links ]
96. Webb, M. E. 1990. Micromorphology of the leaf epidermis in taxa of the Agropyron-Elymus complex (Poaceae). Bot. J. Linn. Soc. 103: 153-158. [ Links ]
97. Zuloaga, F. O. & E. J. Judziewicz. 1991. A revision of Raddiella (Poaceae: Bambusoideae: Olyreae). Ann. Missouri Bot. Gard. 78: 928-941. [ Links ]
98. Zuloaga, F. O.& O. Morrone. 1996. Revisión de las especies americanas de Panicum Subgénero Panicum Sección Panicum (Poaceae: Panicoideae: Paniceae). Ann. Missouri Bot. Gard. 83: 200-280. [ Links ]
99. Zuloaga, F. O., O. Morrone, A. S. Vega & L. M. Giussani. 1998. Revisión y análisis cladístico de Steinchisma (Poaceae: Panicoideae: Paniceae). Ann. Missouri Bot. Gard. 85: 631-659. [ Links ]
100. Zuloaga, F. O. & T. Soderstrom. 1985. Classification of the outlying species of New World Panicum (Poaceae: Paniceae). Smithsonian Contr. Bot. 59: 1-63. [ Links ]
101. Zuloaga, F. O., E. Nicora, Z. E. Rúgolo de Agrasar, O. Morrone, J. Pensiero & A. Cialdella. 1994. Catálogo de la familia Poaceae en la República Argentina. Monogr. Syst. Bot. Missouri Gard. 47: 1-178. [ Links ]














