Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Darwiniana, nueva serie
Print version ISSN 0011-6793On-line version ISSN 1850-1699
Darwiniana vol.44 no.2 San Isidro Aug./Dec. 2006
Análisis comparativo del cariotipo en poblaciones de Alstroemeria ligtu subsp. ligtu y A. ligtu subsp. simsii (Alstroemeriaceae) de Chile
Carlos M. Baeza1, Otto Schrader2, Eduardo Ruiz1 & M. Negritto1
1Facultad de Ciencias Naturales y Oceanográficas, Departamento de Botánica, Casilla 160-C, Universidad de Concepción, Concepción, Chile; E-mail: cbaeza@udec.cl (autor corresponsal).
2 Federal Centre for Breeding Research on Cultivated Plants, Institute of Horticultural Crops, Neuer Weg 22/23, 06484 Quedlinburg, Germany.
Resumen. Baeza, C. M.; O. Schrader, E. Ruiz & M. Negritto. 2006. Análisis comparativo del cariotipo en poblaciones de Alstroemeria ligtu subsp. ligtu y A. ligtu subsp. simsii (Alstroemeriaceae) de Chile. Darwiniana 44(2): 313-318.
Alstroemeria (Alstroemeriaceae) es un género endémico de América del Sur. En Chile, este género se distribuye desde el extremo norte hasta la Patagonia, y la mayor diversidad de especies se encuentra en la zona central. Precisamente en esta zona crece Alstroemeria ligtu con sus 3 subespecies: A. ligtu subsp. ligtu, A. ligtu subsp. incarnata, A. ligtu subsp. simsii. Se realizó un estudio comparativo del cariotipo de individuos provenientes de 5 poblaciones de A. ligtu subsp. ligtu de la VIII Región, y de una población de A. ligtu subsp. simsii de la V Región, mediante tinción de los cromosomas con DAPI u orceína acética. Las seis poblaciones estudiadas presentaron un cariotipo asimétrico, con 2n=2x=16 cromosomas. Las poblaciones de A. ligtu subsp. ligtu presentaron una fórmula haploide conformada por cuatro cromosomas metacéntricos (los pares 1 y 2 con microsatélites), uno submetacéntrico con microsatélite y tres telocéntricos con microsatélites. La población de A. ligtu subsp. simsii se caracterizó por poseer cinco cromosomas metacéntricos (el par 2 con un microsatélite y el par 6 con una constricción secundaria) y tres cromosomas telocéntricos con satélite. Estos resultados indican que el cariotipo en A. ligtu es variable, y es probable que cambios a nivel cromosómico hayan contribuido en la diversificación de esta especie.
Palabras clave. Alstroemeria, Alstroemeriaceae, Cariotipo, Chile.
Abstract. Baeza, C. M.; O. Schrader, E. Ruiz & M. Negritto. 2006. Comparative karyotype analysis in populations of Alstroemeria ligtu subsp. ligtu and A. ligtu subsp. simsii (Alstroemeriaceae) from Chile. Darwiniana 44(2): 313-318.
Alstroemeria (Alstroemeriaceae) is a genus endemic to South America. In Chile, this genus is distributed from the northern end to Patagonia, with a diversification center in central Chile. Precisely in this central zone grows Alstroemeria ligtu with its three subspecies: A. ligtu subsp. incarnata, A. ligtu subsp. simsii and A. ligtu subsp. ligtu. A comparative study of the karyotype with DAPI or acetic orcein of 5 populations of A. ligtu subsp. ligtu from the VIII Region, and one population of A. ligtu subsp. simsii from the V Region was made. The karyotype observed in these six studied populations was asymmetric, with 2n=2x=16 chromosomes. The populations of A. ligtu subsp. ligtu presented a haploid formula conformed by four metacentric chromosomes (pairs 1 and 2 with microsatellites), one submetacentric chromosome with a microsatellite, and three telocentric chromosomes with microsatellites. The haploid formula of A. ligtu subsp. simsii was: five metacentric chromosomes (pair 2 with a microsatellite, and pair 6 with a secondary constriction) and three telocentric chromosomes with satellite. Therefore, the karyotype of A. ligtu is variable, and changes at chromosomal level have probably contributed to the diversification of this species.
Keywords. Alstroemeria, Alstroemeriaceae, Chile, karyotype.
Original recibido el 6 de septiembre de 2006;
aceptado el 20 de octubre de 2006
INTRODUCCIÓN
Alstroemeria L. (Alstroemeriaceae) es un género exclusivamente sudamericano, que comprende alrededor de 50 especies distribuidas desde Venezuela a Argentina y Chile, y que habitan desde el nivel del mar hasta los 4.500 m s.m. (Aagesen& Sanso, 2003; Ravenna, 1988; Sanso 2002). En Chile, el género está compuesto por 31-33 especies (Bayer, 1987; Muñoz & Moreira, 2003) distribuidas desde el extremo norte hasta la Patagonia, siendo la zona central la que presenta la mayor concentración de especies (Muñoz & Moreira, 2003).
Dada la belleza de sus flores, las especies de Alstroemeria han adquirido relevancia mundial como plantas ornamentales de cultivo y de corte (Buitendijk & Ramanna, 1996; Buitendijk et al., 1997). Alstroemeria ligtu L., constituye una fuente de cruzamientos para nuevos cultivares y ha sido exitosamente utilizada en Japón (Miyake et al., 1989; Zhou et al., 2003). Híbridos interespecíficos entre A. ligtu y otras especies de Alstroemeria han sido producidos mediante cultivo de óvulos (De Jeu & Jacobsen, 1995; Ishikawa et al., 1997). Dentro de esta especie endémica de Chile se reconocen tres subespecies: A. ligtu L. subsp. ligtu, A. ligtu L. subsp. incarnata Bayer y A. ligtu subsp. simsii (Sprengel) Bayer (Bayer, 1987; Muñoz & Moreira, 2003). El objetivo de esta investigación consistió en analizar y comparar el cariotipo de Alstroemeria ligtu subsp. ligtu y de una población de A. ligtu subsp. simsii, considerando que el análisis del cariotipo de taxones relacionados genera información sobre la evolución dentro del grupo que conforman (González & Fernández, 1984; Dimitrova & Greilhuber, 2000).
MATERIALES Y MÉTODOS
Material examinado
Los ejemplares coleccionados están depositados en el Herbario de la Universidad de Concepción (CONC). Las plantas fueron cultivadas en invernadero.
Alstroemeria ligtu L. subsp. ligtu
CHILE. VIII Región. Provincia de Concepción, bifurcación camino a Chome, 60 m, (36º46'S-73º11'O), 20-XII-2002, Baeza 4179 (CONC); Camino hacia Ramuntcho, 60 m, (36º47'S-73º10'O), 20-XII-2002, Baeza 4178 (CONC); Camino a Caleta Lenga, ca. 500 m, fábrica AGA, 20 m, (36º46'S-73º07'O), 20-XII- 2002, Baeza 4180 (CONC); Camino Concepción Santa Juana, cerca de Mitrinhue, 21 m, (37º00'S-72º58'O), 23-XII-2002, Baeza 4184 (CONC); Camino Concepción Santa Juana, km 17, 47 m (36º58'S-73º00'O), 23- XII-2002, Baeza 4185 (CONC).
Alstroemeria ligtu L. subsp. simsii (Sprengel) Bayer
CHILE. IV Región. Prov. de Valparaíso, Jardín Botánico Nacional, al inicio del sendero de Los Colectivos, 25 m, (33º02'S-71º30'O), 28-X-2005, Baeza & Novoa 4244 (CONC).
Obtención de cariotipos
Puntas de raíces de 1-2 cm de longitud fueron pretratadas con una solución de 8-hidroxiquinolina (2mM) por 24 horas a 4 ºC. Posteriormente, fueron fijadas en etanol: ácido acético (3:1) por 24 horas y almacenadas en alcohol 70% a -20 ºC. Previamente a la maceración, las raíces fueron lavadas 3 veces en agua destilada por 30 minutos, para luego ser tratadas con una mezcla de enzimas de 4% celulasa "Onozuka R-10" (Serva) + 1% pectinasa Y-23 (Seishin Pharmaceutical) en 75 mM de KCl, a pH 4,0 por 40 minutos a 37 ºC. Luego de un breve lavado en agua destilada, las raíces fueron mantenidas durante un minuto en ácido acético al 45% y luego se hizo el aplastado correspondiente. Los cubreobjetos fueron removidos después de mantener los preparados a -84 ºC. Éstos se dejaron secar durante 1-2 días a temperatura ambiente y se almacenaron a -20 ºC. Los cromosomas fueron teñidos con DAPI (1,0 ng/l de 4',6-diamidino- 2-fenilindol). A la colección Baeza & Novoa 4244, posteriormente a la fijación, se le realizó una hidrólisis ácida con HCl 0,5 N durante 25 minutos a 40 ºC. Luego se lavó 3 veces con agua destilada, y por último se tiñó el ápice de la raíz con orceína acética al 1% y se realizó el aplastado. Se analizaron 10 individuos en cada población. El análisis de los cromosomas (10 placas metafásicas) se realizó con un microscopio Axioskop Zeiss con cámara fotográfica digital incluida. Los cromosomas se midieron con la ayuda del programa "MicroMeasure 3.3" (Reeves, 2001) y fueron clasificados de acuerdo a su índice centromérico (Levan et al., 1964). Para cada población analizada, se determinó el índice de asimetría del cariotipo (AsI %) usando la fórmula de Arano y Saito (1980) y el valor R (la razón de la longitud del par más largo dividido por el par más corto). Se usó el programa Corel Draw versión 8.0 para la
RESULTADOS
Los individuos estudiados de Alstroemeria ligtu presentan un cariotipo asimétrico con 2n=2x=16 cromosomas (Figs. 1 y 2). Los de A. ligtu subsp. ligtu tienen una fórmula haploide constituida por cuatro cromosomas metacéntricos (el par 1 y 2 con microsatélites, Fig. 1A-B, recuadros y Fig. 2A), uno submetacéntrico con satélite (par 7, Fig. 1E, recuadro) y tres telocéntricos con satélites (Figs. 1A-E y 2A). Los individuos de A. ligtu subsp. simsii presentan cinco cromosomas metacéntricos (el par 2 con un satélite y el par 6 con una constricción secundaria) y tres cromosomas telocéntricos con satélite (Figs. 1F y 2B). La Tabla 1 resume, para cada población analizada, la fórmula cariotípica haploide, el índice de asimetría del cariotipo (AsI %) descrito por Arano y Saito (1980), y la razón entre la longitud del cromosoma de mayor tamaño y el de menor tamaño (R).
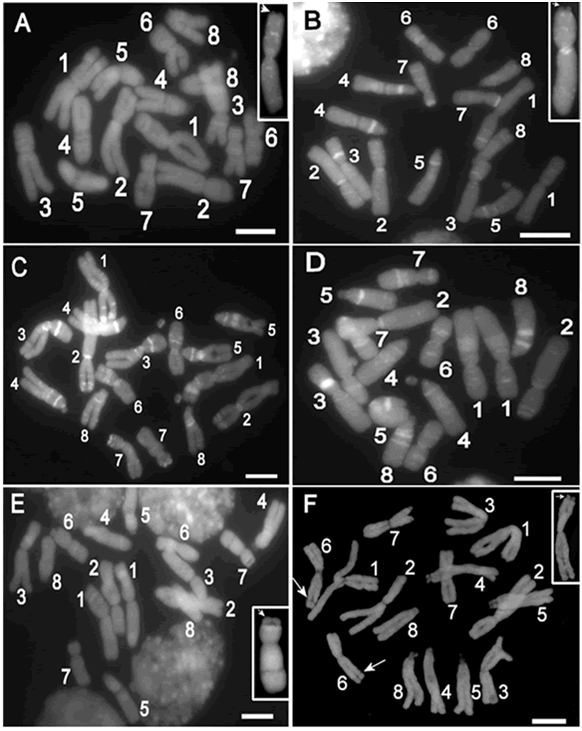
Fig. 1. Metafases mitóticas de Alstroemeria ligtu (2n=16). A, A. ligtu subsp. ligtu (Baeza 4180). En el recuadro se observa el cromosoma 1 y la flecha indica el satélite. B, A. ligtu subsp. ligtu (Baeza 4178). En el recuadro se observa el cromosoma 2 y la flecha indica el satélite. C, A. ligtu subsp. ligtu (Baeza 4179). D, A. ligtu subsp. ligtu (Baeza4184). E, A. ligtu subsp. ligtu (Baeza 4185). En el recuadro se observa el cromosoma 7 y la flecha indica el satélite. F, A. ligtu subsp. simsii (Baeza & Novoa 4244). En el recuadro se observa el cromosoma 2 y la flecha indica el satélite. La escala corresponde a 10 µm.
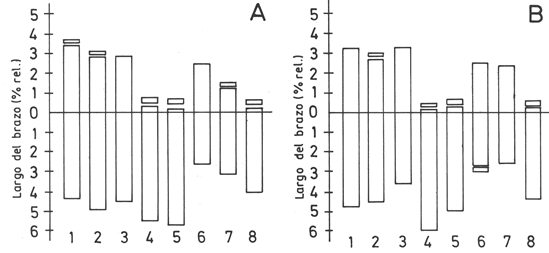
Fig. 2. Idiogramas de los complementos haploides. A, Alstroemeria ligtu subsp. ligtu (promedio de las 5 poblaciones). B, A. ligtu subsp. simsii (Baeza & Novoa 4244). Los cromosomas se han ordenado de acuerdo a su tamaño decreciente.
Tabla 1. Características del cariotipo de las poblaciones de Alstroemeria ligtu subsp. ligtu y A. ligtu subsp. simsii estudiadas. Abreviaturas: AsI %, índice de asimetría de Arano & Saito (1980); R, razón de la longitud del par más largo / longitud del par más corto.

DISCUSIÓN
Las tres subespecies de Alstromeria ligtu presentan distintas distribuciones geográficas y características morfológicas florales que permiten distinguirlas. A. ligtu subsp. ligtu se distribuye en la VII y VIII Regiones de Chile Central, en cambio A. ligtu subsp. simsii está presente en la V y la Región VI del país. Buitendjik & Ramanna (1996) y Buitendijk et al. (1998) encontraron variación en la cantidad de ADN y el polimorfismo de bandas C en los cromosomas de Alstroemeria ligtu subsp. ligtu y A. ligtu subsp. simsii; el cariotipo se caracterizaba por presentar 4 cromosomas metacéntricos, 1 submetacéntrico y 3 telocéntricos, es decir la misma fórmula cariotípica encontrada para las cinco poblaciones de A. ligtu subsp. ligtu analizadas en este trabajo (Tabla 1). Sin embargo, estos autores no hacen referencia a la presencia de satélites en los cromosomas metacéntricos 1, 2 y 7, situación que se observa en la mayoría de las placas metafásicas estudiadas en las cinco poblaciones de A. ligtu subsp. ligtu (Fig. 2A). Además, la población de A. ligtu subsp. simsii estudiada en este trabajo se caracteriza por presentar diferencias en los cromosomas 1, 6 y 7 (Fig. 2B). Los cromosomas 1 y 6 son metacéntricos, al igual que en Buitendjik & Ramanna (1996) y Buitendijk et al. (1998). Sin embargo, estos autores no informan la presencia de un satélite en el cromosoma 1, situación observada en A. ligtu subsp. ligtu (Fig. 1A, recuadro). En A. ligtu subsp. simsii el cromosoma 6 presenta una constricción secundaria que podría corresponder a la región organizadora del nucléolo (NOR), situación nunca antes observada en A. ligtu (Fig. 1F, flechas). Buitendjik et al. (1997; 1998) trabajaron con un híbrido interespecífico (P002K101-1) entre A. ligtu subsp. simsii x A. inodora, el cromosoma 6 de esta planta es también metacéntrico y además presenta la misma constricción secundaria. No obstante, esta constricción no se aprecia en las especies parentales (Buitendjik & Ramanna, 1996). En este estudio, se documenta la presencia por primera vez de esta característica del cariotipo en una población natural de A. ligtu subsp. simsii. Se podría pensar que la población coleccionada en la V Región podría corresponder a un híbrido natural entre A. ligtu subsp. simsii y A. inodora, situación altamente improbable debido a que A. inodora no crece en Chile, sino en Brasil (Buitendjik et al., 1997; Kamstra et al., 1997).
Zhou et al. (2003) realizaron una caracterización de híbridos en Alstroemeria utilizando secuencias de ADN altamente repetitivas de A. ligtu subsp. ligtu, además, entregaron un detallado cariotipo de A. ligtu subsp. ligtu y de A. ligtu subsp. simsii. El cariotipo de A. ligtu subsp. ligtu presenta una fórmula constituida por 3 cromosomas metacéntricos y 5 cromosomas subtelocéntricos, sin presencia de un cuarto cromosoma metacéntrico y de cromosomas telocéntricos con satélites, a diferencia de lo informado en este trabajo y en el de Buitendjik & Ramanna (1996) y Buitendjik et al. (1998). Tampoco existe coincidencia entre el cariotipo aquí informado para A. ligtu subsp. simsii y el cariotipo que presentan Zhou et al. (2003). Estos autores indican para esta subespecie una fórmula haploide conformada por 3 cromosomas metacéntricos, 1 submetacéntrico y 3 subtelocéntricos, a diferencia del cariotipo encontrado en este trabajo. Tampoco hay mención de una constricción secundaria en el cromosoma 6 en la población estudiada por Zhou et al. (2003), situación claramente visible en el material estudiado en este trabajo. Además, al comparar ambos cariotipos no hay coincidencia en los tipos de cromosomas, por ejemplo: los cromosomas metacéntricos para Zhou et al. (2003) corresponden a los pares 1, 2, y 6 para la subespecie ligtu, y para la subespecie simsii los pares 1, 2, y 7. En cambio, para A. ligtu subsp. ligtu los cromosomas metacéntricos que aquí se informan son los pares 1, 2, 3 y 6 (Fig. 2A) y para A. ligtu subsp. simsii corresponden a los pares 1, 2, 3, 6 y 7 (Fig. 2B). Además, no se encontraron cromosomas subtelocéntricos en esta investigación, sino únicamente telocéntricos con satélites (Tabla 1). En definitiva, la única diferencia aquí encontrada entre las subespecies A. ligtu subsp. ligtu y A. ligtu subsp. simsii corresponde a los pares cromosómicos 1, 6 y 7. En A. ligtu subsp. ligtu los cromosomas 1 y 2 presentan en algunas metafases un satélite (Fig. 1A, 1B, recuadros). En A. ligtu subsp. simsii el cromosoma 1 carece de satélite y sólo el cromosoma 2 lo posee, y el cromosoma 6 presenta una constricción secundaria (Fig. 1F). En A. ligtu subsp. ligtu, el cromosoma 6 no presenta constricción alguna y el cromosoma 7 es submetacéntrico con un microsatélite (Fig. 1E, recuadro), en cambio en A. ligtu subsp. simsii este cromosoma es metacéntrico y no presenta satélite. Esto puede significar que el polimorfismo intraespecífico e interpoblacional no sólo es común en esta especie en cuanto al número de bandas C en los cromosomas y tamaño del genoma (Buitendjik et al., 1998) sino también existe polimorfismo a nivel del tipo de cromosomas.
Nuestras observaciones indican que el cariotipo en A. ligtu no es uniforme y es probable que cambios a nivel cromosómico hayan contribuido a la diversificación de esta especie, situación similar también encontrada en Crotalaria L. (Fabaceae) (Almada et al., 2006). A. ligtu subsp. simsii presenta un cariotipo más simétrico que A. ligtu subsp. ligtu. Esta variación en la asimetría de sus cariotipos estaría indicando translocación de segmentos cromosómicos (Shan et al., 2003).
AGRADECIMIENTOS
El primer autor agradece a la Fundación Alexander von Humboldt (Georg Forster Stipendium), al Proyecto DIUC Nº 204.111.036-1.0, al proyecto Fundación Andes Nº C-14055 y al Departamento de Botánica de la Universidad de Concepción por las facilidades otorgadas. Al Sr. Patricio Novoa (CONAF, V Región) por su apoyo logístico.
BIBLIOGRAFÍA
1. Aagesen, L. & M. Sanso. 2003. The phylogeny of the Alstroemeriaceae, based on morphology, rps16 Intron, and rbcL sequence data. Syst. Bot. 28: 47-69. [ Links ]
2. Almada, R., J. Daviña & J. Seijo. 2006. Karyotype analysis and chromosome evolution in southernmost South American species of Crotalaria (Leguminosae). Bot. J. Linn. Soc. 150: 329-342. [ Links ]
3. Arano, H., & H. Saito. 1980. Cytological studies in family Umbelliferae 5. Karyotypes of seven species in subtribe Seselinae. La Kromosomo 2: 471-480. [ Links ]
4. Bayer, E. 1987. Die Gattung Alstroemeria in Chile. Mitt. Bot. Staatssaml. München 24: 1-362. [ Links ]
5. Buitendijk, J. & M. Ramanna. 1996. Giemsa C-banded karyotypes of eight species of Alstroemeria L. and some of their hybrids. Ann. Bot. 78: 449-457. [ Links ]
6. Buitendijk, J.; E. Boon. & M. Ramanna. 1997. Nuclear DNA content in twelve species of Alstroemeria L. and some of their hybrids. Ann. Bot. 79: 343-353. [ Links ]
7. Buitendijk, J.; A. Peters, R. Jan-Quené. & M. Ramanna. 1998. Genome size variation and C-band polymorphism in Alstroemeria aurea, A. ligtu and A. magnifica (Alstroemeriaceae). Plant Syst. Evol. 212: 87-106. [ Links ]
8. De Jeu, M. & J. Jacobsen. 1995. Early postfertilization ovule culture in Alstroemeria L. and barriers to interspecific hybridization. Euphytica 86: 15-23. [ Links ]
9. Dimitrova, D. & J. Greilhuber. 2000. Karyotype and DNA-content evolution in ten species of Crepis (Asteraceae) distributed in Bulgaria. Bot. J. Linn. Soc. 132: 281-297. [ Links ]
10. González, J. & A. Fernández. 1984. Phylogenetic relationships in the family Resedaceae. Genetica 64: 185-198. [ Links ]
11. Ishikawa, T., T. Takayama, H. Ishizaka, K. Ishikawa & M. Mii. 1997. Production of interspecific hybrids between Alstroemeria ligtu L. hybrid and A. pelegrina L. var. rosea by ovule culture. Breeding Science 47: 15-20. [ Links ]
12. Kamstra, S., A. Kuipers, M. De Jeu, M. Ramanna & E. Jacobsen. 1997. Physical localisation of repetitive DNA sequences in Alstroemeria: karyotyping of two species with species- specific and ribosomal DNA. Genome 40: 652-658. [ Links ]
13. Levan, A., K. Fredga & A. A. Sandberg. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52: 201-220. [ Links ]
14. Miyake, I., S. Mobara. & K. Chiba. 1989. Breeding spotless Alstroemeria in Japan. Herbertia 45: 40-44. [ Links ]
15. Muñoz, M. & A. Moreira. 2003. Alstroemerias de Chile. Diversidad, distribución y conservación. Santiago: Taller La Era. [ Links ]
16. Ravenna, P. 1988. New or noteworthy species of Alstroemeria. Phytologia 64: 281-288. [ Links ]
17. Reeves, A. 2001. MicroMeasure: a new computer program for the collection and analysis of cytogenetic data. Genome 44: 239-443. [ Links ]
18. Sanso, A. 2002. Chromosome studies in Andean taxa of Alstroemeria (Alstroemeriaceae). Bot. J. Linn. Soc. 138: 451-459. [ Links ]
19. Shan, F., Yan, G. & Plummer, J. 2003. Karyotype evolution in the genus Boronia (Rutaceae). Bot. J. Linn. Soc. 142: 309-320. [ Links ]
20. Zhou, S., M. De Jeu, R. Visser & A. Kuipers. 2003. Characterisation of distant Alstroemeria hybrids: application of highly repetitive DNA sequences from A. ligtu subsp. ligtu. Ann. Appl. Biol. 142: 277-283. [ Links ]














