Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Darwiniana, nueva serie
versión impresa ISSN 0011-6793
Darwiniana vol.46 no.1 San Isidro ene./jul. 2008
SISTEMÁTICA Y TAXONOMIA DE PLANTAS AVASCULARES
Nuevas citas de Saprolegniales (Peronosporomycota, Straminipila) para ambientes acuáticos de la provincia de Buenos Aires (Argentina)
María L. Arellano, Agostina V. Marano & Mónica M. Steciow
Instituto de Botánica Carlos Spegazzini, calle 53 N° 477, B1900AVJ La Plata, Buenos Aires, Argentina; mluzarellano@yahoo.com.ar (autor corresponsal).
Original recibido el 28 de agosto de 2007;
aceptado el 21 de abril de 2008
Resumen. Cuatro especies de Saprolegniales fueron encontradas en ambientes acuáticos de los partidos de La Plata y Ensenada (charcas semipermanentes, arroyo Las Cañas y zanjón Los Helechos), provincia de Buenos Aires, Argentina. Scoliolegnia asterophora, Aphanomyces laevis, A. stellatus y A. parasiticus, son citadas por primera vez para la Argentina. Tres de ellas fueron encontradas como saprótrofas en muestras de materia orgánica flotante (restos vegetales) y agua, y la cuarta, como parásita en hifas de una especie no identificada del género Achlya.
Palabras clave. Aphanomyces; Ambientes acuáticos; Argentina; Saprolegniales; Scoliolegnia.
Abstract. New records of Saprolegniales (Peronosporomycota, Straminipila) for aquatic environments from Buenos Aires Province (Argentina).
Four species of Saprolegniales were isolated from three aquatic environments of Buenos Aires Province, Argentina. Scoliolegnia asterophora, Aphanomyces laevis, A. stellatus and A. parasiticus are reported for the first time for Argentina. Three of them were found as saprotrophs on floating organic matter (vegetative remains) and water samples, and the fourth one, as a parasite on the hyphae of an unidentified species of the genus Achlya.
Keywords. Aphanomyces; Aquatic environments; Argentina; Saprolegniales; Scoliolegnia.
INTRODUCCIÓN
Los Peronosporomycetes (Oomycetes) son un grupo de organismos cosmopolitas que se encuentran en cuerpos de agua dulce, salobre y en ambientes terrestres. La mayoría de las formas acuáticas crecen en arroyos bien aireados, ríos, lagos y lagunas (Alexopoulos et al., 1996; Müeller et al., 2004). Pueden desarrollarse como saprótrofos, o también como parásitos de plantas y animales (Fuller & Jaworski, 1987).
Dentro de los Peronosporomycetes, las Saprolegniales, comúnmente conocidas como "mohos acuáticos", son las más ubicuas entre los organismos acuáticos (Alexopoulos et al., 1996). Como saprótrofos, desempeñan un importante papel ecológico en la descomposición y el reciclado de los nutrientes en los sistemas acuáticos.
El género Scoliolegnia fue establecido en principio para tres especies por Dick (1969), a pesar de no haber sido reconocido posteriormente por Seymour (1970) y Johnson et al. (2002), quienes mantienen un concepto genérico más amplio para Saprolegnia, incluyendo a las especies de Scoliolegnia. Mil'ko (1979) transfirió formalmente a las especies de Scoliolegnia al género Saprolegnia. Sin embargo, Dick (2001) y Spencer et al. (2002) conservan a Scoliolegnia teniendo en cuenta caracteres morfológicos y de biología molecular. Este género comprende seis especies (Index Fungorum, 2004), entre las cuales figura Sc. hypogyna (Pringsh.) de Bary, nueva especie hallada en nuestro país, en la región fitogeográfica Paranense, Parque Nacional Iguazú, Pcia. de Misiones (Steciow et al., 2005). La mayoría de los aislamientos de las especies del género Scoliolegnia han sido obtenidos a partir de suelos húmedos, con alto contenido de materia orgánica y bajos valores de pH. Sólo la especie tipo, Sc. asterophora (de Bary) M. W. Dick, tiene una amplia distribución y también ha sido encontrada en sustratos de origen animal (peces muertos).
El género Aphanomyces comprende 21 especies (Johnson et al., 2002), de las cuales existen formas saprótrofas y parásitas. Las formas saprótrofas son raramente aisladas a partir de semillas de cáñamo, ya que generalmente se desarrollan sobre sustratos queratínicos (pelos, mudas de serpientes) o quitínicos (exoesqueleto de camarón) empleados como cebo (Johnson et al., 2002).
El objetivo de este trabajo es describir por primera vez para la Argentina a Scoliolegnia asterophora, Aphanomyces laevis de Bary, A. parasiticus Coker y A. stellatus de Bary, y dar a conocer los datos de frecuencia y abundancia de estas especies en tres ambientes acuáticos de la provincia de Buenos Aires (Partidos de La Plata y Ensenada).
MATERIALES Y MÉTODOS
Las muestras fueron coleccionadas de tres ambientes acuáticos de la provincia de Buenos Aires: dos charcas semipermanentes (charcas A y B), ubicadas en el partido de La Plata, y el arroyo Las Cañas, situado en el partido de Ensenada.
Las charcas semipermanentes, se ubican al este de la provincia, en el valle de inundación del Arroyo El Pescado (35° 1' S, 57° 51' O). Se encuentran dentro de un pastizal modificado y se caracterizan por presentar un período de sequía en la estación de verano. La charca A presenta una vegetación formada por Schoenoplectus californicus (C. A. Mey.) Soják ("Junco") en los márgenes, Ceratophyllum aquaticum H.C.Wats. ("Cola de zorro") y Potamogeton sp. en la zona más profunda. También se encuentran en bajas densidades Spirodela intermedia W. Koch, Lemna giba L. y Wolffiella oblonga (Phil.) Hegelm. ("Lentejas de agua") y Azolla filiculoides Lam., entre otras. La charca B se encuentra principalmente poblada por S. californicus y en menor proporción por Typha latifolia L. (totora). En zonas más profundas predominan C. aquaticum mezclada con Lemna sp. y Sagitaria sp.
En agosto de 2006 (14-VIII) se coleccionaron muestras de materia orgánica flotante y de agua superficial costera en ambas charcas y se registró el pH.
El arroyo Las Cañas (34° 47' 58.5" S, 57° 57' 19.3" O; 34° 47' 29.3" S, 57° 59' 49.2" O), es un pequeño curso de agua de 600 m de longitud, perteneciente a la cuenca del Río de la Plata, ubicado en la Reserva Natural Selva Marginal Punta Lara. Las especies arbóreas más frecuentes en el área son: Allophyllus edulis (St. Hil., Juss. & Cambess.) Hieron. ex Niederl., Citharexylon montevidense (Spreng.) Moldenke, Lonchocarpus nitidus (Vogel) Benth., Ocotea acutifolia (Nees) Mez y Pouteria salicifolia (Spreng.) Radlk. (Cabrera & Zardini, 1978). Los muestreos en su afluente (zanjón Los Helechos) fueron realizados en agosto (27-VIII) de 2005, mientras que en el arroyo, en octubre (18-X) de 2006 y en febrero (28-II) de 2007. En todas las fechas se registró el pH del agua, se coleccionaron muestras de materia orgánica flotante y agua, y se colocaron bolsas de malla plástica con sustratos queratínicos (mudas de serpiente) de 5 mm de diámetro, que permanecieron en el ambiente durante 10 días.
Las muestras provenientes de los tres ambientes fueron transportadas al laboratorio, en donde se colocaron 50 ml de agua (muestras de agua), 10 gramos de materia orgánica con 20 ml de agua destilada (muestras de materia orgánica) y 5 unidades de los sustratos anteriormente mencionados con 20 ml de agua destilada (sustratos "in situ") en cápsulas de Petri plásticas estériles. A las muestras de agua y materia orgánica se les adicionaron 5 unidades de sustrato por cápsula de Petri (unidad muestral). Los sustratos utilizados en este caso fueron queratínicos (mudas de serpiente) y semillas de Sesamum indicum L. ("Sésamo"), para ambos ambientes y además sustratos celulósicos (hojas de Zea mays L.) para las muestras provenientes de las charcas. Cada submuestra fue realizada por triplicado. Transcurridos entre 4 a 7 días de incubación a una temperatura de 18-20 °C, se registró la presencia-ausencia de las especies por unidad muestreal (cápsula de Petri). El procedimiento consistió en observar cada unidad de sustrato bajo microscopio óptico recorriendo toda su superficie.
La identificación taxonómica de las especies se realizó en base a los trabajos de Coker (1923), Scott (1961), Seymour (1970) y Johnson et al. (2002).
Para las especies encontradas se registró su frecuencia y abundancia, de acuerdo con Marano & Steciow (2006):
-Frecuencia de colonización porcentual (FC%): (número de unidades muestrales positivas para una especie / número de unidades muestrales analizadas) × 100.
-Frecuencia relativa porcentual (FR%): (número de unidades muestrales positivas para una especie/ número de unidades muestrales positivas para organismos zoospóricos) × 100.
-Abundancia (A%): (número de aislamientos de una especie/ número de unidades de sustrato empleadas) × 100.
- Abundancia relativa porcentual (AR%): (número de aislamientos de una especie / número de aislamientos de organismos zoospóricos) × 100.
Una unidad muestral se consideró positiva cuando se registró la presencia de al menos una colonia de la especie evaluada. En la cuantificación del número de unidades muestrales colonizadas por otros organismos zoospóricos se consideraron positivas aquéllas en donde se observó micelio y/o estructuras asexuales y sexuales.
RESULTADOS
Las charcas A y B presentaron el mismo pH: 5,5, mientras que en el arroyo Las Cañas se registraron valores entre 7,8-8,31 y por último en el zanjón Los Helechos el pH fue 6,45.
Descripción de las especies
Scoliolegnia asterophora (de Bary) M. W. Dick, J. Linn. Soc., Bot. 62: 257. 1969. Saprolegnia asterophora de Bary, Jahrb. Wiss. Bot. 2: 189. 1860. Cladolegnia asterophora (de Bary) Johannes, Feddes Repert. Spec. Nov. Regni Veg. 58: 215. 1955. Fig. 1, A-C.

Fig. 1. A-C, Scoliolegnia asterophora. A, C, aspecto general del micelio con oogonios inmaduros. B, detalle de oogonios papilados y una rama anteridial monoclina. D-F, Aphanomyces laevis. D-E, micelio con oogonios y ramas anteridiales. F, detalle de un oogonio de pared lisa, con una única oospora subcéntrica. Escalas: A-E = 50 µm; F = 10 µm. Las fotos fueron obtenidas a partir de cultivos en agua (Sc. asterophora LPS Nº 47768 y A. laevis LPS Nº 47891).
Sinonimia fide Index Fungorum (2004).
Micelio extenso con hifas delgadas, escasamente ramificadas. Estructuras asexuales (zoosporangios y yemas) no observadas. Oogonios moderadamente abundantes; laterales, ocasionalmente terminales, raramente intercalares; esféricos u ovales; (25-) 30-47 (-51) µm diám., incluyendo las ornamentaciones de la pared. Pared del oogonio no punteada internamente; densamente ornamentada, con ornamentaciones cortas, papiladas (2-10 µm long.), de extremos romos o redondeados, ocasionalmente apiculadas (hasta 20 µm long.). Pie del oogonio usualmente largo, delgado, recto, en ocasiones ramificado. Oosporas 1-2 en número, subcéntricas, esféricas u ovoides, que llenan completamente la cavidad del oogonio; (15) 20-31 µm diám. Germinación de las oosporas no observada. Ramas anteridiales usualmente numerosas; andróginas y diclinas, cortas, a veces ramificadas y retorcidas. Célula anteridial simple, clavada, corta, en ocasiones tuberosa, que contacta el oogonio de forma apical o lateral. Tubo de fertilización no observado.
Distribución geográfica y hábitat. Alemania, Argentina (material estudiado), Checoslovaquia, Dinamarca, Estados Unidos de América, Finlandia, Japón, Latvia, Países Bajos, Gales (Reino Unido); aislada a partir de agua y suelo; relativamente común en ambientes ácidos, pantanos de ciprés, pantanos de Sphagnum sp., suelos húmedos ácidos; también registrada sobre peces muertos (material estudiado), sobre Leuciscus sp. (Seymour, 1970).
Observaciones. La especie fue aislada a partir de semillas de sésamo empleadas como sustrato. Si bien no se observaron estructuras asexuales (zoosporangios y yemas), esta especie fue fácilmente reconocida en cultivos en agua, por su micelio delicado, delgado y de escaso crecimiento conjuntamente con el desarrollo de oogonios densamente papilados que contienen 1-2 oosporas subcéntricas (Johnson et al., 2002). La ausencia de zoosporangios también fue documentada por otros autores (Coker, 1923; Dick, 1969). Se conserva material herborizado.
La cepa encontrada presenta oogonios de menor diámetro que las cepas provenientes de otras regiones, los cuales alcanzan (36-) 44-52 (-78) µm (Seymour, 1970), 30-57 µm (Coker, 1923) y (25-) 42-56 (-78) µm diám. (Johnson et al., 2002). No se encontraron más de dos oosporas por oogonio presentando éstas también valores de diámetro menores que los encontrados por Seymour (1970), quien describe diámetros de (20-) 29-32 (-36) µm y por Coker (1923), quien cita valores entre 18-35 µm. Las ramas anteridiales registradas fueron mayormente andróginas y diclinas, no coincidiendo con lo expuesto en los trabajos de Seymour (1970) y Coker (1923) en los cuales las ramas anteridiales monoclinas y diclinas son raramente observadas.
Esta especie fue encontrada en dos ambientes ácidos, lo que coincide con los hallazgos de Roberts (1963) y Seymour (1970). Czegzuga et al. (2003) ha registrado a esta especie únicamente en invierno, lo que coincide con nuestros hallazgos.
Material examinado
ARGENTINA. Buenos Aires. Partido de Ensenada: zanjón Los Helechos (afluente del arroyo Las Cañas, Reserva Natural Selva Marginal Punta Lara), 27-VIII-05, a partir de muestras de agua incubadas con semillas de sésamo, Marano s. n. (LPS Nº 48242); Partido de La Plata: charcas semipermanentes (A y B), 14-VIII-06, a partir de muestras de materia orgánica flotante incubadas con semillas de sésamo, Arellano s. n. (LPS N° 47768).
Aphanomyces laevis de Bary, Jahrb. Wiss. Bot. 2: 179. 1860. Fig. 1, D-F.
Aphanomyces helicoides Minden, Kryptogamenfl. Mark. Brandenburg. 5: 559. 1912. 1915.
Aphanomyces balbohensis Harvey, J. Elisha Mitchell Sci. Soc. 58: 35. 1952.
Aphanomyces laevis var. helicoides, Cejp, Oomycetes I, Flora CSR, Ser. B, Part 2, p. 97. 1952.
Sinonimia fide Johnson et al. (2002).
Micelio de moderado desarrollo, 3,2-3,5 cm diám., hifas delicadas, 5-10 µm diám., generalmente no ramificadas. Zoosporangios filamentosos, de aspecto semejante a las hifas vegetativas, rectos, (45-) 81-241 (-613) × 5-11 µm diám., terminales, ocasionalmente laterales, no ramificados. Zoosporas primarias 7-10 µm diám., enquistadas en el extremo del zoosporangio, de descarga poroide. Oogonios de coloración castaña, terminales, raramente laterales, esféricos o piriformes, (20-) 25-36 (38) µm diám.; pared externa e interna lisa, no punteada. Oospora única, (15-) 20-26 µm diám., que no llena completamente la cavidad de oogonio, subcéntrica. Germinación de las oosporas no observada. Ramas anteridiales una a varias que contactan al oogonio, envolviéndolo en ocasiones; mayormente diclinas, infrecuentemente monoclinas, ramificadas o no. Célula anteridial persistente, de contacto lateral.
Distribución geográfica y hábitat. África, Alemania, Argentina (material estudiado), Brasil, Bulgaria, Canadá, Checoslovaquia, China, Cuba, Dinamarca, Estados Unidos de América, Filipinas, Haití, India, Islandia, Japón, México, Noruega, Nueva Zelanda, Panamá, Polonia, Rumania, República Dominicana, Rusia, Sri Lanka, Suiza, Trinidad y Tobago, Venezuela, Yugoslavia. Obtenida a partir de muestras de agua, sobre mudas de serpiente (material estudiado); saprótrofa en exuvias de insectos, larvas de termitas y hojas sumergidas en descomposición de Salix sp.; obtenida a partir de muestras de agua y suelo; parásita de Cambarus clarkii Girard (Crustaceae), diatomeas y desmidiáceas (Scott, 1961).
Observaciones. Scott (1961) menciona a esta especie como la más común del género. La cepa encontrada presenta oogonios cuyos diámetros coinciden con los descriptos por Couch (1926) y Johnson et al. (2002), pero son levemente mayores a los descriptos por Scott (1961) cuyo diámetro máximo alcanza los 35 µm. El diámetro de las oosporas descriptas por estos autores son levemente mayores (hasta 31 µm y 29 µm diám., respectivamente). A diferencia de las cepas examinadas por Johnson et al. (2002), no se han observado oogonios sésiles ni de pared papilada y tampoco la presencia de ramas anteridiales andróginas. Al igual que estos autores, se ha observado una amplia variación en la longitud del zoosporangio, pero a diferencia de ellos, nuestra cepa presenta zoosporangios con un rango de longitud cuyo límite inferior y superior son menores. Las características de nuestra cepa coinciden con las descriptas por Coker (1923), excepto por el tipo de ramas anteridiales (andróginas y monoclinas para este autor, diclinas y monoclinas en nuestro aislamiento). En lo referente a las condiciones de pH, nuestro registro coincide con lo mencionado por Roberts (1963) quien refiere a esta especie como habitante de aguas de pH alcalino (entre 7,6 y 8,4).
Material examinado
ARGENTINA. Buenos Aires. Partido de Ensenada: arroyo Las Cañas (Reserva Natural Selva Marginal Punta Lara), 18-X-06, a partir de muestras de agua incubadas con sustratos queratínicos (muda de serpiente) y a partir de sustratos queratínicos colocados en el arroyo durante 10 días, Marano s .n. (LPS N° 47891).
Aphanomyces parasiticus Coker, The Saprolegniaceae 165. 1923. Fig. 2, A-D.

Fig. 2. A-D, Aphanomyces stellatus. A, detalle del micelio y de oogonios ornamentados. B-D, oogonios provistos de tubérculos rectos o curvos, con 1-2 oosporas en su interior (fotos obtenidas a partir de cultivo en medio agarizado: LPS Nº 47769). E-H, A. parasiticus. E, micelio desarrollándose en el interior de las hifas de Achlya sp. F-G, zoosporangios emergiendo de las hifas del hospedador. H, zoosporangio descargado con zoosporas enquistadas en el extremo (fotos obtenidas a partir de cultivo en agua: LPS Nº 47892). Escalas: A-G = 50 µm; H = 10 µm.
Micelio con hifas escasamente ramificadas, irregulares, 5-11 µm diám., que se desarrollan externamente en ocasiones (extramatricales) y dentro de las hifas y yemas del hospedador (intramatricales). Yemas ausentes. Zoosporangios (40-) 51-118 (-164) × 5-11 µm, filamentosos, no ramificados, rectos, de aspecto semejante a las hifas vegetativas. Zoosporas primarias enquistadas en el extremo del zoosporangio, 5-11 µm diám., de descarga poroide. Estructuras sexuales (oogonios y ramas anteridiales) no observadas.
Distribución geográfica y hábitat. Argentina (material estudiado), Checoslovaquia, China, Escocia, Estados Unidos de América, Noruega, Reino Unido, Rusia; parásita en hifas de Achlya sp. (Coker, 1923; Sparrow, 1932; Shen & Siang, 1948 y material estudiado); parásita principalmente en Achlya sp., pero también ha sido encontrada en otros organismos zoospóricos (Johnson et al., 2002), como Dictyuchus monosporus (Sparrow, 1936).
Observaciones. Como ha sido mencionado por Scott (1961), es una especie ampliamente distribuida, pero raramente hallada. Infecta sólo el micelio, esporangios jóvenes y oogonios inmaduros del hospedante, pero nunca las estructuras sexuales bien desarrolladas. El micelio es primero intramatrical y luego se disemina por el agua, para infectar otras hifas (Scott, 1961). Achlya realiza una defensa ante el parásito desarrollando vacuolas en sus hifas, que detienen su crecimiento a lo largo de las mismas.
Material examinado
ARGENTINA. Buenos Aires. Partido de Ensenada: arroyo Las Cañas, 28-II-07, a partir de muestras de materia orgánica flotante (restos vegetales), incubados con semillas de sésamo, en el interior de hifas de Achlya sp., Marano & Steciow s. n. (LPS N° 47892).
Aphanomyces stellatus de Bary, Jahrb. Wiss. Bot. 2: 178. 1860. Fig. 2, E-H.
Aphanomyces coniger Petersen, Bot. Tidsskr. 2: 378. 1909.
Sinomia fide Johnson et al. (2002).
Micelio con hifas delgadas, rectas y ramificadas. Zoosporangios no diferenciados de las hifas vegetativas, 130 µm long. Zoosporas enquistadas en el exterior del orificio de descarga; descarga poroide. Oogonios terminales o sobre ramas laterales, esféricos o subesféricos, (27-) 29-39 µm diám. Pared del oogonio no punteada internamente; densamente provista de tubérculos cilíndricos de paredes rectas con los extremos romos y frecuentemente furcados, de hasta 6,5 µm long. Oospora 1-2 en número, (17-) 20-23 µm diám., de coloración castaña y contenido homogéneo, sin glóbulo lipídico conspicuo. Ramas anteridiales una a varias, monoclinas o andróginas en origen. Célula anteridial tuberosa, clavada o cilíndrica. Germinación de las oosporas y tubo de fertilización no observados.
Distribución geográfica y hábitat. Alaska, Alemania, Argentina (material estudiado), Brasil, Dinamarca, Estados Unidos de América, Japón. Saprótrofa sobre cadáveres de insectos en ambientes acuáticos (de Bary, 1860; Petersen, 1910; Minden, 1915); obtenida a partir de muestras de agua (Coker, 1923; Coker & Braxton, 1926), suelo (Harvey, 1925; Whiffen, 1945; Scott, 1961) y materia orgánica flotante (material estudiado), o parásita de Achlya sp. (Coker, 1923; Nagay, 1931).
Observaciones. La especie fue aislada a partir de sustratos queratínicos. La presencia de dos oosporas en el oogonio fue frecuente, contrariamente a la oospora única que mencionan Scott (1961) y Johnson et al. (2002). En el material estudiado las ramas anteridiales andróginas y monoclinas predominaron sobre las diclinas, lo que también difiere de lo encontrado por Scott (1961) y Johnson et al. (2002) los cuales registran con mayor frecuencia ramas diclinas y monoclinas. Los oogonios son de mayor diámetro que los de aquellas cepas provenientes de otras regiones del mundo en donde ha sido aislada, los cuales presentan un diámetro de 23,5-32,2 µm (Scott, 1961) y (16-) 22-28 (-35) µm (Johnson et al. 2002). Las oosporas también presentan variación en el tamaño, siendo mayores los tamaños encontrados por Scott (1961), quien describe diámetros entre 15-26 µm.
Ha sido cultivada en medio agarizado Emerson YpSs/10 y se conserva material herborizado. Roberts (1963), menciona a esta especie para ambientes ácidos (pH: 3,6- 6,8), lo que coincide con las condiciones registradas en el ambiente para nuestro aislamiento. En Brasil, ha sido recientemente aislada por Schoenlein-Crusius et al. (2006) a partir de muestras de agua.
Material examinado
ARGENTINA. Buenos Aires. Partido de La Plata: charca A, 14-VIII-06, a partir de muestras de materia orgánica flotante, Arellano s. n. (LPS N° 47769).
Análisis de la frecuencia y abundancia de las especies en los ambientes estudiados
Scoliolegnia asterophora
Esta especie fue obtenida a partir de muestras de materia orgánica de ambas charcas semipermanentes. Los sustratos colonizados fueron semillas de sésamo y celulósicos en la charca A y sólo semillas de sésamo en la charca B. Las frecuencias de colonización, colonización relativa y abundancia fueron las mismas para ambas charcas siendo 33,3%, 33,3% y 17,7% respectivamente. Por el contrario la abundancia relativa fue mayor en la charca B que en la charca A (Tabla 1). En la charca A se observaron diferencias entre ambos sustratos: los valores de FC%, FR%, A% y AR% para las semillas de sésamo fueron mayores (66,6%, 66,6%, 33,3% y 15,1%) que para el sustrato celulósico (33,3%, 33,3%, 20% y 8,8%).
Tabla 1. Frecuencia de colonización (FC%), frecuencia relativa (FR%) y abundancia absoluta y relativa (A%, AR%), de Scoliolegnia asterophora en las charcas A y B, y de Aphanomyces stellatus en la charca A.

Aphanomyces laevis
Fue registrada como saprótrofa sobre sustratos queratínicos, a partir de muestras de agua y de sustratos colocados "in situ" en el arroyo Las Cañas. La frecuencia de colonización sobre sustratos queratínicos fue del 8,3% y su abundancia en este tipo de sustratos del 2,7%. La frecuencia de colonización sobre sustratos queratínicos obtenida a partir de muestras de agua y de sustratos "in situ" fue la misma; sin embargo, en las muestras de agua la abundancia fue mayor, que aquella obtenida para los sustratos colocados "in situ". Así también los datos de frecuencia y abundancia relativa fueron mayores para las muestras de agua que para los sustratos "in situ" (Tabla 2).
Tabla 2. Frecuencia de colonización (FC%), frecuencia relativa (FR%) y abundancia absoluta y relativa (A%, AR%) para Aphanomyces laevis en muestras de agua (A) y de sustratos colocados "in situ" (IS) y para A. parasiticus, en el arroyo Las Cañas.
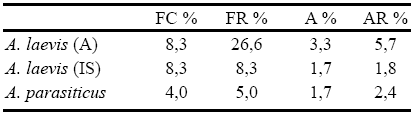
Aphanomyces parasiticus
Fue obtenida a partir de muestras de materia orgánica del arroyo Las Cañas incubadas con semillas de sésamo. La frecuencia de colonización (FC%) fue del 4%. De las 24 unidades muestrales analizadas, 20 de ellas fueron colonizadas por su hospedante (Achlya sp.) y sólo una de ellas se encontró parasitada por esta especie. En cuanto a su abundancia, sólo se registraron dos aislamientos y su abundancia relativa (AR%) fue del 2,4% (parasitó solo dos aislamientos de Achlya sp., de los 83 obtenidos para este género), lo que se detalla en la Tabla 2.
Aphanomyces stellatus
Fue aislada de muestras de materia orgánica de la charca semipermanente A, a partir de sustratos queratínicos. La frecuencia de colonización y frecuencia relativa presentaron el mismo valor. La abundancia fue de 2,2% mientras que la abundancia en relación a la abundancia de otros organismos zoospóricos (AR%) presentó un valor mucho más bajo (Tabla 1).
DISCUSIÓN Y CONCLUSIONES
Scoliolegnia asterophora, A. laevis y A. stellatus fueron registrados previamente para Sudamérica en Brasil (Schoenlein-Crusius et al., 2006; Pires-Zottarelli, 1999; Gomes & Pires-Zottarelli, 2006). En ese país, A. stellatus fue aislada a partir de muestras de agua superficial con contenido de materia orgánica (ramas, hojas), mientras que Sc. asterophora sólo se registró a partir de muestras de suelo. En Polonia, Czeczuga & Muszynska (2001) han aislado a todas las especies registradas en nuestro estudio a partir de pelos (sustratos queratínicos) de distintos mamíferos domésticos y salvajes. Las especies de Aphanomyces descriptas en nuestro estudio han sido registradas como parásitas a partir de muestras de agua incubadas con ovas fecundadas de Carassius carassius (Czeczu-ga & Kiziewicz, 1999).
Algunas de las especies fueron aisladas de muestras de materia orgánica, creciendo como saprótrofas o como parásitas (en este caso, A. parasiticus sobre hifas de Achlya sp.). Entre las especies saprótrofas encontradas, dos de ellas fueron registradas para un ambiente ácido (Sc. asterophora y A. stellatus) y la tercera, bajo condiciones alcalinas (A. laevis). Mientras que ninguna de las especies encontradas en las charcas fue registrada en muestras de agua, en el arroyo Las Cañas A. laevis fue hallada tanto en muestras de agua como en sustratos queratínicos colocados durante 10 días en este ambiente.
En las charcas semipermanentes, de los tres tipos de sustratos utilizados como cebo (semillas de sésamo, muda de serpiente y hojas de Zea mays), Sc. asterophora colonizó tanto las semillas como el sustrato celulósico, mientras que A. stellatus solamente fue aislado a partir de sustratos queratínicos. Como ha sido mencionado por Scott (1961) y Park et al. (1978), y al igual que en nuestras observaciones, existe una preferencia del género Aphanomyces por sustratos queratínicos.
Las muestras de materia orgánica de ambas charcas presentaron aislamientos de Sc. asterophora; por el contrario sólo en las muestras de materia orgánica de la charca A se registró a A. stellatus. Si analizamos las muestras de materia orgánica de la charca A, en donde se encontraron las dos especies, la frecuencia de colonización y la abundancia fueron mayores para Sc. asterophora. A. stellatus sólo fue encontrada con una frecuencia de colonización y frecuencia relativa del 11%; la abundancia absoluta y la abundancia relativa fueron del 2% y 1%, respectivamente. Sc. asterophora fue registrada en muestras de materia orgánica de ambas charcas, pero mientras que en la charca A los sustratos colonizados fueron semillas y celulosa, en la charca B sólo creció en las semillas. Presentó valores de frecuencia de colonización y frecuencia relativa del 33% para ambas charcas y una abundancia del 17,7% y abundancia relativa del 9,5% para la charca A, y de 17,7% y 11,4% para la charca B.
En el arroyo Las Cañas, por otra parte, A. laevis sólo fue registrada sobre sustratos queratínicos, tanto a partir de muestras de agua como de sustratos "in situ". En el caso de A. parasiticus se desarrolló como parásito en el interior del micelio de una especie de Achlya, obtenida a partir de muestras de materia orgánica incubadas con semillas de sésamo.
La frecuencia de colonización de A. laevis en sustratos queratínicos incubados con muestras de agua o colocados "in situ" fue la misma, aunque los valores de frecuencia relativa y abundancia (tanto absoluta como relativa) obtenidos para las muestras de agua fueron mayores. En lo referente a A. parasiticus, fue una especie poco común en el arroyo Las Cañas, ya que al comparar los aislamientos obtenidos de su hospedante (Achlya sp.), su abundancia fue baja.
En el presente trabajo, se describen e ilustran por primera vez para la Argentina cuatro especies de Saprolegniales: Scoliolegnia asterophora, Aphanomyces laevis, A. stellatus y A. parasiticus. Para las especies mencionadas estos hallazgos constituyen los registros más australes para el continente americano.
AGRADECIMIENTOS
Los autores desean expresar su agradecimiento al CONICET (PIP 5931) y a la Universidad Nacional de La Plata (Proyecto N 11/ 440), por el apoyo económico brindado para el estudio de los organismos acuáticos zoospóricos. Agradecemos a Facundo Garnis, Maria Celeste Scattolini, Emiliano Guerrero y Laura Ramirez Barrios por la colaboración en los trabajos de campo.
BIBLIOGRAFÍA
1. Alexopoulos, C. J.; C. W. Mims & M. Blackwell. 1996. Introductory Mycology, 4th ed. New York: John Willey and Sons. [ Links ]
2. Bary, A. de. 1860. Einige nueue Saprolegnieen. Jahrb. Wiss. Bot. 2: 169-192. [ Links ]
3. Cabrera, A. L. & E. M. Zardini. 1978. Manual de la flora de los alrededores de Buenos Aires, 2nd ed. Buenos Aires: ACME S.A. [ Links ]
4. Coker, W. C. 1923. The Saprolegniaceae with notes on water molds. North Carolina: Univ. North Carolina Press. [ Links ]
5. Coker, W. C. & H. H. Braxton. 1926. New water molds from the soil. J. Elisha Mitchell Sci. Soc. 42: 139-147. [ Links ]
6. Couch, J. N. 1926. Notes on the genus Aphanomyces, with a description of a new semiparasitic species. J. Elisha Mitchell Sci. Soc. 41: 213-226. [ Links ]
7. Czeczuga, B. & B. Kiziewicz. 1999. Zoosporic fungi growing on the eggs of Carassius carassius (L.) in oligo and eutrophic water. Pol. J. Environm. Stud. 8: 63-66. [ Links ]
8. Czeczuga, B. & E. Muszynska. 2001. Aquatic fungi growing on the hair of wild and domestic animal species in diverse water bodies. Pol. J. Environm. Stud. 10: 313-323. [ Links ]
9. Czeczuga, B.; B. Kiziewicz & B. Mazalska. 2003. Further studies on aquatic fungi in the river Biebrza within Biebrza National Park. Pol. J. Environm. Stud. 12: 531-543. [ Links ]
10. Dick, M. W. 1969. The Scoliolegnia asterophora aggregate, formerly Saprolegnia asterophora de Bary (Oomycetes). Bot. J. Linn. Soc. 62: 255-266. [ Links ]
11. Dick, M. W. 2001. Straminipilous Fungi: systematics of the Peronosporomycetes, including accounts of the marine straminipilous protists, the plasmodiophorids, and similar organisms. Dordrecht: Kluwer Academic Publishers. [ Links ]
12. Fuller, M. S. & A. Jaworski. 1987. Zoosporic fungi in the teaching and research. Athens, Georgia: Southeastern Pub. Corp. [ Links ]
13. Gomes, A. L. & C. L. Pires Zottarelli. 2006. Diversidade de Oomycota da Reserva Biológica de Paranapiacaba, Santo André, SP: primeiras citações para o Brasil. Revista Brasil. Bot. 29: 569-577. [ Links ]
14. Harvey, J. V.1925. A study of the water molds and Pythiums occurring in the soils of Chapel Hill. J. Elisha Mitchell Sci. Soc. 41: 151-164. [ Links ]
15. Häyrén, E. 1928. Saprolegnia asterophora de Bary. Mem. Soc. pro Fauna et Flora Fennica 4: 50. [ Links ]
16. CABI Bioscience & CBS database. 2004. Index Fungorum. http://indexfungorum.org/Names/NamesRecord.asp. [Consulta: junio 2007]. [ Links ]
17. Johnson, Jr T. W.; R. L. Seymour & D. E. Padgett. 2002. Biology and systematics of the Saprolegniaceae. http://dl.uncw.edu/digilib/biology/fungi/taxonomy, and, systematics/padgett/book/SYSTEMATIC/CHAPTER_31/Family.pdf. [Consulta: junio 2007]. [ Links ]
18. Marano, A. V. & M. M. Steciow. 2006. Metodología para el análisis cualicuantitivo de comunidades de hongos zoospóricos. Actas del XX Congreso Argentino de la Ciencia del Suelo (CD-ROM), 19-22 de Septiembre de 2006, Salta (Argentina): 224. [ Links ]
19. Mil`ko, A. A. 1979. Taxonomy of the genus Saprolegnia. Mikologiya i Fitopatologiya 13: 288-294. [ Links ]
20. Minden, M. von. 1915. Chytridiineae, Ancylistineae, Monoble-pharidineae, Saprolegniineae. Kryptogamenfl. Mark Brandenburg 5: 193-352. [ Links ]
21. Müeller, G. M.; G. F. Bills & M. S. Foster. 2004. Biodiversity of Fungi: Inventory and Monitoring Methods. Burlington: Elsevier Academic Press. [ Links ]
22. Nagay, M. 1931. Studies on the Japanese Saprolegniaceae. J. Fac. Agr. Hokkaido Imp. Univ. 32: 1-43. [ Links ]
23. Park, H. C.; W. G. Sorenson & R. J. Davis. 1978. Aquatic Oomycetes in farm ponds in Bryan County, Oklahoma. Proc. Okla. Acad. Sci. 58: 48-53. [ Links ]
24. Petersen, H. E. 1910. An account of Danish freshwater Phycomycetes with biological and systematical remarks. Ann. Mycologici. 8: 494-560. [ Links ]
25. Pires-Zottarelli, C. L. A. 1999. Fungos zoospóricos dos vales dos rios Mojie Pilões, região de Cubatão, SP. Rio Claro, SP, 300 p. Tesis doctoral, Instituto de Biociências, Universidad Universidade Estadual Paulista (UNESP). [ Links ]
26. Roberts, R. E. 1963. A study of the distribution of certain members of the Saprolegniales. Trans. Brit. Mycol. Soc. 46: 213-224. [ Links ]
27. Schoenlein-Crusius, I. H.; A. I. Milanez, S. F. B. Trufem, C. L. A. Pires-Zottarelli, R. A. P. Grandi, M. L. Santos & K. C. Giustra. 2006. Microscopic fungi in the Atlantic Rainforest in Cubatão, São Paulo, Brazil. Braz. J. Microbiol 37: 267-275. [ Links ]
28. Scott, W. W. 1961. A monograph of the genus Aphanomyces. Virginia Agricultural Experiment Station. Tech. Bull. 151: 1-95. [ Links ]
29. Seymour, R. L. 1970. The genus Saprolegnia. Nova Hedwigia Beihefte 19: 1-124. [ Links ]
30. Shen, S. C. & W. N. Siang. 1948. Studies on the aquatic Phycomycetes of China. Sci. Rept. Natl. Tsing Hau Univ. Series B: Biol. and Psycol. Sci. 3: 176-206. [ Links ]
31. Sparrow, F. K. 1932. Observation on the aquatic fungi of Cold Spring Harbor. Mycologia 24: 268-303. [ Links ]
32. Sparrow, F. K. 1936. A contribution to our knowledge of the aquatic Phycomycetes of Great Britain. J. Linn. Soc. London 50: 417-478. [ Links ]
33. Sparrow, F. K. Jr. 1960. Aquatic Phycomycetes, 2nd ed. Michigan: Ann. Arbor, Univ. Michigan Press. [ Links ]
34. Spencer, M. A.; M. C. Vick & M. W. Dick. 2002. Revision of Aplanomycopsis, Pythiopsis and "subcentric" Achlya species (Saprolegniaceae) using 18S DNA and morphological data. Mycol. Res. 106: 549-560. [ Links ]
35. Steciow, M. M.; C. C. López Lastra & M. W. Dick. 2005. The status of the genus Scoliolegnia (Saprolegniales, Peronos-poromycetes), with a new species from Argentina. Mycotaxon 91: 381-391. [ Links ]
36. Whiffen, A. J. 1945. Nutritional studies of representatives of five genera of the Saprolegniaceae. J. Elisha Mitchell Sci. Soc. 61: 114-123. [ Links ]














