Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Darwiniana, nueva serie
versión impresa ISSN 0011-6793
Darwiniana vol.46 no.1 San Isidro ene./jul. 2008
SISTEMÁTICA Y TAXONOMÍA DE PLANTAS VASCULARES
Los géneros de Caesalpinioideae (Leguminosae) presentes en Sudamérica
Emilio A. Ulibarri
Instituto de Botánica Darwinion (CONICET, ANCEFN), Casilla de correo 22, Labardén 200, B1642HYD San Isidro, Buenos Aires, Argentina; eulibarri@darwin.edu.ar
Original recibido el 28 de agosto de 2007;
aceptado el 21 de abril de 2008
Resumen. La flora sudamericana posee 65 géneros de Caesalpinioideae (Leguminosae) con gran variación morfológica, distribuidos en las 4 tribus de esta subfamilia: Caesalpinieae con 31 géneros (3 de ellos introducidos); Cassieae con 9 géneros; Cercideae con 2 géneros (1 introducido) y Detarieae con 23 géneros nativos (2 introducidos). De las Caesalpinoideae sudamericanas, 30 géneros son endémicos (en su mayoría de Brasil), y los restantes habitan principalmente los trópicos y subtrópicos de ambos hemisferios. Todos ellos ocupan ambientes variados, desde selvas tropicales, bosques perennifolios y caducifolios, hasta sabanas, semidesiertos y alta montaña. En la clasificación de los géneros se ha seguido el sistema de Polhill & Raven (1981). Solamente Poepiggia ha pasado de las Caesalpinieae a Cassieae, y Ceratonia de las Cassieae a las Caesalpinieae. Por otro lado, se aceptan sensu lato tanto al género Caesalpinia como a la tribu Detarieae. Se trata Cercidium separado de Parkinsonia, hasta que no se completen nuevos estudios biosistemáticos y se realicen las combinaciones necesarias. Sclerolobium se considera sinónimo de Tachigali, y Phyllocarpus de Barnebydendron. El género Thylacanthus es considerado como de introducción dudosa. Se hacen también observaciones sobre la extensión del área de Zuccagnia punctata y Parkinsonia aculeata para la Argentina. Por primera vez se tratan conjuntamente para Sudamérica los géneros Barnebydendron, Brodriguesia, Ecuadendron, Orphanodendron y Pomaria. Además se brindan claves para el reconocimiento de las tribus y los géneros, descripciones genéricas, bibliografía actualizada, iconografía, observaciones, distribución, citas de tipos nomenclaturales, material representativo, usos e ilustraciones de algunas especies.
Palabras clave. Caesalpinioideae; Distribución; Leguminosae; Morfología; Sudamérica; Taxonomía; Usos.
Abstract. The genera of Caesalpinioideae (Leguminosae) from South America.
The South American flora includes 65 genera of Caesalpinioideae (Leguminosae) with wide morphological variation. The four tribes of that subafmily are represented: 31 genera belong to the Caesalpinieae (3 of them introduced); 9 to the Cassieae; 2 to Cercideae (1 introduced), and 23 to Detarieae (2 introduced). Among the South American Caesalpinoideae, 30 genera are endemic (mainly to Brazil), the remaining ones inhabit in tropical and subtropical areas from both hemispheres. All of them grow in diverse habitats: from rainforests, evergreen or deciduous forests, to savannas, semideserts and high mountains. Tribes and genera are arranged according to Polhill & Raven (1981), only Poepiggia has been transferred from Caesalpinieae to Cassieae, and Ceratonia from Cassieae to Caesalpinieae. Both Detarieae and Caesalpinia are treated here sensu lato. Cercidium and Parkinsonia are treated as separate taxa until new biosystematic studies and combinations are made. Sclerolobium is included under the synonymy of Tachigali, and Phyllocarpus under Barnebydendron. The genus Thylacanthus is considered of doubtful introduction. Geographic range area in Argentina is expanded for of Zuccagnia punctata and Parkinsonia aculeata. Barnebydendron, Brodriguesia, Ecuadendron, Orphanodendron and Pomaria are treated jointly for the first time for South America. In addition, keys to tribes and genera, generic descriptions, updated bibliography, iconography, remarks, distribution, nomenclatural types, representative specimens, utilization and illustrations for some species are included.
Keywords. Caesalpinioideae; Distribution; Leguminosae; Morphology; South America; Taxonomy; Utilization.
INTRODUCCIÓN
Las contribuciones monográficas referentes a la Caesalpinioideae de Sudamérica, han sido parciales y circunscritas a un determinado país. Así se ha considerado a la familia Leguminosae en un sentido amplio o parcial tratando a las Caesalpinioideae por separado en distintas obras como por ejemplo Tulasne (1844); (Bentham (1870); Ducke (1922, 1925a, 1925b, 1939); Lewis (1987), para Brasil; Karsten (1861); Quiñones (2005), para Colombia; Clos (1847) y Reiche (1898) para Chile; Micheli (1889) Paraguay; Amshoff (1939), para Suriname; Macbride (1943), para Perú; Burkart (1952, 1967, 1984, 1987); Ulibarri (1997a, 1997b, 1997c, 1999), Ulibarri & Troncoso (1984); Ulibarri et al. (1994) para la Argentina; Izaguirre & Beyhaut (2003) para el Uruguay; Steyermark et al. (1998) para Venezuela entre otros. Trabajos importantes, relacionados con géneros varios fueron realizados por Cowan (1953a, 1953b, 1957a, 1957b, 1975a) y en menor grado por Barneby & Grimes (1990); Barneby (1993, 1996). Otras contribuciones que han ampliado el conocimiento de diversos géneros, que aquí se tratan, se podrán apreciar en la bibliografía correspondiente relacionada con cada uno de ellos.
Con el panorama expuesto arriba, este trabajo trata de llenar el vacio existente en ese aspecto, considerando en su totalidad y principalmente en lengua española, lo referente a los distintos géneros de Caesalpinioideae de Sudamérica. Es así como en esta contribución, se brinda un cuadro sinóptico de las tribus con sus respectivos géneros, una clave general de las tribus y de los géneros para su reconocimiento, se presentan descripciones genéricas, se hacen observaciones varias, se actualiza la bibliografía, se cita el material tipo cuando corresponde, material representativo e ilustraciones; además se menciona el uso de algunas especies.
MATERIALES Y MÉTODOS
Se ha trabajado principalmente con herbarios argentinos, y cuando en algunos géneros el material de referencia de América del Sur fué escaso, se ha suplido esa carencia con especímenes de otros paises extrasudamericanos. Los herbarios están citados según la siglas registradas en el Index Herbariorum, Holmgren et al. (1990). Se ha optado por citar material de referencia y no material examinado ya que en algunos casos, principalmente el relacionado con los tipos nomenclaturales, no se vió el material en cuestión. Por esta razón, la notación (!) y no visto se reservó para el material tipo. El resto de material de referencia de cita con el estilo del material examinado. Para las citas de publicaciones botánicas periódicas se ha seguido al Botanico-Periodicum-Huntianum (BPH-2), Bridson (2004), y para la cita de obras antiguas a Stafleu & Cowan (1976-1988). Las siglas de autores se han abreviado según Brummitt & Powell (1992). Para la terminología botánica se ha seguido a Font Quer (1970).
Para el sistema de clasificación y las claves se ha seguido principalmente a Polhill & Raven (1981) y Polhill (1994) con leves modificaciones.
Solamente el género Poepiggia ha cambiado de tribu, de las Caesalpinieae pasó a las Cassieae y Ceratonia de Cassieae a Caesalpinieae, según los últimos estudios, Bruneae et al. (2001); Herendeen et al. (2003) y Lewis et al. (2005).
TRATAMIENTO TAXONÓMICO
Subfamilia Caesalpinioideae (DC.) K. R. Robertson & Y. T. Lee, J. Arnold Arbor 57(1): 1.1976.
Subord. Caesalpinea De Candolle, Prodr. 2: 473. 1825.
Ord. Caesalpineae Brown, Voy. Terra austral. 2: 19.
1814; reprinted in Misc. Bot. Works. 1: 23. 1866.
Árboles, a veces con raíces tabulares, arbustos, o hierbas, anuales o perennes, menos frecuentemente lianas, inermes o no, con o sin indumento de tricomas simples o glandulares variados. Nectarios extraflorales a menudo presentes en diversos géneros. Hojas alternas, pecioladas, bipinnadas, o pinnadas, menos frecuentes simples o reducidas; estípulas pequeñas, deltoides, subuladas, filiformes a folíáceas, pinnadas, a veces espinescentes, persistentes o caducas; folíolos escasos a numerosos, generalmente opuestos. Inflorescencias axilares o terminales en racimos simples o compuestos, o en espigas, a veces reducidas a fascículos umbeliformes o a flores solitarias, a veces con caulifloría; brácteas y bractéolas presentes o no. Flores generalmente zigomorfas, de prefloración imbricada, ascendente, medianamente pequeñas o grandes, a veces vistosas, generalmente bisexuales; hipanto generalmente presente, cupular o tubuloso, frecuentemente con tejido nectarífero en su interior; cáliz gamo o dialisépalo, de 3-6 sépalos; corola dialipétala, amarilla, rojiza o rosada, menos frecuente blanca, de (0-)1-5 pétalos; estambres (1-)2-10 (-26), a veces soldados hacia la base, exsertos o inclusos, dimórficos o heteromórficos; polen generalmente libre; estigma cóncavo o convexo. Ovario 1-pluriovulado, generalmente estipitado, con el estípite libre o adnato a la pared del hipanto; estilo largo o breve, a menudo incurvo; estigma, capitado, peltado o inconspicuo. Legumbres generalmente alargadas, rectas o encorvadas, comprimidas lateralmente o cilíndricas, a veces aladas (sámara), rara vez globosa, de consistencia variada, glabras o pilosas, con o sin tricomas glandulares, a veces espinescentes, dehiscentes o no. Semillas frecuentemente numerosas, medianas, comprimidas, globosas, ovoides o romboidales, con o sin endosperma mucilaginoso, con hilo apical o subapical, completo o incompleto, generalmente sin linea fisural o pleurograma, a veces ariladas; embrión usualmente recto; cotiledones carnosos o foliáceos.
Distribución y hábitat. Subfamilia integrada por aproximadamente 160 géneros y ca. 2. 500 especies que habitan principalmente en los trópicos y subtrópicos de ambos hemisferios, formando parte importante de la vegetación primaria, principalmente en América, Africa y Asia. Unas pocas especies crecen en climas templados (Cercis, Ceratonia, Gleditsia y Gymnocladus). Las Caesalpinioideae ocupan un ancho rango de ambientes, algunas estrictamente en selvas tropicales, bosques perennifolios, selvas en galería, bosques caducifolios, sabanas o bien semidesiertos, distribuyéndose entre altitudes que van desde el nivel del mar hasta los 3.600-4.000 m s.m. En Sudamérica se encuentran 65 géneros (entre nativos e introducidos) y aproximadamente 1.200 especies, siendo los más numerosos para el área: Chamaecrista (214 especies), Senna (ca. 146 especies), Macrolobium (70-80 especies); Bauhinia (75 especies), Tachigali (65 especies) y Caesalpinia (s. l.) (ca. 40 especies). De estos 65 géneros, 30 son endémicos de Sudamérica, principalmente en Brasil.
La literatura sobre esta subfamilia es abundante: algunos temas referentes a fósiles pueden consultarse en Herendeen et al. (1992); la morfología puede profundizarse en Kantz & Tucker (1994) y Herendeen (2000), la anatomía en Gasson et al. (2003), biología reproductiva en Lewis et al. (2000); frutos y semillas en Kirkbride et al. (1994); polen en Ferguson (1987) y Ferguson et al. (1994); filogenia en Bruneau et al. (2001) y Herendeen et al. (2003).
Observaciones. Como datos de interés de la diversidad morfológica, casi únicos, dentro de esta interesante subfamilia, caben destacarse las siguientes variaciones en los géneros sudamericanos que se mencionan a continuación, algunos también presentes en otros continentes. Respecto a la lámina foliar: simples (Cercis, Paloue, y Paloveopsis); simple a bilobada distalmente (Bauhinia); a veces simples en géneros con hojas pinnadas (Dialium, Crudia y Macrolobium); reducidas a filodios o nulas como en especies australianas de Chamaecrista y Senna. Respecto del pecíolo: a menudo con mirmecodomacios (Tachigali). En cuanto al cáliz: 2-4-lobulado (Browneopsis); con 3 sépalos (Apuleia y Gleditsia); con 6 sépalos (Gleditsia); en el resto de las especies comúnmente 4-5 lobulado. En cuanto a la corola: apétalas (Ceratonia, Copaifera, Crudia, Guibourtia y Prioria); con variaciones de (0-)1-5 pétalos (Dialium, 5 a veces vestigiales, casi nulos); 3 normales y 2 rudimentarios (Dicymbe y Heterostemon); con 1 sólo pétalo (Eperua y Macrolobium). Con respecto al androceo heteromorfo en Cassia, Senna y menos notable en Chamaecrista; 1 estambre fértil y 9 rudimentarios (Moldenhawera); 2 libres y desiguales (Dicorynia), además uno de ellos con 8-10 tecas, carácter único dentro de las Leguminosas; (12-)15-20 (Campsiandra); 16-17 (Orphanodendron); 9-26 (Browneopsis); el resto de los géneros generalmente con 10 estambres. En cuanto al gineceo: con 1 carpelo, pero en Martiodendron a veces 2, unidos basalmente, con estilos y estigmas libres [algunas variaciones en el número de carpelos fueron observadas en Bauhinia asiáticas, Hou et al. (1996: 414)]. Con respecto a la legumbre: con dehiscencia no sutural o de típica legumbre, sino a lo largo de la línea media de las valvas (rimosa)1 (Haematoxylun); o solamente por la sutura ventral (folicular) (Batesia).
Según Tucker (2000) la falta de órganos florales, principalmente sépalos y pétalos, acompañada por la innovación de otras estructuras florales como por ejemplo bractéolas petaloides, pétalos simples o variación funcional de los estambres, estaría regulada por la supresión o regulación de genes que podrían ser los responsables de cambios evolutivos y ello explicaría la falta de esos órganos en algunos géneros de Detarieae, Cassieae y Swartzieae.
SINOPSIS DE LAS TRIBUS Y GÉNEROS DE CAESALPINIOIDEAE PRESENTES EN SUDAMÉRICA
Los géneros con asterisco no son nativos.
1. Tribu Caesalpinieae
Arapatiella (2 especies)
Balsamocarpon (1 especie)
Batesia (1 especie)
Caesalpinia s. l. (40 especies)
Campsiandra (2-3 especies)
Cenostigma (6 especies)
Ceratonia *(2 especies, 1 cultivada en Sudamérica)
Cercidium (9 especies)
Delonix *[10 especies, 1 cultivada y naturalizada
(?) en Sudamérica]
Dimorphandra (25 especies)
Diptychandra (3 especies)
Gleditsia (14 especies, 1 nativa y 1 naturalizada)
Gymnocladus *(6 especies, 1 especie cultivada en
Sudamérica)
Haematoxylun (3 especies)
Hoffmannseggia (22 especies, 12 en Sudamérica)
Jacqueshuberia (7 especies)
Lophocarpinia (1 especie)
Melanoxylon (1 especie)
Moldenhawera (7 especie)
Mora (6 especies)
Orphanodendron (1 especie)
Parkinsonia (3 especies)
Peltophorum (7-9 especies)
Pomaria (16 especies)
Pterogyne (1 especie)
Recordoxylon (3 especies)
Schizolobium (1 especie)
Stenodrepanum (1 especie)
Tachigali (65 especies)
Vouacapoua (3 especies)
Zuccagnia (1 especie)
2. Tribu Cassieae
Androcalymma (1 especie)
Apuleia (1-2 especies)
Cassia (30 especies)
Chamaecrista (214 especies)
Dialium (28 especies)
Dicorynia (2 especies)
Martiodendron (4 especies)
Poeppigia (1 especie)
Senna (146 especies)
3. Tribu Cercideae
Bauhinia (150-160 especies, ca.75 en Sudamérica)
Cercis *(6 especies,1-2 cultivadas en Sudamérica)
4. Tribu Detarieae
Barnebydendron (1 especie)
Brachycylix (1 especie)
Brodriguesia (1 especie)
Brownea (12 especies)
Browneopsis (6 especies)
Copaifera L. (25-30 especies)
Crudia (55 especies)
Cynometra (80-90 especies)
Dicymbe (19 especies)
Ecuadendron (1 especie)
Elizabetha (11 especies)
Eperua (14 especies)
Goniorrhachis (1 especie)
Guibourtia (16 especies)
Heterostemon (7 especies)
Hymenaea (14 especies)
Macrolobium (70-80 especies)
Paloue (4 especies)
Paloveopsis (1 especie)
Peltogyne (25 especies)
Prioria (1 especie)
Tamarindus * [1 especie 1 cultivada y naturalizada
(?) en Sudamérica]
Thylacanthus* [1 especie introducida (?) en Sudamérica]
Clave de las tribus
Modificación de la clave de Cowan (1981)
1. Hojas aparentemente simples, enteras o frecuentemente bilobadas. Cáliz gamosépalo.
3. Cercideae
1. Hojas generalmente compuestas, con numerosos pares de folíolos. Cáliz dialisépalo o con sépalos brevemente unidos en la base ................................................................................ 2
2(1). Hipanto nulo o corto; sépalos 4-5 libres, o si 3, más o menos unidos. Anteras con dehiscencia poricida o longitudinal.
2. Cassieae
2. Hipanto generalmente acopado o tubular, rara vez corto; sépalos 2-6, libres o brevemente unidos en la base. Anteras con dehiscencia longitudinal .................................................................. 3
3(2). Estípulas laterales o nulas. Hojas bipinnadas, imparipinnadas o paripinnadas. Yemas florales no estrobiliformes, sin brácteas coriáceas o cicatrices en su base. Bractéolas generalmente caducas, pequeñas o nulas. Sépalos (3-) 5 (-6). A menudo presencia de aguijones o espinas
1. Caesalpinieae
3. Estípulas intrapeciolares. Hojas generalmente pinnadas. Yemas florales estrobiliformes, cubiertas de brácteas coriáceas, pequeñas o bien desarrolladas, caducas o no, con cicatrices conspicuas en su base. Bractéolas sepaloides o petaloides, grandes o pequeñas, o ausentes, cuando presentes, valvadas o imbricadas, envolviendo o no al primordio floral, persistentes o caducas. Sépalos (2-) 4 (-5). Plantas inermes.
4. Detarieae
1.Tribu Caesalpinieae Rchb., Fl. germ. excurs. 2(2). 544. 1832.
Ceratonieae Rchb., Ibidem 2(2): 544. 1832.
Dimorphandreae Benth., in Hook., J. Bot. 2: 74. 1840.
Sclerolobieae Benth., Gen. pl. 1: 436. 1865.
Moreae Britton & Rose, N. Amer. fl. 23(4): 201.1930.
(sinonimia fide Lewis, 2005: 127).
Tribu con ca. 50 géneros tropicales ampliamente distribuidos principalmente en Sudamérica donde se encuentran presentes 28 géneros nativos y 3 introducidos. Número cromosómico generalmente x = 7 ó 14 (Goldblatt, 1981: 431)
Referencias. Kantz & Tucker (1994); Lewis & Schire (1995) y Simpson & al. (2003).
Clave de géneros
Modificación de la clave de Polhill & Vidal (1981)
1. Flores generalmente unisexuales, apétalas o no. Árboles ............................................. 2
1. Flores generalmente bisexuales, con sépalos variados cubriendo o no a los pétalos en el pimpollo floral; pétalos diferenciados a menudo de colores llamativos. Hierbas, arbustos o árboles. Hojas pinnadas o bipinnadas en distintas
2(1). Flores apetálas, con disco carnoso conspicuo, dilatado. Sépalos deciduos. Hojas pinnadas
7. Ceratonia
2. Flores con pétalos, a menudo pequeños. Sépalos angostos, no cubriendo a los pétalos en el pimpollo floral, sin disco carnoso conspicuo y dilatado. Hojas frecuentemente pinnadas y bipinnadas en la misma planta ................ 3
3(2). Plantas generalmente con espinas. Folíolos angostamente ovados, de margen crenado. Flores en racimos espiciformes, cortamente pediceladas; hipanto 1-4 mm long. Estigma dilatado.
12. Gleditsia
3. Plantas inermes. Folíolos anchamente ovados, de margen entero. Flores en racimos laxos o pequeñas panículas, largamente pediceladas; hipanto 6-12 mm long. Estigma dilatado o capitado
13. Gymnocladus
4(1). Sépalos no cubriendo a los pétalos, generalmente unidos a manera de breve tubo calicinal. Flores inconspicuas, numerosas, subsésiles, actinomorfas, en racimos espiciformes péndulos; anteras subsagitadas ................. 5
4. Sépalos cubriendo a los pétalos, libres desde el borde del hipanto y si unidos, la flor marcadamente zigomorfa. Flores generalmente conspicuas, bien pediceladas, en cimas, racimos o panículas con frecuencia laxas; anteras generalmente no sagitadas ............................................................................. 6
5(4). Hojas pinnadas. Anteras generalmente vellosas. Ovario 4-5-ovulado.
20. Mora
5. Hojas bipinnadas. Anteras glabras. Ovario 8-11-ovulado.
10. Dimorphandra
6(4). Hojas pinnadas. Inflorescencias cimosas; pétalos 4-5, blancos; estambres 16-17
21. Orphanodendron
6. Hojas pinnadas o bipinnadas. Inflorescencias en racimos o panículas; pétalos 5, amarillos, rojizos o blancos (en Arapatiella); estambres 10-15(-20) ................................................................... 7
7(6). Flores zigomorfas o actinomorfas; Pétalos no excediendo demasiado a los sépalos; anteras con el conectivo muy angosto y dehiscencia lateral ..................................................................... 8
7. Flores actinomorfas o bien zigomorfas en diverso grado, con pétalos mayores que los sépalos, vistosas; anteras a veces con el conectivo ancho que se extiende por detrás de la teca, y dehiscencia introrsa
8(7). Folíolos alternos y raquis prolongado después de estos. Flores en delicadas inflorescencias amentiformes. Legumbre sámara.
25. Pterogyne
8. Folíolos opuestos o subopuestos y raquis no prolongado, folíolos pares o impares. Flores en inflorescencias no amentiformes. Legumbre no sámara ............................................................... 9
9(8). Flores actinomorfas; estambres 10, uniformes, biplegados en el primordio floral; ovario central libre. Pecíolo siempre delgado. Estípulas enteras. Fruto coriáceo, dehiscente. Semillas 1-3, aladas.
11. Diptychandra
9. Flores zigomorfas o actinomorfas; estambres 10 (15-16), a veces 3 menores y engrosados, nunca biplegados. Ovario central, libre u oblicuo, adnato a la pared del hipanto. Pecíolo a menudo engrosado. Estípulas a veces pinnatipartidas o foliáceas. Fruto membranáceo, dehiscente o no. Semillas (1-)2, no aladas.
29. Tachigali
10(7). Sépalo abaxial y adaxial iguales, exteriores en el pimpollo floral, pero a veces también valvares. Flores actinomorfas o zigomorfas; estambres desplegados o unidos hacia la base. Plantas tomentosas a glabras; con frecuencia glándulas en la inserción de los folíolos; sin tricomas glandulares dispersos, sin espinas o aguijones ........... 11
10. Sépalo abaxial diferenciado, ancho, cóncavo, frecuentemente ganchoso en el pimpollo floral; generalmente imbricados. Flores zigomorfas. Estambres reunidos alrededor del pistilo, al menos hacia la base. Plantas con indumento variado, sin glándulas en la inserción de los folíolos; presencia de aguijones, espinas, tricomas simples o glandulares
11(10). Sépalos imbricados. Estambres 10-25. Estípulas simples, no divididas. Legumbres subglobosas, elipsoides, fusiformes a lineares, a veces aladas, papiráceas a leñosas, indehiscentes o dehiscentes ...................... 12
11. Sépalos ± valvados. Estambres 10. Estípulas a veces divididas, principalmente hacia la base. Legumbres lineares, nunca aladas, coriáceas o leñosas, dehiscentes, a veces tardíamente- ..................................... 20
12(11). Hojas pinnadas ......................................................................... 13
12. Hojas bipinnadas- .......................................................................... 18
13(12). Estambres 10. Legumbres subglobosas, elipsoides a lineares, coriáceas a leñosas, con valvas revolutas o no, con o sin torsión .............................................................................. 14
13. Estambres 15-25. Legumbres lineares, coriáceas, con dehiscencia levemente espiralada.
5. Campsiandra
14(13). Estigma inconspicuo. Estípulas no foliáceas ni semicirculares. Valvas no revolutas ni con torsión ....... 15
14. Estigma anchamente peltado. Estípulas conspicuas, foliáceas, semicirculares. Valvas revolutas o con torsión.
1. Arapatiella
15(14). Pétalos menores de 5 mm lat., poco expandidos por arriba de la uña. Pecíolos anchamente canaliculados y con glándulas entre la inserción de los folíolos. Legumbres subglobosas a elipsoides, tardíamente dehiscentes por la sutura placentar, 1- a pauciseminadas. Semillas no aladas
15. Pétalos de 7-9 mm lat., anchamente expandidos arriba de la uña. Pecíolos finamente canaliculados, eglandulosos. Legumbre alargada, abriéndose por ambas suturas. Semillas varias, aladas en su contorno o sólo de un margen
16(15). Disco no rellenando el hipanto. Conectivo de las anteras continuo. Legumbre subglobosa a elipsoide de paredes gruesas, lisa, sin prominencias longitudinales, con dehiscencia tardía o elástica.
30. Vouacapoua
16. Disco rellenando el hipanto. Conectivo de la antera formando un escudo saliente no excediendo la base de la teca. Legumbre subcompresa, coriácea a leñosa, con prominencias longitudinales, sin dehiscencia elástica.
3. Batesia
17(15). Filamentos de los estambres pilosos. Legumbre septada internamente, a veces leñosa, no alada. Semillas aladas distalmente.
18. Melanoxylon
17. Filamentos de los estambres glabros. Legumbre no septada, coriácea, alada en la sutura placentar. Semillas subcarinadas en un margen.
26. Recordoxylon 18(12). Estambres unidos hacia la base. Pétalos rojizos. Estípulas foliáceas a pinnadas.
16. Jacqueshuberia
18. Estambres libres. Pétalos amarillentos. Estípulas simples ........................................... 19
19(18). Estigma peltado. Anteras todas similares. Ovario estipitado, central. Legumbre fusiforme, alada a lo largo de ambas suturas, indehiscente, 1-3-seminada, centralmente.
23. Peltophorum
19. Estigma inconspicuo. Estambre superior abrazado por el pétalo adaxial, con antera más corta. Ovario subestipitado. Legumbre oblonga, no alada, de base cuneada, dehiscente apicalmente, 1-seminada, distalmente.
27. Schizolobium
20(11). Estambre inferior excediendo a los restantes en long., igualando al estilo. Anteras sagitadas. Legumbre linear a subfalcada, leñosa, con dehiscencia elástica.
19. Moldenhawera
20. Estambres todos iguales. Anteras no sagitadas. Legumbre linear, coriácea a leñosa, sin dehiscencia elástica.
9. Delonix 21(10).
Plantas sin espinas laterales o axilares. Hojas y racimos no reunidos en cortos brotes, ................ 22
21. Plantas frecuentemente con espinas derivadas de modificaciones de ramas, estípulas o raquis. Hojas y racimos reunidos en cortos brotes. . ........................................................................ 29
22(21). Hojas pinnadas ......................................................................... 23
22. Hojas bipinnadas .......................................................................... 25
23(22). Indumento frecuentemente estipitado y estrellado. Legumbre leñosa y con una cresta proximal en la sutura placentar.
6. Cenostigma
23. Indumento variado pero no estrellado. Legumbre coriácea a papirácea, sin cresta proximal en la sutura placentar ........................................................................................... 24
24(23). Ovario 1-ovulado. Fruto ovoide, compreso con largas cerdas pilosas.
31. Zuccagnia
24. Ovario 1-pluriovulado. Fruto generalmente alargado, paucipluriseminado, sin largas cerdas pilosas.
4. Caesalpinia 25(22). Hojas paribipinnadas.
4. Caesalpinia
25. Hojas imparibipinnadas ..................................................................... 26
26(25). Cuatro sépalos con glándulas negras lacrimiformes apicales. Legumbre cilíndrico-torulosa. Semillas longitudinalmente dispuestas a lo largo de la legumbre.
28. Stenodrepanum
26. Sépalos sin glándulas negras apicales. Legumbres no cilíndrico-torulosas. Semillas dispuestas transversalmente en la legumbre .................................................................................. 27
27(26). Hierbas perennes, frecuentemente arrosetadas o pequeños subarbustos; sin tricomas glandulares inmersos en el envés. Sépalos persistentes en el fruto o tardíamente caducos.
15. Hoffmannseggia
27. Árboles o arbustos, o si hierbas perennes, éstas dotadas de tricomas glandulares inmersos en el envés. Sépalos caducos ..................................................................................... 28
28(27). Estípulas persistentes. Estambres y estilo curvados hacia abajo y abrazados por el sépalo abaxial. Estigma lateral. Legumbre generalmente coriácea, con tricomas glandulares negruzcos inmersos y otros ramificados o pilosos.
24. Pomaria
28. Estípulas generalmente caducas. Estambres y estilo no curvados hacia abajo ni abrazados por el sépalo abaxial. Estigma terminal o subterminal. Legumbre leñosa o coriácea, glabra o con tricomas simples o ramificados, glandulares, pedicelados.
4. Caesalpinia
29(21). Arbustos con legumbre lomentácea, generalmente 2-3-articulada; artejos con 4 alas crenadas.
17. Lophocarpinia
29. Generalmente árboles con legumbres no lomentáceas ............................................. 30
30(29). Legumbre papirácea, dehiscente por el medio de sus valvas (rimosa). Estípulas a veces espinescentes
14. Haematoxylum
30. Legumbres leñosas a coriáceas, a veces con gruesas valvas resinosas, dehiscentes a lo largo ambas suturas o no. Estípulas espinescentes o no- .................................................................... 31
31(30). Arbusto de hojas pinnadas. Estípulas no espinescentes. Sépalos con abundantes tricomas glandulares dorsalmente, el abaxial fimbriado. Legumbre corta, de paredes gruesas carnosas, resinosa.
2. Balsamocarpon
31. Arbolitos de hojas bipinnadas pero a veces muy reducidas con apariencia de ser pinnadas. Estípulas a veces espinescentes. Sépalos sin tricomas glandulares, el abaxial no fimbriado. Legumbres alargadas de valvas finas, no resino
32(31). Pinnas muy largas, con raquis aplanado, folíolos hasta más de 20 pares y distanciados entre sí. Pecíoloraquis abreviado, espinoso. Racimos alargados. Legumbre comprimido-torulosa.
22. Parkinsonia
32. Pinnas menores, con raquis filiforme, 4-12 pares de folíolos sin pecíoloraquis espinescente.. Corimbos breves. Legumbre comprimida no torulosa.
8. Cercidium
1. ARAPATIELLA Rizzini & Mattos, Revista Brasil. Biol. 32(3): 33. 1972. Especie tipo: Arapatiella trepocarpa Rizzini & Mattos.
Flores bisexuales, actinomorfas; hipanto campanulado-turbinado, estriguloso, pedicelado. Cáliz de 5 sépalos, ovadodeltoides, estrigulosos. Corola de 5 pétalos, blancos, libres, obovados, unguiculados. Estambres 10, todos fértiles; anteras dorsifijas. Ovario oblongo, seríceo-estrigoso, 6-8 ovulado; estigma disciforme; estípite central. Legumbre alargada, atenuada hacia la base, comprimida lateralmente, de márgenes engrosados, densamente estrigulosa, con dehiscencia elástica, valvas recurvas. Semillas negras elipsoides. Árboles altos, inermes, con ramas juveniles pubescentes, glabrescentes. Hojas pari o imparipinnadas, glabras; folíolos 2-4 pares, elípticos, agudos o acuminados, de base obtusa, subcoriáceos; estípulas conspicuas, foliáceas, semicirculares, con nerviación prominente, generalmente persistentes. Inflorescencias racimosas o panículas de racimos terminales; brácteas y bractéolas, ovadas externamente estrigulosas, caducas.
Iconografía. Lewis (1987: Fig. 1A-B); Toledo Rizzini & Mattos Filho (1972: Fig. 1); Lewis et al. (2005: 151, A. psilophylla).
Nombres vulgares. Para A. psilophylla (Harms) Cowan: Favecavermelha, Arapatí, Violeta, Brinco da cabocla, Quiro (Lewis, 1987: 32).
Etimología. Del nombre vernáculo Arapatí, con el que se designan en el Brasil a muestras de estas maderas.
Distribución geográfica y hábitat. Género con 2 especies, ambas endémicas de Bahia, Brasil, A. emarginata Cowan y A. psilophylla (Harms) Cowan (Cowan, 1973, 1981).
Usos. La madera se usa para construcciones civiles y navales, no es atacada por los gusanos de agua salada (Toledo Rizzini & Mattos Filho, 1972: 327).
Observaciones. Arapatiella psilophylla, sinónimos: Tachigalia psilophylla Harms, Dicymbe psilophylla (Harms) Dwyer y Arapatiella trepocarpa Rizz. & Mattos.
Material de referencia
A. psilophylla (Harms) Cowan
BRASIL. Bahia. Municipio de Itamarajú, fazenda Guanabara, 5 km NW de Itamarajú, black forest soil of mata higrófila sul baiana.ca. 60 m s.m. tree 10-15 m, DBH ca. 18 cm, 6-XII-1981 (fr), G. P. Lewis & A. M. de Carvalho 778 (RB 368152, imagen digital). Municipio de Santa Cruz de Cabrália, antiga Rodovia que liga Estação Ecológica Pau-brasil a Sta. Cruz, região de mata higrófila sul baiana, arvore 18 m x 20 cm (fr), S. Mori et al 12711 (RB 254479, imagen digital 11507).
A. trepocarpa Rizz. & Mattos
BRASIL. Sine locus. Valde dispersa in silvis primaevis Bahiae australis. Camacan-Mascote, 21-V-1970, T. S. dos Santos 834 (holotipo RB, no visto).
2. BALSAMOCARPON Clos, in Gay, Fl. Chile 2: 228. 1845; Atlas Bot. tab. 20. 1866. Especie tipo: Balsamocarpon brevifolium Clos.
Flores bisexuales, subzigomorfas; hipanto campanulado, 2-2,5 mm long. Cáliz de 5 sépalos libres, oblongos a subdeltoides de 5-6 mm long. x 2-4 mm lat., fimbriados, pilosos y con tricomas glandulares capitados hasta de 1-2 mm long. Corola amarilla, de 5 pétalos libres, obovados, subiguales, brevemente unguiculados, 10 mm long. x 3-4,5 mm lat., con tricomas glandulares dorsalmente. Estambres 10, libres, filamentos escábridos, anteras dorsifijas, oblongas, rimosas. Ovario recto, 6-ovulado, piloso, glanduloso, estipitado, estilo recto, subglabro, estigma subapical, cóncavo, ciliolado. Fruto grueso, turgente y amarillento en los primeros estadíos, castaño-negruzco a rojizo cuando maduro, rugoso, resinoso, 2,5-4 cm long. x 1,5 cm lat., 3-4 seminado. Arbusto de 1-2 m alt., de ramas tuberculadas, con aguijones infraestipulares divaricados, rectos, de 3-5 mm long. Hojas pinnadas, alternas en macroblastos, fasciculadas en braquiblastos, de 3-8 mm long.; estípulas deltoides, pilosas, glandulosas; folíolos 3-4 pares, elíptico-obovados a orbiculares, 1,5-4,5 mm long. x 1-2 mm lat., glabros, nervados. Inflorescencias en breves racimos, 2-3 cm long. todos muy glandulosos; brácteas deltoides, pilosas, glandulosas; flores 10-12 mm long.; pedicelos 8-12 mm long., pilosos y glandulosos.
Iconografía. Clos (1866: tab. 20); Lewis et al. (2005: 147, B. brevifolium).
Nombres vulgares. Algarrobillas, Algarrobo, Algarrobito.
Etimología. Del latín balsamo=sustancia aromática y del griego carpus=fruto, aludiendo a su fruto resinoso y aromático.
Distribución geográfica y hábitat. Género con 1 especie endémica de Chile septentrional, que crece en suelos secos y rocosos, entre los 400-500 m s.m.
Usos. Los frutos son utilizados para teñir, curtir y fabricación de tinta (Burkart, 1952: 191).
Observaciones. Ulibarri (1996) reunió este género con Caesalpinia, aunque con la evidencia actual, merece un rango genérico. Se encuentra relacionado con Hoffmannseggia y Zuccagnia (Simpson et al., 2005).
Material de referencia
CHILE. Región III. Prov. Atacama. Depto. Huasco, 30 km al norte de Vallenar, 17-IX-1957 (fl), A. Cabrera 12619 (SI). Depto. Copiapó, Castilla, XI-1924 (fl), E. Werdermann 469 (SI). Región IV. Prov. Coquimbo, Muy común en las colinas secas de la Provincia de Coquimbo, (holotipo probable P, no visto). Depto. Elqui.Vicuña, 13-X-1940 (fl), G. Looser 4326 (SI).
3. BATESIA Spruce ex Benth., in Benth. & Hooker f. , Gen. pl. 1: 563. 1865. Especie tipo: Batesia floribunda Spruce ex Benth. Fig. 1 (B. floribunda).

Fig. 1. Batesia floribunda Benth. A, hoja e inflorescencia. B, pimpollo floral. C, flor abierta vista de arriba; D, pétalos. E, androceo y parte del pistilo sin el cáliz y la corola. F, estambres; G, diagrama floral. H, pistilo. I, corte longitudinal del ovario. J, fruto; K, corte longitudinal del fruto; L, semilla. M, corte longitudinal de semilla; N, cotiledón y embrión. Tomado de Bentham 1870: tab. 16.
Flores bisexuales, pediceladas; hipanto breve. Cáliz campanulado, de 5 sépalos libres, oblongos, glabros, imbricados, lóbulos de 4-7 mm long. x 2,5 mm lat., tomentosos externamente. Corola de 5 pétalos libres, amarillos, ovados a angostamente obovados de 6-7 mm long. x 3 mm lat. sésiles, con algunos pelos externamente hacia la base, subiguales. Estambres 10, subiguales, de filamentos pilosos hacia la base. Ovario brevemente pubescente y central; 4-ovulado, estilo breve, estigma terminal, truncado, cóncavo, ciliado. Legumbre breve, subfalcada, compresotúrgida, brevemente estipitada, subleñosa, elipsoide a obovoide, a veces subfalcada, subcompresa, con 2 prominencias longitudinales, submarginales, la mayor hacia el borde placentar, a veces una tercera media, o sea valvas con 2-3 prominencias longitudinales, 2-4 cm long. x 1,5-2 cm lat. , 0,6-1,6 cm espesor, con dehiscencia folicular en 180° por la sutura ventral Semillas 2-3, gruesas, compresosuborbiculares, lustrosas, rojas. Árboles altos, hasta 30 m alt. inermes; ramas apicales e inflorescencias tomentosas Hojas amplias, largamente pecioladas, imparipinnadas; pecíolo canaliculdo adaxialmente; folíolos 9-11(-13) pares, ovado-elípticos, acuminados, coriáceos, reticulados en ambas caras, glabros y lustrosos en el haz, finamente tomentosos en el envés, 10-17 cm long. x 4,5- 6 cm lat, de base obtusa, con glándulas verrucosas entre los folíolos apicales. Inflorescencia en panículada terminales de racimos, amplias, excediendo las hojas superiores, brácteas y brácteolas tempranamente caducas; flores sobre pedicelos de 4-6 mm long
Iconografía. Bentham (1865: tab. 37); Bentham (1870: tab. 16); Lewis et al. (2005: 148).
Nombres vulgares. Huairuro colorado, Wairuro (Perú, fide Macbride).
Etimología. En honor a Henry W. Bates (1825-1892), zoólogo inglés y viajero por 11 años en el valle del Amazonas.
Distribución geográfica y hábitat. Género con 1 especie, B. floribunda Spruce ex Benth. de Brasil, Colombia, Guyana Francesa y Perú amazónico.
Material de referencia
BRASIL. Prope Panuré ad Rio Vaupés, oct. 1852-jan. 1853, Spruce 2780 (holotipo K!) Amazonas. Manaos, Río Tarumá, circa cataratorum minorum in silva non indundabili, 13-XII-1941 (fl, fr), Ducke s. n. (SI). Basin of Rio Solimoes, Santa Cruz-Curanen, Munic. São Paulo de Olivenza, 18-VII-1941 (fr), B. Krukoff 12076 (NY, LIL 70732). Basin of Rio Solimoes, Ig. Belem, 18-VII-1941 (fr), B. Krukoff 12074 (NY, LIL 63664).
4. CAESALPINIA L. sensu lato, Sp. pl. 1: 380. 1753; Gen. pl. ed. 5: 178. 1754 (Caesalpina). Especie tipo: Caesalpinia brasiliensis L
Flores generalmente bisexuales, zigomorfas, frecuentemente de prefloración imbricada, ascendente. Cáliz dialisépalo, 5-lobulado, el sépalo inferior más o menos cóncavo y cubriendo a los restantes, caducos. Pedicelos articulados o no. Corola comunmente amarilla; pétalos 5, el superior diferente de los otros cuatro. Estambres 10, base de los filamentos pilosa; anteras dorsifijas, con dehiscencia longitudinal. Ovario sésil o más o menos estipitado, 1-10-ovulado, estigma terminal. Legumbre dehiscente o no, de forma variada, glabra, pilosa o glandulosa, inerme o espinosa, coriácea a leñosa. Semillas esférico-elipsoides o reniformes, aplanadas, con o sin albumen. Arboles, arbustos o lianas (estas últimas ausentes en Sudamérica), inermes o espinosas. Hojas bi o imparipinnadas; estípulas generalmente presentes; folíolos por lo común numerosos. Indumento de pelos eglandulosos o glandulosos a veces sésiles, inmersos. Inflorescencias generalmente en racimos o en panículas, terminales o axilares; brácteas frecuentemente caducas. Número cromosómico x=12, 13 (Goldblatt, 1981: 431).
Referencias. Burkart (1936); Lewis (1994, 1998); Ulibarri (1996, 1997a); Rudall et al. (1994).
Iconografía. Burkart (1936: Figs. 1-6, lám. 1-10 y 1952: Fig. 31); Lewis (1994: Figs.1-72); Lewis (1998: Figs. 1-42, pl. 1-15); Lewis et al. (2005: 140, C. bahamensis, C. cassioides y C. pulcherri-ma); Ulibarri (1996: Figs. 1-5).
Nombres vulgares. Para Caesalpinia gilliesii: Mal de ojo, Lagaña de perro, Algarrobilla, Flor de San Esteban. Para C. paraguariensis: Guayacán, Ibirá-bera, Guayacán del Chaco.
Etimología. En honor al botánico y médico italiano Andrea Cesalpino (1519-1603).
Distribución geográfica y hábitat. Género pantropical, de unas 100-150 especies en América, Africa y Asia, unas 40 en Sudamérica.
Usos. Caesalpinia brasiliensis Sw. y C. echina-ta Lam.: se usa la madera para diversas construcciones y fuente de tintura roja (Uphof, 1968: 93-94). Caesalpinia paraguariensis (D. Parodi) Burkart: maderable y riqueza tánica de sus frutos (Burkart, 1952: 176); la importancia económica de esta especie es tratada por Aronson & Saravia Toledo (1992) y Tortorelli (1956). Caesalpinia brevifolia (Clos) Baill., C. coriaria (Jacq) Willd., C. dygina Rottl. y C. spinosa (Mol.) Kuntze: fuente de tanino (Stant, 1972). Caesalpinia gilliesii es una especie que merece ser cultivada como ornamental, como C. pulcherrima (L.) Sw.
Observaciones. Se acepta Caesalpinia en un sentido amplio hasta que no haya un estudio multidisciplinario de los taxones afines: Ponciana, Poincianella, Erythrostemon, Tara, Guilandina y Libidibia, evitando así combinaciones innecesarias.
Material de referencia
Caesalpinia brasiliensis L.
JAMAICA. Habitat in Jamaicae, Carolinae collibus (holotipo LINN no visto, microfilm IDC 528.31-530.1-No. 309 SI!).
Caesalpinia gilliesii (Wall. ex Hook.) D. Dietr.
ARGENTINA. Salta. Depto. Guachipas, Alemanía, 9-XI-1978 (fl, fr inmaduro), A. Cabrera et al. 29721(SI).
Caesalpinia paraguariensis (D. Parodi) Burkart
BOLIVIA. Chuquisaca. Prov. Azero, 27 km NW de Carandaytí, 13-IV-1977 (fr), A. Krapovickas & A. Schinini 31259 (CTES, SI).
5. CAMPSIANDRA Benth., in Hooker, J. Bot. 2: 93. 1840. Especie tipo: Campsiandra comosa Benth.
Flores bisexuales, subzigomorfas, sobre pedicelos articulados; hipanto campanulado. Cáliz de 5 sépalos libres, imbricados, breves, ovado-deltoides, subiguales. Corola de 5 pétalos, libres, obovado-oblongos, subiguales. Estambres (12-)15-20, de filamentos alargados, glabros; anteras ovadas, uniformes, versátiles, de dehiscencia longitudinal. Ovario central, con estípite breve, pluriovulado; estilo alargado, filiforme; estigma terminal, pequeño, truncado o dilatado. Legumbre alargada, comprimida, recta o falcada, coriácea-leñosa. Semillas 4, orbiculares o cuadrangulares, compresas, de testa fina, exalbuminadas, exariladas. Árboles inermes. Hojas imparipinnadas; estípulas pequeñas, caducas; folíolos (7-)9-13 pares, coriáceos, opuestos o subopuestos. Flores rosadas o amarillas, en panículas terminales; brácteas pequeñas caducas; bractéolas pequeñas caducas.
Referencias. Cowan (1953a); Stergios (1998).
Iconografía. Bentham (1870: tab. 15, C. laurifolia); Lewis et al. (2005: 159, Campsiandra sp.); Stergios (1998: Figs. 14-19, Campsiandra).
Nombres vulgares. Guamo (Venezuela), Acapúraná, Comandá-assú (Brasil).
Etimología. Probablemente del griego kampsion=caja, estuche y andro=masculino, aludiendo a su androceo.
Distribución geográfica y hábitat. Género con 2-3 especies sudamericanas, en Venezuela, Colombia, Perú y Brasil.
Usos. Las hojas y raíces de C. laurifolia Benth. son usadas en Brasil como medicinales (Hutchinson, 1964: 227; Uphof, 1968: 101).
Observaciones. Cowan (1953a) pasa a C. lauri-folia como variedad de C. comosa. En el protólogo de C. comosa, figuran como localidades típicas, además de Banks of the Essequibo con los ejemplares Schomburgk 13 (K) y Schomburgk 296, las siguientes: Apicaro of the Creoles y Uluri Wallaba of the Arrowaks. El ejemplar seleccionado por Cowan (1953a), Schomburgk 296 (US, no visto), corresponde al lectotipo.
Material de referencia
C. angustifolia Spruce ex Benth.
PERU. Loreto. Prov. Maynas, Distr. Iquitos, Pto. Almendras, bosque primario, suelo aenoso-arcilloso, no anegadizo, 122 m s.m., C. Grández et al. 4649 (SI).
Campsiandra comosa Benth.
GUYANA BRITÁNICA. Banks of the Essequibo, Schomburgk 296 [lectotipo US, no visto, designado por Cowan, Mem. New York Bot. Gard. 8(2): 112. 1953].
SURINAME. Corantyne near Apoera, 22-X-1916 (fr), Stahl & Gonggryjp 2948 (LIL 260487).
VENEZUELA. Sine locus, 1948 (fl), F. Tama-yo 3453 (SI).
C. laurifolia Benth.
BRASIL. Amazonas. Manaos, Igarapé da Cachoeira Grande, 3-IX-1940 (fl), A. Ducke s. n. (SI). Amapá, Rio Araguarí, 19-VII-1951 (fl), R. Froés & G. Mack 27535 (SI).
COLOMBIA. Vaupés, Depto. San Felipe, 21-XI-1948 (fr), R. Romero Castañeda 1199 (LIL 272072)
6. CENOSTIGMA Tul., Ann. Sci. Nat. sér. 2, 20: 140, tab. 3. 1843. Especie tipo: Cenostigma macrophyllum Tul.
Flores bisexuales, subzigomorfas, sobre pedicelos articulados; hipanto campanulado. Cáliz breve, disciforme, sépalos 5, libres, deltoides, cóncavos, imbricados, el ventral mayor, a veces de margen fimbriado. Corola de 5 pétalos, libres, subiguales, obovado-elípticos, de ápice agudo, brevemente unguiculados. Estambres 10, libres, en 2 series, declinados; filamentos pilosos hacia la base; anteras oblongas, uniformes, con dehiscencia longitudinal. Ovario subsésil, linear, pilosoglanduloso, 3-4-ovulado; estilo alargado, pilosoglanduloso; estigma terminal. cóncavo. Legumbre recta, de contorno oblanceolado, comprimida lateralmente, coriácea-leñosa, con una breve cresta proximal sobre la sutura ventral. Semillas 3-4, ovadas, compresas. Árboles inermes, comúnmente con indumento de tricomas estipitados o estrellados. Hojas impari o paripinnadas; estípulas pequeñas, folíolos 2-5 pares, coriáceos. Flores en racimos terminales; brácteas pequeñas, angostamente deltoides, caducas.
Referencias. Cowan (1959); Lewis (1987); Lewis et al. (2005); Tulasne (1844).
Iconografía. Lewis (1987: Fig. 2D-E., C. macrophyllum, pl. 3E-F, C. gardnerianum); Lewis et al. (2005: 142, C. gardnerianum); Tulasne (1843: tab. 3, C. macrophyllum).
Nombres vulgares. Para C. macrophylum: Fava-de-viado (Brasil).
Etimología. Del griego stigma = estigma y kenon = vacío, aludiendo a la concavidad del estigma.
Distribución geográfica y hábitat. Género con 6 especies, de Brasil y Paraguay.
Material de referencia
C. gardnerianum Tul.
BRASIL. Bahía. Planalto do Brasil, Valley of the Rio das Ondas, 3-III-1971 (fr), H. Irwin et al. 31379 (K); 10 km SW of Correntina, 26-IV-1980 (fl), R. Harley et al. 21801 (K). Piauí. Brasilia trop., 1841, (fl.), Gardner 2523 (isotipo K!). 9 km along trackway to Lagoa Achada, 8-I-1985 (fl, fr), G. Lewis et al. 1342 (K).
C. macrophyllum Tul.
BRASIL. Mato Grosso Brasiliae, Gaudi-chaud 213 (holotipo P, no visto). Bahia, Chapadão occidental da Bahia, 12 km N of Correntina, 28-IV-1980 (fr), R. Harley 21893 (K). Xavantina-Cachimbo Road, 30-XI-1967 (fl), D. Philcox et al. 3308 (K). Mato Grosso. 27-IX-1968 (fl), R. Har-ley & R. Suza 10290 (K).
7. CERATONIA L., Sp. pl. 1026. 1753. Especie tipo: Ceratonia siliqua L.
Ceratia Adanson, Fam. pl. 2: 319. 1763.
Flores polígamas o dioicas, raro bisexuales; apétalas; disco carnoso, dilatado, hipógino. Cáliz de tubo breve, turbinado, 5-lobulado, imbricado, deciduo. Flores estaminadas con 5 estambres libres, erectos, anteras dorsifijas, rimosas; ovario rudimentario. Flores pistiladas con 5 estaminodios breves; ovario subcilíndrico, subfalcado, grueso, pluriovulado, estipitado, pubescente, estilo breve; estigma peltado, 2-lobado. Legumbre recta o algo curva, comprimida lateralmente, engrosada, coriácea, indehiscente, engrosada en cada sutura, sulca-da entre las semillas, 1-pluriseminada. Semillas obovoides, compresas, transversalmente dispuestas. Árboles pequeños a medianos, inermes. Hojas paripinnadas; estípulas pequeñas; folíolos generalmente opuestos, 2-8 pares, elíptico-ovados, oblongos u obovados, coriáceos. Inflorescencias en racimos fasciculados, plurifloros, densos, 2-6 cm long.; flores pequeñas, amarillo-verdosas. Número cromosómico x=12 (Goldblatt, 1981: 431).
Referencias. Hillcoat et al. (1980); Ferguson (1980).
Iconografía. Burkart (1952: Fig. 23c-f, C. siliqua); Burkart (1972: Fig. 128D, C. siliqua); Irwin & Barneby (1981: Fig. 1, 1a-c, C. siliqua); Lewis et al. (2005: 133, C. siliqua); Ulibarri et al. (2002: Figs. pág. 53-55, C. siliqua); Taubert (1891-94: Fig. 87, C. siliqua).
Nombres vulgares. Algarrobo, Algarrobo del Líbano, Carubo, Carob tree.
Etimología. Del griego keration, nombre vernáculo de la planta proveniente de keras=cuerno, aludiendo a la forma del fruto.
Distribución geográfica y hábitat. Género con 2 especies: C. siliqua L. de las costas orientales y templadas del Mediterráneo, desde Turquía y Chipre hasta Libia y Túnez, difundida bajo cultivo en diversos paises del mundo; y C. oreothauma Hillcoat, Lewis & Verdcourt de la península Arábiga (Sultanato de Omán) y Africa (República de Somalía). Introducida en América y cultivada como ornamental en plazas y parques.
Usos. Ornamental, forrajera, industrial y alimenticia (Davies, 1970; Rachie et al., 1979: 109-116).
Material de referencia
C. siliqua L.
Habitat in Apuleia, Sicilia, Creta, Cypro, Syria, Palestina (holotipo LINN, no visto, microfilm IDC 1239.1- No. 756-1 y 2 SI!).
ARGENTINA. Buenos Aires. Capital Federal, cultivado Jardín Botánico Municipal, III-1930 (fl), E. Clos 4368 (BA). Corrientes. Depto. Empedrado, Estación Experimental INTA El Sombrerito, cultiv., arbolito 2-3 m., 2-VI-1987 (fl), A. Schi-nini 25369 (CTES, LIL 583685). Mendoza. Cultivado en parque Benegas, 6-IV-1937 (fl), A. Bur-kart 8430 (SI).
BOLIVIA. Cochabamba. Prov. Cercado, Cochabamba, cultiv. parque Portales, 26-IX-1981 (fr), S. Beck 7019 (SI).
8. CERCIDIUM Tul., Arch. Mus. Hist. Nat. 4: 133. 1844. Especie tipo: Cercidium spinosum Tul.
Flores bisexuales, subzigomorfas; hipanto, 1-2 mm long. x 2,5-4 mm diám. Cáliz de 5 lóbulos, largamente ovado-deltoides, valvados a subvalvados, verde-amarillentos. Corola de 5 pétalos generalmente amarillentos, el adaxial largamente unguiculado, limbo elevado. Androceo de 10 estambres, en 2 ciclos, filamentos pilosos hacia la base. Ovario linear, sésil. Legumbre linear-elipsoide o torulosa, coriácea o papirácea. Semillas 1-4, comprimidas o subglobosas. Árboles o arbustos, corteza lisa, verdosa; frecuentemente con espinas axilares. Hojas bipinnadas, con 1-3 pares de pinnas; estípulas deltoides, caducas; folíolos pequeños, opuestos. Flores en cortos racimos axilares, sobre pedicelos articulados. Número cromosómico de C. praecox: n=14, 2n=28 (Bernardello et al., 1990: 152).
Referencias. Burkart & Carter (1976); Ulibarri (1997a); Ulibarri et al. (1994); Bernardello et al. (1990).
Iconografía. Burkart (1952: Fig. 35a-g); Karsten [1862: tab. 113, sub Rhetinophloeum viridi (= Cercidium praecox subp. praecox)]; Ulibarri et al. (1994: Fig. 320).
Nombres vulgares. Para C. praecox (Ruiz & Pav.) Harms subsp. praecox, Brea (Argentina); Espinillo, Tronco liso, Palo brea (Bolivia); Verde oliva (Paraguay); Jabo (Venezuela); para C. praecox (Ruiz & Pav.) Harms subsp. glau-cum (Cav.) Burkart & Carter, Brea, Monte pelado, Chañar brea.
Etimología. Del griego kerkidion, por la semejanza del fruto con la lanzadera del tejedor.
Distribución geográfica y hábitat. Género de 9 especies que habitan principalmente ambientes secos desde el sudoeste de Estados Unidos de Norteamérica, N de México y NO de Sudamérica hasta la Argentina, donde crecen 2 especies, una de ellas con 2 subespecies.
Usos. Localmente con la madera se hacen estribos, goma para pegar (secreción resinosa), forrajero (follaje), comestible (semillas).
Observaciones. Hughes et al. (2003) consideran que Cercidium debe incluirse dentro de Parkinsonia. Por el momento, y hasta que no se completen los estudios de biosistemática entre ambos géneros y se realicen las combinaciones nomenclaturales correspondientes, se mantiene el género separado de Parkinsonia según los caracteres morfológicos enunciados en la clave.
Material de referencia
C. andicola Griseb.
ARGENTINA. Jujuy. Depto. Humahuaca: Humahuaca, 6-XII-1969 (fl), A. Cabrera & R. Kiesling 20266 (SI); 28-I-1945 (fr), A. Krapovickas 1526 (SI). Depto. Tilcara: Tilcara, 15-II-1953 (fr), J. Hunziker & O. Caso 6086 (SI). Depto. Tumbaya: camino a Lipán, 21-XI-1988 (fl), A. Cabrera et al. 34626 (SI).
BOLIVIA. Sine locus. Tupiza, 8-II-1941 (fl), Crespo s. n. (BA 37083, SI). Tupiza-Potosí, XII-1946 (fl), M. Cárdenas 3709 (SI).
C. praecox (Ruiz & Pav.) Harms subsp. praecox
PARAGUAY. Boquerón. Puerto Casado & Vicinity, Estancia Palo Santo, X-1975 (fr), T. Pedersen 4185 (SI).
C. praecox (Ruiz & Pav.) Harms subsp. glaucum (Cav.) Burkart & Carter
ARGENTINA. Tucumán. Depto. Tafí del Valle, Amaicha del Valle, Valle del Río Amaicha, 31-I-1933 (fr), A. Burkart 5365 (SI).
Cercidium spinosum Tul.
COLOMBIA. Regionem Amazonum (Bonplandi herb. propr. nunc in herb. Mus. Par.), Colombiam prope Maracibo, Plée 73 (sintipo P, no visto).
MÉXICO. Oaxaca. Novae Hispaniae propter Tehuacan, in Cordillera alt. 1700 m s.m., habitat, Galeotti 3212 (sintipo P, no visto).
9. DELONIX Raf., Fl. tellur. 2: 92. 1836. Especie tipo: Delonix regia (Boj. ex Hook.) Raf. (Poin-ciana regia Boj. ex Hook.)
Flores bisexuales, zigomorfas. Cáliz de 5 sépalos valvares. Corola de 5 pétalos de larga uña, lámina obovada, elíptica a reniforme, el vexilar diferenciado del resto en forma y color. Estambres 10, fértiles, bien exsertos, declinados, filamentos pilosos hacia la base, eglandulosos; anteras dorsifijas, con dehiscencia longitudinal. Ovario brevemente estipitado, pluriovulado, pubescente o glabro, con estilo tan largo como los estambres. Legumbre linear, grande, comprimida lateralmente, coriácea a leñosa, dehiscente, pluriseminada. Semillas compresas, elipsoides a subcilíndricas, dispuestas transversalmente. Árboles inermes. Hojas bipinnadas, grandes, estípulas caducas o no, enteras, subuladas o de base dividida, pinnada; folíolos numerosos. Inflorescencias en racimos breves, brácteas pequeñas, persistentes o no.
Referencia. Isely (1975).
Iconografía. Brenan (1967: Fig. 3, D. elata); Curtis & Hooker (1829: 56, tab. 2884, sub Poinciana regia); Capuron (1968: Fig. 1); Hou (1996: Fig. 53); Lewis et al. (2005: 154, D. floribunda, D. regia); Stergios (1998: Fig. 38, D. regia).
Nombres vulgares. Para D. regia, Royal poin-ciana, Flamboyant, Flame tree, Samboyán, Chivato, Poinciana, entre otros.
Etimología. Del griego delos=evidente y onyx=uña, aludiendo a sus pétalos de largas uñas.
Distribución geográfica y hábitat. Género con 10 especies tropicales; principalmente de Madagascar, 1 en Africa e India.
Usos. Delonix regia (Hook.) Raf., especie muy ornamental, ampliamente cultivada en los trópicos de América central y del Sur; en Argentina principalmente en el norte del país.
Material de referencia
Poinciana regia Boj. ex Hook
MADAGASCAR. Madagascar, near Foule Point (where it is known by the name of Tanahou) by Professor Bojer (holotipo probable K, no visto).
D. regia (Boj. ex Hook.) Raf.
ARGENTINA. Jujuy. Depto. Ledesma, cultiv. calle Vollmann de Ledesma, 21-II-2004 (fl), E. Ulibarri 1864 (SI). Entre La Mendieta y San Pedro, cultiv.?, 11-XI-1992 (fl, fr), R. Kiesling et al. 8154 (SI).
PARAGUAY. Asunción. Cultiv., XI-1941, A. Icart s. n. (SI 12509).
PERU. Lambayeque. Cultiv., ornamental, 5-XII-1948, N. Angulo & A. López 403 (SI).
10. DIMORPHANDRA Schott, in Sprengel, Syst. veg. 4(2) append.: 404. 1827. Especie tipo. Dimorphandra exaltata Schott
Flores bisexuales, actinomorfas. Cáliz usualmente campanulado, 5-lobulado, amarillo a anaranjado. Corola de 5 pétalos espatulados, glabros o pilosos, blancos, amarillentos o rojizos. Estambres fértiles 5, oposipétalos; anteras oblongas, versátiles, alternando con 5 estaminodios, libres o coherentes, regularmente engrosados hacia el ápice, a veces con antera rudimentaria. Ovario piloso, 5-9-ovulado, sésil o brevemente estipitado; estilo breve, estigma terminal, pequeño, ciliolado, crateriforme. Legumbre linear o falcada, comprimida lateralmente, carnosa a coriácea o leñosa, indehiscente o no. Semillas pequeñas, cilíndricas u ovoides. Árboles inermes, a menudo muy grandes. Hojas bipinnadas; estípulas pequeñas, tempranamente caducas; folíolos pequeños, numerosos, frecuentemente pilosos. Inflorescencias en densas panículas racimosas o espiciformes, flores pequeñas, numerosas, sésiles o pediceladas; brácteas pequeñas, tempranamente caducas.
Referencias. Ragonese (1973, 1982); Ducke (1935); Sandwith (1932); Silva et al. (1998).
Iconografía. Bentham (1870: tab. 66, D. vernico-sa); Ducke (1925a: pl. 2, D. macrostachya y D. parviflora); Lewis (1987: Fig. 3R, sub. D. jorgei, Fig. 3S-V, D. gardneriana); Lewis et al. (2005: 157, D. gardneriana); Silva et al. (1998, Fig. 42, D. pennigera).
Nombres vulgares. Para D. mollis, Netas (Bolivia).
Etimología. Del griego dis=doble y andros=masculino, en referencia a su androceo dimorfo.
Distribución geográfica y hábitat. Género con 25 especies de América central y Sudamérica tropical: Venezuela, Colombia, Guyana, principalmente Brasil amazónico, Perú y llegando hasta Paraguay y Bolivia.
Usos. Algunas especies son maderables, por ejemplo en construcciones navales. La raíz de D. mollis es medicinal [fide I. Guareco 360 (SI), in sched.].
Material de referencia
Dimorphandra exaltata Schott
BRASIL. Sine locus, sine data (holotipo probable B o W, isotipos probables K, L, M, N Y, OXF, STU, U, US, no vistos).
D. gardneriana Tul.
BOLIVIA. Santa Cruz. Prov. Ñuflo de Chavez, W of Concepción to San Javier, ca. 550 m s.m. 4-IV-1996 (fr), J. Abbott & F. Mamani 16559 (SI).
D. mollis Benth.
BOLIVIA. Beni. Prov. Ballivián y Yacuma. Aguas Negras, 200 m s.m., bejuco, fl. blanca, 21-III-1995, I. Guareco 360 (SI).
11. DIPTYCHANDRA Tul., Ann. Sci. Nat. sér. 2, 20: 139. 1843. Especie tipo: Diptychandra epunctata Tul
Flores bisexuales, actinomorfas; hipanto obcónico, breve. Cáliz de 5 sépalos imbricados, ovado-elípticos, cóncavos, subiguales, reflejos, pubescentes. Corola de 5 pétalos imbricados, ovado-elípticos, subiguales, pubescentes en el dorso. Estambres 10, libres, filamentos biplegados en el pimpollo, pilosos hacia la base; anteras oblongas versátiles. Ovario piloso, 4-6-ovulado, estipitado, central; estilo filiforme; estigma terminal, pequeño, cóncavo. Legumbre brevemente estipitada, alargada o breve, comprimida lateralmente, coriácea. Semillas 1-3, dispuestas transversalmente, orbiculares o reniformes. Arbustos o árboles inermes pequeños. Hojas paripinnadas; estípulas pequeñas o ausentes; folíolos submembranáceos, a veces con puntuaciones glandulosas. Racimos axilares o terminales; flores pequeñas, pediceladas, de corola amarillenta; brácteas y bractéolas ausentes.
Iconografía. Bentham (1870: tab. 13I, D. epunctat); Lewis (1987, Fig. 1E-F, D. aurantiaca subsp. epunctata); Tulasne (1844, tab. 8, D. aurantiaca); Lewis et al. (2005: 160, D. aurantiaca).
Nombres vulgares. Para. D. aurantiaca, Arca colorada, Tacurciituriqui (Bolivia); Balsamo do Cerrado (Brasil).
Etimología. Del griego dis=dos y ptychos =doblez, plegado y andros=masculino, en referencia al doble plegamiento de los filamentos en el pimpollo.
Distribución geográfica y hábitat. Género con 3 especies de Bolivia, Brasil y Paraguay.
Usos. Género cuyas especies se utilizan en la construcción (fide Toledo 500, LIL 601597)
Material de referencia
D. aurantiaca Tul.
BOLIVIA. Santa Cruz. Parque Nac. Noel Kempff, 25 Km de los Fierros, 24-X-1993, 155 m s.m. (fl), Killeen et al. 5839 (SI). Región de Lomerío, Ñuflo de Chávez, Comunidad de San Lorenzo, árbol 12 m, corteza estriada y corchosa, café, interna amarilla, 300-500 m s.m. (fr color café), M. Toledo et al. 500 (LIL 601597).
BRASIL. Minas Gerais. Loba, 27-X-1948 (fl. aromáticas), A. Macedo 1302 (SI).
D. epunctata Tul.
BRASIL. Crescit in agro Bahiensi secus fluv. Rio S. Francisco, Blanchet 2784 (holotipo P, no visto, isotipo K!)
PARAGUAY. Sine locus, sine data, (fl.), E. Hassler 10678 (SI, LIL 393599). Depto. Amambay. Sierra de Amambay, 1907/08, (fr), E. Hassler 10678a (LIL 393634).
12. GLEDITSIA L., Sp. pl. 2. 1056. 1753. Especie tipo. Gleditsia triacanthos L. Fig. 2

Fig. 2. Gleditsia amorphoides (Griseb.) Taub. A, rama. B, ápice de racimo masculino. C, flor masculina. D, estambre. E, botón de flor femenina. F, flor femenina. G, flor femenina desplegada con un estaminodio. H, gineceo; I, estilo y estigma vistos de arriba y abajo. J, fruto. Tomado de Burkart 1987: 534, fig. 241.
Flores regulares, pequeñas, unisexuales o bisexuales; hipanto turbinado. Cáliz con 3-6 sépalos subiguales, libres, de estivación valvar, incompletamente cubriendo a los pétalos y tan largos como ellos. Corola de 3-6(-10) pétalos, subiguales, blanco-verdosos, imbricados en aestivación. Las estaminadas con 5-6(-11) estambres, incluyendo estaminodios, exsertos, libres, de base pilosa; anteras dorsifijas, ovario rudimentario o nulo. Las pistiladas con 3-6(-10) estaminodios; gineceo sésil o brevemente estipitado, 2-multiovulado; estilo beve, estigma prominente y dilatado. Legumbre estipitada, comprimida lateralmente, ovada a oblonga, recta, falcada o con torciones, pulpa presente o ausente, coriácea a leñosa, lisa o nervosa; 1-pauci o multiseminada, indehiscente o tardíamente indehiscente. Semillas compreso-elipsoides a subcuadrangulares, endospermadas, dispuestas transver-salmente en la legumbre. Árboles poligamodioicos; troncos y ramas frecuentemente armados de espinas simples o ramificadas; corteza lisa. Hojas pinnadas o bipinnadas en el mismo individuo; estípulas pequeñas, caducas; folíolos pequeños a medianos, numerosos, alternos o subopuestos, generalmente de margen crenado y base oblicua. Inflorescencias axilares, solitarias o racimos fasciculados; brácteas y bractéolas lineares, caducas. Número cromosómico x=14 (Goldblatt, 1981: 431.).
Referencias. Isely (1975); Robertson & Lee (1976); Hou (1996); Larson (1984a, 1984b); Estrada et al. (2002).
Iconografía. Burkart (1978: Fig. 241-142); Robert-son & Lee (1976: Fig. 4), Gleditsia triacanthos; Lewis et al. (2005: 130), G. caspica, G. japonica.
Nombres vulgares. Para G. amorphoides (Griseb.) Taub. var. amorphoides, Espina de corona, Coronillo blanco, Algarroba, Espinillo, Caranchi (Argentina); G. triacanthos L., Acacia negra, Espina corona de Cristo, Algarroba turca (Argentina); Honey locust (Estados Unidos de Norteamérica).
Etimología. En honor al botánico alemán Gottlieb Gleditsch (1714-1786).
Distribución geográfica y hábitat. Género con ca. 14 especies de regiones templadas y subtropicales; E de los Estados Unidos de Norteamérica, México, Asia y S de América. En la Argentina crecen 2 especies, una de ellas nativa, Gleditsia amorphoides (Griseb.) Taub. var. amorphoides, la otra cultivada y naturalizada, Gleditsia triacanthos L.
Usos. G. triacanthos es ornamental, maderable, y produce goma. También es forrajera (frutos) y ocasionalmente comestible (por el hombre). G. amor-phoides es localmente maderable, y sus semillas endospermadas son una fuente de goma con aplicaciones industriales.
Material de referencia
G. amorphoides (Griseb.) Taub.var. amorphoides
ARGENTINA. Entre Ríos. Depto. La Paz, Campo del Arenal, 2º-I-1960 (fr), A. Burkart & N. Bacigalupo 21223 (SI). Jujuy. Depto. Ledesma: Sa. de Calilegua, 11-X-1927 (fl), S. Venturi 5416 (SI). Santa Fe. Depto. Gral. Obligado, entre Rabón y Florencia, 10-I-1937 (fr), A. Ragonese 2422 (SI).
G. triacanthos L.
ESTADOS UNIDOS DE NORTEAMÉRICA. Habitat in Virginia (holotipo LINN, no visto, microfilm IDC 1229.1-No. 753 SI!)
ARGENTINA. Entre Ríos. Depto. Colón, Colón, 15-XII-1963 (fr. inmad.), subespontánea, A. Burkart 24812 (SI).
13. GYMNOCLADUS Lam., Encycl. 1: 733.1785. Especie tipo: Gymnocladus canadensis Lam. nom. illeg. = G. dioicus (L.) Koch.
Flores generalmente unisexuales, actinomorfas; hipanto alargado, angostamente campanulado, externamente rojizo oscuro, pubescente, nectarífero internamente. Cáliz de 5 sépalos libres, de estivación valvar, elípticos, subiguales, ápice agudo, purpúreos externamente. Corola generalmente de 5 pétalos, de estivación imbricada, verde-blanquecinos adaxial-mente, a veces purpúreos abaxialmente, oblongos, pubescentes externamente, agudos u obtusos, subca-renados. Androceo de 10 estambres libres, en 2 ciclos, alternando largos y cortos; anteras dorsifijas. Flores pistiladas con carpelos bien desarrollados, sésiles o brevemente estipitados, pluriovulados, centrales y en la base del hipanto, estambres reducidos; con estilo erecto y exserto; estigma oblicuo generalmente dilatado. Legumbre ovoide o elipsoide, recta o levemente falcada, comprimida lateralmente, túrgida, subleñosa cuando madura, castaño-cobriza o glauca, lustrosa, sésil, oblicuamente adherida al pedicelo; péndula, 1- o con diversas semillas, cuando dehiscente a lo largo de la sutura placentar, pero las semillas son retenidas. Semillas compresas, ovoides, obovoides o circulares, castaño-cobrizas, con embrión rodeado de endosperma cartilaginosos. Árboles grandes, caducifolios, de ramas gruesas, inermes; corteza grisácea en placas longitudinales con grietas profundas. Hojas bipinnnadas, largas; frecuentemente el 1er. o 2do. par reducido a 1 sólo folíolos; estípulas caducas; folíolos numerosos, cortamente peciolulados, ovados a elípticos, acuminados;. Inflorescencias erectas o no; terminales o axilares, en plantas pistiladas paniculadas; en las esta-minadas racemosas;brácteas y bractéolas caducas; flores muy fragantes,largamente pediceladas. Número cromosómico x = 14 (Isely, 1975: 4; Goldblatt, 1981: 431).
Referencias. Burkart (1952); Isely (1975); Lewis et al. (2005); Robertson & Lee (1976); Wilbur (1963).
Iconografía. Burkart (1952: Fig. 39. G. dioicus); Lewis et al. (2005: 130, G. dioicus); Robertson & Lee (1976: Fig. 3, G. dioicus); Wilbur (1963: Fig. 10, G. dioicus).
Nombres vulgares. Para G. dioicus, Kentucky coffe-tree (Estados Unidos de Norteamérica).
Etimología. Del griego gymno = desnudo y kla-dos = rama, en alusión a las ramas de más de un año desprovistas de hojas.
Distribución geográfica y hábitat. Género pequeño con 6 especies, 1 en el este de Estados Unidos de Norteamérica y las otras 5 en el este y sudeste de Asia. En Sudamérica, G. dioicus ha sido citada por Burkart (1952: 188) como rara vez cultivada en Argentina y Chile.
Usos. En China y en India G. chinensis Baill. y G. assamicus Kanj. ex P. C. Kanj. son usadas en distintos procedimientos de lavados por su riqueza en saponinas. G. dioicus es ornamental, maderable localmente y sus semillas tostadas son consumidas por algunas etnias indígenas de Estados Unidos de Norteamérica. Antiguos colonizadores usaron sus semillas tostadas como sustituto del café (Robertson & Lee, 1976).
Material de referencia
G. dioicus (L.) Koch.
ARGENTINA. Buenos Aires. Lobos, cultiv., 23-XII-1939, A. Burkart 10042 y 10044 (SI).
CHILE. Santiago. Árbol cultiv. adorno; enormes hojas bipinnadas, fr. subleñosos, 24-II-1939, A. Burkart 9415 (SI).
14. HAEMATOXYLUM L., Sp. pl. 384. 1753. Especie tipo. Haematoxylum campechianum L.
Haematoxyllum Scop. (hom. illeg.), Introd. Hist. Nat.: 225. 1777.
Cymbosepalum Bak., Bull. Misc. Inform. 100-101: 103. 1895
Flores bisexuales, actinomorfas; hipanto breve. Cáliz de 5 sépalos imbricados, anchamente ovados, el ventral mayor que los restantes, ganchoso en el ápice y abrazando a los otros, eglandulosos o no. Corola de 5 pétalos amarillos, imbricados, obova-dos, subiguales. Estambres 10, libres; filamentos densamente pilosos hacia la base; anteras dorsifijas, de dehiscencia longitudinal. Ovario 2-3-ovulado, a veces glanduloso, brevemente estipitado; estilo filiforme; estigma pequeño, terminal. Legumbre comprimida lateralmente, recta u oblicua, membranácea, con dehiscencia a lo largo de la línea media de cada valva (rimosa). Semillas comprimidas, oblongas, dispuestas transversalmente. Arbustos o árboles inermes o no. Hojas paripinnadas o a veces las inferiores bipinnadas; estípulas pequeñas, inconspicuas o espinescentes; folíolos comúnmente obcordados, 2-4 pares. Inflorescencias racimosas, axilares o terminales; flores pediceladas; brácteas inconspicuas, bractéolas ausentes.
Iconografía. Karsten (1862: tab. 114, sub Hae-matoxylum brasileto); McVaugh (1987: Fig. 10, Haematoxylum brasileto; Ross (1977: Fig. 22, H. dinteri); Lewis et al. (2005: 135, H. brasileto).
Nombres vulgares. Para H. brasileto, Brasil, Brasil-wood, Nicaragua-wood.
Etimología. Del griego haimatikos=de sangre y xylon=madera, en alusión al color rojizo de su madera.
Distribución geográfica y hábitat. Género de 3 especies, 2 de América tropical, México, Indias occidentales (probablemente introducida), Sud-américa (Colombia y Venezuela) y 1 en S Africa.
Usos. De H. brasileto H. Karst. se extrae un colorante para teñir; la madera de H. campechianum L. se utiliza para mobiliario fino y fuente de la hematoxilina para preparados microscópicos (Uphof, 1968: 260).
Material de referencia
H. brasileto H. Karst.
COLOMBIA. Magdalena. 28 km S Riohacha, 9-XII-1944 (fl), 40 m s.m., O. Haught 4488 (SI).
VENEZUELA. Lara. Pozo Guapo, antes de Carora, 16-IV-1946 (fr), A. Burkart 16534 (SI).
H. campechianum L.
MEXICO. Habitat in Campeche Americes (holotipo LINN, no visto, microfilm 538.1-No. 311 SI!).
PUERTO RICO. Prope Cabo Rojo, 26-II-1885 (fl), Herb. Krug & Urban 671 (SI).
15. HOFFMANNSEGGIA Cav., Icon. 4: 63. 1798. nom. cons. Especie tipo: Hoffmannseggia falcaria Cav. nom. illeg. [H. glauca (Ortega) Eifert].
Flores bisexuales, zigomorfas; hipanto acopado, breve. Cáliz de 5 sépalos, libres, subiguales, persistentes, de prefloración valvar o levemente imbricada. Corola amarillo-anaranjada, de 5 pétalos, libres, subiguales, largamente obovados a suborbiculares, con tricomas glandulosos en el dorso, unguiculados, el superior con uña más o menos acanalada. Estambres 10, libres; filamentos pilosos; anteras dorsifijas, rimosas. Ovario linear, subestipitado, glabro, piloso o glanduloso, 7-15 ovulado, estilo ligeramente curvo, estigma apical, cóncavo. Legumbre comprimida, de márgenes casi paralelos, recta, incurva o recurva, a sigmoide, papirácea a coriácea, a menudo con surcos transversales entre las semillas, glabra o pubescente, con o sin tricomas glandulosos, indehiscente o con dehiscencia tardía. Semillas ovoides, comprimidas albuminadas. Hierbas perennes, generalmente en rosetas, raro subarbustivas, inermes, comúnmente radicigemífero-tuberíferas. Indumento diferenciado en tricomas glandulares capitados y claviformes y no glandulares unicelulares. Hojas imparipinnadas; pinnas opuestas; folíolos frecuentemente pequeños y numerosos, glabros, pubescentes y glandulosos, sin glándulas inmersas. Inflorescencias en racimos terminales o axilares; pedicelo sin articulación; brácteas presentes, a menudo caducas; flores pediceladas. Número cromósomico x=12 (Goldblatt, 1981: 431).
Referencias. Simpson (1999); Simpson & Miao (1997); Simpson & Ulibarri (2006a); Simson et al. (2004, 2005); Ulibarri (1979, 1984, 1996, 1997a); Ulibarri et al. (1994).
Iconografía. Burkart (1952: Figs. 32 y 33); Ulibarri (1979: Figs. 1-4, H. glauca; Fig. 5, H. doelli, H. doelli subsp. argentina, H. yaviensis; Fig. 6, H. erecta, H. minor; Fig. 7, H. eremophila, H. trifoliata). Ulibarri (1984: Fig. 572, H. trifoliata var. trifoliata; Fig. 573, H. glauca; Fig. 574, H. erecta). Ulibarri et al. (1994: Fig. 321, H. glauca; Fig. 322, H. erecta; Fig. 323, H. doelli susbp. argentina). Ulibarri (1996: Fig. 6, H. glauca; Fig. 7, H. arequipensis; H. minor; H. stipulata y H. yaviensis; Fig. 8, H. doelli subsp. doelli; H. erecta, H. eremophila; H. ternata; H. trifoliata var. trifoliata). Simpson & Ulibarri (2006, Figs. 2, H. doelli; H. drepanocarpa; H. minor; H. miranda y H. yaviensis; H. doelli; Fig. 3, H. miranda; H. peninsularis; H. viscosa; H. repens y H. tenella).
Nombres vulgares. Para H. glauca, Porotillo, Algarrobilla fina, Papa cuchi; H. minor, Ají, Ajicillo del campo, Cuaresmillo.
Etimología. En honor al naturalista alemán Conde J. C. Hoffmannsegg (1766-1849).
Usos. H. doelli Philippi, H. glauca (Ortega) Eifert y H. minor (Phil.) Ulibarri, son forrajeras naturales y con tuberosidades comestibles.
Distribución geográfica y hábitat. Género con aproximadamente 22 especies, desde el S de Estados Unidos de Norteamérica y N de México, llega a Perú, Bolivia y el S de Argentina y Chile; en zonas semiáridas bajas o de alta montaña, algunas especies hasta los 3.600-4.000 m s.m. Véase Simpson (2004, 2005), sobre el probable origen sudamericano del género y su relación con Balsa-mocarpon y Zuccagnia.
Material de referencia
Hoffmannseggia falcaria Cav.
PERU. Habitat in Vico Surco Provinciae Lima, & Provincia Canta & Atiquipa Regni Peru-viani, pero descripto a partir de material cultivado en el Jardín Botánico de Madrid (holotipo MA, no visto, fotografía Field Museum 29415 SI!).
H. doelli Phil.
CHILE. Región II. Prov. Antofagasta. Aiquina-Toconce, 19-XI-1967 (fl, fr), H. Martin 386 (LIL, SI). Prov. El Loa, Conche to Inacaliri, 10-II-2000, 3.400 m s.m. (fl, fr), B. Simpson 10-II-00-1 (SI, TEX).
H. glauca (Ortega) Eifert.
ARGENTINA. Catamarca. Depto. Antofagas-ta de la Sierra, A. de la Sierra, 17-II-1974 (fl), E. Ulibarri et al. 639 (K, SI).
H. minor (Phil.) Ulibarri
ARGENTINA. Jujuy. Depto. Tumbaya, 0.5 km N Tres Morros, 3-II-2000 (fl, fr), B. Simpson 3-II-00-1 (SI, TEX).
BOLIVIA. Potosí. Quechisla, 6-XII-1931 (fl, fr), M. Cárdenas 6 (LIL).
H. yaviensis Ulibarri
ARGENTINA. Salta. Depto. Cachi, 12 km W of Piedra de Molina, 30-I-200 (fl, fr), B. Simpson 30-I-00-1 (SI, TEX).
16. JACQUESHUBERIA Ducke, Arch. Jard. Bot. Rio de Janeiro 3: 118. 1922. Especie tipo: Jac-queshuberia quinquangulata Ducke.
Flores bisexuales, subactinomorfas; hipanto obcónico, breve, pubescente. Cáliz de 5 lóbulos, imbricados, ovados, cuculados, pubescentes. Corola de 5 pétalos, imbricados, erectos, ovados, subigua-les, sésiles. Estambres 10, iguales, exsertos, filamentos de base pilosa, unidos en un tubo estaminal, externamente piloso o glabro que se abre profundamente adaxialmente; anteras dorsifijas. Ovario central, pubescente, sésil, 8-ovulado; estilo filiforme, alargado, estigma terminal, oblicuamente capitado. Legumbre linear, recta, moderadamente comprimida, atenuada hacia la base, leñosa, dehiscente elásticamente desde el ápice hacia la base, 4-8-seminada, profunda y longitudinalmente sulcado en el medio, septado oblicuamente entre las semillas; estas compresas, oblongo-romboides. Árboles pequeños, inermes, con troncos y ramas 5-angulosos. Hojas bipinnadas, con numerosos pares de pinnas; folíolos coriáceos, numerosos; estípulas caducas y en ramas floríferas persistentes, foliáceas a pinnadas; flores pediceladas en racimos breves, subcorimbosos; brácteas setáceas, bractéolas ausentes.
Referencias. Ducke (1922, 1932); Cowan (1958, 1985, 1990); Stergios (1998).
Iconografía. Cowan (1958: pl. 29a-c, J. amplifo-liola); Cowan (1990: Fig. 1, J. brevipes); Ducke (1922: pl. 7, estampa 7, J. quinquangulata); Ster-gios & Berry (1996: Fig. 1, J. pustulata; Fig. 2, J. splendens); Lewis et al. (2005: 151, J. brevipes); Stergios (1998: Figs. 53 y 54, J. pustulata y J. splendens).
Etimología. En honor a Jacques Huber (1867-1914), botánico suizo, fundador del Herbario del Museo Emilio Goeldi (Belém, Brasil) en 1895, el más antiguo de Amazonia.
Distribución geográfica y hábitat. Género con 7 especies que se distribuyen en el norte de Sudamérica: Venezuela, Guyana, Colombia, Perú y Brasil.
Material de referencia
J. quinquangulata Ducke
BRASIL. Habitat in campinâ arenosâ silvis primaevis circumdatâ in vecinitate oppiduli Guru-pá civitatis paraensis, 17-I-1916, A. Ducke 15953 (holotipo probable MG, no visto).
J. loretiana Cowan
PERU. Loreto. Maynas 4 km from Mishana, Rio Nanay, 150 m s.m., 10-I-1976 (fl), A. Gentry et al. 15778 (isotipo K!).
J. purpurea Ducke
BRASIL. Amazonas. Río Urubú, 17-IV-1949, solo arenoso, 6 m alt., fl. vermelhas, R. Fróes 25253 (SI). Ad ripas flum. Curicuriany affl. Rio Negro, 23-XII-1931 (fl), A. Ducke 54 (isotipo K!).
17. LOPHOCARPINIA Burkart, Darwiniana 11(2): 256, Fig. 2 y 3. 1957. Especie tipo: Lophocarpinia aculeatifolia (Burkart) Burkart (Cenostigma? aculeatifolium Burkart).
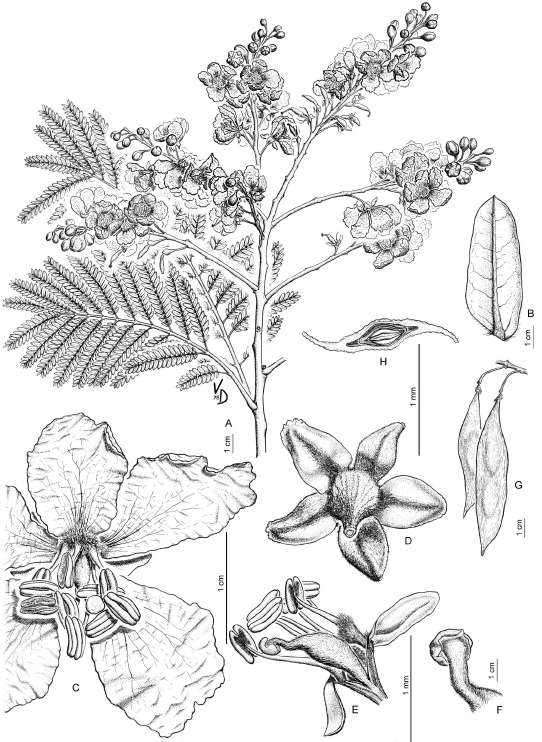
Fig. 3. Peltophorum dubium (Spreng.) Taub. A, rama con flores. B, folíolo, cara dorsal. C, flor, cara frontal. D, cáliz, cara abaxial. E, corte longitudinal de la flor, sin la corola. F, estilo y estigma. G , frutos. H, corte longitudinal del fruto. Tomado de Burkart 1987: 529, fig. 239.
Flores bisexuales, zigomorfas; hipanto brevemente turbinado, carnoso. Cáliz de 5 sépalos, libres, oblongos, obtusos, pubescentes, caducos, el abaxial mayor, navicular, cubriendo a los órganos sexuales durante la antesis. Corola de 5 pétalos, libres, obovados, desiguales, el vexilar bien diferenciado del resto, de uña carnosa y bordes ondulados, velluda. Estambres 10, libres subiguales; filamentos pilosos; anteras elípticas, dorsifijas, rimosas. Ovario lineal, 5-6-ovulado, estilo filiforme, glabro; estigma apical, cóncavo. Legumbre en lomento, incurvo hasta anular, con (1-)2-3(-5) artejos con 4 alas crenadas, rojizas. Semillas elipsoide-reniformes, con albumen tenue. Arbustos leñosos, 0,5-2(-3) m alt., generalmente achaparrados, radicigemíferos, flexuosos, espinescentes por aguijones infraestipulares, 2-5 mm long.; ramas glabras, rojizas. Hojas paripinnadas, 5-10 mm long., generalmente en braquiblastos; estípulas acuminadas; raquis aculealado en las inserciones foliolares, 2(-3) pares de folíolos obovados o elíptico-orbiculares, 4-7 mm long. x 3-3,5 mm lat., finamente pubescentes. Racimos breves, corimbi-formes, 3-6 floros, pubescentes; brácteas tempranamente caducas; flores de 1-1,5 cm long., amarillo-anaranjadas.
Iconografía. Burkart (1957: Figs. 1-2, L. aculeatifolia); Lewis et al. (2005: 146, L. aculeatifolia).
Nombres vulgares. Brea del bordo (Argentina).
Etimología. Del griego lophos=peine o cresta, carpos=fruto, aludiendo a la morfología del epicarpo del fruto.
Distribución geográfica y hábitat. Género con una sola especie, Lophocarpinia aculeatifolia Burkart, de Paraguay y Argentina. Habita en el bosque xerófilo de la Provincia Biogeográfica Chaqueña, en Argentina se encuentra en el Chaco, Formosa, Salta y probablemente en Jujuy oriental. Crece junto a Bulnesia samientoi Griseb., Aspidosperma quebracho-blanco Schltdl., Prosopis sp., Lycium sp., entre otras.
Material de referencia
PARAGUAY. Boquerón. Mariscal Estigarribia, Estancia Remonia, 13-X-1992 (fl), F. Mereles & R. Degen 4701 (SI). Misión Nueva Vida, II-1981 (fl), P. Arenas 1729 (SI). Detpo. General Güemes, 19 km de Sauzalito hacia el E por ruta en dirección a El Sauzal, 17-XI-1990 (fl, fr), R. Fortunato et al. 1417 (SI). Chaco. Km 220, sector López de Filippis, X-1938 (fl), T. Rojas 8441 (holotipo SI!).
ARGENTINA. Formosa. Depto. Matacos, Ing. Juárez, 12-I-1957 (fl), A. Burkart 20216 (SI). Depto. Bermejo, Quebrachito, 5 km de la Rinconada, arbusto 1,5-2 m alt., fl. amarillas con manchas rojas, crece en terreno anegadizo, arcilloso, 24-X-1985 (fl), P. Arenas 3025 (BA-90224). Salta. Depto. Anta, Pto. Humildad a Rivadavia, E. Parada 957 (LIL).
18. MELANOXYLON Schott, in Sprengel, Syst. cur. post. 406. 1827. Especie tipo: Melanoxylon braunia Schott.
Perittium Vogel, Linnaea 11: 408. 1837.
Flores bisexuales, actinomorfas; hipanto campanulado, breve. Cáliz 5-lobado, imbricados, ovado-deltoides, pubescentes externamente, el abaxial menor que los restantes. Corola amarilla, de 5 pétalos, imbricados, orbiculares u obovados, el adaxial levemente diferenciado del resto, cortamente unguiculados. Estambres 10, libres, filamentos pilosos hacia la base; anteras oblongas, uniformes, dorsifijas. Ovario piloso, estipitado, central, pluriovulado; estilo breve, engrosado, incurvo; estigma terminal, cóncavo, ciliolado. Legumbre alargada, falcada, estipitada, comprimida lateralmente, internamente con tejido denso entre las semillas, coriácea a leñosa, 10-11-seminada. Semillas oblongas, compresas, con ala apical, transversalmente dispuestas. Árboles altos, inermes. Hojas imparipinnadas, folíolos numerosos, ovado-elípticos, agudos u obtusos, peciolulados. Inflorescencias racimosas, paniculadas hacia el ápice, brácteas caducas, flores pediceladas, pedicelos bibracteolados en su parte media.
Iconografía. Bentham (1870: tab. 17, M. brau-na); Lewis (1987: Fig. 1M-O); Lewis et al. (2005: 148, M. brauna).
Nombres vulgares. Baraúnapreta, Baraúna-verdadeira, Braúna (Lewis, 1987: 30).
Etimología. Del griego melanos=negro y xylon =madera, en alusión al color de su madera.
Distribución geográfica y hábitat. Género al que se habían asignado 3 especies, pero en los últimos estudios de la flora sudamericana, Lewis (1987) y Barneby (1993) consideran al género como monotípico y endémico del la región boscosa del atlántico brasilero.
Usos. Maderable, medicinal y tánico (Uphof, 1968: 339).
Material de referencia
Melanoxylon braunia Schott
BRASIL. Habitat in sylvis prov. Rio de Janeiro haud infrequens: Schott, Vauthier, Peckott, Gla-ziou 1030, etc., et in prov. Minas Geraës prope S. Joâo Baptista: Sello (sintipos probables en K, L, M, NY, OXF, STU, U, US, W, no vistos). Bahia. Santa Cruz Cabrália, mata costeira, arvore 30 m x 35 cm diâm., fl. amarela, calice marron, 8-2-1967, R. P. Belém & R. S. Pinheiro 3288 (SI)
19. MOLDENHAWERA Schrad., Goett. Gel. Anz. 1: 718. 1821 (no vista). Especie tipo: Molden-hawera floribunda Schrad.
Flores bisexuales, actinomorfas, tetrámeras o pentámeras. Cáliz con 5 sépalos carnosos, reflexos, elípticos a espatulados. Corola amarilla, menos frecuente rosada, de 5 pétalos conspicuamente unguiculados, limbo crenado o lobado. Estambre fértil 1, antera rimosa, conectivo generalmente villoso, del doble de longitud de los otros 9 transformados en estaminodios, dispuestos en 2 ciclos con anteras rimosas, poricidas o indehiscentes. Ovario piloso, 6-14-ovulado, levemente curvado en el ápice; estilo excéntrico; estigma truncado, fimbriado. Legumbre linear a subfalcada, lateralmente comprimida, de márgenes rectos, raro submoniliforme, leñosa, elásticamente dehiscente. Semillas 5-12, comprimidas, ovoides. Árboles o arbustos con indumento principalmente de pelos biramosos. Hojas pinnadas o bipinnadas o parcialmente bipin-nadas; estípulas simples o divididas; folíolos generalmente opuestos, angostamente elípticos a orbiculares, coríaceos. Inflorescencias en racimos sub-corimbosos, flores pediceladas, pedicelos articulados hacia el ápice; brácteas caducas.
Referencias. Queiroz et al. (1999); Irwin & Arroyo (1974); Yakovlev (1975).
Iconografía. Bentham (1870: tab. 25, M. floribunda); Irwin & Arroyo (1974: Fig. 2, M. nitida); Lewis (1987: Fig. 2 G-H, M. blanchetiana); Lewis et al. (2005: 149, M. blanchetiana var. blanchetiana, M. nutans y M. papillanthera).
Etimología. En honor Joham J. P. Moldenhawer (1766-1827), profesor de botánica de la Universidad de Kiel (Alemania).
Distribución geográfica y hábitat. Género con 7 especies endémicas del nordeste y de la región atlántica del Brasil.
Material de referencia
Moldenhawera floribunda Schrad.
BRASIL. Sine locus, sine data, Pr. Vidensis 44 (holotipo BR, no visto, isotipo LE, no visto).
M. blanchetiana Tul var. blanchetiana
BRASIL. Bahia. Entre Itajuipe e Banco Central, 21-I-1965, arvore de 10-15 m fl. aurantia-cas, E. Pereira 9558 (LP).
20. MORA Schomb. ex Benth., Trans. Linnean Soc. 18: 210, tab. 16-17. 1839. Especie tipo: Mora excelsa Benth.
Flores bisexuales, actinomorfas. Cáliz urceola-do-campanulado, brevemente 5-lobulado, imbricado en prefloración. Corola de 5 pétalos, subiguales, obovado-oblongos, brevemente unguiculados. Estambres fértiles 5, oposipétalos, con anteras pilosas; otros 5 estaminodios alternipétalos con anteras glabras. Ovario recto, pauciovulado, brevemente estipitado, estilo breve, glabro, estigma pequeño, terminal. Legumbre elipsoide, leñosa, dehiscente. Árboles de gran talla (18-50 m alt.), inermes. Hojas paripinnadas, glabras; folíolos 3-4 pares, opuestos, grandes; estípulas caducas; flores en densas inflorescencias espiciformes; brácteas escamiformes; bractéolas ausentes.
Referencias. Lewis et al. (2005); Ragonese (1973 y 1982); Steyermark et al. (1998).
Iconografía. Bentham (1839: tab. 16-17, M. excelsa); Lewis et al. (2005: 158, M. excelsa); Stergios (1998: Fig. 72, M. gonggrijpii).
Nombres vulgares. Para M. excelsa y M. gonggrijpii, Nato, Nato rojo (Colombia); Mora de Guyana (Venezuela); Morabukea, Mora (Guyana); para M. paraensis, Pra cuúba (Brasil).
Etimología. Mora proviene del nombre vernáculo empleado para estas plantas por la etnia Ara-wak.
Distribución geográfica y hábitat. Género con 6 especies de las Antillas Mayores, Centroa-mérica y N de Sudamérica: Colombia, Venezuela, Trinidad, Guyana, Suriname, Ecuador y Brasil.
Usos. M. excelsa Benth. y M. gonggrijpii (Klein-hoonte) Sandwith, maderables, para construciones navales. M. megistosperma (Pittier) Britton & Rose, posee las semillas más grandes conocidas (de 18 x 12 cm) que son usadas localmente para teñir de rojo; le sigue M. excelsa con semillas de (7-)12 x (4-)7 cm (Britton & Rose, 1930; Amshoff, 1939; Lewis et al., 2005).
Material de referencia
Mora excelsa Benth.
GUYANA BRITÁNICA. Sine locus, sine data, Schomburgk 496 (holotipo probable K, no visto).
M. paraensis Ducke
BRASIL. Pará. Rio Mojú, mata a beira do rio, 1-VI-1954 (fr), G. Black 54-16337 (SI).
COLOMBIA. El Valle. Buanaventura Bay, Mangrove swamp at mouth of Río Dagua, tree 18 m alt. 3-II-1939 (estéril), E. Killip 33005 (SI).
21. ORPHANODENDRON Barneby & J. W. Gri-mes, Brittonia 42(4): 249. 1990. Especie tipo: Orpahnodendron bernalii Barneby & J. W. Gri-mes
Flores bisexuales, subzigomorfas; hipanto breve. Cáliz de 5 sépalos, deltoides, de prefloración valvar, unidos hacia la base. Corola de 5 ó 4 pétalos por ausencia del dorsal, libres y fugaces, obova-dos. Estambres 16-17, libres, anteras versátiles, con dehiscencia lateral. Ovario linear, 3-4-ovulado, central, estipitado. Legumbre recta, comprimida lateralmente, glabra, con dehiscencia elástica. Semillas con embrión recto, exariladas, exendos-pérmicas. Árboles inermes de de hasta 15 m alt. Hojas imparipinnadas; estípulas nulas o tempranamente caducas (?); folíolos 3 pares, peciolulados, opuestos o subopuestos, anchamente o angostamente elípticos, ca. 6,5-12 cm long. x 2,2-4,4 cm lat., con acumen de 12-20 mm long., menudamente estrigulosos dorsalmente. Inflorescencia terminal, cimosa, densamente serícea, castaño-dorada, de 7-10 cm long.; flores de aprox. 1,5-1,9 cm long., hipanto 2 mm; cáliz 7-8 mm, lóbulos 3,5-4 mm; pétalos blancos, 8,5-9,5 x 3,4-6 mm, los abaxiales de menores en lat. sobre pedicelos bibracteolados en su parte media. Legumbre recta, de contorno eliptico-obovado, ca. 10-12 cm long. x 3 cm lat., gabra, castaña, lustrosa, leñosa, pero quebradiza.
Iconografía. Barneby & Grimes (1990: Fig. 1, O. bernalii); Lewis et al. (2005: 161, O. bernalii).
Etimología. Del griego orphanos=huérfano y dendron=árbol, en alusión a la afinidad incierta del género.
Distribución geográfica y hábitat. Género con 1 especie de Colombia, O. bernalli Barneby & J. W. Grimes.
Observaciones. Género de afinidad incierta y ubicado dentro de las Caesalpinioideae por su embrión recto, comparte características con la tribu Swar-tzieae de las Papilionoideae por el número indefinido de sus estambres libres y su cáliz de prefloración valvar y lóbulos unidos hacia la base. Representa un estado aislado y basal de diversificación en la familia; aún se requieren estudios de este género (Barneby & Grimes, 1990; Lewis et al., 2005).
Material de referencia
COLOMBIA. Antioquia. En potrero con árboles, 350 m s.m., 14 km a sur de Mutatá en la carre-
tera a Dabeiba, 19-VII-1988 (fl), R. Bernal et al. 1482 (holotipo COL, no visto, isotipos K!, US 3208005 Imagen Digital 324051). Municipio de Mutatá, 8-20 km S de Mutatá en la vía a Dabeiba, Alto de Echevarri, 210-230 m s.m., bosque, 22-XI-1987 (fr), R. Callejas et al. 5802 (paratipo K!, Imagen Digital 743680 NY!).
22. PARKINSONIA L., Sp. pl. 1: 375. 1753. Especie tipo: Parkinsonia aculeata L
Flores bisexuales, zigomorfas; hipanto incons-picuo. Cáliz de 5 sépalos libres, oblongos, reflexos, caducos. Corola de 5 pétalos amarillos, obo-vados, el superior usualmente con uña larga. Androceo de 10 estambres libres, con filamentos pilosos hacia la base. Ovario linear, pubescente o glabro, estipitado. Legumbre recta, comprimida o torulosa, indehiscente o dehiscente sin elasticidad, papirácea o coriácea. Semillas generalmente escasas, endospermadas. Arbustos o árboles, inermes o espinosos, eglandulosos. Hojas bipinnadas, 1-3 pares de pinnas; estípulas escamiformes a espinosas; folíolos pequeños, caducos. Inflorescencias generalmente breves, racimosas, paucifloras; pedicelo articulado, bráceas inconspicuas, caducas. Número cromsómico x=14 (Goldblatt, 1981: 431).
Referencias. Abedini (2005); Burkart (1952, 1967, 1987a); Hughes et al. (2003); Ulibarri et al. (1994); Ulibarri (1997a).
Iconografía. Burkart (1952: Fig. 36); Burkart (1967: Fig. 145); Burkart (1978: Fig. 240); Hughes et al. (2003: Fig. 1, P. peruviana); Izaguirre & Beyhaut (2003: Fig. 2); Lewis et al. (2005: 153, P. aculeata).
Nombres vulgares. Cinacina (Argentina, Bo-livia, Brasil, Paraguay); Uña de gato (Perú); Sauce, Retama (Colombia).
Etimología. Dedicado al botánico inglés J. Parkinson (1567-1650).
Distribución geográfica y hábitat. Género con 3 especies de regiones cálidas del norte, centro y sur de América, Antillas y Africa. En América occidental cálida se encuentra Parkinsonia aculeata L., desde el sur de Estados Unidos y México hasta la Argentina, donde es nativa y además se cultiva (desde el norte y centro del país hasta Entre Ríos y Buenos Aires). Común a orillas de caminos, a menudo en terrenos bajos o a lo largo de los cursos de ríos. Llega hasta los 500 m s.m.
Usos. Ornamental, melífera y adecuada para pasta de papel, medicinal(?) (Burkart, 1978: 533).
Observaciones. Hughes et al. (2003) consideran que Cercidium debe incluirse dentro de Parkinsonia.
Material de referencia
P. aculeata L.
Habitat in America calidiore (holotipo LINN no visto, microfilm IDC 527.1-No. 307 SI!).
ARGENTINA. Buenos Aires. Barracas al Sur, 25-II-1902, (fl, fr), S. Venturi 3 (SI). Entre Ríos. Depto. Diamante, Diamante, 15-XII-1960 (fl), A. Burkart 22191 (SI). Jujuy. Depto. Ledesma, Ayo. Zanjón Seco, entre Caimancito y Yuto, 19-X-1964 (fl), A. Cabrera & H. Fabris 16169 (LP). Depto. Santa Bárbara, Palmeras a 20 km de Vinalito, 22-X-1964 (fl), A. Cabrera & H. Fabris 16234 (LP).
BOLIVIA. Tarija. Tarija, 10-I-1979 (fr), C. Ruiz s. n. (SI).
ECUADOR. Guayas. Guayaquil, 4-VII-1964 (fl), A. de Delgado 48 (SI).
PARAGUAY. Chaco paraguayo, XII-1937 (fl), T. Rojas 7676 (SI).
23. PELTOPHORUM (Vogel) Benth., in Hooker, J. Bot. 2: 75. 1840. nom. cons. Especie tipo: Pel-tophorum dubium (Spreng.) Taub. (Caesalpinia dubia Spreng.). Fig. 3.
Caesalpinia sect. Peltophorum Vogel, Linnaea11: 406. 1837.
Flores bisexuales, zigomorfas; botones florales globosos; hipanto obcónico. Cáliz de 5 sépalos, libres, ovado-deltoides, pubescentes. Corola de 5 pétalos, libres, obovados, subiguales, amarillos. Estambres 10, libres, filamentos pilosos. Ovario pubescente, estipitado; estigma peltado, ancho. Legumbres indehiscentes, samaroides, 1-3-seminadas. Árboles inermes, altos. Hojas bipinnadas, grandes, multifolioladas. Inflorescencias en racimos apicales paniculados. Número cromosómico x =14, 13 (Goldblatt, 1981: 431).
Referencias. Barneby (1996); Bolzon de Muñiz & Marchiori (2005); Haston et al. (2003); Santiago & Paoli (1999); Ulibarri (1997a).
Iconografía. Bentham, 1870, tab. 20, P. dubium. Burkart, 1978, Fig. 239. Izaguirre & Beyhaut, 2003, Fig. 3, P. dubium. Lewis, 1987, Fig. 1 C-D, P. dubium. Lewis et al. 2005: 152, P. dubium. Ster-gios, 1998, Fig. 77, P. pterocarpum (Fig. 3).
Nombres vulgares. Para P. dubium, ibirá-pitá, ibirapuitá, ibirápitá guazú, virapitá, cañafístula (Argentina); ibirá-pitá, árbol de Artigas (Uruguay); cassia amarela, farinha-seca (Brasil).
Etimología. Del griego peltophoros, en alusión a su estigma peltado.
Usos. Ornamental, magnífico en floración, y de importancia forestal (Burkart, 1978: 530-531).
Distribución geográfica y hábitat. Género tropical y subtropical, de aproximadamente 7-9 especies distribuidas en Sudamérica, Indias Occidentales, África, Asia y Australia. Cinco especies, entre indígenas y domesticadas están presentes en América. En la Argentina, sur de Brasil, Paraguay y noroeste del Uruguay, crece una especie, P. dubium (Spreng.) Taub.
Material de referencia
P. dubium (Spreng) Taub.
Brasil, Hispaniola (holotipo probable B; isotipos probables GOET, P, W, no vistos).
ARGENTINA. Entre Ríos. Depto. Federación, Cantera Chaviyú, 18-I-1977 (fl, fr), N. Troncoso et al. 1581 (SI). Formosa. Sin. loc., II-1918 (fr), P . Joergensen 2722 (SI). Misiones. Depto. Candelaria, Santa Ana, XII-1912 (fl), F. Rodríguez 670 (SI).
BRASIL. Santa Catarina. Aguas de Chapecó, 4-III-1964 (fr), R. Klein 5381 (SI). Conceiçao, Ita-piranga, 12-I-1964 (fl), R. Klein 16824 (SI).
PARAGUAY. Cordillera Altas, IV-sin año (fl), E. Hassler 153 (SI). San Pedro. Primavera, 26-XII-1957 (fl), A. Woolston 933 (SI).
24. POMARIA Cav., Icon. 5: 2, tab. 402. 1799. Especie tipo: Pomaria glandulosa Cav.
Melanosticta DC., Prodr. 2: 484. 1825.
Cladotrichium Vogel, Linnaea 11: 401. 1837.
Flores bisexuales, zigomorfas; hipanto breve, campanulado. Cáliz de 5 sépalos libres, valvados, lanceolados, desiguales, el abaxial mayor sosteniendo al androceo y gineceo. Corola de 5 pétalos libres, amarillos, obovados, unguiculados, subiguales. Estambres 10, libres, incurvos, 2 superiores geniculados, filamentos pilosos, anteras dorsifijas. Ovario ovoide, recto, pluriovulado, frecuentemente piloso y glanduloso, estilo incurvo, glabro, estigma, subapical, cóncavo, ciliolado. Legumbre linear o falcada, comprimida lateralmente, atenuada hacia la base, mucronulada, con tricomas simples o plumosos y glandulosos, dehiscente elásticamente, a veces tardíamente, 1-4-seminada. Pequeños arbustos, subarbustos o hierbas perennes, con indumento común de tricomas simples o plumosos, principalmente en frutos y glandulares estipitados o de base bulbosa. Hojas imparipinnadas; estípulas ciliadas a laciniadas, pilosas y glandulosas; pinnas 1-7 pares; folíolos pequeños, numerosos, simpre con puntuaciones glandulosas en el envés. Inflorescencias en racimos terminales o axilares; flores sobre pedicelos articulados o no, brácteas tempranamente caducas.
Referencias. Simpson (1998); Simpson & Lewis (2003); Simpson et al. (2006).
Iconografía. Micheli (1889: pl 25, sub Hoff-mannseggia parviflora); Simpson & Lewis (2003: Fig. 1 , P. stipularia); Lewis et al. (2005: 141, P . stipularis).
Etimología. En honor a Dominic Pomar (1598-1621), botánico español.
Distribución geográfica y hábitat. Género con 16 especies de América del norte, Sudamérica y África.
Material de referencia
P. glandulosa Cav.
MEXICO. [Nova Hispania] Querétaro, X-sin año, Née s. n. (lectotipo MA, no visto).
P. parviflora (Micheli) B. B. Simpson & G. P. Lewis
PARAGUAY. "in collibus incultis vallis YAcan prope Valenzuela" Balansa 4444 (holotipo G!, isotipos BM!, CORD!, F!, SI!).
P. pilosa (Vogel) B. B. Simpson & G. P. Lewis
BRASIL. Brasilia. RGS, Toca do Tigre, Itapoan, 11-X-1950 (fl), Anchieta 48968 (SI).
P. rubicunda (Vogel) B. B. Simpson & G. P. Lewis
ARGENTINA. Misiones. Depto. Capital, Ayo. Garupá, 27-II-1947 (fl, fr), Berti & Escalante 539 (SI).
25. PTEROGYNE Tul., Ann. Sci. Nat. sér. 2, 20: 140. 1843. Especie tipo: Pterogyne nitens Tul. Fig. 4
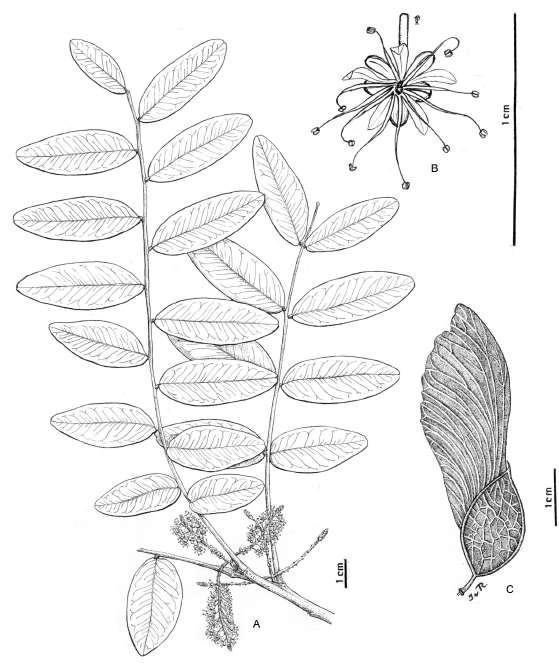
Fig. 4. Pterogyne nitens Tul. A, rama florífera. B, flor, vista de arriba. C, fruto. A y B, de Mee 47928 (SI); C, de Tay-lor et al. 11445 (SI).
Flores bisexuales, pequeñas, raro masculinas con ovario atrofiado (imperfectas), actinomorfas, hipanto breve. Cáliz de 5 sépalos libres, iguales, subpetaloides, obtusos, cóncavos, de prefloración imbricada. Corola de 5 pétalos libres, subiguales. Estambres 10, libres; anteras versátiles. Ovario compreso, de contorno elipsoide, piloso, estipitado, 1-ovulado; estilo recto, breve; estigma apical, truncado. Fruto sámara, castaña, comprimida lateralmente, indehiscente con estípite de 1-2 mm long., porción seminífera oblicuamente elipsoide, comprimida, acuminada, coriácea, reticulada, 1,4-1,8 cm long. x 0,8-1 cm lat.,con ala hacia el margen adaxial y apical, obtusa o aguda, con nervios subparalelos y curvos, 2,5-3,5 cm long. x 1,5 cm lat., el margen adaxial-apical. Semilla 1 en la porción basal de la sámara, comprimida, elipsoide, castaña, exalbuminada, 12 mm long. x 7 mm lat. Árboles de 5-12 m alt., inermes; hojas paripinnadas o pseudo imparipinnadas, 11-27 cm long.; estípulas tempranamente caducas; folíolos (4-)7-8 pares, generalmente alternos, ovado-elípticos, 3,5-6 cm long. x 1,5-2,5 cm lat.; inflorescencia amen-tiformes cuando juveniles, durante la antesis, racimos de 2-4(-9) cm long. Número cromosómico x=10 (Goldblatt, 1981: 431).
Iconografía. Bentham (1870: tab. 64, P. nitens); Burkart (1952: 25); Lewis et al. (2005: 134, P. nitens); Tulasne (1844: pl. 9).
Nombres vulgares. "Tipilla", "Tipa colorada" (Tucumán, Argentina); "Cocal", "Viraró", "Ajunado" (Bolivia); "Palo mortero", "Ibiráró" (Paraguay).
Etimología. Del griego pteron=ala y gyne=pistilo, aludiendo al pistilo alado.
Distribución geográfica y hábitat. Género con 1 especie: P. nitens Tul., que habita en el sudoeste de Brasil, Bolivia, Paraguay y Argentina. Crece en quebradas, montes ribereños y bosques, entre los 300-1.200 m s.m.
Usos. Especie maderable, importante por su veteado, resistencia y durabilidad, en fabricación de muebles y otros tipos de construcciones (Burkart, 1952: 156; Tortorelli, 1956).
Material de referencia
P. nitens Tul.
BRASIL. "Crescit circa Bahiam", Blanchet 3262, "et in provincia Piauhensi", Gardner 1939 (sintipos P, no vistos).
ARGENTINA. Formosa. en el norte de La Felicidad, IV-1918 (fl), P. Jörgensen 2282 (SI). Jujuy. Depto. Ledesma, ruta 34, Río Zora, 11-III-1986 (fr), E. R. Guaglianone et al. 1820 (SI). 34 km S of Yuto, 22-III- 1994 (fl), C. Taylor et al. 11445 (SI).
BOLIVIA. Santa Cruz. Prov. Velasco, San Ignacio, 26-IV-1986 (fl), R. Seidel & S Beck 187 (SI).
PARAGUAY. Depto. de la Cordillera. San Bernardino, orillas montes, X-1915 (fl), E. Hass-ler 152 (SI).
26. RECORDOXYLON Ducke, Trop. Woods 39: 16. 1934. Especie tipo: Recordoxylon amazonicum (Ducke) Ducke (Melanoxylon amazonicum Ducke).
Flores bisexuales; hipanto cupular, ferrugíneo. Cáliz de 5 sépalos libres, ovado-deltoides, imbricados, caducos. Corola de 5 pétalos subiguales, angosta o anchamente obovados, brevemente unguiculados. Estambres 10, libres, filamentos glabros. Ovario recto, seríceo, pauciseminado, brevemente estipitado, estilo breve, engrosado, incurvo, estigma terminal, ciliolado. Legumbre, lineal, de márgenes paralelos, estipitada, valvas finamente coriáceas, frágiles, sin tabique entre las semillas, con muy angosto margen alado en la sutura placentar, tardíamente dehiscente, no elástica. Semillas subcarinadas en un margen. Árboles medianamente altos, inermes, glabros. Hojas imparipinnadas; folíolos generalmente opuestos, grandes. Panículas terminales, con pubescencia ferrugínea; brácteas y bractéolas pequeñas, tempranamente caducas; flores pediceladas.
Iconografía. Lewis et al. (2005: 148, R. speciosum); Aymard (1998: Fig. 78, R. pulcherrimum).
Etimología. En honor al botánico norteamericano Samuel J. Record (1881-1945) y del griego xylon=madera.
Distribución geográfica y hábitat. Género con 3 especies, principalmente de Brasil, región Amazónica, también en Venezuela, Guyana, Guyana Francesa y probablemente en Suriname y el Perú.
Usos. R. amazonicum es maderable (Uphof, 1968: 445).
Observaciones. Cowan (1973) describe R. irwinii, que es sinonimizado por Lewis (1987) con Melanoxylon brauna Schott. Barneby (1993), realiza cambios nomenclaturales y sinonimiza R. amazonicum (Ducke) Ducke con R. speciosum (Benoist) Gazel ex Barneby, motivo por el cual el género queda constituido por 3 especies, de las 5 que se citaban anteriormente. Ellas son, R. speciosum, R. pulcherrimum Barneby y R. stenopetalum Ducke.
Material de referencia
Melanoxylon amazonicum Ducke
BRASIL. "Habitat in Silva riparia vix vel rarius inundata super Santa Izabel (Rio Negro, civitate Amazonas) A. Ducke, 8-XII-1929" (holotipo RB 23-323, no visto).
R. amazonicum Ducke
BRASIL. Amazonas. Rio Negro, Padauiry, Tapera, 20-XI-1947 (fl), L. Froes 22903 (NY, SI). Rio Negro super Santa Isabel, "silva riparia vix vel non inundabili. Arbor magna, fl. aureis" 8-XII-1929 (fl), A. Ducke, Herb. Jard. Bot. Rio Janeiro 23323 (K).
R. stenopetalum Ducke
BRASIL. Amazonas. Sao Paulo de Olivença, "silva non inundabili. Arbor magna, fl. aureis", 27-I-1937 (fl), A. Ducke, Herb. Jard. Bot. Rio Janeiro 35087 (K).
27. SCHIZOLOBIUM Vogel, Linnaea 11: 399. 1837. Especie tipo: Schizolobium parahybum (Vell.) Blake (Cassia parahyba Vell.). Fig. 5.

Fig. 5. Schizolobium parahyba (Vell.) S. F. Blake. A, hoja e inflorescencia. B, fruto. C, androceo. D, corte longitudinal de flor. E, estambres. F , diagrama floral. G , corte longitudinal de fruto. H, corte longitudinal de semilla. I, transcorte de semilla. Tomado de Bentham 1870: tab. 24, sub s. excelsum.
Flores bisexuales; hipanto oblicuo. Cáliz de 5 sépalos libres, subiguales, ovados-deltoides, imbricados, reflexos. Corola de 5 pétalos, subiguales, ovados, obovados u orbiculares, largamente unguiculados, imbricados. Estambres 10, libres, filamentos escábridos hacia la base, anteras uniformes. Ovario recto, pluriovulado, subestipitado, insertado lateralmente en la pared del hipanto, estilo filiforme, estigma pequeño, terminal. Legumbre recta, comprimida lateralmente, de contorno obovado, coriácea, reticulada. Semilla 1, distal, oblonga, compresa, incluida en una capa membranácea aliforme, de contorno obovado, dentro del pericarpio. Árboles altos, inermes. Hojas bipinnadas, con varios pares de pinnas; folíolos pequeños, numerosos, discolores. Inflorescencias en racimos axilares o panículas terminales, brácteas pequeñas, bractéolas ausentes; flores sobre pedicelos articulados en su parte media o no, éste e hipanto con pubescencia breve, fina, adpresa. Número cromosómico x=13 (Goldblatt, 1981: 431).
Iconografía. Bentahm (1870: tab. 24, S. excelsum); Lewis (1987: 33, Fig. 2 O-S, S. parahyba); Lewis et al. (2005: 151, S. parahyba var. amazonicum); Vellozo (1825: tab. 71).
Nombres vulgares. "Guapuruvú" (Brasil).
Etimología. Del griego schizo=abrirse o dividirse y lobium=pequeña legumbre, aludiendo a las capas en que se separa la legumbre.
Usos. Género ornamental y probablemente para sombra en plantaciones de "Cacao" y "Café" (Lewis, 1987: 33; Lewis et al., 2005: 151). "S. amazonicum" es maderable y de rápido crecimiento (Alvino et al., 2005: 415).
Distribución geográfica y hábitat. Género con 1 especie y 2 variedades según Barneby (1996). S. parahyba (Vell.) Blake var. parahyba, de Brasil, con pedicelos no articulados y anteras 2,3-3,2 mm; y S. parahyba (Vell.) Blake var. amazonicum (Ducke) Barneby, con pedicelos articulados y anteras 1,2-2,3 mm, que se destribuyen desde el sur de México, Centroamérica, por Colombia, Venezuela, Ecuador, Brasil y Perú hasta Bolivia y Paraguay.
Material de referencia
S. parahyba (Vell.) Blake var. parahyba
BRASIL. Paraná (Paranagua), Morro do Tabaquera, "árvore 20 m, mata en costa do Morro, 50 m s.m." 30-I-1966 (fr), G. Hatschbach 13622 (LIL 506791). São Paulo. Jardim Botânico, cultiv. 3-X-1944 (fl), W. Hoehne 52128 (SI).
28. STENODREPANUM Harms, Notizbl. Bot. Gart. Berlin-Dahlem. 7(70): 500. 1929. Especie tipo: Stenodrepanum bergii Harms.
Flores bisexuales, subzigomorfas; hipanto breve, obcónico, glabro. Cáliz de 5 sépalos libres, glabros, 4 superiores oblongos, obtusos a truncados, con 4-9 glándulas negras, lacrimiformes en el ápice, el quinto anchamente elíptico, cóncavo, sin glándulas. Corola de 5 pétalos libres, amarillos y con máculas rojizas internamente, largamente obovados, glandulosos en el dorso, el vexilar con uña larga, glandulosa. Estambres 10, rojizos, libres en 2 ciclos de 5 cada uno, el interno con filamentos pilosos, glandulosos. Ovario lineal, glanduloso; filamento tan largo como el ovario, estigma cóncavo. Legumbre lineal, cilíndrico-torulosa, estriada, apergaminadas, péndulas, falcadas, 3-6 cm long. x 2-2,5 mm diám., 1-5-seminada. Semillas ovoides, dispuestas longitudinalmente, con el funículo espiralado, albuminadas. Sufrútice (10-)20-40 cm alt., perenne con raíces gemíferas, a veces tuberiformes; glabro, con glándulas globosas sésiles dispersas en las ramas. Hojas imparipinnadas, 4-10 cm long., estípulas ovales, membranosas, glabras, 2,5-4 mm long. x 2-2,5 mm lat., con 1-3 pares de pinnas laterales; folíolos 5-9 pares, elípticos, obtusos, 5-12 mm long. x 2-5,5 mm lat., imbricados, herbáceos, con margen crenulado, glanduloso, y con alguna glándula inmersa en el envés. Racimos terminales, laxifloros, 4-14 cm long. con flores de 10 mm long..
Referencias. Ulibarri (1978, 1997a).
Etimología. Del griego stenos=angosto y drepano=hoz, aludiendo al fruto angosto en forma de hoz.
Iconografia. Burkart (1952: Fig. 34); Ulibarri (1978: Fig. 1), Lewis et al. (2005: 146, S. bergii).
Distribución geográfica y hábitat. Género raro con una sola especie; S. bergii Harms, halófito, endémico del centro y oeste de Argentina. Crece preferentemente en lugares salobres, de suelos arcillosos junto con especies de Heterostachys sp. y Atriplex sp. o bien en suelos arenosos con Hoffmannseggia glauca; Nicotiana noctiflora Hook. y Cressa nudicaulis Griseb.
Usos. No se le conocen aplicaciones, aunque probablemente sea melífera.
Material de referencia
ARGENTINA. Catamarca. Depto. Pomán, Salinas de Pipanaco, 25-IV-1973 (fl), P. Cantino 198 (SI). Córdoba. Depto. Tulumba. Totoralejos, "Caesalpinia am Rande der Salinas von Catamarca, 20-V-1875, C. Berg 201" (Lectotipo SI, designado por Ulibarri, Darwiniana 21: 403. 1978. Isolectotipos LP!, CORD!). Totoralejos, Salinas Grandes, 22-II- 1944 (fl, fr), A. Soriano 787 (SI). La Rioja. Depto. Rosario V. Peñaloza, Salinas de Mascasin, 13-XI-1970 (fl), Piccinini & Leguizamóm 1810 (BAB, SI). San Juan. Depto. Valle Fértil, Salinas de Macasín, 14-X-1974 (fl, fr), E. Menese & F. Vervoorst 95 (LIL, SI).
29. TACHIGALI Aubl., Hist. pl. guiane 1: 372. 3: tab. 143. 1775. Especie tipo: Tachigali paniculata Aubl.
Sclerolobium Vogel, Linnaea 11: 395. 1837.
Flores bisexuales, actinomorfas o zigomorfas; hipanto cupular, recto u oblicuo. Cáliz de 5 lóbulos unidos hacia la base, imbricados, subiguales o 2 inferiores, externos más pequeños y engrosados, oblongos, ovados, lineares hasta aristiformes, pubescente externamente, reflexos en la antesis. Corola de 5 pétalos obovados, oblongos, lineares hasta aristiformes, imbricados, subiguales, subunguiculados, el superior interno y recto. Estambres 10 (-15-16), subiguales o 3 más cortos, falcados o sigmoides y engrosados en el medio, filamentos pilosos a hacia la base, anteras dorsifijas o basifijas. Ovario generalmente recto, pauci o pluriovulado, breve o largamente estipitado, central o adnato lateralmente en diverso grado a la pared del hipanto, estilo filiforme o engrosado, estigma terminal, pequeño. Legumbre de contorno oblongo, ovado o elíptico, estipitada, membranácea, dehiscente o no. Semillas 1(-2) ovadas, compresas, incluidas en el andocarpio fibroso. Pequeños o grandes árboles. Hojas pari o imparipinnadas; estípulas lineares, pequeñas o pinnatipartidas, foliáceas o ausentes; pecíolo a menudo con mirmecodomacios, generalemnte proximales; folíolos (1-)3-8(-15) pares, frecuentemente opuestos, coriáceos o subcoriáceos, glabros o pubescentes. Inflorescencias terminales o axilares de racimos o panículas densas; brácteas subuladas; bractéolas subuladas o ausentes; botones florales regulares o marcadamente curvos. Número cromosómico x=13 (12?) (sub Sclerolobium, Goldblatt, 1981: 431).
Referencias. Dwyer (1954, 1957); Howard (1983); Irwin & Arroyo (1974).
Iconografía. Aublet (1775: tab. 143, Fig. 1, T. paniculata; Fig. 2: T. trigona); Bentham (1870: tab. 59, T. multijuga y tab. 12 sub Sclerolobium paniculatum y S. chrysophyllum); Irwin & Arroyo (1974: Fig. 3, sub Sclerolobium prance); Zarucchi (1998: Figs. 84-88); Lewis et al. (2005: 150, T. paniculatum, T. versicolor).
Nombres vulgares. Para T. myrmecophila, "Tachí preto", para T. paniculata, "Tachí".
Etimología. Referido a "tachigali", nombre con el cual un grupo indígena de Guyana designan ciertos árboles habitados por hormigas "tachi" del género Pseudomyrma.
Distribución geográfica y hábitat. Género con ca. 65 especies de América central y Sudamérica: Colombia, Venezuela, Guyana, Surinam, Guayana Francesa, Brasil, Ecuador, Perú hasta Bolivia y Paraguay. Ha sido citado para la Argentina por Zarucchi (1998), sin embargo el autor no ha localizado material que lo documente.
Observaciones. Se acepta la sinonimia de Sclerolobium con Tachigali, realizadas por Barneby (1996), Zarucchi (1998) y Lewis et al. (2005), no obstante, convendría una revisión de todas las especies involucradas para confirmar esa decisión.
Material de referencia
T. cavipes (Spruce ex Benth.) J. F. Macbr.
BRASIL. Amazonas. Manaos. Estrada Campos Salles, "arbor circ. 30 m, radicibus tabularibus...", 11-IX-1946 (fl), A. Ducke 1989 (SI).
T. myrmecophila (Ducke) Ducke
BRASIL. Pará. Belem, Bosque Municipal, 17-VII-1945 (fl), A. Ducke 1706 (SI)
T. paniculata Aubl.
GUYANA "Habitat ad ripam fluvii Sinemariensis, & amnis Galibiensis" (holotipo probable P, no visto, isotipos BM, LINN, no vistos).
BRASIL. Pará. Belem. Agua Preta, "silva non inundabili.fl. pallide flavidis, odoratis", 6-VII-1945, A. Ducke 1713 (SI).
30. VOUACAPOUA Aubl., Pl. guiane Suppl. 9, tab. 373. 1775. Especie tipo: Voucapoua americana Aubl.
Flores bisexuales, actinomorfas, pequeñas; hipanto breve, campanulado. Cáliz de 5 sépalos, libres, ovados, imbricados, subiguales. Corola de 5 pétalos, libres, espatulados, subiguales, imbricados, casi tan largos como el cáliz. Estambres 10, libres, filamentos dilatados en la base, anteras sub-sagitadas. Ovario brevemente estipitado, 1(-2) ovulado, estilo filiforme, más corto que el ovario, estigma pequeño, terminal. Fruto subgloboso, obovoide, atenuado hacia la base, tardíamente dehiscente, 1-seminado. Semilla alargada, exalbuminada, con gruesa testa coriácea. Altos árboles inermes. Hojas imparipinnadas; pecíolo con glándulas entre la inserción de todos los folíolos o sólo en los proximales; estípulas tempranamente caducas; folíolos 2-4 pares, opuestos, glabros. Inflorescencia en panículas terminales, ferrugíneas, alargadas; brácteas y bractéolas pequeñas, caducas.
Iconografía. Aublet (1775: tab. 373); Howard (1983: Fig. 52 reproducción de tab. 373 de Aublet, 1775); Lewis et al. (2005: 161, V. americana).
Nombres vulgares. Para V. pallidior, "Acapú" (Brasil).
Etimología. De wakapú o vouacapou nombre con el que los indígenas Galibis de la Guayana Francesa designan a V. americana, como también acapú.
Distribución geográfica y hábitat. Género con 3 especies de Guayana Francesa y Brasil amazónico.
Usos. V. americana es maderable para diversas construcciones (Ducke, 1939: 90; Plotkin et al., 1991: 9).
Observaciones. Algunas especies publicadas originalmente bajo este género han pasado a Andira Lam. (Papilionoideae), ambos géneros son muy distintos.
Material de referencia
V. americana Aubl
GUAYANA FRANCESA. "Habitat in sylvis Guianae" (holotipo probable P, no visto, isotipo BM , P-J 15671, no visto).
V. pallidior Ducke
BRASIL. Amazonas. Manáos. Estrada do Aleixo, 18-II-1943 (fl), "silva non inundabili...fl. pallide flavis, odoratis", A. Ducke 1183 (SI).
31. ZUCCAGNIA Cav., Icon. 5: 2, tab. 403. 1799, nom. cons. Especie tipo: Zuccagnia punctata Cav.
Flores bisexuales, subzigomorfas, pediceladas; hipanto obcónico, glabro, 1,5-2 mm long., 2,5 mm diám. Cáliz 5-sépalos, glabros, elípticos o subobovados, libres, cuculados, 4-5 mm long. x 1-1,5 mm lat., finamente laciniados, persistentes. Corola 5-pétalos, libres, obovados, amarillos, pétalo vexilar 5-6 mm long. x 4,5-5 mm lat., los restantes 6-7 mm long. x 3 mm lat., de uña breve, con tricomas glandulares en el dorso. Estambres 10, libres, 6-7 mm long. con filamentos pilosos hacia la base; anteras dorsifijas. Ovario central, ovoide a subgloboso, 1-1,5 mm long., pilosos en sus caras laterales, 1-ovulado, estípite 0,5 mm long., estilo 5-6 mm long. alargado y curvo hacia el ápice, estigma apical, cóncavo. Frutos capsuliformes, ovoideagudos, oblicuos, comprimidos, estipitado, 10 mm long. x 6, 5 mm lat., con cerdas castaño-rojizas pilosas, 10 mm long., indehiscentes, 1-seminados. Semillas comprimidas, ovoides, 7 mm long. x 4 mm lat., castañas. Arbustos 1-2, 5 m alt., glutinosos, aromáticos. Hojas pinnadas por reducción, (2-)3-5(-6) cm long.; estípulas tempranamente caducas; folíolos subopuestos, 5-13 pares, elíptico-lineares, raro obovados, 4-14 mm long. x 1-4 mm lat., se hacen menores distalmente; con puntuaciones glandulares en ambas caras. Racimos con flores de 8 mm long., erguidos, laxifloros, del largo de las hojas o algo mayores; brácteas deltoides, glabras, glandulosas; pedicelos 3-5 mm long.
Referencias. Simpson et al. (2004, 2005); Ulibarri (1997a, 2005).
Iconografía. Burkart (1952: Fig. 37); Ulibarri et al. (1994: Fig. 325); Ulibarri (2005: Fig. 1); Lewis et al. (2005: 146, Z. punctata).
Nombres vulgares. "Jarilla macho", "Puspus", "Lata", "Jarilla pispito" (Argentina).
Etimología. Dedicado al físico y botánico italiano Attilio Zuccagni (1754-1807).
Distribución geográfica y hábitat. Género con una sola especie Zuccagnia puntacta Cav., endémica del oeste de Argentina. Elemento de la flora xerófila de la Provincia Biogeográfica del Monte, que se introduce brevemente por el norte hasta el sudoeste de la provincia de Jujuy y al oriente hasta Córdoba. Crece en cerros y llanos entre los 700-2.700 m s.m. Tiene cierto parecido con las verdaderas "jarillas", especies del género Larrea (Zygophyllaceae), con las cuales convive. Por su hábito presenta cierto parecido con Caesalpinia s. l., más que con Hoffmannseggia que son generalmente herbáceas. De ambas, lo mismo que de Balsamocarpon, se diferencia muy bien por su fruto.
Usos. Tiene aplicaciones medicinales y sus ramas se usan para techar (Burkart, 1952: 185; Del Vitto et al., 1997: 62). Antifúngico (Svetaz et al., 2004).
Material de referencia
ARGENTINA. Córdoba. Depto. Cruz del Eje, Serrezuela, 8-XI-1945 (fl), A. Cuezzo 1049 (LIL 133010). Jujuy. Depto. San Antonio, Los Misos, 27-VII-1969 (fl), A. A. Vaca 398 (LIL 510488). La Rioja. Depto. Chilecito, Nonogasta, 28-XII-1928 (fl), S. Venturi 7820 (SI). Mendoza. "Habitat in Chilenibus montibus, in tractu a Portillo usque ad scaturigenes vulgo Manantiales" (holotipo MA no visto, Imagen Digital SI!). Depto. Luján de Cuyo, Cacheuta, 10-IV-1937 (fr), A. Burkart 8387 (SI). Salta. Depto. Guachipas, Qda. de Guachipas, Punilla, A. Castellanos s. n. (BA 46789). San Juan. Depto. Iglesia, entre La Ciénaga e Iglesia, 9-I-1980, A. Cabrera et al. 27010 (SI).
2. TRIBU CASSIEAE Bronn, Form. pl. legumin: 78, 127, 130, 1822; emend Irwin & Barneby, Mem. New York Bot. Gard. 35(1): 1.1982.
Poeppigieae Britton & Rose, N. Amer. fl. 23(4). 201.1930 (sinonimia fide Lewis, 2005: 111).
Tribu que comprende unos 20 géneros tropicales y subtropicales; 9 de ellos nativos. Número cromosómico generalmente x=7 ó 14 (Goldblatt, 1981: 431).
Referencias. Banks et al. (2003); Lewis (2005).
Clave de los géneros
Modificación de la clave de Irwin & Barneby (1981)
1 Hojas 1-folioladas a imparipinnadas. Inflorescencia cimosa-paniculada. Legumbre drupácea, samaroide a discoidal, en estos casos papirácea; generalmente alada sobre una sutura o en ambas, 1-pauciseminada, tardíamente dehiscente....2
1. Hojas paripinadas, a veces reducidas a 2-folioladas. Inflorescencia generalmente racemosa espiralada o si paniculada, compuesta de racimos parciales, a veces reducida a 1-2-floras. Generalmente legumbre típica, a veces alada a lo largo de las suturas, nunca drupácea, dehiscente o no, frecuentemente pluriseminada ........................ 6
2(1).Receptáculo plano a subconvexo. Sépalos 5-6. Pétalos (1-)2-5 o ausentes. Estambres hipóginos 2-6(-10) ..... 3
2. Receptáculo cóncavo. Sépalos y pétalos 3. Estambres periginos, (2-)3
2. Apuleia
3(2). Flores apétalas o con (1-)-2 pétalos menores que los sépalos y naciendo abajo de un disco hipógino. Legumbre drupácea.
6. Dialium
3. Flores con 3-5 pétalos más largos que los sépalos, sin disco hipógino. Legumbre samaroide a discoidal ....... 4
4(3). Pétalos 3, blanquecinos. Estambres 2, anteras o una de ellas, 8-10-locular distalmente.
7. Dicorynia
4. Pétalos 5, generalmente amarillos. Estambres 4-5, anteras 2-loculares .................................. 5
5(4). Estambres no orientados marcadamente hacia el centro de la flor durante la antesis; anteras más largas que los filamentos, éstos no abruptamente contraídos apicalmente.
8. Martiodendron
5. Estambres marcadamente orientados hacia el centro de la flor (casi 90°) durante la antesis, anteras más cortas que los filamentos, éstos abruptamente contraídos apicalmente.
1. Androcalymma 6(1). Cáliz gamosépalo. Pedicelo bibracteolado en el medio. Estambres rectos y casi de igual longitud; anteras con dehiscencia longitudinal.
9. Poeppigia
6. Cáliz dialisépalo. Pedicelo bibracteolado basalmente, en el medio o apicalmente. Estambres generalmente hetero-mórficos, anteras con dehiscencia apical o basal ...................................................... 7
7(6). Pedicelos con 2 bractéolas basales. Filamentos de los 3 estambres abaxiales muy largos y con curvaturas sigmoides; anteras con dehiscencia introrsa por ranuras; los adaxiales rectos cortos y anteras con dehiscencia basal. Estípulas a veces 2-lobadas. Legumbre cilíndrica a subcompresa, indehiscente.
3. Cassia
7. Pedicelos bibracteolados o no. Filamentos todos derechos, más cortos o no que las anteras, a menudo 3 abaxiales más largos que los restantes y con dehiscencia apical. Estípulas simples. Legumbre variada dehiscente o no ...... 8
8(7). Bractéolas ausentes. Androceo comúnmente zygomorfo, 3 estambres adaxiales frecuentemente estaminodios, a veces 10 subiguales; anteras desnudas a lo largo de sus suturas. Nectarios extraflorales sobresalientes, claviformes, o ausentes. Legumbre indehiscente o con dehiscencia no elástica.
10. Senna
8. Bractéolas 2, cerca del medio o apicales. Androceo subactinomorfo, los 2 ciclos de anteras frecuentemente de diferente longitud pero no zigomorfos dividiendo en 2 zonas (adaxial y abaxial) a la flor, anteras ciliadas a o largo de sus suturas. Nectarios extraflorales en disco, acopados o ausentes. Legumbre dehiscente elásticamente.
5. Chamaecrista
1. ANDROCALYMMA Dwyer, Ann. Missouri Bot. Gard. 44: 295, Fig. 1. 1957. Especie tipo: Androcalymma glabrifolium Dwyer.
Flores bisexuales, actinomorfas. Receptáculo plano, carnoso. Cáliz de 5 sépalos, libres, imbricados, oblongos a ovados, subiguales, sépalos 3 mm long. x 1,8-2 mm lat., carnosos, de margen ciliolado, con pubescencia breve externamente. Corola de 5 pétalos libres, subiguales, pétalos 4-6,5 mm long. x 1,7-2 mm lat., obovados, unguiculados, con uña carinada y glabra internamente, pubescente externamente. Estambres 4, libres, estambres 2-3 mm long., filamentos subcarnosos, anteras ovadas, subrectas o deflexas, subversátiles, conectivo delgado, ápice bipórico. Ovario subovoide, ca. 2 mm long., 2-3-ovulado, pubescente, subestipitado, estilo brevísmo. Fruto desconocido. Arboles altos, ca. 30 m alt., inermes. Hojas imparipinnadas; estípulas desconocidas; pecíolo 3-6 cm long., folíolos opuestos o alternos, ovado-elípticos, 4,5-10 cm long. x 2,5-5,5 cm lat., agudos, coriáceos. Inflorescencia cimosa en panículas terminales, flores pediceladas, de aprox. 5-6,5 mm long., brácteas y bractéolas tempranamente caducas.
Iconografía. Lewis et al. (2005: 118, A. glabrifolium).
Etimología. Del griego andros=hombre y calyma=capucha, aludiendo a la antera deflexa que semeja a un caperuza desenfundada.
Distribución geográfica y hábitat. Género con 1 especie en selva tropical del Brasil, A. glabrifolium Dwyer.
Observaciones. Género poco conocido, por sus caracteres florales estaría relacionado con Apuleia, Dicorynia y Martiodendron.
Material de referencia
BRASIL. Munic. Sao Paulo de Olivença, basin of Creek Belém (fl), "terra firma, high land, Amazonas" Krukoff 9005 (holotipo MO, no visto, isotipo NY, Imagen Digital 3402!).
2. APULEIA Mart., Herb. Fl. Bras. 123. 1837 "Apuleja" nom. cons. Especie tipo. Apuleia leiocarpa (Vog.) Macbr. (Leptolobium [?] leiocarpum Vog.).
Zenkeria Arnott, Mag. Zool. & Bot. 2: 548. 1838 (no vista).
Apoleya Gleason, Phytologia 1: 143. 1935.
Flores pequeñas, frecuentemente polígamas; hipanto breve, turbinado. Cáliz de 3 sépalos, libres, imbricados, oblongos, reflexos. Corola de 3 pétalos, libres, levemente imbricados, oblongo-elípticos, atenuados hacia la base, subsésiles. Estambres (2-) 3, atenuados distalmente; anteras oblongas, erectas, basifijas. Ovario elipsoide, pubescente, 1-2-ovulado, subestipitado, estípite adnato al hipanto, estilo incurvo, estigma terminal. Legumbre de contorno oblicuamente elíptica, comprimida lateralmente, de extremos aguzados, estipitada, coriácea, indehiscente, 1-2-seminada. Árboles inermes. Hojas imparipinnadas; estípulas pequeñas, tempranamente caducas (?); folíolos alternos, subcoriáceos o coriáceos, glabros. Inflorescencias cimosas axilares breves; flores 4-5 mm long., sobre pedicelos de 5-6 mm long., blanquecinas; brácteas pequeñas; bractéolas ausentes. Número cromosómico x=14, 12 (Goldblatt, 1981: 431).
Referencias. Bolzon de Muñiz & Marchiori (2005); Macbride (1943); Ulibarri (1997a); Zaruc-chi (1998).
Iconografía. Bentham (1870: tab. 46, A. praecox); Zarucchi (1998: Fig. 1); Lewis et al. (2005: 115, A. leiocarpa).
Nombres vulgares. Para A. leiocarpa, "Garape", "Grapia" (Brasil); "Ibirá peré" (Paraguay, Argentina); "Grapia", "Grapiapuña", "Grapia marilla" (Argentina); "Garapo" (Perú).
Etimología. En homenaje a Lucius Apuleus Madaurensis, escritor y filósofo platónico de la segunda centuria de nuestra era.
Distribución geográfica y hábitat. Género con 1-2 especies en Colombia, Venezuela, Ecuador, nordeste de Perú, Paraguay, sur de Brasil y noreste de Argentina. La más conocida es, A. leio-carpa (Vog.) J. F. Macbr.
Usos. Maderable.
Material de referencia
A. leiocarpa (Vog.) J. F. Macbr.
ARGENTINA. Misiones. Depto. Iguazú. Salto Iguazú, 8-IX-1910 (fl), Rodríguez 423 (SI).
BRASIL. Rio Grande do Sul. Salvador do Sul, Boa Vista, 13-IV-1974 (fr), R. M. & M. M. Klein 11101 (SI). Leptolobium leiocarpum Vog., "Sello leg. in Brasilia" (holotipo B†, isotipos probables R, BM, no vistos).
3. CASSIA L., Sp. pl. 378. 1753. Especie tipo: Cassia fistula L.
Cathatocarpous Pers., Syn. pl. 1: 459. 1805.
Bactyrilobium Willd. Enum. hort. berol.: 439. 1809.
Cassia sect. Fistula DC ex. Colladon, L., Hist. Cass.: 83.1809.
} Cassia sensu Link, Handbruch 2: 138. 1831.
Flores bisexuales, zigomorfas; hipanto inconspicuo. Cáliz de 5 sépalos, imbricados, ovados, oblongo-elíticos a obovados u orbiculares, reflexos en la antesis, deciduos: Corola de 5 pétalos, obovados a elíptico-oblongos, unguiculados o subsésiles, el vexilar diferenciado e interno. Estambres 10, irregularmente acrescentes abaxialmente, diferenciados (a): 3 abaxiales de largos filamentos curvados y a menudo engrosados o dilatados en su parte media, con dehiscencia ventral rimosa y basal poricida; (b): 2 adaxiales menores, erectos, pero curvados en el ápice, generalmente estériles; (c): 4 medianos, erectos con anteras poricida basalmente; (d): 1 muy pequeño, anterovexilar, estéril. Ovario estipitado, linear, incurvo, pluriovulado; estilo poco diferenciado; estigma pequeño, ciliolado. Legumbre linear, brevemente estipitada, terete o subcompresa, péndula, valvas leñosas o cartáceas, generalmente septada internamente y de consistencia variada, indehiscente, pluriseminda. Semillas obovoides o elipsoides, biconvexas. Árboles de hojas paripinnadas; estípulas simples o 2-lobadas, usualmente caducas; folíolos numerosos, pequeños. Inflorescencias racemosas; pedicelos bibracteolados en su base; flores vistosas de corola generalemente amarilla o rosada, menos frecuente roja o blanca. Número cromósomico x=12, 14 (Goldblatt, 1981: 431).
Referencias. Irwin & Barneby (1981 y 1982a).
Iconografía. Brenan (1967: Fig. 11, C. afrofistula); Irwin & Barneby (1981: Fig. 1, 9a, C. burtii); Irwin & Barneby (1982a: Figs. 1-8); Lewis et al. (2005: 124, C. hippophallus, C. javanica, C. moschata).
Nombres vulgares. Para C. fistula, "Cañaflote" (Venezuela), "Caña fístula" (Argentina).
Etimología. Derivado del antiguo nombre griego casia aplicado a la especie tipo C. fistula.
Distribución geográfica y hábitat. Género con ca. 30 especies circumtropicales; América, Africa, Madagascar, Asia y Australia. En América se registran entre nativas y cultivads unas 14 especies; 11 nativas en Sudamérica.
Usos. Numerosas especies son ornamentales: C. fistula L., C. grandis L. f. (de flores amarillas), C. javanica L. (de flores rosadas); otras medicinales, C. sieberiana DC., C. alata L. (Uphof, 1968: 111-112; Watt & Breyer-Brandwijk, 1962: 568, 573) y otras como industriales o maderables, C. roxburghii DC., C. grandis, C. fistula (Burkill, 1966: 481; Dassanayake & Fosberg, 1991: 64, 65).
Material de referencia
C. fastuosa Willd. ex Benth.
BOLIVIA. Pando. Prov. Muripi, Trocha entre Campamento Bay y Curichón, 18-X-1989 (fl), S. Beck et al. 19522 (SI).
BRASIL. Pará. Belem, 25-VIII-1948 (fl), A. Ducke 2159 (SI).
C. fistula L.
"Habitat in America" (holotipo LINN, no visto, microfilm IDC 528.15- No. 308 SI!).
ECUADOR. Guayas. Guayaquil, cultv. semillas provenientes de Brasil, 17-XII-1964 (fl), A. de Delgado 117 (SI).
C. grandis L. f.
VENEZUELA. Guárico. Los Bancos, al S de Calabozo, 17-III-1946 (fr), A. Burkart 16055 (SI).
C. leptophylla Vogel
BRASIL. Santa Catarina. 22-XI-1944 (fl, fr), R. Reitz C852 (SI)
4. CHAMAECRISTA [Bryne] Moench, Meth. pl. hort. bot. Marburg. 272. 1794. Especie tipo: Chamaecrista nictitans (L.) Moench (Cassia nictitans L.). Fig. 6.
Cassia sect. Lasiorhegma Vogel, Syn. gen. Cass.: 8. 1837.
Cassia subgen. Absus (DC) Symon, Trans. Roy. Soc. S. Australia 90:77. 1966.
Chamaecrista sensu Greene, Pittonia 3: 238-243. 1897.

Fig. 6. Chamaecrista repens (Vogel) H. S. Irwin & Barneby. A, planta. B, nudo foliar con detalle de su base, estípulas, glándula peciolar e inflorescencia con botones florales y flor en antesis. C, androceo y gineceo. D, fruto. Tomado de Burkart 1987: 523, fig. 236.
Flores bisexuales; hipanto plano. Cáliz de 5 sépalos imbricados, subiguales, ovado-lanceolados, delicadamente nervados. Corola irregular, de 5 pétalos heteromórficos, generalmente obovados y brevemente unguiculados, 1 de los abaxiales asimétrico, mayor, cuculado, a veces resupinado, frecuentemente protegiendo en parte al androceo, el vexilar interno o externo en la prefloración. Androceo irregularmente actinomorfo, los 2 ciclos frecuentemente de distinta longitud, pero sin formar simetría bilateral. (2-)5-10-meros, anteras basifijas más largas que los filamentos, estos rectos o ligeramente curvos, iso o heteromórfas, con dehiscencia apical poricida o brevemente fisural, pulvurulentas o cilioladas a lo largo de sus suturas. Ovario linear, sésil, generalmente piloso, pluriovulado, estilo incurvo; estigma apical, pequeño. Legumbre linear, comprimida lateralmente, raro alada a lo largo de sus suturas, papirácea, coriácea o subleñosa, elasticamente dehiscente con las valvas longitudinalmente espiraladas, generalmente plurisemindas. Semillas comprimidas, obovoides, romboides o trapezoides con puntuaciones translúcidas. Árboles, arbustos o hierbas anuales o perennes. Hojas paripinnadas, a veces filodios en especies australianas o nulas, estípulas presentes; folíolos 1-numerosos pares; nectarios peciolares cuando presentes generalmente discoides, sésiles o pedicelados. Inflorescencias racemosas, 1-plurifloras; pedicelos 2-bracteolados; flores amarillas o anaranjado-rojizas. Número cromosómico x=14, 8 (7) (Goldblatt 1981: 431)
Referencias. Irwin & Barneby (1981, 1982a).
Iconografía. Burkart (1978: Figs. 234-237, C. flexuosa, C. repens, C. rotundifolia, C. serpens); Irwin & Barneby (1981: Fig. 1, 11a, C. cathartica); Irwin & Barneby (1982a: Figs. 36-53); Lewis et al. (2005: 122, C. desvauxii, C. nigricans, C. ochnacea).
Etimología. Del griego chamai=enano , de crecimiento rastrero y del latín crista=cresta, probablemente aludiendo al aspecto rastrero de algunas especies, y a la cresta de sus pinnas o a la disposición de los estambres.
Distribución geográfica y hábitat. Género con ca. 350 especies y 6 secciones, principalmente tropicales, en su mayoría del Nuevo Mundo, ca.146 especies sudamericanas con gran diversidad especialmente en el Brasil. En el Viejo Mundo en cambio están presentes la sección monotípica Absus y numerosas especies de la sección Chamaecrista.
Usos. Forrajeras y medicinales. C. mimosoides (L.) Greene, C. rotundifolia (Pers.) Greene y C. desvauxii (Collad. ) Killip, C. absus (L.) H. S. Irwin & Barneby son usadas además como alimenticias y para la fabricación de bebidas; C. diphylla (L.) Greene y C. flexuosa (L.) Greene, y probablemente otras, serían útiles para el mejoramiento agrícola y como recursos naturales útiles.
Material de referencia
C. absus (L.) H. S. Irwin & Barneby
PERU. Lambayeque. Depto. Lambayeque. Portachuelo de Olmos, naturalizada?, 21-IV-1981 (fl, fr), S. Llatas Quiroz 602 (SI).
C. desvauxii Collad. var. brevipes (Benth.) H. S. Irwin & Barneby
BOLIVIA. Beni. Prov. de Vaca Diez. 37 km E of Riberalta on road to Guayaramerín, 21-V-1982 (fl), J. C. Solomon 7724 (MO, SI).
C. diphylla (L.) Greene
BRASIL. Tapera-Pernambuco, Tapera, VIII-1930 (fl, fr), D. Pickel 30 (SI).
C. nictitans L
ESTADOS UNIDOS. "Habitat in Virginia" (holotipo LINN, no visto, microfilm IDC 528.31-No. 309-33 SI!).
C. rotundifolia (Pers.) Greene
ARGENTINA. Entre Ríos. Depto. Gualeguaychú, río Ceibas al SE del Arroyo Ñancay, 12-IV-1963 (fl, fr), A. Burkart & N. Troncoso 24181 (SI).
6. DIALIUM L., Mant. 1: 3, 11. 1767. Especie tipo: Dialium indum L. Fig. 7.
Dansera Steenis, Bull. Bot. Gard. Buitenzorg 3, 17: 413. 1948.

Fig. 7. Dialium guianense (Aubl.) Sandwith. A, rama en flor. B, frutos. C, botón floral. D, flor en antesis. E, corte longitudinal de flor. F y G, estambres. H, transcorte de ovario. I, corte longitudinal de ovario. J, semillas. K, corte longitudinal de semilla. Tomado de Bentham 1870: Tab. 47, sub D. divaricatum.
Flores bisexuales, zigomorfas, pequeñas. Disco presente o ausente. Cáliz de (3-)5-6 sépalos, imbricados. Corola con (0-)1-5 pétalos, unguiculados.
Estambres 2-6(-10), filamentos breves o más largos que las anteras, rectos o curvados, anteras oblongas, erectas. Ovario 2-ovulado, sésil o subestipitado, con el estípite adnato al breve hipanto, estilo breve, subulado, estigma terminal, pequeño. Fruto piriforme, discoide u ovoide-globoso, raro compreso, indehiscente, endocarpo frecuentemente carnoso, epicarpo coriáceo. Semillas 1-2, regularmente compresas, generalmente reniformes. Árboles inermes, rara vez arbustos. Hojas 1-folioladas a impa-ripinnadas, hasta 21 pares, ocasionalmente 1-folioladas por reducción, folíolos generalmente alternos y coriáceos; estípulas pequeñas. Inflorescencias cimosas-paniculadas, axilares o ternimales; brácteas y bractéolas pequeñas, caducas. Número cromo-sómico x=14 (Goldblatt, 1981: 431).
Referencias. Steyaert (1951, 1953); Brenan (1967); Ross (1977); Irwin & Barneby (1981); Rojo (1996); Herendeen et al. (2003).
Iconografía. Brenan (1967: Fig. 17, D. orientale); Exell & Mendoça (1956: tab. 39, D. englerianum; tab. 40, D. angolense); Ross (1977: Fig. 15, D. schlechteri); Lewis et al. (2005: Fig. 120, D. guianense, D. madagascariense, D. orientale, D. unifoliolatum).
Etimología. Probablemente del griego "dialion, dialyo"=separación, libre, en referencia al reducido número o ausencia de pétalos.
Distribución geográfica y hábitat. Género con ca. 28 especies pantropicales, principalmente oeste de Africa, Madagascar, pocas en Asia; ausentes en Australia e Islas del Pacífico. En América una especie, D. guianense (Aubl.) Sandwith, desde el S de México a través de América Central hasta Colombia, Ecuador, Perú, Bolivia y Brasil. Frecuentes en selvas tropicales, a lo largo de ríos, matorrales y pantanos; de bajas y medianas latitudes, llegando hasta los 1150 m s.m. en Asia; también en ambientes de costa, secos y arenosos de Africa.
Usos. D. indum es maderable y sus frutos son comestibles; también son comestibles los frutos de D. maingayi Baker; D. ovoideum Thwaites y D. platysepalum Baker, todos de Asia (Hutchinson, 1964: 231; Uphof, 1968: 177).
Material de referencia
D. guianense (Aubl.) Sandwith
BOLIVIA. Pando. Amazonia, W bank of Rio Madeira opposite Abuna, "forest on terra firme, tree 18 m. x 25 cm diam", 9-VII-1968 (fr), G. Prance et al. 5700 (NY, LIL 564075).
BRASIL. Territorio do Amapá. Rio Oiapoque, 19-X-1950 (fl), "arvore 10 m, fl verde-amareladas", R. L. Fróes 26682 (SI). Pernambuco. Tapera, XII-1930 (fl), D. Pickel 199 (SI).
D. indum L.
MALASIA. (Holotipo LINN, no visto, microfilm IDC 23.1-No. 6 SI!).
7. DICORYNIA Benth., in Hooker, J. Bot. 2:82. 1840; emend. Benth., in Mart., Fl. bras. 15(2): 81. 1870. Especie tipo: Dicorynia paraensis Benth. Fig. 8.
Fig. 8. Dicorynia paraensis Benth. A, rama en flor. B, flor sin los pétalos para mostrar el andoceo. C y D, transcorte de anteras. E, diagrama floral. F , corte longitudinal de ovario. G , fruto; H, corte longitudinal de fruto. I y J, corte longitudinal y transcorte de semilla respectivamente. Tomado de Bentham 1870: tab. 29.
Flores bisexuales; hipanto breve. Cáliz de 5 sépalos, libres, imbricados, pubescentes externamente, ciliados; 3 externos envolviendo a toda la flor, 1 adaxial y 2 laterales, ovados, cóncavos, engrosados, coriáceos; 2 inferiores, internos, angostamente ovados a oblongos, levemente cóncavos, delgados, subcoríaceos. Corola de 3 pétalos, libres, imbricados, blancos a rosado-blanquecinos, unguiculados; el adaxial generalmente mayor; uñas angostas, de coloración oscura; lámina ancha, elíptica a orbicular, frecuentemente emarginados, pubescentes externamente, tempranamente caducos. Estambres 2, libres, desiguales, filamentos engrosados, blanquecinos; anteras amarillentas, 8-10 tecas, erectas en el menor, 4-8 tecas, incurvas en el mayor. Pistilo sésil, pubescente, ovario 3-6-ovulado, estilo incurvo distalmente; estigma pequeño, levemente capitado. Legumbre de contorno ovado, oblicua, bien comprimida lateralmente, fina, coriácea, finamente pubescente, con la sutura superior angostamente alada, dehiscente tardíamente. Semilla (1-) 2, transversas, suborbiculares, compresas. Medianos a grandes árboles, inermes. Hojas alternas, imparipinnadas; estípulas tempranamente caducas; folíolos 5-13, alternos a subopuestos, ovado-elípticos u obovados, generalmente mayores distalmente, agudos a acuminados, coríaceos, pubérulos a pubescentes. Inflorescencias en tirsos terminales; flores numerosas, pediceladas; brácteas y bractéolas tempranamente caducas.
Referencia. Koeppen (1967).
Iconografía. Bentham (1870: tab. 29, sub D. paraensis); Irwin & Barneby (1981: Fig. 1, 7 a-c, D. paraensis); Koeppen (1967: Figs. 1-7); Lewis et al. (2005: 121, D. guianensis); Taubert (1891-94: Fig. 90 E-G, D. paraensis).
Etimología. Del griego di=dos y corynia=clava o maza, en alusión a la forma claviforme de sus estambres.
Distribución geográfica y hábitat. Género con 2 especies, una de ellas D. paraensis con 4 variedades. Su distribución abarca Venezuela, Colombia, Guyana, Suriname, Guayana Francesa y Brasil. Común en zonas anegadizas, pero también de tierra firme.
Usos. D. guianensis es maderable y se usa para para extracción de resinas.
Observaciones. El género Dicorynia es fácilmente distinguible del resto de las Cassieae por su pistilo sésil, 3 pétalos de lámina ancha y 2 estambres desiguales en su longitud y forma, de filamentos engrosados; además uno de ellos con 8-10 tecas, carácter único dentro de las Leguminosae.
Material de referencia
D. guianensis Amshoff
SURINAME. Forest Reserva, Sectie 0, tree 44, 20-II-1924 (fr), Forestry Bureau 6371 (LIL 261218).
D. paraensis Benth.
BRASIL. "Pará" L. C. Richard s. n. (holotipo P, no visto). Amazonas. Manáos, Igarapé da Cachoeira Grande, "ad ripas inundata, arbor magna, p&ala alba, stamina lutea", 25-5-1941 (fl, fr), A. Ducke 727 (SI).
D. paraensis Benth. var. macrophylla (Ducke) Koeppen
BRASIL. Amazonas. Tonantis, 4-XII-1940 (fl), A. Ducke s. n. (SI)
8. MARTIODENDRON Gleason, Phytologia 1: 141. 1935. Especie tipo: Martiodendron excelsum (Benth.) Gleason (Martiusia excelsa Benth.).
Martia Benth., in Hook. J. Bot. 2: 84. 1840, non Spreng. 1818.
Martiusa Benth., in Hook. f. , Gen. pl. 1: 571. 1863, in synon., sphalm.
Flores bisexuales, zigomorfas. Cáliz de tubo breve, sépalos 5, libres, subvalvares, desiguales, pubescentes en ambas caras, reflexos durante la antesis. Corola amarilla o anaranjada, de 5 pétalos, imbricados, libres, obovados, de uña breve, el ada-xial más ancho y cubierto por los laterales. Estambres 4-5(-7), libres, 4 laterales funcionales, alternipétalos, los otros, 1-3 cuando presentes, reducidos; cuando hay estaminodios presentes, hasta 5, aciculares, sin anteras; filamentos breves y engrosados; anteras, mayores que los filamentos, alargadas, sagitadas con dehiscencia apical, poricida. Ovario sésil, glabro o pubescente, 1-ovulado; carpelo 1 o menos frecuente con 2 unidos basalmente, pero la porción apical, estilo y estigma libres; estilo glabro, subulado, estigma pequeños, levemente capitado. Fruto sámara, de contorno elíptico u oblongo, muy comprimida lateralmente, coriácea, alada en ambas suturas, finamente pubescente o glabra, indehiscente. Semilla central, generalmente 1. Pequeños a grandes árboles, inermes; pubescencia dorado-castaña en partes jóvenes. Hojas imparipinnadas, alternas; estípulas tempranamente caducas; folíolos alternos, 15-11(-13), ovados-elípticos u oblongos, de base obtusa o cordada, ápice agudo acuminado o emarginado. Inflorescencia en largo tirso terminal; brácteas y bractéolas tempranamente caducas; pimpollos florales angostamente ovoides, acuminados hacia el ápice, de base gibosa; flores vistosas.
Referencias. Koeppen & Iltis (1962).
Iconografía. Bentham (1870: tab. 27, sub Martia excelsa); Koeppen & Iltis (1962: Figs. 1-6); Lewis et al. (2005: 118, M. excelsum, M. parviflorum); Stergios (1998, Fig. 71, M. excelsum).
Nombres vulgares. Para M. elatum, "Jutahysica", "Muirapichuna" (Brasil); M. excelsum, "Tata-buballi" (Suriname); M. parviflorum , "Witte pur-perhart", "Boschmahonie", "Bosmahonie", "Tataboballi" (Suriname) (fide Koeppen & Iltis, 1962).
Etimología. En honor a Carl F. P. Martius (1794-1868), botánico y explorador germano e inspirador de la Flora Brasiliensis, y del griego dendron =árbol.
Distribución geográfica y hábitat. Género con 4 especies. Sudamérica tropical: S Venezuela, Guyana, N, NO y NE de Brasil.
Usos. Al parecer no hay datos acerca de la importancia económica del género, pero debido a la durabilidad de su madera, podría tener aplicaciones en construcciones navales y otras (Koeppen & Iltis, 1962: 199).
Material de referencia
M. elatum (Ducke) Gleason
BRASIL. Pará. Marabá. Río Teocantins, 9-VI-1949 (fl, fr), R. Froés & G. Black 24361 (SI)
M. excelsum (Benth.) Gleason
BRASIL. Amazonas. Rio Branco, ad ripas altas ostii affluentis Cauamé, 10-IX-1943, (fl), Ducke 1389 (SI).
GUYANA "Habitat in Guiana anglica ad ripas fluv. Rupununy, Essequebo superioris & Quitaro", R. Schomburgk 589 (Lectotipo K, designado por Koeppen & Iltis, Brittonia 14(2): 200. 1962, no visto).
9. POEPPIGIA C. Presl, Symb. bot. 1: 16, tab. 8. 1830. Especie tipo: Poeppigia procera C. Presl.
Flores bisexuales, subzigomorfa; hipanto, 1,5 mm long., 10-nervado, pubescente. Cáliz campanulado, 3-3,5 mm long., pubescente, de 5 sépalos deltoides, divididos a partir del medio del tubo, raro desde la base, pubescentes internamente, 2 x 2 mm. Corola de 5 pétalos libres, largamente elíptico-obovados, levemente subiguales, amarillos, 10-12 mm long x 3 mm lat., con pelos en el dorso de la uña, el superior recto y los restantes curvos. Estambres 10 libres, de casi igual longitud filamentos glabros, anteras dorsifijas, oblongas u ovadas, versátiles. Ovario recto, 8-10- ovulado, estípite 3-5 mm long. pubérulo hacia el ápice, central y libre, estilo breve, estigma pequeño, terminal. Legumbre recta, estipitada, 8-10,5 cm long. x 1-1, 5 cm lat., glabra.membranácea, fina, comprimida lateralmente, angostamente alada a lo largo de la sutura placentar. Semillas transversas, ovoides. Árboles 5-18 m alt., 30 cm diám., inermes, con leve pubescencia en partes juveniles. Hojas paripinnadas, 3,5-10 cm long., raquis pubérulo folíolos (7-)10-20(-30) pares, oblongos, de ápice obtuso, glabescentes, 10-12 mm long. x 2,5-5 mm lat. Inflorescencia cimosa, terminal, breves; brácteas y bractéolas angostas, membranáceas, tempranamente caducas; pedicelos florales, pubescentes, 3-5 mm long., bibracteolados en su parte media; flores 12-13 mm long.
Iconografía. Bentham (1870: tab. 14, P. procera var. conferta); McVaugh (1987: Fig. 14, P. procera); Lewis et al. (2005: 113, P. procera).
Nombres vulgares. "Faveira do mato", "Coração de negro", "Cabo de machado" (Brasil); "Guaje" (México); "Plumillo" (Guatemala); "Caricari" (Bolivia).
Etimología. Nombre dedicado en honor al naturalista y explorador Eduard Friedrich Poeppig (1798-1868), profesor de la Universidad de Leipzig (Alemania).
Distribución geográfica y hábitat. Género con 1 especie, P. procera C. Presl, que crece en México, Centro América, Cuba, Colombia, Venezuela, Perú, Bolivia y Brasil.
Usos. Maderable y medicinal.
Observaciones. Polhill (1994) lo ubica dentro de la tribu Caesalpinieae; Lewis et al. (2005) sobre la base de trabajos moleculares de Bruneau et al. (2001) y Herenden et al. (2003) lo ubica dentro de la tribu Cassieae.
En el material estudiado no se ha podido comprobar que el estípite esté adnato al hipanto o tubo calicinal (Hutchinson, 1964;, Polhill & Vidal, 1981), observándose, en cambio, libre y central.
Material de referencia
BOLIVIA. Santa Cruz. Velasco, Parque Nac. Noel Kempff, El Encanto, bosque alto en pie de monte, 250 m s.m., 26-VI-1993 (fr), M. Saldías et al. 2727 (LIL 601036). Prov. Guarayos, 5 km al S de las instalaciones de Perseverancia, 280 m s.m., bosque poco alterado, ocasionalmente inundado, 5-X-1992 (fr), I. G. Vargas et al. 1694 (LIL 601431).
BRASIL. Bahía. Boninal, alrredores de Bahía, 24-XI-1985, in caatinga (fl), G. Hastchbach & J. M. Silva 50159 (SI). Minas Geraes. Lago Santa, 8-IV-1865 (fr), E. Wraming 2752 (SI). Piauí. Munic. de São Raimundo Nonato, S. E., 220 km de Petrolina, 19-I- 1982, caatinga aberta, 320 m s.m. (fl), G. Lewis & H. Pearson 1125 (K).
CUBA. "Habitat in sylvis siccis insulae Cubae. Poeppig, fl julio" (holotipo probable PR, no visto, isotipos probables BM, GOET, H, HAL y W, no vistos).
10. SENNA [K. Bauhin] Miller, Gard. Dict. , Abr. ed. 4, 3. 1754. Especie tipo: "Senna alexandrina sive foliis acutis Caspar Bauhin Pinax 397" =Senna alexandrina Mill., 1768 (Irwin & Bar-neby, 1982a: 35). Fig. 9.
Cassia sect. Senna DC ex Colladon, Hist. Cass.: 92. 1816.
Cassia subgen. Senna Benth., in Mart., Fl. brasil. 15(2): 96. 1870 y Trans. Linn. Soc. London 27: 513. 1871. Cassia sect. Senna sensu Benth., in Benth. & Hooker, Gen. pl. 1(2): 572. 18652.

Fig. 9. Senna corymbosa (Lam.) H. S. Irwin & Barneby. A, rama florífera. B, glándula raqueal entre los folíolos inferiores. C, cáliz, cara abaxial. D, pétalos. E, flor sin los pétalos, mostrando la disposición del androceo. F, un estaminodio, vista dorsal, un estambre intermedio y un estambre inferior. G, gineceo. H, fruto. I, semilla de perfil. Tomado de Burkat 1987: 518, fig. 233.
Flores bisexuales; hipanto plano, frecuentemente poco diferenciado. Cáliz de 5 sépalos imbricados, generalmente obtusos, ovados, obovados a lanceolados. Corola zigomorfa o irregular, de 5 pétalos, generalmente obovados y brevemente unguiculados, subiso o marcadamente heteromorfos, obtusos a emarginados, a veces uno de los abaxiales ampliamente ensanchado protegiendo parte del androceo, el vexilar casi siempre interno en la prefloración. Androceo comúnmente zigomorfo, estambres funcionales 4-10, basifijos, de filamentos rectos o ligeramente curvos, variando en longitud desde el lado adaxial al abaxial, los abaxiales generalmente con los filamentos más largos que las anteras, en los restantes las anteras mayores, los 3 adaxiales casi siempre estaminoidales, los restantes a menudo en dos grupos heteromorfos, raramente los 10 fértiles y subiguales; anteras con o sin apéndices apicales, de dehiscencia poricida o por breves fisuras apicales, no cilioladas a lo largo de las suturas. Ovario linear, sésil, curvo, generalmente pubescente, pluriovulado, estilo incurvo, dilatado o no debajo del estigma, este puntiforme o dilatado, comúnmente ciliolado. Legumbre generalmente recta, variable en longitud y textura, comprimida lateralmente, terete o angulosa, a veces umbonadas encima de las semillas y sulcada entre las mismas, indehiscente o tardiamente dehiscente sin elasticidad a través de 1 o ambas suturas, pluriseminada, dispuestas en 1-2 (-4) series. Semillas de funículo filiforme, areoladas o no, lisas o con puntuaciones. Arboles, arbustos o hierbas, a veces anuales. Hojas paripinnadas, 1-multiyugadas, raro ausentes o filódicas en especies australianas; glándulas nectaríferas extraflorales a menudo globosas, claviformes o fusiformes. Inflorescencias racemosas, generalmente multifloras, bractéolas comúnmente ausentes; flores amarillas o menos frecuente blancas. Número cromosómico x=14 (13, 12, 11) (Goldblatt, 1981: 431).
Referencias. Bravo (1978a, 1978b, 1981); Irwin & Barneby (1981, 1982a); Marazzi et al. (2006, 2006a).
Iconografía. Bravo (1978a: Figs. 1-15); Bravo (1978b, Figs. 1-2); Bravo (1981: Figs. 1-5); Irwin & Barneby (1981: Fig.1, 10, S. suratensis); Irwin & Barneby (1982a: Figs. 9-27); Irwin & Barneby (1982b: Figs. 28-35); Burkart (1978: Figs. 230-233, S. corymbosa, S. morongii, S. occidentalis, S. pendula var. paludicola); Lewis et al. (2005: 123, S. australis, S. pistacifolia var. picta).
Nombres vulgares. Para S. crassiramea, "Sumalahua o Sumalagua", "Retamo" "Timoyuyo" (Argentina).
Etimología. Derivado del árabe sanna, referido a aquellas especies con propiedades laxantes.
Distribución geográfica y hábitat. Género con ca. 295-300 especies, tropicales, pero extendiéndose también dentro de praderas templado-desérticas y excepcionalmente en zonas de temperaturas frías en ambos hemisferios. La mayoría de ellas americanas (ca. 214 especies sudamericanas), bien representadas en Africa, Madagascar y Australia, pero escasas en Asia y Oceanía.
Usos. Ornamentales, S. corymbosa (Lam.) H. S. Irwin & Barneby, S. didimobotrya Fres. y S. pendula (Willd.) H. S. Irwin & Barneby, etc. Varias especies de la serie Aphyllae: S. crassiramea (Benth.) H. S. Irwin & Barneby, S. aphylla Cav., entre otras, pueden considerarse como forrajeras naturales en zonas áridas, y además son utilizadas como leña para la fabricación y construcción de objetos varios en zonas rurales, también como ornamentales (Bravo, 1978a: 352). Las hojas jóvenes de S. tora (L.) Roxb. son comestibles en Sumatra; y en la India las semillas tostadas son usadas como sustituto del café (Larsen & Hou, 1996). Principalmente en Africa, S. alexandrina Mill., S. alata (L.) Roxb., S. singueana (Delile) Lock y muchas más, son medicinales (Watt & Breyer-Branndwijk, 1962: 568, 574). Sucedáneo del café al tostar sus semillas, S. occidentalis (L.) Link, (Burkart, 1978: 512; Das-sanayake & Fosberg, 1991: 75), etcétera.
Material de referencia
S. crassiramea (Benth.) H. S. Irwin & Barneby
ARGENTINA. Jujuy. Depto. Humahuaca, Quebrada de Hornillos, 8-II-1960, (fl, fr), T. Meyer et al. 21582 (LIL, SI)
S. spectabilis (DC) H. S. Irwin & Barneby
BOLIVIA. La Paz. Prov. Sud Yungas, Chulimani hacia Irupana, 29-VI-1982, (fr), S. Beck 12118 (SI).
S. silvestris (Vell.) H. S. Irwin & Barneby var. unifaria H. S. Irwin & Barneby
BOLIVIA. Beni. Prov. Vaca Diez, 37 km E of Riberalta on road to Guayaramerín, 1-VI-1982 (fl, fr), J. Solomon 7891 (MO, SI).
S. haughtii (J. F. Macbr.) H. S. Irwin & Barneby
PERU. Santa Cruz. Depto. Cajamarca, cerca de Carhuaquero, 26-I-1986 (fl, fr. inmad.), S. Llatas Quiroz 1717 (SI)
3. TRIBU CERCIDEAE Bronn, Form. pl. legumin.: ad Sect. 134, 131. 1822.
Bauhinieae Benth., in Hook., J. Bot. 2: 74. 1840. (sinonimia fide Lewis & Forest, 2005a: 57)
Tribu con 5 géneros tropicales y de zonas templadas. En Sudamérica, 1 género nativo (Bauhinia) y 1 introducido (Cercis). Número cromosómico generalmente x=7 o 14 (Golblatt, 1981: 431)
Referencias. Wunderlin et al. (1981); Lewis & Forest (2005)
Clave de géneros
Modificación de la clave de Wunderlin et al. (1981)
1. Flores comúnmente rosadas, pseudopapilionoideas, 5 pétalos desiguales, 2 inferiores adheridos por sus bordes anteriores formando una quilla, 2 alas y 1 estandarte pequeños e interno. Hoja simple orbicularreniforme. Árboles o arbustos, inermes. Legumbre alargada, dehiscente, con con ala angosta en la sutura placentar.
2. Cercis
1. Flores blancas, amarillas, rosadas o rojizas, no pseudopapilionoideas, pétalos frecuentemente subiguales entre sí. Hojas bífidas o bilobadas. Árboles, arbustos o lianas, inermes o con aguijones. Legumbre alargada, dehiscente o no, sin ala angosta en la sutura placentar.
1. Bauhinia
1. BAUHINIA Plum. ex L., Sp. pl. 1: 374. 1753; non Kunth, 1824; nec Raf., 18383. Especie tipo: Bauhinia divaricata L. Fig. 10.
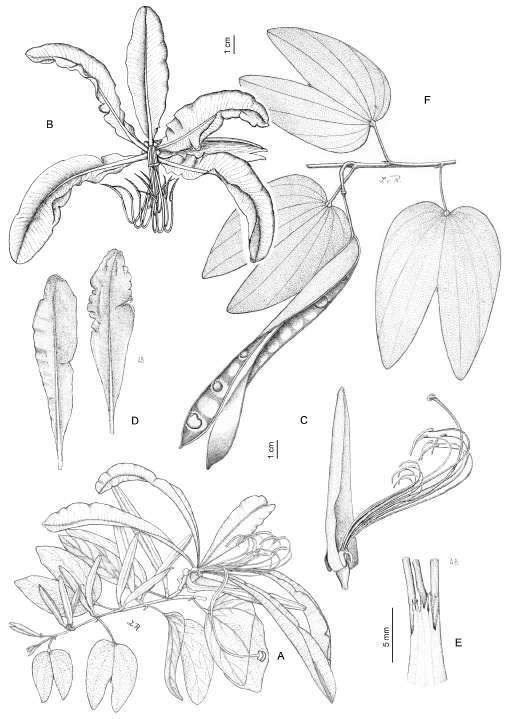
Fig. 10. Bauhinia forficata Link subsp. pruinosa (Vogel) Fortunato & Wunderlin. A, ápice de un tallo florífero. B, flor vista de frente. C, flor vista de perfil sin los pétalos. D, pétalos. E, sector del tubo ligulado de la parte basal de los estambres. F, rama con una legumbre dehiscente. Tomado de Burkart 1987: 510, fig. 229.
Flores bisexuales o no, a veces polígamas; botón floral cilíndrico, elipsoide o globoso; hipanto breve o muy largo, a veces con nectarios. Cáliz gamosépalo, campanulado, tubuloso, turbinado o espatáceo después de la antesis; de base fenestrada y ápice inconspicuamente 5-lobulado. Corola de 2-6 pétalos libres, subiguales, obovales, lineales o espatulados, blancos, amarillos, rosados o rojizos, extendidos. Estambres 10, a veces con estaminodios, libres o soldados irregularmente en la base, largos; anteras basifijas, largas, versátiles, rimosas o poricidas. Ovario lineal, 1-pluriovulado, fecuentemente estipitado; estilo generalmente alargado; estigma capitado, peltado o bilobado. Legumbre generalmente lineal, comprimida lateralmente, membranácea a leñosa, dehiscente o no, comúnmente pluriseminada. Semillas elipsoides, globosas a comprimidas, generalmente endospermadas. Árboles, arbustos, inermes o con aguijones curvos intraestipulares, o lianas, en este caso con zarcillos caulinares. Hojas enteras o bilobadas distalmente, alternas, con pulvínulos; estípulas tempranamente caducas. Inflorescencias generalmente en racimos simples o compuestos, brácteas pequeñas, bractéolas 2. Número cromosómico x =14, 13 (Goldblatt, 1981: 431).
Referencias. Bandyopadhyay & Sharma (1993); Chauchan et al. (1998); Das & Paria (1999); Ferguson & Pearce (1986); Fortunato (1984, 1986, 1997); Fortunato & Wunderlin (1985); Gamerro & Fortunato (2001); Hokcke & Ramírez (1990); Iribarren & Pomilio (1983); Kotresha & Seetharam (1995); Lewis & Forest (2005a); Vaz (1993); Vaz & Silva (1995); Vaz & Tozzi (2003); Wunderlin (1976, 1979, 1983, 1998, 2006).
Iconografía. Fortunato (1986: Figs. 1-6); Lewis et al. (2005: 61, B. grandidieri, B. hildebrandtii, B. purpurea). Fig. 10.
Nombres vulgares. Para B. argentinensis var. argentinensis, "Pata de vaca", "Pata de buey" (Argentina); "Ilta'a" (Paraguay); B. forficata subsp. pruinosa, " Pata de buey", "Pata de chivo", "Caobá o Caubá", etc. (Argentina, Paraguay); "Caoba del país (Uruguay); "Unha de boi" (Brasil), entre otros.
Etimología. En honor a los hermanos Jean (1541-1613) y Gaspar Bauhin (1560-1620), botánicos suizos.
Distribución geográfica y hábitat. Género con aproximadamente 150-160 especies de las regiones tropicales, subtropicales y templado-cálidas de América, Asia, África y Oceanía. Lo integran 4 subgéneros: Bauhinia, Pilostigma Hochst., Barklya F. Muell.y Phanera Lour. En Sudamérica crecen aproximadamente 75-80 especies.
Usos. B. forficata subsp. forficata es maderable, medicinal y ornamental. Otras especies asiáticas y africanas tienen importancia como medicinales (B. acuminata L.), comestibles (B. variegata L., B. reticulata DC., entre otras, Uphof, 1968: 69-70).
Material de referencia
B. affinis Vogel
BRASIL. Paraná. Guaraniaçú, Guaraní. "arbor 2-3 m, fl. branca. Mata". 7-XI-1963 (fl), E. Pereira 7758 (SI).
B. argentinensis Burkart var. argentinensis
PARAGUAY. Boquerón. Ea. Loma Porá, montes ribereños, IV-1917 (fr), T. Rojas 2111ª (SI).
B. bauhinioides Mart.
ARGENTINA. Formosa. Depto. Pilcomayo, monte cercano al casco, hacia la ribera del río Paraguay, 21-XI-1991 (fl), R. Fortunato et al. 2509 (SI).
B. divaricata L.
"Habitat in America" (holotipo probable S-LINN, no visto).
B. forficata Link subsp. pruinosa (Vog.) Fortunato & Wunderlin.
ARGENTINA. Tucumán. Depto. Capital, Valle Luján, XII-1918 (fl fr inmaduro), S. Venturi 40 (SI).
2 CERCIS L., Sp. pl. 1. 374. 1753; Gen. pl. ed. 5.: 176. 1754. Especie tipo: Cercis siliquastrum L
Flores bisexuales, 5-meras. Cáliz gamosépalo, oblicuo, con 5 lóbulos, breves, deltoides. Corola de 5 pétalos libres, unguiculados, ovado-elípticos, diferenciados en un estandarte pequeño e interno, 2 alas laterales y 2 inferiores mayores, adosados entre sí formando una quilla. Estambres 10, declinados e incluidos en la quilla, filamentos pilosos hacia la base, anteras breves, versátiles. Ovario lineal, glabro, subsésil, óvulos numerosos; estilo curvo, estigma terminal. Legumbre linealfusiforme, comprimida lateralmente, papirácea, tardíamente dehiscente, angostamente alada en la sutura placentar. Semillas 3-6, orbiculares u oboides, compresas, castaño-rojizas, endospermadas. Arbustos o árboles, inermes. Hojas simples, ovadas, orbiculares o subreniformes, emarginadas o acuminadas; estípulas escamiformes, tempranamente caducas. Flores dispuestas generalmente en corto fascículos sobre las ramas de un año o más viejas y floreciendo antes que las hojas; brácteas pequeñas esacamiformes, fecuentemente imbricadas en la base de la inflorescencia; bractéolas pequeñas, presentes o ausentes. Número cromosómico x=7 (Goldblatt, 1981: 431)
Referencias. Davis et al. (2002).
Iconografía. Burkart (1952: Fig. 27, C. siliquastrum); Robertson & Lee (1976: Fig. 6, C. canadensis var. canadensis); Wilbur (1963: Fig. 3, C. canadensis); Lewis et al. (2005: 59, C. siliquastrum); Taubert (1891-94, Fig. 84, C. siliquastrum).
Nombres vulgares. Para C. canadensis, "Redbud" (Estados Unidos de América), C. siliquastrum, "Árbol de Judea", "Árbol de Judas".
Etimología. Derivado del griego cerkis, antiguo nombre usado por el filósofo Teofrasto (siglo IV y principio del III a. c.) para C. siliquastrum.
Distribución geográfica y hábitat. Género con 6 especies de la zona templada de Eurasia y los Estados Unidos de Norteamérica y México. En Argentina se cultivan: C. canadensis L. de hojas cordadas-orbiculares, generalmente acuminadas a subagudas; vexilo y alas 9-12 mm long., quilla menor; legumbre 4-8(-10) x 0,8-1,8(-2) cm y C. siliquatrum L. de hojas cordadas a reniformes, obtusas a emarginadas; vexilo y alas 14-18 mm long.; legumbre 5-10 x 1,3-1,8 cm
Usos. Plantas histerantas y muy decorativas en el momento de su floración; maderables, comestibles y medicinales, C. canadensis L., C. chinensis Bunge (Uphof, 1968: 120).
Material de referencia
C. canadensis L.
ARGENTINA. Buenos Aires. Partido de San Isidro: S. Isidro, 1-IX-1980 (fllila, cáliz purpúreo), 8-X-1980 (con hojas y fr.inmaduros), cultiv., E. Ulibarri 1272 (SI).
C. siliquastrum L.
"Habitat in Italia, Hispania, Narbona" (holotipo LINN, no visto, microfilm IDC 524.1-No. 306 SI!).
ARGENTINA. Buenos Aires. La Plata, bosque de La Plata, 16-XII-1938 (fr), A. Cabrera s. n. (SI)
4. TRIBU DETARIEAE DC., Prodr. 2: 521. 1825. Cynometreae Benth., in Hook., J. Bot. 2: 74. 1840, emend. Léonard, Mém. Acad. Roy. Sci. Belg. 30(2): 94. 1957.
Phyllocarpeae Britton & Rose, N. Amer. fl. 23(4): 201. 1930.
Amherstieae Benth., in Hook., J. Bot. 2: 73. 1840 emend. Léonard, Mém. Acad. Roy. Sci. Belg. 30(2): 94.1957.
Brachystegioideae Hutch., Gen. fl. pl.: 225. 1964.
Macrolobieae Breteler, Advan. legum. syst. 7, Phylog.:59. 1995
Sinonimia fide Mackinder 2005: 69
Tribu con ca. 79 géneros tropicales, 21 presentes en Sudamérica, 1 introducido (Tamarindus) y otro de introducción dudosa(Thylacanthus). Número cromosómico x=12 (Golblatt, 1981: 431)
Referencias. Fougère-Danezan, M et al. (2003 y 2007); Mackinder (2005).
Clave de géneros
Modificación de la clave de Cowan & Polhill, in Polhill & Raven, 1981.
1. Bractéolas bien desarrolladas, valvadas, envolviendo al primordio floral, persistentes. Cáliz reducido ......... 2
1. Bractéolas pequeñas, medianas o nulas, imbricadas o parcialmente fusionadas de manera tubular, no envolventes, caducas o subpersistentes. Cáliz bien desarrollado .................................................... 4
2(1). Hojas 1-folioladas o con 1-45 pares de folíolos. Corola con 1 pétalo (el pétalo adaxial más desarrollado y conspicuo, 2-4 escamiformes); estambres fértiles 3, libres, raro con otros estaminoidios menores.
17. Macrolobium
2. Hojas con 1-6 pares de folíolos. Corola con (0-)3-5 pétalos, subiguales; estambres 10 ...................... 3
3(2). Hipanto desarrollado. Sépalos 4(-5). Pétalos (0-)3-5 en combinaciones de 1-3 normales, 2-5 vestigiales. Estambres 10 libres.
9. Dicymbe
3.Hipanto nulo. Sépalos 5. Pétalos 5. Estambres 10 brevemente connados hacia la base.
23. Thylacanthus
4(1). Bractéolas unidas, libres o ausentes. Flores vistosas, dispuestas en espiral en la inflorescencia. Estambres unidos en un tubo .................................................................................... 5
4. Bractéolas libres, pequeñas, desarrolladas o nulas. Flores poco vistosas menudo apétalas, dispuestas en espiral o dísticamente en la inflorescencia. Estambres libres o cortamente unidos hacia la base, en un tubo que no excede al ovario ...................................................................................... 15
5(4). Bractéolas generalmente unidas en un tubo bilobado, corto o largo, ± persistente. Hojas 1-folioladas hasta con 25 pares de folíolos. Estambres fértiles 3 ó 9 ........................................................ 6
5. Bractéolas libres, desarrolladas o pequeñas, comúnmente caducas. Hojas con 2-18(-21) pares d folíolos. Estambres fértiles 3 ó 10 ................................................................................ 13
6(5). Hojas 1-folioladas ......................................................................... 7
6. Hojas (1-)3-plurifolioladas .................................................................... 8
7(6). Pétalos 5, uno más largo que los restantes. Estambres fértiles 9.
18. Paloue
7. Pétalos 5, subiguales. Estambres fértiles 3.
19. Paloveopsis
8(6). Inflorescencia laxa o densa, sin involucro de brácteas. Estambres 3-9(-10), 3-5 fértiles, el resto reducidos . . . . ............................................................................................ 9
8. Inflorescencia generalmente en un racimo denso o capitado, con involucro de brácteas persistentes o no. Estambres 9-26, uniformes, todos fértiles .................................................................. 12
9(8). Folíolos peciolulados, hojas con 2 pares de folíolos. Brácteas tempranamente caducas o ausentes. Bractéolas formando breve copa bilobada. Estambres fértiles 3-5. Inflorescencias péndulas ............................. 10
9. Folíolos sésiles, hoja 1-foliolada hasta con 4-25 pares de folíolos. Estambres 3 fértiles. Brácteas conspicuas, persistentes. Bractéolas formando tubo bilobado. Inflorescencias erectas o péndulas ............................ 11
10(9). Pétalos 3, blancos. Estambres fértiles 5.
2. Brachycylix
10. Pétalos 5, amarillentos. Estambres fértiles 3.
10. Ecuadendron
11(9). Hojas con 1 folíolo o hasta con 25 pares de folíolos. Estípulas a veces foliáceas enteras. Brácteas pequeñas ± deltoides persistentes. Pétalos 3, desarrollados, 2 inferiores reducidos o nulos. Estambres unidos en tubo oblicuo.
15. Heterostemon
11. Hojas con 4-6 pares de folíolos. Estípulas a veces 2-divididas apicalmente. Brácteas bien desarrolladas, anchas, caducas. Pétalos 5, el adaxial frecuentemente leve o marcadamente diferente de los restantes, a veces 2-4 vestigiales. Estambres débilmente unidos hacia la base.
11. Elizabetha
12(8). Bractéolas generalmente conspicuas, persistentes. Sépalos 4. Pétalos 5, bien desarrollados. Estambres (10-)11(-12).
4. Brownea
12. Bracteólas nulas. Sépalos 2-4. Pétalos 3-4 rudimentarios. Estambres 9-26.
5. Browneopsis
13(5). Folíolos 10-18(-21) pares. Bractéolas bien desarrolladas, tempranamente caducas. Estambres fértiles 3. Legumbre recta o curva, subterete, gruesa, pulposa, no alada, indehiscente.
22. Tamarindus
13. Folíolos 2-8 pares. Bractéolas pequeñas, caducas. Estambres fértiles 10 ó 5 reducidos a estaminodios. Legumbre comprimida, variada, de sutura dorsal engrosada o alada, dehiscente o no. . .............................. 14
14(13). Folíolos 6-8 pares, sésiles. Estípulas nunca foliáceas. Hipanto inconspicuo. Pétalos 3, bien desarrollados. Estambres fértiles 10. Ovario estipitado central. Legumbre alada en la sutura dorsal, indehiscente.
1. Barnebydendron
14. Folíolos 2-6 pares, peciolulados. Estípulas a veces foliáceas. Hipanto cupular, con tejido nectarífero. Pétalo 1, bien desarrollado. Estambres fértiles 10, a veces 4-5 reducidos a estaminodios. Ovario estipitado central o adnato al hipan-to. Legumbre con la sutura dorsal engrosada o subalada, dehiscente.
12. Eperua
15(4). Folíolos con nervio marginal continuo y marcado, usualmente con puntuaciones glandulares hacia el margen, al menos cuando jóvenes, subsésiles, con leve o sin torsión del peciólulo. Bractéolas no petaloides. Flores dispuestas dísticamente en la inflorescencia. Sépalos subvalvados ............................................... 16
15. Folíolos generalmente sin nervio marginal continuo, con o sin puntuaciones glandulares; peciólulos con leve torsión. Bractéolas petaloides o no. Flores dispuestas en espiral o dísticamente en la inflorescencia. Sépalos imbricados-
16(15). Folíolos 1 par, sin puntuaciones glandulares. Bractéolas orbiculares, gruesas, persistentes. Pétalos 5, bien desarrollados. Estambres 10.
13. Goniorrhachis
16. Folíolos 1-12 pares, generalmente con puntuaciones glandulares cerca de la base. Bractéolas pequeñas, tempranamente caducas. Pétalos nulos. Estambres 8(-10).
6. Copaifera
17(15). Hojas 1-plurifolioladas, folíolos opuestos o alternos. Bractéolas pequeñas o ausentes. Pétalos ausentes .....
17. Hojas (1-)2-6-folioladas, folíolos opuestos. Bractéolas generalmente petaloides, caducas. Pétalos 5 ........... 20
18(17). Hoja 1-plurifoliolada, folíolos alternos u opuestos con nervio medio principal, con o sin puntuaciones glandulares. Estambres 10 iguales ..................................................................... 19
18. Hoja (1-) 2-foliolada, folíolos opuestos, con nervio principal o diversos excéntricos, con puntuaciones glandulares. Estambres 8-12, alternándose largos y cortos.
14. Guibourtia
19(18). Hoja 1-9 -foliolada, folíolos alternos, sin puntuaciones glandulares. Estípulas a veces foliáceas. Inflorescencia racimosa. Ovario 1-6-ovulado; estilo levemente capitado.
7. Crudia
19. Hoja 2-4-foliolada, folíolos opuestos, con puntuaciones glandulares. Estípulas nunca foliáceas. Panículas piramidales o espiciformes a racimos densos. Ovario 1-2-ovulado; estilo puntiforme.
21. Prioria
20(17). Folíolos sin puntuaciones glandulares. Bractéolas pequeñas, tempranamente caducas. Flores en racimos o panículas piramidales. Pétalos (4-)5. Estambres (8-)10(12). Legumbre ovoide o subreniforme, turgente a subcompre-sa, generalmente rugosa.
8. Cynometra
20. Folíolos a veces con puntuaciones glandulares. Bractéolas frecuentemente bien desarrolladas, caducas. Flores en inflorescencias subcorimbosas, raro en panículas alargadas. Pétalos 5. Estambres 10. Legumbre de otra forma .....
21(20). Folíolos 2-3 pares. Pétalos (subsésiles), ovario y fruto no glanduloso-pustulados. Legumbre leñosa, comprimida, tardíamente dehiscente.
3. Brodriguesia
21. Folíolos 2-pares. Pétalos (sésiles), ovario y fruto glanduloso-pustulados. Legumbre coriácea a leñosa, compresa a subterete, indehiscente o dehiscente ............................................................... 22
22(21). Folíolos con glándula proximal sobre el margen adaxial. Flores de 2-27 mm long. Legumbre oblicua, orbicular, coriácea, con la sutura dorsal angostamente alada, generalmente dehiscente; 1(-2)-seminada.
20. Peltogyne
22. Folíolos sin glándulas marginales. Flores 10-37 mm long. Legumbre leñosa, subcompresa a subterete, indehiscente, 1-seminada.
16. Hymenaea
1. BARNEBYDENDRON J. H. Kirkbr., Sida 18(3): 815-818. 1999. Especie tipo: Barnebydendron riedelii (Tul.) J. H. Kirkbr. (Phyllocarpus riedelii Tul.).
Phyllocarpus Riedel. ex Tul., Ann. Sci. Nat. sér. 2, 20: 142. 1843.
Flores bisexuales, zigomorfas; hipanto inconspi-cuo. Cáliz de 4 sépalos imbricados, anchamente ovado-orbiculares, cuculados, subiguales, glabros, coriáceos, los externos de margen ciliolado. Corola de 3 pétalos imbricados, anchamente obovados los laterales, el superior menor, subsésiles, tan largos como los sépalos. Androceo de 10 estambres libres desde su parte media hacia el ápice, connados hacia la base en forma de vaina con hendidura longitudinal adaxialmente, bien exsertos ca. 15 mm long; anteras uniformes, dorsifijas. Ovario central, libre, linear, (3-) 6-ovulado, glabro, estipitado; estilo filiforme, claviforme y geniculado hacia el ápice; estigma terminal, cupuliforme. Legumbre fusiforme, cobriza, glabra, 9,5-13 cm long. x 3,5-4 cm lat., muy comprimida lateralmente, subfalcada, brevemente estipitada, papirácea, reticulada, alada a lo largo de la sutura placentar, indehiscente, 1-seminada. Semilla central, reniforme, compresa. Árboles altos, 30-40 m alt., inermes. Hojas paripinnadas, (4-) 8-11 cm long.; estípulas conspicuas o no; folíolos 4-8 pares, 1,3-5,5 (-6) cm long. x 0,8-2 (-2,5) cm lat., largamente ovados, obtusos o subagudos, de base asimétrica. Inflorescencias en cortos racimos; pedicelos articulados hacia la base, 6-8 mm long., brácteas y bractéolas tempranamente caducas; flores purpúreas o rojizas, 8 mm long. Número cromosómico x=11 (Goldblatt, 1981 sub. Phyllocarpus: 433).
Referencia. Warwick et al. (2008).
Iconografía. Bentham (1870: tab. 19, sub Phyllo-carpus riedelii); Lewis et al. (2005: 73, B. riedelii); Tulasne (1844: pl. 10, sub Phyllocarpus riede-lii). Warwick et al. (2008: 146, B. riedelli).
Etimología. Dedicado en honor al botánico R. Barneby (1911-2000), especialista en Leguminosas, principalmente del Nuevo Mundo, cuyo lugar de trabajo fue durante años, el Jardín Botánico de Nueva York; y del griego dendron=árbol.
Distribución geográfica y hábitat. Género con 1 especie neotropical, B riedelii (Tul.) J. H. Kirkbr, con dos áreas disyuntas, una en América Central (desde Guatemala a Panamá), Venezuela, sudoeste de Brasil, vecindad de Perú y Bolivia y otra en el este de Brasil, desde Bahia a Rio de Janeiro.
Usos. Cultivado como ornamental en Florida (EE.UU.), Cuba, Guatemala, Costa Rica y Panamá, Kirkbride (1999).
Material de referencia
Barnebydendron riedelii (Tul.) J. H. Kirkbr.
BRASIL. Rio de Janeiro. Mata em frente de Jard. Bot., final da Rua Sara Vilela, "tree to 35 m,...bark dark greyish..., imbricate part of sepals yellowish, exposed part scarlet, peals and stamen filaments shocking pink...",27-IV-1987 (fl), G . Lewis et al. 1615 (RB 386270, SI).
PERU. Rio Acre. Amazonas Exped., V-1911 (fl), E. Ule 9447 (K).
Phyllocarpus riedelii Tul.
BRASIL. Rio de Janeiro. L. Riedel s. n. (Herb. Brasil. Guillemin 1022) (holotipo P, no visto, isotipo US, no visto).
"P. septentrionalis" Donn. Sm.
GUATEMALA. Depto. Zapaca, near Gualan, II-1912, "Guacamaya tree" (fl), W. P. Cockerell s. n. (US 861342), Imagen Digital 2733!; frutos (K) [Lectotipo K, designado por Kirkbride, Sida 18(3): 817. 1999, para el epiteto específico P. septentrio-nalis, sinónimo de B. riedelii].
COSTA RICA: Puntarenas. Cantón de Osa. Península de Osa, Carbonera, "árbol de 40 m x 60 cm DAP...frutos abundantes, rojizos"...,12-IV-1992 (fr), N. Zamora & R. Aguilar 1828 (MO, SI).
2. BRACHYCYLIX (Harms) Cowan, Konikl. Nederl. Akad. Wetensch. Proc. (C) 78 (5):464. Fig. 1. 1975. Especie tipo. Brachycylix vageleri (Harms) Cowan (Heterostemon vageleri Harms).
Heterostemon subgenus Brachycylix Harms, Notizblatt 11: 291-293. 1927.
Flores bisexuales, zigomorfas; hipanto tubuloso con pubecencia muy breve. Cáliz de 4 sépalos, imbricados, subiguales, ovado-elípticos, 17-27 mm long. x 9-15 mm lat., cóncavos, obtusos, con pubescencia muy breve externamente. Corola de 3 pétalos adaxiales, subiguales, obovados, unguiculados, 35-48 mm long. x 20-30 mm lat., obtusos o emarginados, los 2 abaxiales, menores, ciliolados. Estambres 9, los 5 fértiles reunidos hacia la base en un tubo desigual, villoso en su interior, con hendidura longitudinal adaxialmente, anteras dor-sifijas, los estériles menores y glabros. Ovario linear, 7-ovulado, velutino, estipitado, adnato al hipanto; estilo filiforme; estigma capitado. Fruto desconocido. Árboles 25-35 m alt., inermes. Hojas paripinnadas, con raquis de 4-8,5 cm long., estípulas ovadas, acuminadas, caducas; folíolos 2 pares, cartáceos a finamente coriáceos, los basales, 11,5-17 cm long. x 3,8-7 cm lat., los apicales, 26-30 cm long. x 6-10 cm lat. Inflorescenciapéndula, 30-70 cm long; flores purpúreas, vistosas, sésiles; brácteas caducas a ausentes; bractéolas connadas en una estructura cupular escasamente bilobada.
Iconografía. Cowan (1975a: Fig. 1); Lewis et al. (2005: 97, B. vageleri).
Nombres vulgares. "Cucharo", "Guamo rosado" o "Guamo rosa" (Colombia).
Etimología. Del griego brachys=corto y cylix= copa en alusión a su corto hipanto.
Distribución geográfica y hábitat. Género con 1 especie de Colombia., B. vageleri (Harms) Cowan, que habita en las selvas tropicales, entre los 100-200 m s.m.
Observaciones. Género vecino de Heterostemon, que se diferencia por sus folíolos peciolulados; ausencia de brácteas; bractéolas escasamente bilobadas y tan largas como el hipanto, y por poseer 5 estambres fértiles.
Usos. Probablemente maderable y ornamental por sus vistosas flores.
Material de referencia
B. vageleri (Harms) Cowan
COLOMBIA. Santander. Vecinity of Barranca Bermeja, Magdalena Valley, Sogamoso-Carare Rivers, -13-IX-1936, 100-500 m s.m. (fl), O. Haught 1978 (K).
Heterostemon vageleri Harms
COLOMBIA. Santander. Buena Fortuna am Carare, 21-VIII-1923, H. Vageler 70 (holotipo B†, isotipo US, no visto). (Véase Cowan, 1975a: 466).
3. BRODRIGUESIA Cowan, Brittonia 33(1): 9. 1981. Especie tipo: Brodriguesia santosii Cowan.
Flores bisexuales, actinomorfas; hipanto tubulo-so,10-12 mm long. x 3-4 mm lat, Cáliz de 4 sépalos, imbricados, iguales, elíptico-ovados, externamente con pubescencia densa y breve, internamente vellosos, 11-12,5 mm long. x 6,5-9 mm lat. Corola de 5 pétalos subiguales, ancha o angostamente elípticos, externamente glabros, internamente vellosos, 11-13 mm long. x 4,5-7 mm lat., brevemente unguiculados. Estambres 10, de 50-55 mm long., exsertos, unidos en breve tubo hacia la base; anteras oblongo-elípticas, dorsifijas, versátiles. Ovario oblongo, 2-3(?)-ovulado, estipitado, parte inferior del estípite adherido al hipan-to; estilo filiforme; estigma terminal, capitado. Fruto linear, comprimido lateralmente, de contorno elíptico-oblongo, subleñoso, 13 cm long. x 6,5 cm lat., glabro, indehiscente, con el exocarpo, fino, nervoso, endocar-po agrietado y separándose a la madurez. Semillas 1-2, negras compresas, oblongo-suborbiculares. Árboles de 5-13 m alt., troncos 20-80 cm diám., inermes, glabros. Hojas paripinnadas, estípula persistentes; folíolos 2-3 pares, opuestos, elípticos, falcados, de ápice agudo a obtuso, coriáceos, 6,5-8,5 cm long. x 3,5-4(-6,5) cm lat., peciólulos torcidos, generalmente con una glándula incrustada, submarginal y hacia la base y a veces otras menores, 1-3 sub-basales. Inflorescencias paniculadas, terminales o axilares; 10-11 cm long., pubérula; brácteas y bractéolas tempranamente caducas; flores pediceladas.
Referencias. Cowan (1981).
Iconografía. Cowan (1981: Figs. 1-2), Lewis (1987: Fig. 5 L-N); Lewis et al. (2005: 92, B. santosii).
Nombres vulgares. "Jitai peba" (Brasil).
Etimología. En honor al botánico brasilero João Barbosa Rodrígues (1842-1909); fundador del Museo Botánico y Etnográfico de Manaos (1883) y Director del Jardín Botánico de Rio de Janeiro (1889-1909).
Distribución geográfica y hábitat. Género con 1 especie de la zona costera norte y atlántica del Brasil, B. santosii Cowan.
Observaciones. Género afín a Afzelia (África y Asia) e Intsia (Asia e Islas del Pacífico), pero diferenciándose de ambos por sus 10 estambres fértiles, 5 pétalos subiguales y minúsculo arilo.
Material de referencia
BRASIL. Bahía. "km 3 a 10 da road. Nilo Peçanha para Cairú. Mata de restinga", 11-VI-1973, T. S. Santos 2658 (holotipo CEPEC no visto, isotipo US, imagen digital 1142). Munic. de Maraú, restinga arbórea, estrada Maraú-Ubaituba, 10 m s.m., 18-V-1985 (fl, fr), G. Martinelli et al. 11089 (SI). Municipio de Valença, estrada Valença-Guaibin, ca. 10 km estrada, 8-I-1982 (fl), G. Lewis & A. M. de Carvalho 1038 (K, fragmento SI).
3. BROWNEA Jacq., Enum. pl. Carib. 6 (1760) nom. cons. Especie tipo: Brownea coccinea Jacq. Fig. 11.
Hermesias Loefling, Iter. hispan. 278. 1758.

Fig. 11. Brownea negrensis Benth. A, hoja, ápice de una rama con primordios de inflorescencias e inflorescencia desarrollada. B, flor en antesis de perfil, corte parcial y longitudinal de la misma. C, bractéolas. D, corte longitudianal de la base del hipanto. E, estambres. F, pistilo. G , corte longitudinal del ovario. Tomado de Bentham 1870: Tab. 54.
Flores bisexuales, zigomorfas; hipanto tubuloso. Cáliz de 4 sépalos, imbricados, petaloides, oblongos, filamentosos a espatulados, glabros. Corola de 5 pétalos, imbricados, generalmente subiguales, ovados u oblongos, unguiculados, glabros. Estambres (10-)11(-12) libres, desiguales en longitud, connados basalmente, exsertos o inclusos; anteras dorsifijas, oblongas, glabras. Ovario linear, 3-11-ovulado, estipitado, tomentoso, estípite adnato al hipanto; estilo filiforme, estigma terminal, capitado. Fruto recto a falcado, estipitado, comprimido lateralmente, coriáceo a subleñoso, con la sutura superior fecuentemente engrosada o dilatada, con dehiscencia elástica. Semillas 2-10, compresas, ovoides. Árboles a medianos arbustos, inermes. Hojas paripinnadas; estípulas folíaceas, caducas; folíolos 2-18 pares, coriáceos, a menudo grandes. Inflorescencias en racimo breves, a veces en densos capítulos con brácteas grandes o pequeñas, coloreadas, caducas; bractéolas coloreadas más o menos connadas, generalmente bilobadas, incluyendo a la flor; éstas pediceladas o subsésiles, 7 a numerosas por inflorescencia, muy vistosas, rosadas, rojas menos frecuente blancas. Número cromosómico x=12 (Goldblatt, 1981: 433)
Referencias. Klitgaard (1991) y Velázques (1998).
Etimología. En honor al naturalista irlandés Patrick Brown (1720-1790), explorador de Jamaica.
Iconografía. Bentham (1870: tab. 54, B. negrensis); Klitgaard (1991: Figs. 1-6); Woodson et al. (1951: Fig. 115, B. rosademonte); Lewis et al. (2005: 98, B. grandiceps, B. macrophylla); Velázquez (1998: Figs. 10-12, B. coccinea subsp. capitellata, B. ariza y B. longipedicellata). Fig. 11.
Nombres vulgares. Para B. coccinea, "Guaraba"; B. grandiceps, "Rosa de montaña", "Rosa de Venezuela"; B. macrophylla y B. longipedicellata, "Rosa de montaña" (Venezuela).
Distribución geográfica y hábitat. Género con 12-24 especies tropicales de América Central (Costa Rica y Panamá), Antillas Mayores (Jamaica y Puerto Rico), Antillas Menores (San Vicente, Trinidad y Tobago) y Sudamérica (Venezuela, Colombia, Guayana Francesa, Ecuador y Perú).
Usos. B. coccinea, B. grandiceps y B. macrophylla son ampliamente cultivadas como ornamentales y junto con B. multijuga Britton & Killip, usadas como medicinales por pueblos indígenas del norte de Sudamérica (Klitgaard, 1991).
Material de referencia
B. coccinea Jacq.
ANTILLAS. "colour plate Tab. 121 in Jacquin, N. J., Select. stirp. amer. hist. 1763" (lectotipo designado por Klitgaard, Nord. J. Bot. 11(4): 438. 1991).
VENEZUELA. Lara. Carora, bosques xerófilos, 17-IV-1946 (fl), A. Burkart 16584 (SI).
B. grandiceps Jacq.
VENEZUELA. Distrito Federal. Caracas, 18-II-1979, (fl), I. Irigoyen 470 (CTES, SI).
B. longipedicellata Huber
BRASIL. Pará. Belem, cultiv. semillas procedentes de Colombia, IX-1936 (fl), A. Ducke 269 (SI)
5. BROWNEOPSIS Huber, Bol. Mus. Para. 4: 197, 565. 1906. Especie tipo: Browneopsis ucayalina Huber
Flores bisexuales, zigomorfas; hipanto tubuloso. Cáliz de 2-4 sépalos, desiguales, oblongos a cuadrangulares o espatulados, densamente pubescentes externamente. Corola de 3-4 pétalos, desiguales, espatulados; los rudimentarios, deltoides o ligulados. Estambres 9-26, exertos, connados basalmente, filamentos desiguales en longitud; anteras oblongas, dorsifijas, versátiles. Ovario linear, pluriovulado, estipitado, estípite adnato al hipanto; estilo filiforme; estigma terminal, capitado. Fruto estipitado, linear, falcado hacia el ápice, comprimido lateralmente, con ambas suturas engrosadas, velutino o glabro, leñoso, con dehiscencia elástica. Semillas 2-10, castañas, duras, compresas, orbiculares a cuadrangulares, sin arilo. Árboles inermes. Hojas paripinnadas; estípulas filamentosas, tempranamente caducas; folíolos opuestos o subopuestos, 1-11 pares, peciolulados, coriáceos, glabros y con glándula incrustada basal. Inflorescencias breves, capituliformes, péndulas o erectas; flores vistosas, sésiles o subsésiles; bractéolas ausentes.
Referencias. Klitgaard (1991).
Iconografía. Klitgaard (1991: Figs. 7-9); Lewis et al. (2005: 98. B. disepala).
Etimología. Del griego opsis=apariencia y Brownea, o sea por su parecido con ese género vecino.
Distribución geográfica y hábitat. Género con 6 especies tropicales que se distribuyen desde América Central (Panamá) al noroeste de América del Sur (Colombia, Ecuador y Perú).
Material de referencia
B. excelsa Pittier
PANAMA. Darien, forest near Garachine (fl, 28-I-1912) (fr, 11-II-1912), H. Pittier 5511 (holotipo US 715759, 715760 y 715761, no vistos).
B. ucayalina Huber
PERU. Depto. Loreto. Paca, Río Ucayali, 21-XII-1892, J. Huber 1566 (holotipo probable MG, no visto, isotipo BM, no visto).
6. COPAIFERA L., Sp. pl. ed. 2: 557. 1762. nom. cons. Especie tipo: Copaifera officinalis (Jacq.) L (Copaiva officinalis Jacq.).
Copaiva Jacq., Enum. syst. pl. 65. 1760.
Copaiba Adanson, Fam. pl. 2: 241. 1763.
Pseudosindora Symington, Proc. Linn. Soc. 155th: 285. 1944.
Flores bisexuales, zigomorfas. Cáliz de 4 sépalos desiguales, subvalvares o imbricados, generalmente hirsutos internamente. Corola nula. Estambres (8-)10, libres, de filamentos alargados; anteras dorsifijas, oblongas, glabras. Ovario ovoide, estipitado o sésil, 2(-7) ovulado, frecuentemente pubescente a hirsuto; estilo filiforme; estigma terminal. Fruto suborbicular o elípticamente oblicuo, compreso o no, más o menos estipitado, generalmente coriáceo, dehiscente. Semillas 1(-4) con arilo amarillo o blanco. Árboles o arbustos inermes, a menudo de corteza aromática. Hojas pari o imparipinnadas; estípulas pequeñas, tempranamente caducas; folíolos opuestos o alternos, 1-22 pares, usualmente con puntuaciones, glabros o velutinos, membranáceos o coriáceos. Inflorescencias paniculadas, brácteas frecuentemente pequeñas y caducas; bractéolas 2, tempranamente caducas; flores sésiles, numerosas, pequeñas. Número cromosómico x=12 (Goldbaltt, 1981: 433).
Referencias. Dwyer (1951).
Etimología. De "copaiba" nombre indígena de tribus del Amazona para estos árboles con resina; y del griego phorus=portador.
Iconografía. Bentham (1870: tab. 63 I, C. langsdorfii); Bernardi (1984: Fig. 56); Burkart (1952: Fig. 24); Lewis et al. (2005: 84, C. palustris); Xena & Berry (1998: Figs. 31-33, C. camibar, C. officinalis, C. pubiflora); Taubert (1891-94: 131, Fig. 76, sub Copaiba langsdorfii). Nombres vulgares. Para C. langsdorfii, "Cupaih", "Kupa'y" (Paraguay); "Cabrewa", "Copaiba", "Jatobá", "Pau óleo de copaiba" (Brasil); C. officinalis, "aceite", "Copaiba de Maracaibo" (Venezuela), "Copaiba de Pará (Brasil), etcétera.
Distribución geográfica y hábitat. Género con ca. 30 especies tropicales que se distribuyen en América Central (Panamá y Costa Rica) y el área del Caribe; en Sudamérica, en Venezuela, Brasil (con la mayor diversidad), Guayanas, Colombia, Bolivia y Paraguay; 4 especies en Africa tropical y 1 en Malasia.
Usos. Género con varias especies maderables. Las especies más importantes por sus resinas y aceites son: la "Copaiba de Maracaibo" de Venezuela (C. officinalis L.) y la "Copaiba de Pará" de Brasil (C. reticulata Ducke). El bálsamo de copaiba es una oleorresina que tiene aplicaciones industriales y medicinales. Fue muy empleado como curativo por los pueblos indígenas que hacían uso de sus cualidades y que fueron transmitidas a los europeos del siglo XVI (Hill, 1965: 201). El arilo blanco de las semillas de C. officinalis es comestible en Venezuela (fide Burkart 16057 [SI]). Para otras especies como C. coriacea Mart., C. guyanesis Desf., C. langsdorfii Desf., etc. véase Uphof (1968: 149-150). Véase también: "Baume of Copahu" (C. officinalis) en Plotkin et al. (1991: 8).
Material de referencia
C. coriacea Mart.
BRASIL. Bahia. Municipio Correntina. Espigão Mestre, roa BR-349, 64 km L do trevo com Rod BR-020; 800 m s.m., 16-V-2000 (fr), G. Hatschbach et al. 71239 (MBM, SI).
C. chodatiana Hassl.
PARAGUAY. Amambay. Cero Corá, 8-XII-1978 (fl), L. Bernardi 18946 (G, SI).
C. langsdorfii Desf.
ARGENTINA. Misiones. Islas de Pto. Iguazú, 19-IV-1913 (fr), Rodríguez 795 (SI).
C. officinalis L.
VENEZUELA. Guarico. El Sombrero, 17-III-1946 (fr), A. Burkart 16057 (SI)
Copaiva officinalis Jacq.
ANTILLAS MENORES. Isla Martinica (holotipo probable P, no visto).
7. CRUDIA Schreb., Gen. pl.1: 282. 1789. nom. cons. Especie tipo: Crudia spicata (Aubl.) Willd. (Apalatoa spicata Aubl.)
Flores bisexuales, zigomorfas, hipanto breve. Cáliz de 4 sépalos imbricados, subiguales, ovados, membranáceos, reflexos durante la antesis. Corola nula. Estambres (8-)10, libres, filamentos filiformes, anteras ovadas u oblongas, dorsifijas, uniformes. Ovario linear, generalmente villoso, 1-6-ovulado, subestipitado o estipitado, con estípite libre o adnato al hipanto; estilo filiforme; estigma pequeño, terminal. Legumbre comprimida lateralmente, oblicuamente orbicular, ovada o anchamente oblonga, claviforme a falcada, coriácea o leñosa, con nervación prominente, con los márgenes frecuentemente engrosados, con dehiscencia elástica. Semillas 1-6, orbiculares a reniformes, compresas. Generalmente árboles inermes. Hojas 1-folioladas a imparipinnadas; estípulas pequeñas tempranamente caducas o foliáceas y persistentes; folíolos alternos, variados, 2-13 por hoja. Inflorescencias en racimos terminales o laterales; brácteas y bractéolas generalmente pequeñas y caducas; flores pequeñas, pediceladas. Número cromosómico x=12 (Goldblatt, 1981, 433).
Referencia. Hou (1996); Breteler & Nguema Miyono (2008).
Iconografía. Bentham (1870: tab. 62, C. oblicua); Hou (1996: Figs. 26, C. bantamensis, 27, C. ornata); Lewis et al. (2005: 87, C. choussyana, C. gabonensis, C. klainei).
Nombres vulgares. Para C. amazonica, "Igapó" (Brasil).
Etimología. En honor a Johann Wilhelm Crudy (1753-1810?) coleccionista botánico en las Bahamas y las Antillas Menores (St. Thomas y Sta. Lucia).
Distribución geográfica y hábitat. Género con ca. 55 especies tropicales, con mayor diversidad en Asia, Africa, Nueva Guinea, América Central, Caribe y Sudamérica. Habitan en selvas tropicales de tierras bajas hasta los 400 m s.m.
Usos. Algunas especies son probablemente maderables, pero escasamente conocidas.
Observaciones. Los cotiledones son cóncavos y dejan una larga cavidad en su interior que retiene aire, como también en Entada Adans., lo que permitiría su hidrocoria.
Material de referencia
Apalatoa spicata Aubl.
GUAYANA FRANCESA "Habitat in sylvis Guianae" (holotipo probable P, no visto, isotipos BM, LINN-SM 743.1, no vistos). Véase Howard (1983: 260).
C. aequalis Ducke
BRASIL. Amazonas. Manáos. Estrada do Aleixo, 23-VI-1941 (fl), A. Ducke 740 (SI).
C. amazonica Benth.
BRASIL. Amazonas. Lago do Badajós, 24-VIII-1950 (fr), R. Fróes 26361 (SI).
C. glaberrima (Steud.) J. F. Macbr.
BRASIL. Pará. Mosqueiro, "ad ripam flumi", 1-I-1941 (fl), A. Ducke 1683 (SI).
8. CYNOMETRA L., Sp. pl.:382. 1753. Especie tipo: Cynometra cauliflora L. Fig. 12.

Fig. 12. Cynometra spruceana Benth. A, ramas con inflorescencias y frutos. B, flor en antesis de perfil. C, corte longitudinal de flor. D, corte longitudinal del cáliz. E, pétalos. F, estambres. G, transcorte de ovario. H, fruto. I, corte longitudinal del fruto. Tomado de Bentham 1870: Tab. 65.
Flores bisexuales, zigomorfas; hipanto inconspicuo. Cáliz de 4(-5) sépalos, ocasionalmente 2-3, imbricados, desiguales, oblongos a ovados, usual-mente reflexos durante la antesis. Corola de (4-)5 pétalos, subiguales obovados a angostamente elípticos. Estambres (8-)10(-12), libres o frecuentemente unidos hacia la base, glabros; anteras pequeñas, dorsifijas, versátiles. Ovario ovoide, generalmente piloso, 1-4-ovulado, comúnmente estipitado, estípite libre, central; estilo filiforme; estigma terminal, pequeño. Fruto ovoide, arqueado o recto, grueso, turgente o subcompreso, generalmente rugoso o verrucoso, dehiscente o indehiscente. Semillas 1-2(-4) subglobosas o compresas, funículo corto, exalbuminadas. Árboles o arbustos inermes. Hojas paripinnadas; estípulas filiformes, tempranamente caducas; folíolos 1-6 pares (en el Nuevo Mundo exclusivamente 1 par), coriáceos, simétricos o asimétricamente oblicuos. Inflorescencias en racimos o panículas, los racimos usualmente estrobiliformes cuando jóvenes; brácteas escariosas o membranáceas; bractéolas no envolventes, deciduas; flores pequeñas sobre pedicelos articulados o no, blancas o amarillas, raro rojizas.
Referencias. Brenan (1967); Dwyer (1958); Knaapvan Meeuwen (1970); Silva et al. (1998); Tavares & Silva (1992); Ulibarri (1997a).
Iconografía. Bentham (1870: tab. 65, C. spruceana); Brenan (1967: Fig. 19, C. webberi); Knaapvan Meeuwen (1970: Figs. 1-3); Lewis et al. (2005: 89, C. abrahamii, C. crassifolia).
Nombres vulgares. Para C. bauhiniaefolia var. meridiana, "Mandubirá" (Argentina).
Etimología. Del griego kynos=perro o perra y metra=vulva, en alusión a su legumbre.
Distribución geográfica y hábitat. Género con ca. 80-90 especies distribuidas en América Central, Caribe, Sudamérica, Africa, Madagascar, Asia, Australia y del Pacífico, principalmente en selvas tropicales. C. bauhiniaefolia Benth. var. bauhiniaefolia es la única especie extratropical que llega a Chile y Argentina.
Usos. En América, C. sphaerocarpa Pittier es maderable y sus son semillas medicinales; C. retusa Britton & Rose, se utiliza para carbón (Dwyer, 1958: 318-319); C. cubensis A. Rich. es maderable (Uphof, 1968: 168). En Asia C. vogelii Hook. f., posee frutos medicinales; C. cauliflora L., tiene frutos comestibles y es maderable; C. inaequifolia A. Gray, es maderable (Burkill, 1966: 740-741). En África, C. alexandri C. H. Wright, es maderable; C. cauliflora L., tiene frutos comestibles; C. hankei Harms y C. pedicellata De Willd, son maderables; C. sessiliflora Harms, produce la resina "Copal" (Uphof, 1968: 169).
Material de referencia
C. bauhiniaefolia Benth. var. meridiana
ARGENTINA. Formosa. Río Paraguay, 11-XI-1909 (fl, fr. inmad.), M. Lillo 313 (LIL, SI). s. loc., I-1918 (fl, fr), P. Jörgensen 2124 (SI).
C. cauliflora L
"Habitat in India" (holotipo LINN, no visto, microfilm IDC 533.1-No. 310 SI!).
C. marginata Benth. var marginata
SURINAME. Posoegronoe. Saramaca River, 3-VII-1944 (fl), B. Maguire 24040 (NY, SI).
C. spruceana Benth. var. spruceana
BRASIL. Pará. Amazonas, Cachoeira do Río Arua, 29-V-1952 (fl), J. Pires & N. Silva 4210 (NY, SI).
9. DICYMBE Spruce ex Benth. & Hooker f. , Gen. pl. 1: 564. 1865. Especie tipo: Dicymbe corymbosa Spruce ex Benth. Fig. 13.
Dicymbopsis Ducke, Bol. Técn. Inst. Agron., Pará 19: 10. 1950.

Fig. 13. Dicymbe corymbosa Benth. A, porción de rama con hoja, folíolo e inflorescencia. B, flor. C, bráctea. D, sépalos. E, pétalos. F, estambres. G , diagrama floral. H, pistilo. I, corte longitudinal de ovario. Tomado de Bentham: Tab. 18.
Flores bisexuales, zigomorfas; hipanto turbinado, engrosado. Cáliz de 4(-5) sépalos, imbricados, ovado-oblongos, frecuentemente bífidos en el ápice. Corola de 5 pétalos (en combinaciones de 3 normales y 2 vestigiales, 1 normal y 4 vestigiales o 5 vestigiales), imbricados ovados, levemente desiguales. Estambres 10, libres, con filamentos inflexos, pilosos hacia la base; anteras uniformes, lineares. Ovario oblongo, a veces curvado, piloso, pluriovulado, con estípite libre o adnato al hipanto; estilo filiforme, involuto en el primordio floral; estigma terminal, capitado o peltado. Fruto legumbre alargada, comprimida lateralmente, nervada, con la sutura placentar levemente o conspicuamente 2-alada, dehiscente; 3-6 seminada. Semillas compresas, ovoides o discoides. Árboles pequeños o grandes, inermes. Hojas paripinnada o imparipinnadas; estípulas pequeñas, tempranamente caducas; folíolos 1-6 pares, peciolulados, coriáceos, acuminados, glabros o pubescentes, a veces con la cara abaxial con punctuaciones productoras de cera. Inflorescencias axilares o terminales, en racimos, panículas o corimbos; brácteas engrosadas, anchamente ovadas, tempranamente caducas; 2 bractéolas engrosadas, coriáceas, con glándula dorsal hacia el ápice, valvadas, envolventes del primordio floral, abriéndose durante la antesis, persistentes; flores pediceladas, vistosas cuando los 5 pétalos presentes, blanco-amarillentas.
Referencias. Bentham (1865 y 1870); Cowan (1957b, 1961, 1990).
Iconografía. Bentham (1865: tab. 38, D. corymbosa); Bentham (1870: tab. 18, D. corymbosa); Cowan (1961: Fig. 50, D. neblinensis; Fig. 51, D. pharangophila); Cowan (1990: Fig. 3, D. mollis y Fig. 4, D. hymenaea); Lewis et al. (2005: 101, D. alstonii, D. hymenaea). Fig. 13.
Etimología. Del griego di=dos y kymbe=cúpula, aludiendo a sus dos bractéolas cupuliformes envolventes del primordio floral.
Distribución geográfica y hábitat. Género con ca. 19 especies de Sudamérica tropical, principalmente del Brasil amazónico, Venezuela, Colombia y Guyana. Habitan en bosques montanos, bajos o elevados, como son los "tepui", macizos montañosos en forma de mesa y aislados que se elevan desde la selva, principalmente en Venezuela; son también frecuentes en las selvas en galeria en bordes de ríos, entre los 200-3.000 m s.m.
Usos. Probablemente maderable localmente.
Material de referencia
D. corymbosa Spruce ex Benth.
BRASIL: "In sylvis arenosis caatingas, prope Panuré ad rio Uaupés, oct. 1852-jan. 1853", Spru-ce 2791 (holotipo K!).
D. froesii Ducke
BRASIL. Amazonas. Serra de Tunuhy, Rio Caiary, Içana, árvore 9 m alt. fl. verde branco, 450 m s.m., 13-XI-1944 (fl), R. Fróes 21372 (SI).
D. pharangophila Cowan
VENEZUELA. Territorio de Amazonas, 25-XII-1957, (fl), Maguire et al. 42503 (isotipo K!).
D. jenmanii Sandw.
GUYANA BRITÁNICA. IX-X-1881 (fl), G. Jenman 1006 (isotipo K!).
10. ECUADENDRON D. A. Neill, Novon 8(1): 45. 1998. Especie tipo: E. acosta-solisianum D. A. Neill
Flores bisexuales, zigomorfas; hipanto cupulado, carnoso. Cáliz de 4 sépalos imbricados en el primordio floral, ovados, obtuso, glabros. Corola de 5 pétalos obovados, obtusos, glabros, el adaxial carnoso hacia la base de la uña. Androceo de 5 estambres fértiles, alternando con 4 estaminodios, unidos basalmente y adnatos al hipanto. Gineceo adnato al hipanto en la base; ovario velutino, estilo filiforme, estigma terminal, pequeño. Legumbre linear, estipitada, péndula, de márgenes levemente engrosados, paralelos, brevemente apiculada, valvas oblicuamente nervadas, con breve pubescencia rojiza. Semillas 4-9, oblongas a cuadrangulares, exalbuminadas. Árboles altos, inermes. Hojas con estípulas falcado-subuladas, persistentes o caducas; folíolos 2 pares, elípticos, de base atenuada, ápice bruscamente acuminado, los proximales menores y algo arqueados, cartáceos o coriáceos; pecíolulos retorcidos o plicados. Inflorescencia péndula, con numerosas flores, brácteas ausentes; bractéolas connadas en breve copa bilobada hacia el ápice, éstas, hipanto y cáliz de coloración rosado o rojiza, glabros; flores resupinadas, de pétalos amarillentos y con probable polinización por murciélagos.
Iconografía. Neill (1998: Fig. 1); Lewis et al. (2005: 95, E. acostasolisianum).
Nombres vulgares. "Guabo jiche" (Ecuador).
Etimología. Resulta de la combinación del país de origen, Ecuador, y del griego, dendron= árbol.
Usos. Maderable para construcciones varias.
Distribución geográfica y hábitat. Género con 1 especie: E. acostasolisianum endémica de los bosques primarios húmedos y tropicales del oeste de Ecuador, entre los 300-350 m s.m. Está ubicado dentro del grupo de Brownea y es afín a Brachycylix, Heterostemon y Elizabetha.
Material de referencia
ECUADOR. Azuay. Cantón Cuenca, Manta Real, at western base of Andes, 20 km SE of La Troncal, on lower slopes just above the village, primary forest remmant trees in cocoa plantation, Tropical Wet Forest life zone 350 m, 7-XI-1995 (fl), D. Neill, H. Vargas, T. Nuñez & J Clark 10437 (holotipo QCNE, no visto, isotipos AAU, COL, GB, GUAY, K, NY, MEXU, MO, QCA, US, no vistos, imagen digital isotipo MO 5103204! sheet 1 of 3, MO 5103203 sheet 2 of 3, MO 5103205 3 of 3. Paratipos: D. Neill et al. 10533, imagen digital MO 5103211!; J. Clark et al. 1710, imagen digital MO 4916520!.
11. ELIZABETHA M. R. Schomb. ex Benth., in Hooker, J. Bot. 2: 92. 1840. Especie tipo: Elizabetha princeps M. R. Schomb. ex Benth.
Flores bisexuales, zigomorfas; hipanto tubular. Cáliz con 4 sépalos petaloides, imbricados, levemente desiguales, ovadooblongos. Corola de generalmente 5 pétalos, a veces 2-4 vestigiales y el resto normal, imbricados, levemente desiguales, el superior interno, ensanchado y algo oblicuo. Androceo fecuentemente de 9 estambres, libres, 3 largos, fértiles, 6 estaminodios, menores con anteras vacias o sin ellas. Ovario oblongo a elíptico, pubescente o glabro, pluriovulado, estipitado, estípite adnato al hipanto; estilo filiforme, estigma terminal, capitado. Legumbre alargada, comprimida lateralmente, falcada, leñosa, engrosada o alada dorsalmente, dehiscente. Semillas 3-6, ovoides, compresas, axalbuminadas. Árboles de gran porte, inermes. Hojas paripinnadas; estípulas alargadas, finas a membranáceas, a veces 2-divididas apicalmente, caducas; folíolos 2-57 pares, angostamente oblongos a elípticos. Inflorescencias en breves y densos racimos apicales; brácteas anchas, caducas; bractéolas coriáceas, coloreadas, connadas hacia la base y envolviendo al hipanto; flores muy vistosas, escarlatas.
Referencias. Cowan (1959 y 1976b); Redden & Herendeen (2006).
Iconografía. Cowan (1976b: Fig. 1, E. leiogyne); Cowan [1957a: Fig. 1 c (fl), E. coccinea]; Cowan & Berry (1998: Fig. 43, E. macrostachya; Fig. 44, E. leiogyne); Lewis et al. (2005: 97, E. coccinea var. oxyphylla).
Etimología. En honor a "H. R. H. Princesa Real de Prusia" (Cowan, 1976b: 323), Wittstein (1856: 318), asigna el nombre a Elizabeth Fitton, que junto con Sarah M. Fitton, fueron las autoras de Conversations on Botany (1817), libro de divulgación de temas botánicos.
Distribución geográfica y hábitat. Género con 11 especies tropicales del norte de Sudaméri-ca (sudeste de Colombia, sudoeste de Venezuela, Brasil amazónico, Guyana y Suriname).
Usos. Género con especies ornamentales por sus bellas flores y probablemente maderables, (E. durissima Ducke, Cowan, 1976b: 339). Indígenas de las tribus Waikás (Amazonas Colombiano, alto Orinoco de Venezuela y río Negro del Brasil) mezclan las cenizas de la corteza de Elizabetha princeps con el polvo alucinógeno de Virola sp. (Myristicaceae) (Schultes & Hoffmann, 1982: 166-167). Con el mismo fin usan la ceniza de la corteza de E. leiogyne Ducke para mezclarla con el alucinógeno "yopo" (Cowan, 1976b: 336).
Material de referencia
E. duckii Huber
BRASIL. Pará. Horto Musaei Paraense culta, e río Caquetá, Pto. Córdoba (Colombia), III-1943 (fl), A. Ducke 767 (SI).
E. paraenssis Ducke
BRASIL. Pará. Belem, in Horto Musaei Paraense, 21-X-1940 (fl), A. Ducke 591 (SI).
E. princeps M. R. Schomb. ex Benth.
GUYANA. "1839, R. Schomburgk s. n. " (holotipo K!). Véase Cowan (1959: 59; 1976b: 328).
E. specieosa Ducke
BRASIL. Amazonas. Río Ururhú, Cachoeira Iracema, in silva, 28-IX-1941 (fl), A. Ducke s. n. (SI).
12. EPERUA Aubl., Hist. pl. Guiane. 1: 369, tab. 142. 1775. Especie tipo: Eperua falcata Aubl. Fig. 14.
Parivoa Aubl., loc. cit. 2: 756, tab. 303. 1775.
Dimorpha Schreber, Gen. pl. 2: 493. 1791.
Panzera Willd., Sp. pl. 2: 540. 1799.

Fig. 14. Eperua purpurea Benth. A, rama florífera. B, pétalo. C, corte longitudinal de la flor. D, androceo. E, estambre. F, diagrama floral. G, legumbre. H, semilla. Tomado de Bentham 1870: Tab. 58.
Flores bisexuales, regulares a zigomorfas; hipanto cupular con tejido nectarífero en su interior. Cáliz de 4 sépalos imbricados, ovados, elípticos a oblongos, iguales o el dorsal más largo y cóncavo, los 2 externos a menudo con glándula subapical dorsalmente. Corola con 1 pétalo flabeliforme, oblato, de base truncada o cuneada, glabro y 4 disminutos petaloides. Androceo de 10 estambres fértiles o 5 estaminoidios reducidos, libres o unidos hacia la base abaxialmente. Ovario obovado u oblongo, 4-5-ovulado, glabro o tomentoso, estipitado, estípite casi central; estilo elongado; estigma terminal, capitado o bilobado. Legumbre alargada, comprimida lateralmente, de contorno subobovado, oblicua, falcada a arqueada, sutura dorsal frecuentemente engrosado, a veces alado, coriácea a leñosa, nervada, generalmente glabra, dehiscente. Semillas 1-2, ovoides, compresas. Árboles de 5-70 m alt., inermes. Hojas paripinnadas; estípulas foliáceas y libres o pequeñas y unidas en un cuerpo intrapeciolar bífido o no; folíolos 2-6 pares, generalmente glabros, pelúcido-punctiformes, coriáceos, falcados o no. Inflorescencias racimosas, erectas o péndulas; flores pediceladas, muy vistosas, purpúreas, violáceas o blancas; brácteas pequeñas caducas, bractéolas 2, sobre distintos niveles en el pedicelo.
Referencias. Cowan (1975b); Howard (1983).
Iconografía. Bentham (1870: tab. 58, E. purpurea); Cowan (1975b: Fig. 2, Eperua purpurea, E. jenmanii y E. rubiginosa); Cowan & Berry (1998: Figs. 45-47); Lewis et al. (2005: 78, E. falcata, E. grandiflora y E. jemanii subsp. sandwithii); Plotkin et al. (1991: 62, reproduc. de tab. 142, Eperua falcata de Aublet 1775).
Nombres vulgares. Para E. purpurea, "Iebaró" (Brasil); "Wallaba" aplicado a las maderas de diversas especies de Eperua (Cowan, 1975a: 17; Uphof, 1968: 200). Para otros nombres vulgares, véase Cowan (1975b).
Etimología. De "Eperu" nombre local que los indígenas Galibis de Guayana dan al fruto de E. falcata por su semejanza con un sable tipo cimitarra.
Distribución geográfica y hábitat. Género de 14 especies, principalmente del nordeste de Sud-américa (Venezuela, Guyana, Suriname, Guayana Francesa y Brasil), menos frecuente en Colombia. Habitan tierras bajas y anegadizas de las selvas tropicales, a lo largo de los ríos y también en bosques bajos de pastizales.
Usos. E. falcata Aubl. es maderable (Plotkin et al., 1991: 8). E. oleifera Ducke produce una resina que se emplea para la fabricación de barnices. Sobre el uso de otras especies, véase Cowan (1975b).
Material examinado
E. bijuga Benth.
BRASIL. Pará. Mosqueiro, río Pará, " ad ripas inundatis rivis" 20-VI-1943 (fr), R. Fróes 32988 (NY, SI, US).
E. duckeana Cowan
BRASIL. Amazonas, río Urubú, infra catarac-tarum Iracema, 7-VI-1941 (fl, fr inmad.), A Ducke 732 (holotipo US, no visto, isotipo SI!).
E. leucantha Benth.
BRASIL. Amazonas. Porto Curucuhy, río Negro, "restinga alta, terreno arenoso, árvore 8 m x 25 cm, fl. branco-verde", 6-X-1945, R. Fróes 21104 (NY, SI, US).
E. falcata Aubl.
BRASIL. Amapá. Rio Oiapoque, "floresta alta ao longo do rio, 8 m , fl. rôxas", 19-I-1950, R. Fróes 26687 (NY, SI, US).
GUAYANA FRANCESA. "Habitat in sylvis Guianae, & ad ripas fluviorum", F. Aublet s. n. (lectotipo BM!, designado por Cowan, Smithsonian Contr. Bot. 28: 26. 1975b).
E. purpurea Benth.
BRASIL Amazonas. Jauareté, Vaupés, río Negro, "árvore mais bela da regio em flor", 19-X-1945, R. Fróes 21206 (NY, SI, US).
13. GONIORRHACHIS Taub., Flora 50, 75: 77, tab. 3. 1892. Especie tipo: Goniorrhachis margina-ta Taub.
Flores bisexuales, oblicuamente zigomorfas; hipanto tubular. Cáliz de 4 sépalos imbricados, subiguales, ovados, pubescentes externamente, el abaxial externo. Corola de 5 pétalos, imbricados subiguales obovados, cortamente unguiculados, glabros, de margen sinuado-ondulado, el adaxial interno. Androceo de 10 estambres libres, 5 levemente mayores que los restantes; anteras dorsifijas , uniformes. Ovario pluriovulado, estipitado, con pilosidad en sus márgenes o en su totalidad, estípite adnato unilateralmente a la pared del hipanto; estilo breve, incurvo; estigma terminal, pequeño, apenas dilatado. Legumbre madura no vista, la juvenil villosa. Arbustos o árboles medianos, inermes. Hojas paripinnadas; estípulas tempranamente caducas; folíolos 2-pares, cartáceos, oblicuamente ovados u oblongos, de base asimétrica, glabros, nervoso-reticulados. Inflorescencias en breves racimos espiciformes apicales; brácteas suborbiculares formando una copa, deciduas; 2-bractéolas gruesas, orbicular-ovadas, cóncavas, basales, persistentes durante la antesis; flores medianas, brevemente pediceladas, de corola blanca.
Referencias. Cowan (1981); Lewis (1987).
Iconografía. Lewis (1987: 101, Fig. 5 F-H.); Lewis et al. (2005: 73, G. marginata); Taubert (1892: tab. 3).
Nombres vulgares. Para G. marginata var. bahiana, "Tapicuru", " Pasturiu", "Itapicurú amarelo".
Etimología. Del griego gonia=ángulo y rachis=eje principal, en alusión a la disposición en zigzag del eje principal de la inflorescencia.
Usos. Potencialmente maderable.
Distribución geográfica y hábitat. Género con 1 especie y 2 variedades de Brasil (Bahia).
Material de referencia
G. marginata Taub. var. bahiana Cowan
BRASIL. Bahia. Rod. Palmira a Itaju do Colônia, "árvore 6 m x 25 cm, fl branca, anteras amarelas", 25-II-1972 (fl), T. S. Santos 2255 (isotipo US 2858599!, Imagen Digital 1124 K!).
G. marginata Taub. var. marginata
BRASIL. "Habitat in Brasiliae provincia Rio de Janeiro in minte Corcovado. Glaziou n. 13726" (holotipo probable P, no visto, isotipo probable K!). Minas Gerais, Munic. Monte Azul, Serra do Espinaçao, subida via Montividiu, "árvore 15 m, fl. alva, anteras amarelas, Mata", 18-IV-1996 (fl), G. Hatschbah et al. 64990 (LIL 602905)
14. GUIBOURTIA Benn., J. Linn. Soc., Bot. 1: 149. 1857; emend. Léonard, Bull. Jard. Bot. Brux. 19: 400. 1949. Especie tipo. Guibourtia copallifera Benn.
Gorskia Bolle, in Peters, Naturw. Reise Mossambique, Bot. 1: 16, tab. 3. 1862.
Pseudocopaiva Brittton & Wilson, Trop. Woods 20: 28.1929.
Flores bisexuales, regulares; hipanto breve, discoide. Cáliz de 4 sépalos, imbricados, desiguales, ovados. Corola nula. Androceo de (8-)10(-12 estambres libres, alternando largos y cortos; filamentos glabros; anteras dorsifijas. Ovario ovoide, compreso, 1-4 -ovulado, sésil o estipitado, libre, central; estilo alargado, glabro, curvo; estigma terminal, capitado. Legumbre oblicuamente elíptica, semiorbicular u obovada en su controno, compresa o dilatada, más o menos estipitada, coriácea a membranácea, unilateralmente subalada, indehiscente o dehiscente a lo largo de una sutura. Semillas 1(-2) alargadas, compresas, ariladas o no. Arbustos o árboles, inermes. Hojas paripinnadas; estípulas disminutas, generalmente caducas; folíolos generalmente 1-par, raro 1-foliolado, coriáceos, falcados, asimétricos, sésiles, usualmente pelúcidos y con punctuaciones glandulosas. Inflorescencias terminales, en racimos o paniculas, estrobiliformes cuando jóvenes; brácteas pequeñas; 2 bractéolas pequeñas, persistentes o no; flores pequeñas pediceladas o sésiles. Número cromosómico x=12 (Goldblatt, 1981: 433)
Iconografía. Brenan (1967: Fig. 27, sub G. schliebenii); Ross (1977: Fig. 4, sub. G. coleosperma (Benth.) J. León y G. conjugata (Bolle) J. León); Lewis et al. (2005: 81, G. coleosperma, G. schleibenii).
Nombres vulgares. Para G. chodatiana, "Cabo de Formão" (Brasil).
Etimología. En honor a Nicolás J. B. G. Guibourt (1790-1867), farmacólogo francés y profesor en la Escuela de Farmacia de París.
Usos. Las semillas de Guibourtia coleosperma (Benth.) Léonard (África) son comestibles y fuente de aceite; G. himenaefolia (Moric.) J. Léonard es maderable; G. conjugata (Bolle) J. Léornard produce resina como G. demeusii (Harms) Léonard ,"Cameroon Copal", para la fabricación de barniz y laca. Estas 3 últimas especies, también africanas, son citadas por (Uphof, 1968: 149, 255) bajo el género Copaifera.
Distribución geográfica y hábitat. Género con ca.16 especies principalmente en Africa tropical. De selvas lluviosas, bosques xerófilos, a veces en terrenos anegadizos y a lo largo de ríos. En América crecen 3 especies, G. hymenaefolia (Mo-ric.) J. Léonard, en el área del Caribe, y las otras 2 en Sudamérica: G. chodatiana (Hassl.) J. Léonard (en Paraguay) y G. confertifolia (Benth.) J. Léonard (en Brasil).
Material de referencia
G copallifera Benn.
AFRICA. Sierra Leona. "Habitat in Africa Tropica Occidentali, apud Goderich & Lumley", W. F. Daniel s.n. (holotipo probable BM, no visto, probable isotipo K, no visto).
G chodatiana (Hassl.) J. Léonard
BRASIL. São Paulo. Tanaby, 23-VIII-1941 (fr), A. Gehrt s. n. (Inst. Bot. São Paulo-Brasil 45855) (SI).
15. HETEROSTEMON Desf., Mem. Mus. Paris 4: 248, tab. 12. 1818. Especie tipo: Heterostemon mimosoides Desf.
Flores bisexuales, zigomorfas; hipanto cilíndrico, subarqueado. Cáliz de 4 sépalos, imbricados, petaloides, levemente desiguales. lineares a angostamente elípticos. Corola de 3 pétalos superiores imbricados, subiguales, ovados, unguiculados; 2 inferiores reducidos o nulos. Estambres 9, solamente los 3 inferiores y más largos fértiles, unidos basalmente en una vaina abierta en el borde adaxial, pilosa o glabra, libres apicalmente; 6 más cortos estériles. Ovario angostamente elipsoide, glabro o marginalmente pubescente, 3-9-ovulado, con estípite adnato a la pared del hipanto; estilo filiforme; estigma terminal, capitelado. Fruto estipitado, alargado, comprimido lateralmente, recto o falcado, coriáceo, glabro o velutino, dehiscente. Semillas ovoides a orbiculares, compresas. Arbustos o árboles, 2-20 m alt., inermes. Hojas impari o paripinnadas; estípulas caducas o persistentes, subuladas o foliáceas; pecíolo breve; raquis poco o notablemente alado; folíolos 1-27 pares. Inflorescencias en racimos sésiles, apicales o en nudos desfoliados (ramas cauliforas); brácteas pequeñas, pesistentes; bractéolas persistentes, connadas, más breves que el hipanto; flores pedicelas, vistosas, azulado-purpúreas a blanquecinas y con pétalo medio maculado.
Referencias. Cowan (1957a, 1976); Cowan & Berry (1998); Redden & Herendeen (2006).
Iconografía. Desfontaine (1818: tab. 12); Ben-tham (1870: tab. 55, Fig. 1 y 2, sub H. ellipticus y H. mimosoides); Cowan (1957a: Fig. 1 b, sub H. otophorus); Cowan (1976a: Fig. 1, H. otophorus); Lewis et al. (2005: 97, H. mimosoides Mee, Flowers of the Brazilian Forest pl. 6, H. ellipticus (fide Cowan, 1976a: 46).
Etimología. Del griego hetero=distinto, diferente y stemon=estambre en alusión a la alternacia de estambres fértiles y estériles.
Distribución geográfica y hábitat. Género con 7 especies localizadas en el norte de América del Sur: Río Orinoco Superior, Río Casiquiare y Río Negro (Venezuela); Amazonas Superior y a lo largo del Río Negro (Brasil) y en Vaupés (sudeste de Colombia) y 2 especies endémicas en Guyana. Habitan en suelos arenosos, pero también en terrenos anegadizos y bordes de selva.
Usos. Género ornamental y probablemente maderable.
Material de referencia
H. conjugatus Spruce ex Benth.
COLOMBIA. Vaupés. Forest between Itilla and Macaya Rivers, about 300 m s.m., 1-7-IV-1943 (fl), R. Schultes 5356 (US, SI).
H. mimosoides Desf.
BRASIL. Sine locus, sine data,"Cet arbre est indigène du Brésil" (holotipo P, no visto). Véase Cowan (1976a: 51). Amazonas. Manáos. Igarapé da Cachoeira Grande, "ad ripam inundabilem; arbor parva; fl. violacei cum azureo et albo", 1-VIII-1941 (fl, fr inmaduro), A. Ducke 768 (SI).
COLOMBIA. Amazonas. Río Ricapuyá. 700 feet, fl. violet, 25-26-IX-1952 (fl), R. Schultes & I. Cabrera 17622 (US, SI).
H. mimosoides Desf. var. pacimoniensis Cowan
VENEZUELA. Rio Pacimoni-Yatua, Casiquiare, Territorio Amazonas, "small tree, corolla lavander.", 100-140 m s.m., 27-XI-1953 (fl, fr), B. Maguire et al. 36638 (holotipo NY, Imagen Digital 4404!).
16. HYMENAEA L., Sp. pl. 1192. 1753. Especie tipo: Hymenaea courbaril L.
Trachylobium Hayne, Flora 10: 743. 1827.
Para otros sinónimos véase Lee & Langenheim (1975: 51)
Flores bisexuales, zigomorfas; hipanto grueso, campanulado. Cáliz de 4 sépalos imbricados, subiguales, coriáceos, ovados a elípticos. Corola de 5 pétalos subiguales, oblongos, ovados a obovados, sesiles o brevemente unguiculados, glabros o pilosos, el superior frecuentemente más largo. Estambres 10, libres, exsertos; filamentos glabros; anteras oblongas, uniformes, dorsifijas. Ovario oblicuamente oblongo o romboide, excéntrico, glabro o piloso hacia la base, 2-18 o más ovulado, con estípite adnato a la pared del hipanto; estilo filiforme, glabro, incurvo apicalmente; estigma terminal, capitado o bilobado. Fruto oblicuamente obovoide o elipsoide a drupiforme, grueso, subterete o levemente compreso, leñoso, liso o rugoso, glabro, castaño oscuro a cobrizo, resinoso, indehiscente. Semillas 1-8 o más, oblongas, obovoides o elipsoides, exalbuminadas. Árboles medianos a grandes, raro arbustos, 1,5-40 m alt., inermes, resinosos. Hojas 2-folioladas; estípulas lineares, caducas; folíolos peciolulados, coriáceos, pelúcidos-punteados. Inflorescencias terminales, paniculadas o corimbosas; brácteas y bractéolas caducas; flores pediceladas, todas sus partes pelúcido-punteadas, blancas o amarillentas, raro rojas. Número cromosómico x=12 (Goldblatt, 1981: 433).
Referencias. Langenheim et al. (1973); Lee & Langenheim (1975).
Iconografía. Bentham (1870: tab. 61, sub. H. stigonocarpa); Lee & Langenheim (1975: Figs. 1-4, 9, 13, 17, 19, 21, 22, 24, 26, 30, 32); Lewis et al. (2005: 80, H. courbaril, H. martiana, H. verrucosa); Taubert (1891-94: 136, Fig. 77 A-C, H. courbaril).
Nombres vulgares. Para H. courbaril var. cour-baril, "Algarrobo" (Brasil); H. martiana, "Nara" (Argentina); H. parvifolia, "Jutahy pororoca", "Jutahy miní" (Brasil).
Etimología. Del griego Hymen, hymenaios=Dios del matrimonio, enlace, unión, en alusión a sus folíolos pareados.
Usos. Hymenaea courbaril L., "Courbaril", es maderable, industrial, medicinal, fuente de resina, y la pulpa que rodea sus semillas es comestible y sirve para la fabricacion de bebidas; nativos de Brasil preparan té con sus hojas. De H. verrucosa Gaertn., de Africa, se extrae resina para la fabricación de barniz. La resina de H. parvifofia Huber diluida en xileno es empleada en preparaciones microscópicas (Lee & Langenheim, 1975: 49-51; Uphof, 1968: 275); especie también citada como de potencial resinífero (Alvino et al., 2005: 416).
Distribución geográfica y hábitat. Género con 14 especies de distribución disyunta, a cada lado del Atlántico. H. verrucosa Gaertn. al este de Africa, Madagascar, Islas Seychelles y Mascare-nas (Mauricio y Reunión), el resto en América Central, zona caribeña y en Sudamérica (principalmente Brasil amazónico, Venezuela, Guyana, Suriname, Guayana Francesa, Colombia, Ecuador y Perú). H. stigonocarpa Hayne llega hasta Paraguay y Bolivia. H. martiana Hayne, además de Paraguay llega hasta la Argentina (Misiones). Habitan en selvas tropicales, a veces en terrenos anegadizos, o ambientes semiáridos del "cerrado" (Brasil, bosques abiertos de poca altura o zonas elevadas con sabanas de gramíneas y arbustos dispersos) y "caatinga" (Brasil, bosques xerófilos).
Material de referencia
H. courbaril L. var. courbaril
BRASIL "Habitat in Brasilia" (holotipo LINN, no visto, microfilm IDC 526.1-No. 307 SI!).
VENEZUELA. Guárico. Al sur de Calabozo, 17-III-1946 (fl, fr), A. Burkart 16052 (VEN, SI).
H. martiana Hayne
ARGENTINA. Misones. Depto. Leandro N. Além: Leandro Além, s. fecha, J. Barreiro s. n. (Ex Herb. Direc. Forestal Min. Agric. no. 1569, SI).
H. parvifolia Huber
BRASIL. Pará. Mosqueiro" in relictis silvae non inundabilis ad ripas altas fluvii Pará. Arbor magna flor. albis", 19-X-1940 (fl), A. Ducke 613 (SI).
17. MACROLOBIUM Schreb., Gen. pl. 1. 30. 1789. nom. cons. Especie tipo: Macrolobium vuapa J. F. Gmelin (Syst. Nat. 2: 93. 1791. nom. illeg.; Vouapa bifolia Aublet Macrolobium bifolium (Aubl.) Pers. (typ. cons.). Fig. 15.
Vouapa Aubl., Hist. pl. Guiane 1: 25. 3: tab. 7. 1775.
Outea Aubl., Hist. pl. Guiane 1: 28. 3: tab. 9. 1775.

Fig. 15. Macrolobium multijugum (DC.) Benth. A, rama florífera y fructificada. B, flor en antesis de perfil. C, corte longitudinal de flor. D, pétalo. E, estambres. F, fruto. G, corte longitudinal de fruto. M. taxifolium Benth. H, rama florífera. I, flor en antesis de perfil. J, corte longitudinal de flor. K, pétalo. L, estambres. Tomado de Bentham 1870: Tab. 57, figs. 1 y 2 respectivamente.
Flores bisexuales, zigomorfas; hipanto cupular a tubuloso. Cáliz de 4-5 sépalos imbricados, ovado-oblongos, a veces los del par adaxial parcialmente adheridos. Corola con 1 pétalo sólo adaxial, blanco, plegado y cuculiforme en el primordio floral, unguiculado o sésil, obovado a suborbicular, 2-4 inferiores, escamiformes, mínimos, efímeros. Estambres 3, libres, raro con diminutos estaminodios; filamentos filiformes, glabros o pubescentes hacia la base; anteras, dorsifijas, a veces pilosas. Ovario alargado, glabro o piloso, 1-8- ovulado, con estípite conspicuo, basal o adnato por su base a la pared adaxial del hipanto; estilo filiforme; estigma terminal, puntiforme o capitado. Fruto ovoide, orbicular o alargado, oblicuamente obovado, falcado o arqueado distalmente, comprimido lateralmente, coriáceo, con sutura superior engrosada, dehiscente o no. Semillas 1-4, ovoides a orbiculares, compresas, exalbuminadas. Arbustos, árboles medianos a grandes, imermes. Hojas paripinnadas o pseudo-imparipinnadas; estípulas caducas, a veces foliáceas; 1-foliolada o con folíolos 1-45 pares, coriáceos, grandes o pequeños, a veces con puntuaciones abaxialmente. Inflorescencia generalmente en racimos, densos o laxos; brácteas usualmente caducas; 2 bractéolas que envuelven al primordio floral, pesistentes en la antesis; flores pediceladas o subsésiles.
Referencias. Cowan (1953a, 1953b, 1957b, 1961 y 1973); Howard (1983).
Iconografía. Aublet (1775: vol. 3, tab. 7, Vouapa bifolia; tab. 8, V. simira; tab. 9, Outea guianensis); Bentham (1870: tab. 56 I, M. punctatum; tab. 56 II, M. limbatum; tab. 57 I, M. multijugum; tab. 57 II, M. taxifolium); Cowan (1953a: Fig.1, M. multijugum, M. microcalyx, M. canaliculatum, M. stenosiphon); Cowan (1957b: Fig. 64 a-b, M. unifoliolatum; c-d, M. exfoliatum); Cowan (1961: Figs. 52-55, Macrolobium); Lewis (1987: Fig. 3A-C, sub M. rigidum); Karsten (1861: tab. 75, sub Macrolobium floridum); Lewis et al. (2005: 99, M. acaciifolium, M. latifolium, M. unijugum); Plotkin et al. [1991: 65, reproduc. tab. 7 Vouapa bifolia de Aublet (1775), como Macrolobium bifolium (Aublet) Pers.].
Nombres vulgares. Para M. acaciifolium, "Arepillo" (Venezuela).
Etimología. Del griego makros=largo, grande y lobium=prolongación, en alusión al único pétalo adaxial bien desarrollado.
Distribución geográfica y hábitat. Género americano con ca. 70-80 especies, principalmente en América del Sur (Venezuela, Guyana, Suriname, Guayana Francesa, Brasil, Colombia, Ecuador y Perú, llegando hasta Bolivia); pocas en América Central (Honduras, Costa Rica y Panamá). Estos arbustos, (0,30-)1-4 m o árboles de (3-)4-35 m alt. habitan en selvas tropicales, frecuentemente a lo largo de ríos, terrenos anegadizos y también en bosques y pastizales o en bosques de laderas de elevaciones rocosas. Crecen entre los 50-1200 m s.m.
Usos. Varias especies son maderables, principalmente Macrolobium biflorum (Plotkin et al., 1991: 8).
Material de referencia
M. acaciifolium (Benth.) Benth.
VENEZUELA. Amazonas. San Carlos, Río Negro, 26-II-1942 (fr), L. Williams 144485 (SI).
M. bifolium (Aubl.) Pers.
BRASIL. Pará. Rodovia Belem- Brasilia, km 92, 20-VIII-1959 (fl), M. Kuhlmann & S. Jimbo 73 (SI).
M. multijugum (DC.) Benth.
BRASIL. Amazonas. Manaos, 15-VI-1941 (fl), 30-I-1941 (fr) A. Ducke 576 (SI).
M. unifoliolatum Cowan
VENEZUELA. Terr. Amazonas, South Maroa, Rio Guainía, "slender tree 7 m, petal white, stamens red; in river forest just south Maroa", 28-XI-1953, B. Maguire et al 36445 (holotipo NY, no visto, Imagen Digital 4498!).
Vouapa bifolia Aubl.
GUAYANA FRANCESA. "Habitat in sylvis Caïennae et Guianae prope littora fluviorum et amnium" (holotipo probable P, no visto, isotipos BM, LINN-SM 77.2, p-r 1:47, no visto). Véase Howard (1983: 290).
18. PALOUE Aubl., Hist. pl. Guiane 1: 365, tab. 141. 1775. Especie tipo. Paloue guianensis Aubl
"Palovea" Juss., Gen. pl.: 351. 1789 (sphalm. por Paloue).
Flores bisexuales, zigomorfas; hipanto turbinado. Cáliz de 4 lóbulos imbricados, ovado-oblongos, levemente subiguales, reflejos durante la antesis. Corola de 5 pétalos desiguales, a veces 1-3 grandes y 2-4 menores, elípticos, lineares a subobovados, subsésiles. Estambres 9, libres apicalmente, soldados regularmente en la base, exsertos, glabros; anteras oblongas, uniformes, a veces pilosas. Ovario elipsoide, glabro o piloso, pluriovulado, con estípite adnato al hipanto; estilo filiforme, alargado, estigma terminal, pequeño, subcapitado. Fruto alargado, de contorno oblicuamente subobovado, recto o subfalcado, comprimido lateralmente, leñoso, glabro o no, con la sutura superior engrosada, pluriseminado, dehiscente. Semillas ovoides, compresas. Árboles medianos, inermes. Hojas 1-folioladas, generalmente grandes, coriáceas, glabras, cortamente pecioladas; estípulas pequeñas, caducas. Inflorescencias en racimos terminales; brácteas cortas; bractéolas 2, connadas en tubo bilabiado que envuelve al hipanto; flores pediceladas, vistosas, rojizas.
Referencias. Bruneau et al. (2001); Cowan in Polhill & Raven (1981a); Rodrigues & Lima (1989); Redden & Herendeen (2006).
Iconografía. Cowan (1957a: Fig. 1a, sub P. riparia); Lewis et al. (2005: 96, P. guianensis, P. riparia); Rodrigues & Lima (1989: Fig. 1, P. brasiliensis, P. emarginata, P. guianensis, P. induta y P. riparia).
Etimología. Nombre dado por la tribu caribeña de los Galibis para P. guianensis.
Distribución geográfica y hábitat. Género con 4 especies en selvas tropicales de América del Sur (Brasil amazónico, Suriname, Guyana y Guayana Francesa); frecuentes a lo largo de ríos y en terrenos anegadizos.
Usos. Probablemente maderable.
Material de referencia
P. brasiliensis Ducke
SURINAME. Sipaliwini, vecinity of Blanche Marie Waterfall on Nickerie River, " tree 12-15 m tall, overhanging river...., 50 m s.m.", 19-XI-1995 (fl), R. Evans et al. 2446 (MO, SI).
P. guianensis Aubl.
GUAYANA FRANCESA. "In sylvis prope praedium Sancti-Regis" (holotipo probable P, no visto, isotipo probable BM, no visto). Véase Howard (1983: 279).
SURINAME. Gonini River, 20-II-1918 (estéril), Ex. Herb. Acad. Rhenot. 3737 (LIL 261764).
P. riparia Pulle
SURINAME. N side of Kuruni Island, E of trail from airstrip to N branch of Kuruni River around Island, " tree 15 m tall...180 m s.m.", 8-XI-1992 (fl), R. Evans et al. 1922 (MO, SI).
19. PALOVEOPSIS Cowan, Brittonia 8(4): 251, Fig. 1 d. 1957. Especie tipo: Paloveopsis emarginata Cowan.
Flores bisexuales; hipanto infundibuliforme, 5 mm long. Cáliz con 4 sépalos elípticos, glabros, 10 mm long. x 3,5-5,5 mm lat. Corola con 5 pétalos castaño-verdosos, lineares a angostamente elípticos, 6,5-8 mm long. x 1-1,5 mm lat. Androceo de 3 estambres fértiles, exsertos, castaños, 21 mm long. Ovario oblongo, 4 mm long. 1,5 mm lat., glabro, con estípite 1,5 mm long. Legumbre inmadura alargada, comprimida lateralmente, verdosa, ferrugínea, reticulada, falcada, probablemente leñosa. Árboles de 9-11 m alt., 20 cm diám., inerme, con ramas jóvenes pubescentes. Hojas 1-folioladas, pecioluladas; estípulas deciduas; lámina elíptica, 5,5-7,5 cm long. x 2,5-3,5 cm lat., de base atenuada, ápice agudo u obtuso a emarginado, coriácea, abaxialmente glabra y con puntuaciones Inflorescencia de racimos axilares o terminales breves; brácteas tempranamente caducas; 2 bracté-olas connadas, obovadas, cilioladas apicalmente; flores pediceladas.
Referencias. Cowan (1957a); Rodrigues & Lima (1989); Redden & Herendeen (2006).
Iconografía. Cowan (1957a: Fig. 1d, sub P. emarginata); Lewis et al. (2005: 96, P. emarginata); Rodrigues & Lima (1989: Fig. 1, P. emargi-nata).
Etimología. Del griego opsis=apariencia, por su parecido con el género Paloue.
Distribución geográfica y hábitat. Género monotípico (P. emarginata Cowan) que habita las selvas tropicales de Sudamérica, Brasil amazónico y Guyana, en suelos arcillosos de bordes de ríos, hasta los 137 m s.m.
Usos. Probablemente maderable.
Observaciones. Es afin a Paloue del que se diferencia por su corola con pétalos iguales entre sí, 3 estambres fértiles y 6 estaminodios, todos reunidos irregularmente hacia la base.
Material de referencia
GUYANA. Side of Bunawan Creek, "tree with grey bark", 31-X-1952, N. G. L. Guppy 513 (Bristish Guiana Forest Dept. No. 7528) (holotipo N Y, no visto, isotipo US 2169118, Imagen Digital 1222!).
20. PELTOGYNE Vogel, Linnaea 11: 410. 1837. Especie tipo: Peltogyne discolor Vogel.
Flores bisexuales, actinomorfas a subzigomorfas; hipanto engrosado, disciforme a turbinado. Cáliz de 4 sépalos imbricados, ovados o suborbi-culares. Corola de 5 pétalos, ancha o angostamente ovados, obovados o lineares, generalmente desiguales, sésiles o brevemente unguiculados. Estambres 10, libres, exsertos, glabros; anteras generalmente dorsifijas, uniformes. Ovario breve o alargado, glabro o piloso, pauci-ovulado, con estípite breve, adnato al hipanto; estilo corto a alargado, glabro; estigma terminal, capitado-dila-tado. Legumbre oblicuamente orbicular a subdel-toide, comprimida lateralmente, coriácea a leñosa, glabra, dehiscente o no, con la sutura superior angostamente alada o no. Semilla generalmente 1, suborbicular, compresa, exalbuminda, exarilada. Árboles pequeños a grandes, a veces con altas raíces tabulares en la base del tronco, inermes. Hojas bifoliadas; estípulas tempranamente caducas; folíolos membranáceos o coriáceos, peciolulados, elípticos a obovados, falcados, pilosos cuando jóvenes, glabros, generalmente glanduloso-punteados. Inflorescencias en racimos o panículas, terminales o axilares, con pubescencia ferrugínea o serícea; brácteas pequeñas , caducas, bractéolas generalmente breves y caducas; flores pediceladas, pequeñas, blancas o rosadas.
Referencias. Silva (1976).
Iconografía. Bentham (1870: tab. 60, Figs. 1 y 2, sub P. paniculata y P. densiflora); Silva (1976: Fig. 7, P. heterophylla; Fig. 11, P. prancei); Lewis et al. (2005: 79, P. pauciflora); Steyermark (1998: Fig. 74, P. floribunda; Fig. 75, P. paniculata subsp. pubescens y Fig. 6, P. venosa subsp. densiflora).
Nombres vulgares. Conocidas comúnmente en Brasil como "Pau roxo", pero abundan otros nombres vulgares (Silva, 1976); P. paniculata, "Purple heart"; P. paniculatus subsp. pubescens, "Zapatero" (Venezuela).
Etimología. Del griego peltos=escudo y gyne= femenino, en alusión al estigma dilatado en la especie típica.
Distribución geográfica y hábitat. Género con alrededor de 25 especies, desde México, Panamá, Venezuela, Colombia y Bolivia hacia Guyana, Suriname, Guayana Francesa hasta el SE de Brasil, principalmente en el Amazonas, 1 especie en la zona caribeña (Isla de Trinidad). Algunas especies, como por ejemplo P. floribunda (Kunth) Pittier, llegan hasta los 600 m s.m. Crecen en bordes de ríos, selvas, praderas graminosas y arbustiva o en serranías.
Usos. Peltogyne paniculata Benth., P. paniculata subsp. pubescens y otras especies son maderables (Uphof, 1968: 393). Según Contreras Miranda et al. (2004: 96) las especies de este género son utilizadas para artesanías, y son importantes por su composición química y en la ecología del Amazonas (Silva, 1976: 9).
Material de referencia
P. confertifolia (Hayne) Benth.
BRASIL. Minas Gerais. Municipio de Ituiutaba, campo de aviaçao, "pequena árvore do cerado, fl. branca conm man cheíro", 28-V-1945 (fl), A. Mancedo 477 (SI).
P. discolor Vogel
BRASIL. "ad Mayé prope Rio de Janeiro" B. Luschnath, s. n. (in Herb. Lucae, holotipo probable P, no visto).
P. maranhensis Huber ex Ducke
BRASIL. Maranháo. Sao Luis, Grapia Barreto, 25-X.1948 (fr), A Duche 2175 (SI).
P paniculata Benth. subsp. pubescens (Benth.) M. Freitas da Silva
BRASIL Amazonas. Territorio Roraima, Rio Branco, Caracarahy, "silva riparia inundabili, arbor mediocrei, floribus pallida roseis", 19-VIII-1943 (fl), A. Duche 1346 (SI).
P venosa (M. Vahl.) Benth. subsp. densiflora (Spruce ex Benth.) M. Freitas da Silva.
BRASIL. Amazonas. Região do Anapú, Rio Pracupí, Portel, "árvore 5 m, beira rio", 12-VIII-1956, R. Fróes 32964 (SI).
21. PRIORIA Griseb., Fl. Brit. W. I.: 215. 1860. Especie tipo: Prioria copaifera Griseb.
Flores bisexuales, subzigomorfas; hipanto muy breve, disciforme. Cáliz con 5 sépalos imbricados, orbiculares, petaloides, ca. 2,5 mm. Corola ausente. Estambres 10, libres, subiguales, 5 mm long., filamentos pilosos basalmente; anteras uniformes, conectivo engrosado, con apéndice detrás de las tecas. Ovario oblicuamente ovoide, subsésil, piloso, central, libre, 1-2-ovulado; estilo breve, subulado; estigma terminal, puntiforme. Legumbre oblicuamente obovoide-orbicular, comprida lateralmente, castaña, coriácea a leñosa, prominentemente nervada, verrucosa, lepidota cuando joven, tardíamente dehiscente. Semilla 1, compresa, subovoide, péndula. Árboles de 5-40 m alt., inermes. Hojas paripinnadas, 3-7 cm long.; estípulas inconspicuas, caducas; folíolos (2-) 4 pares, peciolulados, oblicuamente elípticos, 6-16 x 4-8 cm, de base obtusa, a veces asimétrica, ápice cortamente acuminado, coriáceos, pelúcidopunteados, glabros. Inflorescencia en panículas de racimos espiciformes, 10 cm long., sobre las ramas apicales; flores pequeñas, blanquecinas, sésiles, numerosas; brácteas inconspicuas; 2 bractéolas connadas formando una copa bilobada que envuelve al hipanto.
Referencias. Léonard (1957); Breteler (1999); Herenden et al. (2003).
Iconografía. Woodson et al. (1951: Fig. 112, Prioria copaifera); Lewis et al. (2005: 75, P. copaifera).
Nombres vulgares. "Cativo", "Cautivo", "Camibar" (Costa Rica).
Etimología. En honor de R. C. A. Prior (1809-1902), botánico inglés y uno de los promotores de la Flora of the British West Indian Islands.
Distribución geográfica y hábitat. Género con 1 especie, P. copaifera Griseb., en Nicaragua, Panamá, Costa Rica, Jamaica y Colombia, que crece hasta los 300 m s.m.
Usos. La madera, poco durable, se utiliza para la fabricación de mobiliario rústico (Uphof, 1968. 428); también es medicinal, fuente de oleo-resina "bálsamo" y de semillas comestibles.
Material de referencia
P. copaifera Griseb.
JAMAICA. "Rare at Bachelor's Hall, near Bath", N. Wilson s. n. (holotipo probable K, no visto).
COSTA RICA. Prov. León, bank of inland waterway 3 km north of Moín, 13-II-1965 (fl, fr), R. Lent 352 (imagen digital F 1639126!).
PANAMÁ. Barro Colorado Island, Canal Zone, lake shore east of Donato1, 13-X-1973 (fl en pimpollo), G. Montgomery 188 (imagen digital F 1808793!).
22. TAMARINDUS L., Sp. pl. 34. 1753. Especie tipo: Tamarindus indica L.
Flores bisexuales, zigomorfas; hipanto brevemente turbinado, 3-5 mm long. Cáliz de 4 sépalos imbricados, oblongos, agudos, 8-12 mm.long. Corola de 5 pétalos, elíptico u obovados, blanquecinos o amarillentos con venación rojiza, 10-13 mm long., 3 superiores, desarrollados y 2 inferiores, menores, setiformes. Estambres 3, libres en su mitad superior, connados hacia la base en una banda pubescente abierta adaxialmente, alternando con 4-5 dientes estériles. Ovario linear, pubescente, sobre largo estípite que se une unilateralmente al hipanto; estilo elongado, levemente incurvo hacia el ápice; estigma terminal, pequeño, capitado. Fruto linear, incurvo o recto, grueso, (3-)6,5-14 x 2-3 cm, subcompreso, a veces irregularmente constricto, epicarpo fino, castaño, mesocarpo pulposo, endocarpo grueso y coriáceo, indehiscente, septado entre las semillas. Semillas 1-10, castañas , compresas, irregularmente rómbicas a trapezoides. Árbol inerme, de 2,5-25 m alt., perennifolio. Hojas paripinnadas de 5-16 cm, más o menos pubescentes, folíolos 8-18(-21) pares, angostamente oblongo-elípticos(0,8-)1,2-3,2 x 0,3-1,1 cm, obtusos, de base asimétrica, generalmente glabros,subsésiles; estípulas tempranamente caducas. Racimos de 1-15(-22) cm de largo, laxos, terminales o laterales, péndulos, con el eje principal subglabro a densamente pubescente; brácteas y 2 bractéolas presentes; pimpollos florales rojizos sobre pedicelos de 3-14 mm de largo.
Iconografía. Brenan (1967: Fig. 32); Burkart (1972: Fig. 128 G); Lewis et al. (2005: 90, T. indica); Roti-Michelozzi (1957: Fig. 1); Taubert (1891-94: 139, Fig. 79, T. indica).
Nombres vulgares. "Tamarindo".
Etimología. Del árabe tamer o tamar=dátil e hindi=hindúes, es decir "dátil de los hindúes".
Distribución geográfica y hábitat. Género con 1 especie, T. indica L, polimorfa, presumiblemente nativa de África; ampliamente cultivada en zonas tropicales y probablemente crezca como espóntanea en algunos paises. (En Sudamérica cfr. Material de referencia Nee & Vargas 40253). Usos. T. indica L., muy usado para sombra, es de fina madera, tenaz, rojiza. Las hojas, los frutos y las semillas son medicinales. El fruto es comestible, se hacen bocadillos y además se usa para la fabricación de bebidas, dulces, compotas y condimentos (Dassanayake & Fosberg, 1991: 96; Uphof, 1968: 510).
Observaciones. Para un cuadro completo de los sinónimos de T. indica, véase Roti-Michelozzi (1957).
Material de referencia
"Habitat in India, America, Aegypto, Arabia" (sintipos LINN, no vistos, microfilm IDC 49.1 y 49.2-No. 24 SI!).
ARGENTINA. Jujuy. Depto. Ledesma, cultiv. calle Vollmann de Ledesma, 23-II-2004 (fl), E. Ulibarri 1874 (SI).
BOLIVIA. Santa Cruz. Prov. Ichilo, 2,5 km SW of Buena Vista on road to Rio Surutu; "marshes and marshy pasture on flat; tree 3,5 m tall; seems not to have been planted; flowers cream with reddish lines; 330 m s.m.", 8-XII-1990 (fl), M. Nee & I. Vargas 40253 (NY, SI).
BRASIL. Rio Grande do Norte. Mitad camino entre Mossoró y Tibau, "árbol 8 m alt.; copa compacta, globosa; madera tenaz; racimos péndulos; flor crema-rosada", 24-I-1974 (fl), A. Burkart 30317 (SI).
COLOMBIA. Antioquia. En selvas en la hacienda de Montenegro, cerca a la Pintada; árbol 20 m alt., cultiv.?, 19-XII-1947 (fr), J. M. Mejía et al. 17C299 (Ex Herb. Fac. Nac. Agron., SI).
23. THYLACANTHUS Tul., Arch. Mus. Paris 4: 175. 1844. Especie tipo: T. ferrugineus Tul.
Flores bisexuales, subzigomorfas; hipanto nulo. Cáliz de 5 sépalos, imbricados en prefloración, subiguales, ovados a orbiculares, petaloides, ciliados. Corola de 5 pétalos, imbricados en prefloración, angostamente obovados. Androceo de 10 estambres, 9 connados hacia la base, 1 libre; filamentos glabros, inflexos distalmente; anteras breves, uniformes. Ovario subsésil, central, libre, ferrugíneo, 3-4-ovulado; estilo alargado, involuto en prefloración; estigma peltado. legumbre desconocida. Árboles o arbustos, inermes, ramas con pubescencia cinérea o ferrugínea. Hojas paripinnadas; folíolos generalmente 3 pares, brevemente peciolulados, elípticos, acuminados u obtusos, de base asimétrica, subcoriáceos, nervados, glabros en el haz, pubescentes en el envés. Inflorescencia panicualada, ferrugínea; flores subsésiles; brácteas engrosadas, cóncavas, ferrugíneas, caducas; bractéolas engrosadas, ovadas, ferrugíneas, incluyendo al primordio floral, después de la antesis formando un involucro 2-lobado persistente en la base de la flor.
Referencias. Bentham (1870); Ducke (1939); Mackinder (2005); Pellegrin (1943); Tulasne (1844a).
Etimología. Del griego thylakos=bolsa, en alusión a la envoltura floral.
Distribución geográfica y hábitat. Género con 1 especie poco conocida, T. ferrugineus Tul., del Brasil.
Observaciones. Queda en duda si se trata de una especie introducida desde el África y de la que no se ha podido estudiar mejor material. Algunos autores la sinonimizan con Julbernardia paniculata (Benth.) Troupin de África, Mackinder (2005: 105); de todos modos tendría prioridad Thylacanthus y no Julbernardia Pellegr.
Material de referencia
BRASIL. "Nascitur ad Para, Brasiliae borealis" (holotipo P, no visto, fragmento bastante deteriorado y calco de rama K!).
CONCLUSIONES
La subfamilia Caesalpinioideae comprende en Sudamérica 65 géneros (30 géneros endémicos), que representan a las 4 tribus actualmente aceptadas. Entre las Caesalpinieae tenemos como géneros endémicos: Arapatiella (Brasil); Balsamocarpon (Chile); Batesia (Brasil, Colombia, Guyana Francesa y Perú); Campsiandra (Brasil, Colombia, Perú, Venezuela); Cenostigma (Brasil, Paraguay); Diptychandra (Brasil, Paraguay); Jacqueshuberia (Brasil, Colombia, Guyana, Perú, Venezuela); Lophocarpinia (Argentina, Paraguay); Melanoxylon (Brasil); Moldenhawera (Brasil); Orphanodendron (Colombia), escasamente representado en herbarios, se necesitarían nuevas colecciones; Pterogyne (Argentina,Bolivia, Brasil); Recordoxylon (principalmente Brasil, Venezuela); Stenodrepanum (Argentina); Vouacapoua (Brasil, Guayanas); Zuccagnia (Argentina). Dentro de las Cassieae a: Androcalymma (Brasil), género poco conocido, se necesitan nuevas colecciones; Apuleia (Argentina, Brasil, Colombia, Ecuador, Paraguay, Perú, Venezuela); Dicorynia (Brasil, Colombia, Guayanas, Venezuela) y Martiodendron (Brasil, Guyana, Venezuela). Finalmente en la tribu de las Detarieae se encuentran: Brachycylix (Colombia), poco representado en los herbarios, se necesitarían nuevas colecciones; Brodriguesia (Brasil), escasamente representado en los herbarios; Dicymbe (Brasil, Colombia, Guayanas, Venezuela); Ecuadendron (Ecuador); Elizabetha (Brasil, Colombia, Guyana, Suriname, Venezuela); Eperua (Brasil, Colombia, Guayana Francesa, Guyana, Suriname, Venezuela); Goniorrhachis (Brasil); Heterostemon (Brasil, Colombia, Venezuela); Paloue (Brasil, Guayana Francesa, Guyana, Suriname) y Paloveopsis (Brasil, Guyana), éste último, poco representado en herbarios, se necesitarían nuevas colecciones.
Debido a la rápida deforestación en los trópicos, la información requerida de los géneros poco conocidos o escasamente coleccionados, se ve amenazada a perderse, pues las especies corren el riesgo de extinción.
Se acepta a las Detarieae sensu lato según Mackinder (2005) y también la sinonimia de Sclerolobium con Tachigali.
Se mantiene el género Caesalpinia en sentido amplio debido a que aún se necesitan estudios biosistemáticos en ese grupo, evitando así combinaciones innecesarias. En cambio Cercidium se mantiene separado de Parkinsonia hasta que no se hagan nuevos estudios y las combinaciones correspondientes.
La tribu Caesalpinieae está compuesta por 31 géneros, es la más numerosa, de ellos 3 (Ceratonia, Delonix y Gymnocladus) son introducidos; Cassieae, con 9; Cercideae, con 2, 1 (Cercis) introducido y Detarieae, con 21, 1 género introducido (Tamarindus) y 1 de introducción dudosa (Thylacanthus, de Brasil).
Los géneros introducidos aparecen principalmente cultivados, sólo Tamarindus podría encontrarse como subespontáneo en Bolivia.
Los géneros Barnebydendron (Phyllocarpus); Brodriguesia; Ecuadendron; Orphanodendron y Pomaria, son tratados por primera vez en conjunto y en lengua española; los cinco, excepto el último, son posteriores a la obra general sobre la sistemática de las Leguminosas de Polhill & Raven (1981).
El género Zuccagnia ya fue considerado, como endémico para Argentina, (Ulibarri, 2005); en este trabajo se considera la extensión de su área en las provincias de Jujuy y Córdoba (Argentina). Es interesante porque este género es un elemento característico de la provincia fitogeográfica argentina del monte, lo que indicaría que una pequeña área se introduce por el norte en el sudoeste de Jujuy. Lo mismo se puede decir para el área de Parkinsonia aculeata, que debido al examen de distintas colecciones queda demostrada su presencia en Jujuy.
AGRADECIMIENTOS
Se agradece al Dr. F. Zuloaga por la lectura crítica del manuscrito y sugerencias brindadas, como también a R. Pozner, M. Múlgura, A. Cialdella, S. Denham y M. Ponce. Se extiende además este agradecimiento a las siguientes personas e instituciones que de una manera u otra han posibilitado el estudio de los distintos materiales, intercambio de opiniones o el acceso a la bibliografía consultada, ellos son: M. Arriaga (BA); G. Bernardello (CORD); Biblioteca Museo Botánico (CORD); N. Deginani (SI); M. R. Figueroa, M. Sidán y O. Varela (LIL); G. Giberti (BAF); M. González Bausá (MA); L. Iharlegi (LP); G. P.Lewis, L. Rico y S. Cox (K); C. Marticorena y A. Marticorena (CONC), M. Muñoz (SGO); M. Peña (BM); R. Pessa (Instituto Internacional Ecología, Brasil); O. Osiaref y E. Allers (US); B. B. Simpson (TEX); B. Thiers (NY); Proyecto PIP 5262-CONICET (2005-2006) de Plantas Vasculares; al personal de la biblioteca del Darwinion por su amable atención; a los árbitros que con sus sugerencias, pacientes correcciones y aporte de citas, han enriquecido este trabajo; a V. Dudás y a M. Valente por acondicionar y escanear las láminas.
1Los primeros en describir este tipo de dehiscencia fueron Britton & Rose (1930:318), sin asignarle un nombre. En este caso, le correspondería el nombre de dehiscencia rimosa.
2Para otros sinónimos véase Irwin y Barneby in Polhill, 1981: 105
3Para un cuadro completo de la sinonimia genérica principalmente de las especies Neotropicales y su tipificación, véase Wunderlin, 1976 y 1983; Lewis & Forest, 2005a.
BIBLIOGRAFÍA
1 Abedini, W. 2005. Propagación vegetativa de Parkinsonia aculeata L. por estaquillado. Quebracho 12: 22-33. [ Links ]
2 Alvino, F. de O.; M. F. F da Silva & B. P. Rayol. 2005. Potencial de uso das espécies arbóreas de uma floresta secundária, na Zona Bragantina, Pará, Brasil. Acta Amazonica 35: 413-420. [ Links ]
3 Amshoff, G. J. H. 1939. Caesalpinioideae, in A. A. Pulle (ed.), Flora of Suriname, vol. 2(2). Leiden: E. J. Brill. [ Links ]
4 Aronson, J. & C. Saravia Toledo. 1992. Caesalpinia paraguariensis (Fabaceae): forage tree for all seasons. Econ. Bot. 46: 121-132. [ Links ]
5 Aymard, G. A. 1998. Recordoxylon, en J. A. Steyermark; P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, vol. 4, pp. 98-99. Saint Louis: Missouri Botanical Garden. [ Links ]
6 Aublet, J. B. C. F. 1775. Histoire des plantes de la Guiane françoise. Londres, París: P. F. Didot jeune. [ Links ]
7 Bandyopadhyay, S. & B. D. Sharma. 1993. Observations on the pollen morphology of some Bauhinias (Leguminosae, Caesalpinioideae) from India. Bull. Bot. Surv. India 35: 32-39. [ Links ]
8 Banks, H.; B. B. Klitgaard, G. P. Lewis, P. R. Crane & A. Bruneau. 2003. Pollen and the systematics of tribes Caesalpinieae and Cassieae (Caesalpinioideae: Leguminosae), in B. B. Klitgaard & A. Bruneau (eds.), Advances in Legume Systematics, part 10: Higher Level Systematics, pp. 95-122. Kew: Royal Botanic Gardens. [ Links ]
9 Barneby, R. C. & J. W. Grimes.1990. Orphanodendron, a new genus of Caesalpinioid Leguminosae from Northwestern Colombia. Brittonia 42: 249-253. [ Links ]
10 Barneby, R. C. 1993. Two taxonomic equations relevant to the flora of Saül, French Guiana. Brittonia 45: 235-236. [ Links ]
11 Barneby, R. C. 1996. Neotropical Fabales at NY: aside and oversights. Brittonia 48: 174-187. [ Links ]
12 Bentham, G. 1839 Description of the Mora tree. Trans. Linn. Soc. 18: 207-211. [ Links ]
13 Bentham, G. 1865. Description of some New Genera and Species of Tropical Leguminosae. Trans. Linn. Soc. 25: 302. [ Links ]
14 Bentham, G. 1870. Caesalpinieae, in K. F. P. von Martius (ed.), Flora Brasiliensis, vol. 15(2), pp. 41-254. Munich: Apud R. Oldenbourg [ Links ]
15 Bernardello, L.; L. B. Stiefkens & M. A. Piovano.1990. Números cromosómicos en Dicotiledóneas argentinas. Bol. Soc. Argent. Bot. 26: 149-157. [ Links ]
16 Bernardi, L. 1984. Contribución a la dendrología Paraguaya. Boissiera 35: 1-341. [ Links ]
17 Bolzon de Muñiz, G. I. & J. N. C. Marchiori. 2005. Anatomia da madeira de duas Leguminosas Cesalpinioídeas da floresta estacional de Misiones-Argentina. Balduinia 3: 14-20. [ Links ]
18 Bravo, L. D. 1978a. El género Cassia en la Argentina, I. Serie Aphyllae. Darwiniana 21: 343-391. [ Links ]
19 Bravo, L. D. 1978b. Estudio comparativo de las plántulas de las subespecies de Cassia aphylla Cav. Darwiniana 21: 393-399. [ Links ]
20 Bravo, L. D. 1981. El género Cassia en la Argentina, II. Serie Pachycarpae. Darwiniana 23: 257-277. [ Links ]
21 Brenan, J. P. 1967. Subfam. Caesalpinioideae, in E. Milne Redhead & R. M. Polhill (eds.), Flora of Tropical East Africa. Londres: Crown Agents for the Colonies. [ Links ]
22 Breteler, F. J. 1999. A Revision of Prioria, incluiding Gossweilerodendron, Kingiodendron, Oxystigma, and Pterygopodium (Leguminosae-Caesalpinioideae-Detarieae) with emphasis on Africa. Wageningen Agric. Univ. Pap. 99(3): 1-61. Citado por Mackinder (2005: 75). [ Links ]
23 Breteler, F. J. & N. S. Nguema Miyono. 2008. Revision of the African species of Crudia (Leguminosae, Caesalpinioideae). Syst. Georg. Pl. 78: 81-110. [ Links ]
24 Bridson, G. D. R. (Compiler). 2004. Botanico-Periodicum-Huntianum (BPH-2). Pittsburgh: Hunt Institute for Botanical Documentation. [ Links ]
25 Britton, N. L & J. N. Rose. 1930. Caesalpiniaceae. North American Flora, vol. 23, pp. 269-349. The New York Botanical Garden. Lancaster: Lancaster Press. [ Links ]
26 Brummitt, R. K. & C. E. Powell. (eds.). 1992. Authors of Plant Names. Kew: Royal Botanical Gardens. [ Links ]
27 Bruneau, A.; F. Forest, P. S. Herendeen, B. B. Klitgaard & G. P. Lewis. 2001. Phylogenetic relationships in Caesalpinioideae (Leguminosae) as inferred from chloroplast trnl.intron sequences. Syst. Bot. 26: 487-514. [ Links ]
28 Burkart, A. 1936. Las especies Argentinas y Uruguayas del género Caesalpinia. Revista Argent. Agron. 3: 67-112. [ Links ]
29 Burkart, A. 1952. Las Leguminosas argentinas, silvestres y cultivadas, 2ª. ed., pp. 149-192. Buenos Aires: Acme Agency. [ Links ]
30 Burkart, A. 1957. Leguminosas nuevas o críticas , V. Darwiniana 11: 256-271. [ Links ]
31 Burkart, A. 1967. Leguminosae, in A. L. Cabrera (ed.), Flora de la Provincia de Buenos Aires (Argentina). Colecc. Ci. Inst. Nac. Tecnol. Agropecu. 4(3): 394-647. [ Links ]
32 Burkart, A. 1972. Leguminosas, en L. R. Parodi (ed.), Enciclopedia Argentina de Agricultura y Jardinería, 2ª ed. (actualizada por M. J. Dimitri), pp. 467-538. Buenos Aires:Acme Agency. [ Links ]
33 Burkart, A. 1984. Leguminosae, en M. N. Correa (ed.), Flora Patagónica (Argentina). Colecc. Ci. Inst. Nac. Tecnol. Agropecu. 8(4b): 89-297 [ Links ]
34 Burkart, A. 1978. Leguminosas, en L. R. Parodi (ed.), Enciclopedia Argentina de Agricultura y Jardinería, 3ª ed. (actualizada por M. J. Dimitri), vol. 1, pp. 467-538. Buenos Aires: Acme Agency. [ Links ]
35 Burkart, A. 1987. Leguminosae, en N. S. Troncoso de Burkart & N. M. Bacigalupo (eds.), Flora Ilustrada de Entre Ríos (Argentina). Colecc. Ci. Inst. Nac. Tecnol. Agropecu. 6(3a): 442-738. [ Links ]
36 Burkart, A. & A. Carter. 1976. Notas en el género Cercidium (Caesalpinioideae) en Sud América. Darwiniana 20: 305-311. [ Links ]
37 Burkill, I. H. 1966. A Dictionary of the Economic Products of the Malay Peninsula 1(A-H), 2nd ed., pp. 478-488 (Cassia). Kuala Lumpur: Malaysia. Ministry of Agriculture Singapore. Ministry of Agriculture. [ Links ]
38 Capuron, R. 1968. Contributions àl l'étude de la flore forestiére de Madagascar. Reduction du genre Aprevalia Baillon au rang de section du genre Delonix Raf. et description d'une espècie nouvelle (Lég.-Césalp.). Adansonia, sér. 2, 8(1): 11-16. [ Links ]
39 Chauchan, J. S.; P. Tiwari; D. P. Vashist & G. S. Paliwal. 1998. Morphology and histology of stigma and style of Bauhinia purpurea L. J. Indian Bot. Soc. 77: 167-169 [ Links ]
40 Clos, D. 1847. Leguminosas, en C. Gay (ed.), Historia Física y Política de Chile, Botánica, vol. 2, pp. 46-256. Paris: E. Thunot. [ Links ]
41 Clos, D. 1866, en C. Gay (ed.), Atlas de la Historia Física y Política de Chile. Parte Botánica. Paris: E. Thunot. [ Links ]
42 Contreras Miranda, W.; M. E. C. de Owen. & S. Capuz Rizo. 2004. La ecología industrial, el ecodiseño y los procesos más limpios en la industria del mueble con maderas de Venezuela. Revista Forest. Venez. 48: 91-101. [ Links ]
43 Cowan, R. S. 1953a. Leguminosae-Caesalpinioideae, in Maguire, B.; R. S. Cowan & J. J. Wurdack (eds.), The Botany Guayana Highland. A report of the Kumhardt, the Pheleps, and the New York Botanical Garden Venezuelan Expeditions. Mem. New York Bot. Gard. 8: 87-160. [ Links ]
44 Cowan, R. S. 1953b. A taxonomic revision of the genus Macrolobium (Leguminosae-Caesalpinioideae). Mem. New York Bot. Gard. 8: 257-342. [ Links ]
45 Cowan, R. S. 1957a. Tropical American Leguminosae-III. Brittonia 8: 251-253. [ Links ]
46 Cowan, R. S. 1957b.Leguminosae, in B. Maguire & J. J. Wurdack (eds.), The botany of the Guayana Highland. Part II. Mem. New York Bot. Gard. 9: 235-392. [ Links ]
47 Cowan, R. S. 1958. Calliandra, Cassia, Inga, Jacqueshuberia, Macrolobium, in R. E. Schultes (ed.), Planta Austro-Americanae 10. Bot. Mus. Leafl. 18: 150-151. [ Links ]
48 Cowan, R. S. 1959. Leguminosae of the Western Hemisphere. Notes on Choices of Lectopypes. Taxon 8: 58-60. [ Links ]
49 Cowan, R. S. 1961. Leguminosae, in B. Maguire & J. J. Wurdack (eds.), The botany of the Guayana Highland, Part IV. Mem. New York Bot. Gard. 10: 1-87. [ Links ]
50 Cowan, R. S. 1973. Studies of tropical American Leguminosae-VII. Proc. Biol. Soc. Wash. 86: 447-460. [ Links ]
51 Cowan, R. S. 1975a. Brachycylix, a genus of tropical Leguminosae (Caesalpinioideae). Koninkl. Nederl. Akad. Wetensch., series C 78: 464-467. [ Links ]
52 Cowan, R. S. 1975b. A Monograph of the Genus Eperua (Leguminosae: Caesalpinioideae). Smithsonian Contr. Bot. 28: 1-45. [ Links ]
53 Cowan, R. S. 1976a. A taxonomic revision of the genus Heterostemon (Leguminosae-Caesalpinioideae). Koninkl. Nederl. Akad. Wetensch series C 79: 42-60. [ Links ]
54 Cowan, R. S. 1976b. A taxonomic revision of Elizabetha (Leguminosae-Caesalpinioideae). Koninkl. Nederl. Akad. Wetensch., series. C 79: 323-346. [ Links ]
55 Cowan, R. S. 1981a. New taxa of Leguminosae-Caesalpinioideae from Bahia, Brasil. Brittonia 33: 9-14. [ Links ]
56 Cowan, R. S. 1981b . Caesalpinioidae, in R. M. Polhill & P. H Raven. (eds.), Advances in Legume Systematics, part 2, pp. 57-64. Kew: Royal Botanic Gardens. [ Links ]
57 Cowan, R. S.1985. Studies in tropical American Leguminosae. 9. Brittonia 37: 291-304. [ Links ]
58 Cowan, R. S. 1990.Three new Caesalpiniaceous trees from Guyana and its periphery. Mem. New York Bot. Gard. 64: 205-209. [ Links ]
59 Cowan, R. S. & P. E. Berry. 1998. Elizabetha, Eperua, Heterostemon, in J. A. Steyermark; P. Berry & B. K. Holst.(eds.), Flora of the Venezuelan Guayana, vol. 4, pp. 62-64; 64-67; 67-69. Saint Louis: Missouri Botanical Garden. [ Links ]
60 Curtis, S. & W. J. Hooker. 1829. Curtis's Botanical Magazine, vol.3, nueva serie. London: Eduard Coachman. [ Links ]
61 Das, D. C. & N. D. Paria. 1999. Seedling morphology in identification of some Indian species of Bauhinia L. (Caesalpiniaceae). Feddes Repert. 110: 375-379. [ Links ]
62 Dassanayake, M. D. & F. R. Fosberg (eds.) 1991. A Revised Handbook to the Flora of Ceylan, vol. 7. New Delhi: Amerind Pub. Co. [ Links ]
63 Davies, W. N. 1970. The carob tree and its importance in the agrocultural economy of Cyprus. Econ. Bot. 24: 460-470. [ Links ]
64 Davis, C. C.; P. W Fritsch; J. Li & M. J. Donoghue. 2002. Phylogeny and biogeography of Cercis (Fabaceae): evidence from nuclear ribosomal ITS and chloroplast ndhF sequence data. Syst. Bot. 27: 289-302. [ Links ]
65 Desfontaine, M. 1818. Description de quatre nouveaux genres de plantes. Mem. Mus. Paris 4: 245-255. [ Links ]
66 Del Vitto, L. A.; E. M. Petenatti & M. E. Petenatti. 1997. Recursos herbolarios de San Luis (República Argentina). Multequina 6: 49-66. [ Links ]
67 Ducke, A. 1922. Plantes nouvelles ou peu connues de la Région Amazonienne (IIe partie). Arch. Jard. Bot. Rio de Janeiro 3: 3-281. [ Links ]
68 Ducke, A. 1925a. Plantes nouvelles ou peu connues de la Région Amazonienne (IIIe partie). Arch. Jard. Bot. Rio de Janeiro 4: 1-205. [ Links ]
69 Ducke, A. 1925b. As leguminosas do estado do Pará. Arch. Jard. Bot. Rio de Janeiro 4: 211-341. [ Links ]
70 Ducke, A. 1932. Fifteen new forest trees of the Brazilian Amazon. Trop. Woods 31: 14-15. [ Links ]
71 Ducke, A. 1935. New species of the genus Dimorphandra Schott section Pocillum Tul. J. Wash. Acad. Sci. 25: 193-198. [ Links ]
72 Ducke, A. 1939. As Leguminosas da Amazônia Brasileira. Min. Agric., Serv. Forest.: 3-170. [ Links ]
73 Dwyer, J. D. 1951.The Central American, West Indian, and South american species of Copaifera (Caesalpiniaceae). Brittonia 7: 143-172. [ Links ]
74 Dwyer, J. D. 1954. The tropical american genus Tachigalia Aubl. (Caesalpiniaceae). Ann. Missouri Bot. Gard. 41: 223-255. [ Links ]
75 Dwyer, J. D. 1957. Revision Sclerolobium. Lloydia 20: 67-266. [ Links ]
76 Dwyer, J. D. 1958. The New World species of Cynometra. Ann. Missouri Bot. Gard. 45: 313 [ Links ]
77 Estrada, E.; E. Jurado & C. Yen. 2002. A new record of Gleditisia triacanthos in northeastern Mexico and its phytogeo-graphical interest. Southwestern Naturalist 4: 602-604. [ Links ]
78 Exell, A. W. & F. A. Mendoça. 1956. Conspectus Flora Angolensis, vol. 2, pp. 186-191. Lisboa: Ministerio do Ultramar, Junta de Investigações Coloniais. [ Links ]
79 Ferguson. I. K. 1980. The pollen morphology of Ceratonia (Leguminosae: Caesalpinioideae). Kew Bull. 35: 273-277. [ Links ]
80 Ferguson, I. K. 1987. A preliminary survey of the pollen exine stratification in the Caesalpinioideae, in C. H. Stirton (ed.), Advances in Legume Systematics, part 3, pp. 355-385. Kew: Royal Botanic Gardens. [ Links ]
81 Ferguson, I. K. & K. J. Pearce. 1986. Observations on the pollen morphology of the genus Bauhinia L. (Leguminosae: Caesalpinioideae) in the neotropics, in S. Blackmore & I. K. Ferguson (eds.), Pollen and Spores: form and function. Linnean Society of London Series 12, pp. 283-296. London and New York: Academic Press. [ Links ]
82 Ferguson, I. K.; B. D. Schrire & R. Shepperson. 1994. Pollen morphology of the tribe Sophoreae and relationships between subfamilies Caesalpinioideae and Papilionoideae, in I. Ferguson & S. Tucker (eds.), Advances in Legume Systematics, part 6: Structural botany, pp. 1-259. Kew: Royal Botanic Gardens. [ Links ]
83 Font Quer, P. 1970. Diccionario de Botánica, 3ª. reimpresión. Barcelona: Labor. [ Links ]
84 Fortunato, R. H. 1984. Nota crítica sobre Bauhinia mollis (Bong.) D. Dietr. (Caesalpinioideae-Leguminosae). Parodiana 3: 43-51. [ Links ]
85 Fortunato, R. H. 1986. Revisión del género Bauhinia (Cercideae, Caesalpinioideae, Fabaceae) para la Argentina. Darwiniana 27: 527- 557. [ Links ]
86 Fortunato, R. H. 1997. Fabaceae (2). Tribu 3. Cercideae, in A.T. Hunziker (ed.), Flora Fanerogámica Argentina 33: 1-9. [ Links ]
87 Fortunato, R. H. & R. P. Wunderlin. 1985. Benthamia, una nueva Sección del género Bauhinia L. (Cercideae, Caesalpinioideae, Fabaceae). Parodiana 3: 317-327. [ Links ]
88 Fougère-Danezan, M.; S. Maumont & A. Bruneau. 2003. Phylogenetic relationships in resin-producing Detarieae inferred from molecular data and preliminary results for a biogeographic hypothesis, in B. B. Klitgaard & A. Bruneau (eds.), Advances in Legume Systematics, part 10: Higher Level Systematics, pp. 161-180. Kew: Royal Botanic Gardens. [ Links ]
89 Fougère-Danezan, M.; S. Maumont & A. Bruneau. 2007. Relationships among resin-producing Detarieae s. l. (Leguminosae) as inferred by molecular data. Syst. Bot. 32: 748-761. [ Links ]
90 Gamerro, J. C. & R. H. Fortunato. 2001. Morfología del polen de las especies argentinas de Bauhinia (Cercideae, Caesalpinioideae, Fabaceae). Ann. Missouri Bot. Gard. 88: 144-158. [ Links ]
91 Gasson, P.; C. Trafford & B. Matthews. 2003. Wood anatomy of Caesalpinioideae, in B. B. Klitgaard & A. Bruneau (eds.), Advances in Legume Sytematics, part 10: Higher Level Systematics, pp. 63-93. Kew: Royal Botanic Gardens. [ Links ]
92 Goldblatt, P. 1981. Cytology and the Phylogeny of the Leguminosae, in R. M. Polhill & P. H. Raven (eds.), Advances in Legume Systematics, part 2, pp. 427-463. Kew: Royal Botanic Gardens. [ Links ]
93 Haston, E. M.; G. P. Lewis & J. A. Hawkins. 2003. A phylogenetic investigation of the Peltophorum group (Caesalpinieae: Leguminosae), in B. B. Klitgaard & A. Bruneau (eds.), Advances in Legume Systematics, part 10: Higher Level Systematics, pp. 149-159. Kew: Royal Botanic Gardens. [ Links ]
94 Herendeen, P. S.; W. L. Crept & D. L. Dilcher. 1992. The fossil history of the Leguminosae: phylogenetic and biogeographic implications, in P. S. Herendeen & D. L. Dilcher (eds.), Advances in Legume Systematics, part 4: The Fossil Record, pp. 303-316. Kew: Royal Botanic Gardens. [ Links ]
95 Herendeen, P. S. 2000. Structural evolution in the Caesalpinioideae (Leguminosae), in P. S. Herendeen & A. Bruneau (eds.), Advances in Legume Systematics, part 9, pp. 45-64. Kew: Royal Botanic Gardens. [ Links ]
96 Herendeen, P. S.; A. Bruneau & G. P. Lewis. 2003. Phylogenetic relationship in Caesalpinioid legumes: a preliminar analysis based on morphological and molecular data, in B. [ Links ]
97 B. Klitgaard & A. Bruneaeu (eds.), Advances in Legume Systematics, part 10: Higher Level Systematics, pp. 37-62. Kew: Royal Botanic Gardens. [ Links ]
98 Hill, A. F. 1965. Botánica económica. Plantas útiles y productos vegetales. Barcelona: Omega. [ Links ]
99 Hillcoat, D.; G. P. Lewis & B. Verdcourt. 1980. A new species of Ceratonia (Leguminosae-Caesalpinioideae) from Arabia and the Somali Republic. Kew Bull. 35: 261-271. [ Links ]
100 Holmgren, P. K.; N. H. Holmgren & L. Barnett. 1990. Index Herbariorum, part I: The Herbaria of the World. (8th. ed.): 1-693. New York: New York Botanical Garden. [ Links ]
101 Hokcke, O. & N. Ramírez. 1990. Pollination ecology of seven species of Bauhinia L. (Leguminosae: Caesalpinioideae). Ann. Missouri Bot. Gard. 77: 559-572. [ Links ]
102 Hou, D. 1996. Crudia, Gleditsia and Exotic Genera, Caesalpi-niaceae, in Ding Hou, K. Larsen & S. S. Larsen (eds.), Fl. Malesiana 12: 409-730. [ Links ]
103 Howard, R. A. 1983. The plates of Aublet's Histoire des Plantes de la Guiane Françoise. J. Arnold Arbor. 64: 255-292. [ Links ]
104 Hughes, C. E.; A. Daza Yomona & J. A. Hawkins. 2003. A new "Palo Verde" (Parkinsonia-Leguminosae: Caesalpinioideae) from Peru. Kew Bull. 58: 467-472. [ Links ]
105 Hutchinson, J. 1964. The genera of flowering plants (Angiospermae) Dicotyledons, vol.1, pp. 221-276. Oxford: Clarendon Press. [ Links ]
106 Iribarren, A. & A. B. Pomilio. 1983. Components of Bauhinia candicans. Lloydia 46: 752-753. [ Links ]
107 Irwin, H. S. & M. T. K. Arroyo. 1974. Three new species from South America. Brittonia 26: 266-270. [ Links ]
108 Irwin, H. S. & R. C. Barneby. 1981. Cassieae, in R. M. Polhill & P. H. Raven (eds.), Advances in Legume Systematics, part 1, pp. 97-106. Kew: Royal Botanic Gardens. [ Links ]
109 Irwin, H. S. & R. C. Barneby. 1982a. The American Cassiinae. A synoptical revision of Leguminosae tribe Cassieae subtribe Cassiinae in the New World. Mem. New Yotk Bot. Gard 35: 1-454 [ Links ]
110 Irwin, H. S. & R. C. Barneby. 1982b. The American Cassiinae. A synoptical revision of Leguminosae tribe Cassieae subtribe Cassiinae in the New World. Mem. New York Bot. Gard 35: 455-918. [ Links ].
111 Isely, D. 1975. Leguminosae of the United States. II. Subfamily Caesalpinioideae. Mem. New York Bot. Gard. 25: 1-228. [ Links ]
112 Izaguirre, P. & R. Beyhaut. 2003. Las Leguminosas in Uruguay y regiones vecinas, parte 2: Caesalpinioideae y parte 3: Mimosoideae. Montevideo: Hemisferio Sur. [ Links ]
113 Kantz, K. E. & S. C. Tucker. 1994. Developmental basis of floral characters in the Caesalpinieae, in I. K. Ferguson & S. C. Tucker (eds.), Advances in Legume Systematics, part 6: Structural Botany, pp. 33-40. Kew: Royal Botanic Gardens. [ Links ]
114 Karsten, H. 1861. Florae Columbiae, terrarumque adiacentium specimina selecta in peregrinatione duodecim annorum observata delineavit et descripsit H. Karsten, vol. 1. Berlin: Apud F. Duemmler. [ Links ]
115 Karsten, H. 1862. Florae Columbiae, terrarumque adiacentium specimina selecta in peregrinatione duodecim annorum observata delineavit et descripsit H. Karsten, vol. 2. Berlin: Apud F. Duemmler. [ Links ]
116 Klitgaard, B. B. 1991. Ecuadorian Brownea and Browneopsis (Leguminosae-Caesalpinioideae): Taxonomy, palinology, and morphology. Nord. J. Bot. 11: 433-449. [ Links ]
117 Kirkbride, J. H.; C. R. Gunn & C. A. Ritchie. 1994. Seed and fruit phylogenies of Caesalpinioideae and Mimosoideae (Fabaceae) and their tribes, in I. K. Ferguson & S. C. Tucker (eds.), Advances in Legume Systematics, part 6: Structural Botany, pp. 117-140. Kew: Royal Botanic Gardens. [ Links ]
118 Kirkbride, J. H. 1999. Barnebydendron, a new generic name (Fabaceae,Caesalpinioideae, Detarieae, Brownea group). Sida 18: 815-818. [ Links ]
119 Knaapvan Meeuwen, M. S. 1970. A revision of four genera of the tribe Leguminosae-Caesalpinioideae-Cynometreae in Indomalasia and the Pacific. Blumea 18: 1-52. [ Links ]
120 Koeppen, R. C. & H. H. Iltis. 1962. Revision of Martiodendron (Cassieae, Caesalpiniaceae). Brittonia 14: 191-209. [ Links ]
121 Koeppen, R. C. 1967. Revision of Dicorynia (Cassieae, Caesalpiniaceae). Brittonia 19: 42-61. [ Links ]
122 Kotresha, K. & Y. N. Seetharam. 1995. Epidermal studies in some species of Bauhinia L. (Caesalpinioideae). Phytomorphology 45: 127-137. [ Links ]
123 Langenheim, J. H.; Y.-T. Lee & S. S. Martin. 1973. An evolutionary and ecological perpective of Amazonian Hylaea species of Hymenaea (Leguminosae: Caesalpinioidae). Acta Amazonica 3: 5-38. [ Links ]
124 Larsen, K. & D. Hou. 1996, Senna, in Ding Hou, K. Larsen & S. S. Larsen (eds.), Flora Malesiana vol. 12, pp. 409-730. [ Links ]
125 Larson, P. R. 1984a.Vascularization of developing leaves of Gleditsia triacanthos L. I. The node, rachis, and rachillae. Amer. J. Bot. 71: 1201-1210. [ Links ]
126 Larson, P. R. 1984b.Vascularization of developing leaves of Gleditsia triacanthos L. II. Leaflet initiation and early vascularization. Amer. J. Bot. 71: 1211-1220. [ Links ]
127 Lee, Y.-T. & J. H. Langenheim. 1975. Systematics of the genus Hymenaea L. (Leguminosae, Caesalpinioideae, Detarieae). Univ. Calif. Publ. Bot. 69: 1-109. [ Links ]
128 Léonard, J. 1957. Genera des Cynometreae et des Amherstieae africaines (Leguminosae-Caesalpinioidae) Essai de blastogénie appliquée à la sistématique. Mém. Acad. Roy. Belg. Cl. Sci. 30: 3-312. [ Links ]
129 Lewis, G. P. 1987. Legumes of Bahia. Kew: Royal Botanic Gardens. [ Links ]
130 Lewis, G. P. 1994. Systematic studies in neotropical Caesalpinia L. (Leguminosae: Caesalpinioidae). Ph. D. Thesis, University of Saint Andrews, U. K. [ Links ]
131 Lewis, G. P. 1998. Caesalpinia. A revision of the Poincianella-Erythrostemon group. Kew: Royal Botanic Gardens. [ Links ]
132 Lewis, G. P. 2005. Cassieae, in G. P. Lewis; B. Schrire; B. Mackinder & M. Lock. (eds.). Legumes of the World: 57. Kew: Royal Botanic Gardens. [ Links ]
133 Lewis, G. P. & F. Forest. 2005. Cercideae, in G. P. Lewis; B Schrire; B. Mackinder & M. Lock. (eds.), Legumes of the World: 57. Kew: Royal Botanic Gardens. [ Links ]
134 Lewis, G. P. & B. D. Schrire. 1995. A reappraisal of the Caesalpinia group (Caesalpinioideae: Caesalpinieae) using phylogenetic analysis, in M. D. Crisp & J. J. Doyle (eds.) Advances in Legume Systematics, part 7: Phylogeny, pp. 41-52. Kew: Royal Botanic Gardens. [ Links ]
135 Lewis, G. P.; B. Schrire; B.Mackinder & M. Lock. (eds.). 2005. Legumes of the World. Kew: Royal Botanic Gardens. [ Links ]
136 Lewis, G. P.; B. B. Simpson & J. L. Neff. 2000. Progress in understanding the reproductive biology of the Caesalpinioideae (Leguminosae), in Herendeen, P. S. & A. Bruneau (eds.) Advances in Legume Systematics, part 9, pp. 65-78. Kew: Royal Botanic Gardens. [ Links ]
137 Macbride, J. F. 1943. Leguminosae. Flora of Peru. Field Mus. Nat. Hist., Bot. Ser. 13(3, 1): 1-507. [ Links ]
138 Mackinder, B. 2005. Detarieae, in G. P. Lewis, B. Schrire; B. Mackinder & M. Lock. (eds.), Legumes of the World: 69-109. Kew: Royal Botanic Gardens. [ Links ]
139 McVaugh, R. 1987. Leguminosae, in R. McVaugh & W. R. Anderson (eds.), Flora Novo-Galiciana, vol. 5. Ann Arbor: University of Michigan Press. [ Links ]
140 Marazzi, B.; P. K. indress; L. Paganucci de Queiroz & E. Conti. 2006. Phylogenetic relationships within Senna (Leguminosae, Cassiinae) based on three chloroplast DNA regions: patterns in the evolution of floral symmetry and ectrafloral nectaries. Amer. J. Bot. 93: 288-303. [ Links ]
141 Marazzi, B.; R. H. Fortunato; P. K. Endress & R. Spichiger. 2006a. Senna (Cassiinae, Leguminosae) in Paraguay: synopsis, ocurrence, ecological role and ethnobotany. Candollea 61: 315-329. [ Links ]
142 Micheli, M. 1889. Contributions a la Flore du Paraguay, Légumineuses. Mem. Soc. Phys. Genève 30: 1-73. [ Links ]
143 Neill, D. A. 1998. Ecuadendron (Fabaceae. Caesalpinioideae: Detarieae): A new arborescent genus from Western Ecuador. Novon 8: 45-49. [ Links ]
144 Pellegrin, F. 1943. Un genre nouveau de Caesalpiniées du Gabon. Boissiera 7: 296-300. [ Links ]
145 Plotkin, M. J.; B. M. Boom & M. Allison. 1991. The ethnobotany of Aublet's Histoire des Plantes de la Guiane Françoise (1775). Monogr. Syst. Bot. Missouri Bot. Gard. 35: 1-108. [ Links ]
146 Polhill, R. M. & P. H. Raven (eds.). 1981. Advances in Legume Systematics, part 2. Kew: Royal Botanic Gardens. [ Links ]
147 Polhill, R. M. & J. E. Vidal. 1981. Caesalpinieae, in R. M. Polhill & P. H. Raven. (eds.), Advances in Legume Systematics, part 2, pp. 81-95. Kew: Royal Botanic Gardens. [ Links ]
148 Polhill, R. M. 1994. Classification of the Leguminosae-Complete synopsis of legume genera, in F. A. Bisby, J. Buckingham & J. B. Harbone (eds.), Phytochemical Dictionary of the Leguminosae, vol. 1. Cambridge: Capman & Hall. [ Links ]
149 Queiroz, I. P. de; G. P. Lewis & R. Allkin 1999. A revision of the genus Moldenhawera Schrad. (Leguminosae-Caesalpinioidae). Kew Bull. 54: 817-852. [ Links ]
150 Quiñones, L. M. 2005. Leguminosae subfamilia Caesalpinioieae, in E. Forero & C. Romero (eds.), Estudios en Leguminosas Colombianas. Acad. Colomb. Cien. "Colecc. J. Álvarez Lleras" 25: 301-328. [ Links ]
151 Rachie, K. O. 1979. Tropical Legumes; resources for the future, pp. 1-331. Washington D.C.: National Academy of Sciences-National Research Council. [ Links ]
152 Ragonese, A. M. 1973. Systematic anatomical characters of the leaves of Dimorphandra and Mora (Leguminosae: Caesalpinioideae). Bot. J. Linnean Soc. 67: 255-274. [ Links ]
153 Ragonese, A. M. 1982. Presencia de estomas paralelocíticos en el género Mora (Leguminosae-Caesalpinioideae). Darwiniana 24: 69-74. [ Links ]
154 Redden, K. M. & P. S. Herendeen. 2006. Morphology and phylogenetic analysis of Paloue and related genera in the Brownea clade (Detarieae, Caesalpinioideae). Inter. J. Pl. Sci. 167: 1229-1246. [ Links ]
155 Reiche, K. 1898. Leguminosas, en K. Reiche (ed.), Flora de Chile, vol. 2, pp. 26-208. Santiago de Chile: Impr. Cervantes. [ Links ]
156 Robertson, K. & Y. Y. Lee. 1976. The genera of Caesalpinioideae (Leguminosae) in the Southeastern United States. J. Arnold Arb. 57: 1-53. [ Links ]
157 Rodrigues, W. A. & H. C. de Lima. 1989. Notas sobre os gêneros Paloue Aublet e Paloveopsis Cowan (Leguminosae: Caesalpinioideae) no Brasil. Acta Amazonica 19: 147-153. [ Links ]
158 Rojo, J. P. 1996. Dialium, in Ding Hou, K. Larsen & S. S. Larsen (eds.), Fl. Malesiana vol 12, pp. 409-730. [ Links ]
159 Ross, J. H., 1977. Fabaceae, subfamily Caesalpinioideae, in J. H. Ross (ed.), Flora of southern Africa, vol. 16, part 2. Pretoria: Botanical Research Institute, Department of Agricultural Technical Services. [ Links ]
160 Roti-Michelozzi, G. 1957. Adumbratio Florae Aethiopicae. Webbia 13: 133-228. [ Links ]
161 Rudall, P. J.; G. Myers & G. P. Lewis. 1994. Floral secretory structures in Caesalpinia sensu lato and related genera, in I. K. Ferguson & S. Tucker (eds.). Advances in Legume Systematics, part 6: Structural Botany, pp. 41-52. Kew: Royal Botanic Gardens. [ Links ]
162 Sandwith, N. Y. 1932. Contributions to the flora of tropical America XIV. Mora and Dimorphandra in British Guiana. Bull. Misc. Inform. 8: 395-406. [ Links ]
163 Santiago, E. F. & A. A. S. Paoli. 1999. Morfología do fruto e da semente de Peltophorum dubium (Spreng.) Taubert (Leg.-Caesalpinioideae). Naturalia (São Paulo) 24: 139-152. [ Links ]
164 Schultes, R. E. & A. Hoffmann. 1982. Plantas de los Dioses. Orígenes del uso de los alucinógenos, pp. 1-102. México: Fondo de Cultura Económica. [ Links ]
165 Silva, M. F. da 1976. Revisão taxonômica do gênero Peltogyne Vog. (Leguminosae-Caesalpinioideae). Acta Amazonica 6 (Suppl. 1): 1-61. [ Links ]
166 Silva, M. F. da; A. S. Tavares & P. E. Berry. 1998. Cynometra, Dimorphandra, in J. A. Steyermark; P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, vol. 4, 49-51; 58-62. Saint Louis: Missouri Botanical Garden. [ Links ]
167 Simpson, B. B. 1998. Revision of Pomaria (Fabaceae) in North America. Lundellia 1: 46-71. [ Links ]
168 Simpson, B. B. 1999. A revision of Hoffmannseggia (Fabaceae) in North America. Lundellia 2: 14-54. [ Links ]
169 Simpson, B. B. & G. P. Lewis. 2003. New combinations in Pomaria (Caesalpinioideae: Leguminosae). Kew Bull. 58: 175-184. [ Links ]
170 Simpson, B. B. & B.-M. Miao. 1997. The circumscription of Hoffmannseggia (Fabaceae, Caesalpinioideae, Caesalpinieae) and its allies using morphological and cpDNA restriction site data. Pl. Syst. Evol. 205: 157-178. [ Links ]
171 Simpson, B. B. & E. A. Ulibarri. 2006. A synopsis of the genus Hoffmannseggia (Leguminosae) Lundellia 9: 7-33. [ Links ]
172 Simpson, B. B.; L. L. Larkin & A. Weeks. 2003. Progress towards resolving the relationships of the Caesalpinia group (Caesalpinieae: Caesalpinioideae: Leguminosae), in B. B. Klitgaard & A. Bruneau (eds.), Advances in Legume Systematics, part 10: Higher Level Systematics, pp. 123-148. Kew: Royal Botanic Gardens. [ Links ]
173 Simpson, B. B.; L., Larkin; A. Weeks & J. McDill. 2006. Phylogeny and biogeography of Pomaria (Caesalpinioidea: Leguminosae). Syst. Bot. 31: 792-804. [ Links ]
174 Simpson, B. B.; J. A. Tate & A. Weeks. 2004. Phylogeny and character evolution of Hoffmannseggia (Ceasalpinieae: Caesalpinioideae. Leguminosae). Syst. Bot. 29: 933-946. [ Links ]
175 Simpson, B. B.; J. A. Tate & A. Weeks. 2005. A. The biogeography of Hoffmannseggia (Leguminosae, Caesalpinioideae, Caesalpinieae) J. Biogeography 32(2): 15-27. [ Links ]
176 Stafleu, F. A. & R. Cowan. 1976-1988. Taxonomic Literature, 2nd. ed., Vol. 1-7. Utrech: Scheltema. [ Links ]
177 Stant, M. Y. 1972. Pericarpial diversity in Caesalpinia pods used as tanning material. Bot. J. Linn. Soc. 65: 313-334. [ Links ]
178 Stergios, B. 1998. Campsiandra, Delonix, Martiodendron, Mora, in J. A. Steyermark; P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, vol. 4, pp. 18-30; 51-53; 88-90; 90-92. Saint Louis: Missouri Botanical Garden. [ Links ]
179 Stergios, B. & P. E. Berry. 1996. Contributions to South American Caesalpiniaceae. 1. Two new species of Jacqueshuberia from the Venezuelan Guayana. Novon 6: 429-433. [ Links ]
180 Steyaert, R. L. 1951. Contribution a l'étude du genre Dialium. Bull. Soc Roy. Bot. Belgique 84: 29-45. [ Links ]
181 Steyaert, R. L. 1953. Etude sur les rapports entre les genres Uittiena, Dansera et Dalium (Légum.-Caesalp.). Reinwardtia 2: 351-55. [ Links ]
182 Steyermark, J. A.; P. Berry & B. K. Holst (eds.) 1998. Flora of the Venezuelan Guayana 4. Saint Louis: Missouri Botanical Garden. [ Links ]
183 Svetaz, L.; A. Tapia; S. N López; R. L. Furlan; E. Petenatti; R. Pioli; G. Schmeda-Hirschmann & S. A. Zacchino. 2004.
184 Antifungal chalcones and new caffeic acid esters from Zuccagnia punctata acting against soybean infecting fungi. J. Agric. Food Chem. 52: 3297-3300. [ Links ]
185 Taubert, P. 1891-94. Leguminosae, in A. Engler & K. Prantl (eds.), Die Natürlichen Pflanzenfamilien, 3 Teil, 3 Abteilung, pp. 70-388. Berlin: Duncker und Humblot. [ Links ]
186 Tavares, S. A. & M. F. da Silva. 1992. Distribuiçao geográfica do genero Cynometra L. (Caesalpiniaceae) no mundo. Acta Amazonica 22: 17-22. [ Links ]
187 Toledo Rizzini, C. & A. Mattos Filho. 1972. Sobre Arapatiella trepocarpa n. g. & s.p. (Leguminosae, Caesalpinioideae). Revista Brasil. Biol. 32: 323-333. [ Links ]
188 Tortorelli, L. A. 1956. Maderas y bosques argentinos. Buenos Aires: Acme Agency. [ Links ]
189 Tucker, S. C. 2000. Organ loss in detarioid and other leguminous flowers, and the possibility of saltatory evolution, in P. S. Herendeen & A. Bruneau (eds.), Advances in Legume Systematics, part 9, pp. 107-120. Kew: Royal Botanic Gardens. [ Links ]
190 Tulasne, L. R. 1843. Nova quaedam proponit genera in Leguminosarum classe. Ann. Sci. Nat. sér. 2, 20: 136-144. [ Links ]
191 Tulasne, L. R. 1844. Légumineuse arborescentes de L'Ámérique du Sud. Arch. Mus. Hist. nat., Paris 4: 65-195. [ Links ]
192 Ulibarri, E. A. 1978. Sobre Stenodrepanum Harms (Legum.-Caesalp.). Darwiniana 21: 401-405. [ Links ]
193 Ulibarri, E. A. 1979. Las especies argentinas de Hoffmannseggia Cav. (Legum.- Caesalp.). Darwiniana 22: 135-158. [ Links ]
194 Ulibarri, E. A. 1984. Hoffmannseggia, en M. N. Correa (ed.), Flora patagónica (Argentina). Colecc. Ci. Inst. Nac. Tecnol. Agropecu. 8 (4b): 89-297. [ Links ]
195 Ulibarri, E. A. 1996. Sinopsis de Caesalpinia y Hoffmannseggia (Leguminosae-Caesalpinioidae) de Sudamérica. Darwiniana 34: 299-348. [ Links ]
196 Ulibarri, E. A. 1997a. Fabaceae (1). Tribu 1. Caesalpinieae, in A. T. Hunziker (ed.), Flora Fanerogámica Argentina 32: 3-24. [ Links ]
197 Ulibarri, E. A. 1997b. Fabaceae (2). Tribu 4. Detarieae, in A. T. Hunziker (ed.), Flora Fanerogámica Argentina 33: 10-12. [ Links ]
198 Ulibarri, E. A. 1997c. Fabaceae (8). Tribu 2. Cassieae, in A. T. Hunziker (ed.), Flora Fanerogámica Argentina 51: 3-4. [ Links ]
199 Ulibarri, E. A. 1999. Fabaceae (p. p.), in F. Zuloaga & O. Morrone (eds.), Catálogo de las Plantas Vasculares de la República Argentina II (F-Z). Monogr. Syst. Bot. Missouri Bot. Gard. 74: 652-654, 663, 680, 681-682, 724, 733, 743. [ Links ]
200 Ulibarri, E. A. 2005. Zuccagnia punctata (Leguminosae) ¿nuevo o viejo endemismo argentino? Darwiniana 43: 212-215. [ Links ]
201 Ulibarri, E. A. & N. Troncoso. 1984. Fabaceae, in A. T. Hunziker (ed.), Géneros de fanerógamas de Argentina. Bol. Soc. Argent. Bot. 23: 128-155. [ Links ]
202 Ulibarri, E. A.; A Cialdella; E. Gómez-Sosa & R. Palacios. 1994. Leguminosae, in R. Kiesling, M. E. Múlgura & E. A. Ulibarri (eds.), Flora de San Juan, República Argentina, vol 1, pp. 257-332. Buenos Aires: Vázquez Mazzini. [ Links ]
203 Ulibarri, E. A.; E. V Gómez-Sosa; A. M. Ciadella; R. H. Fortunato & D. Bazzano. 2002. Leguminosas. Nativas y Exóticas. Las especies más comunes de la Región Rioplatense (Delta del Paraná, Isla Martín García y Ribera Platense), in H. B. Lahitte& J. A. Hurrell (eds.), Biota Rioplatense, vol. 7. Buenos Aires: L. O. L. A. [ Links ]
204 Uphof, J. C. T. 1968. Dictionary of Economic Plants, 2nd. ed. Lehre: Verlag von J. Cramer. [ Links ]
205 Vaz , A. M. S. da F. 1993. Trepadeiras do gênero Bauhinia (Caesalpiniaceae) no Estado do Rio de Janeiro. Pesquisas (Botânica) 44: 95-114. [ Links ]
206 Vaz, A. M. S. da F. & D. C. P. Silva. 1995. Bauhinia (Leguminosae-Caesalpinioideae) da Reserva Florestal da Vista Chinesa, Rio de Janeiro. Albertoa 4(5): 33-59. [ Links ].
207 Vaz, A. M. S. da. F. & A. M. G. de A Tozzi. 2003. Acualeatae a new series in Bauhinia section Pauletia (Leguminosae, Caesalpinioideae, Cercideae). Novon 13: 141-194. [ Links ]
208 Vellozo, J. M. da C.1825 [1829]. Florae Fluminensis seu, Descriptionum plantarum praefectura Fluminensi sponte mascentium liber primus ad systema sexuale concinnatus. Rio de Janeiro: Typographia national. [ Links ]
209 Velázquez, D. 1998. Brownea, in J. A. Steyermark; P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, vol. 4, pp. 14-17. Saint Louis: Missouri Botanical Garden. [ Links ]
210 Warwick, M.C.; G. P. Lewis & H. C. de Lima. 2008. A reappraisol of Barnebydendron (Leguminosae: Caesalpinioideae: Detarieae). Kew Bull. 63: 143-149. [ Links ]
211 Watt, J. M. & M. G. Breyer-Brandwijk. 1962. The Medicinal and Poissonous Plantas of Southern and Eastern Africa, pp. 535-669. London: E. & S. Livingstone. [ Links ]
212 Wilbur, R. L. 1963. The Leguminous plants of Carolina. Tech. Bull. North Carolina Agric. Exp. Stat. 151: 1-294. [ Links ]
213 Wittstein, G. C. 1856. Etymologisch-botanisches Handworterbuch, ed. 2. Erlangen: J. J. Palm & E. Enke. [ Links ]
214 Woodson, R. E.; R. W. Schery & Collaborators. 1951. Flora of Panama, part 5, fascicle 3, Leguminosae, part 2, pp. 301-394. [Ann. Missouri Bot. Gard. 38: 1-94]. [ Links ]
215 Wunderlin, R. P. 1976. Enumeration and typification of genera in the tribe Cercideae. Rhodora 78: 750-760. [ Links ]
216 Wunderlin, R. P. 1979. Considerationes of Barklya and the subtribe of the Cercideae (Caesalpinioideae: Fabaceae). Phytologia 44: 325-327. [ Links ]
217 Wunderlin, R. P. ; K. Larsen. & S. S. Larsen. 1981. Cercideae, en Polhill, R. M. & P. H Raven (eds.), Advances in Legume Systematics, part 2, pp. 107-116. Kew: Royal Botanic Gardens. [ Links ]
218 Wunderlin, R. P. 1983. Revision of the arborescent Bauhinias (Fabaceae: Caesalpinioideae: Cercideae) native to middle America. Ann. Missouri Bot. Gard. 70: 95-127. [ Links ]
219 Wunderlin, R. P. 1998. Bauhinia, en J. A Steyermark, P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, vol. 4, pp. 5-13. Saint Louis: Missouri Botanical Garden. [ Links ]
220 Wunderlin, R. P. 2006. Revisión of Bauhinia subgenus Bauhinia Section Amaria (Cercideae: Caesalpinioideae: Fabaceae). Sida 22: 97-122. [ Links ]
221 Xena, N. & P. E. Berry. 1998. Copaifera, in J. A. Steyermark; P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, vol. 4, pp. 45-47. Saint Louis: Missouri Botanical Garden. [ Links ]
222 Yakovlev, G. P. 1975. New species of Moldenhawera Schrad. (Caesalpiniaceae) Bot. Zhurn. 60: 219-220. [ Links ]
223 Zarucchi, J. L. 1998. Apuleia, Tachigali, in J. A. Steyermark; P. Berry & B. K. Holst (eds.), Flora of the Venezuelan Guayana, volo. 4, pp. 4-5; 114-120. Saint Louis: Missouri Botanical Garden. [ Links ]














