Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Darwiniana, nueva serie
Print version ISSN 0011-6793
Darwiniana vol.47 no.2 San Isidro Aug./Dec. 2009
SISTEMÁTICA Y TAXONOMÍA DE PLANTAS VASCULARES
Novedades para los géneros Annulohypoxylon e Hypoxylon (Ascomycota, Xylariaceae) en la República Argentina
Adriana I. Hladki1 & Andrea I. Romero2
1Laboratorio de Micología, Fundación Miguel Lillo, Miguel Lillo 251, San Miguel de Tucumán, 4000 Tucumán, Argentina; hladki@csnat.unt.edu.ar, adrianahladki@yahoo.com.ar (autor corresponsal).
2PHHIDEB-CONICET, Departamento de Biodiversidad y Biología Experimental, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad Universitaria, Pabellón II, 4o. Piso, C1428EHA Ciudad Autónoma de Buenos Aires, Argentina.
Original recibido el 25 de febrero de 2009;
aceptado el 3 de septiembre de 2009.
Resumen. Se proponen dos nuevas variedades: Annulohypoxylon moriforme var. macrosporum e Hypoxylon investiens var. magnisporum; se citan por primera vez para la Argentina los siguientes taxones: Annulohypoxylon nitens, Hypoxylon crocopeplum, H. subrutilum e H. rubiginosum var. microsporum. Se presenta una clave dicotómica de las especies hipoxiloides halladas hasta ahora en la Argentina.
Palabras clave. Annulohypoxylon; Argentina; Hongos xilófilos; Hypoxylon; Xylariaceae.
Abstract. Novelties for the genera Annulohypoxylon and Hypoxylon (Ascomycota, Xylariaceae) from Argentina.
Two new varieties, Annulohypoxylon moriforme var. macrosporum and Hypoxylon investiens var. magnisporum are proposed; Annulohypoxylon nitens, Hypoxylon crocopeplum, H. subrutilum and H. rubiginosum var. microsporum are described as new records from Argentina. A dichotomous key to hypoxyloid taxa so far known from Argentina is presented.
Keywords. Annulohypoxylon; Argentina; Hypoxylon; Xylariaceae; Xylophilous fungi.
INTRODUCCIÓN
Hypoxylon Bull. fue establecido por Bulliard (1791) y posteriormente estudiado por Miller (1961). El concepto del género era tan amplio que durante las décadas siguientes Hypoxylon fue circunscripto y disgregado en otros géneros, tales como Biscogniauxia Kuntze, Camillea Fr., Creosphaeria Theiss., Entoleuca Syd., Euepixylon Füisting, Jumillera J. D. Rogers & al., Kretzschmaria Fr., Kretzschmariella Viégas, Nemania S. F. Gray, Neohypodiscus J. D. Rogers & al., Obolarina (Tul. & C. Tul.) Pouzar, Stilbohypoxylon Henn., Whalleya J. D. Rogers & al., entre otros.
Ju & Rogers (1996) y Ju et al. (2004) estudiaron a Hypoxylon s. str. y utilizaron caracteres del anamorfo, de cultivo, de los pigmentos extraídos del estroma y de la dehiscencia del perisporio de la ascospora en KOH al 10%; como resultado se excluyeron varias especies y se propusieron sinónimos para otras. Posteriormente, estudios moleculares (Hellwig et al., 2005; Quang et al., 2003, 2004, 2005) sustentaron esas propuestas. Recientemente, Hsieh et al. (2005) realizaron una filogenia molecular de las Xylariaceae con anamorfo tipo Nodulisporium Preuss y similares, y establecieron a Annu-lohypoxylon Y. M. Ju, J. D. Rogers & H. M. Hsieh para aquellas especies de Hypoxylon antes ubicadas en la sección Annulata de Miller.
Las especies de Hypoxylon con aspecto hipoxiloide presentan una gran diversificación en los trópicos y subtrópicos, variando entre especies patógenas muy dañinas a especies endofíticas (Petrini & Petrini, 1985). Algunas crecen en madera muerta de un hospedante específico mientras que otras lo hacen sobre un amplio rango de sustratos.
La mayoría de los estudios del género Hypoxylon para la Argentina se circunscriben a los trabajos de Spegazzini (1880, 1881, 1888a, b, 1899, 1908, 1909, 1919) quien identificó 21 especies; 15 de estas especies y una variedad fueron erigidas por él. Ju & Rogers (1996) estudiaron algunas de estas propuestas y consideraron a ciertas especies como dudosas o las transfirieron a otros géneros; posteriormente Hsieh et al. (2005) transfirieron otras a Annulohypoxylon.
Por ese motivo, en contribuciones anteriores (Hladki, 2001; Hladki & Romero, 2001, 2003, 2006, 2009, en prensa) se realizó la revisión de los holotipos de Hypoxylon propuestos por Spegazzini y se detalló el estado taxonómico y nomenclatural de los mismos. Como resultado de estas investigaciones y de las contribuciones realizadas por Romero (1998) y Wright & Wright (2005) se confirmó la presencia en el país de tres especies de Annulohypoxylon (A. bovei (Speg.) Y. M. Ju, J. D. Rogers & H. M. Hsieh, A. stygium (Lév.) Y. M. Ju, J. D. Rogers & H. M. Hsieh y A. subeffusum (Speg.) Hladki & A. I. Romero), y ocho especies de Hypoxylon (H. anthochroum Berk. & Broome, H. kermesi Speg., H. lenormandii Berk. & M. A. Curtis, H. megalosporum Speg., H. notatum Berk. & M. A. Curtis, H. perforatum (Schwein.) Fr., H. rubiginosum (Pers.) Fr. e H. subgilvum Berk. & Broome).
El objetivo de este trabajo es contribuir al conocimiento de la diversidad de especies de Annulohypoxylon e Hypoxylon en la República Argentina. Con el propósito de facilitar su identificación y conocimiento, se presenta una clave dicotómica provisional de las 25 especies con aspecto hipoxi-loide halladas en la Argentina y que fueron objeto de nuestro estudio.
MATERIALES Y MÉTODOS
Los ejemplares fueron coleccionados durante exploraciones fúngicas llevadas a cabo en las provincias de Salta y Tucumán, Argentina. También se estudiaron especimenes de Buenos Aires, Entre Ríos y Misiones (Argentina) depositados en BAFC, FH, IMI, LIL, LPS, S y WSP (Holmgren et al., 1990). Las preparaciones, observaciones microscópicas y la terminología empleada para las descripciones, se realizaron siguiendo a Ju & Rogers (1996). Para cada taxón se brinda una referencia bibliográfica para la lista de sinónimos. En cuanto a los criterios para proponer variedades nuevas se sigue a Ju & Rogers (1996); estos autores utilizan el carácter tamaño de las ascosporas y la distribución geográfica del taxón para diferenciar variedades.
RESULTADOS
Se describen dos nuevas variedades y se citan cuatro nuevos taxones para la Argentina de los géneros Annulohypoxylon e Hypoxylon.
Annulohypoxylon moriforme (Henn.) Y. M. Ju, J. D. Rogers & H. M. Hsieh var. macrosporum Hladki & A. I. Romero, var. nov. TIPO: Argentina, Misiones, Puerto Iguazú, Sendero Macuco, 28-X-2003, M. M. Schiavone 2922 (holotipo LIL). Figs. 1A-D, 2A y 3.
A Annulohypoxylo moriformi var. moriformi differt ob ascosporas 9-10,5 x 4-5,5 µm.

Fig. 1. A-D, Annulohypoxylon moriforme var. macrosporum. A, estromas pulvinados. B, detalle de la superficie estromática con papilas ostiolares cónicas rodeadas de un disco cóncavo. C, esquema del corte transversal del estroma. D, ascosporas. E, Annulohypoxylon nitens, aparato apical IK+ y ascosporas. F , Hypoxylon crocopeplum, ascosporas con perisporio dehiscente con ornamentaciones centrales. G, Hypoxylon investiens var. magnisporum, ascosporas. H-K, Hypoxylon rubiginosum var. microsporum. H, aspecto general del estroma con márgenes estériles. I, superficie estromática con ostíolos no papilados ubicados por debajo de la superficie. J, esquema del corte transversal del estroma. K, ascosporas. Abreviaturas: a, capa granulosa ubicada debajo de la superficie y entre los peritecios; b, capa estromática rodeando cada peritecio; c, tejido subperitecial carbonoso; d, sustrato; e, superficie. A-D, de Schiavone 2922 (LIL); E, de Biasuso 2946 (LIL); F, de Savak s.n. (BAFC 51528); G, de Gómez del Busto s.n. (BAFC 51526); H-K, de A. Hladki 2881 (LIL).

Fig. 2. A, Annulohypoxylon moriforme var. macrosporum, aspecto general de los estromas. B-D, Annulohypoxylon nitens. B, aspecto general de los estromas. C, detalle de la superficie estromática con contornos periteciales evidentes y papilas ostiolares cónicas rodeadas de un disco tipo bovei. D, detalle del corte transversal del estroma con una capa estromática que rodea a los peritecios. E-G, Hypoxylon investiens var. magnisporum. E, aspecto general de los estro-mas. F, detalle de la superficie estromática con contornos periteciales poco evidentes y ostíolos no papilados ubicados por debajo de la superficie. G, corte transversal del estroma. H, Hypoxylon rubiginosum var. microsporum, aspecto general del estroma. Abreviaturas: a, capa granulosa negruzca brillosa por debajo de la superficie y entre los peri-tecios; c, tejido subperitecial ceroso. A, de Schiavone 2922 (LIL); B-D, de Biasuso 2946 (LIL); E-G, de Gómez del Busto s.n. (BAFC 51526); H, de Hladki 2881 (LIL).

Fig 3. Distribución en la Argentina de Annulohypoxylon moriforme var. macrosporum (1), Annulohypoxylon nitens (2), Hypoxylon crocopeplum (3), Hypoxylon investiens var. magnisporum (4), Hypoxylon rubiginosum var. microsporum (5) e Hypoxylon subrutilum (6).
Estroma pulvinado con contornos periteciales muy evidentes, 2-8 x 2-4 x 2-3 mm; superficie castaña oscura a negra, opaca; con gránulos negros por debajo de la superficie y entre los peritecios; tejido subperitecial negro y carbonoso; estroma liberando pigmentos negruzcos con tonos oliváceos en KOH al 10%. Peritecios obovoides, 0,3-0,4 mm de diámetro, rodeados de una capa estromáti-ca carbonosa. Papilas ostiolares cónicas rodeadas de un disco cóncavo de 0,3-0,5 mm de diámetro. Ascos no observados. Ascosporas castaño oscuras, elipsoidales inequiláteras con extremos redondeados, 9-10,5 x 4-5,5 µm; surco germinativo recto, largo, en el lado convexo; perisporio dehiscente en KOH al 10%; episporio liso.
Distribución geográfica y hábitat. Misiones (Argentina); lignícola.
Observaciones. Esta variedad se propone en base a una única pero abundante colección que se encuentra en buenas condiciones. Comparte las características morfológicas de la especie, pero presenta esporas de dimensiones ligeramente mayores: 9-10,5 x 4,5-5 µm vs 6-9 x 2,5-4 µm en H. moriforme var. moriforme; y presenta una distribución más austral en América, ya que la var. moriforme presenta una distribución tropical y subtropical, desde el sur de América del Norte hasta el Norte de Brasil e Indonesia (Ju & Rogers, 1997).
Annulohypoxylon nitens (Ces.) Y. M. Ju, J. D. Rogers & H. M. Hsieh, Mycologia 97 (4): 12. 2005. Rosellinia nitens Ces., Atti Accad. Sci. Fis. Mat. Napoli 5: 13. 1872. Hypoxylon nitens (Ces.) Y. M. Ju & J. D. Rogers, Mycol. Mem. 20: 220. 1996. TIPO: Malasia, Borneo, Sarawak, Beccari 10 (holotipo RO, no visto). Figs. 1E, 2B-D y 3.
Sinonimia. Véase Ju & Rogers (1996), sub Hypoxylon nitens.
Estroma aplanado a ligeramente pulvinado, con contornos periteciales evidentes, 4-90 x 0,5-20 x 0,5-0,7 mm; superficie negra opaca tornándose brillosa a la madurez; tejido subperitecial negro brilloso y carbonoso; estroma liberando pigmentos oliváceos a castaños oliváceos en contacto con KOH al 10%. Peritecios obovoides a globosos, 0,4-0,7 mm de diámetro, rodeados de una capa estromática carbonosa. Papilas ostiolares cónicas, rodeadas de un disco de endostroma, por la dehiscencia abrupta del ectostroma (tipo "bovei") de 0,2-0,4 mm de diámetro. Ascos cilíndricos, parte esporífera 60-80 x 6-6,5 µm, pie 60-70 µm, aparato apical IK+ 1,5 x 1 µm. Ascospo-ras castañas a castañas claras, naviculares, elipsoidales inequiláteras con extremos redondeados, 8-9 x 3-4 µm; surco germinativo recto, tenue, ocupando casi toda la longitud de la espora, en el lado convexo; perisporio dehiscente en KOH al 10%; episporio liso.
Distribución geográfica y hábitat. Ampliamente distribuido en trópicos y subtrópicos; en América fue hallado en México y Puerto Rico, las demás citas corresponden a Indonesia (Ju & Rogers, 1996). Esta cita constituye el primer registro de la especie para la Argentina, en Buenos Aires y Entre Ríos; lignícola.
Observaciones. Para la identificación taxonómica se usó Ju & Rogers (1996).
Material examinado
ARGENTINA. Buenos Aires. Parque Lezama, sobre Melia azederach, 15-I-1969, Deschamps s.n. (BAFC 51534); La Plata, Punta Lara, 20-VI-1964, Souto s.n. (BAFC 51527); Delta, canal 6, INTA, IV-1962, Betucci s.n. (BAFC 51536). Entre Ríos. Parque Nacional "Predelta", 32º 03'43" S 60º 38' 39" W, 11-XI-2005, A. B. Biasuso 2946, 2947 (LIL).
Hypoxylon crocopeplum Berk. & M. A. Curtis, Grevillea 4: 49. 1875. TIPO: Estados Unidos de Norteamérica. Carolina del Sur, 1906, H. W. Rabéenle s.n. (holotipo K, no visto). Figs. 1F y 3.
Sinonimia. Véase Ju & Rogers (1996).
Estroma pulvinado a efuso pulvinado con contornos periteciales evidentes, 4-20 x 2-7 x 0,6-0,8 mm; superficie castaño anaranjada, gránulos del mismo color por debajo de la misma y entre los peritecios, tejido subperitecial castaño anaranjado claro; estroma liberando pigmentos castaños rojizos en KOH al 10%. Peritecios globosos a obovoides, 0,5-0,6 x 0,4-0,5 mm. Papilas ostiolares ubicadas por debajo de la superficie estromática rodeadas de un disco amarillento. Ascos cilíndricos, parte esporífera 75-102 x 9 µm, pie 40-60 µm, aparato apical IK+, en forma de disco aplanado, 1,5 x 4 µm. Ascosporas castañas oscuras, elipsoidales inequiláteras a naviculares con extremos redondeados, 14-17 x 6,5-7 µm; surco germinativo recto y largo en el lado convexo; perisporio dehiscente en KOH al 10% con tenues ornamentaciones centrales en forma de anillos; episporio liso.
Distribución geográfica y hábitat. Ampliamente distribuido en los trópicos y subtrópicos. En América está presente en el sur de América del Norte, México, Venezuela y Brasil (Ju & Rogers, 1996). Esta cita es la primera de la especie para la Argentina, en Buenos Aires.
A Hypoxylo investienti var. investienti differt ob ascosporas 9-11 x 4-5 µm.
Estroma aplanado a efuso pulvinado con contornos periteciales poco evidentes, 15-55 x 10-18 x 0,7-0,9 mm; superficie vinácea rojiza tornándose negra a la madurez, gránulos negros debajo de la misma y entre los peritecios, tejido subperitecial negro, ceroso; estroma liberando pigmentos oliváceos oscuros en KOH al 10%. Peritecios obovoi-des a levemente tubulares, 0,4-0,7 x 0,2-0,3 mm. Ostíolos sin papilas ubicados por debajo de la superficie estromática. Ascos cilíndricos, parte esporífera 66-93 x 6 µm, pie 40-60 µm, aparato apical IK+, en forma de disco aplanado, 1-1,5 x 2,5 µm. Ascosporas castañas claras a castañas, elipsoidales ligeramente inequiláteras, con extremos redondeados anchos, 9-11 x 4-5 µm; surco germinativo tenue, recto y largo; perisporio no dehiscente en KOH al 10%; episporio liso.
Distribución geográfica y hábitat. Buenos Aires, Argentina; lignícola.
Observaciones. Se propone esta nueva variedad porque presenta ascosporas más grandes: 9-11 x 4-5 µm vs 6,5-9,5 x 3-4,5 µm en H. investiens var. investiens y por su distribución más austral, ya que la variedad tipo fue citada en América del Norte (Estados Unidos de América y México), América Central (Cuba, Trinidad) y en Sudamérica solamente en Guayana Francesa.
Material examinado
ARGENTINA. Buenos Aires. Lavallol, Estación Experimental Santa Catalina, sobre rama, 5-VIII-1970, H. Savak s.n. (BAFC 51528).
BRASIL. Rio Grande do Sul. São Leopoldo, sobre madera, J. Rick 7414 (FH).
Hypoxylon rubiginosum (Pers.) Fr. var. microsporum Whalley, Trans. Brit. Mycol. Soc. 76: 157. 1981. TIPO: Venezuela. Sierra Leona, Kamajei, Pelewahun, sobre el raquis de hojas muertas de Raphia hookeri, 23-II-1952, F. C. Dieghton s.n. (lectotipo IMI 49402! designado por Ju & Rogers, Mycologia Memoir 20, 1996.) Figs. 1H-K, 2H y 3.
Hypoxylon investiens (Schwein) Curtis var. magnisporum Hladki & A. I. Romero, var. nov. TIPO: Argentina, Buenos Aires, La Plata, Punta Lara, sobre trozo de leño semipodrido, 5-V-1971, Gómez del Busto s.n. (holotipo BAFC 51526). Figs. 1G, 2E-G y 3.
Estroma aplanado a efuso pulvinado, 14-48 x 10-30 x 0,8-1 mm; superficie castaño rojiza, gránulos rojizos anaranjados debajo de la misma y entre los peritecios, tejido subperitecial castaño oscuro a negro, carbonoso; estroma liberando pigmentos castaños rojizos en KOH al 10%. Peritecios obovoides a tubulares, 0,6-0,7 x 0,6-0,8 mm. Ostíolos sin papilas, umbilicados, ubicados por debajo de la superficie estromática. Ascos no observados. Ascosporas castañas, elipsoidales inequiláteras a naviculares con extremos redondeados, 7,5-9 x 3,5-5 µm; surco germinativo recto y largo; perisporio dehiscente en KOH al 10%; episporio liso.
Distribución geográfica y hábitat. Argentina, Australia, Guayana Francesa y Venezuela; ligní-cola. Esta variedad se cita por primera vez para la Argentina. En cambio, H. rubiginosum var. rubiginosum ya había sido citada por Spegazzini (1888a, 1909, 1919) y Wright & Wright (2005) para Buenos Aires, Misiones, Tierra del Fuego y Tucumán.
Observaciones. Los materiales tucumanos difieren del lectotipo de la variedad en la presencia de una capa de gránulos anaranjados amarillos que rodean a los peritecios, liberación de pigmentos anaranjados fuertes sin tintes castaños; esporas con un lado fuertemente convexo y perisporio tenuemente ornamentado; sin embargo comparten los principales caracteres diagnósticos de la variedad señalados en la clave de especies de Ju & Rogers (1996). Por otro lado, la colección argentina comparte con H. samuelsii Y. M. Ju & J. D. Rogers algunas características. Examinamos el holotipo de esta especie (G. J. Samuels 6098, WSP 69636) y corroboramos la identificación, diferenciándose principalmente porque las ascosporas de H. samuelsii son más oscuras con surco germinativo más corto y perisporio indehiscente.
Material examinado
ARGENTINA. Tucumán. Depto. Tafí del Valle, camino a Tafí del Valle, ruta nac. 307, 23-V-2002, A. I. Hladki 2881 (LIL); bosque de Alnus acuminata, 20-IV-2006, A. I. Hladki 2938 (LIL).
Hypoxylon subrutilum Starb., Bih. Kongl. Svenska Vetensk.- Akad. Handl. 27, 3: 10. 1901. TIPO: Brasil. Río Grande do Sul, Porto Alegre, sobre ramitas, 29-IX-1892, Malme s.n. (holotipo S!). Fig. 3 y 4A-E.
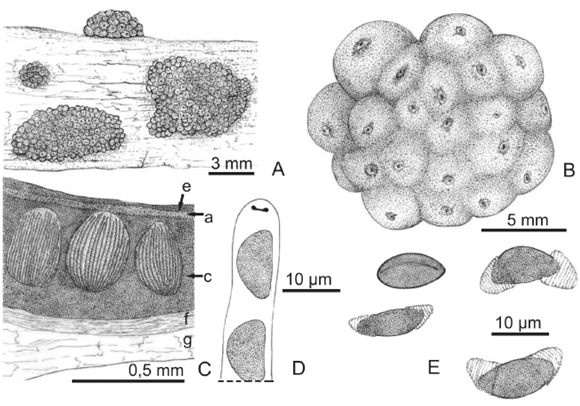
Fig. 4. A-E, Hypoxylon subrutilum. A, aspecto general de los estromas. B, superficie estromática con contornos peri-teciales evidentes y papilas ostiolares diminutas ubicadas por debajo de la superficie. C, esquema del corte transversal del estroma. D, aparato apical IK+ en forma de disco. E, ascosporas con perisporio dehiscente en KOH y conspicuas estriaciones. Abreviaturas: a, capa granulosa castaño rojiza; c, tejido subperitecial compacto castaño oscuro; e, superficie castaña; f, corteza; g, madera. A-E, de Hladki 2904 (LIL).
Sinonimia. Véase Ju & Rogers (1996).
Estroma hemisférico a pulvinado, con contornos periteciales evidentes, 6-9 x 3-6 x 0,5-1 mm; superficie castaño chocolate, con gránulos castaños rojizos por debajo de la misma, tejido subperi-tecial castaño oscuro; estroma liberando pigmentos oliváceos oscuros en KOH al 10 %. Peritecios obovoides, 0,7-0,8 x 0,4-0,6 mm. Ostíolos sin papilas, ubicados por debajo de la superficie estro-mática. Ascos frágiles, cilíndricos, parte esporífe-ra 72-90 x 7 µm, pie 39-42 µm, aparato apical IK+, 1 x 1 µm. Ascosporas castañas, elipsoidales inequiláteras, naviculares, con extremos redondeados anchos, 12-13 x 5-6,5 µm; surco germinativo recto y largo; perisporio dehiscente en KOH al 10%, con conspicuas estriaciones; episporio liso.
Distribución geográfica y hábitat. Esta especie habita en Argentina, Bolivia, Brasil, India, México, Trinidad, Venezuela y Zaire (Ju & Rogers, 1996). Este es el primer registro de la especie para la Argentina.
Observaciones. El examen del holotipo mostró notorias coincidencias morfométricas con el espécimen argentino, a excepción del tamaño de la espora, que en este último está comprendido en el límite inferior de las mediciones obtenidas en el espécimen tipo de S.
Hypoxylina umbilicata Starb. es considerado un sinónimo de Hypoxylon subrutilum por Ju & Ro-gers (1996) y fue coleccionado en el Gran Chaco, Bolivia. Al estudiar el lectotipo coincidimos que se trata de un sinónimo, y debido a la procedencia del material obtenemos una mejor apreciación de la distribución de la especie en el área.
Material examinado
ARGENTINA. Salta. Depto. Santa Victoria, Los Toldos, finca El Nogalar, 22º 16' 670" S, 74º 42' 735", 1.600 m s.m., X-2002, A. I. Hladki 2904 (LIL).
BOLIVIA. Gran Chaco. Tatarenda, 9-IV-1902, P . E. Fries 387 (S, lectotipo de Hypoxylina umbilicata).
DISCUSIÓN
Como consecuencia del presente trabajo, se incorporan a la micobiota de nuestro país a Annulohypoxylon moriforme var. macrosporum, A. nitens, Hypoxylon crocopeplum, H. investiens var. magnisporum, H. rubiginosum var. microsporum e H. subrutilum.
Teniendo en cuenta los taxones de aspecto hipo-xiloide citados por Spegazzini como especies de "Hypoxylon", y que fueron objeto de nuestro estudio, se confirma la presencia de 20 especies en la Argentina distribuidas en 6 géneros (Tabla 1).
Tabla 1. Taxones de aspecto hipoxiloide para la Argentina; referencias bibliográficas.
Las regiones argentinas mejor conocidas en cuanto a la micobiota son el Noroeste (Tucumán, Salta, Jujuy) y el Centro (Buenos Aires) donde se llevaron a cabo numerosos viajes de colección. Es necesario realizar estudios en el Noreste y Sur de la Argentina donde la micobiota de xilariales también está bien representada, aunque menos explorada.
Clave dicotómica de las especies con aspecto hipoxiloide en la Argentina
1. Estroma bipartito ......................................................... Biscogniauxia capnodes
1. Estroma unipartito ........................................................................... 2
2(1). Estroma aplanado o pulvinado, que no libera pigmentos en contacto con KOH; superficie blanquecina grisácea a castaño grisácea, posteriormente oscura y carbonosa, ocasionalmente brillante; tejido interperitecial carbonoso y persistente o blanquecino, blando y generalmente desintegrándose a la madurez; ascosporas generalmente con perisporio no dehiscente en KOH; anamorfo de tipo Geniculosporium ............................................ 3
2. Estroma pulvinado, que libera pigmentos de diferentes colores en contacto con KOH; superficie negruzca o de colores brillantes; tejido interperitecial carbonoso y persistente no desintegrándose a la madurez; ascosporas con perispo-rio generalmente dehiscente en KOH; anamorfo de tipo Nodulisporum ................................... 8
3(2). Ascosporas generalmente castañas, castañas oscuras a castañas negruzcas, con surco germinativo evidente, largo, mayor de 2/3 de la longitud de la espora ........................................................... 4
3. Ascosporas castañas claras o amarillentas, ocasionalmente castañas, con surco germinativo tenue o evidente, corto, menor de 2/3 de la longitud de la espora ........................................................... 5
4(3). Estroma parcialmente inmerso en la madera, conteniendo uno o algunos peritecios esféricos, con contornos peri-teciales evidentes; ascosporas de 16-23,5 x 8-11 µm ................................... Nemania confluens
4. Estroma superficial efuso pulvinado o aplanado, peritecios esféricos a obovoides con contornos periteciales poco evidentes; ascosporas de 14-17,5 x 6-7,5 µm ......................................... Nemania creoleuca
5(3). Ascosporas 6-8,5 x 2,5-3,5 µm, castañas claras, elipsoidales, inequiláteras ................ Nemania effusa
5. Ascosporas de mayor tamaño .................................................................. 6
6(5). Ascosporas castañas claras, cilíndricas, equiláteras, 11-12,5 x 5-6 µm, surco germinativo poco evidente. Estro-ma aplanado ...................................................................... Nemania caries
6. Ascosporas castañas, elipsoidales, inequiláteras, de mayor tamaño, surco germinativo evidente. Estroma pulvinado ................................................................. 7
7(6). Estroma con márgenes cubiertos por subículo castaño púrpura, ascosporas castañas a castañas oscuras, elipsoidales inequiláteras con extremos angostos, de 15-21 x 6,5-8,5 µm ......................... Nemania latissima
7. Estroma sin subículo, ascosporas castañas, elipsoidales inequiláteras a naviculares, de 10-15 x 5-7 µm ................................................ Nemania serpens var. serpens
8(2). Peritecio rodeado de una capa estromática carbonosa; papila ostiolar más alta que la superficie estromática, con disco; ascosporas con perisporio dehiscente en KOH y engrosamientos tenues en la región central ............. 9
8. Peritecio sin capa estromática carbonosa; ostíolo ubicado por debajo de la superficie estromática, sin disco; ascos-poras con perisporio no dehiscente o dehiscente y ornamentaciones transversales en forma de anillos .......... 13
9(2). Ascosporas con surco germinativo en el lado plano ........................... Annulohypoxylon stygium
9. Ascosporas con surco germinativo en el lado convexo ............................................. 10
10(9). Creciendo sobre Nothofagus; el estroma generalmente no libera pigmentos en contacto con KOH, disco ostio-lar de 0,5-0,7 mm de diámetro ................................................. Annulohypoxylon bovei
10. Creciendo sobre otros hospedantes, en regiones tropicales y subtropicales; el estroma generalmente libera pigmentos en contacto con KOH, disco ostiolar de 0,2-0,5 mm de diámetro .................................... 11
11(10). Estroma aplanado a ligeramente pulvinado con contornos periteciales poco evidentes; pigmentos oliváceos a oliváceos castaños; ascosporas castañas a castañas claras, con extremos redondeados anchos, hasta de 9 µm long. y 4 µm ancho ................................................................................... 12
11. Estroma hemisférico a pulvinado con contornos periteciales muy evidentes; pigmentos negruzcos con tonos oliváceos en contacto con KOH; ascosporas castañas oscuras, con extremos redondeados estrechos, de 9-10,5 x 4-5,5 µm.......................................... Annulohypoxylon moriforme var. macrosporum
12(11). Disco ostiolar castaño oscuro a negro; ascosporas castañas claras, de 8-9 x 3-4 µm ........................................................................... Annulohypoxylon nitens
12. Disco ostiolar castaño claro a amarillento; ascosporas castañas, de 7-8 x 3-4 µm ............................................................................ Annulohypoxylon subeffusum
13(8). Estroma placentiforme a hemisférico, generalmente mayor de 2,5 mm de espesor .................... 14
13. Estroma de otra forma, generalmente menor de 2,5 mm de espesor .................................. 15
14(13). Contexto no zonado; ascosporas de 17-18,5 x 8 µm, surco germinativo recto o ligeramente sigmoide .................................................. .Daldinia placentiformis
14. Contexto zonado; ascosporas de 13-15,5 x 5,5-6,5, surco germinativo recto . . ......... Daldinia eschscholzii
15(13). Ascosporas subglobosas, elipsoidales a piriformes, de 26-30 x 18-20 µm ...... .Hypoxylon megalosporum
15. Ascosporas de otra forma, generalmente de menor tamaño ......................................... 16
16(15). Ascosporas con perisporio no dehiscente en KOH ............................................ 17
16. Ascosporas con perisporio dehiscente en KOH .................................................. 18
17(16). Estroma pulvinado, superficie amarillenta pulverulenta que libera pigmentos rojizos en contacto con KOH; ascosporas castañas, elipsoidales, de 11-12 x 5-6 µm ................................... Hypoxylon kermesi
17. Estroma aplanado a efuso pulvinado, superficie vinácea rojiza tornándose negra a la madurez que libera pigmentos oliváceos oscuros en contacto con KOH; ascosporas castañas claras a castañas, elipsoidales ligeramente inequiláteras, de 9-11 x 4-5 µm .......................................... Hypoxylon investiens var. magnisporum
18(16). Estroma con gránulos rojizos anaranjados, anaranjados, anaranjados oscuros, castaños anaranjados, que libera pigmentos anaranjados, rojizos, cobrizos a ocráceos ............................................... 19
18. Estroma con gránulos castaños claros, castaños oscuros, castaños rojizos oscuros a negros que libera pigmentos amarillentos oliváceos, oliváceos, negruzcos oliváceos o pigmentos castaños sin tintes oliváceos ............. 22
19(18). Estroma con gránulos opacos, castaños amarillentos, castaños anaranjados, o castaños ............... 20
19. Estroma con gránulos brillantes, amarillentos, anaranjados o rojizos ................................. 21
20(19). Ascosporas de 9-12 x 4-5,5 µm ............................ Hypoxylon rubiginosum var. rubiginosum
20. Ascosporas de 7,5-9 x 3,5-5 µm .............................. Hypoxylon rubiginosum var. microsporum
21(19). Ascosporas de 14-17 x 6,5-7 µm; conidio de 5-7,5 x 3-4 µm .................. Hypoxylon crocopeplum
21. Ascosporas de 7-11 x 3,5-5 µm; conidio de 3-4,5 x 1,5-2 µm ....................... Hypoxylon subgilvum
22(18). Estroma con gránulos castaños oscuros; pigmentos amarillentos, amarillentos oliváceos .................................................................. Hypoxylon notatum
22. Estroma con gránulos castaños anaranjados, anaranjados, rojizos anaranjados; pigmentos sin tintes amarillentos u oliváceos ............................................................... 23
23(22). Pigmentos extractables castaño avellana, canela, castaño u ocráceos ............. Hypoxylon lenormandii
23. Pigmentos extractables anaranjados, rojizos, cobrizos a ocráceos .................................... 24
24(23). Ascosporas con perisporio dehiscente y fuertes estriaciones ..................... Hypoxylon subrutilum
24. Ascosporas con perisporio dehiscente liso o con ornamentaciones tenues ............................. 25
25(24). Estroma que libera pigmentos amarillentos oliv áceos; ostíolos rodeados de un disco .............................................. Hypoxylon perforatum
25. Estroma que libera pigmentos gris oliváceos, ostíolos sin disco ................... Hypoxylon anthochroum
AGRADECIMIENTOS
Agradecemos a los directores de los herbarios FH, IMI, LPS, S, WSP por el préstamo de los materiales para su estudio. A Inés Jaume (perteneciente a la sección iconografía de la FML) por la realización de los dibujos. Al CIUNT por la financiación de este proyecto. Esta es una publicación del PRHIDEB Nº 176 parcialmente financiada por el CONICET.
BIBLIOGRAFÍA
1. Bulliard, J. B. F. 1791. Histoire des Champignons de la France, 3 vols. Paris: Leblanc. [ Links ]
2. Hellwig, V.; Y. M. Ju, J. D. Rogers, J. Fournier & M. Stadler. 2005. Hypomiltin, a new azaphilone from Hypoxylon hypomiltum and chemotypes in Hypoxylon sect. Hypoxylon as inferred from analytical HPC profiling. Mycol. Progr. 4(1): 39-54. [ Links ]
3. Hladki, A. I. 2001. Xylaria enteroleuca (Xylariaceae), nuevo registro para el Noroeste de la Argentina. Lilloa 40: 209-214. [ Links ]
4. Hladki, A. I. 2004. Contribución al estudio de las Xylariaceae de la República Argentina II). Los géneros Daldinia, Entonaema y Phylacia para Tucumán. Lilloa 41: 37-47. [ Links ]
5. Hladki, A. I. & A. I. Romero. 2001. The genus Kretzschmaria from Tucumán (Argentina). Mycotaxon 79: 481-496. [ Links ]
6. Hladki, A. I. & A. I. Romero. 2003. Two new species of Stilbohypoxylon and the taxonomic positions of Hypoxylon cyclopicum, H. chionostomum, and Anthostoma chionostoma. Sydowia 55: 65-76. [ Links ]
7. Hladki, A. I. & A. I. Romero. 2006. Revisión de las especies de Hypoxylon propuestas por Spegazzini. Lilloa 43: 45-60. [ Links ]
8. Hladki, A. I. & A. I. Romero. 2009. Taxonomic and nomenclatural aspects of Hypoxylon taxa from Southern South America proposed by Spegazzini. Mycologia 101(5): 733-744. [ Links ]
9. Hladki, A. I. & A. I. Romero. (Sine data). A preliminary account of Xylaria in the Tucuman province, Argentina, with a key to species from the Northern Provinces. Fungal Diversity; forthcoming. [ Links ]
10. Holmgren, P. K.; N. H. Holmgren & L. C. Barnett. 1990. Index Herbariorum. Part. I: The Herbaria of the World. New York: New York Botanical Garden. [ Links ]
11. Hsieh, H. M.; Y. M. Ju & J. D. Rogers. 2005. Molecular phylo-geny of Hypoxylon and closely related genera. Mycologia 97: 1-21. [ Links ]
12. Ju, Y. M. & J. D. Rogers. 1996. A revision of the genus Hypoxylon. Mycologia Memoir Nº 20. St. Paul: APS Press. [ Links ]
13. Ju, Y. M.; J. D. Rogers & H. M. Hsieh. 2004. Hypoxylon species and notes on some names associated with or related to Hypoxylon. Mycologia 96(1): 154-161. [ Links ]
14. Miller, J. H. 1961. A monograph of the world species of Hypoxylon. Athens: Univ. Georgia Press. [ Links ]
15. Petrini, L. E. & O. Petrini. 1985. Xylariaceous fungi as endophytes. Sydowia 38: 216-234. [ Links ]
16. Quang, D. N.; T. Hashimoto, Y. Nomura, H. Wollweber, V. Hellwig, J. Fournier, M. Stadler & Y. Asakawa. 2005. Cohaerins A and B, azaphilone from the fungus Hypoxylon cohaerens, and comparison of HPLC-based metabolite profiles in Hypoxylon sect. Annulata. Phytochemistry 66: 797-809. [ Links ]
17. Quang, D. N.; T. Hashimoto, M. Stadler & Y. Asakawa. 2004. New Azaphil from the inedible mushroom Hypoxylon rubiginosum. J. Nat. Prod. 57: 1152-1155. [ Links ]
18. Quang, D. N.; T. Hashimoto, M. Tanaka, M. Stadler & Y. Asakawa. 2003. Cyclic azaphilones daldinins E and F from the ascomycete fungus Hypoxylon fuscum (Xylariaceae). Phytochemistry 65: 469-473. [ Links ]
19. Rogers, J. D. 2009. Xylariaceae home. http//www.mycology.-sinica.edu.tw /Xylariaceae . [ Links ]
20. Romero, A. I. 1998. Clave de las especies de Micromicetes xilófilos, registrados obre Eucalyptus viminalis Labill en el NE de la provincia de Buenos Aires (Argentina). Bol. Soc. Micol. de Madrid 23: 47-89. [ Links ]
21. Spegazzini, C. L. 1880. Fungi Argentini. An. Soc. Cient. Argent. 9(4): 179. [ Links ]
22. Spegazzini, C. L. 1881. Fungi Argentini additis nonnullis brasilensibus montevideensibusque. An. Soc. Cient. Argent. 12(3): 97-117. [ Links ]
23. Spegazzini, C. L. 1888 a. Fungi Fuegiani. Bol. Acad. Nac. Cienc. Córdoba 11(2): 135-311. [ Links ]
24. Spegazzini, C. L. 1888 b. Fungi Guaranitici. Pugillus II. An. Soc. Cient. Argent. 26(1): 5-74. [ Links ]
25. Spegazzini, C. L. 1899. Fungi Argentini novi vel critici. Anales Mus. Nac. Buenos Aires 6: 81-368. [ Links ]
26. Spegazzini, C.L. 1908. Hongos de la yerba mate. Anales Mus. Nac. Buenos Aires 17 (10): 111-141. [ Links ]
27. Spegazzini, C. L. 1909. Mycetes Argentinenses. Anales Mus. Nac. Buenos Aires 19(12): 257-458. [ Links ]
28. Spegazzini, C. L. 1919. Los hongos de Tucumán. Primera Reunión Nac. Soc. Arg. Cs. Nat. Tucumán (Argentina), 1916, 254-274. [ Links ]
29. Wright, J. E. & A. M. Wright. 2005. Checklist of the mycobiota of Iguazú National Park (Misiones, Argentina). Bol. Soc. Argent. Bot. 40: 23-44. [ Links ]














