Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Darwiniana, nueva serie
versão impressa ISSN 0011-6793
Darwiniana vol.48 no.2 San Isidro ago./dez. 2010
SISTEMÁTICA Y TAXONOMÍA DE PLANTAS AVASCULARES
Micromicetes asociados a la corteza y madera de podocarpus parlatorei (Podocarpaceae) en la Argentina. VI. Ascomycota
Myriam del V. Catania1 & Andrea I. Romero2
1 Fundación Miguel Lillo, Laboratorio de Micología, Miguel Lillo 251, San Miguel de Tucumán, 4000 Tucumán, Argentina; mcatania@tucbbs.com.ar; catania@csnat.unt.edu.ar (autor corresponsal).
2 PRHIDEB-CONICET, Departamento de Biodiversidad y Biología Experimental, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad Universitaria, Pabellón II, 4º Piso, C1428EHA Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
Se describen e ilustran diez especies de Ascomycota que crecen sobre madera y corteza de Podocarpus parlatorei. Se proponen Nemania confluens var. microspora var. nov., Togninia minutissima comb. nov., y se citan por primera vez para la Argentina los siguientes taxones: Botryosphaeria sarmentorum, Ceratostomella pyrenaica, Cochliobolus kusanoi, Heptameria obesa, Hypoxylon duranii, Ophioceras dolichostomum, Tengiomyces indicus, Togninia minima, Trichosphaeria pilosa.
Palabras clave. Argentina; Ascomycota; Micromicetes; Podocarpus.
Abstract
Micromycetes on bark and wood of Podocarpus parlatorei (Podocarpaceae) from Argentina. VI. Ascomycota.
Ten species of Ascomycota on bark or wood of Podocarpus parlatorei are described and illustrated. Nemania confluens var. microspora var. nov. and Togninia minutissima comb. nov. are proposed; Botryosphaeria sarmentorum, Ceratostomella pyrenaica, Cochliobolus kusanoi, Heptameria obesa, Hypoxylon duranii, Ophioceras dolichostomum, Tengiomyces indicus, Togninia minima, Trichosphaeria pilosa are recorded for the first time from Argentina.
Keywords. Argentina; Ascomycota; Micromycetes; Podocarpus.
Introduction
Este trabajo forma parte de un proyecto cuyo objetivo es el estudio de los Ascomycetes que crecen sobre corteza y madera de Podocarpus parlatorei Pilg. en la Argentina (Catania, 2001, 2004, 2005; Catania & Romero, 2001, 2005, 2006, 2007, 2008, 2009). En esta oportunidad, nuestro objetivo es describir especies de Ascomycota teleomórficos que se citan por primera vez para el país, hacer una reseña taxonómica histórica breve del género o la especie y brindar información complementaria de dichas especies. Se estudian 10 especies, incluyendo descripciones e ilustraciones del estado teleomórfico; aportando información actualizada sobre las relaciones teleomorfo-anamorfo, localización geográfica y hábitats. Se proponen una nueva variedad y una nueva combinación.
Materiales y métodos
Los materiales estudiados forman parte de las colecciones realizadas en las localidades de Sierra de Medina (26º22'06" S, 65º03'46" O), Depto. Burruyacu; y de Taficillo (26º42'820" S, 65º19'530" O), Depto. Tafí Viejo, en la provincia de Tucumán y en la localidad de Las Juntas (28º07'949" S, 65º54'499" O), Depto. Ambato, provincia de Catamarca (Argentina). Estas zonas pertenecen a la provincia biogeográfica de Las Yungas (Hueck, 1978) (Fig. 1).
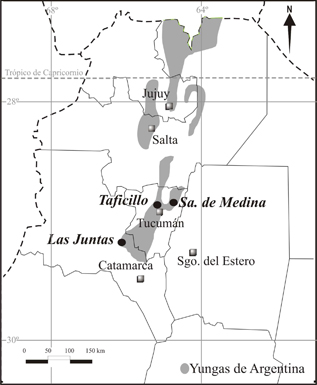
Fig. 1. Ubicación geográfica de los sitios de muestreo.
En cuanto al sistema de clasificación se sigue a Hibbett et al. (2007) y el Index Fungorum (www.indexfungorum.org/Names/Names.asp) para la denominación de las especies fúngicas.
Resultados y discusiones
DOTHIDEOMYCETES
BOTRYOSPHAERIALES
BOTRYOSPHAERIACEAE Theiss. & P. Syd.
Botryosphaeria sarmentorum A. J. L. Phillips, A. Alves & J. Luque. Mycologia 97: 522. 2005. TIPO: Inglaterra, Warwickshire, VIII-1956, E. A. Ellis 63581b (holotipo IMI). Fig. 2A-D y 4A-B.

Fig. 2. Botryosphaeria sarmentorum. A, aspecto general de los ascomas. B, asco joven. C, asco maduro. D, ascosporas. Ceratostomella pyrenaica. E, aspecto general de los ascomas. F, detalle. G, setas. H, asco y paráfisis. I, asco maduro. J, ascosporas. A-D, de Catania 773 (LIL); E-J, de Catania 1961 (LIL).
Ascomas peritecioides castaño oscuros a negros, inmersos, parcialmente errumpentes al madurar, ostiolados; ostíolo circular, central, 300-400 µm de diám.; pared 45-80 µm de grosor, compuesta de células castaño oscuras, de textura angularis. Pseudoparáfisis hialinas, septadas, pared delgada, de 2-3 µm de diám. Ascos bitunicados, cilíndrico claviformes, 4-8 esporados, frecuentemente octosporados, oblicuamente uniseriados o irregularmente biseriados, de 150-192 x (22,5-) 24-27 µm. Ascosporas oblongas a ovoides, más ancha en la parte media, rectas, (0-)1 septadas, castaño oscuras, pared gruesa, superficie lisa, finamente verrugosa en la superficie interna, de 25-30 (-31) x (10-)12-14 µm. Anamorfo: Dothiorella sarmentorum (Fr.) A. J. L. Phillips, A. Alves & J. Luque (Phillips et al., 2005).
Distribución y hábitat. Inglaterra, Noruega, Países Bajos, Suecia; encontrada sobre los siguientes hospedantes: Malus Tourn. ex L., Menispermum L., Prunus L., Pyrus L., Ulmus L. (Phillips et al., 2005). EEUU (Farr et al., 2010). Saprófito sobre corteza de ramita de P. parlatorei. Posiblemente primera cita para Sudamérica.
Observaciones. Nuestros materiales coinciden con la descripción de Phillips et al. (2005).
Botryosphaeria sarmentorum es una especie inusual por sus ascosporas castañas, 1-septadas; en tanto que en las otras especies de Botryosphaeria conocidas, las ascosporas se mantienen hialinas y sin septos, ocasionalmente pueden ser castañas, con 1 ó 2-septos cuando maduras (Shoemaker, 1964; Sivanesan, 1984; Alves et al., 2004).
Otra especie con ascosporas oscuras, B. ingiae A. K. Kar & Maity, fue citada para nuestro país por Romero & Carmarán (1997), en la provincia de Misiones. Botryosphaeria sarmentorum constituye la primera cita sobre P. parlatorei.
Recientemente, De Errasti (2008) en su estudio sobre endófitos fúngicos de madera en la provincia de Buenos Aires (Argentina) citó Botryosphaeria obtusa (Schwein.) Shoemaker, B. ribis Grossenb & Duggar y Botryodiplodia theobromae Pat.
Material examinado
ARGENTINA. Tucumán. Depto. Burruyacu: Sierra de Medina, ruta provincial 310, a 31 km desde Villa Padre Monti, Aguas Negras, Finca Mansilla, 1600 m, 1-IV-1998, Catania 770, 771, 772, 773 (LIL). Depto. Tafí Viejo: Parque Biológico Sierra de San Javier, Cumbres de Taficillo, Las Mentas, 1600 m, 1-III-1999, Catania 1315 (LIL).
SORDARIOMYCETES
XYLARIALES
CLYPEOSPHAERIACEAE G. Winter
Ceratostomella pyrenaica Réblová & J. Fourn., Mycologia 98 (1): 78. 2006. TIPO: Francia, Pyrénées Atlantiques, Rimont, Las Muros, Ruisseau de Peyran, 8-IX- 2000, J. F. Fournier 00195 (holotipo PRM). Fig. 2E-J y 4C-G.
Ascomas peritecioides gregarios, vientre inmerso a semiinmerso, globosos a subglobosos, 350-600 x 400-600 µm, superficie levemente rugoso, castaño oscuros, rodeado por micelio esparcido; hifas castaño oscuras, septadas, rectas o flexuosas, 4-4,5 µm diám.; cuello central, elonga el ápice, surcado con 2-4 surcos, 400-1100 x 80-120 µm. Peridio tuberculado coriáceo a frágil, textura angularis, 35-55 µm espesor, capa externa crustosa 8-15 µm espesor. Hifas ascógenas ramificadas, discretas, con "croziers", produciendo células terminales y laterales, a partir de las cuales se forman los ascos blásticamente, bien visibles con MEF. Paráfisis 10-12 µm diám. cerca de la base, septadas, células subglobosas, constreñidas en el septo, afinándose hasta 2-3 µm hacia el extremo.
Ascos unitunicados, cilíndricos claviformes, octosporados, biseriados, 42-51 x 6,5-8 µm, truncados a ampliamente redondeados hacia el ápice, con anillo apical poco diferenciado, estípite corto, base fuertemente fluorescente en calcofluor. Ascosporas elipsoidales a oblongas, levemente curvadas y apiculadas hacia ambos extremos, aplanadas hacia un lado, 8-9 x 3-4 µm, castaño claras, sin septos, lisas, a menudo con dos gútulas. Anamorfo: desconocido.
Distribución y hábitat. Francia, República Checa; sobre madera de Acer campestre L., Alnus glutinosa (L.) Gaertn. y sobre basidioma pútrido de Trametes gibbosa (Pers.) Fr. desarrollado en Fagus sylvatica L. (Réblová, 2006). Saprófito sobre madera de P. parlatorei. Éste es el tercer registro a nivel mundial. Es la primera cita para Sudamérica.
Observaciones. Ceratostomella Sacc. es un género cosmopolita con peritecios no estromáticos que colonizan madera de angiospermas y gimnospermas en estado avanzado de descomposición. Réblova (2006) realizó un estudio de sistemática molecular de Ceratostomella sensu lato y hongos similares morfológicamente. El género Ceratostomella fue redescripto, el concepto genérico fue enmendado y se aceptaron cuatro especies, entre ellas Ceratostomella pyrenaica. Esta especie se caracteriza por sus ascosporas castaño claras, lisas, elipsoidales a oblongas, levemente apiculadas hacia los extremos. Nuestras colecciones coinciden con la descripción de Réblová (2006).
Con MEF se pueden observar fácilmente detalles del sistema ascógeno y de los ascos. En la base del asco se observa una zona fuertemente fluorescente (Fig. 4F) que parece corresponderse con el material no refractivo depositado en la base del asco descripto por Réblová (2006), con la diferencia que esta autora dice que es más fácil observarlo después que el asco se ha desprendido de la hifa ascógena. En cambio, con MEF, se observa este depósito basal aún cuando el asco está adherido a la hifa ascógena (Fig. 4E). Réblová (2006) obtuvo en cultivo un micelio estéril, dematiaceo.
En la Argentina, Romero (1998), describió tres especies de Ceratostomella: C. ampullasca (Cooke) Sacc., C. cirrhosa (Pers.) Sacc. y C. hyalostoma (Munk) Unter., sobre madera de Eucalyptus viminalis Labill., procedentes de la provincia de Buenos Aires. Réblová (2006) incluyó a Ceratostomella ampullasca y C. cirrhosa en la sinonimia de Lentomitella cirrhosa (Pers.) Réblová.
Material examinado
ARGENTINA. Catamarca. Depto. Ambato: Las Juntas, cruzando el río Las Juntas, 1780 msnm, 07-XII-2000, Catania 1961, 1962, 1963 (LIL). Tucumán. Depto. Burruyacu: Sierra de Medina, ruta provincial 310, a 31 km desde Villa Padre Monti, Aguas Negras, Finca Mansilla, 1600 m, 22-V-2000, Catania 1835 (LIL).
DOTHIDEOMYCETES
PLEOSPORALES
PLEOSPORACEAE Nitschke
Cochliobolus kusanoi (Y. Nisik.) Drechsler ex Dastur, Indian Journal of Agricultural Research 12: 733. 1942. Ophiobolus kusanoi Y. Nisik., Jap. Journ. Bot. 6: 108. 1929. TIPO: Japón, near Kurashiki, on leaves of Eragrostis major Host, VI-1924, IX-1924, 1925, 1926, Y. Nisik(?) s.n. (sintipos no localizados). Figs. 3A-D y Fig. 4H-J.

Fig. 3. Cochliobolus kusanoi. A, aspecto general de los ascomas. B, asco. C, conidióforos y conidio. D, conidios. Heptameria obesa. E, aspecto general de los ascomas. F, asco. G, ascosporas. Nemania confluens var. microspora. H, aspecto general de los ascomas. I, sección longitudinal del estroma. J, aparato apical del asco I-K, ascosporas. Abreviaturas: a, capa estromática superficial; b, ectostroma rodeando a los peritecios; c, sustrato. A-D, de Catania 1726 (LIL); E-G, de Catania 1044 (LIL); H-K, de Catania 1680 (LIL).

Fig. 4. Botryosphaeria sarmentorum. A, aspecto general de los ascomas. B, ascos. Ceratostomella pyrenaica. C, aspecto general de los ascomas. D, ascos. E, ascos sobre hifas ascógenas (flecha). F, asco separado (nótese base fluorescente, flecha). G, paráfisis. (imágenes E-G con MEF). Cochliobolus kusanoi. H, aspecto general de los ascomas. I, ascos con ascosporas filiformes. J, conidio. Heptameria obesa. K, aspecto general de los ascomas. L, ascos. M, ascospora. A-B, de Catania 773 (LIL); C-F, de Catania 1961 (LIL); H-J, de Catania 1726 (LIL); K-M, de Catania 1044 (LIL).
Ascoma peritecioide globoso a subgloboso, castaño oscuro a negro, cuello ostiolar corto, cubierto con hifas estériles, hasta de 550 µm diám. Ascos bitunicados, cilíndricos a levemente claviformes, octosporados, de 240-249 x 18 µm. Pseudoparáfisis celulares, hialinas, ramificadas, abundantes. Ascosporas filiformes, hialinas, multiseptadas, ocasionalmente constreñidas en el septo, dispuestas en fascículos helicoidales a débilmente espiraladas en el asco, de 123,5-156 x 4,5-5 (-6,5) µm. Anamorfo: Drechslera kusanoi (Y. Nisik.) Subram.& B. L. Jain (Subramanian & Jain, 1966). Conidióforos hasta de 225 x 6-7 µm. Conidio obclavado o longitudinalmente elipsoidal, aguzado hacia el ápice redondeado, pálido a castaño oliváceo oscuro, 3-5, a menudo 4 distoseptados, de 25-30 x 9-12 µm, hilum oscuro, de 2-4 µm de diám.
Distribución y hábitat. Estados Unidos, Kansas (Rogerson, 1958), Japón (Sivanesan, 1984). Saprófito sobre corteza de P. parlatorei.
Observaciones. Nuestro material coincide con la descripción de Sivanesan (1984), aunque sus ejemplares son algo menores.
Las especies de Cochliobolus Drechsler están asociadas con anamorfos tales como Curvularia Boedijn y Drechslera S. Ito (= Bipolaris Shoemaker, Can. J. Bot. 37: 882, 1959). En este estado actúan como agentes causales de enfermedades de importancia económica en cultivos graminícolas entre otros (Sivanesan, 1984). Varias de estas enfermedades han sido registradas en nuestro país (Carmona et al., 2010).
Material examinado
ARGENTINA. Catamarca. Depto. Ambato: Las Juntas, cruzando el río Las Juntas, 1780 msnm, 27-VIII-1999, Catania 1726 (LIL).
DOTHIDEOMYCETES
DOTHIDEALES
DOTHIDEACEAE Chevall.
Heptameria obesa (Durieu & Mont.) Sacc., Syll. Fung. 2: 88. 1883. Sphaeria obesa Durieu & Mont., in Durieu de Maisonneuve, Exploration scientifique de l'Algérie pendant l'années 1849-1842. Botanique. I. Cryptogamie (livr. 18-20): 526. 1869. TIPO: Algeria, in culibus Scabiosae urceolatae emortuis semicorruptisque circa Mostaganem, IV-?, Durieu s.n. (holotipo PC?). Figs. 3E-G y 4K-M.
Ascomas peritecioides subepidérmicos o errumpentes en la corteza, aislados o densamente gregarios, subglobosos a cónicos, papilados, negros, de 400-600(-700) x 410-560(-660) µm; peridio rugoso, de 90-195 µm de espesor, formado por células isodiamétricas de paredes gruesas, castañas. Ascos claviformes, bitunicados, octosporados, pedicelo corto, de 135-186 x 14-18 µm. Pseudoparáfisis celulares. Ascosporas biseriadas en la parte superior del asco, uniseriadas en la parte inferior, elongadas fusiformes, rectas a levemente curvadas, con 6-8 septos, la célula media castaña a castaño rojiza oscura, muriforme, con 5-6 septos transversales y 1-3 septos longitudinales; células de los extremos aguzadas, castaño claro a hialinas, con 2-3(-4) septos tranversales levemente constrictas en el septo que separa la porción media, lisa, de 51-71,5 (-79) x 9-14 (-15) µm. Anamorfo: celomicete (Barr, 1990).
Distribución y hábitat. Regiones mediterráneas de Europa, Norte de África, América del Norte (Barr, 1990); España, Portugal (Checa, 2004); Taiwán (Chen y Hsieh, 1997). Saprófito sobre rama P. parlatorei.
Observaciones. Nuestro material coincide con la descripción de Lucas & Sutton (1971) y Barr (1990), excepto en que el rango de longitud de los ascos y ascosporas observados por ellos es menor (Lucas y Sutton, 1971: ascos de 152-164 µm y ascosporas de 52-62 µm; Barr, 1990: ascos de 110-140 µm y ascosporas de 45-60 µm).
Lucas & Sutton (1971) encontraron esta especie sobre tallos muertos de Inula viscosa (L.) Aiton, en Portugal. Barr (1990) la encontró sobre tallos herbáceos, principalmente de Asteraceae. Checa (2004) describe a H. obesa sobre diferentes sustratos (Antirrhinum majus L., Centaurea sempervirens L., entre otras especies y ramas no identificadas).
Spegazzini (1910) describió a Melanomma chilensis Speg., material coleccionado sobre Proustia pungens Poepp. ex Less., en Batuco, Región Metropolitana, Chile (holotipo LPS 2615) y en 1912, identificó a una especie del género Heptameria Rehm & Thüm., coleccionada en Mendoza (Argentina), idéntico a M. chilensis. Por lo cual realizó la transferencia de ésta última a Heptameria chilensis (Speg.) Speg. En el presente trabajo se estudió el tipo de M. chilensis y compartimos el criterio de Spegazzini, que es una especie de Heptameria.
Heptameria obesa constituye la segunda especie citada para nuestro país.
Material examinado
ARGENTINA. Tucumán. Depto. Burruyacu: Sierra de Medina, ruta provincial 310, a 31 km desde Villa Padre Monti, Aguas Negras, Finca Mansilla, 1600 m, 08-VII-1998, Catania 1044 (LIL).
SORDARIOMYCETES
XYLARIALES
XYLARIACEAE Tul. & C. Tul.
Hypoxylon duranii J. D. Rogers, Mycotaxon 23: 429. 1985 TIPO: México, Durán, R., XI-1984, on grounds of Chickén Itzá ruins, near highway 180 near Piste, Yucatan peninsula, Yucatan, Mexico, on wood of leguminous tree on ground, sine colector (holotipo WSP 6797). Fig. 5 A-D.

Fig. 5. Hypoxylon duranii. A, aspecto general del estroma. B, detalle de la superficie estromática. C, corte longitudinal, pseudotejido rodeado con gránulos (flecha). D, ascosporas. Nemania confluens var. microspora. E, aspecto general de los estromas. F, sección longitudinal del estroma. G, sección del peridio. H, asco, aparato apical I+ (flecha). I, ascosporas. Ophioceras dolichostomum. J-K, aspecto general de los ascomas. L, asco con ascosporas filiformes. M, asco, nótese anillo apical conspicuo refractario (flecha). A-D, de Catania 1710 (LIL); E-I, de Catania 1680 (LIL); J-M, de Catania 1204 (LIL).
Estromas pulvinados a efuso pulvinados, con contornos periteciales poco evidentes, de 4-14,5 x 2,5-5 mm, superficie castaña, con gránulos castaño rojizo a negruzco por debajo de la misma y entre los peritecios; estroma liberando pigmentos castaños amarillentos en KOH al 10%; tejido subperitecial negro a inconspicuo. Peritecios globosos, obovoides, de 0,3-0,4 x 0,2-0,35 mm. Papilas ostíolares diferenciadas, más bajas que la superficie estromática. Ascos no observados. Ascosporas elipsoidales inequiláteras, con extremos angostos redondeados, castaño a castaño oscuro, de 12,3-13,5 x 5-6(-6,5) µm, con surco germinativo recto y largo en el lado convexo, perisporio dehiscente en KOH al 10%, con ornamentaciones en forma de anillos, episporio liso. Anamorfo: estructuras conidiógenas semejantes a Nodulisporium (Ju & Rogers, 1996).
Distribución y hábitat. Guyana, India, México, República de Zaire, Taiwán (Ju & Rogers, 1996). Saprófito sobre corteza de rama P. parlatorei.
Observaciones. Nuestros ejemplares coinciden con la descripción de Ju & Rogers (1996); encontrado sobre madera de árboles de Leguminosas en el suelo (Rogers, 1985).
Material examinado
ARGENTINA. Tucumán. Depto. Burruyacu: Sierra de Medina, ruta provincial 310, a 31 km desde Villa Padre Monti, Aguas Negras, Finca Mansilla, 1600 m, 18-VIII-1999, Catania 1710 (LIL).
SORDARIOMYCETES
XYLARIALES
XYLARIACEAE Tul. & C. Tul.
Nemania confluens (Tode) Laessøe & Spooner var. microspora Catania & A. I. Romero, var. nov. TIPO: Argentina, Catamarca, Ambato, Las Juntas, cruzando el río Las Juntas, 16-VI-1999,M. Catania 1680 (holotipo LIL). Figs. 3H-K y 5E-I.
A Nemania confluens var. confluens differt in ascosporis 9-10 x 4-5 µm.
Estromas peritecioides inmersos a casi superficiales, típicamente uniperiteciados, a menudo coalescentes en hileras lineales (1,5-3 mm de diám.) o en pequeños grupos (0,9-1,25 mm de diám.), hasta 5 o a veces más peritecios, debajo de una capa estromática externa carbonácea que se extiende en el sustrato, frecuentemente con un ápice aplanado. Ectostroma carbonáceo, que penetra en la madera y rodea a los peritecios como una zona carbonizada, de 0,1-0,25 mm de espesor. Endostroma escaso o poco diferenciado. Peritecio globoso a subgloboso, generalmente aplanado o deprimido apicalmente, de 0,7-1 x 0,6-1,2 mm, inmerso en la madera, ostíolos pequeños, cónicos. Peridio de 50- 75(-90) µm espesor, de textura porrecta: compuesto por hifas que se entrecruzan, amarillentas a castaño claras, paredes delgadas; hacia el interior en contacto con el lóculo peritecial formado por células aplanadas más claras de paredes delgadas. Ascos unitunicados, cilíndricos, octosporados, uniseriados, apicalmente redondeados, de 62-81 x 6,5-8 µm (parte esporífera), pedicelo corto de 22-58 µm; anillo apical I+, de 1,5-2(2,5) x 2(-2,5) µm. Paráfisis filiformes, flexuosas, incoloras, septadas. Ascosporas elipsoidales a elipsoidales-inequiláteras, con extremos redondeados, unicelulares, lisas, castañas claras a castañas; surco germinativo recto que cubre toda la longitud de la espora, de 9-10,4(-11) x (4-)4,5-5,2(-6) µm. Anamorfo: Geniculosporium sp. (Chester & Greenhalgh, 1964).
Distribución y hábitat. Dinamarca, Noruega, Suecia, Islas Británicas, Estados Unidos (Granmo et al., 1999). Alemania, Chile, Estados Unidos, Francia (Ju & Rogers, 2002). Saprófito sobre madera de P. parlatorei.
Observaciones. Nuestros materiales coinciden con la descripción de Nemania confluens (Tode) Laessøe & Spooner, realizado por Granmo et al. (1999); y comparten las características morfológicas de la especie, excepto en las ascosporas que en nuestros ejemplares son de dimensiones menores: 9-10,4 (-11) x (4-) 4,5-5,2 (-6) µm vs (13-) 14-20 x 7-10 µm (material de Granmo et al., 1999), razón por la cual se propone esta variedad.
Nemania confluens es una especie atípica de Nemania Gray, que se diferencia de todos los otros taxones del género por tener estromas uniperiteciados, por lo general, parcialmente inmersos en el sustrato, asco con estípite corto, aparato apical cuboide y ascosporas casi equiláteras; por lo que esta especie podría ser removida del género Nemania. Generalmente en el campo, en cuanto a su morfología, puede ser fácilmente confundida con los estromas pequeños de Euepixylon udum (Pers.) Laessøe& Spooner, los cuales tienen la papila ostiolar más pronunciada y las características líneas negras que aparecen en la zona baja del sustrato, además de tener las ascosporas de mayor longitud (Granmo et al., 1999).
En la Argentina, Hladki & Romero (2006), examinaron el holotipo de Hypoxylon magellanicum Speg., de Chile, confirmando la sinonimia con N. confluens, realizada por Granmo et al. (1999), criterio compartido por Ju & Rogers (2002). Spegazzini (1888) también coleccionó a esta especie en Ushuaia (Argentina) sobre Fagus betuloides Mirb. En cuanto a su ecología se lo encuentra sobre madera descortezada de Quercus L. sp. que parece ser un sustrato frecuente. También fue registrada por Dennis (1981, 1986) sobre Fagus L., Fraxinus Tourn. ex L., Fuchsia Plum. y Ulmus L. en las Islas Británicas. En Dinamarca a menudo la identifican como N. serpens (Pers.) Gray (Granmo, et al., 1999). Ellis & Ellis (1997) mencionan la especie sobre ramas muertas de Betula L., Castanea sativa Mill., Quercus, Fraxinus, Fagus y Ulmus.
Granmo et al. (1999) examinaron un espécimen coleccionado en Francia, sobre un tronco de Abies alba Mill. en descomposición, destacando que es raro encontrar especies de Nemania sobre madera de Gimnospermas. Este registro argentino constituye el segundo sobre una gimnosperma.
Paratipos
ARGENTINA. Catamarca. Depto. Ambato: Las Juntas, cruzando el río Las Juntas, 1780 msnm, 16-VI-1999, Catania 1683, 1688, 1696 (LIL); ibid., 26-XI-1999, Catania 1766 (LIL); ibid., 24-V-2000, Catania 1858, 1865, 1877, 1878, 1879, 1884, 1885 (LIL).
SORDARIOMYCETES
FAMILIA DE POSICIÓN INCIERTA
MAGNAPORTHACEAE P. F. Cannon
Ophioceras dolichostomum (Berk. & M. A. Curtis) Sacc., Syll. Fung. 2: 358. 1883. Sphaeria dolichostoma Berk. & M. A. Curtis, J. Linn. Soc. London 10: 388. 1869. TIPO: Cuba. Fungi Cubenses N° 856, C. Wright s.n. (holotipo no localizado, isotipo NY). Figs. 4J-M y 6A-D.
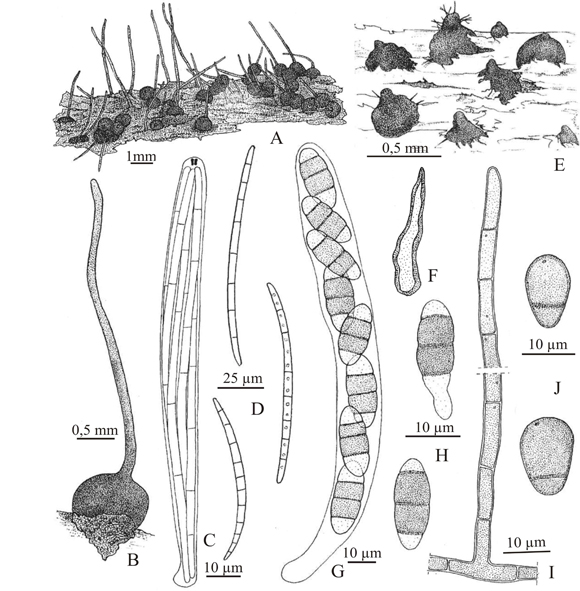
Fig. 6. Ophioceras dolichostomum. A, aspecto general de los ascomas. B, detalle de un ascoma. C, asco, anillo apical conspicuo. D, ascosporas filiformes. Tengiomyces indicus. E, aspecto general de los ascomas. F, seta. G, asco. H, ascosporas. I, conidióforo. J, conidios. A-D, Catania 1701 (LIL); E-J, de Catania 1687 (LIL).
Ascomas peritecioides negros, carbonáceos, gregarios, globosos, lisos, inmersos y/o superficiales en la madera, de 0,5-1 mm diám., peridio compuesto por células grandes de textura angularis; cuellos rectos a levemente curvados, insertos en el centro del vientre peritecial, glabros, ápice hialino, de 2-4 (-6) mm long., textura intricata, en el extremo las hifas se disponen oblicuamente y se entrecruzan entre ellas. Ascos unitunicados, cilíndricos, octosporados, tenues, anillo apical conspicuo refractario, I-, de (100-)110-135 x 10,5-12(-13) µm. Paráfisis septadas, hialinas, de 1,5 µm de diám. Ascosporas filiforme, rectas a levemente curvadas, hialinas, multiseptadas [7(-9) septos], gutuladas, lisas, dispuestas paralelamente en un fascículo en el asco, de (74-)78-125(-130) x 2-2,5(-3) µm. Anamorfo: desconocido.
Distribución y hábitat. Cuba, Florida (Conway & Barr, 1977); Australia, Hong Kong (Taylor & Hyde, 2003). Saprófito sobre madera P. parlatorei.
Observaciones. Berkeley & Curtis (1869) describieron originalmente esta especie para Cuba. Posteriormente, Saccardo (1883) la transfiere al género Ophioceras Sacc., registrando un total de 7 especies. Barr (1976) excluye el género Ophioceras de las Diaporthales principalmente por la estructura del peridio, peritecio, cuello, y el hábitat hipersaprófito. Conway & Barr (1977) estudiaron la especie tipo, originalmente coleccionada en Cuba y encontrada por ellos en la Florida. Consideraron al género dentro de la familia Lasiosphaeriaceae, orden Sordariales.
Nuestras colecciones, en general coinciden con las descripciones dadas por Conway & Barr (1977) y con el material tipo revisado; excepto porque en sus materiales los peritecios son de menor tamaño (hasta de 500 µm de diám.), ascosporas de menor longitud (94-110 µm) con sus células terminales solamente con gútulas, (en nuestros materiales todas las células son gutuladas). Conway & Barr (1977) la describen como un hongo hipersaprófito en madera de Quercus sp. Además, ésta especie ha sido encontrada sobre Archontophoenix alexandrae (F. Muell.) H. Wendl. & Drude y palmera en Hong Kong y Australia (Lu et al., 2000; Taylor & Hyde, 2003).
Material examinado
ARGENTINA. Tucumán. Depto. Burruyacu: Sierra de Medina, ruta provincial 310, a 31 km desde Villa Padre Monti, Aguas Negras, Finca Mansilla, 1600 m, 25-II-1999, Catania 1204 (LIL); ibid., 18-VIII-1999, Catania 1701 (LIL);ibid., 22-V-2000, Catania 1840, 1841 (LIL).
VENEZUELA. Miranda. Vicinity Quebrada Los Palos Grandes, South facing slope of La Silla, Parque Nac. El Avila, 2-VII-1972, K. P. Dumont-VE 3561, G. J. Samuels & B. Manara (NY), como Ophioceras dolichostoma (Berk. & Curt.) Sacc.
SORDARIOMYCETES
TRICHOSPHAERIALES
HELMINTHOSPHAERIACEAE Samuels, Cand.& Magni
Tengiomyces indicus (Varghese & V. G. Rao) Réblová, Mycotaxon 70: 408. 1999. Chaetosphaerella indica Varghese & V. G. Rao, Biovigyanam 5: 2. 1979. TIPO: India: Manjaly, Ekm, Kerala, dead ítems on fan unidentified dicotyledoneous plant, 2-X-1977, K. I. M. Varghese s.n. (holotipo AMH 3871). Figs. 6E-J y 8A-E.
Ascomas peritecioides seminmersos a superficiales, solitarios o gregarios, setosos, subglobosos, cortamente papilados, ostiolados, colapsados cuando secos, castaño oscuros a negros, de 200-350 x (120-)200-310 µm. Seta rígida, aguda, pared gruesa, castaño oscuro, sin septos, no ramificada, de 22-36,5 µm long., 4-5 µm de diám. en la base y 2,5 µm de diám. en el medio. Ascos unitunicados, octosporados, cilíndricos, con extremo redondeado, pedicelo corto, anillo apical I-, no diferenciado, de 90-143 x 9-10,5 µm. Ascosporas elipsoidales, con extremos redondeados, rectas o levemente curvadas, 3-septadas, las 2 células centrales castaño oscuras y la de los extremos hialinas, de 17-18(-19) x 6-8 µm. Anamorfo: Spadicoides sp.: Conidióforos macronematosos, mononematosos, no ramificados, cilíndricos, castaños, rectos o flexuosos, septados, con extremos redondeados, de 4-6 µm diám. Células conidiógenas intercalares y terminales, determinadas, cilíndricas. Conidios obclaviformes, 1-septados, de pared gruesa, con poro diferenciado, de 12-13 µm x 7-9 µm, disminuyendo a 4-5 µm diám.
Distribución y hábitat. China, India (Réblová, 1999). Saprófito sobre corteza P. parlatorei.
Observaciones. Réblová (1999) describe un nuevo género: Tengiomyces Réblová, con la única especie: T. indicus. Hongo saprófito, lignícola, que se caracte riza por presentar ascomas peritecioides superficiales, globosos a subglobosos, no papilados, setosos, que se colapsan en la parte superior cuando secos, ápice peri tecial truncado; con ascos de pared engrosada y ascos poras 3-septadas, elipsoidales, versicolor.
Tengiomyces indicus es conocido solamente por su dos colecciones, ambas de Asia (China e India) y es la única especie en este género. Spadicoides S. Hughes es aparentemente el anamorfo de T. indicus (Réblová, 1999).
Los conidióforos y micelio fueron encontrados creciendo en los peritecios jóvenes y maduros como así también en la superficie del sustrato en la colección realizada por Teng (1934) en China. En la colección de la India no se encontraron hifomi cetes asociados, solamente fue visto un subículo castaño claro, esparcido creciendo en la base del peritecio. La especie de Spadicoides asociada con el peritecio de T. indicus es ligeramente semejante a S. obovata (Cooke & Ellis) S. Hughes en la mor fología conidial, similares en tamaño (12,5-16 x 6- 8,5 µm) y color, pero truncado en el extremo pro ximal y carecen de poro visible en el extremo dis tal (Goh & Hyde, 1996).
Nuestro ejemplar coincide con la descripción de Réblová (1999), excepto por el tamaño menor de sus ascosporas (13-)14-17(-18) x (4-)5-6,5(-7,5) µm); menor longitud y mayor diámetro de sus ascos (68- )71-86(-91) x (11-)12-15(-16) µm. La presente muestra se encuentra muy deteriorada, lo cual podría explicar la escasa presencia de setas en los ascomas periteciales, que en nuestro caso solamente se encontraron muy pocas y de tamaño menor; los ascomas peritecioides son cortamente papilados, y muy colapsados. También junto a los ascomas peri tecioides se encontraron conidióforos y conidios 1- septados correspondientes al género Spadicoides.
El registro de esta especie, en su estado teleomórfico, es el tercero a nivel mundial.
Material examinado
ARGENTINA. Catamarca. Depto. Ambato: Las Juntas, cruzando el río Las Juntas, 1780 msnm, 16-VI-1999, Catania 1687 (LIL).
SORDARIOMYCETES
DIAPORTHALES
TOGNINIACEAE Réblová, L. Mostert, W. Gams& Crous
Togninia minima (Tul. & C. Tul.) Berl., Icon. Fung. 3: 11. 1900. Calosphaeria minima Tul.& C. Tul., Sel. Fung. Carpol. 2: 112, plate XIII: 23-24. 1863. TIPO: Yugoslavia. On roots and stems of Vitis vinifera, 1990, M. Muntañola-Cvetkovic' s.n (holotipo CBS 246.91). Figs. 7A-D y 8F-H.
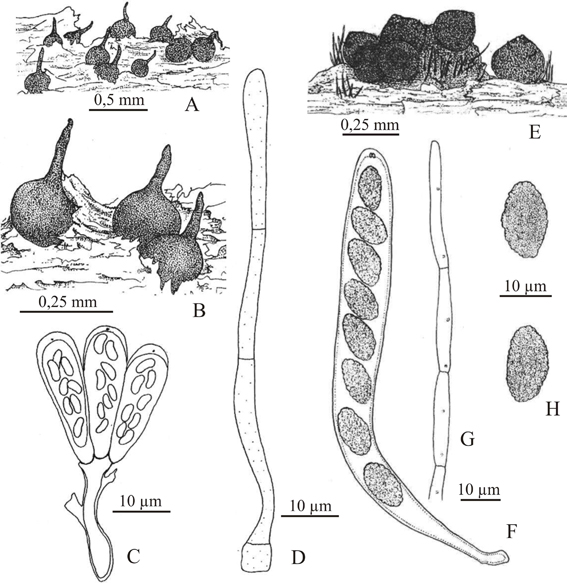
Fig. 7. Togninia minima. A, aspecto general de los ascomas. B, detalle. C, ascos sobre hifas ascógenas. D, paráfisis. Trichosphaeria pilosa. E, aspecto general de los ascomas. F, asco. G, paráfisis. H, ascosporas. A-D, de Catania 1678 (LIL); E-H, de Catania 1209 (LIL).

Fig. 8. Tengiomyces indicus. A, aspecto general de los ascomas. B, detalle de un ascoma. C, seta. D, ascosporas. E, conidio y ascosporas. Togninia minima. F, aspecto general de los ascomas. G, detalle. H, ascos sobre hifas ascógenas. Trichosphaeria pilosa. I, aspecto general de los ascomas. J, ascos y ascosporas. K, detalle. A-E, de Catania 1687 (LIL); F-H, de Catania 1678 (LIL); I-K, de Catania 1209 (LIL).
Sinonimia. Véase Mostert et al., 2006.
Ascomas peritecioides globosos a subglobosos, glabros, de (0,1-)0,15-0,25 mm diám., inmersos o superficiales, solitarios o gregarios, negros, con cuellos centrales, a veces excéntricos, rectos a leve mente curvados, no ramificados, de (0,2-)0,3-0,5 mm, perpendiculares u oblicuamente paralelos a la superficie del sustrato. Hifas ascógenas hialinas, aseptadas, de 18-27 x 2-3 µm, proliferantes, produ ciendo secuencialmente ascos laterales y termina les. Ascos octosporados, oblongo-claviformes, de 18-19 x 4-5 µm, ápices conspicuamente gruesos, con un aparato apical refringente muy pequeño, inamiloide. Ascosporas oblongas-elipsoidales a alantoides con extremos redondeados, de 3-5 x 1-2 µm, unicelulares, incoloras. Paráfisis excediendo el largo de los ascos, septadas, de 2,5-4 µm de diám., raramente ramificadas, abundantes, persistentes.
Anamorfo: Phaeoacremonium aleophilum W. Gams, Crous, M. J. Wingf. & Mugnai, Mycologia 88: 791, 1996.
Phaeoacremonium W. Gams, Crous & M. J. Wingf. es un género de hifomicetes dematiáceo con aproximadamente 17 especies (Crous et al., 1996; Dupont et al., 2000; Groenewald et al., 2001; Mos tert et al., 2005); incluye importantes hongos aso ciados con infecciones humanas y síntomas de enfermedades en hospedantes leñosos como culti vos de vid, mientras que el teleomorfo posee típica mente un ciclo de vida saprófito (Réblová & Mos tert, 2007). La conexión entre Phaeoacremonium aleophilum y Togninia minima (Tul. & C. Tul.) Berl., especie tipo del género, fue recientemente establecido "in vitro" por Mostert et al. (2003).
En nuestro país P. aleophilum es de amplia dis tribución y la especie más común en cultivos de vid, pero también han sido citadas P. parasiticum (Ajello, Georg & C.J. K. Wang) W. Gams, Crous & M.J. Wingf, en vid y P. argentinense L. Mostert, W. Gams & Crous (Dupont et al., 2002). Mostert et al. (2006) también aislaron de suelo P. argentinense y hallaron su correspondiente teleoformo, Togninia argentinense L. Mostert, W. Gams& Crous, sobre tallos de Vitis vinifera L.
Distribución y hábitat. Europa, Norte América (Barr, 1985, sobre madera); Canadá (sobre Prunus pensylvanica L. f.) y Estados Unidos (sobre Alnus, Hausner et al., 1992); Italia (sobre hospedante desconocido, Reblová et al., 2004). Argentina (saprófito sobre rama de P. parlatorei). Esta es la primera cita para Argentina, provincia de Catamarca.
Observaciones. Nuestra colección coincide con la descripción de Mostert et al. (2006) excepto en la longitud de los cuellos periteciales, siendo más largos en sus ejemplares (800-1800 µm long.). El género Togninia Berl., en cuanto a su posición taxonómica fue clasificado originalmente en Calosphaeriaceae, Calosphaeriales (Berlese, 1900; Barr, 1985; Mostert et al., 2003). Barr (1983) detalla la historia de la familia mencionada y sus géneros respectivos, y publica el primer concepto moderno de Calosphaeriaceae (Barr, 1985; Barr et al., 1993).
Sobre la base de datos moleculares, Togninia fue recientemente excluido del orden Calosphaeriales para formar una familia propia, las Togniniaceae, con afinidades filogenéticas con representante de Diaporthales (Reblová et al., 2004). Moster et al. (2006) monografiaron el género Togninia y sus anamorfos, y mediante los análisis filogenéticos basado en caracteres moleculares sostienen la ubicación de Togninia en Diaporthales.
Material examinado
ARGENTINA. Catamarca. Depto. Ambato: Las Juntas, cruzando el río Las Juntas, en bosques de P. parlatorei Pilg., 1780 m, 16-VI-1999, Catania 1678 (LIL).
Togninia minutissima (A. I. Romero & Samuels) M. Catania & A. I. Romero, comb. nov. Erostella minutissima A. I. Romero & Samuels, Sydowia 43: 236. 1991. TIPO: Argen tina, Buenos Aires, Ramallo, Ramallo, VIII-1981, Romero 39/4-13 (holotipo BAFC 32023!).
Observaciones. Se propone esta nueva combinación sobre la base de Hausner et al. (1992) y Mostert et al. (2003), quienes demostraron que Erostella (Sacc.) Sacc. es sinónimo del género Togninia Berl.
Distribución y hábitat. Descrita sobre Eucalyptus viminalis Labill. en la provincia de Buenos Aires. La tercera especie de Togninia citada para Argentina es Togninia argentinense L. Mostert, W. Gams & Crous sobre vid en la provincia de Men doza.
SORDARIOMYCETES
TRICHOSPHAERIALES
TRICHOSPHAERIACEAE G. Winter
Trichosphaeria pilosa (Pers.) Fuckel, Jb. Nas sau. Ver. Natura. 23-24: 145. 1870. Sphaeria pilosa Pers., Icones et Descriptiones Fungorum Minus Cognitorum (Leipzig) 2: 41. 1800. TIPO: Alemania, Leipzig, "nascitur passim at ligna exsiccata mucosa", sine data, Persoon s.n. (holotipo L?). Figs. 7E-H y 8I-K.
Ascomas peritecioides aislados o en grupos pequeños, globosos a subglobosos, base levemen te aplanada, superficiales, castaño oscuro, seto sos, de 140-200 x 140-160(-200) µm. Setas nume rosas, castañas, aseptadas, lisas, de 90-130 x 4-4,5 µm. Ascos cilíndricos-claviformes, 8-esporados, de 58,5-68(-70) x 6,5-8 µm. Paráfisis cilíndricas, raramente ramificadas, anastomosadas y septadas. Ascosporas elipsoidales, incoloras, unicelulares, rugosas, 9-10,5 x 4,5-5 µm. Anamorfo: desconocido.
Distribución y hábitat. Europa, Gran Bretaña (Farr et al., 2008). En Argentina saprófito sobre madera P. parlatorei. Probablemente sea ésta la primera cita para Sudamérica.
Observaciones. El género Trichosphaeria fue erigido por Fuckel (1870) con Trichosphaeria pilosa (Pers.) Fuckel, como especie tipo. Según Kirk et al. (2008), solamente son aceptadas 27 especies del género, de hábitat principalmente cortícola y lignícola y de amplia distribución.
Reblová (2006) realizó un estudio de sistemática molecular en donde Trichosphaeria pilosa, representando la familia Trichosphaeriaceae, toma una posición basal en relación a todos los otros ascomicetes unitunicados. La ubicación del orden Trichosphaeriales no ha sido resuelta por el alto grado de convergencia fenotípica y por datos moleculares escasos. T. pilosa tradicionalmente es aceptada como un ascomicete peritecial con asco unitunicado (von Arx & Müller, 1954; Réblová et al., 1999). Sin embargo, en este estudio de Reblová (2006) su ubicación en el árbol filogenético sugiere afinidad con los ascomicetes ascoloculares con ascos bitunicados.
Esta especie fue coleccionada sobre corteza y madera de Pinus sp. en Alemania (Saccardo, 1882); sobre Quercus sp. en Georgia (Estados Unidos) (Hanlin, 1963); sobre ramas muertas de Fagus sylvatica L. y Fraxinus excelsior L., en las Islas Británicas (Ellis & Ellis, 1997); sobre Alnus sp. en Suiza (Farr et al., 2008).
Material examinado
ARGENTINA. Tucumán. Depto. Burruyacu: Sierra de Medina, ruta provincial 310, a 31 km desde Villa Padre Monti, Aguas Negras, Finca Mansilla, 1600 m, 25-II-1999, Catania 1209 (LIL).
Agradecimientos
A los directores de los herbarios LIL, LPS, NY, por el préstamo de los materiales para su estudio. A Inés Jaume (perteneciente a la Sección Iconografía de la F.M.L.) por la realización de los dibujos. A Adriana I. Hladki por la lectura crítica del manuscrito. A la Fundación Miguel Lillo y al CIUNT por la financiación de este proyecto. Publicación del PRHIDEB-CONICET N° 180.
Bibliografía
1. Alves, A.; A. Correia; J. Luque & A. J. L. Phillips. 2004. Botryosphaeria corticola sp. nov. on Quercus species, with notes and description of Botryosphaeria stevensii and its anamorph Diplodia mutila. Mycologia 96: 598-613. [ Links ]
2. Barr, M. E. 1976. Perspectives in the Ascomycotina. Memoirs of the New York Botanical Garden 28: 1-8. [ Links ]
3. Barr, M. E. 1983. The ascomycete connection. Mycologia 75: 1-13. [ Links ]
4. Barr, M. E. 1985. Notes on the Calosphaeriales. Mycologia 77: 549-565. [ Links ]
5. Barr, M. E. 1990. Some Dictyosporous genera and species of Pleosporales in North America. Memoirs of New York Botanical Garden 62: 1-92. [ Links ]
6. Barr, M. E.; J. D. Rogers & Y.-M. Ju. 1993. Revisionary studies in the Calosphaeriales. Mycotaxon 48: 529-535. [ Links ]
7. Berkeley, M. J. & M. A. Curtis. 1869. Fungi Cubensis (Hymenoascomycetes). Journal of the Linnean Society of London 10: 280-392. [ Links ]
8. Berlese, A. N. 1900. Icones Fungorum ad usum Sylloges Saccardianae adcommodatae. 3 Sphaeriaceae allantosporae. Padova: Cramer. [ Links ]
9. Carmona, M.; D. Barreto, B. A. Pérez & F. Sautua. 2010. Enfermedades de Hordeum vulgare L. (cebada forrajera), en S. F. Nome, D. M. Docampo, L. R. Conci & B. A. Pérez (ed.), Atlas Fitopatológico Argentino 3(1). Córdoba, Argentina. URL: <http://www.fitopatoatlas.org.ar> [Consulta: noviembre 2010]. [ Links ]
10. Catania, M. 2001. Micromicetes asociados con corteza y/o madera de Podocarpus parlatorei Pilg. en la Argentina. Lilloa 40: 173-186. [ Links ]
11. Catania, M. 2004. Corynelia oreophila (Speg.) Starb. en el Noroeste Argentino. Lilloa 41: 3-8. [ Links ]
12. Catania, M. 2005. Micromicetes asociados con corteza y/o madera de Podocarpus parlatorei Pilg. en la Argentina. II. Ascomycotina. Lilloa 42: 15-26. [ Links ]
13. Catania, M. & A. I. Romero. 2001. Tripospora militaris sp. nov. from Argentina, with a key to the known species. Mycological Research 105: 1020-1024. [ Links ]
14. Catania, M. & A. I. Romero. 2005. Two new species of Camarops (Boliniaceae, Ascomycotina) and a key to Argentinean species. Sydowia 57: 3-18. [ Links ]
15. Catania, M. & A. I. Romero. 2006. Micromicetes asociados con corteza y/o madera de Podocarpus parlatorei Pilg. en la Argentina. III. Ascomycetes anamórficos. Lilloa 43: 29-43. [ Links ]
16. Catania, M. & A. I. Romero. 2007. Trichoglossum hirsutum var. hirsutum (Pers.) Boud. (Geoglossaceae, Helotiales) un nuevo registro en el Noroeste Argentino. Lilloa 44: 93-97. [ Links ]
17. Catania, M. & A. I. Romero. 2008. Micromicetes asociados con corteza y/o madera de Podocarpus parlatorei Pilg. en la Argentina. IV. Ascomycetes. Lilloa 45: 3-22. [ Links ]
18. Catania, M. & A. I. Romero. 2009. Micromicetes asociados con corteza y/o madera de Podocarpus parlatorei Pilg. en la Argentina. V. Ascomycota anamóficos. Lilloa 46: 43-51. [ Links ]
19. Checa, J. 2004. Dothideales dictiospóricos. Flora Mycologica Iberica 6: 1-162. [ Links ]
20. Chen, C.-Y. & W.-H. Hsieh. 1997. Taiwan Fungi: New records of ascomycetes. Fungal Science 12: 81-92. [ Links ]
21. Chester, C. G. C. & G. N. Greenhalgh. 1964. Geniculosporium serpens gen. et sp. nov., the imperfect state of Hypoxylon serpens. Transactions of the British Mycological Society 47: 393-401. [ Links ]
22. Conway, K. E. & M. E. Barr. 1977. Classification of Ophioceras dolichostomum. Mycotaxon 5: 376-380. [ Links ]
23. Crous, P. W.; W. Gams; M. J. Wingfield & P. S. Van Wyk. 1996. Phaeoacremonium gen. nov. associated with wilt and decline diseases of woody hosts and human infections. Mycologia 88: 786-796. [ Links ]
24. De Errasti, A. 2008. Endófitos fúngicos: un acercamiento a su biodiversidad y estrategias ecológicas. Tesis de Licenciatura. Universidad de Buenos Aires, Facultad de Ciencias Exactas y Naturales. [ Links ]
25. Dennis, R. W. G. 1981. British Ascomycetes Supplement. Edit. Vaduz: Cramer. [ Links ]
26. Dennis, R. W. G. 1986. Fungi of the Hebrides. Kew: Royal Botanic Gardens. [ Links ]
27. Dupont, J.; J. Laloui, S. Magnin, P. Larignon & M. F. Roquebert. 2000. Phaeoacremonium viticola, a new species associated with esca disease of grapevine in France. Mycologia 92: 499-504. [ Links ]
28. Dupont, J.; S. Magnin; C. Césari & M. Gatica. 2002. ITS and ß-tubulin markers help delineate Phaeoacremonium species, and the occurrence of P. parasiticum in grapevine disease in Argentina. Mycological Research 106: 1143-1150. [ Links ]
29. Ellis, M. B. & J. P. Ellis. 1997. Microfungi on Land Plants: An Identification Handbook. London: The Richmond Publishing. [ Links ]
30. Goh, T. K. & K. D. Hyde. 1996. Spadicoides cordanoides sp. nov., a new dematiaceous hyphomycete from submerged wood in Australia, with a taxonomic review of the genus. Mycologia 88: 1022-1031. [ Links ]
31. Granmo, A.; T. Laessøe & T. Schumacher. 1999. The genus Nemania s. l. (Xylariaceae) in Norden. Sommerfeltia 27: 1-96. [ Links ]
32. Groenewald, M.; J-C. Kang, P. W. Crous & W. Gams. 2001. ITS and ß-tubulin phylogeny of Phaeoacremonium and Phaeomoniella species. Mycological Research 105: 651-657. [ Links ]
33. Farr, D. F.; A. Y. Rossman, M. E. Palm & E. B. Mc Cray. 2008. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. <http://www.nt.ars-grin.gov/fungaldatabase/>. [Accessed March 2009]. [ Links ]
34. Farr, D. F.; A. Y. Rossman, M. E. Palm & E. B. Mc Cray. 2010. Fungal Databases, Systematic Mycology and Microbiology Laboratory, ARS, USDA. <http://www.nt.ars-grin.gov/fungaldatabase/>. [Accessed November 2010]. [ Links ]
35. Fuckel, L. 1870. Symbolae mycologicae. Beiträge zur kenntnis der rheinischen Pilze. Jahrbücher des Nassauischen Vereins für Naturkunde 23-24: 1-459. [ Links ]
36. Hanlin, R. T. 1963. A revision of the Ascomycetes of Georgia. Georgia Agricultural Experimental Station Mimeo Ser. 175:1-65. [ Links ]
37. Hausner, G.; G. G. Eyjólfsdóttir, J. Reid & G. R. Klassen. 1992. Two additional species of the genus Togninia. Canadian Journal of Botany 70: 724-734. [ Links ]
38. Hibbett, D. S.; M. Binder, J. F. Bischoff, M. Blackwell, P. F. Cannon, O. E. Eriksson, S. Huhndorf, T. James, P. M. Kirk, R. Lucking, H. Thorsten Lumbsch, F. Lutzoni, P. B. Matheny, D. J. Mclaughlin, M. J. Powell, S. Redhead, C. L. Schoch, J. W. Spatafora, J. A. Stalpers, R. Vilgalys, M. C. Aime, A. Aptroot, R. Bauer, D. Begerow, G. L. Benny, L. A. Castlebury, P. W. Crous, Y.-Ch. Dai, W. Gams, D. M. Geiser, G. W. Griffith, C. Gueidan, D. L. Hawksworth, G. Hes- tmark, K. Hosaka, R. A. Humber, K. D. Hyde, J. E. Ironside, U. K. Ljalg, C. P. Kurtzman, K.-H. Larsson, R. Lichtwardt, J. Longcore, J. Mia Dlikowska, A. Miller, J.-M. Moncalvo, S. Mozley-Standridge, F. Oberwinkler, E. Parmasto, V. Reeb, J. D. Rogers, C. Roux, L. Ryvarden, J. P. Sampaio, A. Schüßle J. Sugiyama, R. G.Thorn, L. Tibell, W. A. Untereiner, C. Walker, Z. Wang, A. Weir, M. Weiss, M. M. White, K. Winka, Y.-J. Yao, N. Zhang. 2007. A higherlevel phylogenetic classification of the Fungi. Mycological Research 111: 509-547. [ Links ]
39. Hladki, A. I. & A. I. Romero. 2006. Revisión de las especies de Hypoxylon propuestas por Spegazzini. Lilloa 43: 45-60. [ Links ]
40. Holmgren, P. K.; N. H. Holmgren & L. C. Barnett. 1990. Index Herbariorum. Part. I: The Herbaria of the World 8th ed. New York: New York Botanical Garden. [ Links ]
41. Hueck, K. 1978. Los bosques de Sudamérica. Eschborn: Sociedad Alemana de Cooperación Técnica. [ Links ]
42. Ju, Y.-M. & J. D. Rogers. 1996. A revision of the genus Hypoxylon. The Mycological Society of America. Mycologia Memoir Nº 20 and the American Phytopathological Society of America. St. Paul, Minnesota. [ Links ]
43. Ju, Y.-M. & J. D. Rogers. 2002. The genus Nemania (Xylariaceae). Nova Hedwigia 74: 75-120. [ Links ]
44. Kirk, P. M.; P. F. Cannon, D. W. Minter & J. A. Stalpers. 2008. Dictionary of the Fungi 10th Edition. Wallingford: Cabi Publishing. [ Links ]
45. Lu, B.; K. D. Hyde; W. H. Ho; K. M. Tsui; J. E. Taylor; K. M. Y. Wong & D. Zhou. 2000. Checklist of Hong Kong Fungi. Hong Kong: Fungal Diversity Press. [ Links ]
46. Lucas, M. T. & B. C. Sutton. 1971. Heptameria Rehm & Thüm. Transactions of the British Mycological Society 57: 283- 288. [ Links ]
47. Luttrell, E. S. & C. T. Rogerson. 1959. Homothallism in an undescribed species of Cochliobolus and in Cochliobolus kusanoi. Mycologia 51: 195-202. [ Links ]
48. Mostert, L.; P. W. Crous, J. Z. Groenewald; W. Gams & R. C. Sum- merbell. 2003. Togninia (Calosphaeriales) is confirmed as teleomorph of Phaeoacremonium by means of morphology, sexual compatibility and DNA phylogeny. Mycologia 95: 646-659. [ Links ]
49. Mostert, L.; J. Z. Groenewald, R. C. Summerbell; D. A. Sutton; A. A. Padhye & P. W. Crous. 2005. Species of Phaeoacremonium associated with human infections and environmental reservoirs in infected woody plants. Journal of Clinical Microbiology 43: 1752-1767. [ Links ]
50. Mostert, L.; F. Halleen, P. Fourie & P. W. Crous. 2006. A rewiew of Phaeoacremonium species involved in Petri disease and esca of grapevines. Phytopathologia Mediterranea 45: 12-29. [ Links ]
51. Petrini, L. E. & J. D. Rogers. 1986. A summary of the Hypoxylon serpens complex. Mycotaxon 26: 401-436. [ Links ]
52. Phillips, A.; A. Alves, A. Correia & J. Luque. 2005. Two new species of Botryosphaeria with brown, 1-septate ascospores and Dothiorella anamorphs. Mycologia 97: 513-529. [ Links ]
53. Réblová, M. 1999. Studies in Chaetosphaeria sensu lato I. The genera Chaetosphaerella and Tengiomyces gen. nov. of the Helminthosphaeriaceae. Mycotaxon 70: 387-420. [ Links ]
54. Réblová, M. 2006. Molecular systematics of Ceratostomella sensu lato and morphologically similar fungi. Mycologia 98: 68-93. [ Links ]
55. Réblová, M. & L. Mostert. 2007. Romellia is congeneric with Togninia, and description of Conidiotheca gen. nov. for one species of this genus with polysporous asci. Mycological Research 111: 299-307. [ Links ]
56. Réblová, M.; M. E. Barr & G. J. Samuels. 1999. Chaetosphaeriaceae, a new family for Chaetosphaeria and its relatives. Sydowia 51: 49-70. [ Links ]
57. Réblová, M.; L. Mostert, W. Gams; & P. W. Crous. 2004. New genera in the Calosphaeriales: Togniniella and its anamorph Phaeocrella, and Calosphaeriophora as anamorph of Calosphaeria. Studies in Mycology 50: 533-550. [ Links ]
58. Rogers, J. D. 1985. Hypoxylon duranii sp. nov. and the anamorphs of H. caries, H. papillatum, and Rosellinia subiculata. Mycotaxon 23: 429-437. [ Links ]
59. Rogerson, C. T. 1958. Diseases of grasses in Kansas: 1956-1957. U.S.D.A. Plant Disease Reporter 42: 346-353. [ Links ]
60. Romero, A. I. 1998. Clave de las especies de micromicetes xilófilos, registrados sobre Eucalyptus viminalis Labill en el noroeste de la provincia de Buenos Aires (Argentina). Boletin de la Sociedad Micológica de Madrid 23: 47-84. [ Links ]
61. Romero, A. I. & C. Carmarán. 1997. Algunos micromicetes xilófilos de la región subtropical Argentina. I. Misiones. Boletin de la Sociedad Argentina de Botanica 33: 59-67. [ Links ]
62. Romero, A. I. & D. W. Minter. 1988. Fluorescent microscopy: an aid to the elucidation of ascomycete structures. Transactions of the British Mycological Society 90: 457-470. [ Links ]
63. Romero, A. I. & G. J. Samuels. 1991. Studies on xylophilous fungi from Argentina. VI. Ascomycotina on Eucalyptus viminalis (Myrtaceae). Sydowia 43: 228-248. [ Links ]
64. Saccardo, P. A. 1882. Pyrenomycetum. Sylloge Fungorum 1: 1- 768. [ Links ]
65. Saccardo, P. A. 1883. Pyrenomycetum Sylloge Fungorum 2: 1- 813. [ Links ]
66. Shoemaker, R. A. 1964. Conidial states of some Botryosphaeria species on Vitis and Quercus. Canadian Journal of Botany 42: 1297-1301. [ Links ]
67. Sivanesan, A. 1984. The Bitunicate Ascomycetes and their anamorphs. Vaduz, Liechtenstein, J. Cramer. [ Links ]
68. Spegazzini, C. L. 1888. Fungi Fuegiani. Boletin de la Academia Nacional de Ciencias de Córdoba 11: 135-311. [ Links ]
69. Spegazzini, C. L. 1910. Fungi Chilenses. Revista de la Facultad de Agronomia y Veterinaria, La Plata 6: 1- 205. [ Links ]
70. Spegazzini, C. L. 1912. Mycetes Argentinenses. 6. Anales del Museo Nacional de Buenos Aires 23: 1-146. [ Links ]
71. Subramanian, C. V. & B. L. Jain. 1966. A revision of some graminicolous Helminthosporia. Current Science 35: 352-355. [ Links ]
72. Taylor, J. E. & K. D. Hyde. 2003. Microfungi of tropical and temperate palms. Hong Kong: Fungal Diversity Press. [ Links ]
73. Teng, S. C. 1934. Notes on Sphaeriales from China. Sinensia 4: 359-433. [ Links ]
74. Von Arx, J. A. & E. Müller. 1954. Die Gattungen der amerosporen Pyrenomyceten. Beiträge zur Kryptogamenflora der Schweiz 11: 1-434. [ Links ]














