Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Darwiniana, nueva serie
versión impresa ISSN 0011-6793
Darwiniana vol.49 no.1 San Isidro ene./jun. 2011
BIOLOGÍA REPRODUCTIVA
Biología reproductiva de Gomesa Bifolia (Orchidaceae, Cymbidieae, Oncidiinae)
Juan P. Torretta, Natalia E. Gomiz, Sandra S. Aliscioni & Mariano E. Bello
Cátedra de Botánica Agrícola, Facultad de Agronomía, Universidad de Buenos Aires, Av. San Martín 4453, C1417DSE Ciudad Autónoma de Buenos Aires, Argentina; torretta@agro.uba.ar (autor corresponsal).
Resumen
Gomesa bifolia (Orchidaceae, Cymbidieae, Oncidiinae) es una orquídea epífita que presenta vistosas flores amarillas con marcas marrones en los sépalos y pétalos, carentes de fragancia y con aceite como recompensa. La biología floral de esta especie fue estudiada en individuos cultivados para describir la fenología, longevidad floral, conocer el sistema reproductivo (mediante tratamientos manipulativos de auto-polinización vs. polinización cruzada) y sus polinizadores. Además, se realizaron observaciones directas sobre plantas expuestas al aire libre para identificar a los polinizadores, describiendo su comportamiento de forraje y la duración de las visitas. Los resultados obtenidos revelan que G. bifolia es una especie principalmente auto-incompatible, no autógama y dependiente de sus polinizadores. La formación de frutos en flores tratadas con polinización cruzada manual (100%) fue superior a las flores manualmente auto-polinizadas (30,8%); mientras que las flores no tratadas no formaron frutos. Los únicos polinizadores observados fueron hembras de Centris trigonoides (Apidae, Centridini), y la tasa de visitas fue baja. Numerosas orquídeas Neotropicales de la subtribu Oncidiinae ofrecen aceites florales a sus polinizadores, como lo hacen los representantes de la familia Malpighiaceae. Los resultados obtenidos también permiten inferir que ambos grupos de plantas estarían formando parte de un gremio de especies polinizadas por abejas colectoras de aceites y que el síndrome de polinización por engaño no es verdadero para todas las especies de Oncidiinae.
Palabras clave. Aceite floral; Biología floral; Oncidiinae; Reproducción.
Abstract
Gomesa bifolia (Orchidaceae, Cymbidieae, Oncidiinae) is an epiphytic orchid that presents showy yellow flowers with brown markings on sepals and petals, fragranceless and with oil as reward. The floral biology of this species was studied in cultivated individuals to describe phenology, flower longevity, reproductive system (using manipulative treatment of cross-pollination vs. self-pollination) and floral pollinators. Moreover, direct observations were made on plants exposed outdoors to identify pollinators, describing their foraging behavior and the duration of visits. The results showed that G. bifolia is a mainly self-incompatible, non-autogamous and pollinator-dependent species. The fruit set in manually cross-pollination flowers (100%) was higher than the manually self-pollinated flowers (30.8%), whereas the control flowers did not set fruits. Females of Centris trigonoides (Apidae, Centridini) were the exclusive pollinators, and the visit rate was low. Several Neotropical orchids of the subtribe Oncidiinae offer floral oils to the pollinators, like the Malpighiaceae familiy. Our results allow inferring that both groups of plants would be part of a guild of species pollinated by oil-collecting bees and that the deceit/pollination syndrome should not be applied to all Oncidiinae flowers.
Keywords. Floral biology; Oil-rewarding flower; Oncidiinae; Reproduction.
INTRODUCCIÓN
La diversidad de la morfología floral y biología reproductiva de las orquídeas (Orchidaceae) atrajo la atención de diversos investigadores (Darwin, 1862; van der Pijl & Dodson, 1966; Tremblay et al., 2005). Las flores de esta familia son muy variadas en forma y color, y atraen a una gran diversidad de polinizadores (van der Pijl & Dodson, 1966; Proctor et al., 1996; van der Cingel, 2001). La importancia de los polinizadores dentro de la familia Orchidaceae se refleja en los complejos mecanismos de polinización (Tremblay, 1992), como también en las diversas recompensas ofrecidas a sus polinizadores (Davies & Stpiczynska, 2008). Sin embargo, cerca de un tercio de especies de Orchidaceae no ofrece recompensas (Tremblay et al., 2005) y engañan a sus polinizadores, a través de diversos mecanismos de decepción (Jersáková et al., 2006).
Con respecto al sistema reproductivo, la autocompatibilidad prevalece en las orquídeas; aunque para algunos linajes se ha reportado la presencia de auto-incompatibilidad (Tremblay et al., 2005). Roberts (2003) menciona que numerosas especies de la subtribu Oncidiinae son auto-incompatibles. Tremblay et al. (2005) resumen el conocimiento acerca de la auto-incompatibilidad dentro de Oncidiinae, citando auto-incompatibilidad para los géneros Tolumnia Raf., Trichocentrum Poepp. & Endl. y Oncidium Sw.
La subtribu Oncidiinae, según la circunscripción sistemática propuesta por Chase et al. (2003), presenta un diverso espectro en sus relaciones con los polinizadores (Dressler, 1993); pero existen estudios sobre polinización y biología reproductiva para un pequeño número de especies (van der Pijl & Dodson, 1966; Ackerman & Montero Oliver, 1985; Chase, 1986; Rodríguez-Robles et al., 1992; Singer & Cocucci, 1999; Carvalho & Machado, 2006, Pansarin & Pansarin 2010).
Gomesa bifolia (Sims) M.W. Chase & N.H. Williams es una especie perenne, epífita, perteneciente a la subtribu Oncidiinae (tribu Cymbidieae) que se distribuye desde Bolivia, Brasil, Paraguay, Uruguay hasta Argentina, alcanzando su extremo austral en los bosques ribereños del Río de la Plata, en la provincia de Buenos Aires. Tradicionalmente, G. bifolia fue considerada dentro de Oncidium, uno de los géneros más conspicuos y sistemáticamente controversiales de orquídeas neotropicales. Sobre la base de estudios filogenéticos moleculares, Chase et al. (2009) decidieron transferir O. bifolium Sims al género Gomesa R. Br. con la intención de redefinir los límites taxonómicos de Oncidium a un grupo monofilético de especies.
La mayoría de las especies de la subtribu Oncidiinae del Nuevo Mundo no ofrecen recompensas a sus polinizadores (Chase et al., 2009). Sin embargo, para algunas especies de Gomesa, Lockhartia Hook., Oncidium, Ornithocephalus Hook, Phymatidium Lindl. y Trichocentrum (Singer & Cocucci, 1999; Flach et al.; 2004; Reis et al., 2006; 2007; Pacek & Stpiczynska, 2007; Stpiczynska et al., 2007, Stpiczynska & Davies, 2008) se demostró la existencia de aceites florales como recompensa para sus polinizadores. Sobre la base de estudios anatómicos y ultraestrucutrales, Aliscioni et al. (2009) han demostrado la presencia de elaióforos epiteliales en el labelo y la secreción de aceite en G. bifolia.
La subtribu Oncidiinae se distingue del resto de las Orchidaceae por su diversidad en cuanto a las estrategias de vida, hábitos y números cromosómicos por lo que sus especies son interesantes de estudiar a distintos niveles evolutivos (Chase et al., 2005). Asimismo, la interacción de las flores de estas especies con sus polinizadores es altamente especializada, vía mimetismo floral o vía producción de recompensa, pero la biología reproductiva fue estudiada para un número reducido de especies.
Debido que G. bifolia es una especie de Oncidiinae que presenta elaióforos, es interesante estudiar su biología reproductiva y su interacción con polinizadores, ya que este carácter es poco frecuente para la familia, pudiendo representar una estrategia evolutiva novedosa para las Oncidiinae, un grupo diverso y rico de orquídeas Neotropicales.
Mediante este estudio describimos la fenología y longevidad floral de G. bifolia; estudiamos su sistema reproductivo y sus polinizadores, discutimos nuestros resultados con aquellos publicados para otras especies de Oncidium (s.l.) y géneros estrechamente relacionados dentro de la actual circunscripción de la subtribu.
MATERIALES Y MÉTODOS
Especie estudiada
Las plantas de G. bifolia presentan inflorescencias paniculadas arqueadas a la madurez, de 20-50 cm, con 7-15 flores. Las flores son amarillas (2-3 x 4-5,5 cm) con marcas marrones en los sépalos y pétalos, y carecen de fragancias. El labelo es trilobulado, con un gran lóbulo apical emarginado y dos pequeños lóbulos laterales sub-erectos y auriculados. En la base del labelo y entre los dos lóbulos laterales, se localiza un callo que está formado por varias protrusiones.
Plantas de G. bifolia (N=10 individuos) fueron mantenidas en cultivo en un invernáculo del Jardín Botánico "Lucien Hauman", Facultad de Agronomía, Universidad de Buenos Aires. Fueron coleccionadas de poblaciones naturales en el Dpto. Oberá, Provincia de Misiones, Argentina (S 27º 28' W 55º 07'). Un ejemplar de referencia se encuentra depositado en el Herbario "Gaspar Xuarez" (BAA 26015), Facultad de Agronomía, Universidad de Buenos Aires.
Las plantas fueron mantenidas en macetas con corteza de pino como sustrato, y encerradas con bolsas de tul para evitar que las flores de cualquier tratamiento (incluso las flores mantenidas como control) reciban visitantes.
Fenología y longevidad floral
Para describir la antesis y determinar la longevidad floral, veintidós botones florales pertenecientes a cinco individuos de G. bifolia fueron marcados con etiquetas numeradas y observados dos veces por día (8:00 h y 19:00 h) hasta la senescencia floral. Definimos antesis como el tiempo transcurrido desde que comienza la apertura floral hasta que se observaban los primeros rasgos de marchitez, y senescencia a partir de ese momento hasta la caída de los ciclos florales estériles.
Sistema reproductivo
El sistema reproductivo fue estudiado utilizando el siguiente protocolo manipulativo: a) para probar autogamia y/o auto-polinización automática, se marcaron flores que no recibieron ningún tratamiento (este grupo de flores fue utilizado como control), b) para probar auto-compatibilidad, un polinario fue depositado en la superficie estigmática de la misma flor o de otra flor de la misma inflorescencia, y c) para probar polinización cruzada, un polinario fue depositado en la superficie estigmática de una flor de otro individuo. Estos tres tratamientos fueron asignados al azar a todas las flores de cada inflorescencia y todos los eventos de polinización manual (auto-polinización y polinización cruzadas) fueron realizados el segundo día después de la antesis. Las plantas utilizadas tenían de 1 a 3 inflorescencias cada una y, para los tres tratamientos, se utilizaron en total 81 flores de 21 inflorescencias. La proporción de flores que producen frutos (tasa de fructificación) para cada tratamiento fue utilizada como una medida del éxito reproductivo. La proporción fruto/flor obtenida para cada tratamiento se comparó mediante el test estadístico no paramétrico de Kruskal-Wallis (Zar, 1996).
Polinizadores
Con el objeto de conocer los polinizadores de G. bifolia en el área de estudio, tres plantas de G. bifolia (con 10, 17 y 31 flores, respectivamente) fueron expuestas en el campo del Jardín Botánico "L. Hauman" y observadas por un total de 15 h, durante los días 5, 6 y 7 de diciembre de 2007, de 9:00 h a 15:00 h. Durante las observaciones se registró el comportamiento de forraje y la duración de las visitas. Algunos ejemplares de los polinizadores fueron capturados con redes entomológicas, posteriormente preparados con técnicas de rutina e identificados en el laboratorio. Los especímenes coleccionados se encuentran depositados en la Colección Entomológica de la Cátedra de Botánica (FAUBA) de la Facultad de Agronomía de la Universidad de Buenos Aires.
RESULTADOS
Fenología y longevidad floral
Las plantas de G. bifolia florecieron desde mediados de noviembre hasta principios de enero en nuestra área de estudio. La floración fue en sentido acrópeto (Fig. 1 A), y la duración de la inflorescencia fue de 35 a 50 días. La longevidad floral fue de 21,25 ± 2,65 días (media ± s.d., N=22). El período de fructificación comenzó a fin de enero hasta fin de marzo. Las cápsulas demoraron entre 70 y 90 días para completar su maduración (Fig. 1E ). El período de senescencia floral (desde el comienzo del marchitamiento hasta la caída de los ciclos florales estériles) fue de 1,92 ± 0,18 días (media ± d.e., N=22).

Fig. 1. Gomesa bifolia (Oncidiinae: Cymbidieae: Orchidaceae). A, Inflorescencias con flores en diferentes estadios. B, flor en vista frontal. C, flor en el comienzo de la antesis. D, flor en vista lateral. E, cápsula inmadura. Abreviaturas: Ac, caperuza de la antera; Ca, callo; Co, columna; Cw, alas de la columna; Lab, labelo; Pe, pétalos; Se, sépalos; St, estigma; Ti, tabula infraestigmatica; Vi, viscidio.
Sistema reproductivo
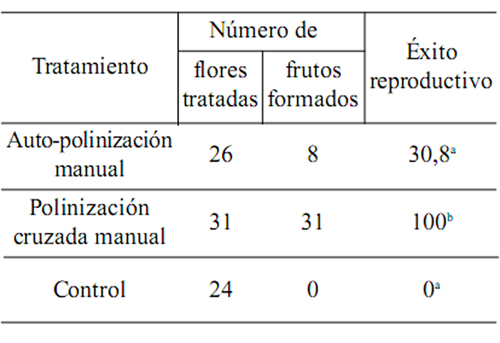
Nuestros resultados indican que G. bifolia se comporta mayormente como una especie autoincompatible (Kruskal-Wallis H (2, N=26)= 18,87, p < 0,00001). Sin embargo, se observó la formación de frutos en flores auto-polinizadas (Tabla 1). La tasa de fructificación fue 100% en el tratamiento de polinización cruzada, mientras que para las flores auto-polinizadas dicha tasa fue 30,8% (rango = 0 - 57,1%). Ninguna de las flores control (no manipuladas) desarrolló fruto. De los diez frutos que comenzaron a desarrollarse a partir de flores auto-polinizadas, dos abortaron antes de alcanzar la madurez de las semillas. La senescencia de las flores polinizadas de manera manual se evidenció al siguiente día de la polinización (independientemente del tratamiento), la que resultó mucho más rápida que en las flores control.
Tabla 1. Número de flores tratadas, de frutos formados y éxito reproductivo (proporción de fruto/flor) de Gomesa bifolia obtenido a través de tratamientos de auto-polinización manual y polinización cruzada manual. Las flores "control" no recibieron ningún tratamiento. Letras iguales indican diferencias no significativas (P<0,0001).
Polinizadores
Los únicos polinizadores observados en las tres plantas de G. bifolia que fueron expuestas, resultaron ser individuos hembra de Centris trigonoides Lepeletier (Apidae: Centridini) (Fig. 2 A). Las plantas recibieron cinco, cinco y dos visitas durante los tres días de observación, respectivamente. Los polinizadores recorrieron 1-2 flores por visita, con vuelos rápidos y la duración de cada visita floral fue de 1-5 segundos. Los mismos se acercaron a la flor volando rápidamente, luego sobrevolaron frente a la flor y aterrizaron sobre el callo. En esta posición, las abejas se tomaron de la tabula infrastigmatica mediante sus mandíbulas, mientras coleccionaban (forrajeaban) aceites florales con sus patas delanteras y medias. Durante este comportamiento de forraje la abeja puede contactar el viscidio y cuando ocurre la remoción del polinario, éste queda adherido al área clipeal de la abeja (Fig. 2 B).
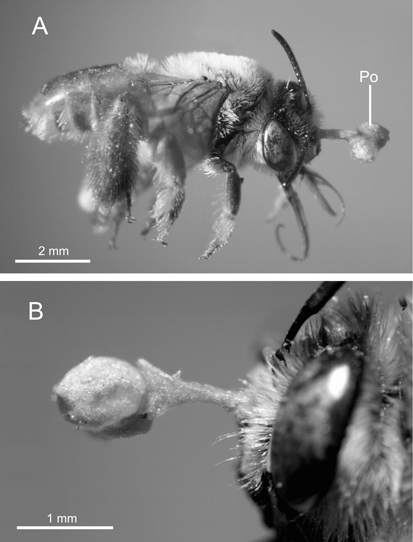
Fig. 2. Hembra de Centris trigonoides (Apidae: Centridini) capturada sobre una flor de Gomesa bifolia con una polinario adherido en el área clipeal. A, Vista lateral. B, detalle de la cabeza. Abreviatura: Po, polinario.
DISCUSIÓN
Nuestros resultados revelaron que en G. bifolia, si bien es una especie principalmente auto-incompatible, alógama y dependiente de los polinizadores, también se detectó un porcentaje bajo de autocompatibilidad. La tasa de fructificación en el tratamiento de polinización cruzada fue significativamente mayor que la obtenida en el tratamiento de auto-polinización, mientras que las flores no tratadas no fructificaron. Tremblay et al. (2005) enumeraron 10 especies de Oncidium s.l. auto-incompatibles. Por otro lado, Singer et al. (2006) mencionaron que numerosas especies ornamentales de Oncidium s.l. son fuertemente auto-incompatibles. Además, la auto-incompatibilidad fue reportada en Rodriguezia bahiensis Rchb. f. (Carvalho & Machado, 2006), Gomesa hookeri (Rolfe) M.W. Chase & N.H. Williams (Alcantara et al., 2006) y Trichocentrum ascendens (Lindl.) M.W. Chase & N.H. Williams (Parra-Tabla et al., 2000) y T. pumilum (Lindl.) M.W. Chase & N.H. Williams (Pansarin & Pansarin, 2010).
Los resultados obtenidos en este trabajo mostraron la formación de algunos frutos en flores auto-polinizadas (30.8%). Dado que no realizamos estudios de viabilidad de semillas, no podemos inferir si las semillas obtenidas a partir de diferentes tratamientos tienen capacidad similar para germinar y establecer nuevos individuos. Futuros estudios sobre desarrollo de fruto, embriología y germinación de semillas obtenidos por distintos tratamientos manipulativos (auto-polinización y polinización cruzada) permitirán comprender de manera fehaciente el sistema reproductivo de esta especie.
Mediante nuestras observaciones pudimos detectar pocas visitas de hembras de C. trigonoides en las flores de G. bifolia, siendo el único polinizador en el sitio de estudio. Estas observaciones concuerdan con lo reportado por Tremblay (1992), quien mostró que el 67% de las orquídeas son polinizadas por un único polinizador. En cuanto a las áreas de distribución, Centris trigonoides se halla desde México hasta las Provincias del NO y NE de Argentina, siendo Buenos Aires el límite austral (Roig Alsina, 2000). G. bifolia coincide en parte con la distribución geográfica de C. trigonoides, ya que se encuentra a lo largo de ambientes boscosos desde Bolivia hasta NO y NE de Argentina, alcanzando su extremo austral de distribución en los bosques ribereños del Delta del Río de la Plata. A pesar de que nuestras observaciones fueron realizadas en un sitio antrópico, éste se encuentra dentro de las áreas de distribución natural de G. bifolia y C. trigonoides, en el extremo austral para ambas especies. Si bien ambas especies son simpátricas en una amplia región de Argentina, este hecho no implica una interacción especialista entre ambos participantes, debido a que numerosas especies de Centris cohabitan con G. bifolia en otras regiones dentro de su área de distribución natural. Por lo tanto, no podemos rechazar la posibilidad que otras especies de este género de abejas visiten las flores de G. bifolia en otros sitios geográficos.
Las flores secretoras de aceites son polinizadas por abejas pertenecientes a las familias Apidae, Melittidae y Ctenoplectridae, aunque en la región Neotropical solo está representada la familia Apidae con diversos géneros de tres diferentes tribus Centridini (Centris y Epicharis), Tapinotaspidini (Caenonomada, Chalepogenus, Lanthanomelissa, Monoeca, Paratetrapedia s.l., Tapinotaspis) y Tetrapediini (Tetrapedia).
La secreción de aceites florales como recompensa fue descubierta por Vogel (1974) y la presencia de glándulas secretoras de aceite en Angiospermas tiene un origen polifilético, por lo cual este carácter debió haber surgido repetidas veces de manera independiente en diversos grupos taxonómicos (Rasmussen & Olesen, 2000). Actualmente se acepta que unos 28 linajes de Angiospermas (Renner & Schaefer, 2010) ofrecen aceites florales a abejas que coleccionan activamente esta recompensa como alimento junto con el polen para sus larvas o para el revestimiento de sus celdas de cría.
A partir del trabajo de Vogel (1974) se asumió una asociación importante entre abejas del género Centris y algunas orquídeas de la subtribu Oncidiinae en el Neotrópico (Pemberton, 2010). Como se mencionó anteriormente, muchas de estas orquídeas presentan flores que no ofrecen recompensas, y se mimetizan con flores de la familia Malpighiaceae, las cuales presentan elaióforos glandulares en el cáliz (Vogel, 1990). Ejemplo de esto es Oncidium cosymbephorum C. Morren (mimética de Malpighia glabra L.) que atrae a hembras de C. ruthannae (Carmona-Díaz & García-Franco, 2009).
Sin embargo, la presencia de elaióforos fue confirmada en numerosas especies de Oncidiinae: Gomesa loefgrenii (Cogn.) M.W. Chase & N.H. Williams, G. paranaensis (Kraenzl.) M.W. Chase & N.H. Williams, G. radicans (Rchb.f.) M.W. Chase & N.H. Williams, G. recurva R. Br., G. venusta (Drapiez) M.W. Chase & N.H. Williams, G. bifolia, Oncidium cheirophorum Rchb.f., Ornithocephalus kruegeri Rchb.f., Phymatidium delicatulum Lindl., P. tillandsioides Barb. Rodr., Trichocentrum cavendishianum (Bateman) M.W. Chase & N.H. Williams y T. pumilum (Singer & Cocucci, 1999; Reis et al., 2006, Stpiczynska et al., 2007; Stpiczynska & Davies, 2008, Pacek & Stpiczynska et al, 2007; Aliscioni et al., 2009, Pansarin & Pansarin 2010). Renner & Schaefer (2010) reportaron que la presencia de glándulas secretoras de aceites evolucionó independientemente numerosas veces en las Orchidaceae.
Para algunas especies de Oncidium s.l. (y géneros estrechamente relacionados) que secretan aceites, se conoce también que reciben visitas de Centris, Paratetrapedia s.l., y Tetrapedia (Singer & Cocucci, 1999; Silveira, 2002; Pansarin & Pansarin 2010; Renner & Schaefer, 2010, este trabajo), al igual que las flores de las Malpighiaceae. Este hecho permitiría pensar que este grupo de orquídeas y las Malpigiáceas podrían estar formando un gremio de plantas polinizadas por el mismo grupo de abejas colectoras de aceites y por ese motivo presentan semejanzas florales superficiales. Nuestros resultados aportan más evidencias a lo sugerido por Reis et al. (2007), quienes afirman que el síndrome de polinización por engaño no es verdadero para todas las flores de Oncidiinae.
Nosotros observamos que los individuos de C. trigonoides contactan los ciclos fértiles de las flores de G. bifolia durante sus visitas. El polinario de esta orquídea se fija a la región clipeal mientras la abeja colecciona (forrajea) aceite secretado en las protrusiones del callo de la flores (Aliscioni et al., 2009). Durante estas breves visitas, las hembras de C. trigonoides raspan el área del callo floral con sus basitarsos delanteros y medios, los cuales tienen en sus márgenes un cepillo de setas especializadas en la colección de aceite (Neff & Simpson, 1981). Las hembras de C. trigonoides utilizan aceites florales mezclados con polen para aprovisionar sus celdillas de cría (Simpson et al., 1977).
El comportamiento de forraje de estas abejas en las flores de G. bifolia, junto con los datos anatómicos y ultra-estructurales reportados por Aliscioni et al. (2009) confirman que esta orquídea es una especie que ofrece aceite como recompensa a sus polinizadores. Las visitas de las abejas son de corta duración y son semejantes al comportamiento de otras abejas colectoras de aceites en flores de otras Oncidiinae (Pansarin & Pansarin, 2010). Una posible explicación a este comportamiento podría deberse a que la cantidad de aceite producido por los elaióforos florales de G. bifolia sea escaso. Además, como demuestran Aliscioni et al. (2009), el aceite queda depositado como una delgada capa continua cubriendo las células epidérmicas. Es decir, que durante el comportamiento de forraje (raspado del elaióforo con las patas delanteras y medias), el aceite puede adherirse por capilaridad de las patas de las abejas. Esto se vería facilitado por el hecho de que la abeja no tiene que romper la cutícula para obtener la recompensa como ocurre en otras especies en las cuales la cutícula se despega generando una "ampolla" de aceite como en Gomesa paranaensis (Singer & Cocucci, 1999).
Durante doce horas de observación, registramos pocos eventos de visitas y solamente en una ocasión la remoción del polinario por una hembra de C. trigonoides. Este hecho concuerda con lo reportado por Tremblay et al. (2005), quienes comentan que la frecuencia de visitas efectivas en las orquídeas, cuantificadas como remoción de polinias y polinizaciones, es a menudo muy baja.
La longevidad de las flores no manipuladas de G. bifolia fue de aproximadamente tres semanas, pero en las flores manualmente polinizadas (autopolinización o polinización cruzada), la senescencia floral se hizo evidente un día después de la polinización. La remoción de polinias y/o polinización puede tener distintas implicancias, tales como la de producir cambios en emisión de aromas y/o producción de recompensas florales (Parra-Tabla et al., 2009). Además, la senescencia inmediata, siguiendo un evento de polinización, es una respuesta típica encontrada en las Orchidaceae (Primack, 1985; Clayton & Aizen, 1996; Abdala-Robles et al., 2007). En esta familia, las flores de algunas especies no autógamas viven por varias semanas (Primack, 1985) y su longevidad puede ser vista como una compensación por la rareza de los eventos de polinización o por impredecibilidad de los polinizadores (Endress, 1998).
AGRADECIMIENTOS
A Rodrigo B. Singer y un revisor anónimo por la lectura crítica y sus comentarios, que permitieron mejorar la versión preliminar del manuscrito.
BIBLIOGRAFÍA
1 Abdala-Robles, L.; V. Parra-Tabla & J. Navarro. 2007. Is floral longevity influenced by reproductive costs and pollination success in Cohniella ascendens (Orchidaceae)? Annals of Botany 100: 1367-1371. [ Links ]
2 Ackerman, J. D. & J. C. Montero Oliver. 1985. Reproductive biology of Oncidium variegatum: moon phases, pollination, and fruit set. American Orchid Society Bulletin 54: 326-329. [ Links ]
3 Alcántara, S.; J. Semir & V. N. Solferin. 2006. Low genetic structure in an epiphytic Orchidaceae (Oncidium hookeri) in the Atlantic rainforest of south-eastern Brazil. Annals of Botany 98: 1207-1213. [ Links ]
4 Aliscioni, S. S.; J. P. Torretta; M. E. Bello & B. G. Galati. 2009. Elaiophores in Gomesa bifolia (Sims) M.W. Chase & N.H. Williams (Oncidiinae: Cymbidieae: Orchidaceae): structure and oil secretion. Annals of Botany 104: 1141-1149. [ Links ]
5 Carmona-Díaz, G. & J. García-Franco. 2009. Reproductive success in the Mexican rewardless Oncidium cosymbephorum (Orchidaceae) facilitated by the oil-rewarding Malpighia glabra (Malpighiaceae). Plant Ecology 203:253-261. [ Links ]
6 Carvalho, R. & I. C. Machado. 2006. Rodriguezia bahiensis Rchb. f.: biologia floral, polinizadores e primeiro registro de polinizaçao por moscas Acroceridae em Orchidaceae. Revista Brasileira de Botanica 29: 461-470. [ Links ]
7 Chase, M. W. 1986. Pollination ecology of two sympatric, synchronously flowering species of Leochilus in Costa Rica. Lindleyana 1: 141-147. [ Links ]
8 Chase, M. W.; R. L. Barrett; K. N. Cameron & J. V. Freudenstein. 2003. DNA data and Orchidaceae systematics: a new phylogenetic classification, en K. M. Dixon (ed.), Orchid conservation, pp. 69-89. Kota Kinabalu, Sabah: Natural History Publications. [ Links ]
9 Chase, M. W.; L. Hanson; V. A. Albert; W. M. Whitten & N. H. Williams. 2005. Life history evolution and genome size in subtribe Oncidiinae (Orchidaceae). Annals of Botany 95: 191-199. [ Links ]
10 Chase, M. W.; N. H. Williams; A. D. de Faria; K. M. Neubig; M. C. E. Amaral & W. M. Whitten. 2009. Floral convergence in Oncidiinae (Cymbidieae; Orchidaceae): an expanded concept of Gomesa and a new genus Nohawilliamsia. Annals of Botany 104: 387-402. [ Links ]
11 van der Cingel, N. A. 2001. An atlas of orchid pollination: America, Africa, Asia, and Australia. Rotterdam: A. A. Balkema. [ Links ]
12 Clayton, S. & M. A. Aizen. 1996. Effects of pollinia removal and insertion on flower longevity in Chloraea alpina (Orchidaceae). Evolutionary Ecology 10: 653-660. [ Links ]
13 Darwin, C. 1862. The various contrivances by which orchid are fertilized. London: John Murray. [ Links ]
14 Davies, K. L. & M. Stpiczynska. 2008. The anatomical basis of floral, food-reward production in Orchidaceae, en J. Teixeira da Silva (ed.), Floriculture, ornamental and biotechnology: advances and topical issues, vol. V., pp. 392-407. Isleworth, Middlesex: Global Science Books. [ Links ]
15 Dressler, R. L. 1993. Phylogeny and classification of the orchid familiy. Oregon: Dioscorides Press. [ Links ]
16 Endress, P. K. 1998. Diversity and evolutionary biology of tropical flowers. Cambridge: Cambridge University Press. [ Links ]
17 Flach, A.; R. C. Dondon; R. B. Singer; S. Koehler; M. C. E. Amaral & A. J. Marsaioli. 2004. The chemistry of pollination in selected Brazilian Maxillariinae orchids: floral rewards and fragrance. Journal of Chemical Ecology 30: 1045-1056. [ Links ]
18 Jersáková, J.; S. D. Johnson & P. Kindlmann. 2006. Mechanisms and evolution of deceptive pollination in orchids. Biological Review 81: 219-235. [ Links ]
19 Neff, J. & B. B. Simpson. 1981. Oil-collecting structures in Anthophoridae (Hymenoptera): morphology, function, and use in systematics. Journal of the Kansas Entomological Society 54: 95-123. [ Links ]
20 Pacek, A. & M. Stpiczynska. 2007. The structure of elaiophores in Oncidium cheirophorum Rchb. f. and Ornithocephalus kruegeri Rchb. f. (Orchidaceae). Acta Agrobotanica 60: 9-14. [ Links ]
21 Pansarin E. M. & L. M. Pansarin. 2010. Reproductive biology of Trichocentrum pumilum: an orchid pollinated by oilcollecting bees. Plant Biology. doi:10.1111/j.1438-8677.2010.00420.x [ Links ]
22 Parra-Tabla, V; C. F. Vargas, S. Magaña-Rueda & J. Navarro. 2000. Female and male pollination success of Oncidium ascendens Lindey (Orchidaceae) in two contrasting habitat patches: forest vs agricultural field. Biological Conservation 94: 335-340. [ Links ]
23 Parra-Tabla, V., L. Abdala-Roberts, J. C. Rojas, J. Navarro & L. Salinas-Peba. 2009. Foral longevity and scent respond to pollen manipulation ad resource status in the tropical orchid Myrmecophila christinae. Plant Systematics and Evolution 282: 1-11. [ Links ]
24 Pemberton, R. W. 2010. Biotic resource needs of specialist orchid pollinators. Botanical Review 76: 275-292. [ Links ]
25 van der Pijl, L. & C. H. Dodson. 1966. Orchid flowers: their pollination and evolution. Florida: University of Miami Press. [ Links ]
26 Primack, R. B. 1985. Longevity of individual flowers. Annual Review of Ecology and Systematics 16: 15-37. [ Links ]
27 Proctor, M.; P. Yeo & A. Lack. 1996. The natural history of pollination. Oregon: Timber Press. [ Links ]
28 Rasmussen, C. & J. M. Olesen. 2000. Oil flowers and oilcollecting bees. Det Norske Videnskaps-Akademi. I. Matematisk Naturvidenskapelige Klasse, Ny Serie 39: 23-31. [ Links ]
29 Reis, M. G.; A. D. Faria, V. Bittrich, M. C. E. Amaral & A. J. Marsaioli. 2000. The chemistry of flower rewards - Oncidium (Orchidaceae). Journal of the Brazilian Chemical Society 11: 600-608. [ Links ]
30 Reis, M. G.; R. B. Singer; R. Goncalves & A. J. Marsaioli. 2006. The chemical composition of Phymatidium delicatulum and P. tillandsioides (Orchidaceae) floral oils. Natural Product Communications 1: 757-761. [ Links ]
31 Renner, S. S. & H. Schaefer. 2010. The evolution and loss of oil-offering flowers: New insights from dated phylogenies for angiosperms and bees. Philosophical Transactions of the Royal Society B 365: 423-435. [ Links ]
32 Rodríguez-Robles, J. A.; J. E. Meléndez & J. D. Ackermann. 1992. Effects of display size, flowering phenology and nectar availability on effectivity visitation frequency in Comparettia falcata (Orchidaceae). Amercian Journal of Botany 79: 1009-1017. [ Links ]
33 Roberts, D. L. 2003. Pollination biology: the role of sexual reproduction in orchid conservation, en K. M. Dixon (ed.), Orchid conservation, pp. 113-136. Kota Kinabalu, Sabah: Natural History Publications. [ Links ]
34 Roig Alsina, A. 2000. Clave para las especies argentinas de Centris (Hymenoptera, Apidae), con descripción de nuevas especies y notas sobre distribución. Revista del Museo Argentino de Ciencias Naturales n.s. 2:171-193. [ Links ]
35 Silvera, K. I. 2002. Adaptive radiation of oil-reward compounds among Neotropical orchid species (Oncidiinae). M. Sc diss., University of Florida. [ Links ]
36 Simpson, B. B.; J. L. Neff & D. Seigler. 1977. Krameria, free fatty acids and oil-collecting bees. Nature 267: 150-151. [ Links ]
37 Singer, R. B. & A. A. Cocucci. 1999. Pollination mechanisms in four sympatric southern Brazilian Epidendroideae orchids. Lindleyana 14: 47-56. [ Links ]
38 Singer, R. B., A. J. Marsaioli, A. Flach & M. G. Reis. 2006. The ecology and chemistry of pollination in Brazilian orchids: recent advances, en J. Teixeira da Silva (ed.), Floriculture, ornamental and plant biotechnology, vol. IV, pp. 569-582. Isleworth: Middlesex: Global Science Books. [ Links ]
39 Stpiczynska, M.; K. L. Davies & A. Gregg. 2007. Elaiophore diversity in three contrasting members of Oncidiinae (Orchidaceae). Botanical Journal of Linnean Society 155: 135-148. [ Links ]
40 Stpiczynska, M. & K. L. Davies. 2008. Elaiophore structure and oil secretion in flowers of Oncidium trulliferum Lindl. and Ornithophora radicans (Rchb.f.) Garay & Pabst (Oncidiinae: Orchidaceae). Annals of Botany 101: 375-384. [ Links ]
41 Tremblay, R. L. 1992. Trends in the pollination ecology of the Orchidaceae: evolution and systematics. Canadian Journal of Botany 70: 642-650. [ Links ]
42 Tremblay, R. L.; J. D. Ackerman; J. K. Zimmerman & R. N. Calvo. 2005. Variation in sexual reproduction in orchids and its evolutionary consequences: a spasmodic journey to diversification. Biological Journal of Linnean Society 84: 1-54. [ Links ]
43 Vogel, S. 1974. Ölblumen und ölsammelnde Bienen. Tropical und Subtropical Pflanzenwelt 7: 285-547. [ Links ]
44 Vogel, S. 1990. History of the Malpighiaceae in the light of pollination ecology. Memoirs of the New York Botanical Garden 55: 130-142. [ Links ]
45 Zar, J. H. 1996. Biostatistical analysis. New Jersey: Prentice Hall. [ Links ]














