Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Darwiniana, nueva serie
versión impresa ISSN 0011-6793
Darwiniana vol.50 no.1 San Isidro jun. 2012
NOTAS
Aloe maculata (Xanthorroeaceae), primer registro para la flora argentina
Marcelo D. Arana1, Antonia J. Oggero1, Cesar A. Bianco2, Gideon F. Smith3,4,5 & Estrela Figueiredo5,6
1 Orientación Plantas Vasculares, Departamento de Ciencias Naturales, Facultad Ciencias Exactas, FísicoQuími cas y Naturales, Universidad Nacional de Río Cuarto, Ruta 36 km 601, X5804ZAB Río Cuarto, Córdoba, Argenti na; marana@exa.unrc.edu.ar (autor corresponsal)
2 Botánica Agrícola, Facultad de Agronomía y Veterinaria, Universidad Nacional de Río Cuarto, Ruta 36 km 601, X5804ZAB Río Cuarto, Córdoba, Argentina.
3 Biosystematics Research and Biodiversity Collections, South African National Biodiversity Institute, Private Bag X101, Pretoria, 0001 South Africa.
4 Acocks Chair, Schweickerdt Herbarium, Department of Botany, University of Pretoria, Pretoria, 0002 South Africa.
5 Centre for Functional Ecology, Departamento de Ciências da Vida, Universidade de Coimbra, 3001455 Coimbra, Portugal.
6 Department of Botany, P.O. Box 77000, Nelson Mandela Metropolitan University, Port Elizabeth, 6031 South Africa.
Resumen
Aloe maculata, una monocotiledónea petaloidea originaria de Sudáfrica, se cita por primera vez como miembro de la flora espontánea de Argentina. Esta especie crece en diferentes ambientes de la provincia de Córdoba, Argentina. Los objetivos del trabajo son determinar su estatus de residencia y proponer caracteres diagnósticos novedosos para su identificación, junto con observaciones ecológicas. Se ilustra la especie y se provee un mapa de distribución.
Palabras clave. Aloe; Argentina; flora; Xanthorroeaceae.
Abstract.
Aloe maculata, a petaloid monocot native from South Africa, is recorded as a member of the spontaneous flora of Argentina. This species occurs in different habitats from Córdoba province, Argentina. The aim of this work is to determine its residential status and propose novel diagnostic characters to identify this species, together with ecological observations. The species is illustrated and a distribution map is provided.
Keywords. Aloe; Argentina; flora; Xanthorroeaceae.
INTRODUCCIÓN
Diversas monocotiledóneas petaloideas y de hojas suculentas han logrado naturalizarse, e inclusive se han vuelto invasoras, en regiones del mundo que poseen climas similares a los presentes en las áreas donde son nativas. Como ejemplo podemos citar a Agave sisalana Perrine ex Engelm., A. americana L. (Smith & Mössmer, 1996), Furcraea foetida (L.) Haw. (Crouch & Smith, 2011) y Aloe arborescens Mill. (Smith & Figueiredo, 2009). El género Aloe L. [Xanthorroeaceae, Asphodeloideae (The Angiosperm Phylogeny Group, 2009; Chase et al., 2009)], incluye plantas perennes suculentas, acaules, subarbustivas o arborescentes, simples o ramificadas, con hojas carnosas de margen en general armado con dientes deltoideos; inflorescencia lateral, simple o ramificada, con racimos cilíndricos o capitados, flores actinomorfas hermafroditas, con perigonio vistoso formado por seis tépalos fusionados en la base; seis estambres, ovario súpero tricarpelar; fruto generalmente tipo cápsula y semillas con alas membranosas estrechas. Varias especies poseen considerable valor medicinal, cosmético y ornamental (Judd et al., 2008), entre ellas A. vera (L.) Burm.f. y A. ferox Mill. son de particular importancia comercial ya que se cultivan por los exudados y el gel que pueden extraerse de sus hojas (Bloomfield, 1985; Gage, 1988; Smith & van Wyk, 1998).
El género Aloe consta de alrededor de 600 especies distribuidas en África y Asia, con aproximadamente 130 especies en Sudáfrica, el país con la mayor riqueza específica del género. Numerosas especies se encuentran naturalizadas en India, China (Smith & van Wyk, 1998; Grace et al., 2011), Estados Unidos (Holmes & White, 1993) y en la región Mediterránea europea, donde varias especies se han vuelto invasoras (Guillot Ortiz et al., 2008). En Argentina, la especie Aloe ciliaris Haw., ha sido citada previamente como adventicia para la región rioplatense cerca de la Ciudad Autónoma de Buenos Aires (Hurrell et al., 2009).
En la región central de Argentina, se han encontrado recientemente poblaciones de especies asilvestradas no citadas previamente, como por ejemplo Zanthoxylum armatum DC. (Rutaceae) (Arana & Oggero, 2009). La documentación de estos nuevos registros es importante, ya que la invasión por plantas alóctonas puede cambiar el funcionamiento a gran escala de los ecosistemas nativos y alterar la dinámica poblacional y estructura de la comunidad de las especies nativas (Vitousek, 1993). Como consecuencia de sus efectos potenciales, el estudio de las invasiones biológicas se ha convertido en un tema prioritario en ecología y biogeografía (Pyšek et al., 2004; Pyšek & Richardson, 2006) y ha generado una creciente preocupación en varios países incluido Argentina (Zalba & Villamil, 2002).
La región central de Argentina se ha visto fuertemente modificada por las actividades humanas, principalmente mediante las prácticas agropecuarias del último siglo, el avance de la red de urbanización, los incendios, la tala, el sobrepastoreo y la invasión de especies exóticas (Zak et al., 2004; Cingolani et al., 2008; Renison et al., 2010). Estas actividades han dado como resultado un aspecto uniforme en gran parte de la región, aunque aún se encuentran algunos relictos aislados que permiten reconocer parte de la flora nativa (Arana & Oggero, 2009). Según Giorgis et al. (2011), el 11 % de las especies relevadas en un sector de Bosque de las Sierras de Córdoba son exóticas, mayoritariamente de origen euroasiático. Este valor representa el doble del registrado para los pastizales de altura serranos del sur de Córdoba (Cantero et al., 2003). Así, la detección temprana de una invasión y la descripción de los factores más importantes asociados, son el primer paso en la investigación de las invasiones de plantas en sistemas montañosos (Dietz & Edwards 2006; Pauchard et al., 2009).
Observaciones preliminares en el campo por parte de los autores, sugieren evaluar el estatus de residencia de Aloe maculata All. como posible especie naturalizada. Adicionalmente se proponen caracteres diagnósticos novedosos para su identificación, junto con observaciones ecológicas, imágenes y un mapa de distribución.
MATERIALES Y MÉTODOS
Con el objeto de actualizar el conocimiento de la vegetación espontánea en el centro de Argentina (Córdoba, La Pampa y San Luis), se han realizado numerosas excursiones botánicas desde el año 1990 hasta el presente. Durante estas campañas se localizaron y geoposicionaron poblaciones de A. maculata. El material coleccionado durante este estudio se encuentra depositado en el herbario RCV (Departamento de Ciencias Naturales, Facultad de Ciencias Exactas, FísicoQuímicas y Naturales) en la Universidad Nacional de Río Cuarto. Se consultó la descripción original (Allioni, 1773) y se complementó con bibliografía específica (Reynolds, 1950; Guillot Ortiz et al., 2008).
Para considerar este taxón como naturalizado se siguió el criterio de Richardson et al. (2000), que define a una especie como naturalizada cuando logra mantener poblaciones sostenibles por varios ciclos de vida, reproduciéndose libremente, con individuos jóvenes cercanos a las plantas adultas y que no necesariamente invaden los ecosistemas naturales o seminaturales.
RESULTADOS
Aloe maculata All., Auct. Syn.: 13. 1773, non Forssk. 1775, non Thunb. 1785. TIPO: C. Commelijn, Horti medici Amstelodamensis rariorum 2: fig. 5, 1701 (lectotipo designado por Guglielmone et al., Bothalia 39: 178. 2009). Epitipo: Sudáfrica, Pietermaritzburg, alongside the road between Bishopstowe and Hayfields, 29°37'13.05" S, 30º 26'46.13"E, 18-VIII-2007, N. L. Crouch 1138 (NH!, designado por Guglielmone et al., Bothalia 39: 178. 2009).
Plantas acaules o con tallos cortos hasta de 30 cm con hojas en roseta basal densa, estrechas a anchamente lanceoladas, hasta de 30 x 8-12 cm, erectas, ascendentes a ligeramente recurvadas, con haz plano o ligeramente acanalado, de color verde, con numerosas manchas blancas oblongas, en bandas transversales irregulares, envés convexo, en general más claro que el haz, con igual patrón de manchas, margen sinuoso dentado, con dientes de color marrón, deltoideos, de 3-5 mm, espaciados aproximadamente 1 cm; inflorescencias racimosas de 40-100 cm, con hasta 30 flores nutantes, densamente capitado-corimbosas, con brácteas deltoideo-acuminadas, plurinervadas, 1/3-1/2 de la longitud del pedicelo, pedicelos inferiores de 35-45 mm; flores perfectas, perigonio tubuloso de 35-45 mm, con una constricción por encima del ovario, de color naranja vivo con los tépalos connados hasta casi el ápice; filamentos estaminales aplanados, los tres internos más estrechos, anteras parcialmente exsertas; ovario súpero tricarpelar, trilocular, pluriseminado; fruto cápsula de 3-4 cm, trígona; semillas aplanadas, de color marrón con ala estrecha en el borde.
Referencias. Véase Grace et al. (2011: 95) para una lista sinonímica de la especie.
Distribución y hábitat. Especie originaria del sur de África; se distribuye en Lesotho, Sudáfrica y Swazilandia, en zonas costeras y de clima continental (Guglielmone et al., 2009). Ha sido reportada como naturalizada en España (Guillot Ortiz et al., 2008), Australia (Forster & Clifford, 1986) y México (Espejo Serna & LópezFerrari, 1993). Las poblaciones halladas en Argentina se han encontrado en diversos ambientes de la provincia de Córdoba, en lugares casi inalterados (como relictos de bosque) o con diverso grado de perturbación antrópica (como bordes de caminos). Estas poblaciones crecen espontáneamente en el bosque serrano de la provincia biogeográfica del Chaco, y en relictos de bosque nativo y bordes de caminos de la provincia biogeográfica de La Pampa (sensu Morrone, 2001) entre los 380-800 m s.m. (Fig. 2). Visitas anuales a las localidades con poblaciones de A. maculata mostraron que la especie se encuentra en expansión tanto en número de individuos como en superficie, ya que se observó abundante reproducción vegetativa (Fig. 1c), asimismo se registró la presencia de nuevos individuos jóvenes en la cercanía de los individuos adultos. También se observó que los individuos forman poblaciones muy densas debido a la combinación de su forma de vida y reproducción vegetativa. Como resultado, en la zona serrana ocupan todo el espacio disponible en las grietas entre las rocas, lo que impide a otras especies establecerse. Esto podría afectar a las poblaciones de especies nativas que habitan casi exclusivamente en estos ambientes, como por ejemplo diversas especies del género Gymnocalycium Pfeiff. ex Mittler (Cactaceae), la mayoría endémicas de las sierras, y las dos especies del género Selaginella P. Beauv. (S. peruviana (Milde) Hieron. y S. sellowii Hieron.). Las poblaciones de A. maculata se disponen cercanas a los márgenes de los caminos y a la sombra de las plantas leñosas nativas, asociadas a otras especies nativas dominantes de los sitios de las localidades serranas como Acacia aroma Gillies ex Hook. & Arn., Acacia caven (Molina) Molina, Aloysia gratissima (Gillies & Hook. ex Hook.) Tronc. y Lepechinia floribunda (Benth.) Epling; también herbáceas nativas como Selaginella selowii Hieron. y exóticas como Agave americana L. y Melinis repens (Willd.) Zizka; y en la provincia biogeográfica de la Pampa también se asocia con la especie dominante Prosopis alba Griseb.
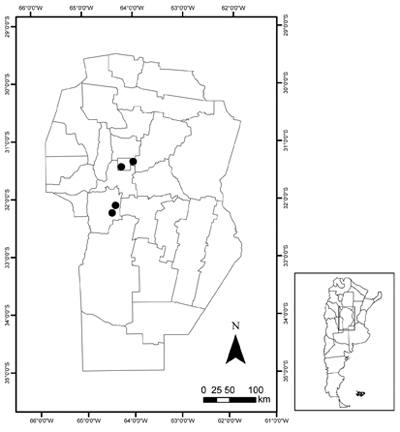
Fig. 2. Distribución de las poblaciones de Aloe maculataen la provincia de Córdoba.

Fig. 1. Aloe maculata. A, hábitat. B, aspecto general de una población. C, inflorescencia. D, plantas con reproducción vegetativa.
Observaciones. En las poblaciones de A. maculata del centro de Argentina, se observó que los individuos florecen desde septiembre a noviembre, fructifican en enero y febrero y producen numerosas semillas que son dispersadas por el viento, como ocurre en Asphodeloideae (Smith et al., 1992; Smith & van Wyk, 1998).
Hurrel et al. (2009) cita otra especie del género Aloe naturalizada en Argentina: A. ciliaris, que se puede diferenciar de A. maculata por sus tallos delgados de más de 50 cm y ramificados y las hojas sin manchas (vs. plantas acaules o con tallos muy cortos, no ramificados y hojas con manchas blancas en ambas superficies).
Material representativo examinado
ARGENTINA. Córdoba. Depto. Calamuchita, Embalse, proximidades de la terminal, 32°11'68'' S 64° 24'16'' O, 2IV2011, Oggero & Arana s.n. (5320 RCV); Segunda Usina, 32°10'11'' S 64° 22'87'' O, 2IV2011, Arana &. Oggero s.n (5307 RCV). Depto. Capital, proximidades Dique San Roque, 31°22'83'' S 64° 46'54'' O, 11-X-2009, Arana 874 (RCV). Depto. Colón, próximo a ciudad de Monte Cristo, 31°49'96'' S 64° 14'76'' O, 10-IV-2011, Oggero s.n. (5304 RCV).
AGRADECIMIENTOS
A Sandra S. Aliscioni y Fernando Biganzoli (Universidad de Buenos Aires) por sus valiosas sugerencias en la preparación del manuscrito.
BIBLIOGRAFÍA
1. Allioni, C. 1773. Auctarium ad synopsim methodicam stirpium horti regii taurinensis. Melanges de Philosaphie et de Mathematique de la Societe Royale de Turin pour les annees 1770-1773, vol. V, pp. 53-96. Turín: Italia. [ Links ]
2. Arana, M. D. & A. Oggero. 2009. Zanthoxylum armatum (Rutaceae), su presencia en Argentina. Darwiniana 47: 335-338. [ Links ]
3. Bloomfield, F. 1985. Miracle plants. Aloe vera. London: Century Publishing. [ Links ]
4. Cantero, J. J.; J. Liira, J. M. Cisneros, J. González, C. Núñez, L. Petryna, C. Cholaky & M. Zobel. 2003. Species richness, alien species and plant traits in Central Argentine mountain grasslands. Journal of Vegetation Science 14: 129-136. [ Links ]
5. Chase, M. W.; J. L. Reveal & M. F. Fay. 2009. A subfamilial classification for the expanded asparagalean families Amaryllidaceae, Asparagaceae and Xanthorrhoeaceae. Botanical Journal of the Linnean Society 161: 132-136. [ Links ]
6. Cingolani, A. M.; D. Renison, P. A. Tecco, D. E. Gurvich & M. Cabido. 2008. Predicting cover types in a mountain range with long evolutionary grazing history: a GIS approach. Journal of Biogeography 35: 538-551. [ Links ]
7. Crouch, N. R. & G. F. Smith. 2011. Agavaceae. Furcraea foetida: an invading alien in KwaZuluNatal, South Africa. Bothalia 41: 196-199. [ Links ]
8. Dietz, H. & P. J. Edwards. 2006. Recognition that causal processes change during plant invasion helps explain conflicts in evidence. Ecology 87: 1359-1367. [ Links ]
9. Espejo Serna, A. & A. R. LópezFerrari. 1993. Las monocotiledóneas mexicanas. Una sinopsis florística. 1. Lista de referencia. Parte II. Anthericaceae, Araceae, Arecaceae, Asparagaceae, Asphodelaceae, y Asteliaceae. México DF: Consejo Nacional de la Flora de México, A. C. & Universidad Autónoma Metropolitana-Iztapalapa. [ Links ]
10. Forster, P. I. & H. T. Clifford. 1986. Aloe, en: A. S. George (ed.), Flora of Australia. Iridaceae to Dioscoreaceae, vol. 46, pp. 6770. Canberra: Australian Government Publishing Service. [ Links ]
11. Gage, D. 1988. Aloe vera. Nature's soothing healer. Rochester: Healing Arts Press. [ Links ]
12. Giorgis, M. A.; A. M. Cingolani, F. Chiarini, J. Chiapella, G. Barboza, L. Ariza Espinar, R. Morero, D. E. Gurvich, P. A. Tecco, R. Subils & M. Cabido. 2011. Composición florística del Bosque Chaqueño Serrano en la provincia de Córdoba, Argentina. Kurtziana 36: 9-43. [ Links ]
13. Grace, O. M.; R. R. Klopper, E. Figueiredo & G. F. Smith. 2011. The Aloe names book. Kew: The South African National Biodiversity Institute and the Royal Botanic Gardens. [ Links ]
14. Guglielmone, L.; L. Gallo, M. Meregalli, G. F. Smith & E. Figueiredo. 2009. Allioni's Aloe names (Asphodelaceae): nomenclature and typification. Bothalia 39: 177-183. [ Links ]
15. Guillot Ortiz, D.; E. Laguna Lumbreras & J. A. Rosselló Picornell. 2008. La familia Aloaceae en la flora alóctona valenciana. Bouteloua 6: 1-58. [ Links ]
16. Holmes, W. C. & H. L. White. 1993. Aloaceae Batsch. Flora of North America vol. 26, pp. 410-412. New York: Oxford University Press. [ Links ]
17. Hurrel, J. A.; G. Delucchi & F. Buet Constantino. 2009. Nuevas citas de monocotiledóneas adventicias para la Argentina. Revista del Museo Argentino de Ciencias Naturales (nueva serie) 11: 131-144. [ Links ]
18. Judd, W. S.; C. S. Campbell, E. A. Kellogg, P. F. Stevens & M. J. Donoghue. 2008. Plant Systematics: a phylogenetic approach, 3rd. edition. Sunderland: Sinauer Associates. [ Links ]
19. Morrone, J. J. 2001. Biogeografía de América Latina y el Caribe. Zaragoza: Manuales & Tesis SEA. [ Links ]
20. Pauchard, A. & P. B. Alaback. 2004. Influence of elevation, land use and landscape context on patterns of alien plant invasions along roadsides in protected areas of SouthCentral Chile. Conservation Biology 18: 238-248. [ Links ]
21. Pyšek, P.; D. M. Richardson, M. Rejmanek, G. L. Webster, M. Williamson & J. Kirschner. 2004. Alien plants in checklists and floras: towards better communication between taxonomists and ecologists. Taxon 53: 131-143.
22. Pyšek, P. & D. M. Richardson. 2006. The biogeography of naturalization in alien plants. Journal of Biogeography 33: 2040-2050.
23. Renison, D.; I. Hensen, A. M. Cingolani, P. Marcora & M. A. Giorgis. 2010. Soil conservation in Polylepis mountain forests of Central Argentina: Is livestock reducing our natural capital? Austral Ecology 35: 435-443. [ Links ]
24. Reynolds, G. W. 1950. The aloes of South Africa. Johannesburg: The aloes of South Africa book fund. [ Links ]
25. Richardson D. M.; P. Pyšek, M. Rejmánek, M. G. Barbour, D. F. Panetta & C. J. West. 2000. Naturalization and invasion of alien plants: concepts and definitions. Diversity and Distribution 6: 93-107.
26. Smith, G. F. & B. E. van Wyk. 1998. Asphodelaceae, en K. Kubitzki (ed.), The families and genera of vascular plants, vol 3, Monocotyledons: Lilianae (except Orchidaceae), pp. 130-140. Berlin: Springer. [ Links ]
27. Smith, G. F.; P. D. Theron & G. C. Loots. 1992. Notes on the microfaunal complement and pollination mechanisms of Poellnitzia rubriflora (Asphodelaceae: Alooideae): an example of miteflower domatia association. Taxon 41: 437-450. [ Links ]
28. Smith, G. F. & M. Mössmer. 1996. FSA contributions: 4. Agavaceae. Bothalia 26: 31-35. [ Links ]
29. Smith, G. F. & E. Figueiredo. 2009. Aloe arborescens Mill. (Asphodelaceae) is spreading in Portugal. Bradleya 27: 165-167. [ Links ]
30. The Angiosperm Phylogeny Group. 2009. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society 161: 105-121. [ Links ]
31. Vitousek, P. M. 1993. Effects of alien plants on native ecosystems, en C. P. Stone, C. W. Smith & J. T. Tunison (eds.), Alien plant invasions in native ecosystems of Hawaii: management and research, pp. 29-41. Honolulu: University of Hawaii. [ Links ]
32. Zak, M. R.; M. Cabido & J. G. Hodgson. 2004. Do subtropical seasonal forests in the Gran Chaco, Argentina, have a future? Biological Conservation 120: 589-598. [ Links ]
33. Zalva, S. M. & C. B. Villamil. 2002. Woody plant invasion in relictual grasslands. Biological invasions 4: 55-72. [ Links ]














