Introducción
La ecología, como disciplina científica, intenta comprender las causas de la distribución y abundancia de los millones de especies de organismos que viven en el mundo (Begon et al., 2006). Durante más de un siglo los ecólogos han abordado este colosal problema estudiando directamente cómo las especies se distribuyen con relación a variables ambientales, tanto abióticas como bióticas (Clements, 1905; Gleason, 1917; Curtis, 1959; Whittaker, 1970; Mueller-Dombois & Ellenberg, 1974; Pickett & White, 1985; Van der Maarel & Franklin, 2012). Esta aproximación especie-específica ha sido muy valiosa para explicar o entender patrones de composición y diversidad de especies. Sin embargo, ha encontrado grandes problemas a la hora de predecir las posibles respuestas de especies y comunidades frente a cambios en el ambiente (Peters, 1991), un tema cada vez más importante dados los rápidos cambios ambientales que enfrentamos (Maris et al., 2018). En el marco especie-específico, tales predicciones requieren de información sobre el signo e intensidad de las interacciones entre pares de especies (e incluso entre grupos de mayor orden) en la infinidad de distintas condiciones ambientales posibles (combinaciones de temperatura, humedad, pH, etc.) (Levine & Hart, 2020). Esto es prácticamente imposible, lo que ha generado grandes frustraciones y categóricas críticas hacia la ecología (por ejemplo, Lawton, 1999). Una alternativa promisoria, la cual motiva este artículo, consiste en caracterizar a las especies no solamente con información taxonómica sino también utilizando los rasgos fenotípicos “funcionales” de los individuos que las componen (Keddy, 1992; Lavorel & Garnier, 2002; McGill et al., 2006; Violle et al., 2007; Shipley et al., 2016). Brevemente, la promesa radica en que son precisamente estos rasgos funcionales los que determinan el éxito ecológico de las especies y el “ensamblaje” de las comunidades a lo largo de gradientes ambientales.
Desde sus inicios a finales del siglo pasado, la ecología basada en rasgos o caracteres (“trait-based ecology”) ha captado la atención de muchos ecólogos en todo el mundo (Funk et al., 2017). Una búsqueda rápida en la bibliografía a nivel mundial muestra que la publicación de trabajos que nombran el término “plant trait” ha crecido mucho más rápido respecto de otros términos relacionados, como “plant interaction” o “plant species” (Fig. 1A). Sin embargo, tal incremento diferencial no parece haber ocurrido en Argentina (Fig. 1B). El principal propósito de este trabajo es entonces fomentar entre lectores locales e hispanoparlantes a los rasgos funcionales como una herramienta útil para el estudio de comunidades ecológicas. En particular, me interesa discutir cómo funcionan estos llamados “rasgos funcionales” (o, simplemente, rasgos fenotípicos). Creo que esta discusión puede ser útil por dos motivos. Primero, entender mejor a las herramientas disponibles nos permite darles un mayor y mejor uso. Segundo, veremos que aún resta mucho por entender respecto de la funcionalidad de los rasgos fenotípicos, lo cual abre vías importantes de investigación.
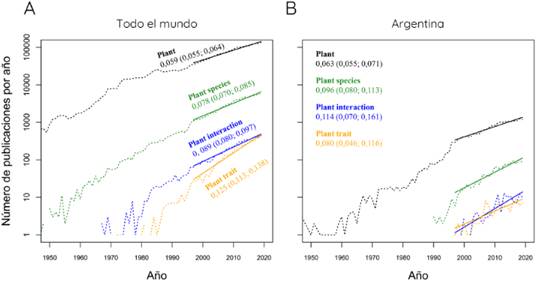
Fig. 1 Cantidad de publicaciones por año en todo el mundo (A) o por investigadores con afiliación en Argentina (B) que incluyen los términos “plant trait”, “plant interaction”, “plant species” o “plant” en el título, el resumen, o las palabras clave en la base de datos Scopus (líneas punteadas). Los resultados del término “plant” pueden servir como guía o patrón nulo del incremento de publicaciones científicas en general. Las rectas fueron ajustadas mediante modelos lineales generalizados (quasipoisson, especial para datos de conteos con sobre-dispersión) para el periodo que comienza en 1997, año de la primera publicación sobre “plant trait” en Argentina (Díaz & Cabido, 1997). Los números debajo de cada término son la pendiente estimada y el intervalo de confianza del 99%, entre paréntesis. A nivel mundial, el intervalo de confianza de la pendiente de “plant trait” no se superpone con el de los otros términos, lo que indica que el incremento temporal fue claramente mayor para “plant trait”. El intervalo de confianza de “plant trait” también se superpone muy poco con su homólogo de la Argentina, indicando que la tasa de incremento de trabajos con este término es significativamente mayor en el mundo que en la Argentina. Por el contrario, utilizando el mismo criterio, vemos que la pendiente para “plant species” es mayor en Argentina que en el mundo; al contrario del caso de “plant interaction”, donde el intervalo de confianza de la Argentina incluye a la pendiente estimada para el mundo. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1000/1245
Marco general
Definiciones
En un trabajo importante para la ecología basada en rasgos, Violle et al. (2007) definen a los “rasgo funcionales” como las características morfológicas, fisiológicas o fenológicas medibles en los individuos que afectan el éxito ecológico o “fitness” individual a través de su efecto sobre la “performance” (en adelante utilizaré el termino en inglés, fitness, por simplicidad). Esta definición está basada en el clásico modelo “morfología-performance-fitness” propuesto por Arnold (1983) para estudiar la selección natural de caracteres en poblaciones. En general, la definición de Violle et al. (2007) coincide con otras definiciones en la conexión causal entre características medibles de los individuos y el fitness (por ejemplo, Ackerly et al., 2000; Geber & Griffen, 2003; McGill et al., 2006). Sin embargo, no parece haber consenso respecto de qué es la “performance”, esto es, las variables que conectan a las puntas de esta cadena causal, lo cual es clave para el avance de este paradigma. Por un lado, están quienes ponen el foco en las tasas vitales, típicamente el crecimiento, la supervivencia y la fecundidad (Ackerly et al., 2000; Geber & Griffen, 2003; Violle et al., 2007), a veces llamadas tasas demográficas o componentes del fitness (Laughlin et al., 2020). Otros enfatizan los procesos de captación y partición de recursos, como la asimilación de CO2 por unidad de masa foliar (McGill et al., 2006).
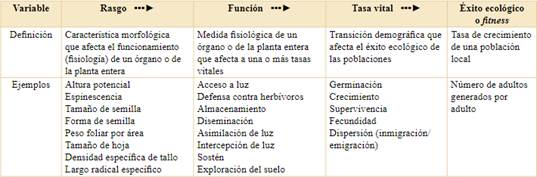
Tabla 1 Definiciones y marco conceptual general presentados en este trabajo. El éxito ecológico o fitness de una especie en un lugar y momento depende de sus tasas vitales, las cuales a su vez dependen de la medida en que las funciones desempeñadas por las características o rasgos se ajustan a las condiciones ambientales locales.
Para aclarar el panorama en términos de definiciones, propongo volver a las raíces y, siguiendo el mensaje principal de Arnold (1983), iniciar la cadena causal en variables morfológicas, a las que llamaré rasgos. En mi esquema (Tabla 1), los rasgos (por ejemplo, tamaño de hoja o de semilla) afectan funciones específicas, como la intercepción de luz o la acumulación de reservas. Lo que llamo “función” se puede asemejar a los rasgos fisiológicos y fenológicos de Violle et al. (2007), a las medidas de performance de McGill et al. (2006) y a lo que algunos han llamado rasgos “difíciles” (hard traits) dada la relativa dificultad que implica medirlos (Hodgson et al., 1999; Weiher et al., 1999). Mi intención aquí es enfatizar la relación mecanística entre estructura y función que ha sido fundamental en el desarrollo de la botánica, la ecología y otras ciencias. Las funciones desempeñadas a distintas escalas dentro del individuo (de las células a la planta entera) se integran para determinar tasas vitales (germinación, crecimiento, supervivencia, fecundidad) que a su vez se integran para determinar el fitness en un ambiente dado (Tabla 1). Entendemos al fitness como la tasa de crecimiento de una población (de una especie en un lugar), es decir, cuántos adultos nuevos genera un adulto de esa población en promedio (Fisher, 1958; Charlesworth, 1994). Asumo que los individuos dentro de esa población son genética y fenotípicamente similares, lo que nos permite concentrarnos en las diferencias entre especies (Laughlin et al., 2020). Si bien el crecimiento es una tasa vital frecuentemente citada como un componente del fitness (Violle et al., 2007; Laughlin et al., 2020), su efecto sobre el fitness es indirecto mediado, principalmente, por la fecundidad (claramente, individuos más grandes, per se, no hacen a una población más grande). Estrictamente, el fitness depende directamente de la supervivencia y la fecundidad, las cuales, para simplificar, pueden multiplicarse para obtener una estimación de fitness (Ehrlich & Roughgarden, 1987).
En resumen, con el objetivo de poner el foco en la relación entre estructura y función de las plantas, defino a los rasgos funcionales como características morfológicas de los individuos o sus partes que afectan al fitness de las poblaciones de especies a través de su efecto encadenado sobre el funcionamiento de los individuos o sus partes y las tasas vitales. Si bien esta definición de rasgo deja afuera a las medidas fisiológicas y fenológicas (incluidas en la definición de Violle et al., 2007), es consistente con el marco conceptual “hoja-altura-semilla” propuesto por Westoby (1998), una de las piedras fundamentales de la ecología basada en rasgos.
Relaciones funcionales
Actualmente existe un amplio consenso de que los rasgos funcionales deben tener alguna relación con el fitness (Ackerly et al., 2000; Geber & Griffen, 2003; McGill et al., 2006; Violle et al., 2007; Laughlin & Messier, 2015; Shipley et al., 2016). Es decir que “funcionan” en la medida que afecten la dinámica de las poblaciones. Sin embargo, lo que no está del todo claro es qué formas pueden adoptar las relaciones funcionales entre rasgos y fitness. Los manuales para mediciones estandarizadas (ver en Pérez-Harguindeguy et al., 2013 la versión más reciente) interpretan a los rasgos funcionales como “indicadores” de las funciones de las plantas, es decir, si están correlacionados positiva o negativamente con algún componente del fitnes. Dado que estos manuales son resúmenes muy completos de la importancia ecológica de los rasgos, lo anterior puede sugerir que hay un supuesto implícito de “funcionalidad rectilínea” generalizado en la literatura. Sin embargo, hay buenas razones para pensar que las relaciones entre rasgos y fitness sean preponderantemente no lineales (Rolhauser & Pucheta, 2017; Rolhauser et al., 2019).
Por un lado, los biólogos evolutivos han reconocido desde hace ya varias décadas que la selección natural puede actuar de tres formas o “modos” diferentes sobre un rasgo fenotípico (Lande & Arnold, 1983; Endler, 1986; Kingsolver et al., 2012). Uno de estos modos es la selección direccional, una relación lineal donde son favorecidos los individuos con valores en un extremo del rango del rasgo. Pero además están la selección estabilizadora y la disruptiva donde, respectivamente, son favorecidos los individuos con valores intermedios del rasgo (una relación de unimodal o de óptimo) o aquellos con valores extremos del rasgo (una relación bimodal, en forma de u). La selección estabilizadora (junto con la direccional) es entendida como una fuerza particularmente importante en la evolución de distintos organismos (Estes & Arnold, 2007). Si aceptamos que la selección natural ocurre a nivel de individuo, podríamos entonces pensar que estos mismos modos de selección deberían ser evidentes a nivel de comunidad, donde los individuos pertenecen a distintas especies (Shipley, 2010; Vellend, 2016; Rolhauser & Pucheta, 2017; Loranger et al., 2018; Rolhauser et al., 2019). Por otro lado, las discusiones referidas a la convergencia o divergencia funcional de comunidades en respuesta a la variación ambiental (por ejemplo, Grime, 2006) también han enfatizado, aunque implícitamente, las relaciones no lineales (estabilizadora o de óptimo vs. disruptiva o divergente). Parece ser que las relaciones entre rasgos y fitness no lineales, especialmente de óptimo, podrían ser más comunes de lo que se ha pensado.
La idea de valores fenotípicos óptimos que resultan de la adaptación a condiciones locales está muy asociada al estudio de las variaciones fenotípicas a lo largo de gradientes ambientales (Westoby et al., 2002; Grime, 2006; Muscarella & Uriarte, 2016). Si las condiciones cambian, por ejemplo, porque nos movemos de un lugar a otro, deberíamos ver una vegetación con valores de rasgos distintos respecto del primer lugar. El resultado son las llamadas relaciones rasgo- ambiente, trait-environment relationships en inglés (ver revisiones en Garnier et al., 2016; Funk et al., 2017). Dos ejemplos claros son los aumentos en la altura de las plantas a medida que aumentan las precipitaciones o la temperatura (Moles et al., 2009; Moles et al., 2014).
Preguntas generales
Para llevar adelante la discusión que sigue pretendo expresar explícitamente las relaciones funcionales entre rasgos y fitness (o relaciones rasgo- fitness), lo cual constituye la base indispensable para la predicción de las respuestas de especies y comunidades frente a cambios en el ambiente (McGill et al., 2006; Laughlin & Messier, 2015). Mi intención es discutir dos preguntas generales ¿Cómo tendrían que ser las relaciones entre rasgos y tasas vitales (relaciones rasgo- tasa vital) en un sitio determinado para dar lugar a relaciones rasgo-fitness de óptimo, frecuentemente asumidas en la literatura? ¿Cómo tendrían que cambiar estas relaciones rasgo-tasa vital con las condiciones ambientales para reproducir las relaciones rasgo-ambiente observadas en la literatura? Para tal fin utilizo dos tipos de herramientas gráficas. Las primeras son los diagramas de influencias (o de rutas; path diagrams) que muestran las conexiones positivas o negativas, directas o indirectas, entre rasgos y fitness. Estos diagramas han sido fundamentales para entender los mecanismos de selección de rasgos fenotípicos dentro de poblaciones (Arnold, 1983; Kingsolver & Schemske, 1991; Kingsolver & Huey, 2003). Las otras herramientas son gráficos de coordenadas cartesianas que muestran relaciones rasgo-tasa vital que, al combinarse, dan lugar a relaciones rasgo-fitness de óptimo. Si bien el análisis de relaciones rasgo-tasa vital y rasgo-fitness ya tiene una larga tradición en la biología evolutiva (Kingsolver et al., 2012), la agenda homóloga en la ecología de comunidades de plantas (i.e. analizando varias especies en conjunto) ha comenzado a tomar forma en la última década (ver revisión en Laughlin et al., 2020). El presente trabajo parece apropiado en este momento gestacional para ayudar a generar hipótesis y predicciones que guíen la investigación sobre la funcionalidad de los rasgos funcionales.
Cuatro dimensiones principales de variación entre especies vegetales
Utilizaremos el marco conceptual detallado arriba para discutir el significado ecológico (y adaptativo) de cuatro rasgos que han sido muy estudiados hasta el momento. Estos rasgos son la altura máxima que pueden alcanzar los individuos, el peso (seco) de las semillas, el peso (seco) por unidad de superficie de las hojas y el tamaño (área) de las hojas. Mark Westoby usó a los tres primeros para diagramar su clásico esquema de estrategias ecológicas denominado “hoja-altura-semilla” (Westoby, 1998). El tamaño de hoja fue incluido al poco tiempo como una cuarta dimensión importante de variación ecológica (Westoby et al., 2002). El objetivo principal de este esquema es caracterizar las estrategias ecológicas de las especies con base en características medibles de los individuos (rasgos) de modo tal de facilitar la comparación entre especies y comunidades. Ésta es una perspectiva superadora desde el punto de vista práctico respecto de otros esquemas de estrategias, como el triángulo de Phillip Grime, donde las especies serían ordenadas a lo largo de gradientes entre tres estrategias extremas: competitiva, estrés tolerante y ruderal (Grime, 1977). Para utilizar este esquema triangular, sería necesario conocer la habilidad competitiva, la tolerancia al estrés y las respuestas a los disturbios de las especies objetivo, lo cual requiere manipular vecinos, recursos y disturbios. En cambio, el esquema hoja-altura-semilla permite que cualquier especie de planta vascular terrestre sea colocada dentro del esquema, sin la necesidad de medir las respuestas de los individuos a la manipulación de su ambiente (Westoby, 1998).
Altura máxima o potencial
Entendemos a la altura de una planta como la distancia más corta entre el límite superior de los principales tejidos fotosintéticos (excluidas las inflorescencias) y el nivel del suelo (Pérez-Harguindeguy et al., 2013). La altura máxima o potencial (AP), es la estatura máxima que alcanzan los adultos de una especie. Cuanto mayor es la altura de las plantas, mayor es su capacidad de interceptar luz cuando se encuentran rodeadas de otras plantas vecinas. Sin embargo, mantener plantas altas es energéticamente costoso: se está invirtiendo recursos (carbohidratos, principalmente) en órganos de sostén que no son fotosintéticos y por lo tanto generan gastos sin generar ingresos inmediatos (Westoby et al., 2002).
La altura potencial afecta positivamente al fitness a través de su efecto positivo sobre la robustez y la supervivencia (línea azul discontinua en Fig. 2A). No es que la altura esté mecanísticamente involucrada en la robustez, más bien es lo contrario, pero basándonos en esta relación (siguiendo a Westoby et al., 2002) asumimos que la altura potencial es indicativa de la estrategia de las especies en términos de inversión en robustez. En realidad, lo que afecta directamente a la robustez es la calidad de los tejidos, por ejemplo, cuando contienen lignina, que es un compuesto durable pero energéticamente costoso. Esta inversión en sostén limita el crecimiento (línea naranja continua en Fig. 2A): las especies potencialmente más bajas, que invierten menos en sostén durable, pueden crecer más rápido en altura (Falster & Westoby, 2003). Entonces, luego de un disturbio que elimina parcial o totalmente la biomasa vegetal, las especies potencialmente bajas llegan antes a alcanzar la luz en la parte superior del dosel. Pero no llegan muy alto, precisamente porque sus tejidos de sostén no son muy robustos. Tampoco disfrutan de la ventaja lumínica por mucho tiempo, sólo hasta que otras especies que invirtieron más en sostén las sobrepasen. Estas últimas venían creciendo más lento, pero a paso firme; tardaron más en llegar al tope del dosel, pero es probable que estén allí por más tiempo dada su mayor robustez.
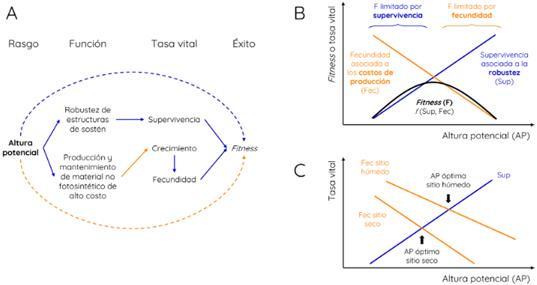
Fig. 2 Funcionalidad de la altura potencial (AP). A, diagrama de influencias que conecta la altura potencial con el funcionamiento de las plantas (robustez vs. costos), con las tasas vitales (supervivencia, crecimiento, fecundidad) y con el éxito global, el fitness. Las flechas azules indican influencias positivas y las naranjas, negativas. Las flechas continuas son influencias directas y las discontinuas, indirectas. B, relación funcional entre altura potencial y fitness en una condición ambiental particular, por ejemplo, un sitio húmedo. El fitness (F, línea negra) es una función de la supervivencia (Sup, línea azul, por su respuesta positiva) y la fecundidad (Fec, línea naranja, por su respuesta negativa). C, la altura potencial óptima se desplaza hacia valores menores cuando pasamos de un sitio húmedo a uno seco. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1000/1245
El resultado de estos mecanismos es un compromiso entre velocidad de crecimiento y robustez de la arquitectura de las plantas. Ambas fuerzas se balancean dando lugar a una altura potencial óptima para una condición ambiental determinada, como puede ser un sitio húmedo o lluvioso (línea negra, Fig. 2B). En ese sitio, las especies relativamente bajas están limitadas por la supervivencia; son demasiado frágiles como para sostener la competencia por luz con especies más altas por el tiempo necesario. Sin embargo, las especies relativamente altas incurren en gastos innecesarios en sostén que podrían estar invirtiendo en producir más hojas y, en última instancia, en más semillas (fecundidad).
Matemáticamente, la relación AP-fitness de óptimo emerge debido a la combinación de dos supuestos que he decidido hacer: (i) la supervivencia y la fecundidad responden linealmente a la altura potencial y (ii) ambos componentes se multiplican para dar el fitness. La multiplicación de dos rectas (en este caso, Fecundidad = a + bAP y Supervivencia = c + dAP) produce una función cuadrática, Fitness = ac + adAP + bcAP + bdAP2. Como b (el efecto de la altura sobre la fecundidad) es negativo y d (el efecto de la altura sobre la supervivencia) es positivo, el término cuadrático bd resulta ser negativo determinando una relación convexa o de óptimo. El compromiso entre fecundidad y supervivencia (reflejado en los parámetros b y d de distinto signo) determina que el fitness se maximice para una altura potencial intermedia que hace que ninguna de las dos tasas vitales sea demasiado baja.
Moviéndonos hacia un sitio más seco, deberíamos encontrar distintas relaciones entre altura potencial y los componentes del fitness. Para simplificar, podemos pensar que este cambio afecta cuantitativamente más a la fecundidad que a la supervivencia; los individuos de una especie con determinada altura potencial podrían sobrevivir en un sitio con menos disponibilidad de agua, pero seguramente van a crecer menos y producir menos semillas. Por esta razón, la Fig. 2C muestra una línea asociada a la supervivencia y dos líneas asociadas a la fecundidad, una para cada sitio. Vemos entonces que la fecundidad es generalmente menor en el sitio seco, lo que desplaza la línea correspondiente hacia abajo (Fig. 2C). Como consecuencia, la altura óptima (donde se cruzan la curva de fecundidad y la de supervivencia) es menor. También es menor el fitness máximo que puede alcanzarse, dado que las condiciones ambientales son más restrictivas. Este razonamiento puede explicar los patrones reportados en la literatura, donde la altura potencial de las especies aumenta con las precipitaciones, entre otros factores (Moles et al., 2009). Aplicaré este mismo razonamiento para analizar la funcionalidad de los otros tres rasgos funcionales.
Peso de semilla
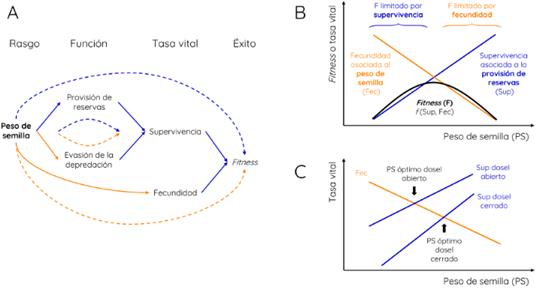
El peso o masa de semilla, usualmente utilizado como indicador de tamaño, se refiere al peso seco de una semilla promedio de una especie (Pérez-Harguindeguy et al., 2013). Las semillas grandes suelen almacenar muchos recursos, lo que puede ayudar a las plántulas a sobrevivir condiciones adversas como la sequía, la sombra o la defoliación (Fig. 3A). Sin embargo, a igualdad de recursos destinados a la reproducción, las semillas pequeñas pueden ser producidas en mayor cantidad (Fig. 3A). Por lo tanto, el peso de semilla reflejaría un compromiso entre la probabilidad de arribo a parches “vacíos” (que aumenta con la cantidad de semillas dispersadas) y la probabilidad de establecimiento exitoso frente a determinados peligros (que aumenta con el peso de semilla) (Venable, 1992; Westoby et al., 2002).
Este compromiso entre arribo y establecimiento se manifiesta a nivel de fitness mediante los efectos opuestos sobre la fecundad y la supervivencia (Fig. 3A). El peso de semilla afecta negativamente a la fecundidad y positivamente a la supervivencia y, como resultado, el fitness muestra una respuesta de óptimo al peso de semilla (Fig. 3B). Las especies con semillas chicas generan plántulas demasiado débiles y con poca supervivencia, mientras que aquellas con semillas grandes están limitadas por una baja ocupación de espacios debido a la baja fecundidad.
El caso anterior podría ser el de un sitio relativamente sombrío, como el sotobosque de una selva, donde las especies con semillas relativamente grandes suelen ser favorecidas (Fig. 3C; Westoby et al., 2002). En cambio, en un sitio con el dosel más abierto y el sotobosque menos sombrío, como en una sabana, las plántulas reciben más luz y por lo tanto no obtienen tanto beneficio de sus reservas. En estas condiciones no hay restricciones para que el óptimo se desplace hacia semillas más pequeñas, las que permiten una mayor fecundidad (Fig. 3C). Aquí he asumido que el cambio en la cantidad de luz disponible para las plántulas afecta la supervivencia (de las plántulas) y no la fecundidad (de los adultos); por esta razón la Fig. 3C muestra una línea asociada a la fecundidad y dos líneas asociadas a la supervivencia, una para cada sitio. La ausencia de efecto sobre la fecundidad puede ocurrir en el caso de árboles dominantes; los adultos en ambas situaciones (dosel cerrado o abierto) alcanzan el tope del dosel y están expuestos al máximo de radiación incidente, a diferencia de las plántulas.
Notemos que el compromiso discutido más arriba no es el único en el que el peso de semilla está involucrado. El peso de semilla también está relacionado negativamente con la evasión de la depredación, la cual a su vez afecta positivamente a la supervivencia (Fig. 3A). Las semillas pequeñas entrarían en el suelo más fácilmente y serían por lo tanto menos propensas a ser depredadas que las semillas grandes (Thompson et al., 1993). Vemos entonces que este compromiso se manifiesta a nivel de la supervivencia, una tasa vital, a diferencia del compromiso anterior, que se observaba a nivel de fitness (Fig. 3A). El compromiso a nivel de fitness, basado en una relación positiva entre peso de semilla y supervivencia, sólo estará operando en caso de que la depredación de semillas no sea muy intensa. Cuando la depredación es intensa, el peso de semilla afectaría negativamente a la supervivencia y la fecundidad, determinando una relación negativa, y no de óptimo, con el fitness (como en los casos discutidos en Pearson et al., 2018).
Peso foliar por área
El peso foliar por área (PFA, leaf mass per area en inglés) es el cociente entre el peso seco y el área en estado fresco de una hoja y es la inversa del área foliar específica (Pérez-Harguindeguy et al., 2013). El peso foliar por área es una medida de la inversión energética por unidad de área fotosintética por lo que, a igualdad de otras condiciones, está negativamente relacionado con la tasa de crecimiento de las plantas (Fig. 4A; Poorter et al., 2009). Sin embargo, las hojas con alto peso foliar por área suelen presentar estructuras que las hacen más resistentes a distintas clases de estrés, como el hídrico (Niinemets, 2001; Wright & Westoby, 2002), lo cual está ligado a la supervivencia (Fig. 4A). Por lo tanto, el peso foliar por área reflejaría un compromiso entre velocidad de crecimiento y tolerancia al estrés, discriminando entre especies “rápidas” o “adquisitivas” versus especies “lentas” o “conservativas” (Reich, 2014). Este compromiso se manifiesta a nivel de fitness mediante los efectos opuestos sobre la supervivencia y la fecundad (Fig. 4A) y, como resultado, el fitness muestra una respuesta de óptimo al peso foliar por área (Fig. 4B). Las especies con peso foliar por área menor que el óptimo tienen hojas demasiado blandas lo que limita su supervivencia, mientras que aquellas con peso foliar por área mayor que el óptimo son demasiado conservativas lo que limita su crecimiento y fecundidad.
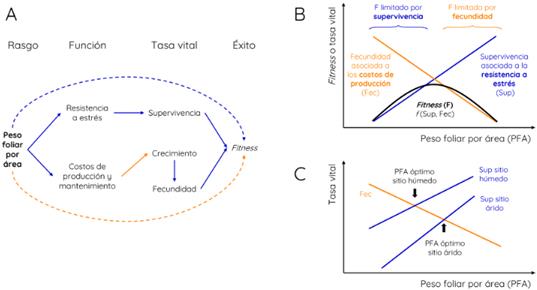
Fig. 4 Funcionalidad del peso foliar por área (PFA) siguiendo el esquema presentado en la Fig. 2. Otras referencias como en la Fig. 2. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1000/1245
Dada su relación con la economía de recursos, el peso foliar por área suele variar a lo largo de gradientes ambientales. Por ejemplo, existe mucha evidencia empírica que muestra que el peso foliar por área responde negativamente a las precipitaciones (Niinemets, 2001; Wright et al., 2004; Poorter et al., 2009; Moles et al., 2014). En un sitio seco, las especies con alto peso foliar por área son favorecidas porque invierten en área foliar “costosa” en términos de biomasa que les permite hacer un uso más eficiente del agua y sobrevivir al estrés hídrico (Fig. 4C). En un sitio húmedo, en cambio, la supervivencia frente a estrés hídrico no está en juego, sino que la principal amenaza son las plantas vecinas. En estas condiciones, las especies con bajo peso foliar por área son favorecidas porque invierten en área foliar “barata” que les permite crecer rápido, desplazando competitivamente a especies más lentas, con mayor peso foliar por área (Fig. 4C). En este caso he asumido que el cambio en las precipitaciones afecta más a la supervivencia que a la fecundidad (por lo que la Fig. 4C muestra una línea asociada a la fecundidad y dos líneas asociadas a la supervivencia, una para cada sitio). Esto puede no ser siempre así en realidad, aunque parece ser un supuesto necesario para generar el movimiento del óptimo hacia valores menores de peso foliar por área cuando aumentamos las precipitaciones. La evidencia empírica respecto de estas relaciones (i.e. de cómo las relaciones PFA-fecundidad y PFA-supervivencia varían a lo largo de gradientes ambientales) en el campo es muy poca. Uno de los pocos estudios hechos hasta el momento incluso muestra resultados que contradicen el patrón general (relación PFA- precipitaciones negativa): las especies de árboles en las selvas de Panamá con alto peso foliar por área mostraron mayor (en lugar de menor) crecimiento y supervivencia que especies con bajo peso foliar por área (Muscarella et al., 2018). Esto evidencia el tamaño de nuestro desconocimiento respecto de la funcionalidad ecológica en el campo del peso foliar por área que, paradójicamente, ha sido ampliamente estudiado en condiciones ambientales controladas (Poorter et al., 2009).
Tamaño de hoja
El tamaño de una hoja es generalmente medido como el área de la hoja incluyendo el pecíolo (Pérez-Harguindeguy et al., 2013). A mayor tamaño, mayor es la capa de aire quieto alrededor de ellas (capa límite) y, en consecuencia, menor es la capacidad de las hojas para intercambiar gases con el aire que las rodea y disipar calor a través de la transpiración (Gates, 1968; Leigh et al., 2017). Por esta razón, en sitios donde hay mucha radiación o hace mucho calor (aunque sea por unas horas), el tamaño de hoja afectaría negativamente a la supervivencia (Fig. 5A). Sin embargo, las hojas chicas son menos eficientes que las grandes para interceptar luz, ya que se sombrean más entre ellas (Givnish, 1987). A mayor tamaño de hoja, mayor es la eficiencia de intercepción de luz y, a igualdad de otras condiciones, mayor será el crecimiento (Fig. 5A). Vemos entonces que el tamaño de hoja tendría un efecto positivo sobre el crecimiento y negativo sobre la supervivencia, siempre que nos encontremos en condiciones de temperatura relativamente alta (Fig. 5B).
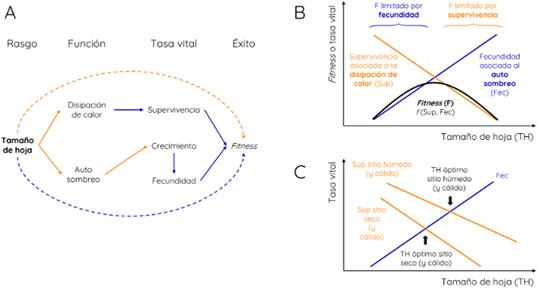
Fig. 5 Funcionalidad del tamaño de hoja (TH) siguiendo el esquema presentado en la Fig. 2. Otras referencias como en la Fig. 2 excepto en los paneles B y C donde la supervivencia está representada por las líneas naranjas (por su respuesta negativa al TH) y la fecundidad por las azules (por su respuesta positiva). Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1000/1245
Como resultado de estos compromisos, el tamaño de hoja suele aumentar con las precipitaciones (Moles et al., 2014; Wright et al., 2017) o disminuir con la demanda atmosférica (Dong et al., 2020). En un sitio seco, las especies con hojas chicas son favorecidas porque disipan calor más eficientemente (sin necesidad de transpirar tanto) lo que aumenta su supervivencia (Fig. 5C; Givnish, 1987; Wright et al., 2017). En los sitios húmedos, donde la supervivencia frente a estrés hídrico no está en juego, las especies con hojas grandes son favorecidas porque interceptan luz más eficientemente, desplazando competitivamente a especies con hojas más chicas (Fig. 5C). En este caso he asumido que el cambio en las precipitaciones afecta más a la supervivencia que a la fecundidad (por lo que la Fig. 5C muestra una línea asociada a la fecundidad y dos líneas asociadas a la supervivencia, una para cada sitio). Esto puede ser así porque el auto-sombreo no depende de las condiciones hídricas sino de las propiedades físicas de las hojas (el área). En cambio, la disipación de calor depende fuertemente de cuánta agua tengan las plantas para transpirar (Gates, 1968; Leigh et al., 2017), lo que genera las dos curvas asociadas a la supervivencia.
Conclusiones
McGill et al. (2006) enfatizaron la necesidad de “poner la ‘función’ en los rasgos funcionales”, es decir, estudiar explícitamente cómo la interacción entre rasgos y ambiente afecta a la performance o el éxito ecológico de las especies. Sin embargo, no han sido muchos los esfuerzos por discutir qué formas toman estas relaciones y cuáles son los mecanismos subyacentes (Rolhauser & Pucheta, 2017). En este trabajo, apoyándome en herramientas gráficas, llevé adelante esta discusión tratando de compatibilizar conceptos teóricos que aún no cuentan con suficiente sustento empírico (relaciones rasgo-fitness de óptimo) con evidencias empíricas relativamente más robustas respecto de relaciones rasgo-ambiente. Los diagramas de influencias me fueron útiles para razonar el efecto indirecto final de los rasgos sobre el fitness. Usé los gráficos de coordenadas cartesianas para plasmar estos efectos de una manera explícitamente funcional.
Deliberadamente, definí a los rasgos funcionales como características morfológicas que luego afectan una cadena de procesos ecológicos a los que llamé función, tasa vital y fitness. Esta definición (que difiere de la de Violle et al., 2007) responde estrictamente al principio mecanístico de relacionar estructura (morfología) con funcionamiento (fisiología). El beneficio práctico es sumamente importante: poder predecir el futuro de un objeto o sistema con sólo conocer sus propiedades físicas. Las medidas morfológicas son generalmente menos costosas de obtener (en tiempo y dinero), lo que facilita la generación de datos y abarcar la mayor cantidad de especies posibles (Westoby, 1998).
Tener presente y comprender esta cadena causal nos permitirá llenar vacíos de información existentes y mejorar nuestra capacidad de predicción. Por ejemplo, vimos que el peso de semilla está implicado en compromisos que emergen en distintos niveles de la cadena causal. En ausencia o poca importancia de depredadores de semillas, primaría un compromiso entre supervivencia y fecundidad (tasas vitales). En cambio, en presencia de depredadores entraría en juego un compromiso entre la provisión de reservas y la susceptibilidad a la depredación, i.e. medidas de funcionamiento que afectan a la supervivencia y no (al menos directamente) a la fecundidad (Fig. 3A). Por lo tanto, las predicciones respecto del rol del peso de semilla sobre el fitness de las especies y la dinámica resultante de las comunidades dependerán de cómo la intensidad de la depredación modula estos dos compromisos.
Éste ha sido un ejercicio mental para producir predicciones que ayuden a guiar la generación de datos en el futuro. Sin embargo, es necesario que estas predicciones sean evaluadas tanto teórica como empíricamente. Por un lado, será necesario revisar y completar los diagramas de influencias incorporando toda la información fisiológica y ecológica disponible (ésta no ha sido una revisión exhaustiva) y la que vaya apareciendo con los años. Por otro, es importante evaluar en qué medida la aparición de relaciones rasgo-fitness de óptimo depende de los dos supuestos que usé para mi análisis, linealidad de las relaciones rasgo-tasa vital y multiplicabilidad de la fecundidad y la supervivencia.
Espero que este texto motive a ecólogos y botánicos no solo a incorporar a los rasgos funcionales a sus “cajas de herramientas” sino también a indagar en la frontera del conocimiento respecto de las relaciones funcionales entre rasgos, funciones (fisiología), tasas vitales y fitness. Los pocos ejemplos con los que contamos hasta ahora muestran que los rasgos funcionales explican la performance individual (en sentido laxo) y la distribución de las especies con distinto éxito. Algunos trabajos han encontrado conexiones débiles entre rasgos y tasas vitales (ver revisión en Yang et al., 2018), aunque otros vieron claras conexiones entre rasgos y habilidad competitiva (Kunstler et al., 2016; Rolhauser et al., 2019). Otros han encontrado que un puñado de rasgos y de variables ambientales (y sus interacciones) pueden explicar más de un cuarto de la variación de la distribución o presencia-ausencia de especies (Löbel et al., 2018; Pollock et al., 2018) e incluso de la abundancia (Rolhauser et al., 2021) en distintas regiones del mundo. En definitiva, es claro que los rasgos funcionales no son la panacea ni el santo grial de la ecología (sensu Lavorel & Garnier, 2002) ya que es improbable que ofrezcan explicaciones completas o predicciones infalibles. Sin embargo, ignorarlos nos negaría una fuente de información irremplazable para entender y predecir las respuestas de poblaciones y comunidades vegetales a las condiciones ambientales en nuestro mundo cambiante.












 uBio
uBio