INTRODUCCIÓN
Cheilanthes Sw. (Cheilanthoideae, Pteridaceae) es un género con distribución cosmopolita (Tryon et al., 1990) descrito hace más de 200 años. En un principio, la delimitación del género fue basada en características morfológicas extremadamente variables, tanto que se superponían con las de los géneros afines, lo cual redundó en la inclusión de más de 150 especies. En los últimos 30 años, el uso de secuencias de ADN para análisis filogenéticos permitió la segregación de nuevos géneros cheilanthoides, así como la rehabilitación de otros descriptos antiguamente, ya sea neotropicales como Adiantopsis Fée (Link-Pérez et al., 2011; Ponce & Scataglini, 2012), Gaga Pryer, F.W. Li & Windham (Li et al., 2012) y Myriopteris Fée (Grusz & Windham, 2013), o paleotropicales como Aleuritopteris Fée y Oeosporangium Vis. (Zhang et al., 2013; Fraser‐Jenkins, 2016; Fraser‐Jenkins et al., 2016[2017]), dejando a Cheilanthes con aproximadamente 100 especies a nivel mundial (PPG I, 2016).
Los últimos tratamientos taxonómicos sobre el género, que incluyen casi la totalidad de las especies sudamericanas, basados en análisis filogenéticos moleculares y en caracteres morfológicos y reproductivos (Ponce & Scataglini, 2018, 2020), proponen que Cheilanthes s. str. estaría formado por 70 especies divididas en tres clados: uno de Australasia + Sudamérica, conteniendo a la especie tipo C. micropteris Sw., otro africano, y el restante de distribución exclusivamente sudamericana. Sin embargo, algunas de las especies sudamericanas aún permanecen en una posición taxonómica incierta, debido principalmente a su convergencia morfológica y a la falta de evidencias moleculares.
Uno de estos casos, es el de Cheilanthes volcanensis de la Sota, especie poco frecuente, restringida al noroeste de la Argentina y Bolivia, que fue descripta en 1972 basándose principalmente en material coleccionado a principios del siglo XX. Con excepción de un ejemplar coleccionado en 1978, la especie recién volvió a ser hallada en el año 2020, en pastizales de altura de la provincia de Salta, en el noroeste de Argentina.
En cuanto a su morfología externa, C. volcanensis posee láminas de contorno pentagonal, 2-pinnadas-pinnatífidas o 3(-4)-pinnadas, ejes de color castaño-oscuro, brillantes, glabros, y surcados adaxialmente. Asimismo, estas características constituyen atributos importantes para la delimitación morfológica del género Gaga, que fue segregado de Cheilanthes s. str. principalmente por sus diferencias moleculares (Li et al., 2012). Otras especies sudamericanas de Cheilanthes, como por ejemplo C. hieronymi Herter, C. glauca (Cav.) Mett. y C. rufopunctata Rosenst., también presentan tipos de láminas y ejes similares a los descriptos para C. volcanensis y Gaga, pero los análisis moleculares mostraron que tanto C. hieronymi, como C. glauca y C. rufopunctata no son cercanas a Gaga y se ubican dentro del clado de Cheilanthes s. str. (Ponce & Scataglini, 2016, 2018, 2020).
En el aspecto anatómico, las especies sudamericanas de Cheilanthes s. str. presentan raíces con corteza parenquimática homogénea y con un periciclo de 2-3 capas; los ejes son teretes a semiteretes, a veces con extensiones laterales como aristas o alas, con corteza parenquimática formada por células de paredes engrosadas, a veces con sectores de esclerénquima. Dentro del cilindro vascular, el xilema generalmente es monoxilar siendo las formas más comunes en “V”, “U”, “X” e “Y”, a menudo se presenta dixilar en la base del pecíolo (Hernández & Albornoz, 2001; Hernández, 2019). Las esporas son triletes con una ornamentación del perisporio del tipo rugulado, crestado, reticulado o equinulado (Tryon & Lugardon, 1991; Morbelli & Ponce, 1997). Algunas de estas características anatómicas (e. g. el periciclo de 2-3 capas, y la corteza de los ejes con sectores de esclerénquima) y palinológicas (e. g. el perisporio rugulado-crestado) también se encuentran en G. marginata (Kunth) F.W. Li & Windham, la única especie que crece en el Cono Sur de Sudamérica del género (Li et al., 2012), y que, además, es simpátrica con C. volcanensis.
Dado que algunas especies de Cheilanthes y Gaga comparten una alta afinidad morfológica, y que, además, ciertas características anatómicas y palinológicas presentes en Cheilanthes se encuentran en G. marginata, la asignación genérica de C. volcanensis ha permanecido incierta hasta la actualidad (Ponce, 2016), debido a la falta de un análisis anatómico y filogenético de la especie. En línea con lo expuesto, el objetivo de este trabajo es testear la ubicación taxonómica de C. volcanensis dentro del género Cheilanthes s. str., mediante secuencias de ADN obtenidas a partir de una reciente colección de la especie proveniente de la provincia de Salta (Argentina). Además, y sobre la base de estos resultados moleculares, se realizó un análisis morfo-anatómico de la especie y de sus especies afines, a fin de corroborar dicha posición taxonómica, como así también aportar características para la correcta delimitación de Cheilanthes s. str.
MATERIALES Y MÉTODOS
Análisis filogenético molecular
Extracción, amplificación y secuenciación de ADN. A partir del material de Cheilanthes volcanensis (F. Luna s.n., MCNS-13564), recientemente coleccionado en Salta (Argentina), se obtuvieron secuencias de los marcadores plastidiales rbcL y matK. El ADN genómico total se extrajo de hojas secas con el protocolo de bromuro de cetil-trimetilamonio (Doyle & Doyle, 1987). La amplificación por PCR de los marcadores matK y rbcL se realizó utilizando los cebadores propuestos por Kuo et al. (2011) y Gastony & Rollo (1995), respectivamente. Las reacciones de PCR se realizaron en volúmenes finales de 25 μL con 50-100 ng de ADN molde, 0,2 μM de cada cebador, 25 μM de dNTP, 5 mM de MgCl2 y buffer 1x y 0,3 unidades de polimerasa Taq de Invitrogen Life Technologies (Brasil). Los ciclos de la PCR se realizaron bajo los siguientes parámetros: 1 ciclo de 94°C por 5 min, 39 ciclos de 94°C por 30 s, 48°C por 1 min, y 72°C por 1 min 30 s, y una extensión final ciclo de 72°C por 10 min. Los productos de PCR se procesaron en un gel de agarosa TBE al 1 % teñido con SYBRSAFE (Invitrogen), y se visualizaron en un transiluminador de luz azul. La secuenciación automatizada fue realizada por Macrogen, Inc. (Seúl, Corea). Las secuencias fueron editadas y alineadas utilizando el programa Bioedit (Hall, 1999).
Análisis filogenéticos. Las secuencias obtenidas de rbcL y matK se analizaron en diferentes matrices disponibles para ambos marcadores, respectivamente: en la matriz combinada de rbcL+trnL-F+rps4, de la filogenia de Cheilanthes de Ponce & Scataglini (2020) (73 taxones x 3304 caracteres; Apéndice A, Material suplementario I http://www.ojs.darwin.edu.ar/index.php/darwiniana/ article/view/1118/1289), analizada bajo Inferencia Bayesiana; y en la matriz de matK de Ponce & Scataglini (2016), basada en el trabajo de la filogenia de Gaga de Li et al. (2012) (26 taxones x 1303 caracteres; Apéndice B, Material suplementario II http://www.ojs.darwin.edu.ar/index.php/darwiniana/ article/view/1118/1290), analizada bajo el criterio de Parsimonia. El detalle de los taxones analizados y los números de acceso de GenBank se encuentran disponibles en los Apéndices A y B.
El análisis bayesiano se realizó con BEAST 1.8.1 (Drummond et al., 2012), bajo los mismos parámetros utilizados en el análisis de esta matriz en Ponce & Scataglini (2020). Se tomaron muestras de dos corridas independientes de 10 millones de generaciones cada 1000 generaciones. Para identificar cuándo los análisis alcanzaron la estacionariedad, se verificaron valores de ESS> 200 con Tracer v1.6 (Rambaut et al., 2014). Con base en este diagnóstico de convergencia, los primeros 1000 árboles muestreados fueron descartados utilizando TreeAnnotator 1.7.1 (Drummond et al., 2012). Los árboles de las dos corridas independientes se combinaron utilizando LogCombiner 1.8.4 (Drummond et al., 2012). El árbol de máxima credibilidad con las probabilidades posteriores (PP) de cada nodo se visualizó en FigTree 1.3.1 (Rambaut, 2009).
El análisis de parsimonia se realizó utilizando TNT 1.1 (Goloboff et al., 2008). Todos los caracteres se ponderaron por igual y se trataron como desordenados. Las búsquedas incluyeron 1000 repeticiones, cada una de las cuales generó un árbol de Wagner usando una secuencia de adición aleatoria de taxones de la matriz de datos, intercambiando el árbol inicial con TBR (bisección y reconexión de árboles) y reteniendo un máximo de 10 árboles en cada réplica. Posteriormente, todos los árboles óptimos se intercambiaron utilizando TBR, con un máximo de 20000 árboles. Se generó un árbol de consenso estricto a partir de los árboles más parsimoniosos. Los soportes de las ramas se estimaron utilizando Bootstrap (BS) (Felsenstein, 1985) con un total de 10000 repeticiones. Cada réplica se analizó usando 10 árboles de Wagner como punto de partida, seguido de un intercambio de ramas TBR, salvando sólo un árbol por réplica.
Análisis morfo-anatómico
Se examinaron especímenes de herbario de Cheilanthes volcanensis y de Gaga marginata, depositados en LIL y MCNS (Thiers, 2023). Complementariamente, se analizó material depositado en SI de C. rufopunctata y C. glauca, ambas especies pertenecientes al clado donde se ubicó C. volcanensis en el análisis molecular realizado (ver Material examinado).
Los ejemplares frescos se fijaron en FAA (1:1:8 v/v/v formaldehido: ácido acético glaciar: alcohol etílico 80%) para estudios de microscopía óptica. Los cortes histológicos se realizaron a mano alzada, en sentido transversal, y las secciones se decoloraron con hipoclorito de sodio (NaClO) comercial diluido en agua a una proporción de 1:1; posteriormente, se lavaron cinco veces con agua destilada, y se aplicó la coloración diferencial azul astra (0,5%) y safranina (1%) (Bruno et al., 2007). El diafanizado de las láminas foliares se realizó siguiendo la técnica de Dizzeo de Strittmater (D’Ambrogio de Argüeso, 1986), las que fueron posteriormente coloreadas con azul astra. En algunos casos, se realizó coloración diferencial safranina-azul astra, a fin de visualizar con mayor contraste los tricomas glandulares de la superficie foliar. Las esporas se suspendieron en etanol 96%, y después de la deshidratación, se secaron con dióxido de carbono en un equipo de preparación para muestras para MEB marca Denton Vacuum DCP-1, y se fijaron en “stubs” de aluminio con cinta bifaz de grafito y se las recubrió de oro (20-24 nm de espesor) con un equipo marca Denton Vacuum Desk IV.
Para el análisis comparativo se estudiaron los siguientes caracteres diagnósticos descritos para Cheilanthes (Tryon et al., 1990; Li et al., 2012; Ponce, 2016). Raíces: características de la corteza, distribución de los tejidos mecánicos, endodermis y bandas de Caspary; cilindro vascular, estratos de periciclo y tipo de estela. Pecíolos y raquis: forma en sección transversal; distribución de los tejidos mecánicos y vasculares en sección basal (SB), sección media (SM) y sección distal (SD). Láminas: arquitectura foliar e indumento; características del margen reflexo o pseudoindusio. Esporas: Cantidad de esporas por esporangio, diámetro ecuatorial y ornamentación.
Las observaciones, ilustraciones y fotografías se realizaron con microscopios de luz marca Leica DM500 con cámara anexada ICC50 HD, Zeiss Axiostar con una cámara Canon Powershot A620 de 7,2 MP y Olympus CX 41 con una cámara digital Zeiss Axiocam ERc 5s”, estereoscopios Optika SZM-LED2 con cámara anexada MotiCAM BTU10 y Nikon SMZ 800 con cámara de video, y microscopio electrónico de barrido Supra SS VP (Zeiss) del Centro Integral de Microscopía Electrónica (CEMA, CONICET).
RESULTADOS
Análisis filogenético molecular
La secuencia de rbcL de Cheilanthes volcanensis, obtenida y analizada bajo Inferencia Bayesiana en la matriz combinada de Ponce & Scataglini (2020), mostró que la especie se incluye en el clado exclusivamente sudamericano de Cheilanthes s. str. (PP = 0,98), ubicándose como especie hermana de C. rufopunctata (PP = 0,99), en un subclado de PP = 0, 98 integrado por C. glauca y C. hypoleuca (Kunze) Mett. (Fig. 1).
De igual modo, la secuencia de matK, obtenida y analizada bajo Parsimonia en la matriz de Ponce & Scataglini (2016), resultó en 17 árboles más parsimoniosos de 495 pasos, cuyo consenso estricto mostró a C. volcanensis nuevamente en el clado sudamericano de Cheilanthes s. str. como especie hermana de C. rufopunctata con un soporte de Bootstrap BS=100% (Fig. 2). Las secuencias de estas dos especies comparten además una deleción de 3 pares de bases, exclusiva de ambas, en las posiciones 754-757 de la matriz de matK (Apéndice B)
Análisis morfo-anatómico
Se describe la morfo-anatomía de las estructuras vegetativas y reproductivas de Cheilanthes volcanensis, C. glauca, C. rufopunctata y Gaga marginata. Los caracteres analizados se presentan en forma comparada en la Tabla 1 y en las Figuras 3 a 5.
Raíces. La epidermis es 1-estratificada de paredes delgadas en las cuatro especies (Fig. 3 A-D); la corteza es parenquimática y no lignificada, excepto en C. rufopunctata que presenta una corteza lignificada (Fig. 3 B). El cilindro vascular diarco está rodeado por una endodermis uniestratificada y posee un periciclo 1-3-estratificado en capas irregulares, mientras que C. volcanensis se distingue por su periciclo 3-estratificado en capas regulares (Fig. 3 C).

Fig. 1 Árbol obtenido del análisis Bayesiano de la matriz combinada de Ponce & Scataglini (2020), incluyendo a Cheilanthes volcanensis. En los nodos, se muestran los valores de Probabilidades Posteriores (PP) mayores de 0,85. Abreviaturas: AF, clado africano; SA, clado sudamericano; SA+AUS, clado sudamericano + Australasia.
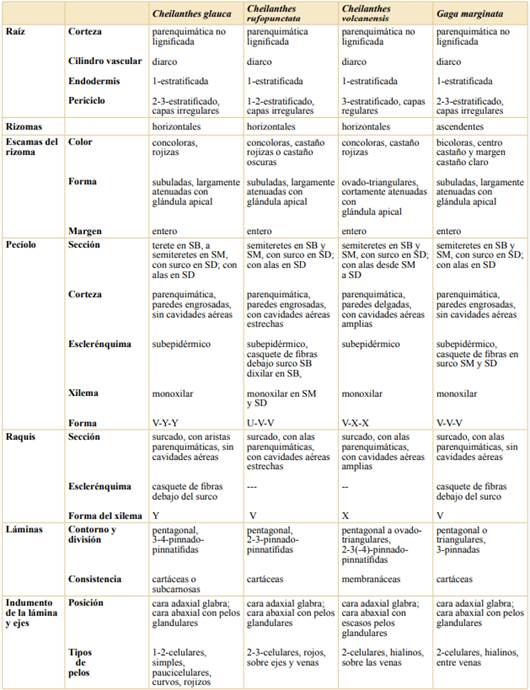
Tabla 1 Caracterización morfo-anatómica comparada entre Cheilanthes volcanensis, C. glauca, C. rufopunctata y Gaga marginata. Abreviaturas: SB, sección basal; SM, sección media; SD, sección distal.

Tabla 1 (Continuación). Caracterización morfo-anatómica comparada entre Cheilanthes volcanensis, C. glauca, C. rufopunctata y Gaga marginata. Abreviaturas: SB, sección basal; SM, sección media; SD, sección distal.
Rizomas. Los rizomas son horizontales en las tres especies de Cheilanthes, y ascendentes en G. marginata; en general de 2-3 mm diámetro. El cilindro vascular es soleno-dictiostélico en las cuatro especies. Las escamas rizomáticas en las especies de Cheilanthes son concoloras; en C. glauca y C. rufopunctata son angostamente triangulares (subuladas), con márgenes enteros y el ápice largamente atenuado con una glándula apical de contorno elíptico a clavado (Fig. 3 E, F), mientras que en C. volcanensis son ovado-triangulares, cortamente atenuadas apicalmente, y también con una glándula apical de la misma forma (Fig. 3 E-G). En G. marginata las escamas son bicoloras castaño-oscuras con un margen angosto castaño-claro o a veces concoloras castaño-oscuras, angostamente triangulares, atenuadas, con glándula apical (Fig. 3 H).
Pecíolo y raquis. En las cuatro especies, los pecíolos son teretes o semiteretes en SB y SM; a partir de la SM se encuentra un surco dorsal más o menos pronunciado (Fig. 4 A-B, E-F, I-J, M-N). En la SD y en el raquis, se encuentran aristas o alas latero-dorsales, que a veces son verdes (Fig. 4 G-H, K-L, O-P), en C. glauca son menos pronunciadas (Fig. 4 C-D). Cheilanthes volcanensis es la única especie con pecíolo alado en gran parte de su extensión hasta el raquis (Fig. 4 J-L). Las cuatro especies presentan una epidermis 1-estratificada, corteza parenquimática con esclerénquima subepidérmico o en casquetes de fibras (cfr. Tabla 1). El parénquima cortical de las alas de los ejes presenta cavidades aéreas muy desarrolladas en C. volcanensis (Fig. 4 J-L), y menos pronunciadas en C. rufopunctata (Fig. 4 G-H). El xilema es monoxilar, excepto en C. rufopunctata que presenta un xilema dixilar en la base (Fig. 4 E); la forma del xilema es en “V”, “U”, “X” e “Y”, predominando la forma en “V”. Cheilanthes volcanensis se identifica por el xilema en “X” en gran parte del pecíolo y raquis (Fig.4 J-L).

Fig. 2 Árbol de consenso estricto obtenido del análisis de Parsimonia de la matriz de matK de Ponce & Scataglini (2016), incluyendo a Cheilanthes volcanensis. Los valores de Bootstrap se indican sobre las ramas.

Fig. 3 Raíces en corte transversal. A, Cheilanthes glauca. B, C. rufopunctata. C, C. volcanensis. D, Gaga marginata. Escamas rizomáticas. E, C. glauca. F, C. rufopunctata. G, C. volcanensis. H, G. marginata. Abreviaturas: p, periciclo. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1118/1288
Láminas. Las láminas son de contorno pentagonal, de consistencia cartácea a subcarnosa, excepto en C. volcanensis, que tiene láminas membranáceas. En C. rufopunctata, C. volcanensis, y G. marginata, la superficie adaxial es glabra, y la abaxial presenta pelos glandulares 2-3-celulares (Fig. 5 D, F, I). En cambio, en C. glauca, además de pelos glandulares, posee pelos simples, con un pie 1-celular, corto, de paredes delgadas y una célula alargada de paredes gruesas (Fig. 5 B).
Los pseudoindusios en Cheilanthes, están restringidos a los segmentos de la lámina; en G. marginata son decurrentes a lo largo de los ejes; los bordes varían de papilado a irregularmente papilado en las especies de Cheilanthes, y fimbriado en G. marginata (Fig. 5 C, E, G, J).
Esporas. Son subtriangulares en C. glauca y C. rufopunctata, y subglobosas en C. volcanensis y G. marginata. Las tres especies de Cheilanthes tienen 64 esporas pequeñas (40-55 µm), mientras que G. marginata presenta 32 esporas de mayor tamaño (60-87 µm). Las cuatro especies tienen exosporio liso; en C. volcanensis el perisporio es crestado-reticulado con perforaciones (Fig. 5 H), en C. glauca y C. rufopunctata el perisporio presenta rúgulas o crestas y perforaciones, esta pared se desprende rápidamente. En G. marginata el perisporio es rugulado o rugulado-crestado (Fig. 5 K).
DISCUSIÓN
En este estudio, la evidencia molecular obtenida del marcador matK de la reciente colección de C. volcanensis, nos permitió establecer la posición taxonómica de esta especie dentro del género Cheilanthes s. str. (Fig. 2). La presencia de los nucleótidos “GAGA” en las posiciones 598-601 de matK es propuesta como una sinapomorfía definitoria que caracteriza al género Gaga (Li et al., 2012). La secuencia obtenida de C. volcanensis presentó los nucleótidos “GAGG” en dichas posiciones de matK, demostrando su no pertenencia al género Gaga.
Por otro lado, el análisis de la secuencia de rbcL de C. volcanensis, en la matriz combinada de Ponce & Scataglini (2020), que incluye casi la totalidad de las especies cheilanthoides sudamericanas, nos permitió definir que C. volcanensis es la especie hermana de C. rufopunctata y ambas especies forman, junto a C. glauca y C. hypoleuca, un sub-clado de máximo soporte perteneciente al clado de Cheilanthes s. str. exclusivo de América del Sur (Fig. 1). Cheilanthes rufopunctata, crece en los Andes de Bolivia y Perú, entre los 2000-4000 m s.m.; C. glauca y C. hypoleuca, son endémicas de la región andino-patagónica de la Argentina y Chile (C. hypoleuca desde Coquimbo a Araucanía, y C. glauca de Coquimbo a Aysén). Este grupo de especies comparten características morfológicas como los rizomas horizontales; las escamas rizomáticas concoloras de margen entero y terminadas en una glándula; y los pecíolos y el raquis son surcados en la porción media y distal. También producen 64 esporas pequeñas por esporangio, que estaría indicando una condición reproductiva sexual (Tabla 1).
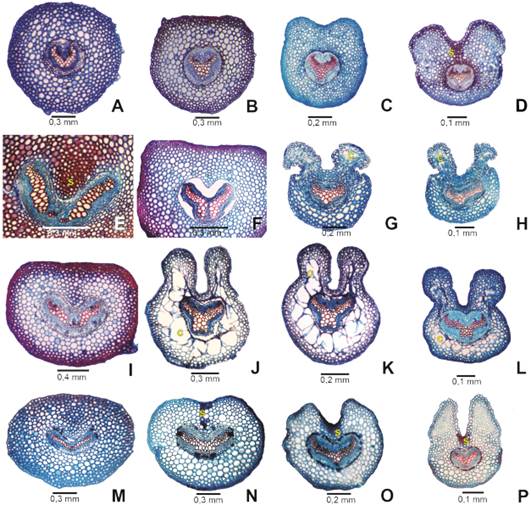
Fig. 4 Corte transversal de pecíolo en sección basal, media y distal y raquis (de izquierda a derecha). A-D, Cheilanthes glauca. E-H, Cheilanthes rufopunctata. I-L, Cheilanthes volcanensis. M-P, Gaga marginata. Abreviaturas: c, cavidades; s, casquete esclerenquimático. Figura en color en la versión en línea http://www.ojs.darwin.edu.ar/index.php/darwiniana/article/view/1118/1288

Fig. 5 Indumento y margen del pseudoindusio y esporas. A-C, Cheilanthes glauca: A, pelo glandular clavado; B, pelo simple; C, margen papilado. D-E, Cheilanthes rufopunctata: D, pelos glandulares; E, margen. F-H, Cheilanthes volcanensis: F, pelos glandulares; G, margen; H, espora. I-K, Gaga marginata: I, pelos glandulares; J, margen; K, espora.
Desde el punto de vista anatómico, se encontraron algunas diferencias entre las especies de este grupo: C. volcanensis se caracteriza por presentar raíces con un periciclo muy desarrollado de 3 capas de células regulares, pecíolo y raquis con alas laterales en casi toda su extensión y cavidades aéreas (grandes espacios entre el parénquima) presentes en la corteza; C. rufopunctata se distingue por sus pelos glandulares rojos sobre las costas y venas, por sus raíces con corteza lignificada, y también por presentar cavidades en las alas en la SD del pecíolo y raquis, pero en menor proporción y más pequeñas que en C. volcanensis (Tabla 1, Fig. 4 G-H). De acuerdo con los estudios anatómicos en Cheilanthes (Hernández, 2019), los tejidos con espacios intercelulares grandes y desiguales se encuentran presentes en algunas especies con similitudes morfológicas y ambientales como C. hieronymi y C. poeppigiana Mett. ex Kuhn, pertenecientes al clado sudamericano, pero distantes de C. volcanensis y sus especies afines. Sus láminas, también pentagonales y con ejes con proyecciones laminares, poseen este tipo de tejido en el parénquima de esas alas, sin embargo, su presencia es mucho menos significativa que en C. volcanensis.
Por otro lado, la otra especie del grupo de C. volcanensis, C. glauca, presenta una morfología externa característica con láminas pentagonales, coriáceas, segmentos linear-elípticos con márgenes recurvados y continuos, con un indumento abaxial de pelos simples, crespos, ferrugíneos, en alta densidad. Estos rasgos diferencian a C. glauca del resto de las especies; no obstante, en el aspecto anatómico, no muestra diferencias significativas presentando la estructura y organización semejante al resto de las especies del género.
Por último, el análisis morfo-anatómico mostró que G. marginata se distingue del clado de las especies de C. volcanensis, principalmente por el tipo de rizoma ascendente; las escamas bicoloras; los márgenes foliares curvados en los segmentos, con borde fimbriado y decurrentes a lo largo de los ejes; y por presentar 32 esporas por esporangio, de mayor tamaño, que estaría indicando una reproducción asexual (Tabla 1). De las 19 especies de Gaga, casi la mitad poseen 64 esporas pequeñas (haploides) por esporangio, y el resto 32 esporas grandes (diploides o triploies) (cfr. Li et al., 2012).
CONCLUSIONES
Cheilanthes volcanensis es una especie poco coleccionada y su posición taxonómica ha sido controversial debido a que presenta características morfológicas compartidas con las especies del género Gaga. El análisis de filogenia molecular de un espécimen recientemente coleccionado de C. volcanensis, mostró que la especie no se relaciona con Gaga, sino que se ubica en el clado sudamericano de Cheilanthes s. str., como especie hermana de C. rufopunctata, junto a C. hypoleuca y C. glauca. Por otro lado, las observaciones morfo-anatómicas, mostraron que C. volcanensis comparte con las especies de su clado los siguientes caracteres que, a su vez, se distinguen de los del género Gaga: rizomas horizontales (vs. ascendentes en Gaga), escamas rizomáticas concoloras (vs. bicoloras en Gaga) y la presencia de 64 esporas pequeñas (vs. 32 esporas grandes en G. marginata). Además, C. volcanensis se distingue de las especies de su clado, por presentar las siguientes características anatómicas particulares: raíces con periciclo muy desarrollado de 3 capas regulares (vs. 1-3 capas irregulares), cavidades aéreas amplias en la corteza del pecíolo y raquis (vs. parénquima sin cavidades aéreas o cavidades estrechas), surco dorsal con alas a cada lado, que se extiende en la mayor parte del eje pecíolo-raquis (vs. surco dorsal con alas o aristas a partir de la SD y raquis) y, por último, la presencia de láminas membranáceas, pentagonales u ovado-triangulares (vs. cartáceas o subcarnosas, pentagonales).
Tratamiento taxonómico
Cheilanthes volcanensis de la Sota, Darwiniana 17: 78, fig. 5, G-I, Lám. I, 1. 1972. Hemionitis volcanensis (de la Sota) Christenh., Global Fl. 4: 23. 2018. TIPO. Argentina. Jujuy. Depto. Tumbaya. Estación Volcán, I-1920, L. Castillón 20 (holotipo, LIL-17156!; isotipo, US!).
Distribución
Se distribuye en la Argentina, en las provincias de Jujuy, Salta y Tucumán, y también en Cochabamba, Bolivia. Crece exclusivamente en los pastizales de neblina por encima de los 2000 m s.m.
Observaciones
En la etiqueta del material tipo, solo figura (ex-)Estación Volcán, es una localidad pequeña al costado de la Ruta Nacional 9 en la provincia de Jujuy, sus alrededores más cercanos no representan el hábitat de C. volcanensis, probablemente el ejemplar proviene de los sitios neblinosos a mayor altitud que se encuentran en las montañas que bordean la quebrada.
Material examinado
ARGENTINA. Salta. Depto. Santa Victoria: Nazareno, cerro de San Marcos, 3200 m s.m., 19-IV-2020, F. Luna s.n. (MCNS-13564). Tucumán. Depto. Chicligasta: Cochuna Basin, 26-III-1978, S. Halloy 134 (LIL). Depto. Lules: Filo de Mala Mala, 06-IV-1904, M. Lillo 3460 (LIL). Depto. Tafí del Valle: La Ciénaga, Cerros de las Aguadas, 19-XII-1888, M. Lillo 1310 (LIL).
Material examinado de las especies afines a C. volcanensis
Cheilanthes glauca. ARGENTINA. Neuquén. Depto. Lácar: Ruta Nacional 234, 5 km S de San Martín de los Andes, borde del Cerro Colorado, 960 m s.m., 25-I-2006, M. J. Belgrano et al. 522 (SI). CHILE. Región del Bio Bio (VIII). Prov. Bio Bio. Ruta Q-45, El Abanico, 28-XI-2008, O. Morrone et al. 6013 (SI).
Cheilanthes rufopunctata. BOLIVIA. La Paz. Inquisivi, entre Choquetanga y Carabuco, 3000-3200 m s.m., 27-I-1990, M. Lewis 37011 (SI).
Gaga marginata. ARGENTINA. Jujuy. Depto. Valle Grande: Santa Ana, Camino del Inca, 29-XI-2008, M. Hernández & M. Mata 850, 851, 852, 853 (LIL); Camino del Inca desde Santa Ana hasta 2 km de Valle Colorado, 26-II-2009, M. Hernández & N. Muruaga 927, 952 (LIL); Santa Ana, camino del Inca por las escaleras, 11-IV-2011, M. Hernández, L. Terán & F. Ríos 1650, 1651, 1653, 1654 (LIL). Tucumán. Depto. Tafí del Valle: El Rincón, 17-XII-2013, M. Hernández et al. 3215 (LIL); El Rincón camino a El Mollar, 03-V-2014, M. Hernández et al. 3367, 3370, 3404, 3405 (LIL); La Ciénaga, 20-IV-2013, R. Delgado 423 (LIL).












 uBio
uBio 

