Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.63 n.1 Buenos Aires ene./feb. 2003
Anticuerpos Anti-F2/3 como marcador de curación en niños con infección congénita por trypanosoma cruzi
J. Altcheh1, R. Corral2, M. A. Biancardi, H. Freilij1
Laboratorio de Parasitología y Chagas y Laboratorio de Virología, Hospital de Niños Ricardo Gutiérrez, Buenos Aires.
1 Miembros de la Carrera de Investigador Científico del Gobierno de la Ciudad de Buenos Aires.
2 Miembro de la Carrera de Investigador Científico del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas)
Dirección postal: Dr. Jaime Altcheh, Laboratorio de Parasitología y Chagas, Hospital de Niños R. Gutiérrez, Gallo 1330, 1425, Buenos Aires, Argentina. E-mail: jaltcheh@intramed.net.ar
Resumen
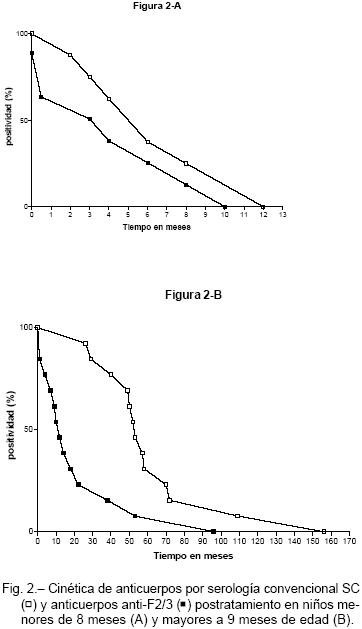
La fracción antigénica F2/3 de tripomastigotes contiene epitopes detectables por anticuerpos representativos de infección activa. Después del tratamiento con benznidazol, se comparó la cinética de negativización de la serología convencional (SC) y de los anticuerpos anti-F2/3 en 21 pacientes con Chagas congénito. Los pacientes se dividieron en 2 grupos: A) Edad < de 8 meses al diagnóstico; B) Edad > de 9 meses al diagnóstico; el grupo A negativizó la SC a los 6.6 m (IC95 3.4-9.8 m) y anti-F2/3 a los 4 m (IC950.9-7.1 m) p = 0.18. El grupo B negativizó la SC a los 63.1 m (IC95 42.1-84.2 m) y anti-F2/3 a los 21.9 m (IC95 5.7-38.1 m) p = 0.0025. El grupo A presentó una temprana negativización tanto de la SC como de los anti-F2/3. En el grupo B la negativización de los anti-F2/3 anticipó significativamente a la SC. La negativización de los anticuerpos anti-F2/3 es un marcador temprano de curación, particularmente en pacientes con mayor tiempo de infección.
Palabras claves: Chagas congénito; Tratamiento; Curación; Anticuerpos anti-F2/3; Serología; Glicoconjugados.
Abstract
Anti-F2/3 serum antibodies as cure marker in children with congenital Trypanosoma cruzi infection. The F2/3 antigenic fraction isolated from Trypanosoma cruzi trypomastigotes contains epitopes recognised by antibodies which are representative of active infection. The kinetics of disappearance of conventional serology (CS) and anti-F2/3 antibodies were compared in 21 patients with congenital Chagas´disease after receiving benznidazole treatment. Patients were divided into 2 groups: (A) Age < 8 months at diagnosis; (B) Age > 9 months at diagnosis. Group A presented negative outcome for CS at 6.6 mo. (CI95 3.4-9.8 mo.) and for anti-F2/3 at 4 mo. (CI95 0.9-7.1 mo.), p = 0.18. Group B exhibited non-reactive CS at 63.1 mo. (CI95 42.1-84.2 mo.) whereas anti-F2/3 antibody determination became negative at 21.9 mo. (CI95 5.7-38.1 mo.), p = 0.0025. In patients belonging to group A, antibodies were undetectable by both CS and anti-F2/3 ELISA soon after receiving chemotherapy. In infants included into group B, a negative result for anti-F2/3 antibody detection significantly anticipated the disappearance of CS reactivity. Consequently, an anti-F2/3 antibody assay becoming negative should be considered as an early marker for assessment of cure, particularly in those patients with prolonged time of infection.
Key words: Congenital Chagas disease; Chemotherapy; Cure; Mucin-like glycoconjugates; Anti-F2/3 serum antibodies; Serology.
La enfermedad de Chagas ha cambiado su perfil epidemiológico a partir de la disminución de la transmisión vectorial1 y de fenómenos de migración de individuos infectados a las grandes ciudades. Esto determina que en la ciudad de Buenos Aires se generen casos autóctonos por la adquisición del Trypanosoma cruzi por transfusión, por vía transplacentaria2 o por transplante de órganos. Distintos trabajos muestran que entre el 2 y el 7% de los niños nacidos de madres infectadas adquieren el parásito durante el embarazo. El estudio sistemático para la detección del Chagas congénito es particularmente importante porque hemos demostrado la curación de más del 97% de los niños tratados en los primeros meses de vida2.
El criterio actual de curación es la negativización postratamiento de la serología convencional (SC), esto significa que el individuo tratado no posee parásitos ni restos antigénicos que estimulen el sistema inmune. El momento en que se negativiza la SC está relacionado directamente con el tiempo de evolución de la infección previa al tratamiento. Los niños en la fase aguda (vectorial o transplacentaria), negativizan la SC entre los 2 y 12 meses postratamiento3, especialmente en la infección congénita4. En el período indeterminado se suele negativizar varios años después de finalizada la medicación5. La persistencia de la SC reactiva en los pacientes tratados y curados podría deberse a la estimulación del sistema inmune por anticuerpos anti-idiotipo generados por el T. cruzi y/o por antígenos en común entre el protozoario y agentes saprófitos6.
En los últimos años se demostró que los anticuerpos líticos (AL) evaluados mediante la lisis mediada por complemento (LMCo) están asociados a la presencia del estadio tripomastigote del T. cruzi 7, 8. Un grupo de investigadores de Brasil observó en pacientes tratados en el período indeterminado que después de 10 años de seguimiento presentaban estudios parasitológicos reiteradamente negativos, negativización de la LMCo y persistencia de la SC reactiva7. A partir de estas observaciones se propuso a la desaparición de los AL como un nuevo marcador de curación9.
Los AL pueden evidenciarse también por técnicas inmunoenzimáticas utilizando antígenos del estadio tripomastigote (F2/38, ESAg, GPs 160, 75/90, T-DAF y 57/51)10. Estas técnicas presentan menor complejidad y menor costo que la LMCo.
La fracción antigénica F2/38 está constituida por glico-conjugados, anclados a la membrana por glicofosfati-dilinositol, con características de mucinas: - alto contenido de aminoácidos hidrofílicos (T, S, K, G), - ácido siálico, y - oligosacáridos con unión O-glicosídica a la proteína. Estos oligosacáridos representan el 60% de la masa de esta glicoproteína del T. cruzi y son ricos en residuos a-galactopiranosil11.
El objetivo del presente trabajo es evaluar la cinética de los anticuerpos anti-F2/3 en pacientes con Chagas congénito curados.
Criterios de infección: a) paciente menor de 6 meses con parasitemia presente por técnica de microhematocrito, b) paciente mayor de 6 meses con SC reactiva al menos por 2 de las siguientes técnicas: hemaglutinación indirecta (Polychaco), ELISA (Wiener) y aglutinación de partículas (Bayer). La vía congénita se definió si el paciente no recibió transfusiones de sangre, no concurrió a área endémica y la madre presentaba SC reactiva.
Se estudiaron 156 sueros de 21 pacientes con infección congénita por T. cruzi, que concurrieron al Laboratorio de Parasitología y Chagas del Hospital de Niños Ricardo Gutiérrez para su diagnóstico y tratamiento (edad media al diagnóstico: 2 años y 7 meses, rango: 15 días-10 años).
Todos ellos completaron el tratamiento (benznidazol (RADANIL®, Roche), 5-8 mg/kg/día en 2-3 dosis diarias por 60 días) y negativizaron la SC en distintos lapsos postratamiento.
Como controles se incluyeron 20 niños no infectados nacidos de madres con enfermedad de Chagas y 20 niños con otras parasitosis tisulares (toxoplasmosis, malaria, toxocariasis, leishmaniasis)
Se determinaron los niveles de anticuerpos séricos contra T. cruzi por SC y anti-F2/3 a partir de las muestras almacenadas a -20 °C obtenidas al inicio, a los 30 días, al fin del tratamiento y luego cada 3 a 6 meses, con un seguimiento promedio de 75 meses (rango: 24-156 meses) hasta la negativización de la SC en dos muestras sucesivas.
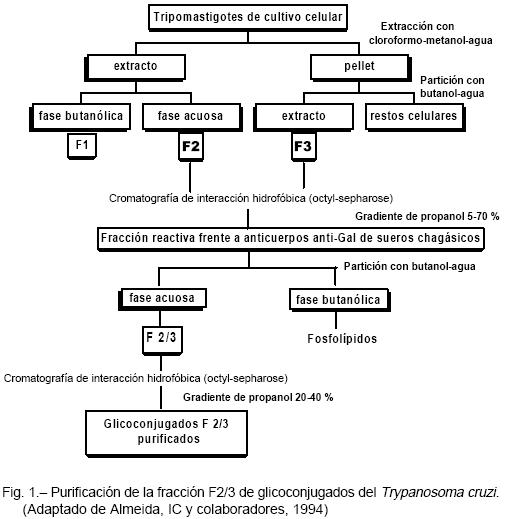
Para la obtención del antígeno F2/3 se cultivaron tripomastigotes de la cepa RA en células Vero y se purificaron por pasaje a través de una columna de DEAE-Sepharose (Pharmacia)12.
La obtención y purificación de las fracciones antigénicas F2 (74-96 kDa) y F3 (120-200 kDa) se muestra en la Figura 1(adaptado de Almeida IC et al; 199411). Los eluatos obtenidos con propanol 20-25% contenían los antígenos F2/38, 11.
ELISA de quimioluminiscencia13 (ELISA-CL): Se utilizaron 2 ng de la fracción F 2/3, para sensibilizar los pocillos de microplacas de poliestireno opaco (Nunc). Las muestras se utilizaron a una dilución de 1:2000. Se emplearon controles positivos y negativos para anti-F2/3 provistos gentilmente por el Dr. IC. Almeida, (Universidad de San Pablo, Brasil). Se utilizaron como conjugado anticuerpos contra IgG humana biotinilados (1:2000) (Amersham) y estreptavidina marcada con fosfatasa alcalina (1:2000) (Gibco-BRL) y como sustrato Lumiphos-530 (1:10) (Gibco-BRL). Para evitar depender de un luminómetro, se expusieron las placas por 30 segundos a película Kodak TMAT-S en un ambiente oscuro. Se reveló con soluciones estándar para películas radiográficas y se determinó la densitometría a 492 nm en un lector de ELISA (Labsystems).
Se realizó el test t de Student para dos grupos no apareados utilizando GraphPad InStat 3.00, San Diego California USA, 1992-1998. El nivel de significación estadística fue de p < 0.05. Todos los pacientes con Chagas congénito presentaron SC y anti-F2/3 positivos al diagnóstico y los controles estudiados presentaron ambos resultados negativos.
Se dividieron los pacientes en 2 grupos: A) Edad < de 8 meses al diagnóstico, B) Edad > de 9 meses al diagnóstico. Se compararon las cinéticas de desaparición de los anticuerpos detectados por SC vs. los anticuerpos anti-F2/3. El grupo A (n: 8, edad media: 2.8 meses, rango: 15 d-8 m); presentó una media de negativización de la SC de 6.6 m (IC95: 3,4-9.8) y de 4 m (IC95: 0.9-7.1) para los anticuerpos anti-F2/3, P= 0.18, Figura 2-A. En el grupo B (n: 13, edad media: 49 m, rango 9-120 m), presentó una media de negativización de la SC de 63,1 m (IC95: 42.1-84.2 m) y de 21.9 m (IC95: 5.7-38.1 m) para los anticuerpos anti-F2/3, P=0,0025, Figura 2-B.
Con el fin de acortar el período para definir curación se están desarrollando técnicas para detectar anticuerpos que reconozcan solo al tripomastigote a diferencia de la SC que emplea el parásito entero o un lisado del estadio epimastigote.
Son escasos hasta el presente los trabajos realizados con pacientes tratados empleando estos marcadores. Los primeros en evaluarse fueron los mismos AL mediante la LMCo6. Un estudio de seguimiento durante 3 años postratamiento utilizando el mismo antígeno que el empleado en este trabajo, fue realizado en Brasil en niños de 7 a 12 años de edad. Los autores observaron la negativización de los anticuerpos anti-F2/3 en el 58% de los niños y una caída significativa de los títulos de anticuerpos de la SC14.
Un trabajo realizado en Argentina en niños de 6 a 12 años, evaluó al cabo de 2 años la respuesta terapéutica empleando un antígeno recombinante perteneciente al flagelo (F29). El resultado mostró que el 62.1% de los pacientes negativizaron los anticuerpos anti-F29 y el 11.3% la SC15.
Estos ensayos demostraron la negativización de anticuerpos contra antígenos no convencionales en parte de los pacientes, pero no pudieron ser validados como marcador de curación, pues la mayor parte de los pacientes mantenían la SC reactiva.
En cambio, esta es la primera experiencia en la que se demostró con certeza que los anticuerpos contra F2/3 son marcadores precoces de curación dado que todos los pacientes negativizaron la SC.
En conclusión, nuestro trabajo demuestra que la negativización de los anticuerpos anti-F2/3 es un marcador temprano de curación, particularmente en aquellos que tienen mayor tiempo de infección. En los pacientes menores de 8 meses de edad esta diferencia no fue significativa. No hemos encontrado trabajos previos que utilicen esta metodología en paciente congénito, con Chagas, seguidos fuera de área endémica, lo que excluye la posibilidad de reinfección.
La Organización Mundial de la Salud sugirió el tratamiento a todos los individuos con enfermedad de Chagas, independientemente del estadio de la infección3. Una de las dificultades de la evaluación del tratamiento en pacientes con muchos años de infección es el largo tiempo que se debe esperar para asegurar la curación. Contar con estos marcadores sería una herramienta esencial que alentaría el empleo de la medicación en la fase indeterminada y crónica de la infección.
Agradecimientos: Este trabajo ha sido financiado con un subsidio de la Fundación Alberto J. Roemmers.
1. Moncayo A. Progreso en la interrupción de la transmisión de la enfermedad de Chagas en los países del Cono Sur. Medicina (Buenos Aires), 1999; 59: 120-4. [ Links ]
2. Freilij H, Altcheh J. Chagas congénito. En: Storino R, Milei J (eds). Enfermedad de Chagas. Ed. Buenos Aires: Mosby Doyma 1994; p 267-78. [ Links ]
3. Tratamiento etiológico de la enfermedad de Chagas. Conclusiones de una Consulta Técnica. Documento OPS /HCP /HCT /140 /1999. [ Links ]
4. Freilij H, Altcheh J. Congenital Chagas disease: Diagnostic and clinical aspects. Clin Infect Dis 1995; 21: 551-5. [ Links ]
5. Freilij H, Altcheh J. Respuesta terapéutica al nifurtimox en pacientes de edad pediátrica con enfermedad de Chagas crónica. Rev Patol Trop (Brasil) 1998; 27: 17-9. [ Links ]
6. Galvâo L, Nunes R, Cançado J, Brener Z, Krettli A. Lytic antibody titre as a means of assessing cure after treatment of Chagas disease: a 10 years follow-up study. Trans R Soc Trop Med Hyg 1993; 87: 220-3. [ Links ]
7. Krettli AU, Cançado JR, Brener Z. Effect of specific chemotherapy on the levels of lytic antibodies in Chagas disease. Trans R Soc Trop Med Hyg 1982; 76: 334-40. [ Links ]
8. Almeida IC, Krautz GM, Krettli AU, Travassos LR. Glyco-conjugates of Trypanosoma cruzi: A 74kD antigen of trypomastigotes specifically reacts with lytic anti-a-galactosyl antibodies from patients with chronic Chagas disease. J Clin Lab Anal 1993; 7: 307-16. [ Links ]
9. Krettli AU. Diagnosis of Trypanosoma cruzi chronic infections in humans: Usefulness of the complement regu-latory protein antigens and lytic antibodies in the control of cure. Mem Inst Oswaldo Cruz 1999; 94: 301-4. [ Links ]
10. Krautz GM, Kissinger JC, Krettli AU. The targets of the lytic antibody response against Trypanosoma cruzi. Parasitol. Today 2000; 16: 31-4. [ Links ]
11. Almeida I, Ferguson M, Schenkman S, Travassos L. Lytic anti-galactosyl antibodies from patientes with chronic Chagas disease recognize novel O-linked oligosaccharides on mucin-like glycosyl-phosphatidylinositol anchored glycoproteins of Trypanosoma cruzi. Biochem J 1994; 304: 793-802. [ Links ]
12. Villalta F and Kierszenbaun F. Growth of isolated amas-tigotes of Trypanosoma cruzi in cell-free medium. J Pro-tozool 1982; 29: 570-6. [ Links ]
13. Almeida I, Rodrigues E, Travassos L. Chemiluminescent immunoassays: discrimination between the reactivities of natural and human patient antibodies with antigens from eukaryotic pathogens, Trypanosoma cruzi and Paracocci-dioides brasiliensis. J Clin Lab Anal 1994; 8: 424-31. [ Links ]
14. De Andrade SS, de Andrade JG, Martelli CM. Randomized trial of efficacy of benznidazole in treatment of early Trypanosoma cruzi infection. Lancet 1996; 348: 1407-13. [ Links ]
15. Sosa Estani S, Segura EL, Porcel BM, et al. Chemotherapy with benznidazol in children in undetermined phase of Chagas disease. Am J Trop Med Hyg 1998; 59: 526-9. [ Links ]
Recibido: 28 de Junio de 2002
Aceptado: 17 de Octubre de 2002














