Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina (Buenos Aires)
versão impressa ISSN 0025-7680versão On-line ISSN 1669-9106
Medicina (B. Aires) v.63 n.2 Buenos Aires mar./abr. 2003
Sobresaturación urinaria del oxalato de calcio más alla de la nefrolitiasis.
La relación con el daño tubulointersticial
J. E. Toblli1 *, M. Angerosa1, I. Stella2, L. Ferder2, F. Inserra2
1Laboratorio de Medicina Experimental. Hospital Alemán. Buenos Aires;
2ININCA. Buenos Aires
*Miembro de la Carrera del Investigador del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas)
Dirección postal: Dr. Jorge E. Toblli, Laboratorio de Medicina Experimental, Hospital Alemán, Av. Pueyrredon 1640, 1118 Buenos Aires, Argentina. Fax: (54-11) 4805-6087. E-mail: jtoblli@hospitalaleman.com
Resumen
Numerosos estudios han demostrado que el producto de la actividad iónica (PAI) de oxalato de calcio (OxCa) en la orina, como indicador de sobresaturación (SS) urinaria, es mayor en pacientes formadores de cálculos que en sujetos normales. Más allá de la relación entre SS urinaria del OxCa y litogénesis, la exposición de OxCa al epitelio tubular puede ocasionar lesiones en la célula tubular y en el intersticio renal. Nuestro objetivo fue evaluar la posible relación entre SS urinaria de OxCa y el daño tubulointersticial (TI) en un modelo animal de hiperoxaluria. Durante cuatro semanas, ratas Sprague-Dawley machos, divididas en dos grupos recibieron: grupo 1 Control [G1], (n= 8) agua, grupo 2 [G2], (n = 8) etilenglicol (ETG) al 1% en el agua de beber. La SS urinaria de OxCa se valoró mediante el PAI del OxCa. Las lesiones TI se analizaron al finalizar el estudio por microscopía óptica e inmunohistoquímica. El G2 (ETG) presentó valores mayores (p< 0.01) de: a) oxaluria; b) SS urinaria de OxCa; c) score de cristaluria; d) proteinuria; y menor (p< 0.01) valor de clearance de creatinina, en relación al grupo control (G1). El estudio anatomopatológico mostró en el G2 (ETG) lesiones TI caracterizadas por mayor (p< 0.01) score de: a) atrofia tubular; b) infiltrado inflamatorio (macrófagos / monocitos); c) depósitos de cristales; d) fibrosis intersticial; e) a-actina de músculo liso intersticial; f) colágeno tipo III; g) TGFb1 TI, en comparación al G1 (control). En las ratas del G2 (ETG), la SS urinaria de OxCa se correlacionó con la mayor parte de los parámetros de daño TI evaluados, especialmente con el score de fibrosis intersticial. El infiltrado inflamatorio y la SS urinaria de OxCa fueron las variables más significativas que se relacionaron con fibrosis intersticial. En síntesis, teniendo en cuenta que los animales hiperoxalúricos presentaron mayor SS urinaria de OxCa asociada a mayor daño TI, los resultados de este estudio sugieren un estrecho vinculo entre la SS urinaria de OxCa y el daño TI. Estos datos indicarían que el control de la SS urinaria de OxCa en los estados de hiperoxaluria adquiere importancia más allá de la nefrolitiasis.
Palabras clave: Oxalato de calcio; Hiperoxaluria; Sobresaturación urinaria; Daño tubulointersticial; Sprague Dawley.
Abstract
Urinary calcium oxalate supersaturation beyond nephrolithiasis. Relationship with tubulointerstitial damage. A number of studies have demonstrated that the urinary ion activity product (IAP) of calcium oxalate (CaOx), as an index of urinary CaOx supersaturation (SS), is higher in renal stone formers than in normal subjects. Besides, the relation between CaOx SS and lithogenesis, crystal CaOx exposition can produce tubular cell as well as renal interstitial lesions. The aim of our study was to evaluate the possible relationship between CaOx SS and tubulointerstitial (TI) damage in an animal model of hyperoxaluria. During four weeks, male Sprague-Dawley rats received: G1 (n=8) control regular water, and G2 (n= 8) 1% ethylene glycol (ETG) (precursor for oxalates) in drinking water. In order to evaluate urinary CaOx SS, IAP assessed by Tisselius formula was performed. At the end of the study, renal lesions were evaluated by light microscopy and immunohistochemistry. Animals from G2 (ETG) presented higher (p< 0.01) values of: a) urinary oxalate excretion; b) urinary CaOx SS; c) crystalluria score; d) proteinuria; and lower (p< 0.01) creatinine clearance, with respect to the control group (G1). Moreover, pathology studies showed that rats from G2 (ETG), presented significant TI lesions characterized by a higher (p< 0.01) score of: a) tubular atrophy; inflammatory infiltrates (monocyte / macrophage); c) crystal deposits; d) intersticial fibrosis; e) interstitial a-smooth muscle actin; f) collagen type III; g) TI TGFb1 compared with G1 (control). Rats from G2 (ETG) presented a high correlation between urinary CaOx SS and most of the TI damage parameters evaluated, in especial with interstitial fibrosis. Both, inflammatory infiltrates and urinary CaOx SS were the most significant variables related to interstitial fibrosis. Finally, since hyperoxaluric animals showed higher urinary CaOx SS associated with higher renal TI damage, the results from this study suggest the presence of a tight link between urinary CaOx SS and renal TI damage. Considering these findings we think that urinary CaOx SS control rises in importance beyond nephrolithiasis.
Key Words: Calcium oxalate; Hyperoxaluria; Urine supersaturation; Ion activity product; Tubulointerstitial damage; Sprague Dawley rats.
La baja solubilidad del oxalato de calcio (OxCa) se modifica escasamente en el rango fisiológico del pH urinario. A raíz de esta limitada solubilidad no es sorprendente que la orina humana esté frecuentemente sobresaturada con respecto al OxCa, lo cual favorece la nucleación y el crecimiento de este cristal1. Si bien las primeras etapas en la formación de los cálculos renales son aún desconocidas, la endocitosis del cristal y las subsecuentes respuestas celulares pueden ser pasos patogénicos importantes en la nefrolitiasis2. Tanto la adhesión a las células como su internalización son eventos dependientes de la concentración del cristal y del tiempo de exposición3. El "pool" metabólico de oxalato proviene de la absorción intestinal y de la producción endógena; esta última proporciona el 60-85% del oxalato excretado diariamente en la orina. Los dos substratos principales son el ácido ascórbico y el glioxalato. Una vez que el oxalato es absorbido del lu-men intestinal o producido metabólicamente, es excretado sin cambios en la orina. El oxalato circulante se filtra libremente por los glomérulos y posteriormente experimenta una secreción tubular neta a nivel del túbulo proximal. Diversos estudios han demostrado que los pacientes formadores de cálculos y sujetos normales pueden ser diferenciados en términos de sobresaturación (SS) urinaria respecto al OxCa4-6. Así, el producto de la actividad iónica de OxCa es mayor en forma-dores de cálculos que en sujetos normales. Más allá de la conocida relación entre SS urinaria del OxCa y litogénesis, por otra parte, la exposición de OxCa al epitelio tubular puede desarrollar lesiones tubulointersticiales tanto en corto como en largo plazo, como ha sido oportunamente demostrado en ratas hipero-xalúricas7,8. Teniendo en cuenta este último concepto el objetivo de nuestro estudio fue evaluar la posible relación entre SS urinaria de OxCa y el daño tubulointersticial en un modelo experimental de hiperoxaluria.
Materiales y métodos
Diseño del estudio
Se utilizaron ratas Sprague-Dawley machos con un peso inicial de 250-280 g, provenientes del bioterio de la Facultad de Ciencias Veterinarias de la Universidad Nacional de La Plata (cepa exocriada cuyos progenitores provienen de Charles River, USA). Los animales permanecieron en jaulas individuales de acero inoxidable (La Técnica-Argentina) en el bioterio del Laboratorio de Medicina Experimental del Hospital Alemán, con una temperatura constante de 21 ± 2 °C. El ciclo día/noche es de 12 horas (7.00am-7.00pm). Para la recolección de orina de 24 horas se utilizaron jaulas metabólicas (Nalge Co., Rochester, NY). Para la anestesia se empleó tiopental sódico 40 mg/Kg intraperitoneal. Las muestras de sangre se tomaron de la arteria aorta previo al sacrificio del animal. Todos los animales utilizados fueron sacrificados al finalizar el experimento siguiendo las normas de American Physiological Society.
Diseño experimental
Luego de un período de estabilización de 7 días los animales fueron separados en dos grupos y durante cuatro semanas fueron tratados con el siguiente esquema:
Durante cuatro semanas, el grupo 1 Control [G1], (n= 8) recibió alimento estándar (Cooperación- Argentina) y agua corriente, ambos «ad libitum». En el grupo 2 [G2], (n = 8) se utilizó en el agua de beber un precursor del ácido oxálico, el etilenglicol (ETG) (Mallinckrodt, Germany) a una concentración del 1% y alimento estándar (Cooperación- Argentina), ambos «ad libitum».
Medición de la presión arterial
La presión arterial sistólica (PAS) fue registrada en el período basal y al finalizar el experimento por el método indirecto denominado «tail cuff plethysmography» con el animal consciente ubicado en un «restrainer» térmico. El procedimiento consta en la colocación de un transductor neumático de pulso en la superficie de la cola del animal distal a la oclusión del manguito para detectar el retorno del latido del pulso luego de la deflación. La PAS fue así determinada mediante un Pneumatic Pulse Transducer, utilizando un programmed electro-sphygmoma-nometer PE-300 (Narco Bio-Systems, Austin, Texas), y el pulso registrado en un physiograph MK-IIIS (Narco Bio-Systems, Austin, Texas). Un mínimo de tres determinaciones fue tomado en cada sesión y el promedio de éstas fue informado como PAS.
Procedimientos bioquímicos
Oxalato y citrato se determinaron por método enzimático (Sigma Diagnostics, St. Louis, MO). Calcio y magnesio por el método estándar utilizando absorción atómica. La proteinuria se determinó mediante el método estándar. Alícuotas de orina fueron centrifugadas a 2000 r.p.m. durante cinco minutos para cuantificar cristaluria. Los cristales de OxCa se identificaron utilizando un microscopio con luz polarizada y contraste de fase, cuantificando en 10 campos microscópicos por muestra, examinados a una magnificación de 400x. La cristaluria se evaluó según el siguiente esquema: 0= sin cristales/campo; 1= < 10 cristales/campo; 2= 10 a 25 cristales/campo, 3= 26 to 50 cristales/campo; y 4= > 50 cristales/campo. Para la determinación de creatinina se utilizó el método U-V, (Randox Laboratories Ldt., Crumlin, N. Ireland), mientras que el clearance creatinina se calculó mediante la fórmula estándar.
Con la intención de estimar la SS urinaria respecto al OxCa se determinó el producto de actividad iónica (PAI) del OxCa utilizando la fórmula de Tisselius5.

Donde V es el volumen urinario de 24hs.
Estudio anatomopatológico
Microscopía óptica
Los riñones fueron perfundidos por cateterización de la aorta abdominal con solución fisiológica hasta que el parénquima presentó aspecto pálido. Ambos riñones fueron extraídos, pesados y medidos. Los riñones, luego de remover la cápsula renal y grasa perirrenal, fueron seccionados longitudinalmente y se mantuvieron en una solución de formol 10% con buffer fosfato (pH 7.2). Luego se procesaron en forma convencional, recibiendo un tratamiento de deshidratación con alcoholes en graduación creciente y posterior aclaramiento con xilol. Posteriormente fueron incluidos en parafina para el estudio de microscopía óptica e inmunomarcación. Se efectuaron secciones de tres micrones y luego de sucesivos pasos que se describen más adelante, fueron coloreadas con hematoxilina-eosina (H&E) y con tricrómico Masson (TM).
Inmunohistoquímica
Luego de desparafinar las secciones histológicas con xilol durante 10 minutos, se hidrataron con lavados en alcohol 100° y alcohol 96°. Las secciones fueron expuestas a una solución de peróxido de hidrógeno al 30% en metanol durante 20 minutos para bloquear la actividad de la peroxidasa endógena y fueron lavadas con PBS durante unos minutos. Luego se trataron con una proteína bloqueante, (Immunotech, Ultratech, France); se incubaron con el primer anticuerpo específico. A continuación se realizaron lavados con PBS-Tritón y posteriormente se hicieron incubaciones durante 30 minutos con un anticuerpo secundario polyvalent biotinylated antibody, (Immunotech, Ultratech HRP kit, France). Se realizaron dos lavados de 10 minutos con PBS-Triton; se incubaron durante 30 minutos con un anticuerpo terciario streptavidin-peroxidase, (Immunotech, Ultratech HRP kit, France). Se realizaron dos lavados de 10 minutos con PBS. Para revelar se utilizó el cromógeno DAB (3,3´-diamino-benzidine, Sigma) en PBS y agua oxigenada al 30%, durante 5 minutos. Se lavaron dos veces con agua destilada y se colorearon posteriormente con hematoxilina durante 3 minutos. Se lavaron con agua y luego con carbonato de litio para producir el viraje al color azul. Se deshidrataron utilizando soluciones crecientes de alcohol. Se aclararon con xilol y se montaron sobre un portaobjetos utilizando un bálsamo adherente.
En tejido renal se cuantificó a-actina de músculo liso (a-SMA) utilizando un anticuerpo monoclonal anti-ratón a- SMA, (Sigma Chemical Co., St. Louis, MO). Con la intención de cuantificar colágeno tipo III (Col III), se empleó un anticuerpo monoclonal anti-Col III (Biogen, San Román, CA). El trans-forming growth factor b1 (TGF b1) fue evaluado utilizando un anticuerpo policlonal anti-ratón (Santa Cruz Biotechnology, Inc., Santa Cruz, CA).
A su vez macrófagos y monocitos se identificaron mediante un anticuerpo monoclonal de ratón anti-rata ED1 (Serotec, Ltd, Oxford, UK) en una dilución 1:300 en PBS (pH 7.2-7.6).
Análisis morfológico
El análisis morfológico se realizó sobre diez campos microscópicos consecutivos por muestra examinados a una magnificación de 100x, promediándose los datos. Al realizar este procedimiento el observador desconocía qué grupo estaba evaluando. Se analizó: 1) atrofia tubular; 2) células ED1 (monocitos / macrófagos); 3) depósitos de cristales de OxCa; 4) fibrosis intersticial; 5) expresión de a-SMA tubulointersticial; 6) expresión de Col III, y 7) expresión de TGF b1 tubuloin-tersticial. De acuerdo al siguiente esquema se cuantificó la severidad de las lesiones: 0= ausente; 1= leve (comprometiendo < 25% de cada campo microscópico); 2= moderada (> 26% y < 50%); 3= severa (>51% y < 75%), y 4= muy severa (> 76%).
Métodos estadísticos
Los valores se expresaron como media ± DS. Todos los cálculos del análisis estadístico fueron procesados con el programa Instat, versión 3.0 (GraphPad Software, Inc., San Diego, California, USA). El método de Kolmogorov & Smirnov se empleó como test para determinar si la distribución de las muestras era «gaussiana» en los distintos parámetros evaluados. Para aquellas variables con distribución gaussiana, las diferencias entre los valores de las medias, del período basal y al finalizar el experimento, fueron evaluadas por la prueba t de Student para muestras no apareadas. El análisis estadístico de las variables como los datos histológicos que presentan una distribución no-gaussiana fue realizado utilizando el test no paramétrico de Mann-Whitney.
Los coeficientes de Spearman o de Pearson se utilizaron para determinar la correlación lineal entre los diferentes parámetros medidos cuando fue necesario. Se realizó análisis de regresión múltiple en el grupo que recibió ETG 1% (G2) entre SS urinaria de OxCa; score de cristaluria; score de ED1; score de a-SMA; score de Col III y score de TGF b1, utilizando como variable dependiente score de fibrosis intersticial. El valor de p < 0.05 fue considerado como significativo.
Resultados
En el período basal no se encontraron diferencias significativas entre los grupos en relación a peso, PAS, pH urinario, excreción urinaria de oxalato, calcio, magnesio, citrato, proteínas, así como el PAI y clearance de creatinina. A su vez el score de cristaluria fue considerablemente bajo y similar en ambos grupos. El consumo de agua promedio en cada grupo durante las cuatro semanas del experimento fue el siguiente: G1 (control)= 27.4 ± 3 ml/día; G2 (ETG) = 27.6 ± 2.8 ml/día (p = no significativo).
Al finalizar el estudio, los animales del G2 (ETG) presentaron una significativa mayor excreción de oxalato urinario (Tabla 1). Por otra parte, no se apreciaron diferencias significativas entre los grupos en relación al peso corporal, diuresis, PAS, pH urinario, así como en la concentración del citrato y magnesio urinario (Tabla 1). Por su parte, las ratas del G2 (ETG) presentaron una marcada disminución en la excreción urinaria de calcio al compararlas con sus controles (G1), como se puede observar en la Tabla 1.

Con relación a la SS urinaria con respecto al OxCa, el G2 (ETG) presentó un PAI significativamente mayor al de los animales del G1 (control). Además y consecuentemente con este dato, las ratas del G2 (ETG) evidenciaron un score de cristaluria también superior al de las ratas control (G1), como se ilustra en la Tabla 1. Los animales pertenecientes al G2 (ETG) mostraron una incremento significativo (p< 0.01) en la excreción urinaria de proteínas además de valores de clearance de creatinina menores al compararlos con los del G1 (control), Tabla 1.
El estudio anatomopatológico mostró que los animales del G2 (ETG) presentaron acúmulo de cristales de OxCa en forma difusa dentro del lumen tubular así como también dentro de las células del epitelio tubular y en el intersticio renal, tanto en médula como en corteza.
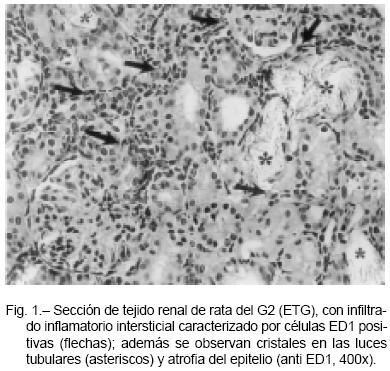
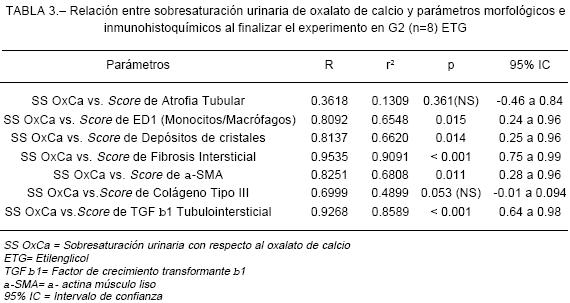
Además, este grupo (G2) evidenció infiltrado de células inflamatorias caracterizado por la presencia de macrófagos y monocitos (células con marcación positiva para ED1), ilustrado en la Figura 1, atrofia tubular y fibrosis intersticial en corteza y médula. Todos estos parámetros morfológicos fueron cuantificados mediante sus respectivos scores siendo significativamente mayores (p< 0.01) a los observados en el G1 (control), (Tabla 2). Mediante inmunomarcación se pudo demostrar que los animales del G2 (ETG) presentaban un incremento significativo (p< 0.01) de a-SMA a nivel peritubular, junto a una mayor proporción de Col III y TGF b1 tanto en el intersticio como en las células tubulares (figuras 2, 3, 4 y tabla 2), con respecto al grupo control (G1). Cabe mencionar que las ratas del G2 (ETG) presentaron una alta correlación lineal positiva entre el SS urinaria respecto al OxCa y la mayor parte de los parámetros de daño tubulointersticial evaluados, destacándose la relación entre SS urinaria de OxCa y el score de fibrosis intersticial (Tabla 3). Por otra parte, el análisis de regresión múltiple demostró que el infiltrado inflamatorio (ED1) y la SS urinaria respecto al OxCa fueron las variables más significativas que se relacionaron con fibrosis intersticial (Tabla 4).





Discusión
En este estudio se pudo observar que los animales que recibieron ETG (G2) mostraron una excreción urinaria de oxalato, score de cristaluria y PAI con respecto al OxCa, significativamente mayores a los del grupo control (G1). Además, los primeros presentaron menor clearance de creatinina y mayor proteinuria. Consecuentemente, este mismo grupo evidenció un substancial daño tubulointersticial expresado por infiltrado inflamatorio y fibrosis del intersticio renal. El análisis de correlación demostró en las ratas hiperoxalúricas (G2) una relación lineal altamente significativa entre el estado de SS urinaria con respecto al OxCa y los diferentes parámetros de daño tubulointersticial.
A partir de diferentes series publicadas ha quedado demostrado que la mayoría de los cálculos de calcio contienen OxCa, ya sea como sal pura o en combinación con fosfato de calcio. Es un hecho conocido que la orina está frecuentemente SS con respecto al OxCa tanto en pacientes con enfermedad litiásica como en aquellos sujetos normales, de allí que es común observar cristales de OxCa en la orina aun sin enfermedad litiásica.
Los primeros pasos de formación de cálculos renales ocurren dentro del riñón cuando la orina está sobresaturada con OxCa en diferentes sectores del nefrón. Se ha podido demostrar a nivel experimental que existen diferentes niveles de saturación de las sales de calcio en los túbulos renales4. Cuando se considera la composición promedio de la orina a diferentes niveles del nefrón, es evidente que en el túbulo proximal, como también en las partes proximales y distales del túbulo distal, las fuerzas de cristalización están a favor de las fases de fosfato de calcio. Lo mismo es cierto para el asa de Henle, en la cual ha sido registrado que la sobresaturación con respecto a las fases de fosfato de calcio son aun mayores que aquellas observadas en el túbulo proximal y en las partes proximales y distales del túbulo distal.
A medida que la orina se vuelve más concentrada por el proceso de sustracción de agua en el conducto colector, el pH de la orina cae y hay un cambio de la fuerza de cristalización desde las fases de fosfato de calcio a OxCa. Esto es posible debido a que el fluido en el segmento fino del asa de Henle puede estar sobresaturado con carbonato de calcio y fosfato de calcio bajo ciertas condiciones. La porción descendente del asa de Henle crea una condición única, ya que extrae agua pero no sodio, bicarbonato, calcio o fosfato, dando una concentración de calcio en la curva del asa de Henle de 3 mM, un pH de 7.4 y una concentración de fosfato que varía de 0.8 a 48 mM9, dependiendo de la secreción de hormona paratiroidea y del fosfato dietario. Por otra parte, un mecanismo importante para la sobresaturación elevada del cristal de OxCa monohidrato en orina es la extracción de agua en los túbulos colectores renales que incrementa las concentraciones de calcio y oxalato. Por lo tanto, las condiciones en el segmento fino del asa de Henle, pueden crear una fase de fosfato de calcio sólido, que puede iniciar la nucleación de sales de oxalato de calcio en los conductos colectores, potenciando así la nefrolitiasis.
Por otra parte, con respecto ya no al rol estrictamente litogénico del OxCa, sino en relación a la toxicidad sobre la célula tubular y compromiso intersticial, datos experimentales han demostrado que concentraciones altas de oxalato dentro de la célula epitelial tubular son tóxicas generando un incremento en la producción de radicales libres y lipoperoxidación10,11.
Además, es reconocido que los estados hiperoxalúricos están asociados con el depósito de cristales de OxCa tanto en la luz tubular como en la célula epitelial del intersticio renal promoviendo el citado mecanismo de injuria tisular12-16.
Una alta concentración de oxalato dentro de la célula tubular estimula la producción de radicales libres ocasionando lesión por varios mecanismos: a) actuando como precursor en la generación de metabolitos reactivos, b) alterando la función mitocondrial, c) modificando la actividad de varias enzimas citosólicas, y d) inhibiendo enzimas secuestradoras de radicales libres17.
Adicionalmente, la hipoxia ocasionada por la injuria y pérdida de capilares peritubulares debido al daño intersticial y por la expansión de matriz extracelular en el intersticio, puede contribuir a la sobreproducción de las especies reactivas del oxígeno (ROS), especialmente una situación de alta actividad metabólica como es la sobrecarga de oxalato a la célula tubular. Además, un origen adicional de las ROS es el infiltrado de macrófagos y monocitos el cual se encuentra presente en esta situación18.
La inflamación progresiva del intersticio renal conduce generalmente a una disminución considerable en la función renal. Por otra parte, la presencia de protei-nuria, hecho no infrecuente en patología tubulointersticial, es un reconocido factor que estimula y perpetúa la respuesta inflamatoria en el intersticio renal19,20. Se debe destacar que en nuestro estudio se pudo apreciar claramente que los animales hiperoxalúricos poseían mayor score de fibrosis intersticial, menor clea-rance de creatinina y una significativa mayor excreción de proteínas en orina. Este hecho ha sido observado no sólo en el experimento actual sino también en otros modelos de daño tubulointersticial como el de nefropatía por ácido úrico21. Los mecanismos involucrados en el daño renal progresivo, fundamentalmente la fibrosis, han sido investigados por varios autores y existen evidencias que indican que la injuria tubulointersticial primaria o secundaria se correlaciona mejor que las alteraciones glomerulares con la disminución de la función renal22-25. Estudios de correlación estructural y funcional muestran una estrecha relación entre la fibrosis intersticial, atrofia tubular y pérdida de capilares peritubulares, lo cual sugiere una probable vinculación fisiopatogénica entre los tres fenómenos y explicaría por qué el grado de fibrosis es el principal determinante del deterioro de la función renal26.
Diversos estudios basados en la correlación altamente significativa entre el número de macrófagos intersticiales y el deterioro de la función renal, han demostrado que estas células desempeñan un rol importante como mediadores y en la regulación de la respuesta fibrogénica a la injuria27,28. En nuestro estudio, los animales hiperoxalúricos (G2) evidenciaron un notorio componente inflamatorio intersticial caracterizado por macrófagos y monocitos (células ED1 positivas) que junto a la SS urinaria respecto al OxCa fueron las variables más significativas que se relacionaron con fibrosis intersticial. Por otra parte, la liberación de factores de crecimiento y citoquinas por células tubulares e intersticiales residentes o infiltrantes, genera señales que pueden traducirse en activación y/o proliferación de dichas células, así como también en modificación de la cantidad y composición de la matriz extracelular. Estos procesos pueden ser de suma importancia en la amplificación, progresión o resolución del daño renal29-32.
Un evento central en la reparación de tejido es la liberación de citoquinas en respuesta a la lesión. Varias líneas de evidencia apuntan al TGF-b1 como una citoquina clave que inicia y termina la reparación del tejido y cuya producción sostenida está implicada en el desarrollo de la fibrosis tisular33,34. En la reparación del tejido normal, la producción de TGF-b1 y de matriz extracelular es un proceso a terminar. Por el contrario, situaciones de injuria tisular sostenida conducen a una sobrexpresión del TGF-b1. En respuesta a la lesión, el TGF-b1 está aumentado y estimula la síntesis de componentes de la matriz incluyendo colágenos, fibronectina y proteoglicanos, estimula la síntesis y expresión de integrinas a nivel de la superficie celular, y aumenta la síntesis del inhibidor del activador de plaminógeno, disminuyendo la degradación de la matriz35-37. Por otra parte, durante la inflamación crónica en el riñón, los fibroblastos, que aportan además al medio TGF-b1, constituyen un componente celular de gran importancia. Algunos de ellos sufren un proceso de transdiferenciación denominándose miofibroblasto, y adquieren características morfológicas y bioquímicas de células del músculo liso, expresando en su citoplasma a-SMA38-40. En el presente experimento, los animales pertenecientes al grupo hiperoxalúrico (G2), mostraron un significativo incremento en la inmunomarcación intersticial para TGF-b1 junto a mayor score de a-SMA intersticial (marcador de miofibroblastos) correlacionándose además ambas variables con la SS urinaria respecto a OxCa en forma altamente significativa. Este hecho sugiere cierta relación en el estado de SS urinaria para el OxCa y una respuesta humoral y celular tubulointersticial a la sobrecarga oxalocálcica.
Finalmente, sobre la base de estos resultados, concluimos que en los animales hiperoxalúricos la SS urinaria con respecto al OxCa se asoció con un significativo daño tubulointersticial. Considerando que la litiasis oxalocálcica es la causa más frecuente de nefrolitiasis, creemos que este estudio enfatiza la importancia de controlar esta enfermedad, más allá de su aspecto estrictamente litogénico
Agradecimientos: Los autores desean agradecer a la Sra. Ana Uceda y la Srta. Mariana Feldman por su asistencia técnica correspondiente al cuidado animal y su colaboración durante los experimentos.
1. Toblli JE. Hiperoxalurias en: Litiasis renal. Ed. Jorge E. Toblli, Juan M. Ghirlanda & Carlos Gigler. El Ateneo, Buenos Aires. 1996, pp 97-116 [ Links ]
2. Lieske J, Toback G. Interaction of urinary crystals with renal epithelial cells in the pathogenesis of nephrolithiasis. Sem Nephrol 1996; 16: 458-73. [ Links ]
3. Lieske J, Toback G, Deganello S. Direct nucleation of calcium oxalate dihydrate crystals onto the surface of living renal epithelial cells in culture. Kidney Int 1998; 54: 796-803. [ Links ]
4. Tiselius HG, Hojgaard I. Some aspects of the intratubular precipitation of calcium salts. J Am Soc Nephrol 1999; 10: S371-S375. [ Links ]
5. Tiselius H. An improved method for the routine biochemical evaluation of patients with recurrent calcium oxalate stone disease. Clin Chim Acta 1982; 122: 409-18. [ Links ]
6. Tiselius HG, Bek-Jensen H, Fornander AM, Nilsson MA. Crystallization properties in urine from calcium oxalate stone formers. J Urol 1995; 154: 940-6. [ Links ]
7. Toblli JE, Ferder L, Angerosa M, Inserra F. Effects of amlodipine on tubulointerstitial lesions in normotensive hyperoxaluric rats. Hypertension 1999; 34 (part 2): 854-8. [ Links ]
8. Toblli JE, Ferder L, Stella I, Angerosa M, Inserra F. Protective role of enalapril for chronic tubulointerstitial lesions of hyperoxaluria. J Urol 2001; 168: 275-80. [ Links ]
9. Asplin J, Mandel N, Coe F. Evidence for calcium phosphate supersaturación in the loop of Henle. Am J Physiol 1996; 270: F604-F613. [ Links ]
10. Scheid C, Koul H, Hill W, et al. Oxalate toxicity in LLC-PK1 cells, a line of renal epithelial cells. J Urol 1996; 155: 1112-6. [ Links ]
11. Thamilselvan S, Hackett RL, Khan SR. Lipid peroxidation in ethylene glycol induced hyperoxaluria and calcium oxalate nephrolithiasis. J Urol 1997; 157: 1059-63. [ Links ]
12. Lieske JC, Spargo BH, Toback FG. Endocytosis of calcium oxalate crystals and proliferation of renal tubular epithelial cells in a patient with type 1 primary hiperoxaluria. J Urol 1992; 148: 1517-9. [ Links ]
13. Lieske JC, Deganello S, Toback G. Cell-crystal interac-tions and kidney stone formation. Nephron 1999; 81 Suppl 1: S8-S17. [ Links ]
14. Water R, Noodermeer C, Kwast T, et al. Calcium oxalate nephrolithiasis: Effect of renal crystal deposition on the cellular composition of the renal interstitium. Am J Kidney Dis 1999; 33: 761-71. [ Links ]
15. Toblli JE, Cavanagh EMV, Fraga CG, Angerosa M, Ferder L, Inserra F. Protective effect of high doses of losartan on tubulointerstitial lesions in hyperoxaluric rats. J Am Soc Nephrol 1999; 10: 539A (Abstract). [ Links ]
16. Toblli JE, de Cavanagh EMV, Angerosa M, Fraga C, Ferder L, Inserra F. Enalapril enhances antioxidant defenses in renal tissue in rats with hiperoxaluria. Am J Kidney Dis 2000; 35: A27(Abstract). [ Links ]
17. Scheid C, Koul H, Hill WA, et al. Oxalate toxicity in LLC-PK1 cells: Role of free radicals. Kidney Int 1996; 49: 413-9. [ Links ]
18. Toblli JE, Stella I, Angerosa M, Ferder L, Inserra F. Mo-nocyte/macrophage infiltration in the renal interstitium of hyperoxaluric rats treated with enalapril and losartan. J Am Soc Nephrol 1998; 9: 487A (Abstract). [ Links ]
19. Ruggenenti P, Remuzzi G. The role of protein traffic in the progression of renal diseases. Annu Rev Med 2000; 51: 315-27. [ Links ]
20. Burton C., Harris K. The role of proteinuria in the progre-ssion of chronic renal failure. Am J Kiney Dis 1996; 27: 765-75. [ Links ]
21. Toblli JE, DeRosa G, Lago N, Angerosa M, Nyberg C, Pagano P. Potassium citrate administration ameliorates tubulointerstitial lesions in rats with uric acid nephropathy. Clin Nephrol 2001; 55: 59-68. [ Links ]
22. Bohle A, Gise H., Macdensen-Haen S, Stark-Jacob B. The obliteration of the postglomerular capillaries and its influence upon the function of both glomeruli and tubuli. Functional interpretation of morfologic findings. Klin Wochen 1981; 59: 1043-51. [ Links ]
23. Bohle A, Macdensen-Haen S, Gise HV. Significance of tubulointerstitial changes in the renal cortex for the excretory function and concentration ability of the kidney. A morphometric contribution. Am J Nephrol 1987; 7: 421-43. [ Links ]
24. Kuncio GS, Neilson EG, Haverty T. Mechanisms of tubulointerstitial fibrosis. Kidney Int 1991; 39: 550-6. [ Links ]
25. DAmico G. Tubulointerstitium as predictor of progression of glomerular diseases. Nephron 1999; 83: 289-95. [ Links ]
26. Bohle A, Müller GA, Wehrmann M, Mackensen-Haen S, Xiao JC. Pathogenesis of chronic renal failure in the primary glomerulopathies, renal vasculopathies, and chronic interstitial nephritides. Kidney Int 1996; 49 Suppl 54: S2-S9. [ Links ]
27. Van Goor H, King G, Kees-Folts D, Ground J, Schrieiner GF, Diamond JR. Macrophages and renal disease. Lab Invest 1994; 71: 456-64. [ Links ]
28. Atkins RC. Macrophages in renal injury. Am J Kidney Dis 1998; 31: 345-56. [ Links ]
29. Rastegar A, Kashgarian M. The clinical spectrum of tubulointerstitial nephritis. Kidney Int 1998; 54: 313-27. [ Links ]
30. Fogo A, Ichikawa I. Evidence for the central rol of glo-merular growth promoters in the development of sclerosis. Sem Nephrol 1989; 9: 329-42. [ Links ]
31. El Nahas AM. Growth factors and glomerular sclerosis. Kidney Int 1992; 41 Suppl 36: S15-S20. [ Links ]
32. Benigni A, BiolSciD, Remuzzi G. How renal cytokines and growth factors contribute to renal disease progression. Am J Kidney Dis 2001; 37 Suppl 2: S21-S24. [ Links ]
33. Border WA, Ruoslahti E. Transforming growth factor-b in disease: The dark side of tissue repair. J Clin Invest 1992; 90: 1-7. [ Links ]
34. Border WA, Noble NA. TGF-b in kidney fibrosis: A target for gene therapy. Kidney Int 1997; 51: 1388-96. [ Links ]
35. Wolf G. Vasoactive factors and tubulointerstitial injury. Kidney Blood Press Res 1999; 22: 62-70. [ Links ]
36. Sharma K, Ziyadeh FN. Emerging role of transforming growth factor-b in kidney diseases. Am J Phisiol 1994; 266: F829-F842. [ Links ]
37. Toblli JE, Stella I, de Cavanagh EMV, Angerosa M, Inserra F, Ferder L. Enalapril prevents tubulointerstitial lesions by hyperoxaluria. Hypertension 1999; 33: 225-31. [ Links ]
38. Sappino AP, Schurch W, Gabbiani G. Differentiation repertoire of fibroblastic cells: Expression of cytoskeletal proteins as marker of phenotypic modulation. Lab Invest 1990; 63: 144-61. [ Links ]
39. Zhang J, Moorhead PJ, El Nahas AM. Myofibroblasts and the progression of experimental glomerulonephritis. Exp Nephrol 1995; 3: 308-18. [ Links ]
40. Schürch W, Seemayer TA, Gabbiani G. The myofibroblast. Am J Surg Pathol 1998; 22: 141-7. [ Links ]
Recibido: 20 de agosto de 2002
Aceptado: 8 de octubre de 2002














