Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.63 n.2 Buenos Aires mar./abr. 2003
Mielitis aguda necrotizante en un paciente con Sida
M. Corti, I. Soto, M. F. Villafañe, B. Bouzas, J. M, Duarte, C. Yampolsky, R. Schtirbu
Unidad 10, Laboratorio de Virología y Servicio de Anatomía Patológica, Hospital de Infecciosas Francisco J. Muñiz, Buenos Aires
Dirección postal: Dr. Marcelo Corti, Puán 381, 1406 Buenos Aires, Argentina.
E-mail: marcelocorti@ciudad.com.ar
Resumen
Como consecuencia de la infección por el virus de la inmunodeficiencia humana tipo-1 (HIV-1), otros patógenos como citomegalovirus (CMV) y herpes simple tipo 1-2 (HSV 1-2) pueden comprometer tanto el sistema nervioso central como el periférico. Estos agentes pueden involucrar también a la médula espinal y causar una mielitis aguda necrotizante. Esta complicación ocurre por lo general en pacientes con enfermedad HIV/sida avanzada y marcada inmunodeficiencia, con recuentos de linfocitos T CD4+ de menos de 50 cél/µL. El cuadro clínico, los cambios en el LCR y las neuroimágenes generan una importante sospecha diagnóstica. Es fundamental el inicio precoz de la terapia antiviral específica. Se presenta un paciente con enfermedad avanzada debida al HIV-1 y mielitis aguda necrotizante por CMV y HSV bajo la forma clínica de síndrome de la cola de caballo.
Palabras clave: HIV-1; Mielitis; CMV; HSV.
Abstract
Acute necrotizing myelitis in an AIDS patient. In the setting of HIV infection, cytomegalovirus (CMV) and herpes simplex virus type 1-2 (HSV 1-2) can affect both the central and peripheral nervous systems. These agents can involve the spinal cord and produce a necrotizing transverse myelitis. This usually occurs in AIDS patients with severe immunodeficiency: CD4 + lymphocyte counts typically are less than 50 cell/µL. The clinical presentation, CSF and imaging studies can provide a high level of suspicion diagnosis. Prompt initiation of antiviral specific drugs is essential. We report a patient with an acute necrotizing myelitis (cauda equina syndrome) secondary to CMV and HSV infections.
Key words: HIV; Myelitis; CMV; HSV.
Los pacientes con enfermedad debida al virus de la inmunodeficiencia humana tipo 1 (HIV-1) y síndrome de inmunodeficiencia adquirida (sida) presentan compromiso del sistema nervioso central (SNC), sistema nervioso periférico y sistema muscular en un 30% a 60% de los casos1. Estos porcentajes se incrementan hasta alcanzar el 80% en estudios anatomopatológicos2,3. El compromiso de la médula espinal incluye a la mielopatía vacuolar, que es la forma más habitual, con una incidencia del 30% en autopsias4, seguida de la mielitis con una frecuencia del 15%5. La mielitis aguda debida a virus de la familia herpes, especialmente citomegalovirus (CMV) y herpes simple (HSV), ha sido descrita en pacientes con sida y marcado deterioro inmunológico6.
Se presenta un paciente con sida y mielitis aguda necrotizante por CMV y HSV.
Caso clínico
Paciente varón de 28 años, con antecedentes de adicción a drogas endovenosas y serología positiva para HIV-1 desde el año 1998, sin tratamiento antirretroviral previo a su internación. Se internó por presentar dolor lumbar acompañado de parestesias dolorosas de miembros inferiores y dificultad para la marcha por disminución progresiva de la fuerza muscular en ambas piernas a predominio derecho, de 5 días de evolución. En el examen neurológico de ingreso presentaba paraparesia fláccida con anestesia en bota larga y nivel sensitivo en L1, que a las 48 horas había evolucionado a paraplejía fláccida grado 0 de la escala MRC (Medical Research Council rating scale), con respuestas plantares indiferentes, hipotrofia muscular, pérdida de la sensibilidad para todas las formas con nivel en L1 y compromiso del esfínter anal y vesical. El test de Siddam para la evaluación de las funciones mentales superiores permitió comprobar la existencia de un trastorno cognitivo menor asociado con el sida.
El examen semiológico evidenció además, la existencia de una úlcera perianal, de fondo granuloso, de evolución subaguda, con una fístula que eliminaba materia fecal y secreción purulenta. En el fondo de ojo se observan papilas de bordes netos, levemente congestivas, con exudados algodonosos y hemorragias bilaterales, compatible con retinitis por CMV. La punción lumbar al ingreso mostró un líquido turbio, hipertenso, con hiperproteinorraquia (1.6 g/L), hipoglucorraquia (42 g/dL) y pleocitosis de 20 cél/µL, con 73% de polimorfonucleares (PMN) y 27% de linfocitos. Las coloraciones de Gram, tinta china y Ziehl Neelsen fueron negativas, igual que la VDRL. La serología para HTLV I-II fue negativa y la carga viral plasmática fue de 250 000 copias/µL (5.4 en escala logarítmica), con 78.000 copias/µL (4.9 en escala logarítmica) en líquido cefalorraquídeo (LCR). El recuento de linfocitos T CD4+ fue de 43 cél/µL. La detección en LCR de DNA para herpesvirus, CMV, HSV 1 y 2, virus de Epstein Barr (EBV) y varicela-zoster, por reacción en cadena de la polimerasa (PCR), resultó negativa.
La serología para CMV fue negativa para anticuerpos de tipo IgM en suero y LCR y positiva para IgG en títulos mayores a 1/3200 en suero y 1/80 en LCR, compatible con síntesis intratecal de inmunoglobulinas anti CMV.
Se realizó resonancia nuclear magnética (RNM) de columna cérvico-dorso-lumbar que mostró lesión hiperintensa en T1 y T2 con leve captación del contraste a nivel del segmento D12 del cono medular en su mitad derecha, con área quística, probablemente hemorrágica (Fig.1). Los potenciales evocados somatosensitivos fueron anormales con deflexiones de mediana reproducibilidad y marcado retraso en el arribo cortical bilateral. De acuerdo con la evaluación del cuadro neurológico de mielopatía aguda, las neuroimágenes, la retinitis compatible con CMV, la úlcera mucocutánea crónica sugestiva de etiología herpética, y las alteraciones en el LCR con síntesis intratecal de anticuerpos anti CMV, se inició tratamiento con ganciclovir a la dosis de 5 mg/kg cada 12 horas más aciclovir a la dosis de 30 mg/kg/día por vía endovenosa.
A la quinta semana de internación, el cuadro neurológico permanecía sin cambios y ante la sospecha clínica de un linfoma se efectuó una biopsia de cono medular. Para tal fin se realizó laminectomía a nivel de D12-L1 y luego de abierta la duramadre se observó un engrosamiento del cono y epicono medular. Se efectuó mielotomía dorsal y se tomaron muestras de tejido patológico. No hubo complicaciones intraoperatorias ni en el posoperatorio atribuibles al procedimiento.
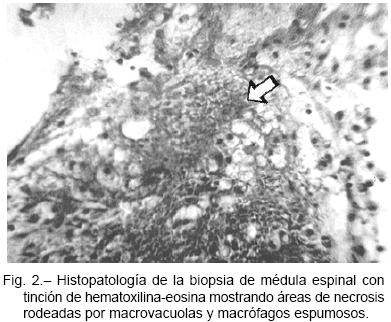
La histopatología demostró a nivel de la sustancia blanca la existencia de áreas de necrosis rodeadas por regular número de macrovacuolas y variable cantidad de macrófagos espumosos (Fig. 2). La PCR para herpesvirus en las muestras de tejido resultó positiva para CMV y herpes simple 1-2. El diagnóstico definitivo fue de mielopatía vacuolar asociada al HIV-1 más mielitis aguda necrotizante por CMV y HSV. El paciente completó 21 días de tratamiento específico, para luego recibir un esquema de profilaxis secundaria con ganciclovir a la dosis de 6 mg/kg cinco veces a la semana, más aciclovir 800 mg/día. Evolucionó con estabilidad clínico-neurológica, con leve mejoría para la rotación externa de ambos muslos (grado 2 de la escala MRC), y normalización de los parámetros del LCR en la punción lumbar efectuada a las tres semanas de tratamiento.

Discusión
Los herpesvirus son una causa importante de compromiso neurológico en los pacientes con sida. Mientras CMV, HSV 1-2 y varicela-zoster pueden causar encefalitis, meningitis, mielitis o polirradiculitis, el EBV se asocia fuertemente con la patogenia de los linfomas primarios del SNC7. La mielitis aguda necrotizante debida a CMV o HSV 1-2 como en el paciente que se presenta, tiene características muy similares desde el punto de vista clínico. Se trata de un cuadro de comienzo agudo con paraplejía fláccida, compromiso sensitivo con nivel, arreflexia e incontinencia urinaria y fecal. Los hallazgos del LCR semejan los de una meningitis bacteriana, con pleocitosis a predominio de PMN, proteínas elevadas e hipoglucorraquia8, alteraciones que se pudieron comprobar en el caso que se presenta. So y col9 evaluaron a 23 pacientes con sida y polirradiculitis lumbosacra aguda; nueve enfermos tuvieron cultivo positivo para CMV en LCR y 8 de ellos presentaron pleocitosis a predominio de PMN. Los autores sugieren que existe una fuerte asociación entre pleocitosis PMN en el LCR y polirradiculopatía por CMV. Para aclarar el diagnóstico puede ser de utilidad la detección del ADN de herpesvirus en el LCR por PCR. En este sentido, Quereda y col10 analizaron a 219 pacientes HIV positivos con síntomas neurológicos y una media de linfocitos T CD4+ de 25 cel/µL. Los autores detectaron ADN de herpesvirus por PCR en 93 (37%) de 251 muestras de LCR y en 74 (34%) de los 219 pacientes incluidos en esta investigación. En 13 casos se detectó amplificación del ADN para dos diferentes herpesvirus. La técnica resultó negativa en 102 de 115 muestras de LCR de pacientes con compromiso neurológico no relacionado con virus de la familia herpes. En esta serie, CMV fue el virus identificado con mayor frecuencia. Esta técnica parece más sensible que las manifestaciones clínicas, para el diagnóstico de la enfermedad neurológica asociada al CMV en pacientes con sida.
Arribas y col11 comprueban una significativa asociación entre el antecedente de infección diseminada por CMV y la detección de amplificación del ADN en el LCR de pacientes con síntomas neurológicos. De acuerdo con los autores, este hecho refleja la elevada prevalencia de infección por CMV en el SNC de los pacientes con sida.
Quereda y col10 detectaron 7 casos de amplificación del ADN de HSV en 219 pacientes (3%) y, en 4 con diagnóstico clínico de encefalitis, los autores obtuvieron PCR positiva para CMV y HSV, simultáneamente. Si bien el paciente que se presenta tuvo PCR negativa para CMV y HSV 1-2 en LCR, se pudo detectar la amplificación del ADN para ambos patógenos en las muestras de tejido medular, además de comprobar síntesis intratecal de anticuerpos anti CMV. Sauerbrei A. y col.12 analizaron 631 muestras de LCR en pacientes con diagnóstico clínico de encefalitis. Los autores detectaron secuencias de ADN de HSV-1 por PCR en 8 (1.3%) y de HSV-2 en 7 muestras (1.1%). Las muestras fueron obtenidas a los 7,3 días, en promedio, del inicio de los síntomas neurológicos. En relación con la síntesis intratecal de anticuerpos, los autores detectaron IgM específica anti HSV en 13 de 624 muestras (2.1%) e IgG en 12 (1.9%). En este caso, el tiempo promedio entre el inicio de la sintomatología neurológica y la obtención de las muestras fue de 34 días. Los autores señalan que la detección de síntesis intratecal de anticuerpos antiherpes representa un método indirecto de confirmación de la infección del SNC. En este sentido, todas las muestras del LCR en que se detectó síntesis intratecal de anticuerpos resultaron negativas para la PCR. Para explicar este hecho es importante tener en cuenta que los resultados de las pruebas diagnósticas, PCR y síntesis intratecal de anticuerpos específicos, dependen del momento en que se obtienen las muestras de LCR en relación con el inicio del cuadro neurológico. El ADN viral se detecta precozmente, cuando aún no puede comprobarse la síntesis intratecal de anticuerpos. Es decir, la PCR sería positiva dentro de los 10-14 días13 y la síntesis intratecal de anticuerpos se comprueba luego de transcurrido el período agudo, con valores máximos entre los 12 y 20 días, pero con persistencia de los mismos durante años14. La respuesta inmune intratecal podría estar ausente cuando el tratamiento antiviral específico se inicia precozmente.
El caso que se presenta tuvo además evidencias histopatológicas de mielopatía vacuolar. Esta complicación fue descrita por Petito y col2 en 20 pacientes fallecidos por sida. Su diagnóstico es histológico, pero puede sospecharse clínicamente, y se caracteriza por un proceso desmielinizante, de evolución subaguda a crónica, con vacuolización de los cordones laterales, posteriores o ambos, de la sustancia blanca medular11. Desde el punto de vista neurológico se trata de una paraparesia espástica progresiva con o sin incontinencia urinaria. Las alteraciones observadas en el estudio de potenciales evocados del paciente que se presenta, sugieren la existencia de una mielopatía vacuolar. El mecanismo fisiopatogénico no es bien conocido, pero lo más probable es que la agresión medular sea el resultado de la acción de citoquinas, en especial el factor a de necrosis tumoral, liberado por macrófagos activados como ocurre en la demencia, con la que coexiste en muchos pacientes2. Dada la semejanza de los cambios patológicos y clínicos observados en la mielopatía vacuolar con los de la mielopatía degenerativa subaguda asociada con el déficit de vitamina B12 o ácido fólico, también podría participar en la patogenia un trastorno metabólico. Chemouilli y col15 a partir de datos necrópsicos señalan que el cuadro clínico de la mielopatía vacuolar se presenta, por lo general, en la fase final del sida, pero pueden observarse lesiones anatomopatológicas en estadios más tempranos de la enfermedad. Petito y col2 dividen los hallazgos patológicos en tres grupos de acuerdo con la gravedad de la mielopatía; esta correlación entre manifestaciones clínicas y gravedad de los hallazgos histológicos ha sido confirmada en trabajos posteriores que señalan que las lesiones precoces podrían ser parcial o totalmente reversibles con tratamiento antirretroviral2-4.
Se considera que el paciente que se presenta tiene evidencias histológicas de mielopatía vacuolar y sobre esta complicación neurológica se instaló el cuadro de mielitis aguda por herpesvirus. Los hallazgos clínicos, neurológicos e histopatológicos confirman ambas etiologías.
1. Singh BM, Levine S, Yarrish RL, Hyland MJ, Jeanty D, Wormster GP. Spinal cord syndromes in the acquired immunodeficiency. Acta Neurol Scand 1986; 6: 590-8. [ Links ]
2. Petito K, Navia BA, Cho ES. Vacuolar myelopathy pathologically resembling subacute combined degeneration in patients with the acquired immunodeficiency syndrome. N Engl J Med 1985; 312: 874-9. [ Links ]
3. Jellinger KA, Setinek U, Drlicek M, Bohm G, Steurer A, Lintner F. Neuropathology and general autopsy findings in AIDS during 15 years. Acta Neuropathol (Berlín) 2000; 100: 213-20. [ Links ]
4. Tan SV, Guiloff RJ, Scaravilli F. AIDS vacuolar myelo-phaty: a morphometric study. Brain 1995; 118: 1247-61. [ Links ]
5. Henin D, Smith TW, De-Girolami U, Sughayer M, Hauw JJ. Neuropathology of the spinal cord in the acquired immunodeficiency syndrome. Hum Pathol 1992; 10: 1106-14. [ Links ]
6. Mosckowitz LB, Gregorios JB, Hensley GT, Berger JR. Cytomegalovirus-induced demyelination associated with acquired immunodeficiency syndrome. Arch Pathol Lab Med 1984; 108: 873-7. [ Links ]
7. Cinque P, Vago L, Dahl L, et al. Polymerase chain reaction on cerebrospinal fluid for diagnosis of virus-associated opportunistic diseases if the central nervous system in HIV- infected patients. AIDS 1996; 10: 951-8. [ Links ]
8. Jayaweera DT, Cassetti LI, Espinoza L, Lopardo GD, Hansman-Whiteman M, Scerpella EG. Polirradiculomie-lopatía causada por citomegalovirus en pacientes con sida. Medicina (Buenos Aires) 1998; 58: 135-40. [ Links ]
9. So YT, Olney KK. Acute lumbosacral polyrradiculopathy in acquired immunodeficiency syndrome: experience in 23 patients. Ann Neurol 1994; 35: 53-8. [ Links ]
10. Quereda C, Corral I, Laguna F, et al. Diagnostic utility of a multiplex herpesvirus PCR assay performed with cerebrospinal fluid from human immunodeficiency virus-infected patients with neurological disorders. J Clin Microbiol 2000; 8: 3061-6. [ Links ]
11. Arribas JR, Clifford DB, Fichtenbaum CJ, Commins DL, Powderly WG, Storch GA. Level of citomegalovirus (CMV) DNA in cerebrospinal fluid of subjects with AIDS and CMV infection of the central nervous system. J Infect Dis 1995; 172: 527-31. [ Links ]
12. Sauerberi A. Eichhorn U, Hottenrott G, Wutzler P. Virolo-gical diagnosis of herpes simplex encephalitis. J Clin Virol 2000; 17: 31-6. [ Links ]
13. Revello MG, Baldanti F, Sarasini A, Zelle D, Zavattoni M, Gerna G. Quantitation of herpes simplex virus DNA in cerebrospinal fluid of patients with herpes simplex ence-phalitis by polimerase chain reaction. Clin Diagn Virol 1997; 7: 183-91. [ Links ]
14. Sköldenberg B, Kalimo K, Carlström A, Forsgren M, Halonene P. Herpes simplex encephalitis: a serological follow-up study. Acta Neurol Scand 1981; 63: 273-85. [ Links ]
15. Chemouilli P, Taussig D, Lacroix C, Gasnault J. Atteinte de la moelle épinere au cours de linfection par le VIH. Press Med 1994; 23: 1646-50. [ Links ]
Recibido: 26 de julio 2002
Aceptado: 7 de octubre 2002














