Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) v.63 n.2 Buenos Aires mar./abr. 2003
Nuevos mecanismos involucrados en la patogénesis de adenomas hipofisarios*
D. Giacomini, M. Paez-Pereda, D. Refojo°, A. Carbia Nagashima° , A. Chervin#, V. Goldberg##, E. Arzt*.
Departamento de Fisiología, Biología Molecular y Celular, Facultad de Ciencias Exactas y Naturales;
##Instituto de Investigaciones Médicas Alfredo Lanari, Facultad de Medicina,
Universidad de Buenos Aires;
#Hospital Santa Lucía, Buenos Aires
° Miembros de la Carrera del Investigador y Becarios del CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas)
* Trabajo que mereció el Premio Lucio Cherny en la reunión anual de la Sociedad Argentina de Investigación Clínica, Mar del Plata, noviembre 2002.
Dirección postal: Dr. E. Arzt, Departamento de Fisiología y Biología Celular y Molecular, FCEN, Universidad de Buenos Aires, Ciudad Universitaria, Pabellón II, 1428 Buenos Aires, Argentina.
Fax: (54-11) 4576-3321. E-mail: earzt@fbmc.fcen.uba.ar
Resumen
Analizamos molecularmente tumores formados por clones estables de la línea lactosomatotrofa GH3 Smad-4 (transductor de señales de la proteína morfogénica de hueso-4, BMP-4) dominante negativo (Smad-4dn que bloquea el transductor Smad) que desarrollan tumores de menor tamaño que los controles en ratones nude, pero que presentaron un crecimiento tardío. Encontramos que en éstos la expresión/control de Smad-4dn se perdió y que sobreexpresan c-Myc. Concordantemente, BMP-4 se sobreexpresa y estimula la expresión de c-Myc en prolactinomas humanos pero no en otros adenomas o en hipófisis normales. Además en células GH3, ICI 182,780 (bloqueante de estrógenos) inhibe la estimulación de c-Myc por BMP-4 y el cotratamiento BMP-4/estrógenos posee un efecto aditivo sobre la proliferación celular. Al bloquear BMP-4 con ICI y estrógenos (E2) con Smad-4dn se bloquea significativamente cada efecto estimulatorio sobre la proliferación. A su vez Smad-4 interacciona físicamente con los dos subtipos de receptores de estrógenos, ERa/ERb. Demostramos por primera vez el rol de BMP-4 en la tumorigénesis de prolactinomas, involucrando un crosstalk funcional BMP-4/estrógenos.
Palabras clave: Prolactinoma; C-Myc.
Abstract
New mechanisms involved in the pathogenesis of pituitary adenomas. We studied Smad-4dn tumors generated from lactosomatotrophic GH3 cells stably transfected with a dominant negative form of Smad-4 (a bone morphogenetic protein-4, BMP-4, signal co-transducer) which had reduced tumorigenicity in nude mice, but had showed a late increase in tumor size. We found that they had lost in vivo the expression of Smad-4dn and had recovered c-Myc expression. In accordance, BMP-4 is overexpressed and stimulates the expression of c-Myc in human prolactinomas, but not in other human pituitary adenomas or normal pituitary. In adittion ICI 182,780 inhibited BMP-4 stimulated c-Myc expression and BMP-4 and 17b-estradiol in combination had an additive effect on GH3 cell proliferation. Their action was inhibited by blocking BMP-4 with ICI 182,780 or 17b-estradiol with Smad-4dn. Furthermore, co-immunoprecipitation studies demonstrate that Smad-4 physically interacts with the ERa/ERb. We show for the first time the role of BMP-4 in prolactinoma pathogenesis, involving a functional cross-talk BMP-4/E2.
Key words: Prolactinoma; C-Myc.
El desarrollo de tumores hipofisarios es un proceso en el cual células estimuladas por esteroides, factores hipotalámicos o de crecimiento se transforman dando lugar a un fenotipo tumoral, y luego se expanden de manera monoclonal generando adenomas1, 2. Sin embargo, los mecanismos moleculares que llevan a la aparición de estos tumores se encuentran en estudio actualmente.
Las proteínas morfogénicas de hueso, BMPs, son miembros de la superfamilia de factores transformantes de crecimiento-b (TGF-b) que fueron originalmente descubiertos por su habilidad de inducir la formación ectópica de cartílago y hueso al inyectarlos en animales experimentales3. Actualmente se sabe que no sólo promueven la diferenciación a linajes óseos, sino que también regulan la división celular, la apoptosis, la determinación celular, diferenciación y morfogénesis3. BMP-4 es uno de los miembros de esta familia más estudiado debido a su participación en numerosos eventos embrionarios3. Existen evidencias que otros miembros de la superfamilia de TGF-b poseen efectos sobre la hipófisis adulta, inhibiendo el desarrollo de prolactinomas4. Por el contrario se desconoce el posible rol de BMP-4 en hipófisis adultas.
Se ha detectado la presencia de receptores de estrógenos (ERs) en la hipófisis anterior y en adenomas hipofisarios; en la pituitaria normal, las poblaciones de gonadotrofos y lactotrofos presentan la mayor expresión de ERs5. En concordancia con esto, se ha informado la presencia de ERs en la mayoría de los tumores secretores de PRL6. Los estrógenos aumentan la expresión de prolactina (PRL)7 y estimulan la proliferación de los lactotrofos tanto normales como transformados8.
Con el objetivo de encontrar genes involucrados en la tumorigénesis hipofisaria, en trabajos recientes nuestro grupo comparó el patrón de expresión génica de hipófisis anteriores normales versus los prolactinomas provenientes de ratones hembras D2KO (differential display PCR). Sólo en las hipófisis normales se identificó una banda correspondiente a Noggin, antagonista específico de BMP-4, el cual no inhibe a otros miembros de la superfamilia de TGF-b9. Por RT-PCR comparativa no solo se encontró que la expresión de Noggin está disminuida en estos prolactinomas sino que BMP-4 está sobreexpresado, lo cual se confirmó en diferentes modelos animales de prolactinomas. Los ratones nude inyectados con clones estables de la línea tumoral lactosomatotrofa GH3-Smad-4dn (bloqueante de los receptores BMP-4/TGF-b) presentan tumores de menor tamaño y con una tasa de crecimiento menor que los controles.
En este trabajo demostramos la expresión de BMP-4 en tumores humanos, su rol en la tumorigénesis de prolactinomas y la participación de un crosstalk funcional entre BMP-4 y los estrógenos.
Trabajamos con tumores hipofisarios provenientes de pacientes con hiperprolactinemia, acromegalia, enfermedad de Cushing o adenomas no funcionantes y con la línea celular tumoral lactosomatotrofa GH3. Se estudiaron la expresión de c-Myc y Smad-4, la proliferación celular, el crecimiento tumoral en ratones nude, la interacción proteína-proteína Smad-4-ER y la actividad trans-cripcional del promotor de BMP-4. Se utilizó la construcción pBMP-4-Luc, la cual contiene un fragmento de 2.6 kb del promotor IA de BMP-4 de ratón (región flanqueante 5´ desde -2371/+258) río arriba del gen reporter LUC. Para la generación de clones estables GH3 Smad-4 dominante negativo (GH3 Smad-4-dn), se utilizó un vector de expresión que contiene un fragmento del cDNA (1-514) del factor DPC-4 fusionado a un FLAG. Las transfecciones se realizaron mediante el método de lipofectamina con 2 µg del ADN plasmídico apropiado. La actividad transcripcional se determinó a través de la actividad luciferasa de los extractos y la normalización se llevó a cabo por b-galactosidasa. Para la proliferación celular se utilizó el método de WST-1. En las co-inmunoprecipitaciones que determinan la interacción proteica, las células fueron tratadas con anticuerpos contra Smad-4, ER-a o ER-b, y en los Western Blot los lisados celulares fueron revelados con anti-BMP-4, anti-Smad-4, anti-ER-a, anti-ER-b, anti-c-Myc o anti-FLAG y como control se utilizó un anti-actinab. Los resultados están expresados como el promedio ± ES. La significación estadística de los datos fue calculada por análisis de la varianza (ANOVA) de un factor y el test de Scheffé.
Habíamos demostrado que ratones nude inyectados con clones GH3-Smad-4dn o GH3-Noggin, presentan tumores de menor tamaño y una tasa de crecimiento menor, que aquellos tumores generados por células GH3-control. Hubo dos ratones inyectados con células GH3 Smad-4dn que desarrollaron tumores que durante los últimos días de la medición tumoral crecieron significa-tivamente hasta igualar a los ratones controles. En primer lugar analizamos molecularmente dichos tumores por Western Blot y observamos que dichas células tumorales perdieron la expresión de Smad-4dn y proliferaron como las controles. A su vez, los tumores controles presentan una sobreexpresión de c-Myc (uno de los reguladores más importantes del ciclo celular), la cual no se detectó en los tumores Smad-4dn de crecimiento lento. Sin embargo, los tumores Smad-4dn que escaparon al control negativo recuperaron la sobreexpresión de c-Myc a niveles similares a los controles. Estos resultados aportan evidencia directa de la participación de BMP-4/Smad-4 in vivo en la tumorigénesis.
Luego estudiamos la capacidad de BMP-4 (200ng/ml) de estimular la expresión de c-Myc en tumores hipofisarios humanos. Encontramos que sólo aumenta en prolactinomas y que el tratamiento con Noggin 1 µg/ml disminuye la expresión basal de c-Myc. Determinamos la expresión de BMP-4 en tumores hipofisarios humanos. Se estudiaron 48 tumores y se encontró que BMP-4 se sobreexpresa en los prolactinomas humanos (n=12), pero no en Cushing (n=11), acromegálicos (n=12), no funcionantes (n=13) o hipófisis humanas normales (n=3). El nivel de expresión fue mayor en seis prolactinomas que presentaban infiltración al seno cavernoso, hueso o dura mater, en oposición a seis prolactinomas restringidos a la sella, encapsulados o sin signos de infiltración.
Al estudiar la estimulación de c-Myc en las células GH3, se observó que el tratamiento con BMP-4 200ng/ml induce la expresión c-Myc (al igual que en prolactinomas humanos), dicha inducción es similar a la ejercida por los E2 100nM. El cotratamiento de BMP-4 con ICI 10-6M, un antagonista del ER, inhibe el efecto estimulatorio de BMP-4. Estos resultados sugieren un crosstalk entre BMP-4 y E2 que decidimos profundizar en ensayos de proliferación. Al estimular las GH3 con BMP-4 y E2 se observa un efecto aditivo del 35% (p<0.01) sobre la proliferación celular (Tabla 1). El bloqueo de cada estímulo con el antagonista contrario, BMP-4 con ICI y E2 con Smad-4dn, resulta en una inhibición parcial pero significativa de la proliferación celular (p<0.01) (Tabla 1), confirmando que BMP-4 y E2 actúan vía caminos intracelulares de señalización solapantes. Efectivamente, ensayos de coinmunoprecipitación demuestran una interacción física entre ER (a y b) y Smad-4 tanto en presencia de BMP-4 100ng/ml como de E2 100nM, que no se observa con anticuerpos controles.
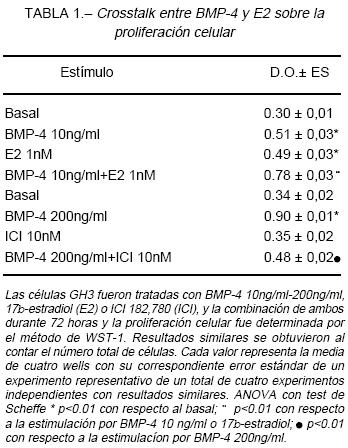
E2 induce la síntesis de BMP-4 por células lactosomatotrofas aumentando la actividad transcripcional del promotor de BMP-4, efecto que es bloqueado con el agregado de tamoxifeno 1 µM (bloqueante ER); este aumento también se observa a nivel proteico (Fig. 1).
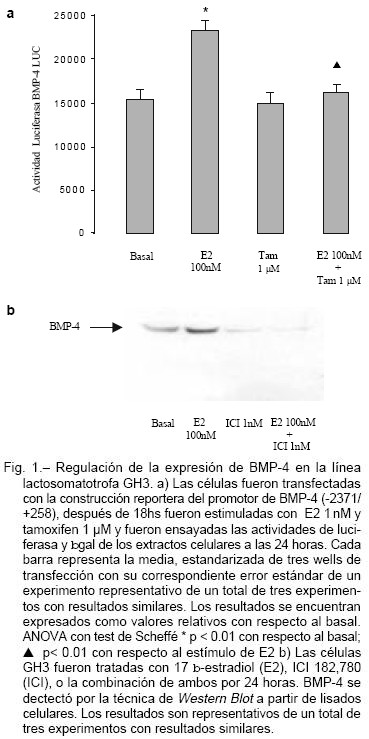
Durante mucho tiempo existió controversia acerca de las bases moleculares de la tumorigénesis hipofisaria. Demostramos que los estrógenos, factores que favorecen el crecimiento de prolactinomas, aumentan la actividad transcripcional del gen y los niveles proteicos de BMP-4. Esta sobreexpresión de BMP-4 a su vez induce la expresión de c-Myc y la proliferación tumoral mediante un mecanismo que involucra un crosstalk de su transductor Smad-4 con E2, que es fundamental para el desarrollo de tumores in vivo.
c-Myc es un protooncogen que media los efectos tanto de los estrógenos como de TGF-b en el ciclo celular9-11. En nuestro trabajo demostramos que tanto los tumores controles, los Smad-4dn que escapan a la regulación negativa, como las células GH3 y prolactinomas estimulados con BMP-4, presentan altos niveles de c-Myc. De esta manera determinamos por primera vez la participación de BMP-4 en un nuevo mecanismo in vivo que promueve el desarrollo de prolactinomas hipofisarios. Se desconocía el posible rol de BMP-4 en la hipófisis adulta, y dada la importancia de éste durante el desarrollo hipofisario12 su participación en la tumorigénesis hipofisaria constituye un mecanismo sumamente novedoso.
A su vez describimos un crosstalk funcional entre BMP-4 y los E2 tanto a nivel de la estimulación de c-Myc como de la proliferación celular, que se corrobora por la interacción física de los correspondientes transductores de señales, Smad-4 y ER. Recientemente se ha identificado una interacción física entre ER y la proteína Smad 3 activada por TGF-b en la línea celular 293T13. Tanto BMP-4 y otros miembros de la familia TGF-b como los E2 cumplen funciones importantes en diferentes tipos tumorales y en la fisiología del hueso. Nosotros demostramos la existencia de un mecanismo molecular regulatorio BMP-4-Smad-4-ER que puede participar en el desarrollo de otras enfermedades. Muchas células tumorales logran escapar al efecto inhibitorio que los miembros de la superfamilia de TGF-b poseen sobre la proliferación celular, y este hecho se ha convertido en un interrogante central para entender la regulación del crecimiento tumoral9. En base a nuestros resultados, proponemos que los prolactinomas, en los cuales BMP-4 estimula la proliferación celular, constituyen un modelo útil para investigar este mecanismo.
1. Arzt E. gp130 cytokine signaling in the pituitary gland: a paradigm for cytokine-neuro-endocrine pathways. J Clin Invest 2001; 108: 1729-33. [ Links ]
2. Asa SL, Ezzat S. The cytogenesis and pathogenesis of pituitary adenomas. Endocr Rev 1998; 19: 798-827. [ Links ]
3. Hogan BLM. Bone morphogenetic proteins: multifunctional regulators of vertebrate development. Genes Dev 1996; 10: 1580-94. [ Links ]
4. Delidow BC, Billis WM, Agarwal P, White BA. Inhibition of prolactin gene transcription by transforming growth factor-beta in GH3 cells. Mol Endocrinol 1991; 5: 1716-22. [ Links ]
5. Mitchner NA, Garlick C, Ben-Jonathan N. Cellular distribution and gene regulation of estrogen receptors alpha and beta in the rat pituitary gland. Endocrinology 1998; 139: 3976-83. [ Links ]
6. Friend KE, Chiou YK, Lopes MB, Laws ER, Hughes KM, Shupnik MA. Estrogen receptor expression in human pituitary: correlation with immunohistochemistry in nor- mal tissue, and immunohistochemistry and morphology in macroadenomas. J Clin Endocrinol Metab 1994; 78: 1497-1504. [ Links ]
7. Lieberman ME, Maurer RA, Laude P, Wiklund J, Wertz N, Gorski J. Regulation of pituitary growth and prolactin gene expression by estrogen. Adv Exp Med Biol 1981; 138: 151-63. [ Links ]
8. Chaidarun SS, Eggo MC, Stewart PM, Barber PC, Shepard MC. Role of growth factors and estrogen as modulators of growth, differentiation and expression of gonadotropin subunit genes in primary cultured sheep pituitary cells. Endocrinology 1994; 134, 935-44. [ Links ]
9. Massague J. How cells read TGF-beta signals. Nat Rev Mol Cell Biol 2000; 1: 169-78. [ Links ]
10. Yagi K, Furuhashi M, Aoki H, et al. C-myc is a downs-tream target of the Smad pathway. J Biol Chem 2002; 277: 854-61. [ Links ]
11. Prall OWJ, Rogan EM, Sutherland RL. Estrogen regulation of cell cycle progression in breast cancer cells. J. Steroid Biochem Molec Biol 1998; 65: 169-74. [ Links ]
12. Scully KM, Rosenfeld MG. Pituitary development: regulatory codes in mammalian organogenesis.Science 2002; 295: 2231-5. [ Links ]
13. Matsuda T, Yamamoto T, Muragushi A, Saatcioglu A. A. cross-talk between tansforming growth factor- and estrogen receptor signaling through Smad3. J Biol Chem 2001; 276: 42908-14. [ Links ]














