Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.63 no.4 Buenos Aires July/Aug. 2003
Neumonía adquirida en la comunidad
Guía practica elaborada por un comité intersociedades
Luna C. M.1, Calmaggi A.2, Caberloto O.1, Gentile J.2, Valentín R.1, 3, Ciruzzi J.1 , Clara L.2, Rizzo O.1, Lasdica S.1, 3, Blumenfeld M.2, Benchetrit G.2, Famiglietti A.4, ApezteguIa C.1, 3, Monteverde A.1 y Grupo Argentino de Estudio de la NAC *
1Asociación Argentina de Medicina Respiratoria (AAMR),
2Sociedad Argentina de Infectología (SADI),
3Sociedad Argentina de Terapia Intensiva (SATI),
4Sociedad Argentina de Bacteriología Clínica (SADEBAC), Asociación Argentina de Microbiología (AAM),
5Sociedad Argentina de Virología (SAV),
6Sociedad Argentina de Medicina (SAM), Buenos Aires
Resumen
Las guías para neumonía adquirida en la comunidad (NAC) contribuyen a ordenar el manejo de los pacientes. La NAC presenta cambios en su etiología, epidemiología y sensibilidad a antibióticos que obligan a la revisión periódica de las guías. Un comité intersociedades elaboró esta guía dividida en tópicos y basada en guías y estudios clínicos recientes. La NAC afecta anualmente al 1% de la población; la mayoría de los pacientes requiere atención ambulatoria, en otros reviste gravedad (representa la 6ª causa de muerte en Argentina). La etiología es diferente si el paciente es ambulatorio, requiere internación en sala general o en terapia intensiva, pero no hay forma segura de predecirla clínicamente. Los predictores de mala evolución son: edad, antecedentes personales y comorbilidades y hallazgos del examen físico, del laboratorio y de la radiografía de tórax. Entre 10 y 25% de los pacientes que se internan deben hacerlo en terapia intensiva para ventilación mecánica o soporte hemodinámico (NAC grave), tanto inicialmente como durante su evolución. Estos pacientes presentan alta mortalidad; algunos criterios ayudan a reconocerlos. Embarazo, EPOC e internación en institutos geriátricos requieren consideraciones especiales. El diagnóstico es clínico, los métodos complementarios ayudan a determinar la etiología y la gravedad: la radiografía de tórax debe practicarse en todos los pacientes; el resto de los estudios están indicados en internados. El tratamiento inicial es empírico y debe iniciarse precozmente usando antibióticos activos frente a los gérmenes blanco, evitando el uso inapropiado que induce el desarrollo de resistencias. El tratamiento no debe prolongarse innecesariamente. Hidratación, nutrición, oxígeno y el manejo de las complicaciones complementan al tratamiento antibiótico. La prevención se basa en la profilaxis antinfluenza y antineumocóccica, evitar la aspiración y medidas generales.
Palabras clave: Neumonía; Guía práctica; Antibióticos; Tratamiento.
Abstract
Clinical practice guidelines for community-acquired pneumonia (CAP) contribute to improve patients management. CAP undergoes continuous changes in etiology, epidemiology and antimicrobial sensitivity, requiring periodic guidelines revisions. An inter-society committee designed this guidelines dividing it into several topics based on prior guidelines and recent clinical studies. CAP compromises annually more than 1% of the population; most of the cases only require outpatient care but others are severe cases, reaching the 6th cause of death in Argentina. The cases are distributed unevenly into ambulatory, admitted in the general ward or in the intensive care unit. There is no way to predict the etiology. Unfavorable outcome predictors include age, antecedents and physical, laboratory and radiography findings. Ten to 25% of inpatients need to be admitted to the intensive care unit at the onset or during the follow-up, for mechanical ventilation or hemodynamic support (severe CAP). Severe CAP is associated with high mortality and requires adequate and urgent therapy. Pregnant, COPD and nursing home patients require special recommendations. Diagnosis is clinical, while complementary methods are useful to define etiology and severity; chest X-ray is the only one universally recommended. Other studies, including microbiologic evaluation are particularly appropriate in the hospitalized patients. The initial therapy is empiric, it must begin early, using antimicrobials active against the target microorganisms, avoiding their inappropriate use which can lead to the development of resistance. Length of therapy must not be unnecessarily prolonged. Hydratation, nutrition, oxygen and therapy of complications must complement antibiotic treatment. Prevention is based on influenza prophylaxis, anti-pneumococcal vaccine, aspiration prevention and other general measures.
Keywords: Pneumonia; Practice guidelines; Antibiotics; Drug therapy.
Introducción
La neumonía adquirida en la comunidad (NAC) impacta al individuo y a la sociedad en su conjunto. A partir de 1991, se han escrito normativas de manejo en todo el mundo1-4. En Argentina un grupo independiente elaboró una guía de práctica clínica que fue publicada en 19975. Más recientemente, especialistas en enfermedades infecciosas elaboraron su propia guía6. NAC es un tema en el cual novedades en cuanto a etiología, diferencias en la epidemiología entre distintos países y aun dentro de un mismo país, nuevos antibióticos y cambios en la sensibilidad a los mismos vuelven obsoletas o inadecuadas recomendaciones relativamente recientes y obligan a una actualización periódica. La instrumentación de este tipo de guías ayudó a ordenar y codificar nuestro enfoque del paciente con NAC y mejoró su manejo, pero por otro lado reveló la futilidad o inaplicabilidad de ciertas recomendaciones, dando paso a nuevos cuestionamientos que a su vez estimulan a nuevas investigaciones.
Este documento es el resultado del trabajo de un comité intersociedades para la elaboración de consensos sobre infecciones respiratorias formado por la Asociación Argentina de Medicina Respiratoria (AAMR), Sociedad Argentina de Infectología (SADI) y la Sociedad Argentina de Terapia Intensiva (SATI). Miembros de estas sociedades junto con los de las sociedades argentinas de Bacteriología Clínica (SADEBAC/AAM), de Virología (SAV/AAM) y de Medicina, aunaron esfuerzos para concretar este trabajo.
Métodos
El comité intersociedades nombró 2 coordinadores y eligió a 30 miembros de las distintas sociedades que trabajaron en 6 equipos en cada uno de los tópicos mayores que forman parte de este consenso (1. Definición Epidemiología y Etiología; 2. Estratificación de Riesgo y Sitio Inicial de Atención; 3. Diagnóstico; 4. Tratamiento Antibiótico; 5. Duración del Tratamiento y Evaluación de la Respuesta; y 6.Medidas de Tratamiento no-Antibiótico y Prevención). Luego de una reunión plenaria realizada en Buenos Aires en abril de 2002, se elaboraron las conclusiones que fueron sometidas a una revisión interna y a la redacción de un documento final que constituye el cuerpo de este manuscrito.
La base para este trabajo fueron las dos guías locales mencionadas5, 6, normativas elaboradas por sociedades médicas extranjeras1-4, 7-10 y estudios clínicos significativos publicados durante los últimos 20 años, pero particularmente durante los últimos 5 años. Para la revisión se hizo una búsqueda sistemática usando MEDLINE como modo de recolección de la información. Excepcionalmente se utilizaron datos provenientes de abstracts u otro tipo de trabajos no publicados, con la justificación de contar con datos locales de etiología y sensibilidad a los antimicrobianos, ante la escasez de publicaciones al respecto en revistas indexadas. La evidencia científica se clasificó en tres niveles, a saber: tipo A (EA): proveniente de estudios randomizados y controlados; tipo B (EB): proveniente de estudios controlados no randomi-zados y tipo C: proveniente de series de casos y opinión de expertos (EC). Resaltamos que para algunos tópicos tales como etiología, este tipo de clasificación de la evidencia no refleja la validez del trabajo, de la misma manera que para otros aspectos como puede ser el tratamiento.
1. Definición, epidemiología, etiología
Definición: NAC es una infección aguda del parénquima pulmonar que se manifiesta por signos y síntomas de infección respiratoria baja, asociados a un infiltrado nuevo en la radiografía de tórax (Rx Tx) producido por dicha infección, y se presenta en pacientes no hospitalizados durante los 14 días previos.
Epidemiología: En Argentina es la 6ª causa de muerte en general y la 5ª causa en mayores de 60 años11. Estadísticas de otros países muestran una incidencia global de 10-15 casos/1 000 habitantes/año, con mayor incidencia en invierno10. Distintos estudios internacionales indican que el 80% se atiende en forma ambulatoria; sin embargo, la mayor parte de la información publicada proviene de internados (270/100 000 habitantes NAC son internados por año), éstos tienen mayor morbilidad, mortalidad y costo del tratamiento12 EB. Estos estudios indican que la mortalidad promedio es 4%, en ambulatorios menor a 1%, en ancianos 18%, en provenientes de geriátricos 30% y en internados en unidades de terapia intensiva (UTI) 37%12 EB.
Clínica: Si bien en la mayoría de los pacientes no existe una buena correlación entre la forma de presentación clínica ("típica" vs. "atípica") y el agente causal13, en cierto número de casos se puede predecir la etiología neumocóccica14 EC. El dolor pleurítico es más frecuente en la NAC bacteriana, y el comienzo brusco en la neumocóccica14 EB. El término atípico ha sido honrado por el tiempo y sirve más para denominar a ciertos agentes (bacterias intracelulares como Legionella pneumophyla, Chlamydia pneumoniae, Chlamydia psittaci, Mycoplasma pneumoniae y Coxiella burnetii y algunos virus respiratorios), que para caracterizar a neumonías de comienzo lento y disociación clínico-radiológica que se presumía era característico de éstos.
Etiología: Es difícil formular una síntesis numérica de la etiología de la NAC a través de estudios publicados, debido a diferencias en la selección, exclusión de pacientes según edad o comorbilidad, condiciones epidémicas y endémicas, pérdida de muestras, uso previo de antibióticos y heterogeneidad de la metodología usada15. Los estudios clínicos sobre etiología son en general descriptivos y corresponden a series de casos y son la mejor evidencia disponible acerca de la etiología. Se consideraron estudios prospectivos en adultos inmunocompetentes que abarcaron por lo menos un año calendario, con metodología diagnóstica y definiciones estrictas.
Streptococcus pneumoniae es el agente más frecuente, produce el 60% de las neumonías bacteriémicas y probablemente la mayoría de las NAC sin patógeno identificado16. Haemophilus influenzae y Staphylococcus aureus son menos frecuentes. La incidencia de agentes atípicos es variable, M. pneumoniae es predominante en ambulatorios, C. pneumoniae es también muy frecuente y suele producir co-infecciones17, a su vez Legionella, endémica en ciertas áreas geográficas y esporádica en otras, es descripta habitualmente en pacientes más graves8, 18, 19. El hallazgo de bacilos gram-negativos aerobios (BGNA) y Pseudomonas aeruginosa en el esputo, tiene significado controvertido para atribuir etiología. Los virus influenza, parainfluenza, adenovirus, y sincicial respiratorio ocasionan alrededor del 10% de las NAC y la categoría neumonía aspirativa (macroaspiración) no está bien definida, y la mayoría de los estudios no analiza su incidencia. La tuberculosis (TBC) puede presentarse como NAC, y debe ser tenida en cuenta por su alta incidencia, su asociación con la infección HIV y por las ventajas que conllevan su diagnóstico y tratamiento temprano20. En los últimos 10 años se ha reconocido el síndrome pulmonar por hantavirus; entre 1997 y 2001 se han notificado 330 casos en Argentina; se debe considerar en personas expuestas a inhalación de partículas infectantes presentes en la tierra contaminada por deyecciones del ratón que transmite la enfermedad21. Si bien la macroaspiración no es una etiología, y muchos de los clásicos agentes productores de NAC primero colonizan la orofaringe y luego son aspirados hacia el pulmón, el término neumonía aspirativa se refiere a la ocurrida en pacientes con mayor riesgo de aspiración22,23; un porcentaje variable de las NAC en pacientes que necesitan internarse reconoce la existencia de este mecanismo. Por último, la mayoría de los estudios sobre etiología reconoce que en 3 a 14% de los pacientes es posible identificar 2 o más patógenos como causa de la infección (concurrente o secuencial)24-27. Aun usando una rigurosa metodología diagnóstica no es posible detectar algún agente causal en 20% a 60% de los pacientes con NAC12, 17. La distribución de estos agentes suele ser diferente según el lugar de atención (ambulatorios, sala general o terapia intensiva) y la presencia de comorbilidades o factores que confieren riesgo para determinados patógenos (Tabla 1). De acuerdo con las series publicadas acerca de la etiología podría decirse que en líneas generales ciertos agentes se aíslan con similar frecuencia en ambulatorios, internados fuera de la UTI y en NAC grave (Streptococcus pneumoniae); otros son más frecuentes en pacientes menos graves (virus respiratorios, Mycoplasma pneumoniae, Chlamydia pneumoniae); finalmente, algunos son más frecuentes cuanto mayor es la gravedad (Legionella pneumophila, bacilos gram-negativos aerobios, Staphylococcus aureus). La etiología polimicrobiana no suele se explorada por todos los investigadores; está presente en todas las categorías pero tiende a ser más frecuente cuanto mayor es la gravedad, mientras que la macroaspiración está ausente en ambulatorios y también aumenta su incidencia con la gravedad27-32.

Etiología en pacientes de manejo ambulatorio (Tabla 2): Predominan: S. pneumoniae, M. pneumoniae y virus. En fumadores, mayores de 65 años y pacientes con comorbilidades H. influenzae también es frecuente. Un estudio reciente en 184 pacientes con NAC ambulatorios, con exhaustiva investigación etiológica, informó la siguiente frecuencia: S. pneumoniae 20%, M. pneumoniae 13.5%, virus respiratorios 10.6%, C. pneumoniae 5.3%, Legionella sp. 0.6%, C. burnetti 2.4%, H. influenzae 1.8%, polimicrobiana 11% y mixta 16%33, 34. En nuestro medio la distribución parece ser similar27.
Etiología en internados en sala general (Tabla 2): Predomina también S. pneumoniae (20-60%); otros microorganismos incluyendo: H. influenzae, M. pneumoniae, C. pneumoniae, S. aureus, BGNA, Legionella y virus, se encuentran presentes individualmente en porcentajes cercanos al 10% cada uno. También en cerca del 10% la etiología es polimicrobiana. Dependiendo de condiciones epidemiológicas también se incluye a M. tuberculosis en este grupo20. Los escasos datos disponibles en nuestro medio indican una distribución similar, con mayor frecuencia de BGNA y menor de Legionella19,27
Etiología en internados en terapia intensiva (Tabla 2): Comprenden entre un 10 y un 35% de los pacientes internados por NAC12. También aquí S. pneumoniae es el agente más frecuente, entre el resto se resaltan BGNA, H. influenzae, S. aureus (relacionado a veces con influenza), agentes intracelulares (en particular Legionella y Mycoplasma) y en ocasiones P. aeruginosa35. En personas jóvenes con neumonía grave y epidemiología compatible deben considerarse alguna infección asociada a HIV, el síndrome pulmonar por hantavirus y la leptospirosis.
Consideraciones sobre Streptococcus pneumoniae resistente a antibióticos (SPRA) en NAC: En Argentina SPRA tiene una distribución en mosaico predominando en grandes centros urbanos y en población pediátrica. Se halló 32.2% de resistencia en menores de 5 años (16.2% resistentes y 16% resistencia intermedia). En adultos la resistencia a penicilina es del 20-24% (con franco predominio de resistencia intermedia)9, 36, pero la tasa depende del material de aislamiento, invasividad (en general asociada a menor resistencia) y antecedentes. En ausencia de meningitis, la resistencia in vitro podría tener escasa relevancia clínica ajustada a la morbi-mortalidad, yel pronóstico en infectados por cepas resistentes no parece ser peor. Es probable que recién a partir de una concentración inhibitoria mínima (CIM) mayor de 4 mg/L exista impacto clínico en NAC37. En neumonía neumocóccica cepas con CIM < 4 pueden tratarse eficientemente con las concentraciones séricas y pulmonares alcanzadas con aminopenicilinas7, 36 EB. Datos provenientes de sistemas de vigilancia de adultos con NAC en Argentina no han detectado cepas con resistencia a penicilina de > 4 mg/L38, 39. Cuando se presenta resistencia a penicilina es más probable la resistencia a otros agentes no relacionados, como macrólidos y trimetoprima-sulfametoxazol; el SPRA funcionaría como un marcador de multi-resistencia40.

Patógenos específicos, condiciones epidemiológicas y su interrelación (Tabla 1).
Distintas etiologías se asocian a determinadas condiciones epidemiológicas, a saber:
SPRA: comorbilidades múltiples, infección HIV y tratamiento con b lactámicos en los últimos 3 meses;
Haemophilus influenzae: hábito tabáquico, edad > 65 años, comorbilidades;
BGNA: residencia en geriátricos, enfermedad cardio-pulmonar, comorbilidades múltiples, uso reciente de antibióticos;
Pseudomonas aeruginosa: enfermedad estructural del pulmón (fibrosis quística, bronquiectasias), uso de corticoides (más de 10 mg/día de prednisona), antibioticoterapia de amplio espectro (> de 7 días en el último mes), desnutrición, neoplasia, anemia aplástica y antecedente de internación en UTI el último mes35;
Staphylococcus aureus: diabetes, insuficiencia renal, actividad de influenza en la comunidad8;
Mycobacterium tuberculosis: alcoholismo, residencia en geriátricos, endemia, contactos, drogadicción intravenosa, hemodiálisis.
Edad mayor de 65 años: En este grupo la neumonía es mucho más frecuente y más severa, predomina S. pneumoniae (SPRA en los residentes en geriátricos), también hay mayor incidencia de S. aureus, H. influenzae, BGNA y de infecciones mixtas. En general virus y bacterias son más frecuentes en ancianos y agentes atípicos en los más jóvenes15, 17, 41-44 EB. Los residentes en geriátricos suelen presentar condiciones que predisponen a la aspiración pero no se ha demostrado mayor incidencia de anaerobios23. Como se comentó, SPRA es más común y ocurren brotes ocasionales de influenza, VSR, C. pneumoniae, Legionella o tuberculosis en estos pacientes41.
2. Estratificación de riesgo y sitio inicial de atención
Entre las primeras decisiones se encuentra la elección del sitio de atención (ambulatorio, salageneral o UTI). Se deben reconocer los factores pronósticos de mala evolución. Distintos estudios identificaron mediante análisis multivariado predictores independientes de mortalidad45-49. La mortalidad correlaciona con la edad, antecedentes, hallazgos del examen físico, el laboratorio y la radiografía de tórax (Tabla 3).

Reglas de predicción para identificar alto y bajo riesgo de mortalidad
Ningún factor pronóstico aislado es específico y sensible, el riesgo de morbi-mortalidad puede estratificarse mediante reglas que usan variables pronósticas que complementan, pero nunca reemplazan, al buen juicio clínico de valoración al momento de decidir si procede la internación33, 41, 44-51. Reglas de predicción han sido incluidas en distintas guías para la atención de NAC7-9, 20.
Muchas de las reglas estratifican sobre la base de los factores de mal pronóstico, centrándose en reconocer grupos de pacientes de alto riesgo5, 50-54. Recientemente se dirigió la atención a pacientes con bajo riesgo de mortalidad, éstos son pasibles de atención ambulatoria o internación breve55, 56.
Entre las reglas más difundidas y validadas se encuentran la regla Pneumonia Severity Index (PSI)47 y las de la British Thoracic Society,[original (BTS) y modificada (BTSm)]45, 57. El PSI permite reconocer de inicio y claramente los pacientes de bajo riesgo de morir. En tanto, las BTS son simples y permiten identificar a aquellos con alto riesgo de muerte o de necesidad de internación en una UTI50, 57, 58.
El PSI fue derivado de un estudio prospectivo (14.199 pacientes) y validado en 38.039 internados y 2.287 ambulatorios51. Según el PSI, los menores de 50 años, sin comorbilidades y con poca repercusión por la infección, pertenecen a la clase I. El resto pertenece a las clases II a V según el puntaje asignado a antecedentes, hallazgos físicos y estudios complementarios. La mortalidad para las clases I a III es casi nula y crece en las restantes. Esta regla usa muchas variables (esto dificulta su implementación); asigna puntajes fijos a variables cuyos valores implican distintos niveles de severidad (Ej.: PaO2 58 mmHg tiene la misma puntuación que 35 mmHg) y no toma en cuenta factores sociales, deterioro cognitivo ni incapacidad para la ingesta oral. Por ello, 1/3 de los pacientes clase I o II son internados56, 59, 60. Su mayor utilidad reside en facilitar la comparación de resultados entre distintas poblaciones.
La BTS se basa en la frecuencia respiratoria inicial > 30/min, la tensión arterial diastólica < 60 mmHg y la urea > 42 mg/dL57. Tener 2 o más de estos parámetros aumenta 21 veces el riesgo de morir. Estudios de validación mostraron sensibilidad y especificidad cercanas al 80%45, sería menos sensible en predecir mortalidad en mayores de 65 años20. La BTSm agregó confusión mental, definida por un puntaje < 8 del Abbreviated Mental Test Score (asigna 1 punto a cada respuesta correcta a 10 preguntas). Fue validada en adultos (sensibilidad = 83%, especificidad = 70%, valor predictivo positivo = 26% y valor predictivo negativo = 97%, El número de factores pronósticos presentes correlacionó con una mortalidad de 2; 8; 23; 33 y 83% según se encuentren presentes 0, 1, 2, 3 o 4 factores, respectivamente58.
Los modelos predictivos facilitan la estratificación inicial y ayudan a decidir el sitio de atención y la intensidad del cuidado. Ningún modelo permite una estratificación inequívoca ni reemplaza al juicio clínico. Otros indicado-res de la evolución (complicaciones, uso de recursos de salud, tiempo de reintegro a tareas, costo y satisfacción de los pacientes), deberían ser evaluados.
Proponemos usar el algoritmo de la Fig. 1, basado en distintas reglas y en publicaciones previas47, 57, 58. Sólo se necesita conocer los antecedentes y hallazgos físicos y de estudios complementarios vinculados a curso complicado.
Si el enfermo tiene dos o más modificadores de los mencionados en la Fig. 1, o si tiene alguna alteración significativa en el examen físico (taquipnea > 30/min, taquicardia > 125/min, hipotensión arterial o compromiso del sensorio); en los análisis (urea > 50 mg/dL, leucocitos > 40 000 o < 3 000 por mm3, PaO2 < 60 mmHg o SaO2 < 90%, hematocrito < 30% o pH < 7.35) o en la RxTx (compromiso multilobar, aumento del infiltrado > 50% en las últimas 24 horas o derrame pleural voluminoso o tabicado), corresponde internarlo. Deben considerarse otras situaciones peor definidas, tomando en cuenta los exámenes complementarios y aplicando el juicio clínico.
En pacientes de riesgo bajo y pasibles de manejo ambulatorio, se deben evaluar las condiciones personales y socioeconómicas para su sostén y su capacidad de ingerir medicación, para decidir su sitio de atención. La evaluación debe ser repetida, en especial si el paciente queda en observación.

Neumonía grave de la comunidad
De los pacientes con NAC que son hospitalizados, el 10 al 25% lo hace en UTI debido a su gravedad25, 27, 51, 61. La NAC es una causa común de internación en UTI. La mayoría de los enfermos con NAC graves se internan en UTI de inicio, pero en un 10 a 15% la indicación aparece durante la evolución61.
El desconocimiento de la etiología de la NAC grave no se asocia a peor pronóstico27, 62, 63. La etiología neumocóccica o por BGNA32, 62 se asociaría a una evolución desfavorable, la relación de la bacteriemia con peor pronóstico es discutida47, 48, 62, 64, 65. Un metaanálisis sobre más de 30 000 pacientes junto con otros estudios han permitido identificar los factores de riesgo de muerte46, 47, 50, 66. El retraso en el comienzo del tratamiento antibiótico también ha sido asociado con incremento en la mortalidad66 EB.
Los motivos más frecuentes de internación son la necesidad de ventilación mecánica o de soporte hemodinámico. Algunos hallazgos previos a la aparición de insuficiencia respiratoria grave o shock séptico pueden ser útiles para decidir precozmente la internación en UTI EC. Esto permite decidir la derivación oportuna a centros con adecuada tecnología evitando retrasar el inicio de un manejo apropiado67.
En 1993 se propusieron 10 criterios para definir a una NAC como grave3. Sin embargo la mayoría de los pacientes internados por NAC presenta alguno de estos criterios61, 68, ya que esta definición tiene alta sensibilidad pero bajo valor predictivo negativo y especificidad. Ewig y col. propusieron definir NAC grave ante la presencia de 2 de 3 criterios menores (tensión arterial sistólica < 90 mmHg, PaO2 / FiO2< 250 o compromiso multilobar en la Rx Tx) o 1 de 2 criterios mayores (necesidad de ventilación mecánica o shock séptico), definición con sensibilidad de 78%, especificidad de 94%, valor predictivo positivo de 75% y valor predictivo negativo de 95%61.
Los scores de gravedad como el APACHE II o el SAPS II, predicen también el curso evolutivo de la NAC69 EB. Estos predictores indican que el pronóstico está vinculado al tipo de enfermedad, su gravedad inicial, al estado de salud previo y a la edad.
De acuerdo a lo anterior y a recomendaciones antes publicadas57 concluimos que –teniendo en cuenta las diferencias que existen entre distintas instituciones en los criterios de internación en UTI– se debe considerar la internación en la misma de pacientes que presentan alguna de las siguientes condiciones: dos o más criterios de la regla BTSm; evolución desfavorable de las variables fisiológicas; fallo respiratorio y/o requerimiento de ventilación mecánica; fallo hemodinámico (en especial con necesidad de inotrópicos); otros fallos orgánicos; compromiso del sensorio; dificultades para el manejo de secreciones u otras situaciones que requieren de monitoreo o manejo específico en UTI (Fig. 1).
NAC en situaciones especiales
Pacientes añosos: Los mayores de 65 años tienen mayor incidencia de neumonía y mayor frecuencia de formas graves; por ello la mayoría de los pacientes internados por NAC tienen más de 65 años17, 51. La mayor incidencia en mayores de 65 se debe a múltiples factores incluyendo algunas comorbilidades, especialmente las neurológicas que determinan un mayor riesgo de aspiración, a menudo silente22.
La mortalidad por NAC también es más elevada en este grupo etario y hasta un 90% de las muertes por NAC ocurren en estos pacientes42, 51, 66, 70, 71. También está afectado el pronóstico a largo plazo72, 73.
Además de los problemas en la defensa contra la infección que aparecen en ancianos, la NAC muchas veces se presenta con síntomas leves lo cual determina un retraso diagnóstico y terapéutico. Probablemente, las enfermedades cardiopulmonares que son más comunes a esta edad, contribuyan a la mayor letalidad. Aunque en algunos estudios la edad fue un factor independiente de mortalidad, la vejez por sí sola no debe motivar limitaciones sobre el uso de recursos diagnósticos y terapéuticos, incluyendo la internación en UTI47 EC.
Postración en cama, alteraciones de la deglución70, respuesta motora alterada (escala motora del score de Glasgow < a 5)52 y enfermedad neurológica previa42, predicen el desarrollo de NAC grave. La clase del PSI correlacionó con la estadía en el hospital, mayor necesidad de admisión en UTI y riesgo de muerte. Sin embargo, no se evaluó la eficacia de esta regla para decidir el manejo ambulatorio u hospitalizado de la neumonía en mayores de 65 años69 EB. Del mismo modo, las reglas de la BTS fueron estudiadas en pacientes mayores de 65 y de 75 años; en éstos se apreció una especificidad de 88% y un valor predictivo negativo de 94%, pero una sensibilidad baja58, 69. La regla BTSm resultó más eficaz EB.
NAC en Institutos Geriátricos (NAG): La NAC es frecuente en residentes en geriátricos, presentando una incidencia de entre 0.6 a 2.6 episodios por 1.000 residentes-día74. Es la única infección que contribuye significativamente a elevar la mortalidad de estos pacientes75, y la causa más común de traslado al hospital. Las tasas de mortalidad oscilan entre 6.5 y 53%76, 77. Las diferencias en mortalidad y etiología de la NAG respecto al resto de las NAC, se explican más por el estado funcional y las comorbilidades que por la edad o el hecho de residir en un geriátrico53, 78. Aumentan el riesgo de NAG la propensión a broncoaspiración por trastornos deglutorios (secundarios a enfermedad vascular o degenerativa del sistema nervioso), la alimentación por sonda nasogástrica y el uso de sedantes o hipnóticos75, 77. En los pacientes con taquipnea > 20 /min debe realizarse oximetría de pulso. Una saturación de oxígeno < 90% es predictiva de mortalidad y es un factor importante para la decisión de derivación79.
El diagnóstico suele dificultarse cuando estos pacientes no expresan claramente sus síntomas; la fiebre puede ser de bajo grado o estar ausente; la presentación clínica ser sutil o estar oculta por las comorbilidades79, 80. Como resultado, se suele demorar la administración de antibióticos o se los usa inapropiadamente.
Estos pacientes con frecuencia se internan. La hospitalización facilita la colonización con microorganismos nosocomiales multirresistentes. Muchas de estas NAG podrían tratarse en la institución geriátrica sin diferencias en la evolución76. Deberían hospitalizarse los que tienen inestabilidad clínica y los que necesitan ciertas intervenciones diagnósticas o terapéuticas (radiografía, tratamiento parenteral, oxigenoterapia o control de infecciones). Según Mehr, sería necesario internar a los pacientes con: dificultad respiratoria, depresión del sensorio, gran dependencia, recuento de leucocitos < 5 000 o > 20 000/mm3 e hipotermia 81. En la decisión del traslado al hospital deben considerarse la gravedad de los pacientes, la decisión previa del paciente o de los responsables del mismo de ser o no internado y la capacidad de las instituciones en cuanto a la atención de los pacientes.
NAC en el embarazo: Durante el embarazo, la neumonía es una infección frecuente y es la infección fatal más común, excluyendo causas obstétricas82. La mayor incidencia de asma, tabaquismo, deficiencias inmunes (por HIV o debida a medicamentos) y del uso de drogas ilícitas, han aumentado la prevalencia de NAC en los últimos años83. Los patógenos no difieren de los que afectan al resto de la población sana y joven; sin embargo, la incidencia y el curso de algunas virosis respiratorias como influenza y varicela son más complicados en embarazadas. Algunas de las dificultades que presenta la NAC en el embarazo tienen que ver con su diagnóstico. La reticencia en realizar radiografías de tórax en embarazadas puede retrasar el inicio del tratamiento. Las embarazadas con NAC requieren internación con frecuencia, tanto por la gravedad de sus manifestaciones clínicas como por las alteraciones fisiológicas que acompañan al embarazo (vómitos, anemia, dificultad respiratoria por el aumento del contenido abdominal, etc)84. Una complicación prevenible, la aspiración de contenido ácido gástrico descripta originalmente en mujeres durante una operación cesárea, puede presentarse con mucha gravedad y/o ser seguida de neumonía85.
NAC en pacientes con EPOC: Esta enfermedad prevalente y en ascenso, vinculada estrechamente al hábito de fumar, es una de las comorbilidades más frecuentes en pacientes con NAC27, 28. Los patógenos más comunes son Streptococcus pneumoniae, Chlamydia pneumoniae, Haemophilus influenzae, y gram-negativos aerobios86. Pacientes con un VEF1< 35%, uso de oxígeno crónico domiciliario, exacerbaciones frecuentes, neumonías previas o uso de esteroides de mantenimiento pueden tener peor pronóstico. Sin embargo, la presencia de EPOC no mostró relación con mortalidad en el estudio de derivación de factores de riesgo de Fine55.
3. Diagnóstico
Diagnóstico clínico
El diagnóstico de NAC es clínico, los métodos complementarios permiten confirmarlo, conocer su extensión, identificar la etiología, categorizar la gravedad y reconocer complicaciones. El interrogatorio, el examen físico, la RxTx y el laboratorio son la base del diagnóstico; la confirmación de la etiología depende de exámenes microbiológicos. El número de estudios a realizar depende de la gravedad y de las posibilidades del lugar de asistencia47. El diagnóstico requiere de un cuadro clínico compatible (síntomas como fiebre, nueva tos o secreciones purulentas más anomalías respiratorias focales en el examen físico) junto a un infiltrado pulmonar de reciente aparición7, 87 EB. Pacientes con comorbilidades o edad avanzada pueden tener formas oligosintomáticas6. La fiabilidad de los signos físicos está sujeta a variabilidad ínter-observador, el diagnóstico por el examen físico fue correcto en menos del 40% de los casos88. Además, el interrogatorio puede brindar algunos indicios en la orientación sobre la etiología involucrada. Algunos de esos elementos se muestran en la Tabla 15.
En oportunidades puede ser necesario realizar análisis clínicos de laboratorio, en especial en pacientes que puedan requerir internación. Debe solicitarse sólo aquellos estudios que han demostrado utilidad como indicadores de riesgo47, 55. El hemograma puede ser útil para evaluar el pronóstico; el descenso del hematocrito (< 30%), la leucopenia o una marcada leucocitosis denotan gravedad 47. La oximetría de pulso puede ser utilizada para evaluar la saturación y puede reemplazar o ser complementada con los gases en sangre. Urea, glucemia, función hepatocelular, ionograma y pruebas de coagulación agregan información útil89, 90. En pacientes con neumonía grave que requieren internación en UTI los estudios no difieren en general de los efectuados en cualquier paciente que se interna y deben ser adaptados a la situación clínica.
La RxTx antero-posterior y lateral permite definir: el tipo de infiltrado (alveolar, intersticial, bronconeumónico); complicaciones (derrame pleural, cavitación); imágenes sospechosas de proceso especifico (tuberculosis) y extensión (puede tener relación con la gravedad y el pronóstico)5. Los diagnósticos diferenciales incluyen atelectasia, enfermedad difusa del parénquima, insuficiencia cardiaca, cáncer de pulmón, bronquiolitis obliterante con neumonía organizativa (BOOP), vasculitis y embolia pulmonar EB. La tomografía axial computada de tórax puede demostrar infiltrados en pacientes con RxTx normal91.
Diagnóstico microbiológico
La sensibilidad y la especificidad de los métodos micro-biológicos para establecer la causa de la NAC, son relativamente bajas. Determinar la etiología permite plantear un tratamiento dirigido, rotar racionalmente a la vía oral, evitar el uso inadecuado de antibióticos y conocer la prevalencia y el patrón de sensibilidad a los antibióticos de los patógenos. Esta búsqueda de la etiología debe hacerse empleando criterios de costo-eficiencia; muchos expertos coinciden en que esto se justifica sólo ocasionalmente5-9, 20, 60. Los criterios de diagnostico etiológico definitivo y probable se transcriben en la Tabla 48 EC. Pueden existir etiologías mixtas en las NAC, en especial la asociación de S. pneumoniae con patógenos intra-celulares92.

Menos del 50% de los pacientes con NAC son capaces de producir un esputo de buena calidad (sin antibióticos previos, > 25 polimorfonucleares y < 10 células epiteliales planas bajo lente de 100 aumentos). En ese caso la especificidad del examen directo con tinción de Gram para S. pneumoniae y H. influenzae sería elevada (97 a 98%)93 EB. El cultivo del esputo tiene bajas sensibilidad y especificidad pero puede ser de utilidad frente a la sospecha de M. tuberculosis y otros agentes específicos menos prevalentes. También sirve para la vigilancia epidemiológica de algunos agentes como S. pneumoniae y H. influenzae EC. El esputo inducido no se recomienda para el estudio rutinario de la NAC salvo que se desee descartar M. tuberculosis o Pneumocystis carinii, siempre que se asegure una adecuada protección al personal frente al riesgo de contagio de tuberculosis. Otros especímenes tales como aspirado de tubo endotraqueal o cánula de traqueostomía tienen una utilidad similar a la del esputo.
El análisis cualitativo de una muestra obtenida por broncoscopia tiene el mismo o menor valor que el del esputo expectorado, por lo que se recomienda hacer cultivos cuantitativos del lavado broncoalveolar o del cepillo protegido para aumentar la especificidad de los estudios bacteriológicos. Su uso es recomendable cuando se desea descartar M. tuberculosis o P. carinii en pacientes que no producen un esputo adecuado; en contados casos de neumonía de diagnóstico incierto, especialmente cuando el paciente no responde al tratamiento estándar; cuando se sospecha obstrucción bronquial tumoral o no, en NAC grave que requiera internación en UTI e intubación y ante un fracaso terapéutico EB.
Los hemocultivos (2 muestras en distintos sitios de punción) se reservan para casos que requieran internación. Suelen ser positivos en 5 a 16% de los casos94, su utilidad para el diagnóstico, en la evaluación de riesgo y como guía del tratamiento se limitaría a pacientes con NAC grave65.
Ante un derrame pleural significativo debe realizarse toracocentesis con examen microbiológico, de pH y citoquímico del líquido. El cultivo positivo tiene pobre sensibilidad pero alta especificidad para la detección del germen EB.
Las pruebas serológicas son útiles para detectar gérmenes difíciles de cultivar como M. pneumoniae, C. pneumoniae, Legionella y virus respiratorios. La infección viral puede confirmarse buscando antígenos o por reacción de cadena de polimerasa (PCR) en materiales clínicos (hisopados, aspirados, lavados de vías aéreas superiores e inferiores, biopsias o en sangre); por serología y por aislamiento en cultivos.
Respecto a la evaluación diagnóstica en personas de bajos recursos, el médico debe extremar las medidas para suministrar un manejo diagnóstico y terapéutico adecuado. Frente a la imposibilidad de obtener una RxTx en un paciente joven, sin comorbilidades y con poco impacto de la enfermedad, es aceptable hacer el diagnóstico y prescribir el tratamiento a través de la clínica, sin detrimento para el paciente95. En los casos que presenten elementos sugestivos de un curso complicado, lo cual sucede en una minoría de las NAC, debería procederse a su derivación.
Evaluación diagnóstica en pacientes con sospecha de NAC.
Frente a la necesidad de ofrecer lineamientos para elegir la metodología diagnóstica adoptamos, con ligeras modificaciones, las recomendaciones de opción mínima y máxima realizadas en 1997 por la guía de Práctica Clínica para NAC5. Opción mínima indica la intensidad de medidas diagnósticas que representan el límite inferior aceptable para una buena calidad de evaluación, y opción máxima, medidas por encima de las cuales cualquier esfuerzo diagnóstico puede considerarse exagerado. Recomendamos:
En ambulatorios menores de 65 años y sin comorbilidades:
a) Opción mínima: RxTx de frente
b) Opción máxima: RxTx de frente y perfil, Gram y cultivo de esputo y recuento y fórmula leucocitarios
En ambulatorios > 65 años o con comorbilidades:
a) Opción mínima: RxTx de frente + laboratorio básico (hemograma, uremia, glucemia, orina)
b) Opción máxima: RxTx de frente y perfil + laboratorio básico + Gram y cultivo de esputo
En internados (neumonía "moderada", no en UTI):
a) Opción mínima: RxTx de frente + laboratorio según la situación clínica + exámenes microbiológicos habituales
b) Opción máxima: RXTx de frente y perfil + gases en sangre (u oximetría) + exámenes microbiológicos especiales
En NAC grave (internados en UTI):
a) Opción mínima: RxTx de frente y perfil + laboratorio según la situación clínica + exámenes microbiológicos habituales (incluyendo virus de inmunodeficiencia humana con consentimiento) + gases en sangre.
b) Opción máxima: ídem al anterior + exámenes microbiológicos especiales + considerar realizar estudios broncoscópicos con muestreo para bacteriología en pacientes intubados.
4. Tratamiento antimicrobiano de la NAC
El mejor tratamiento antibiótico es el que cura con restitución social precoz, induce mínimas reacciones adversas, y presenta costos ecológicos y financieros óptimos. Se debe ser eficiente en la utilización de los recursos, más aún en países en desarrollo y/o con crisis económica y social como ocurre en la mayor parte de Latinoamérica. El objetivo de estas recomendaciones es asistir al médico que atiende pacientes adultos inmunocompetentes con NAC, ofreciéndole un abordaje racional y práctico para el tratamiento antimicrobiano empírico inicial, basado en algunos principios.
Fundamentos del tratamiento antibiótico en la NAC
El tratamiento antibiótico debe aplicarse frente a un diagnóstico de NAC bien fundado, evitando hacerlo en infecciones banales de etiología habitualmente viral tal como la bronquitis aguda96 EC. En la práctica, el patógeno raramente se conoce de antemano y por ende el tratamiento inicial es empírico, debiendo ser activo frente a los patógenos más probables. La recomendación del antibiótico debe hacerse frente a un diagnóstico clínico, basándose en datos epidemiológicos y/o antecedentes del enfermo que ayuden a predecir los patógenos blanco. Si bien algunos agentes tienen similar resistencia en todo el mundo (Moraxella catarrhalis, micoplasma, clamydia y legionella), en otros la situación varía localmente; por esto es importante realizar estudios regionales, adecuadamente diseñados, de vigilancia de la resistencia en patógenos respiratorios. Un retraso del tratamiento de más de 8 horas luego de la consulta aumenta la mortalidad66 EB.
Streptococcus pneumoniae sigue siendo el principal agente etiológico. Las variaciones en su perfil de resistencia a los antibióticos beta-lactámicos han tenido escaso impacto clínico en infecciones respiratorias, especialmente en NAC97-102. Las consideraciones farmacodinámicas, que distinguen claramente la importancia clínica de la resistencia entre infecciones meníngeas y extrameníngeas, junto con la información proveniente de sistemas de vigilancia de resistencia, que muestran que prácticamente no se han identificado cepas con CIM > 4 mg/L en NAC en la Argentina, constituyen la base para recomendar dosis altas de penicilina o aminopenicilinas en el tratamiento de la NAC por neumococo, ya que así se alcanzan concentraciones antibióticas en secreciones respiratorias y parénquima pulmonar superiores a la CIM, aún en neumococos resistentes37-39, 103-105. Es recomendable que el tratamiento antibiótico inicial de un paciente con NAC siempre tenga adecuada actividad frente a S. pneumoniae.
Es preferible tratar la NAC con un solo antibiótico. El tratamiento combinado conlleva mayor costo y toxicidad, por lo que tiene indicación acotada. Se recomienda en NAC grave en pacientes que requieren internación en UTI y en infecciones documentadas o de alta sospecha por P. aeruginosa EC. En infecciones mixtas (S. pneumoniae más agentes atípicos) y en infección bacteriémica por neumococo en pacientes con NAC grave existen estudios que sugieren ventajas del tratamiento combinado; son necesarios estudios prospectivos para confirmar estos resultados 78, 106,107 EB.
La predicción de la etiología basada en la clínica como fundamento para indicar un tratamiento es controvertida. Sin embargo, una presentación clínica característica (comienzo brusco, dolor pleurítico) y sobre todo hallazgos fuertemente sugestivos de neumococo (esputo categórico o un antígeno urinario positivo), pueden justificar el dirigir el tratamiento hacia esa etiología60, 108 EB.
La estrategia de tratamiento de la NAC exige racionalidad en el uso de antibióticos, usando antibióticos activos frente a los patógenos blanco y prudencia en su uso para contener el fenómeno de resistencia bacteriana. Algunas recomendaciones para combatir la resistencia incluyen restringir el uso de cefalosporinas de 3ª generación y vancomicina en internados, ya que favorece el desarrollo de resistencia en bacilos gram-negativos y enterococo. Los macrólidos preocupan por el incremento de resistencia relacionado con su uso exagerado; se ha descrito fracaso clínico en bacteriemia por gérmenes resistentes en pacientes bajo este tratamiento109, 110. Respecto a las fluoroquinolonas, se recomienda usarlas con prudencia ya que su uso indiscriminado en otras infecciones respiratorias y no respiratorias menos graves aceleraría el desarrollo de resistencia en S. pneumoniae y gram-negativos111-113. No debe utilizarse cotrimoxazol en el tratamiento empírico de la NAC ya que la resistencia de los patógenos respiratorios es muy elevada101 .
Reiterar sistemáticamente la indicación de la misma clase de antibióticos en pacientes con infecciones respiratorias frecuentes se correlaciona con la aparición de resistencia y podría ser indicación de utilizar antibióticos de otro grupo (entre b-lactámicos, macrólidos, fluoroquinolonas, etc) o individualizar mejor la dosis109, 114-117 EC.
En esta guía solo se recomiendan antibióticos y presentaciones disponibles en el comercio en Argentina. Algunos antibióticos activos frente a los patógenos de NAC no han sido analizados en la reunión de consenso por haber sido comercializados posteriormente; entre ellos la telitromicina, un nuevo ketólido derivado de los macrólidos que tiene acción sobre la mayoría de los patógenos productores de NAC, incluyendo aquellos resistentes a macrólidos y lincosaminas118, 119.
Antibióticos no recomendados en esta guía podrían resultar adecuados en algunas circunstancias, incluyen al cloranfenicol, cuya actividad y sensibilidad podrían hacerlo útil frente a la mayoría de los patógenos de NAC; su costo es bajo y si bien puede producir aplasia medular, se continúa utilizando en algunos lugares de Latinoamérica120 EC. La doxiciclina es un antibiótico cuya utilización podría ser revalorizada si nuevos datos epidemiológicos confirman su actividad en nuestro medio. Deberían confirmarse por ensayos clínicos la eficacia y seguridad de estos últimos regímenes.
Un grupo reducido de pacientes puede sufrir NAC por Pseudomonas aeruginosa, entre ellos enfermos con NAC grave internados en UTI. Se presenta en pacientes con condición predisponente como grave alteración estructural del pulmón, especialmente bronquiectasias, EPOC avanzada, enfermedad fibroquística o internación previa y/o uso de maniobras invasivas vinculadas a la terapia respiratoria. Este agente también se asocia a mayor mortalidad48, 121, 122 EC.
Cuando la NAC se presenta durante el embarazo conlleva mayor riesgo de morbilidad y complicaciones. El diagnóstico precoz y el inicio a tiempo de un tratamiento adecuado mejoran el pronóstico. Se deben evaluar los riesgos de la infección junto con los de los efectos adversos de las drogas sobre madre e hijo en gestación.
Esquemas de tratamiento antibiótico empírico
Grupo 1 (pacientes ambulatorios): El punto de partida de la prescripción de antibióticos es la presunción deuna causa bacteriana. La NAC en pacientes ambulatorios es en general un proceso de curso benigno pero ocasionalmente puede evolucionar hacia una enfermedad grave. La prescripción deberá hacerse teniendo en cuenta la incidencia y el patrón de resistencia de los agentes considerados en el grupo poblacional y en el área geográfica en cuestión. Streptococcus pneumoniae es el patógeno más común y potencialmente causante de cuadros más graves, pero además debe considerarse la frecuencia significativa de gérmenes intracelulares causantes de NAC en estos pacientes (Tabla 2). Si bien la amoxicilina no es activa frente a todos los patógenos del grupo 1, es aceptable su uso inicial en pacientes ambulatorios jóvenes y sin comorbilidades, ya que en ellos un eventual tratamiento inapropiado sin respuesta a las 72 horas puede corregirse sin correr mayores riesgos123. Macrólidos y doxiciclina cubren la mayoría de estos patógenos blanco y son una indicación alternativa de inicio. Los pacientes con NAC de manejo ambulatorio mayores de 65 años, fumadores y/o con comorbilidades (EPOC, insuficiencia cardíaca, diabetes, alcoholismo crónico, insuficiencia renal crónica, ver Tabla 1) pueden presentar H. influenzae (potencial productor de b-lactamasas), S. aureus, e infrecuentemente BGNA, por lo que los antibióticos deben elegirse considerando estas etiologías (Tabla 5).

Grupo 2 (internados en sala general): La internación en sala general se debe casi siempre a la presencia de factores de riesgo de curso complicado. En este grupo los patógenos blanco son S. pneumoniae, H. influenzae, virus respiratorios, M. pneumoniae, C. pneumoniae, S. aureus, BGNA y, menos frecuentemente, Legionella sp. Una aminopenicilina más inhibidor de beta-lactamasas, o una cefalosporina de tercera generación, tienen actividad frente a la mayoría de las causas bacterianas. La cobertura inicial de gérmenes atípicos en este grupo es discutida. Dado que han sido descriptos pocos casos de Legionella en nuestra región, y que existen argumentos a favor y en contra de cubrir gérmenes atípicos en los pacientes de este grupo, podría no ser necesario el uso siempre de antibióticos con actividad frente a estas bacterias intracelulares en muchos de los pacientes con NAC que requieren internación en sala general19, 27, 124. De modo similar al grupo 1, los mayores de 65 años, fumadores y/o con comorbilidades o residentes en geriátricos (Tabla 1)pueden presentar H. influenzae (potencial productor de b-lactamasas), S. aureus, e infrecuentemente BGNA, por lo que los antibióticos deben elegirse considerando estas etiologías (Tabla 5). Cuando la causa de internación es un motivo social o imposibilidad de recibir la medicación por vía enteral, los patógenos blanco y cobertura antibiótica recomendada siguen siendo los correspondientes al grupo 1. Un grupo seleccionado de pacientes: menores de 65 años sin comorbilidades, con cuadro clínico sugestivo y evidencia confiable (directo de esputo o antígenos) de etiología neumocóccica y sin criterios de severidad, podría tratarse con ampicilina IV; en ellos, claritromicina o clindamicina por vía intravenosa podrían ser alternativas (Tabla 5).
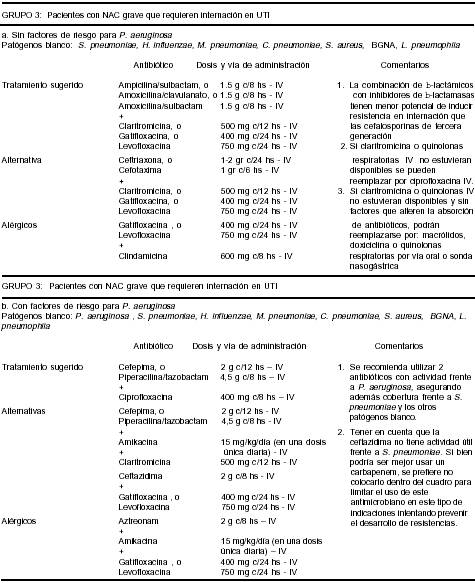
Grupo 3 (neumonía grave, internados en terapia intensiva): El motivo más frecuente de internación en estas unidades es insuficiencia respiratoria, necesidad de monitoreo hemodinámico o shock125. Los microorganismos causales son casi los mismos que para el grupo 2, con mayor frecuencia de etiología mixta y bacilos gram-negativos incluyendoP. aeruginosa48, 121. Los pacientes con NAC grave tienen alta mortalidad; la misma ha sido relacionada – entre otras causas – al uso de antibióticos inadecuados, de modo que es crítico iniciar rápidamente el esquema empírico usando antimicrobianos efectivos contra los patógenos involucrados48, 64. La combinación de b-lactámicos (aminopenicilina) + inhibidor de b-lactamasas o ceftriaxona/cefotaxima asociados a un macrólido o a una fluoroquinolona (por su acción frente a intracelulares), brindan una adecuada cobertura en la mayoría de estos casos. Las evidencias sugieren que l NAC por neumococo tiene mejor evolución si es tratada con 2 antibióticos a los cuales es sensible que con uno, por lo cual se justificaría ampliar la cobertura78, 106, 107.Cuando existan factores de riesgo para P. aeruginosadeberían cubrirse; en general se acepta que deben usarse 2 antibióticos activos frente al mismo, además de cubrir al resto de los patógenos potenciales (ver más abajo)121 (Tabla 5).
Tratamiento en situaciones especiales
Embarazo: El embarazo no predispone a etiologías específicas, debiendo considerarse las ya enumeradas. Se recomienda usar los antibióticos de mayor seguridad para el feto, como ß-lactámicos, eritromicina (etilsuccinato, no estolato) y azitromicina. Evitar usar otros macrólidos, fluorquinolonas, doxiciclina y aminoglucósidos, a menos que representen las únicas opciones terapéuticas.
Factores de riesgo para P. aeruginosa: Este agente se asocia con NAC grave, aunque puede provocar cuadros menos serios. Aun cuando el paciente pueda estar internado en sala general, se recomiendan los mismos regímenes terapéuticos del Grupo 3 b, con actividad frente a P. aeruginosa y el resto de los patógenos del grupo 3a.(Tabla 5).
Aspirativa: Puede usarse aminopenicilina + inhibidor de b-lactamasas como monoterapia. La clindamicina es una alternativa. Si hay riesgo de infección por BGNA (infección mixta) se sugiere combinar un antibiótico con actividad frente a estos microorganismos (ciprofloxacina o cefalosporina de tercera generación) con un anti-anaeróbico (clindamicina o metronidazol) (Tabla 5).
EPOC: El tratamiento de individuos con comorbilidades es apropiado para los pacientes con EPOC y NAC. Datos controvertidos sugieren que agregar corticoides mejoraría el pronóstico en ellos126 EC.
5. Duración del tratamiento y evaluación de la respuesta
No hay evidencias de peso que permitan hacer una recomendación fundada acerca de la duración del tratamiento de la NAC. El tratamiento busca eliminar al microorganismo patógeno rápidamente, y esto probablemente ocurra en no más de 3 días para S. pneumoniae. El cuadro clínico tarda mucho más en mejorar ya que depende de las alteraciones fisiológicas que persisten más allá de la eliminación del agente infectante. La duración del tratamiento dependerá finalmente del juicio clínico del médico que atienda al paciente, en forma orientativa puede decirse que una NAC leve a moderada puede curar con 7 días de tratamiento. Los internados pueden necesitar hasta 10 a 14 días y no se justificaría prolongar el tratamiento más allá.
Recientes estudios clínicos indican que en las NAC que requieren internación es posible cambiar el antibiótico desde la vía IV a la oral rápidamente, una vez que el paciente muestra evidencias de mejoría clínica durante los primeros días de hospitalización. La terapia oral precoz puede ser secuencial (cuando en el pasaje se usa la misma droga con niveles séricos equivalentes y similar biodisponibilidad) o desescalonada: cuando se disminuye el nivel de la droga en sangre al realizar el pasaje. La evolución clínica usando las distintas modalidades no suele mostrar diferencias. El paciente candidato a realizar el cambio de la terapia IV a oral debe reunir algunos criterios, a saber: mejoría de la tos y taquipnea, temperatura menor de 37,8°C durante 8 hs. y adecuadas ingesta oral y absorción gastrointestinal, que no interfieran con la disponibilidad de la medicación. Entre los pacientes no aptos para el cambio precoz (switch therapy) se encuentran los que han tenido bacteriemia por Staphylococcus sp., infección por P. aeruginosa, por S. pneumoniae con compromiso extrapulmonar y neumonía por Legionella. Los agentes antimicrobianos deben reunir ciertas características para ser aptos para terapia switch, incluyendo: buena absorción, adecuado nivel en sangre y posología adecuada. Que el paciente pueda pasar rápidamente a la vía oral no necesariamente significa que sea apto para el alta hospitalaria temprana. Puede dejar el hospital rápidamente luego de pasar a la vía oral, o permanecer en el hospital, sobre todo cuando presenta comorbilidades como insuficiencia cardíaca congestiva, diabetes, arritmia; necesita realizarse estudios (fibrobroncoscopia) o necesita continuar su control o tratamiento intrahospitalario por otros problemas diferentes de la NAC, incluyendo razones sociales.
Neumonías que no responden al tratamiento
La neumonía que no responde se define por la persistencia del infiltrado acompañada de fiebre, producción de esputo, dolor torácico o disnea, más allá del tiempo estimado para su resolución127. La falta de respuesta puede ser temprana: falta de evidencia de respuesta clínica a las 72 horas de iniciado el antibiótico (falla de tratamiento); o tardía: inadecuada mejoría radiológica a los 40 días de comenzado el tratamiento (resolución lenta).
La resolución lenta está básicamente relacionada con la alteración de los mecanismos de defensa, esto se observa en diabetes, insuficiencia cardíaca, falla renal aguda o crónica, alcoholismo, cáncer y edad mayor de 65 años128-131. En general es más común en hospitalizados que en ambulatorios, señalando que la gravedad de la neumonía o la presencia de comorbilidad puede ser importante.
Frente a una neumonía con falla temprana se debe reconsiderar si el diagnóstico de NAC fue correcto, si tiene un curso clínico que es más prolongado que lo previsto, si el tratamiento instituido es apropiado y si está presente un patógeno inusual y/o resistente al tratamiento administrado:
Curso prolongado: La historia natural de la NAC está determinada por factores del huésped y la virulencia del agente causal. La mayoría de los pacientes mejoran clínicamente al cabo de 3 días. La RxTx requiere mayor tiempo para su resolución, por lo que sólo se justifica su repetición frecuente cuando el cuadro general presenta un curso tórpido. La mayor parte de los estudios que evaluaron la resolución radiológica se realizaron en pacientes hospitalizados. La resolución del infiltrado ocurre a las 2 semanas en la mitad, a las 4 semanas en dos tercios y a las 6 semanas en tres cuartas partes de los casos132 EB. El tabaquismo, el alcoholismo, la presencia de derrame pleural paraneumónico, y la etiología por Legionella, S. aureus y gram-negativosentéricos se asocian a una resolución más lenta. El tratamiento inapropiado es otro motivo de lenta evolución.
Tratamiento inapropiado: puede deberse a error en la administración del antibiótico, por dosis bajas o porque la vía utilizada no es la adecuada (por ej. mala absorción intestinal por íleo paralítico; mala adherencia del paciente, quien no recibió la dosis indicada o suspendió personalmente el antibiótico; insuficientes niveles plasmáticos o tisulares: cuando se encuentran por debajo de la CIM, especialmente en las NAC bacteriémicas, o en pacientes con enfermedad estructural del pulmón que no consiguen concentraciones tisulares adecuadas; (por ej: bronquiectasias y abscesos); interacciones medicamentosas que impiden la absorción adecuada; resistencia bacteriana: como ejemplo una infección por H. influenzae que no está cubierto por el esquema empírico inicial o una etiología viral; patógenos inusuales que no responden al tratamiento no suelen ser cubiertos por esquemas empíricos ni detectados por los exámenes bacteriológicos de rutina, incluyendo las micobacterias, hantavirus, leptospira, micosis, Actinomyces sp, P. carinii, Bacillus antracis, Pasteurella multocida, P. pestis y Francisella tularensis.
Diagnóstico incorrecto: la NAC no es la única causa de fiebre con infiltrados pulmonares; una embolia de pulmón, procesos de etiología diversa como BOOP o neumonía eosinofílica crónica, aspiración de partículas o contenido gástrico no-infeccioso, enfermedades inmunológicas, neoplasias y toxicidad por drogas pueden tener presentaciones similares. La BOOP se presenta con fiebre, disnea y decaimiento acompañados de infiltrados pulmonares en la radiografía de tórax; el diagnóstico es establecido por biopsia broncoscópica o quirúrgica133. La neumonía eosinofílica crónica se manifiesta por síntomas generales, tos y fiebre, generalmente con infiltrados bilaterales periféricos que responden a los corticoides. La aspiración puede causar también infiltrados y fiebre de causa no-infecciosa, dependiendo de su patogenia, la aspiración puede ser recurrente. Entre las enfermedades inmunológicas, la granulomatosis de Wegener, la neumonitis lúpica y las vasculitis pueden presentarse con infiltrados segmentarios en un tercio de los casos. Las neoplasias (especialmente el carcinoma bronquioloalveolar128) o los linfomas134, pueden confundirse con una NAC; también los tumores endoluminares pueden producir una neumonía postobstructiva que aun puede responder al tratamiento antibiótico, lo cual suele retardar el diagnóstico del tumor. Las drogas suelen presentar un compromiso difuso del pulmón, sin embargo, algunas drogas como la amiodarona, pueden presentarse como infiltrados alveolares localizados.
Evaluación diagnóstica: La falla de tratamiento temprana o tardía requiere revisar los cultivos y tomar nuevas muestras, prefiriendo los métodos de mayor sensibilidad y especificidad. La broncoscopia puede ser útil en esta circunstancia en más de la mitad de los casos128, 135; se debe recolectar el material de LBA y/o cepillo protegido y además realizar biopsia transbronquial cuando se sospecha una causa no-infecciosa136. La TAC de tórax puede ser útil para determinar la extensión y características de la enfermedad en la NAC que no responde.
6. Tratamiento no antimicrobiano y prevención
Hidratación
En pacientes internados con NAC, y principalmente los mayores de 65 años, el suministro de fluidos es fundamental debido a que frecuentemente presentan disminución del volumen intravascular y requieren hidratación intravenosa con cristaloides. En ancianos, las pérdidas de líquido por hiperventilación y sudoración por hipertermia pueden no ser adecuadamente contrabalanceadas, con el ingreso por vía oral, especialmente cuando existe alteración cognitiva. En pacientes con sepsis por neumonía u otras causas, la administración inicial de cristaloides e inotrópicos con monitoreo y objetivos hemodinámicos definidos mostró disminución de la mortalidad respecto al manejo convencional137 EA.
Aunque es indispensable mantener un volumen circulante adecuado, la neumonía es un proceso inflamatorio, que puede generar edema alveolar por alteraciones en la permeabilidad capilar y empeorar la situación respiratoria, si la cantidad de líquidos aportados es excesiva. La elevación de la presión hidrostática asociada con el incremento de la permeabilidad capilar puede aumentar el agua intrapulmonar, con deterioro consecuente de la oxigenación. Se ha sugerido que una disminución del aporte de fluidos o la realización de balance hídrico negativo podría descender la morbi-mortalidad en pacientes con injuria pulmonar aguda o síndrome de distrés respiratorio agudo138 EC, pero no hay evidencia suficiente que soporte que la restricción de líquidos o el uso sistemático de diuréticos disminuya la mortalidad en esta patología139 EA.
Soporte nutricional
El estado nutricional juega un papel importante en el funcionamiento del sistema inmunitario, habiéndose determinado que los pacientes añosos con mal estado nutricional tienen mayor incidencia de NAC43, 70. Es un factor a tener en cuenta tanto para la prevención de NAC como para disminuir el riesgo de muerte140. Las indicaciones para el soporte nutricional incluyen la desnutrición previa, la imposibilidad de alimentación oral actual y la presencia de fallos orgánicos141. El inicio temprano de la nutrición puede acelerar la recuperación de los enfermos y disminuir la aparición de infecciones nosocomiales y otras complicaciones.
En los pacientes con NAC la mejoría del estado nutricional favorece su recuperación, y la nutrición debe ser iniciada lo más temprano posible43 EB. En pacientes que no puedan alimentarse bien por vía oral (trastornos deglutorios, compromiso del sensorio, etc.) se recomienda la nutrición enteral, ya que mantiene la integridad de la barrera gastrointestinal con reducción del riesgo de sepsis y otras complicaciones severas y acarrea menos costos que la nutrición parenteral142-144 EA.
Oxigenoterapia
La neumonía puede generar deterioro del intercambio gaseoso debido a su extensión, al compromiso de un pulmón previamente enfermo o a ambas causas. La hipoxemia suele obedecer a una reducción de la relación ventilación /perfusión (V/Q) que puede llegar al shunt intrapulmonar.
Dado que el reconocimiento clínico de la hipoxemia no es fiable, es recomendable medir la saturación arterial de oxígeno (SaO2) y si está disminuida, administrar oxígeno (O2) para corregirla a valores superiores a 92%. En los portadores de EPOC es conveniente el control con gases en sangre: la corrección a valores normales puede inducir hipercapnia con acidosis y deterioro clínico; en estos enfermos se debe administrar O2 con fracciones de oxígeno adecuadas para alcanzar valores de PaO2 de 55-60 mmHg (suele corresponder a SaO2 88-90%), evitando superar estos niveles. El objetivo de la oxigenoterapia es aumentar el contenido arterial de O2, evitando las concentraciones tóxicas.
Cuando la hipoxemia es leve, se puede alcanzar la corrección utilizando cánulas nasales con flujo de 1 - 5 L/min que cumplen con el objetivo y resultan cómodas para el paciente. Las máscaras tipo Venturi proporcionan fracciones inspiradas de oxígeno de diferente magnitud de entre 0,24 y 0,50 con seguridad; están especialmente indicadas cuando se desea evitar el riesgo de inducir hipercapnia secundaria a la corrección de la hipoxemia. Se ha demostrado que la administración de oxígeno disminuye la morbimortalidad de los pacientes internados por NAC145 EC. Se debe monitorizar el resultado obtenido midiendo la saturación arterial de O2 por oximetría, o determinando los gases en sangre arterial.
Humidificación, kinesioterapia torácica y mucolíticos
Excepto en pacientes traqueostomizados o con tubo endotraqueal, no está demostrado que los pacientes que reciben oxígeno a flujo bajo o moderado se beneficien del uso de sistemas de humidificación146.
Tanto la utilización de mucolíticos como las maniobras de vibración y percusión no han demostrado fehacientemente su utilidad en la neumonía147 EA.Por otro lado, el drenaje postural, la tos asistida y la kinesioterapia torácica pueden ayudar en pacientes con un volumen diario de expectoración > 25 ml o con atelectasias, en quienes se ha demostrado mejoría en el intercambio de gases148 EA.
Si bien la kinesioterapia no parece modificar la evolución en la NAC, quienes manejan estos enfermos opinan que contribuye a mejorar el manejo de se-creciones en pacientes añosos o debilitados, con tos inefectiva EC.
Cuando se decida utilizar fisioterapia respiratoria, se recomienda la administración previa de broncodilatadores para evitar la inducción de broncoespasmo por la fisioterapia y para incrementar la eliminación de secreciones149.
Broncodilatadores
El uso de b-agonistas (como salbutamol o fenoterol) y/o anticolinérgicos (bromuro de ipratropio), está indicada en pacientes con NAC portadores de patología obstructiva conocida: asma, EPOC, bronquiectasias, enfermedad fibroquística, o ante la presencia de broncoespasmo. Se deben administrar por vía inhalatoria (nebulización o aerosol con espaciador)145, 149.
Proteína C recombinante humana activada (dotrecogin alfa activado)
Recientemente se ha demostrado que la administración de dotrecogin alfa activado en pacientes con sepsis y disfunción orgánica por neumonía u otras causas, reduce la mortalidad en pacientes con formas clínicas graves evaluadas por escore de APACHE > a 25 puntos150 EA. Si bien se obtuvieron estos beneficios, debe tenerse en cuenta que se trata de un tratamiento altamente costoso y que puede generar complicaciones hemorrágicas.
Glucocorticoides en la NAC
Los corticoides intervienen en la modulación de la respuesta inflamatoria en el pulmón, pero su rol en la neumonía bacteriana no está establecido151 EC. En pacientes portadores de EPOC que sufren exacerbación por neumonía con obstrucción al flujo aéreo significativa, se puede administrar corticoides si la respuesta a broncodilatadores es inadecuada y han previamente respondido a esteroides152 EA.
Tratamiento del fallo respiratorio
Un 14% de los enfermos ventilados en terapia intensiva corresponde a pacientes con neumonía y fallo respiratorio agudo153. La mortalidad de los pacientes con NAC internados en las UTI que requieren ventilación mecánica convencional con intubación endotraqueal (IET) es muy alta62, 64, 153.
Si bien no se dispone de estudios controlados con número amplio de enfermos, distintos ensayos muestran una respuesta favorable a la aplicación de ventilación mecánica no invasiva (VMNI) en pacientes con NAC y falla respiratoria aguda: mejoría del intercambio gaseoso, reducción de la necesidad de ventilación mecánica convencional y de sus complicaciones y disminución de la mortalidad en portadores de enfermedad pulmonar crónica que cursan con NAC154-158. Todavía no puede recomendarse su uso rutinario en la NAC con falla respiratoria aguda. En pacientes seleccionados que no mejoran con medidas convencionales de oxigenación, puede utilizarse la VMNI con el fin de disminuir la IET, las complicaciones asociadas a la ventilación mecánica convencional y los días de estadía en UTI y en el hospital156 EB. El procedimiento debe realizarse en un ámbito adecuado, por un equipo familiarizado con la técnica y sus riesgos; habrá de utilizarse bajo estricto control, evitando demorar la IET cuando la evolución no es favorable en las primeras horas de utilizado.
Manejo del derrame paraneumónico y del empiema
Hasta el 57% de los pacientes puede tener derrame paraneumónico. Un 5 a 7% de los que se internan pueden sufrir empiema159. La incidencia de empiema bajó mucho en la era post-antibiótica. Los métodos diagnósticos incluyen imágenes (para la valoración anatómica) y análisis del líquido. Entre las imágenes, la Rx Tx. en decúbito lateral permite evaluar si el derrame se desplaza libremente y cuantificar su volumen. La ecografía permite confirmar un derrame dudoso y dirigir la punción. La TAC permite diferenciar colecciones intrapulmonares de pleurales y detectar loculaciones o paqui-pleura.
El análisis del líquido incluye exámenes microbiológicos, medición del pH, de la glucosa y de la lactato deshidrogenasa (LDH) y recuento de leucocitos.
La conducta se debe adecuar al riesgo de mala evolución (mortalidad, secuelas, re-intervención). El riesgo se valora según la anatomía del espacio pleural, la bacteriología y las características bioquímicas del líquido159. Cuando el derrame está libre y su volumen es pequeño (< 10 mm en la Rx. en decúbito lateral) no es necesario tomar ninguna conducta. Si es abundante pero menor a la mitad del hemitórax, se debe examinar el líquido160. El drenaje con tubo pleural está indicado cuando el aspecto es francamente purulento, cuando se observan gérmenes en la tinción o en los cultivos y si el pH es inferior a 7.20. También está indicado cuando el volumen es mayor a medio hemitórax, existe derrame loculado o pleura parietal engrosada. Si no se puede medir el pH o sus niveles no son definitorios, la glucosa menor a 60 mg/dL indica la necesidad de drenaje. Niveles de LDH superiores a 1 000 U/L también son orientadores de avenamiento pleural159-161 EB. En situaciones intermedias pueden realizarse punciones repetidas con análisis del líquido, y determinar la conducta según la evolución.
Frente a un derrame fibrinopurulento o empiema es conveniente realizar una TAC de tórax para determinar mejor la conducta. En los pacientes con derrame voluminoso o multiloculado, o en los que un tubo pleural no resuelve adecuadamente el problema, el uso de fibrinolíticos (estreptoquinasa o uroquinasa), cirugía asistida por video o toracotomía son opciones aceptables, asociadas a menor mortalidad y menor necesidad de re- intervenciones159, 162, 163 EC. La evolución hacia la paquipleura puede requerir decorticación pleural a fin de reducir las secuelas funcionales.
Prevención de la NAC
Dentro de las medidas potencialmente útiles en la prevención de la NAC deben considerarse la profilaxis contra neumococo e influenza; la prevención de aspiración orofaríngea o gástrica debida a trastornos de la deglución o de los reflejos protectores de la vía aérea superior, el cuidado del estado nutricional y la suspensión del hábito de fumar.
Vacuna antineumocóccica
La vacuna antineumocóccica de polisacáridos en uso (desde 1983) es considerada segura e incluye 23 antígenos capsulares polisacáridos de Streptococcus pneumoniae, que representan entre 85 y 90% de los serotipos que causan infección neumocóccica invasiva en EE.UU., incluyendo los seis serotipos más frecuentes con resistencia antibiótica164.
Entre dos y tres semanas luego de la vacunación se desarrollan anticuerpos en más del 80% de los adultos inmunocompetentes vacunados, con títulos variables para los distintos serotipos. No se ha definido cuál es el nivel de título protectivo. La respuesta es menor en inmunocomprometidos. No se ha demostrado la eficacia de la vacuna en la prevención de enfermedad neumocóccica no invasiva165-167 EA. Su efectividad en la prevención de la enfermedad invasiva varió entre el 56 y el 81%, demostrando ser costo-efectiva en mayores de 65 años168, 169 EB. El nivel de anticuerpos permanece elevado durante cinco a diez años. Existe controversia acerca de la necesidad de revacunar aunque la revacunación está contraindicada antes que transcurran tres años por el riesgo de reacciones severas.
Las indicaciones de vacunación anti-neumocóccica se muestran en la Tabla 6, todos los mayores de 2 años con esas indicaciones deben ser vacunados. Dado que más de la mitad de los pacientes hospitalizados con enfermedad neumocóccica han estado internados en los cinco años previos170, se recomienda la vacunación durante la internación, previa al alta.
Vacuna antigripal
La influenza tiene un doble impacto ya que puede provocar tanto neumonía primaria como neumonía bacteriana secundaria. La vacunación anual antes de la temporada de influenza constituye el método principal de prevención frente a la influenza y sus complicaciones. La vacuna contiene las tres cepas (2 de tipo A y 1 de tipo B) con mayor probabilidad de circulación en la temporada en curso.
Está recomendada para todos los mayores de 6 meses que por edad o enfermedad subyacente tengan un riesgo incrementado de complicaciones (Tabla 6). Asimismo, debe ser vacunado el personal de salud y los convivientes de estas personas, para reducir la posibilidad de transmitirles influenza171.
La vacunación reduce la incidencia de enfermedad respiratoria, hospitalización y muerte vinculada a influenza en personas con riesgo aumentado172-174 EB. Su efectividad depende de la edad, el estado inmune del receptor y el grado de similitud entre los virus de la vacuna y circulantes. Cuando son coincidentes, la vacuna previene la influenza en el 70 a 90% de personas sanas menores de 65 años175.
Las personas con enfermedades crónicas y los ancianos suelen desarrollar un nivel más bajo de anticuerpos y por lo tanto se mantienen susceptibles a la enfermedad. Aun así la vacuna puede prevenir complicaciones secundarias y reducir el riesgo de internación y muerte174, 176, 177. Demostró ser efectiva en entre un 30 y un 70% de ancianos no institucionalizados para prevenir internación por neumonía o influenza178. En ancianos en geriátrico logró una efectividad de 50 a 60% previniendo el desarrollo de neumonía, y del 80% previniendo la muerte179. La vacuna es costo-efectiva en relación a reducción de gastos de salud y pérdida de productividad180. Existe una sub-utilización de este recurso en nuestro medio. Es útil identificar pacientes en riesgo durante el curso de una internación a fin de ofrecerles la inmunización contra influenza

Antivirales
Los antivirales son útiles en la quimioprofilaxis de la influenza y son un complemento al uso de la vacuna, pero no son un sustituto de la misma. Existen cuatro drogas disponibles con actividad contra el virus de influenza. La amantadina y la rimantadina, son inhibidores de la proteína M viral y poseen actividad contra el virus de tipo A pero no sobre el B. El oseltamivir y el zanamivir son inhibidores de neuraminidasa viral y tienen acción contra los virus del tipo A y B181. Estos antivirales pueden usarse en la profilaxis y el tratamiento. Administradas dentro de los dos días del comienzo de los síntomas, estas drogas reducen la duración de la influenza no complicada. Ninguna ha demostrado ser efectiva en prevenir complicaciones severas (neumonía, exacerbación de enfermedades crónicas)15.
Amantadina y rimantadina tienen un 70 a 90% de efectividad en prevenir influenza A. No interfieren en la formación de anticuerpos entre los que desarrollan enfermedad subclínica o los que son vacunados181. Oseltamivir y zanamivir poseen una eficacia similar en la prevención de la influenza. No hay datos de eficacia para ninguna de las cuatro drogas en la prevención en inmunocomprometidos171.
Está indicado el uso de estos antivirales en la profilaxis de influenza en personas de alto riesgo que al comenzar la actividad de influenza en la población no han sido vacunadas. Esto incluye a pacientes HIV y cualquier otra persona con riesgo para su salud en caso de desarrollar influenza.
Consideraciones en pacientes con riesgo de aspiración orofaríngea o gástrica
La aspiración debida a anormalidades en la deglución y en los reflejos protectores de la vía aérea superior es un importante mecanismo patogénico presente en algunos pacientes, especialmente en ancianos, y puede conducir al desarrollo de NAC. Las medidas tendientes a minimizar el riesgo de aspiración incluyen: identificar las personas con riesgo aumentado (particularmente con enfermedad vascular o degenerativa del sistema nervioso central); evaluar clínicamente o mediante estudios complementarios el mecanismo de la deglución; aplicar criteriosamente la alimentación enteral por sonda o gastrostomía en los pacientes que puedan beneficiarse de esas medidas; utilizar prudentemente los sedantes e hipnóticos; individualizar la terapéutica incluyendo la modificación de los alimentos y la reeducación y entrenamiento de la deglución, posición semi-sentado y realización de maniobras que reduzcan el riesgo de aspiración. Los pacientes con riesgo de aspiración deben ser colocados en un ángulo de 45º cuando se alimentan; la dieta debe tener consistencia adecuada41 EC. La alimentación por sonda nasogástrica o gastrostomía percutánea no impide la aspiración (puede incluso favorecerla) y requiere un manejo cuidadoso EC. Todo esto cuidando que el paciente continúe alimentado con normalidad.
Otras medidas de prevención: Mantenimiento del estado nutricional, su importancia se describe más arriba; Supresión del hábito de fumar, su instrumentación sobrepasa el foco de este trabajo.
Agradecimientos: la realización de la presente guía y su publicación pudo llevarse a cabo gracias al sostén económico realizado mediante un aporte irrestricto efectuado por los siguientes laboratorios de la industria farmacéutica: Abbott, Astra Zeneca, Aventis, Bagó, Bayer, Bristol-Mayer-Squibb, Jansen, Merck-Sharp & Dohne, Pharmacia Argentina y Roche.
1. Société de Pathologie Infectieuse de Langue Française. Infections des voies respiratories. Conférence de consensus en thérapeutique anti-infectieuse. Rev Med Infect 1991; 191: 1S-8S. [ Links ]
2. British Thoracic Society. Guidelines for the management of community-acquired pneumonia in adults admitted to hospital. Br J Hosp Med 1993; 49: 346-50. [ Links ]
3. American Thoracic Society. Guidelines for the initial management of adults with community-acquired pneu-monia: diagnosis, assessment of severity and initial antimicrobial therapy. Am Rev Respir Dis 1993; 148: 1418-26. [ Links ]
4. Gialdroni-Grassi G, Branchi L. Guidelines for the management of community-acquired pneumonia in adults. Monaldi Arch Chest Dis 1995; 50: 21-7. [ Links ]
5. Luna CM, Efron E, Schiavi E, et al. Neumonía adquirida en la comunidad, guía de práctica clínica para la Argentina. Medicina (Buenos Aires) 1997; 57: 343-55. [ Links ]
6. Calmaggi A, Clara L, González Arzac M, Levi Hara G, López Furst MJ. Guías para el diagnóstioc y tratamiento de la neumonía adquirida en la comunidad en adultos, http://www.sadi.org.ar/nac_1.doc. [ Links ]
7. American Thoracic Society. Guidelines for the management of adults with community-acquired pneu-monia. Diagnosis, assessment, of severity, antimicrobial therapy and prevention. Am J Respir Crit Care Med 2001; 163: 1730-54. [ Links ]
8. British Thoracic Society guidelines for the management of community acquired pneumonia in adults. Thorax 2001; 56 (Suppl 4): 1-64 [ Links ]
9 Casellas JM, Smayevsky J, Jones RN, et al. Prevalence of antimicrobial resistance among respiratory tract isolates in two medical centers in Argentina: 1997 and 1998 results from the SENTRY Antimicrobial Surveillance Program. 9th. International Congress on Infectious Diseases. Buenos Aires, abril 2000. Abstract 43.011 2 000 [ Links ]
10. Bartlett JG, Breiman RF, Mandell LA, File TM. Community -Acquired Pneumonia in Adults: Guidelines for Mana-gement. Clin Infect Dis 1998; 26: 811-38. [ Links ]
11. Boletín Epidemiológico Nacional, Ministerio de Salud y Acción Social, Secretaría de Salud, Subsecretaría de Salud, Dirección Nacional de Medicina Sanitaria, Dirección de Epidemiología año 2001. [ Links ]
12. Kanno MB, Brown PD. Community acquired pneumonia: An Overview. Curr Infect Dis Report 1991; 1: 49-56. [ Links ]
13. Cassiere HA, Niederman MS. Community-acquired Pneumonia. Disease -a-Month 1998; 44: 613-76. [ Links ]
14. Farr BM, Kaiser DL, Harrison BD, et al. Prediction of microbial aetiology at admission to hospital for pneumonia from the presenting clinical features. Thorax 1989; 44: 1031-5. [ Links ]
15. Jokinen C HL, Juvonen H, Kallinen S, et al. Microbial etiology of community-acquired pneumonia in the adult population of 4 Municipalities in Eastern Finland. Clin Infect Dis 2001; 32: 1141-54. [ Links ]
16. Bartlett JG, Mundy LM. Community acquired pneumonia. N Eng J Med 1995; 333: 1618-24. [ Links ]
17. Marston BJ, Plouffe JF, File TM, et al. Incidence of community acquired pneumonia requiring hospitalization: results of a population based-active surveillance study in Ohio. Arch Intern Med 1997; 157: 1709-18. [ Links ]
18. Falguera M, Sacristán O, Nogués A, et al. Nonsevere Community-Acquired Pneumonia Correlation between cause and severity or comorbidity. Arch Intern Med 2001; 161: 1866-72. [ Links ]
19. Lopardo G, Sturba E, Martínez ML, et al. Detección de infección aguda por Legionella pneumophila en pacientes con neumonía adquirida en la comunidad en Buenos Aires. Medicina (Buenos Aires) 2002; 62: 145-8. [ Links ]
20. Canadian guidelines for the initial management of community-acquired pneumonia: an evidence-based update by the Canadian Infectious Society and the Canadian Thoracic Society. Canadian Community-Acquired Pneumonia Working Group. Clin Infect Dis 2000; 31: 383-421. [ Links ]
21. Boletín Epidemiologico Nacional, Ministerio de Salud y Acción Social, Secretaría de Salud, Subsecretaría de Salud, Dirección Nacional de Medicina Sanitaria, Dirección de Epidemiología, año 2002. [ Links ]
22. Tuomanen EI, Austrian R, Masure HR. Pathogenesis of pneumococcal infection. N Engl J Med 1995; 332:1280-4. [ Links ]
23. Marik PE. Aspiration pneumonitis and aspiration pneu-monia in primary care. N Eng J Med 2001; 344: 665-71. [ Links ]
24. Mundy LM, Auwaerter PG, Oldach D, et al. Community acquired pneumonia: impact of immune status. Am J Respir Crit Care Med 1995; 152: 1309-15. [ Links ]
25. Marrie TJ, Durant H, Yates L. Community-acquired pneumonia requiring hospitalization: a 5-year prospective study. Rev Infect Dis 1989; 11: 586-99. [ Links ]
26. Fang GD, Fine M, Orlof J, et al. New and emerging etiologies for community acquired pneumonia with impli-cations for therapy; a prospective multicenter study of 359 cases. Medicine (Baltimore) 1990; 69: 307-16. [ Links ]
27. Luna CM, Famiglietti A, Absi R, et al. Community-acquired pneumonia: etiology, epidemiology and outcome at a Teaching Hospital in Argentina. Chest 2000; 118: 1344-54. [ Links ]
28. MacFarlane JT, Colbille A, Guion A, MacFarlane RM, Rose DH,. Prospective study of aetiology and outcome of adult lower-respiratory tract in the community. Lancet 1993; 341: 511-4. [ Links ]
29. Everett MT. Major chest infection managed at home. Practitioner 1983; 227:1743-54. [ Links ]
30. Boldy DA. Acute bronchitis in the community: clinical features, infective factors, changes in pulmonary function and bronchial reactivity to histamine. Respir Med 1990; 84: 377-85. [ Links ]
31. Leeper KV Jr, Torres A. Community-acquired pneumo- nia in the intensive care unit. Clin Chest Med 1995; 16: 155-71. [ Links ]
32. Ruiz M, Ewig S, Marcos MA, et al. Etiology of community -acquired pneumonia: Impact of age, comorbidity, and severity. Am J Respir Crit Care Med 1999; 160: 3907-18. [ Links ]
33. Bochud PY, Moser F, Erard P, et al. Community-acquired pneumonia. A prospective outpatient study. Medicine (Baltimore) 2001; 80: 75-87. [ Links ]
34. Brown P, Lerner SA. Community -acquired pneumonia. Lancet 1998; 352: 1295-302. [ Links ]
35. Hatchette TF, Gupta R, Marrie T. Pseudomonas aeru-ginosa community pneumonia in previously healthy adults: case report and review of the literature. Clin Infect Dis 2000; 31: 1349-56. [ Links ]
36. Quinteros M, Couto E. Análisis de resistencia a penicilina y ceftriaxona en Streptococcus pneumoniae aislados de materiales respiratorios. IX Congreso Argentino de Microbiología Bs As (Abstract) 2001. [ Links ]
37. Heffelfinger JD, Dowell SF, Jorgensen JH. et al. Management of community-acquired pneumonia in the era of pneumococcal resistance: a report from the Drug-Resistant Streptococcus pneumoniae Therapeutic Working Group. Arch Intern Med 2000; 160: 1399-408. [ Links ]
38. Hortal M, Lovgren M, De la Hoz F, et al. Antibiotic resistance in Streptococcus pneumoniae in six latin american countries: 1993-1999 surveillance. Microbial Drug Resistance 2001; 7: 391-401. [ Links ]
39. Subcomisión de Antimicrobianos de SADEBAC AyGS. Sistema informático de Resistencia: Análisis de Prevalencia del año 2000. Boletín AAM 2002; 153: 5-8. [ Links ]
40. Olatemi Osiyemi, Dickinson G. Gram positive pneumonia. Current Infect Dis Report 2000; 2: 207-14. [ Links ]
41. Marrie TJ. Community acquired pneumonia in the elderly. Clin Infect Dis 2000; 31: 1066-78. [ Links ]
42. Diaz Fuenzalida A, Vera C, Santamarina J, et al. Neumonía adquirida en la comunidad en ancianos que requieren internación- cuadro clínico y pronóstico. Medicina (Buenos Aires) 1999; 59: 731-8. [ Links ]
43. Riquelme R, Torres A, El Ebiary M, et al. Community adquired pneumonia in the elderly. Clinical and nutritional aspects. Am J Respir Crit Care Med 1997; 156: 1908-14. [ Links ]
44. Woohead M. Pneumonia in the elderly. BMJ 1994; 34 (suppl A): 85-92. [ Links ]
45. Neil AM, Martin IR, Weir R, et al. Community-acquired pneumonia: aetiology and usefulness of severity criteria on admission. Thorax 1996; 51: 1010-6. [ Links ]
46. Farr BM, Sloman AJ, Fisch MJ. Predicting death in patients hospitalized for community-acquired pneumonia. Ann Intern Med 1991; 115: 428-36. [ Links ]
47. Fine MJ, Smith MA, Carson CA, et al. Prognosis and outcomes of patients with community acquired pneumonia. A meta-analysis. JAMA 1996; 275: 134-41. [ Links ]
48. Torres A, Serra-Battles J, Ferrer A, et al. Severe community-acquired pneumonia. Epidemiology and prognostic factors. Am Rev Respir Dis 1991; 144: 312-8. [ Links ]
49. Hasley PB, Albaum MN, Li YH, et al. Do pulmonary radiographic findings at presentation predict mortality in patients with community-acquired pneumonia? Arch Intern Med 1996; 156: 2206-12. [ Links ]
50. Lim WS, Lewis S, Macfarlane JT. Severity prediction rules in community-acquired pneumonia: a validation study. Thorax 2000; 55: 219-23. [ Links ]
51. Fine MJ, Stone RA, Singer D, et al. Processes and outcomes of care for patient outcomes research team (PORT) (Cohort Study). Arch Intern Med 1999; 159: 970-80. [ Links ]
52. Conte HA, Chen YT, Mehal W, Scinto JD, Quagliarello VJ. A prognostic rule for elderly patients admitted with community acquired pneumonia. Am J Med 1999; 106: 20-8. [ Links ]
53. Lim WS, Macfarlane JT. Defining prognostic factors in the elderly with community acquired pneumonia: a case controlled study of patients aged >75 yrs. Eur Respir J 2001; 17: 200-5. [ Links ]
55. Farr BM, Bartlett CL, Wadsworth J, Miller DL. Risk factors for community-acquired pneumonia diagnosed upon hospital admission. British Thoracic Society Pneumonia Study Group. Respir Med 2000; 94: 954-63. [ Links ]
55. Fine MJ, Auble TE, Yealy DM, et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Eng J Med 1997; 336: 243-50. [ Links ]
56. Marras TK, Gutierrez C, Chan CK. Applying a prediction rule to identify low-risk patients with community-acquired pneumonia. Chest 2000; 118: 1339-43. [ Links ]
57. Research Committee of the British Thoracic Society and the Public Health Laboratory Service. Community-acquired pneumonia in adults in British hospitals in 1982-83: a survey of aetiology, mortality, prognostic factors and outcome. Q J Med 1987; 62: 195-220. [ Links ]
58. Lim WS, Macfarlane JT, Boswell TC, et al. SCAPA: Study of community-acquired pneumonia aetiology in adults admitted to hospital: implications for management guidelines. Thorax 2001; 56: 1010-6. [ Links ]
59. Marrie TJ, Lau CY, Wheeler SL, et al. A controlled trial of a critical pathway for treatment of community-acquired pneumonia. JAMA 2000; 283: 749-55. [ Links ]
60. Rosón B, Carratalá J, Dorca J, et al. Etiology, reasons for hospitalizations, risk classes and outcomes of community-acquired pneumonia in patients hospitalized on the basis of conventional admission criteria. Clin Infect Dis 2001; 33: 158-65. [ Links ]
61. Ewig S, Ruiz M, Mensa J, et al. Severe community-acquired pneumonia. Assessment of severity criteria. Am Rev Respir Crit Care Med 1998; 158: 1102-8. [ Links ]
62. Moine P, Vercken JB, Chevret S, Chastang C, Gajdos P. Severe community-acquired pneumonia. Etiology, epidemiology and prognosis factors. French study group for community-acquired pneumonia in the Intensive Care Unit. Chest 1994; 105: 1487-95. [ Links ]
63. Georges H, Leroy O, Vandenbussche, et al. Epide-miological features and prognosis of severe community-acquired pneumococcal pneumonia. Int Care Med 1999; 25: 198-206. [ Links ]
64. Leroy O, Georges C, Beuscart B et al. Severe communi-ty-acquired pneumonia in the intensive care unit: prospective validation of a prognostic score. Int Care Med 1996; 22: 1307-14. [ Links ]
65. Luna CM. Blood cultures in community-acquired pneu-monia. Are we ready to quit? Chest 2003; 123: 977-8. [ Links ]
66. Meehan T, Fine M, Krumholz H, et al. Quality of care, process and outcomes in elderly patients with pneumonia. JAMA 1997; 278: 2080-4. [ Links ]
67. British Thoracic Society Research Committee and The Public Health Laboratory Service. The aetiology, management and outcome of severe community-acquired pneumonia on the intensive care unit. Respir Med 1992; 86: 7-13. [ Links ]
68. Gordon GS, Throop D, Beberian L, et al. Validation of the therapeutics recommendations of the American Thoracic Society (ATS) guidelines for community-acquired pneumonia in hospitalized patients. Chest 1996; 110: A55S. [ Links ]
69. Ewig S, Torres A. Severe community acquired pneu-monia. Clin Chest Med 1999; 20: 575-87. [ Links ]
70. Riquelme R, Torres A, El-Ebiary M, et al. Community-acquired pneumonia in the elderly. A multivariate analysis of risk and prognosis factors. Am J Respir Crit Care Med 1996; 154: 1450-5. [ Links ]
71. Granton JT, Grossman RF. Community-acquired pneumonia in the elderly patient. Clin Chest Med 1998; 14: 537-53. [ Links ]
72. Hedlund JU, Ortqvist AB, Kalin ME, Granath F. Factors of importance for the long term prognosis after hospital treated pneumonia. Thorax 1993; 48: 785-9. [ Links ]
73. Brancati FL, Chow JW, Wagener MM, Vacarello SJ, Yu VL. Is pneumonia really the old mans friend? Two year prognosis after community-acquired pneumonia. Lancet 1993; 342: 30-3. [ Links ]
74. Jackson MM, Fierer J, Barrett-Connor E, et al. Intensive surveillance for infections in a three-year study of nursing home patients. Am J Epidemiol 1992; 135: 685-96. [ Links ]
75. Nicolle L, Strausbaugh L, Garibaldi R, et al. Infections and antibiotic resistance in nursing homes. Clin Microbiol Rev 1996; 9: 1-17. [ Links ]
76. Degelau J, Guay D, Starub K, Luxenberg M. Effective-ness of oral antibiotic treatment in nursing home-acquired pneumonia. J Am Geriatr Soc 1995; 43: 245-51. [ Links ]
77. Loeb M, McGeer A, McArthur M, et al. Risk factors for pneumonia and other lower respiratory tract infections in elderly residents of long-term care facilities. Arch Intern Med 1999; 159: 2058-64. [ Links ]
78. El-Solh AA, Sikka P, Ramadan F, Davies J. Etiology of severe pneumonia in the very elderly. Am J Respir Crit Care Med 2001; 163: 645-51. [ Links ]
79. Bentley DW, Bradley S, High K, Scoenbaum S, Taler G, Yoshikawa TT. Practice guideline for evaluation of fever and infection in long-term care facilities. Clin Infect Dis 2000; 31: 640-53. [ Links ]
80. Medina-Walpole AM, Katz PR. Nursing home-acquired pneumonia. J Am Geriatr Soc 1999; 47: 1005-15. [ Links ]
81. Mehr DR, Zweig SC, Kruse RL et al. Mortality from lower respiratory infection in nursing home residents: a pilot prospective community-based study. J Fam Pract 1998; 47: 298-304. [ Links ]
82. Ramsey PS, Ramin KD. Pneumonia in pregnancy. Obstet Gynecol Clin North Am 2001; 28: 553-69. [ Links ]
83. Munn MB, Groome LJ, Atterbury JL, Baker SL, Hoff C. Pneumonia as a complication of pregnancy. J Matern Fetal Med 1999; 8: 151-9 [ Links ]
84. Yost NP, Bloom SL, Richey SD, Ramin SM, Cunningham FG. An appraisal of treatment guidelines for antepartum community-acquired pneumonia. Am J Obstet Gynecol 2000; 183: 131-5. [ Links ]
85. Schneck H, Scheller M, Wagner R, von Hundelshausen B, Kochs E. Anesthesia for cesarean section and acid aspiration prophylaxis: a German survey. Anesth Analg 1999; 88: 63-6. [ Links ]
86. Torres A, Dorca J, Zalacain R, et al. Community-acquired pneumonia in chronic obstructive pulmonary disease: a Spanish multicenter study. Am J Respir Crit Care Med 1996; 154: 1456-61. [ Links ]
87. Rosón B. Neumonía de la comunidad en pacientes hospitalizados. Análisis de diversas estrategias diagnósticas y de la utilización empírica de b lactámicos. Tesis Doctoral. Universidad de Barcelona. 2001. [ Links ]
88. Osmer JC, Cole BK. The stethoscope and roentge-nogram in acute pneumonia. South Med J 1966; 59: 757. [ Links ]
89. Ortqvist A, Ghendful J. Diagnosis and prognosis value of interleukine-6 and C reactive protein in community acquired pneumonia. Scan J Infect Dis 1995; 27: 457-62. [ Links ]
90. Hanson LO, Hedlug D. Changes of inflamation and nutritional markers in patients with CAP. Scan J Clin Lab Invest 1997; 57: 11-8. [ Links ]
91. Svjrla H, Broas M. High resolution computed tomography for the diagnosis of community acquired pneumonia. Clin Infect Dis 1998; 27: 358-63. [ Links ]
92. Lieberman D. Atypical pathogens in community acquired pneumonia. Clin Chest Med 1999; 20: 20-48. [ Links ]
93. Rosón B, Carratalá J, Verdaguer R, et al. Prospective study of the usefulness of sputum Gram stain in the initial approach to community-acquired pneumonia requiring hospitalization. Clin Infect Dis 2001; 31: 869-74. [ Links ]
94. Skerrett SJ. Diagnostic testing for community-acquired pneumonia. Clin Chest Med 1999; 20: 531-48. [ Links ]
95. Woodhead M. Management of pneumonia in the outpatient setting. Semin Respir Infect 1998; 13: 8-16. [ Links ]
96. Snow W, Mottur-Pilson C, González R. Principles of appropriate antibiotic use for treatment of acute bron-chitis in adults. Ann Intern Med 2001; 134: 518-29. [ Links ]
97. Perez-Tallero E, García Arenzana JM, Jimenez JA, Peris A. Therapeutic failure and selection of resistance to quinolones in a case of pneumococcal pneumonia treated with ciprofloxacin. Eur J Clin Microbiol Infect Dis 1990; 9: 906-16. [ Links ]
98. Sacho H, Klugman KP, Koornhof HJ, Ruff P. Community acquired pneumonia in adult due to multiple-resistand pneumococcus. J Infect 1987; 14: 188-9. [ Links ]
99. Pallares R, Liñares J, Vadillo M, et al. Resistance to penicillin and cephalosporin and mortality from severe pneumococcal pneumonia in Barcelona, Spain. New Eng J Med 1995; 333: 474-80. [ Links ]
100. Garau J. The hidden impact of antibacterial resistance in respiratory tract infection. Clinical failures: the tip of the iceberg? Respir Med 2001; Suppl. A: S5-S11. [ Links ]
101. Feldman C, Kallenbach JM, Miller SD, Thorburn JR, Koornhof HJ. Community-acquired pneumonia due to penicillin-resistant pneumococci. N Eng J Med 1985; 313: 615-7. [ Links ]
102. Buckingham SC, Brown SP, Joaquin VH. Breakdown bacteremia and meningitis during treatment with cephalosporins parenterally for pneumococcal pneumonia. J Pediatr 1998; 132: 174-6. [ Links ]
103. Avellaneda B, Juárez J, de Mier C, et al. Sensibilidad antibiótica en neumococos resistentes (NRP) y sensibles a penicilina (NSP). Rev Argent Med Respir 2001; supl 1: 2. [ Links ]
104. Amsden GW. Pneumococcal macrolide resistance-myth or reality? J Antimicrob Chem 1999; 44: 1-6. [ Links ]
105. Chen DK, McGeer A, de Azavedo JC, Low DE. De-creased susceptibility of Streptococcus pneumoniae to fluoroquinolones in Canada. Canadian Bacterial Sur-veillanceNetwork. N Eng J Med 1999; 341: 233-13. [ Links ]
106. Gleason PP, Meehan TP, Fine JM, Galuscha DH, Fine MJ. Association between initial antimicrobial therapy and medical outcomes for hospitalized elderly patients with pneumonia. Arch Intern Med 1999; 159: 2562-72. [ Links ]
107. Waterer GW, Somes GW, Wunderink RG. Monotherapy may be suboptimal for severe bacteremic pneumococcal pneumonia. Arch Int Med 2001; 161: 1837-43. [ Links ]
108. Marcos MA, Jiménez de Anta MT, de la Bellacasa JP, et al. Rapid urinary antigen test for rapid diagnosis of pneumococcal community-acquired pneumonia in adults. Eur Resp J 2002; 21: 209-14. [ Links ]
109. Kelley MA, Weber DJ, Gilligan P, Cohen MS. Breakthrough pneumococcal bacteremia in patients being treated with azithromycin and clarithromycin. Clin Infect Dis 2000; 31: 1008-11. [ Links ]
110. Lisby G, Brasholt MS, Teglbjerg MS. Bacteremia and meningitis caused by a macrolide-sensitive strain of Streptococcus pneumoniae during treatment with azithromycin. Clin Infect Dis 2001; 33: 415-6. [ Links ]
111. Rahal J, Urban C, Horn D, et al. Class restriction of cephalosporin use to control total cephalosporin resistance in nosocomial Klebsiella. JAMA 1998; 80: 1253-7. [ Links ]
112. Paterson DL, Yu VL. Extended-spectrum -lactamases: a call for improved detection and control. Clin Infect Dis 1999; 29: 1419-22. [ Links ]
113. Klugman KP. The role of clonality in the global spread of fluoroquinolone-resistant bacteria. Clin Infect Dis 2003; 36: 783-5. [ Links ]
114. Davidson R, Cavalcanti R, Brunton JL, et al. Resistance to levofloxacin and failure of treatment of pneumococcal pneumonia. N Engl J Med 2002; 346: 747-50. [ Links ]
115. Ewig S, Ruiz M, Torres A, et al. Pneumonia acquired in the community through Drug-Resistant Streptococcus pneumoniae. Am J Respir Crit Care Med 1999; 158: 1835-42. [ Links ]
116. Lister PD. Pharmacodynamics of 750 mg and 500 mg doses of levofloxacin against ciprofloxacin-resistant strains of Streptococcus pneumoniae. Diagn Microbiol Infect Dis 2002; 44: 43-9. [ Links ]
117. Rebuck JA, Fish DN, Abraham E. Pharmacokinetics of intravenous and oral levofloxacin in critically ill adults in a medical intensive care unit. Pharmacotherapy 2002; 22: 1216-25. [ Links ]
118. Finch R. Community-acquired pneumonia, the evolving challenge. Clin Microbiol Infect 2001; 7 suppl 3:30-8. [ Links ]
119. Felmingham D. Microbiological profile of telithromycin, the first ketolid antimicrobial. Clin Microbiol Infect 2001; 7 suppl 3 :2-10. [ Links ]
120. Gil R, Undurraga A. Epidemiology of hospitalized community-acquired pneumonia (CAP) in Chile: multi-centric survey. Am J Respir Crit Care Med 2001; 163: A103 [ Links ]
121. Arancibia F, Bauer TT, Ewig S, et al. Community-acquired pneumonia due to gram-negative bacteria and pseudomonas aeruginosa: incidence, risk, and prognosis. Arch Intern Med 2002; 162: 1849-58. [ Links ]
122. Vegelin AL, Bissumbhar P, Joore JC, Lammers JW, Hoepelman IM. Guidelines for severe community-acquired pneumonia in the western world. Neth J Med 1999; 55: 110-7. [ Links ]
123. Mundy LM, Oldach D, Autwaerter PG, et al. Implication for macrolide treatment in community-acquired pneumonia. Chest 1998; 113: 1201-6. [ Links ]
124. Luna CM. Neumonía por Legionella, un hecho infrecuente en Argentina. ¿Diferente epidemiología o marcador del subdesarrollo? Medicina (Buenos Aires) 1999; 59: 977-78. [ Links ]
125. Angus DC, Marie TJ, Obrosky DS, et al. Severe community-acquired pneumonia use of intensive care services and evaluation of american and british thoracic society diagnostic criteria. Am J Respir Crit Care Med 2002; 166: 717-23. [ Links ]
126. Marik P, Kraus P, Sribante J, Havlik I, Lipman J, Johnson DW. Hydrocortisone and tumor necrosis factor in severe community-acquired pneumonia. A randomized controlled study. Chest 1993; 104: 389-92. [ Links ]
127. Fein AM, Feinsilver SH, Niederman MS, et al. When the pneumonia doesnt get better. Clin Chest Med 1987; 8: 529-41. [ Links ]
128. Feinsilver SH, Fein AM, Niederman MS, Schultz DE, Faegemburg DH. Utility of fiberoptic bronchoscopy in nonresolving pneumonia. Chest 1990; 98: 1322-6. [ Links ]
129. Amberson JB. Significance of unresolved, organizing or protracted pneumonia. J Mich State Med Soc 1943; 42: 599-603. [ Links ]
130. Gleichman TK, Leder MM, Zahn DW. Major etiological factors producing delayed resolution in pneumonia. Am J Med Sci 1949; 218: 369-73. [ Links ]
131. Israel HL, Weiss W, Eisenberg GM, et al. Delayed resolution of pneumonias. Med Clin North Am 1956; 40: 1291-303. [ Links ]
132. Mittl RL Jr, Schwab RJ, Duchin JS, et al. Radiographic resolution of community-acquired pneumonia. Am J Respir Crit Care Med 1994; 149: 630-5. [ Links ]
133. Ezri T, Kunichezky S, Eliraz A, Soroker D, Halperin D, Schattner A. Bronchiolitis obliteranscurrent concepts. Q J Med 1994; 87: 1-10. [ Links ]
134. Blank N, Castellino RA. The intrathoracic manifestations of the malignant lymphomas and the leukemias. Semin Roentgenol 1980; 15: 227-45 [ Links ]
135. Ortqvist A, Kalin M, Lejdeborn L, Lundberg B. Diagnostic fiberoptic bronchoscopy and protected brush culture in patients with community-acquired pneumonia. Chest 1990; 97: 576-82. [ Links ]
136. Dunn IJ, Marrie TJ, MacKeen AD, Bhan V, Janigan DT. The value of open lung biopsy in immunocompetent patients with community-acquired pneumonia requiring hospitalization. Chest 1994; 106: 23-7. [ Links ]
137. Rivers E, Nguyen B, Havstad S, et al. Early Goal-Directed Therapy Collaborative Group. Early goal-directed therapy in the treatment of severe sepsis and septic shock. N Engl J Med 2001; 345: 1368-77 [ Links ]
138. Schuller D, Mitchell JP, Calandrino FS, Schuster DP. Fluid balance during pulmonary edema. Is fluid gain a marker of a cause of poor outcome. Chest 1991; 100: 1068-75. [ Links ]
139. Mitchell JP, Schuller D, Calandrino F et al. Improved outcome based on fluid management in critically ill patients requiring pulmonary artery catheterization. Am Rev Respir Dis 1992; 145: 990-8. [ Links ]
140. LaCroix AZ, Lipson S, Miles TP, Whit L. Prospective study of pneumonia hopitalization and mortality of U.S. older people: the role of chronic conditions, health behaviors, and nutritional status. Public Health Rep 1989; 104: 350-60 [ Links ]
141. Souba W. Nutritional support. N Eng J Med 1997; 336: 41-8. [ Links ]
142. Moore FA, Moore EE, Jones TN, McCroskey BL, Peterson VM. Enteral feeding (TEN) versus parenteral feeding (TPN) following major abdominal trauma-reduced septic morbidity. J Trauma 1989; 29: 916-23. [ Links ]
143. Kudsk KA, Croce MA, Fabian TC, et al. Enteral versus parenteral feeding. Effects on septic morbidity after blunt and penetrating abdominal trauma. Ann Surg 1992; 215: 503-11. [ Links ]
144. Heyland DK. Nutritional support in the critically ill: a critical review of the evidence. Crit Care Clin 1998; 14: 423-40 [ Links ]
145. American Thoracic Society. Standards for the diagnosis and care of patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1995; 152: S77-S121. [ Links ]
146. Rhew DC. Quality indicators for the management of pneumonia in vulnerable elders. Ann Intern Med 2001; 135:736-43. [ Links ]
147. Britton S, Bejstedt M, Vedin L. Chest physiotherapy in primary pneumonia. BMJ 1990; 290: 1703-4. [ Links ]
148. Raoof S, Choudhrey N, Raoof S, et al. Effect of combined kinetic therapy and percussion therapy on the resolution of atelectasis in critically ill patients. Chest 1999; 115: 1658-66. [ Links ]
149. Sutton PP, Gemmell HG, Innes N, et al. Use of nebulised saline and nebulised terbutaline as an adjunct to chest physiotherapy. Thorax 1988; 43: 57- 60. [ Links ]
150. Bernard G, Vincent JL, Laterre FP, et al. Efficacy and safety of recombinant human activated protein C for severe sepsis. N Eng J Med 2001; 344: 699-709. [ Links ]
151. Montón C, Ewig S, Torres A, et al. Role of glucocor-ticoids on inflammatory response in nonimmuno-suppressed patients with pneumonia: a pilot study. Eur Respir J 1999; 14: 218-20. [ Links ]
152. Davies L, Angus RM, Calverley PM. Oral corticosteroids in patients admitted to hospital with exacerbations of chronic obstructive pulmonary disease: a prospective randomized controlled trial. Lancet 1999; 54: 456-60. [ Links ]
153. Esteban A, Anzueto A, patient receiving mechanical ventilation. A 28-day international study. JAMA 2002; 287: 345-55. [ Links ]
154. Brochard L, Mancebo J, Wysocki F, et al. Noninvasive ventilation for acute exacerbation of chronic obstructive pulmonary disease. N Eng J Med 1995; 333: 817-22. [ Links ]
155. Antonelli M, Conti M, Rocco M, et al. A comparison of noninvasive positive-pressure ventilation and conven-tional mechanical ventilation in patients with acute respiratory failure. N Eng J Med 1998; 339: 429-35. [ Links ]
156. Confalonieri M, Potenza G, Della Porta R, et al. Acute respiratory failure in patients with severe community-acquired pneumonia: a prospective randomized evaluation of noninvasive ventilation. Am J Respir Crit Care Med 1999; 160: 1585-91. [ Links ]
157. Lasdica S, Fainstein D, Casas P, et al. Ventilación mecánica no invasiva en la lesión pulmonar aguda hipoxémica. Med Intensiva 2001; 25: 303-9. [ Links ]
158. Jolliet P, Abajo B, Pasquina P, Chevrolet JC. Non-invasive pressure support ventilation in severe community-acquired pneumonia. Int Care Med 2001; 27: 812-21. [ Links ]
159. Colice G, Curtis A, Deslauriers J et. al. Medical and surgical treatment of parapneumonic effusions. An evidence-based guideline. Chest 2000; 118: 1158-71. [ Links ]
160. Light RW, Girard WM, Jenkinson SG, George RB. Parapneumonic effusions. Am J Med 1980; 69: 507-12. [ Links ]
161. Henke CA, Leatherman JW. Intrapleurally administred streptokinase in the treatment of acute loculated non-purulent paraneumonic effusion. Am Rev Respir Dis 1992; 145: 684-14. [ Links ]
162. Sahn S. Management of complicated parapneumonic effusions. Am Rev Respir Dis 1993; 148: 813-7. [ Links ]
163. Ashbaugh DG. Empyema thoracic factors influencing morbidity and mortality. Chest 1991; 99: 1162-5 [ Links ]
164. Centers for Disease Control and Prevention. Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1997; 46 (RR-8): 1-24 [ Links ]
165. Fine MJ, Smith MA, Carson CA, et al. Efficacy of pneumococcal vaccination in adults: a meta-analysis of randomized controlled trials. Arch Intern Med 1994; 154: 2666-77. [ Links ]
166. Broome CV. Efficacy of pneumococcal polysaccharide vaccines. Rev Infect Dis 1981; 3 (suppl): S82-S96. [ Links ]
167. Simberkoff MS, Cross AP, Al-Ibrahim M, et al. Efficacy of pneumococcal vaccine in high-risk patients: results of a Veterans Administration cooperative study. N Engl J Med 1986; 315: 1318-27. [ Links ]
168. Shapiro ED, Clemens JD. A controlled evaluation of the protective efficacy of pneumococcal vaccine for patients at high risk of serious pneumococcal infections. Ann Intern Med 1984; 101: 325-30. [ Links ]
169. Sisk JE, Moskowitz AJ, Whang W, et al. Cost-effectiveness of vaccination against pneumococcal bacteremia among elderly people. JAMA 1997; 278: 1333-9. [ Links ]
170. Breiman RF, Spika JS, Navarro VC, et al. Pneumo-coccal bacteremia in Charleston County, South Carolina: a decade later. Arch Intern Med 1990;150: 1401-5. [ Links ]
171. Centers for Disease Control and Prevention. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2001; 50 (RR-4): 1-44. [ Links ]
172. Patriarca PA, Weber JA, Parker RA, et al. Risk factors for outbreaks of influenza in nursing homes: a case-control study. Am J Epidemiol 1986; 1: 114-9. [ Links ]
173. Nordin J, Mullooly J, Poblete S, et al. Influenza vaccine effectiveness in preventing hospitalizations and deaths in persons 65 years or older in Minnesota, New York, and Oregon: data from 3 health plans. J Infect Dis 2001; 184: 665-70. [ Links ]
174. Mullooly JP, Bennett MD, Hornbrook MC, et al. Influenza vaccination programs for elderly persons: cost-effectiveness in a health maintenance organization. Ann Intern Med 1994; 121: 947-52. [ Links ]
175. Palache AM. Influenza vaccines: a reappraisal of their use. Drugs 1997; 54: 841-56. [ Links ]
176. Gross PA, Hermogenes AW, Sacks HS, Lau J, Levandowski RA. Efficacy of influenza vaccine in elderly persons: a meta-analysis and review of the literature. Ann Intern Med 1995; 123: 518-27. [ Links ]
177. Blumberg EA, Albano C, Pruett T, et al. Immunogenicity of influenza virus vaccine in solid organ transplant recipients. Clin Infect Dis 1996; 22: 295-302. [ Links ]
178. Nichol KL, Wuorenma J, Von Sternberg T. Benefits of influenza vaccination for low-, intermediate-, and high-risk senior citizens. Arch Intern Med 1998; 158: 1769-76. [ Links ]
179. Patriarca PA, Weber JA, Parker RA, et al. Efficacy of influenza vaccine in nursing homes: reduction in illness and complications during an influenza A (H3N2) epidemic. JAMA 1985; 253: 1136-9. [ Links ]
180. Riddough MA, Sisk JE, Bell JC. Influenza vaccination: cost-effectiveness and public policy. JAMA 1983; 249: 3189-95. [ Links ]
181. Colman PM. Neuraminidase inhibitors as antivirals. Vaccine 2002; 20 Suppl 2: S55-8. [ Links ]
Recibido: 6 de marzo de 2003
Aceptado: 19 de mayo de 2003














