Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.63 no.5 Buenos Aires Sept./Oct. 2003
Análisis del signo de Hoover en relación con parámetros funcionales, radiológicos y de radio de curvatura en pacientes con enfermedad pulmonar obstructiva crónica
Capria, M. E., D'Negri 1 C., De Vito E. L.2
Instituto de Investigaciones Médicas Alfredo Lanari, Facultad de Medicina, Universidad de Buenos Aires
Resumen
El propósito del presente trabajo fue: 1) relacionar el signo de Hoover SH (+) con diversos parámetros funcionales (espirometría y volúmenes pulmonares) y radiológicos (radiografías posteroan-teriores), 2) caracterizar los cambios en el radio de curvatura y la eficiencia del diafragma, y restablecer relaciones con los parámetros funcionales y radiológicos. Se estudiaron 15 pacientes con EPOC (SH (+), n: 8). El radio de curvatura fue determinado en el hemidiafragma derecho en inspiración y espiración máximas. Los SH(+) se hallaron más severamente obstruidos (VEF1%, p 0.005%) y con mayor atrapamiento aéreo (VR/CPT %, p 0.01). El radio espiratorio (Re) fue mayor (p 0.05), y su eficiencia (1/Re), fue menor (p 0.05). El VEF1% correlacionó con el grado de hiperinflación según CPT % (r –0.58, p 0.022) y con el atrapamiento aéreo según VR% (r –0.77, p 0.0008). Los pacientes con menor VEF1% presentaron un Re mayor (r –0. 61, p 0.015) y menor eficiencia diafragmática en espiración (1/Re) de acuerdo a: 1/Re = 0.093 cm-1 + 0.0012 cm-1 * VEF1% (r 0.688, p 0.0054). El VEF1 correlacionó con la movilidad diafragmática (r 0.71, p 0.003). La PaCO2 correlacionó con la CPT % (r 0.534, p 0.04), con el VR % (r 0.62, p 0.014) y con los parámetros radiológicos de hiperinflación (r 0.546, p 0.035) y atrapamiento aéreo (r 0.528, p 0.043). El SH(+) sugiere obstrucción bronquial severa, aplanamiento del diafragma, consiguiente aumento del radio de curvatura, menor movilidad y menor eficiencia.
Palabras clave: EPOC. Signo de Hoover. Diafragma. Radio de curvatura. Eficiencia diafragmática. Hiperinflación.
Abstract
The purpose of the present study was: 1) to relate the Hoover sign -SH (+)- with several functional (spirometry and lung volumes) and radiographic (AP x-ray) parameters, 2) to characterize the changes in diaphragmatic curvature radius and the efficiency and to establish some relationships with the functional and radiographic parameters. Fifteen patients with COPD (SH (+), n: 8) were studied. The radius was determined in the right hemidiaphragm after maximal inspired and expired x-ray. The SH (+) was found in more severely obstructed patients (FEV1%, p 0.005%) and with high degree of air trapping (RV/ TLC %, p 0.01). The expiratory radius (Re) was higher (p 0.05), and their efficiency (1/ Re), was minor (p 0.05). The FEV1% correlated with the degree of hyperinflation according to TLC% (r –0.58, p 0.022) and with air trapping according to RV % (r –0.77, p 0.0008). The patients with low FEV1% showed high Re (r- 0.61, p 0.015) and decreased diaphragmatic efficiency during expiration (1/ Re) according to 1/Re = 0.093 cm-1 + 0.0012 cm-1 * FEV1% (r 0.688, p 0.0054). The FEV1 correlated with the diaphragmatic movement (r 0.71, p 0.003). The PaCO2 correlated with the TLC % (r 0.534, p 0.04), the RV% (r 0.62, p 0.014) and with the radiographic parameters of hyperinflation (r 0.546, p 0.035) and air trapping (r 0.528, p 0.043). The presence of Hoover sign suggest severe bronchial obstruction, diaphragmatic flattening, increase of curvature radius, decrease of mobility and efficiency.
Key words: COPD. Hoover´s sign. Diaphragm. Curvature radius. Diafragmatic efficiency. Hyperinflation.
La enfermedad pulmonar obstructiva crónica se caracteriza por el aumento de la resistencia en la vía aérea e hiperinflación1. Los efectos más evidentes de esta condición se observan en las diversas alteraciones funcionales que valoran el calibre bronquial. Recientemente se ha sugerido la presencia de una miopatía sistémica que afecta a los músculos respiratorios y no respiratorios que considera a la EPOC como una enfermedad sistémica2, 3, 4.
La obstrucción bronquial e hiperinflación producen alteraciones de consideración en los músculos respiratorios, en particular en el diafragma5, 6. Las mismas fueron estudiadas desde el punto de vista radiológico, clínico y funcional. Recientemente se ha incorporado información proveniente de estudios en biología molecular2. Un aspecto de interés es el referente al radio de curvatura del diafragma, un determinante importante de su eficiencia. Se dispone de información en animales7, 8, 9 y en humanos10. Debido a la relativa inaccesibilidad del diafragma y a la complejidad de su morfología, se ha recurrido a modelos simplificados para comprender su mecánica11.
En los pacientes con EPOC, se han descrito diversas alteraciones radiológicas relacionadas con la caja torácica y con el diafragma12, 13, 14. El tórax de estos pacientes presenta aumento del diámetro antero-posterior retroes-ternal, horizontalización de las costillas, aplanamiento del diafragma, reclutamiento de músculos accesorios y movimientos respiratorios anormales. Las descripciones radiológicas clásicas de Fraser y Paré15 en los procesos que cursan con "exceso general de aire en los pulmones" incluyen: "La hiperinsuflación del enfisema puede hacer que el contorno diafragmático sea cóncavo en lugar de convexo hacia arriba. La posición baja del diafrag-ma aumenta el ángulo de los senos costofrénicos, algunas veces hasta un ángulo recto. La limitación de la excursión diafragmática durante la respiración es un signo de atrapamiento de aire e hiperinsuflación pulmonar que es característica aunque no exclusiva del enfisema".
El signo de Hoover consiste en el movimiento para-dojal inspiratorio hacia adentro del margen lateral de la parrilla costal, descrito por Hoover en 192016 y está asociado a obstrucción bronquial. Este signo es la expresión clínica de la desventaja mecánica del diafragma que pierde su curvatura habitual, se aplana, disminuye el área de aposición y, por efecto sobre la inserción costal inferior, su contracción inspiratoria produce movimiento hacia adentro del margen lateral de la parrilla costal.
Se dispone de un número relativamente escaso de trabajos que han relacionado las anomalías funcionales con los hallazgos radiológicos y clínicos13. Además, los estudios básicos sobre el radio de curvatura del diafragma no están aún adecuadamente integrados con los hallazgos clínicos y radiológicos. Otro aspecto de interés, es el volumen desplazado por el diafragma17, 18; el mismo ha sido analizado sólo recientemente. Todo esto puede ser relevante para establecer alguna relación clíni-co-funcional o si se considera la implementación de planes de rehabilitación dirigidos a entrenar específicamen-te el diafragma. En este sentido, los primeros trabajos19, 20, 21 adjudicaban un efecto benéfico que fue puesto en duda por estudios ulteriores22, 23.
Los objetivos del presente trabajo fueron: 1) relacionar la presencia de signo de Hoover con diversos parámetros funcionales y radiológicos de obstrucción bronquial e hiperinflación, 2) caracterizar los cambios en el radio de curvatura del diafragma, inferir los cambios en su eficiencia y restablecer alguna relación con los parámetros funcionales y radiológicos.
Material y métodos
Se estudió un total de 17 pacientes. Dos fueron eliminados debido a inadecuada técnica radiológica. Los 15 restantes (13 varones) de 66 a 78 años tenían diagnóstico de EPOC de acuerdo a los criterios establecidos24. Se definió signo de Hoover como la disminución del ángulo costoesternal durante la inspiración tranquila, en decúbito dorsal. Los pacientes fueron clasificados en dos grupos de acuerdo a su ausencia SH(-), n = 7 o presencia SH(+), n = 8.
Estudios funcionales
En todos los pacientes se efectuaron los siguientes estudios funcionales respiratorios: espirometría (Vitalograph Compact II), volúmenes pulmonares con el método de dilución de helio (Collins GS Modular System), gases en sangre arterial (ABL 510 Radiometer). Las presiones estáticas máximas: presión inspiratoria (Pimax) y espiratoria máxima (Pemax) fueron ob-tenidas con la técnica convencional y mediante un manómetro aneroide25.
Estudios radiológicos
Se obtuvieron radiografías de tórax de frente y de perfil en inspiración máxima (técnica convencional) y luego de una espiración máxima hasta el volumen residual (VR) que el paciente fue capaz de alcanzar luego de 15 segundos de un esfuerzo espiratorio sostenido. De acuerdo con los trabajos de Burki26 y de Lennon27, se obtuvieron diversos índices ra-diológicos en inspiración (i) y espiración (e):
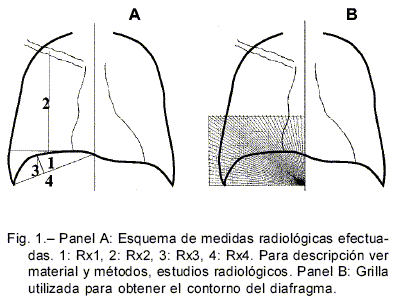
Rx1: la distancia vertical desde la línea medio-clavicular derecha a su intersección con el diafragma.
Rx2: la distancia vertical desde la línea medio-clavicular derecha a la horizontal que pasa por la cúpula diafragmática.
Rx3: la distancia vertical desde el punto más alto de la cúpula diafragmática derecha a la recta que une el ángulo costofrénico y el ángulo costo diafragmático derecho.
Rx4: la distancia perpendicular desde el punto más alto de la cúpula diafragmática derecha a la recta que une el ángulo costofrénico y el ángulo costo diafragmático derecho (Fig. 1A).
Las medidas Rx1i, 2i, 3i y 4i en inspiración fueron consideradas índices radiológicos de hiperinflación, mientras que en espiración (Rx1e, etc.) fueron consideradas índices de atrapamiento aéreo. Las diferencias entre ambas fueron consideradas índices de movilidad diafragmática.
Radio de curvatura
Si se tiene una membrana elástica que ha adoptado la forma de casquete esférico en su situación de equilibrio estático, la diferencia de presión a través de ella, P, la tensión T a la que se halla sometida y el radio de curvatura R del casquete, se relacionan a través de la ecuación de Laplace P=2T/R. Cualquiera sea la forma que adopte la membrana a causa de inhomogeneidades en su composición o diferente forma inicial (a P=0) esta relación es siempre válida localmente, es decir, para el casquete esférico que ajuste en primer orden a la superficie real de la membrana en ese punto. En nuestro caso la membrana es el diafragma, P es la presión transdiafragmática, T es la tensión que se ejerce en el dia-fragma y R el radio de curvatura en el punto del diafragma a considerar.
El diafragma no es homogéneo en su constitución y tampoco adopta estrictamente la forma de un casquete esférico. Conocer los valores de P, T y R en cada punto es imposible y, del mismo modo, obtenerlos a través de una modelización matemática supone una serie de aproximaciones, algunas de ellas de dudoso rigor11. Nuestro propósito fue obtener un parámetro geométrico globalizador que surgiera de la evaluación radiológica y que fuese sensible a las características fisiológicas que distinguen a ambos grupos de pacientes. Los registros experimentales9, 28 muestran valores casi constantes de la tensión a lo largo del diafragma y muy poca variación de la presión transdiafragmática desde el seno costo frénico al seno costo diafragmático para distintas posiciones inspiratorias, lo cual hace suponer un cociente P/T casi constante en toda su superficie para cada una de ellas. Esto da sustento a hipotetizar una aproximación en primer orden, de casquete esférico para el hemidiafragma. Para conocer R sólo basta con tener el perfil del diafragma que registra un corte radiológico y ajustarle un arco de circunferencia.
La eficiencia del diafragma puede ser definida como la capacidad de transformar tensión en presión y lo expresaremos como dP/dT a radio constante, es decir, el cociente de la variación dP para una variación dT. Un diafragma será tanto más eficiente cuanto mayor dP genere para una determinada dT. De la ecuación de Laplace surge que la eficiencia es, entonces, igual a 2/R. De la misma ecuación de Laplace surge que la eficiencia es P/T. De acuerdo a esto, cuanto menor es el R mayor es la presión transdiafragmática que se desarrollará si mantenemos a T constante, esto es mayor eficiencia que equivale a menor costo energético. Por tanto, el valor 1/R (que puede ser medido) será nuestro parámetro a evaluar estadísticamente (prescindiendo del factor 2 a efectos de simplificación).
El radio de curvatura fue determinado en el hemidiafragma derecho en la Rx anteroposterior en inspiración y espiración. Se marcó el contorno del diafragma desde el seno costo-frénico hasta el costo diafragmático sobre una grilla transparente (Fig. 1B). Este contorno se lo ajustó por un arco de circunferencia utilizando cuadrados mínimos (Statistica 5.5). Tanto en las Rx inspiradas como espiradas los puntos analizados para el ajuste fueron aquellos comprendidos entre la región costofrénica y el punto de comienzo de la tangencia al área de aposición.
Análisis estadístico
El análisis estadístico se llevó a cabo mediante Mann Whitney para muestras no apareadas, o Wilcoxon para muestras apareadas y análisis de correlación y regresión. Una p < 0.05 fue considerada significativa.
Resultados
Las características físicas de ambos grupos de pacientes se muestran en la Tabla 1. Ocho de los 15 pacientes presentaron SH(+). No se observaron diferencias significativas entre ambos grupos.
Los volúmenes pulmonares, la difusión de CO2, los gases en sangre arterial y la fuerza de los músculos respiratorios se muestran en la Tabla 2. Los pacientes con SH(+) se hallaron más severamente obstruidos (VEF1 y VEF1/ CVF %) y con mayor atrapamiento aéreo (CVF %, VR % y VR/CPT %). No se alcanzaron diferencias estadísticamente significativas en el grado de hiperin-flación medido en términos de CPT % (p 0.06). La DLCO / VA fue significativamente menor en el grupo SH (+). No hubo diferencias en los valores de gases en sangre arterial y de presiones estáticas máximas. Las mediciones radiológicas efectuadas con el objeto de establecer parámetros de hiperinflación, atrapamiento aéreo y movilidad diafragmática, no fueron diferentes entre ambos grupos.

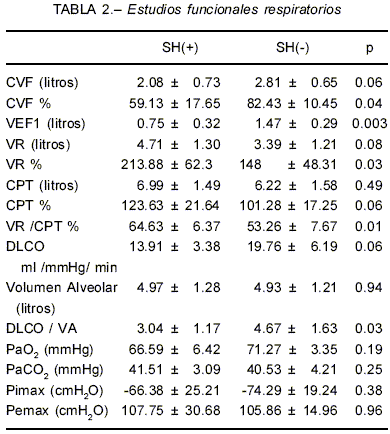
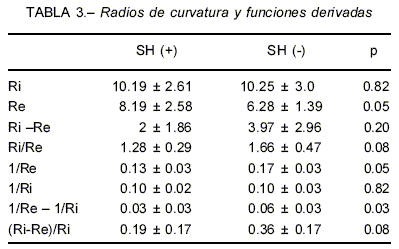
La Tabla 3 muestra los radios de curvatura y funciones de éstos para ambos grupos. El radio espiratorio (Re) fue mayor en los SH(+), lo que evidencia mayor aplanamiento del diafragma en la posición de máxima espiración. No se observaron diferencias significativas en los radios inspiratorios, ni en la diferencia de los radios (Ri-Re). La relación Ri/Re, que indica la proporción del radio inspiratorio respecto del espiratorio, no fue diferente. En cambio 1/Re (eficiencia del diafragma), resultó diferente. La diferencia 1/Re-1/Ri que expresa la variación de la eficiencia desde espiración máxima a inspiración máxima fue 2 veces menor en los SH (+) (p 0.03). La variación de los radios respecto del inspi-ratorio (Ri-Re)/Ri no mostró diferencias estadísticamente significativas. La Fig. 2 muestra los contornos de los diafragmas de 4 pacientes. Se aprecian las diferencias en la movilidad y en los radios.

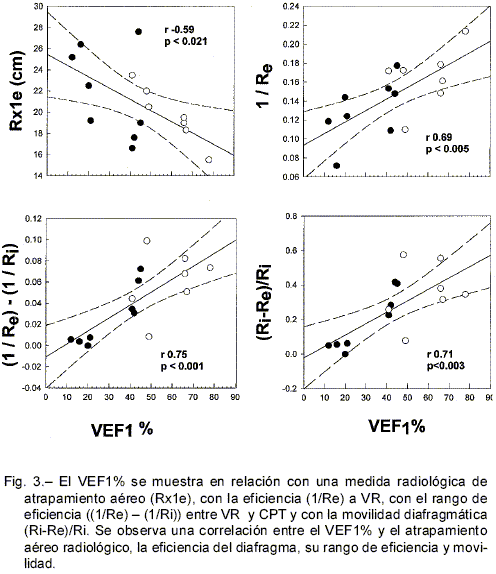
Considerando a todos los pacientes, el VEF1% correlacionó negativamente con el grado de hiperinflación medida en términos de CPT % (r –0.58, p 0.022) y con el grado de atrapamiento aéreo medido en términos de VR % (r -0.77, p 0.0008). Los pacientes con menor VEF1% presentaron un Re mayor (r –0. 61, p 0.015).
En la Fig. 3 se observa una correlación significativa y negativa entre el VEF1 % y el atrapamiento aéreo según la radiología (Rx1e) (r –0.59, p 0.021). El VEF1% correlacionó con la eficiencia diafragmática en espiración (1/Re) de acuerdo a: 1/Re = 0.093 cm-1 + 0.0012 cm-1 * VEF1% (r 0.688, p 0.005). El VEF1% correlacionó positivamente con el rango de eficiencia del diafragma (1/Re – 1/Ri) (r 0.75, p 0.001) y con la movilidad (r 0.71, p 0.003) diafragmática (Ri – Re)/Ri.
La PaCO2 correlacionó con la CPT % (r 0.534, p 0.04), con el VR % (r 0.62, p 0.014) y con los parámetros ra-diológicos de hiperinflación (Rx1i, r 0.546, p 0.035) y atrapamiento aéreo (Rx1e, r 0.528, p 0.043). No se halló correlación alguna entre la PaCO2 y los diferentes radios medidos.
La Fig. 4 muestra la relación entre el VR (en % de la CPT del paciente), la CPT del paciente (en % de la CPT normal) , la Pimax (cmH2O) y la eficiencia del diafragma en cm–1 (1/R). Los pacientes con SH(+) presentaron una Pimax media por debajo del límite inferior normal; respecto de los SH(-), mayor grado de atrapamiento aéreo (VR), p 0.03 y tendencia a la hiperinflación (CPT), p 0.06. La eficiencia diafragmática (1/Re) para su VR (p 0.05) y el rango de variación desde VR a CPT (D(1/R)) fue menor (p 0.03).

Discusión
Este trabajo intentó relacionar el signo de Hoover con hallazgos radiológicos y funcionales en pacientes con EPOC.
La descripción original de Hoover según la cita de Gilmartin16, se refiere a un movimiento paradojal inspi-ratorio hacia adentro del margen lateral costal. Esto fue considerado como un signo de obstrucción al flujo aéreo y atribuido por Hoover a la contracción diafragmática. Posteriormente, Godfrey29 y Stubbing30 sugirieron que el movimiento hacia adentro del margen costal puede ocurrir por factores asociados a la edad y a la caja torácica, además de la hiperinflación.
En 1985, Fleury y col31 sugirieron que durante la evolución de la obstrucción al flujo aéreo, se producen cambios fisiopatológicos que pueden ser presumidos mediante la simple observación clínica. Estos signos son de simple observación y de gran valor semiológico. El signo de Hoover fue atribuido a una modificación de la geometría del diafragma, aplanamiento y disminución del área de aposición. El movimiento inspiratorio del diafragma está limitado, y el aumento de la presion abdominal está disminuido.
Gilmartin y Gibson16 atribuyeron el signo de Hoover a la acción del diafragma plano sobre la zona de inserción, asociado a una disminución del área de aposición; mientras que el movimiento hacia adentro del tercio inferior del esternón fue atribuido a la relajación de los músculos abdominales que estaban contraídos en la espiración precedente. Su población estudiada (n: 11) con Hoover positivo tenía un VEF1 de 26.9 ± 10.9% (rango 9% a 46%) Dos pacientes con un VEF1 de 20 y de 29% no tenían signo de Hoover. El VEF1% de nuestros pacientes con SH (+) fue muy similar. (Tabla 2, rango 12 a 45%).
Reich y col32 intentaron establecer alguna correlación entre las medidas funcionales y los hallazgos radiológicos en 104 pacientes con EPOC. Ellos hallaron que una altura igual o menor de 2.6 cm del arco derecho del diafragma en la proyección lateral identificaba al 67.7% de todos los pacientes con obstrucción bronquial y al 78. 3% de los pacientes con anomalías moderadas a severas. Mientras que la altura de 29.9 cm o mayor identificaba al 69.8% de todos los pacientes con obstrucción bronquial y al 79.7% con obstrucción bronquial moderada a severa. Caskey y col33 hallaron en un grupo de 120 pacientes que la distancia entre el tubérculo de la primer costilla derecha y el domo del hemidiafragma derecho mayor de 30 cm o un nivel más bajo de la 7ma costilla derecha indica aplanamiento del diafragma. El trabajo de Burki y Krumpelman26 intentó establecer el nivel de sensibilidad y especificidad de los hallazgos radiológicos respecto de la obstrucción bronquial en 189 pacientes. La posición de la cúpula del diafragma derecho o la altura del arco costal anterior de la 7ma costilla tuvo una especificidad del 100% (todos tenían un VEF1/CVF < 70%), mientras que la sensibilidad fue sólo de 36 %.
Debido a que el VEF1 es una medida consagrada para inferir el grado de obstrucción bronquial, resultó de interés estudiar sus posibles relaciones con otros parámetros. Los pacientes con menor VEF1 presentaron mayor grado de atrapamiento aéreo radiológico. Como era de esperar, los pacientes con menor VEF1% tuvieron desde el punto de vista funcional mayor hipe-rinflación, atrapamiento aéreo y Re. Además, el rango de eficiencia y la movilidad fueron menores. Conforme el VEF1% desciende, la eficiencia diafragmática es menor. Nuestros resultados sugieren que un paciente cuyo VEF1% cae de 70% a 30%, perderá un 27% de eficiencia en su diafragma en el momento de comenzar la inspiración a VR (Fig. 3).
La variación de la eficiencia (diferencia 1/Re-1/Ri) en el rango de la CVF fue menor en los SH(+) (Tabla 3). Los pacientes con menor VEF1% tenían menor variación de la eficiencia en el rango de la CVF. En sujetos normales, dentro del rango de volumen corriente (Vt) el diafragma desciende sin cambiar mayormente su radio de curvatura (movimiento de pistón), mientras que en el rango de la CVF la variación del radio de curvatura es máxima. Así, a Vt, la variación de la eficiencia debería ser despreciable en normales, mientras que en los pacientes con SH(+), hiperinflados, con menor movilidad diafragmática presentaron un rango de eficiencia menor. Los pacientes con SH(-) tenían el doble de rango de eficiencia, esto es, conservaban cierta movilidad diafrag-mática que condicionaba la variación del radio y así de la eficiencia (Tabla 3).
La Pimax evalúa la fuerza global de los músculos respiratorios. Si bien el valor medio de los pacientes con SH (+) estaba por debajo del límite inferior normal, no hubo diferencias estadísticamente significativas con los pacientes con SH(-). La eficiencia del diafragma a VR en los pacientes con SH(+) fue menor (Fig. 4).
La hipercapnia crónica puede ser vista como un mecanismo adaptativo para evitar la fatiga diafragmática en pacientes con EPOC34. La retención crónica de CO2 en pacientes con EPOC se correlacionó directamente con la resistencia pulmonar, la cual fue el determinante más importante de la presión media intratorácica. En nuestro estudio, la PaCO2 correlacionó con la hiperinflación y el atrapamiento aéreo, pero no se halló correlación con la curvatura del diafragma.
Recientemente el grupo de Gandevia17 y de Finucase18 han explorado la longitud y desplazamiento de volumen del diafragma en pacientes con EPOC. Mediante el análisis de radiografías de frente y de perfil a VR, CRF, al 50% de la CI y a CPT se pudo determinar que el volumen desplazado por el diafragma fue normal en la mayoría de los pacientes enfisematosos, posiblemente debido a que la hiperinflación es compartida entre la caja torácica y el diafragma, preservando la zona de aposición, y a que el diafragma permanece plano durante la inspiración18. Mediante ultrasonografía y magnetometría se determinó que la zona de aposición estaba reducida al 50% a VR y a CRF en los pacientes con EPOC; a esos volúmenes, no hubo diferencias en el volumen desplazado por el diafragma. Algunos pacientes que tenían signo de Hoover, exhibieron movimiento paradojal de la región lateral del diafragma17.
Desde 1954 a la actualidad, distintos investigadores utilizaron la técnica de respiración diafragmática como objetivo en la rehabilitación de pacientes EPOC. La misma reducía el trabajo respiratorio, mejoraba la ventilación pulmonar y disminuía la disnea. Los estudios recientes pueden sugerir que esto no es real y además sugieren que en pacientes severos los síntomas empeoran. Gosselink22 demostró descoordinación de la caja torácica y aumento de la sensación de disnea en pacientes con VEF1 de 34 ± 7%. Pasto23 demostró una disminución de la eficiencia mecánica expresada como Vt / Pdi (Pdi: presión transdiafragmática) en pacientes con VEF1 de 33 ± 12%. Todos estos datos ponen en duda la utilidad del entrenamiento específico y aislado del diafragma en pacientes con hiperinflación severa. Los estudios de biología molecular pueden ayudar a dilucidar estos aspectos. Recientemente, Gea35 demostró que el entrenamiento específico de músculos inspiratorios mejora la fuerza y la resistencia. Esto fue asociado con cambios adaptativos en la estructura de los intercostales externos. Sin embargo, el grupo entrenado no mostró diferencias en la distancia recorrida en la prueba de caminata de seis minutos.
En nuestro estudio, no obstante la complicada geometría tridimencional del diafragma, el cálculo de su eficiencia, a partir del análisis del radio de curvatura en un solo plano, fue útil para caracterizar la gravedad de nuestros pacientes con EPOC.
Nuestros hallazgos confirman observaciones previas en las cuales los pacientes con hipercapnia crónica se hallaban más severamente hiperinflados y con mayor grado de atrapamiento aéreo. La ausencia de correlación entre la PaCO2 y los diferentes parámetros de radios medidos puede deberse, en principio, al bajo número de pacientes estudiados. El correlato clínico – funcional del signo de Hoover sugiere que su presencia indica obstrucción bronquial severa, aplanamiento del diafragma, consiguiente aumento del radio de curvatura, menor movilidad y menor eficiencia.
Bibliografía
1. Cherniack N. Chronic Obstructive Pulmonary Disease. Philadelphia: Saunders, 1991, Chapter 1, p 3-19. [ Links ]
2. Grassino A, Hayot M, Czaika G. Biology of muscle injury and repair. Arch Bronconeumol 2000; 36: 344-50. [ Links ]
3. Gosselink R, Troosters T, Decramer M. Distribution of muscle weakness in patients with stable chronic obs-tructive pulmonary disease. J Cardiopulm Rehabil. 2000; 20: 353-60. [ Links ]
4. Rabinovich RA, Ardite E, Troosters T, et al. Reduced muscle redox capacity after endurance training in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 164: 1114-8. [ Links ]
5. De Vito EL. Causas de retención de CO2 en pacientes con neumopatía obstructiva crónica. Medicina (Buenos Aires) 1993; 53: 350-6. [ Links ]
6. Road JD, Leevers AM. Effect of lung inflation on diaphragmatic shortening. J Appl Physiol. 1988; 65: 2383-9. [ Links ]
7. Newman SL, Road JD, Grassino A. In vivo length and shortening of canine diaphragm with body postural change. J Appl Physiol 1986; 60: 661-9. [ Links ]
8. Newman S, Road J, Bellemare F, Clozel JP, Lavigne CM, Grassino A. Respiratory muscle length measured by sonomicrometry. J Appl Physiol 1984; 56: 753-64. [ Links ]
9. Kim MJ, Druz WS, Danon J, Machnach W, Sharp JT. Mechanics of the canine diaphragm. J Appl Physiol 1976; 41: 369-82. [ Links ]
10. Cherniack N.S. Effects of COPD on the respiratory muscles. In Harcourt Brace Jovanovich. Chronic Obs-tructive Pulmonary Disease. Philadelphia: Saunders, 1991, p 134-57. [ Links ]
11. Whitelaw WA, Hajdo LE, Wallace JA. Relationships among pressure, tension, and shape of the diaphragm. J App Physiol 1983; 55: 1899-905. [ Links ]
12. De Troyer A, Pride NB. The chest wall in Chronic Obstructive Pulmonary Disease. In Roussos Ch. (ed). The Thorax, 2nd ed. Part C: Disease. New York: Marcel Dekker, 1995, p 1975-2006. [ Links ]
13. Braun NM, Arora NS, Rochester DF. Force-length relationship of the normal human diaphragm. J Appl Physiol 1982; 53: 405-12. [ Links ]
14. Walsh JM, Webber JR, Fahey PJ Sharp J.T. Structural change of the thorax in chronic obstructive pulmonary disease. J Appl Physiol 1992; 72: 1270-8. [ Links ]
15. Fraser RG, Paré JAP. El torax normal. En: Diagnóstico de las enfermedades del Tórax. 2da ed, Barcelona: Salvat, 1980, p 1-174. [ Links ]
16. Gilmartin JJ, Gibson GJ. Mechanisms of paradoxical rib cage motion in patients with chronic obstructive pul-monary disease. Am Rev Respir Dis 1986; 134: 683-7. [ Links ]
17. Gorman RB, McKenzie DK, Pride NB, Tolman JF, Gandevia SC. Diaphragm length during tidal breathing in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2002; 166: 1461-9. [ Links ]
18. Singh B, Eastwood PR, Finucane KE. Volume displaced by diaphragm motion in enphysema. J Appl Phisiol 2001; 91: 1913-23. [ Links ]
19. Casaburi R, Petty TL. Principles and Practice of Pulmonary Rehabilitation. Philadelphia: Saunders, 1993, 171-4. [ Links ]
20. Miller WF. A physiologic evaluation of the effects of diaphragmatic breathing training in patients with chronic pulmonary emphysema. Am J Med 1954; 17: 471-7. [ Links ]
21. Cahalin LP, Braga M, Matsuo Y, Hernández ED. Efficacy of Diaphragmatic Breathing in Persons with Chronic Obstructive Pulmonary Disease: A Review of the Literature. J Cardiopulm Rehabil 2002; 22: 7-21. [ Links ]
22. Rik A, Gooselink R A, Wagenaar RC, Riijswijk H, Sargeant A J, Decramer M L. Diaphragmatic breathing reduces efficiency of breathing in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1995; 151: 1163-72. [ Links ]
23. Pasto M, Gea J, Aguar MC, et al. The characteristics of the mechanical activity of the respiratory muscles during the diaphragmatic respiration technique. Arch Bron-coneumol 2000; 36: 13-8. [ Links ]
24. Pauwels RA, Buist AS, Ma P, Jenkins CR, Hurd SS; GOLD Scientific Committee. Global strategy for the diagnosis, management, and prevention of chronic obs-tructive pulmonary disease. Respir Care 2001; 46: 798-825. [ Links ]
25. Rochester DF, Arora NS. Respiratory muscle failure. Med Clin NA 1983, 67: 573-97. [ Links ]
26. Burki NK, Krumpelman JL. Correlation of Pulmonary Function with the Chest Roentgenogram in Chronic Airway Obstruction. Am Rev Resp Dis 1980; 121: 217- 23. [ Links ]
27. Lennon EA, Simon G. The height of the diaphragm in the chest radiograph of normal adults. Brit J Radiol 1965; 38: 937-43. [ Links ]
28. Sharp JT, Beard M, Sunga M, et al. The rib cage in normal and emphysematous subjects: a roentgenographic approach. J Appl Physiol 1986; 61: 2050-9. [ Links ]
29. Godfrey S, Edwards RHT, Campbell ME, Newton-Jones J. Clinical and physiological association of some physical signs observed in patients with chronic airways obstruction. Thorax 1970; 25: 285-7. [ Links ]
30. Stubbing D, Mathur P, Roberts R, Campbell ME. Some physical signs in patients in chronic airflow obstruction. Am Rev Respir Dis 1982; 125: 549-52. [ Links ]
31. Fleury B, Housset B, Kulpa M, Derenne JPh. Signes physiques traduisant les altérations mécaniques de l´appareil respiratoire au cours des bronchopneumopathies chroniques obstructives. Rev Mal Resp 1985; 2: 199-203. [ Links ]
32. Reich SB, Weinshelbaum A, Yee J. Correlation of radio-graphic measurements and pulmonary function tests in chronic obstructive pulmonary disease. Am J Roent-genol 1958; 144: 695-9. [ Links ]
33. Caskey CI, Zerhouni EA, Fishman EK, Rahmouni AD. Aging of the diaphragm: a CT study. Radiology 1989; 171: 358-9. [ Links ]
34. Begin P, Grassino A. Inspiratory muscle dysfunction and chronic hypercapnia in chronic obstructive pulmonary disease. Am Rev Respir Dis 1991; 143: 905-12. [ Links ]
35. Ramirez-Sarmiento A, Orosco-Levi M, Guell R et al. Inspiratory muscle training in patient with chronic obstructive pulmonary disease. Structural adaptation and physiologic outcomes. Am J Resp Crit Care Med 2002; 166: 1491-7. [ Links ]
Recibido: 11 de marzo de 2003
Aceptado: 28 de mayo de 2003














